含Ba(OH)21mol稀溶液与足量稀盐酸反应,放出114.6KJ热,表示该反应中和热的化学方程式正确的是( )
 星宇夜2022-10-04 11:39:541条回答
星宇夜2022-10-04 11:39:541条回答A.Ba(OH)2(aq)+2HCl(aq)=BaCl2 (aq)+2H2O (l)△H=-114.6KJ/mol
B.Ba(OH)2(aq)+2HCl(aq)=BaCl2 (aq)+2H2O (l)△H=+114.6KJ/mol
C.[1/2]Ba(OH) 2 (aq)+HCl(aq)=[1/2]BaCl2 (aq)+H2O (l)△H=-57.3KJ/mol
D.[1/2]Ba(OH) 2 (aq)+HCl(aq)=[1/2]BaCl2 (aq)+H2O (l)△H=+57.3KJ/mol

已提交,审核后显示!提交回复
共1条回复
 Yvonne5295 共回答了23个问题
Yvonne5295 共回答了23个问题 |采纳率100%- 解题思路:依据中和热概念分析,强酸强碱的稀溶液完全反应生成1mol水放出的热量为中和热,含Ba(OH)21mol稀溶液与足量稀盐酸反应,放出114.6KJ热,表示该反应中和热的化学方程式需要表示生成1molH2O放出的热量,标注物质聚集状态和对应焓变写出热化学方程式.
含Ba(OH)21mol稀溶液与足量稀盐酸反应,放出114.6KJ热,表示该反应中和热的化学方程式需要表示生成1molH2O放出的热量,生成1mol水放热为57.3KJ,标注物质聚集状态和对应焓变写出热化学方程式,[1/2]Ba(OH) 2 (aq)+HCl(aq)=[1/2]BaCl2 (aq)+H2O (l)△H=-57.3KJ/mol;
A、选项中生成的是2mol水,热化学方程式不是中和热,故A错误;
B、反应是放热反应,焓变为负值,故B错误;
C、[1/2]Ba(OH) 2 (aq)+HCl(aq)=[1/2]BaCl2 (aq)+H2O (l)△H=-57.3KJ/mol,热化学方程式表示的是中和热,故C正确;
D、酸碱反应是放热反应,焓变为负值,故D错误;
故选C.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了热化学方程式的书写方法和正误判断,主要是中和热的概念理解应用,掌握基础是关键,题目较简单. - 1年前
相关推荐
- 相同物质的量浓度的下列物质的稀溶液中,pH最小的是( )
相同物质的量浓度的下列物质的稀溶液中,pH最小的是( )
A. 乙醇
B. 乙酸
C. 碳酸钠
D. 碳酸 ghost200311年前1
ghost200311年前1 -
 雪碧一瓶 共回答了23个问题
雪碧一瓶 共回答了23个问题 |采纳率82.6%解题思路:pH最小的物质即酸性最强的物质,根据溶液的酸性强弱来回答.A、乙醇在水溶液中不电离,无酸性;
B、乙酸属于酸,其水溶液显酸性;
C、碳酸钠中的碳酸根水解,使溶液显示碱性;
D、碳酸是一种酸,其水溶液显酸性,但是碳酸酸性比醋酸的弱.
综上可知酸性最强的溶液是醋酸的稀溶液,即pH最小.
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡;盐类水解的原理.
考点点评: 本题考查学生电解质的电离以及盐的水解知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体.
向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体.
为什么这句话是不对的? 阁内婷影12211年前3
阁内婷影12211年前3 -
 qijin666 共回答了17个问题
qijin666 共回答了17个问题 |采纳率100%得到的不是胶体,而是沉淀,要想得到胶体,应该是向沸水中(而不是碱液)滴加几滴FeCl3饱和溶液即可,注意Fe(OH)3胶体非常容易聚沉成为沉淀1年前查看全部
- (2009•沈阳一模)某稀溶液中含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁
(2009•沈阳一模)某稀溶液中含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉,溶液中Fe2+的物质的量(纵坐标/mol)和加入铁粉的物质的量(横坐标/mol)之间的关系为( )
A.
B.
C.
D.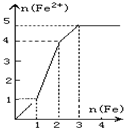
 xl67596961年前1
xl67596961年前1 -
 vooyah1 共回答了17个问题
vooyah1 共回答了17个问题 |采纳率94.1%解题思路:向含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4的混合溶液中逐渐加入铁粉,铁粉和各离子反应的先后顺序是:铁离子、铜离子、氢离子,根据方程式中铁和亚铁离子的关系式进行分析解答.向含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4的混合溶液中逐渐加入铁粉,铁粉和各离子反应的先后顺序是:铁离子、铜离子、氢离子,涉及的反应方程式为:Fe2(SO4)3+Fe=3FeSO4、CuSO4+Fe=FeSO4+Cu、H2SO4+Fe=FeSO4+H2↑,
则Fe2(SO4)3+Fe=3FeSO4
1 1 3
CuSO4+Fe=FeSO4+Cu
1 1 1
H2SO4+Fe=FeSO4+H2↑
1 1 1
所以等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4分别和等物质的量的铁完全反应生成硫酸亚铁,生成硫酸亚铁的物质的量之比是3:1:1,
故选A.点评:
本题考点: 铁的化学性质.
考点点评: 本题考查铁的性质及有关混合物反应的计算,明确离子反应先后顺序是解本题关键,把握物质间的关系式及量的关系即可解答,题目难度不大.1年前查看全部
- 相同物质的量浓度下列物质的稀溶液中,ph最小的是
相同物质的量浓度下列物质的稀溶液中,ph最小的是
乙醇 乙酸 了氯化钠 碳酸 为什么是乙酸?
二氟二氯甲烷 为什么不是只有一种结构呢?不是是四面体么?
烷烃分子可以看做有以下集团组合而成 CH3 CH2 CH C 那个杠杠我就省略了 打不出来.如某烷烃分子中同时存在这四种集团 则改完听最少含有的碳原子数应该是8 为什么呢?》四个不就够了?
巴豆酸结构简式CH3-CH=CH-COOH 为什么可以和才、二丁醇 酸性高锰酸钾溶液反应啊. 浓妆妖怪欧巴桑1年前2
浓妆妖怪欧巴桑1年前2 -
 3ng82 共回答了14个问题
3ng82 共回答了14个问题 |采纳率92.9%1、乙醇和氯化钠为中性,乙酸,碳酸都是弱酸,{弱酸越弱越电离,电离出的氢离子就越多}.乙酸相比碳酸,酸性更弱,故pH最小是乙酸.
2、二氟二氯甲烷和二氯甲烷一样,只有一种结构.
3、碳碳双键/叁键不能连在同一碳原子上
4、和二丁醇酯化反应,酸性高锰酸钾溶液氧化其中的碳碳双键,
~~~~~~~~~希望可以帮到你~~~~~~~~
(酌情给分)1年前查看全部
- 同种溶质和溶剂组成的溶液,其浓溶液的导电能力一定比稀溶液强吗?
同种溶质和溶剂组成的溶液,其浓溶液的导电能力一定比稀溶液强吗?
会不会存在这样一种情况,溶质还能继续溶解,但因其是弱电解质,溶液中电离出来的离子不在增加? maymxl1年前2
maymxl1年前2 -
 jiusiyi 共回答了19个问题
jiusiyi 共回答了19个问题 |采纳率78.9%不一定
电解质有硫酸
因为浓硫酸中水较少,绝大部分硫酸分子没有电离,故自由移动的离子很少,导电性较弱
所有非电解质水溶液都不导电,比如乙醇(酒精),怎么加都不导,导电能力就不说了1年前查看全部
- 为什么浓溶液的导电能力比一定比稀溶液的导电能力强?
为什么浓溶液的导电能力比一定比稀溶液的导电能力强?
打错了
是“不一定比稀溶液的导电能力强?‘ 炙爱天使1年前1
炙爱天使1年前1 -
 mamanini1122 共回答了16个问题
mamanini1122 共回答了16个问题 |采纳率100%不一定吧
比如浓硫酸和稀硫酸的导电能力
因为溶液的导电能力主要是由溶液中游离的离子数(准确的说是电荷总数)来决定的的
浓硫酸中硫酸主要是以分子的形式存在,电离出的氢离子和硫酸根离子相对较少,稀硫酸中硫酸在其中几乎是全部电离
黝黑黝黑,自己悟悟就明白了啊
哈哈哈哈哈哈1年前查看全部
- 11月14日化学14页:5.已知在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热,
11月14日化学14页:5.已知在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热,
现将20g NaOH固体放入1L 0.6mol·L-1的稀盐酸中,测得整个过程共放出41.5KJ的热量,则NaOH与盐酸反应的中和热为
A 41.5KJ·mol-1 B -83KJ·mol-1 C 83KJ·mol-1 D 无法确定 thik1年前1
thik1年前1 -
 夏日的花香 共回答了24个问题
夏日的花香 共回答了24个问题 |采纳率87.5%答案选D.
由于测定时用的是NaOH固体.NaOH固体溶于水会放出大量的热,因而无法确定其溶解后再与HCl反应的中和热是多少.1年前查看全部
- 向沸水中逐滴加入氯化铁稀溶液,会有什么现象
 ouyanghui1年前3
ouyanghui1年前3 -
 a8z0kb4k 共回答了31个问题
a8z0kb4k 共回答了31个问题 |采纳率96.8%产生红褐色胶体,如果继续加热,那么胶体最终会变为红褐色沉淀.1年前查看全部
- 什么稀溶液能补充体液该稀溶液是盐.并且是九年级化学中出现的.
 nullbacca1年前1
nullbacca1年前1 -
 阿嫂地方 共回答了20个问题
阿嫂地方 共回答了20个问题 |采纳率90%生理盐水,氯化钠溶液1年前查看全部
- 在氢氧化铁胶体中逐滴加入碘化氢稀溶液出现的一系列变化和原因
 angela1231年前1
angela1231年前1 -
 zouyun9u471 共回答了17个问题
zouyun9u471 共回答了17个问题 |采纳率100%首先有红褐色沉淀生成(胶体的聚沉),氢氧化铁沉淀
然后HI和Fe(OH)3溶液反应,沉淀消失溶液为红褐色,
Fe(OH)3+3HI=FeI3+3H2O
最后HI和FeI3反应,生成FeI2+I2,溶液变浅黄绿色,
FeI3+HI=FeI2+I2
继续加HI2,I2饱和后析出,有紫黑色固体I2沉淀.1年前查看全部
- 下列物质的稀溶液中,溶质的阴,阳离子个数之比为1:2的是 A.(NH4)2SO4 B.NaHSO4
 refreshghost1年前3
refreshghost1年前3 -
 ffbit123 共回答了22个问题
ffbit123 共回答了22个问题 |采纳率86.4%A
B的是1:1 ,NaHSO4电离出钠正离子和硫酸氢根负离子1年前查看全部
- 中和热数值是固定的吗中和热的数值是固定的吗?强碱弱酸反应或者弱碱强酸反应,不考虑之后的电离吸热,中和热数值和稀溶液的强酸
中和热数值是固定的吗
中和热的数值是固定的吗?强碱弱酸反应或者弱碱强酸反应,不考虑之后的电离吸热,中和热数值和稀溶液的强酸强碱反应的一样吗 一拂红尘1年前3
一拂红尘1年前3 -
 一夜盛开的玫瑰 共回答了18个问题
一夜盛开的玫瑰 共回答了18个问题 |采纳率94.4%是固定的,唯一引起变化的只是电离吸热,或是酸碱过浓而放热.1年前查看全部
- 在含有钠离子,镁离子,碳酸氢根离子,硫酸根离子的稀溶液中,它们的物质的量之比为2:1:2:1.
在含有钠离子,镁离子,碳酸氢根离子,硫酸根离子的稀溶液中,它们的物质的量之比为2:1:2:1.
向该溶液中滴加酚酞试液数滴,溶液呈淡粉红色,有关反应的离子方程式为 majng1年前3
majng1年前3 -
 静享花开 共回答了13个问题
静享花开 共回答了13个问题 |采纳率84.6%HCO32-水解“HCO32-+H2O可逆号H2CO3+OH-1年前查看全部
- 在含铁离子、亚铁离子、镁离子、氨根离子的稀溶液中加入足量的过氧化钠固体……
在含铁离子、亚铁离子、镁离子、氨根离子的稀溶液中加入足量的过氧化钠固体……
2.在含铁离子、亚铁离子、镁离子、氨根离子的稀溶液中加入足量的过氧化钠固体,充分作用后再加入过量的稀硫酸,离子数目没有变化的是 ( )
A.铁离子
B.氨根离子
C.镁离子
D.亚铁离子
答案选C,但不知道为什么,希望大家帮帮忙,分析得细一点,我化学基础不好,我先谢谢大家了! 羊羊弟弟1年前3
羊羊弟弟1年前3 -
 sèνēл 共回答了18个问题
sèνēл 共回答了18个问题 |采纳率77.8%因为过氧根是负一价 所以要发生氧化还原将亚铁离子变成铁离子 所以铁离子增多 亚铁离子减少 至于氨根离子 则是因为过氧根生成的氢氧根变成了氨气1年前查看全部
- 已知:H2A===H++HA-、HA- H++A2-,相同条件下,等物质的量浓度的下列稀溶液:①NaHA、②Na2CO3
已知:H2A===H++HA-、HA- H++A2-,相同条件下,等物质的量浓度的下列稀溶液:①NaHA、②Na2CO3、③HCl、④NaCl溶液中水的电离程度从大到小排列顺序正确的是( ) A.②①④③ x05B.②④①③ C.①②④③ D.③①④②
 137510093751年前5
137510093751年前5 -
 李旋标 共回答了22个问题
李旋标 共回答了22个问题 |采纳率95.5%A,盐酸抑制,氯化钠无影响,碳酸钠促进程度大,因为其水解程度大,盐类水解促进水的电离~1年前查看全部
- 用什么方法鉴别NACL是浓溶液还是稀溶液
 独钓南海鱼1年前1
独钓南海鱼1年前1 -
 湘溪流 共回答了18个问题
湘溪流 共回答了18个问题 |采纳率100%用重结晶法
两种食盐溶液在同一温度下看哪个先产生结晶,即为浓溶液1年前查看全部
- 中和热的问题中和热是强酸和强碱的稀溶液生成1mol水时放出的热量,但今晚听老师说1L0.1mol/L的NaOH和1L0.
中和热的问题
中和热是强酸和强碱的稀溶液生成1mol水时放出的热量,但今晚听老师说1L0.1mol/L的NaOH和1L0.1mol/L的HCl放出的热量为57.3,我想问下各位 不是要生成1mol水吗?这里才0.5mol水,中和热怎么也是57.3呢?
是0.1mol的水,我打成0.5了 分母61年前1
分母61年前1 -
 hhj194728 共回答了19个问题
hhj194728 共回答了19个问题 |采纳率89.5%首先,生成的是0.1mol水1年前查看全部
- 1,强酸和强碱在稀溶液中完全中和生成ImolH2O(l),放出57.3kJ热量,浓硫酸与NaOH溶液反应生成lmolH2
1,强酸和强碱在稀溶液中完全中和生成ImolH2O(l),放出57.3kJ热量,浓硫酸与NaOH溶液反应生成lmolH2O(l),反应放出57.3KJ的热量.2,C(s)+CO2(g)===2CO(g) 焓变
 duguzi_sdqy1年前2
duguzi_sdqy1年前2 -
 he66286628 共回答了15个问题
he66286628 共回答了15个问题 |采纳率86.7%(1)错,浓硫酸被稀释会放热
(2)错,这个反应只有在高温下才能反应,事实上焓变是正的,在高温下反应的原因是因为这个反应时熵增的1年前查看全部
- 下列物质的稀溶液中,溶质的阳、阴离子个数之比为2:1
下列物质的稀溶液中,溶质的阳、阴离子个数之比为2:1
CaCL2
CH3COONA
(NH4)2SO4
K2S 默默baby1年前1
默默baby1年前1 -
 lldyxll 共回答了15个问题
lldyxll 共回答了15个问题 |采纳率80%(NH4)2SO4和K2S.
硫酸铵中含两个阳离子:NH4+,和一个阴离子:SO4(2-);
硫化钾中含两个阳离子:K+,和一个阴离子:S2-.
CaCL2中阳阴离子之比为 1:2;
CH3COONA中阳阴离子之比为 1:1.1年前查看全部
- 为什么将某植物的新鲜叶迅速投入一透明的装有适量NAHCO3稀溶液的容器中光照几分钟,容器内的PH会增大?
 pkwoaini5201年前1
pkwoaini5201年前1 -
 iraina0829 共回答了22个问题
iraina0829 共回答了22个问题 |采纳率86.4%在光照下,进行光合作用,需要消耗溶液中的CO2,而溶液中的碳酸减少,酸性减弱,所以PH升高了1年前查看全部
- 在氢氧化铁胶体中逐滴加入碘化氢稀溶液出现的一系列变化和原因
 crf12341年前1
crf12341年前1 -
 yp22020 共回答了13个问题
yp22020 共回答了13个问题 |采纳率76.9%首先有红褐色沉淀生成(胶体的聚沉),氢氧化铁沉淀
然后HI和Fe(OH)3溶液反应,沉淀消失溶液为红褐色,
Fe(OH)3+3HI=FeI3+3H2O
最后HI和FeI3反应,生成FeI2+I2,溶液变浅黄绿色,
FeI3+HI=FeI2+I2
继续加HI2,I2饱和后析出,有紫黑色固体I2沉淀.1年前查看全部
- 氢氧化钠和硫酸氢铵稀溶液混合不加热后成中性,则溶液中离子浓度由大到小的顺序
 佳侣1年前1
佳侣1年前1 -
 延续的麦博 共回答了18个问题
延续的麦博 共回答了18个问题 |采纳率77.8%c(Na+)>c(NH4+)>c(SO42-)>c(H+)=c(OH-)1年前查看全部
- 等浓度的下列稀溶液:乙酸、苯酚、碳酸、乙醇,它们的PH由小到大怎么排?怎么判断?
 抗战20051年前1
抗战20051年前1 -
 幽蓝寒冰心 共回答了16个问题
幽蓝寒冰心 共回答了16个问题 |采纳率93.8%乙酸,碳酸,苯酚,乙醇1年前查看全部
- 0.9%的医用生理盐水是:饱和溶液,不饱和溶液,浓溶液,稀溶液中哪两类?
 ggqw1年前1
ggqw1年前1 -
 IPHOX 共回答了17个问题
IPHOX 共回答了17个问题 |采纳率88.2%0.9%的医用生理盐水是:不饱和溶液,稀溶液1年前查看全部
- 用什么方法鉴别NACL是浓溶液还是稀溶液
 我就是不服你1年前1
我就是不服你1年前1 -
 这样是不对地 共回答了15个问题
这样是不对地 共回答了15个问题 |采纳率86.7%用重结晶法
两种食盐溶液在同一温度下看哪个先产生结晶,即为浓溶液1年前查看全部
- 电渗析法将废液分为浓溶液和稀溶液之后,这些浓溶液怎么处理呢?
电渗析法将废液分为浓溶液和稀溶液之后,这些浓溶液怎么处理呢?
具体一些啊.
同样的,多级闪蒸法蒸下来的废水怎么处理呢? zhuanghuabushiwo1年前1
zhuanghuabushiwo1年前1 -
 samdio 共回答了17个问题
samdio 共回答了17个问题 |采纳率94.1%能不能把问题说清楚?是指在脱盐过程中淡水室溶液浓度降低到一定程度后又不知道你具体怎么操作的而且料液是什么水质很难分析.1年前查看全部
- 0.96克金属镁跟含6.3克的硝酸稀溶液恰好完全反应,硝酸的还原产物的相对分子质量可能是?
0.96克金属镁跟含6.3克的硝酸稀溶液恰好完全反应,硝酸的还原产物的相对分子质量可能是?
选项A30 B46 C44 D80 szd9671年前1
szd9671年前1 -
 coralstar 共回答了13个问题
coralstar 共回答了13个问题 |采纳率92.3%0.96克镁的物质的量是0.04mol,被氧化后,生成镁离子,失去的电子为0.08mol ,需要0.08mol的硝酸根与之形成硝酸镁
NO3- --- NO2 --- NO ---- N2O -- NH4NO3
----------46-----30-------46-----80
硝酸可能变成上面这四种物质(数字为对应的相对分子质量).
A 变成NO,被还原的硝酸是0.08/3mol,质量是1.68克
B 变成NO2,被还原的硝酸是0.08mol,质量是5.04克
C 变成N2O,被还原的硝酸是0.02mol,质量是1.26克
D 变成NH4NO3,被还原的硝酸是0.01mol,质量是0.63克
题目说:"含6.3克的硝酸稀溶液"
就是说,硝酸只有0.1mol,而且必须有0.08mol硝酸根没有被还原,与镁离子形成硫酸镁,从上面计算的这些数据来看,D是最正确的了.1年前查看全部
- 往含Iˉ与Clˉ的稀溶液中滴入AgNO3溶液,为什么Ag+是先与Iˉ反应
 nathanque1年前1
nathanque1年前1 -
 winter_no 共回答了17个问题
winter_no 共回答了17个问题 |采纳率94.1%先与Iˉ反应
也可以认为是“强者先行”的规律.一种氧化剂遇上多种还原剂,先与还原性最强的反应;一种还原剂遇上多种氧化剂,先与氧化性最强的反应,同样,由于AgI的溶解度比AgCl更小,所以Ag+遇到Iˉ和Clˉ首先生成AgI沉淀,再生成AgCl沉淀.1年前查看全部
- 含三价铁离子,二价铁离子,铝离子,铵根离子的稀溶液中
含三价铁离子,二价铁离子,铝离子,铵根离子的稀溶液中
加入过氧化钠固体,充分反应后,再加稀盐酸,反应完全后,离子数目几乎不变的是? 秋林陈耀川真棒1年前1
秋林陈耀川真棒1年前1 -
 海之男0898 共回答了11个问题
海之男0898 共回答了11个问题 |采纳率72.7%是三价铝离子.
首先,加入过氧化钠之后,溶液呈碱性,且有氧化性,二价铁被氧化成三价铁,三价铁在碱性环境生成氢氧化铁(III)沉淀;铵根离子在碱性环境变成NH3和H2O,自然NH3会挥发;铝离子在碱性环境生成氢氧化铝沉淀,加入盐酸后,与氢氧化铝反应生成氯化铝溶于水;氢离子和氢氧根离子的量有于酸碱加入量不定,无法判断.1年前查看全部
- 亚硝酸和硝酸氧化性谁更强?亚硝酸为什么有时候在稀溶液时氧化性强?为什么?还有,为什么硝酸在加入二氧化氮之后氧化性会变强?
 iuiuioio1年前1
iuiuioio1年前1 -
 tuiguangyuan 共回答了15个问题
tuiguangyuan 共回答了15个问题 |采纳率80%亚硝酸氧化性更强.
硝酸还原的机理有一步是到NO2,因此加入NO2可以使反应变快(相当于催化剂,可以参考硝酸还原机理)1年前查看全部
- 在稀溶液中,1molch3cooh和1molnaoh完全中和时放出的热量为57.3kj
在稀溶液中,1molch3cooh和1molnaoh完全中和时放出的热量为57.3kj
这句话错在哪?不是已经完全中和了么 冰及1年前1
冰及1年前1 -
 braveheart0 共回答了23个问题
braveheart0 共回答了23个问题 |采纳率87%不会放出全部反应热会被溶液吸收一部分1年前查看全部
- 往含Iˉ与Clˉ的稀溶液中滴入AgNO3溶液,为什么Ag+是先与Iˉ反应
 我不是ihvke1年前3
我不是ihvke1年前3 -
 小蚊 共回答了26个问题
小蚊 共回答了26个问题 |采纳率84.6%因为AgI的溶解度比AgCl的溶解度小得多了,也就是含相同I和Cl离子时,加入Ag+,是I-先和Ag+达到形成沉淀的浓度,也就是Ag+.先与Iˉ反应 也可以认为是“强者先行”的规律.一种氧化剂遇上多种还原剂,先与还原性最强的反应;一种还原剂遇上多种氧化剂,先与氧化性最强的反应,同样,由于AgI的溶解度比AgCl更小,所以Ag+遇到Iˉ和Clˉ首先生成AgI沉淀,再生成AgCl沉淀.1年前查看全部
- 为什么制备硫酸钡沉淀是要在稀溶液中进行,不断搅拌的目的是什么?
 david65651年前3
david65651年前3 -
 熊锚烧香 共回答了20个问题
熊锚烧香 共回答了20个问题 |采纳率85%溶液较稀,杂质浓度小,共沉淀现象相应减少,有利于得到纯净的沉淀
不断搅拌使溶液均匀扩散,减少“局部过浓”,有利于得到颗粒较大,纯度高的沉淀1年前查看全部
- 浓溶液,稀溶液,溶解度,结晶的关系
 丰毅1年前1
丰毅1年前1 -
 drakrain 共回答了27个问题
drakrain 共回答了27个问题 |采纳率96.3%浓稀溶液的区别在于溶质的多少
溶解度就是一定温度下100g水可以溶解的溶质的质量
结晶石因为温度改变或溶剂减少及搅拌摩擦等因素导致溶质从溶剂中析出了1年前查看全部
- 饱和溶液、不饱和溶液、浓溶液、稀溶液之间的相似(?)处
饱和溶液、不饱和溶液、浓溶液、稀溶液之间的相似(?)处
什么既属于不饱和溶液又属于浓溶液?什么既属于不饱和溶液又属于稀溶液?什么既属于稀溶液又属于饱和溶液?什么既属于饱和溶液又属于浓溶液? candy19191年前1
candy19191年前1 -
 天上还有太阳 共回答了15个问题
天上还有太阳 共回答了15个问题 |采纳率86.7%某物质在100克水中的溶解度是230克,如果现在只溶解了210克,溶质质量分数达到了68%,它就既属于不饱和溶液又属于浓溶液;如果现在只溶解了10克,溶质质量分数为9%,它就既属于不饱和溶液又属于稀溶液;如果现在已经溶解了230克,溶质质量分数达到70%,它就既属于饱和溶液又属于浓溶液.
某物质在100克水中的溶解度是0.1克,如果现在已经溶解了0.1克,溶质质量分数只达到0.1%,它就既属于稀溶液又属于饱和溶液.1年前查看全部
- 水的离子积 稀溶液中的离子积 就是他们到底的关系吧 搞不太清楚 别都用概念说…… 比如下面一道题
水的离子积 稀溶液中的离子积 就是他们到底的关系吧 搞不太清楚 别都用概念说…… 比如下面一道题
25摄氏度,某稀溶液中由水电离产生的C(h*)与c(oh-)的乘积是1*10负20次
我就不懂了不是水电离产生的都是10负14次嘛?、、 为钱dd20061年前3
为钱dd20061年前3 -
 麒麟山的ll林 共回答了15个问题
麒麟山的ll林 共回答了15个问题 |采纳率100%听我说,只有25℃时才有Kw=1.0×10 -14(纯水或稀溶液)
这里虽也是25℃,但要注意,这里的1.0×10 -20并不是Kw,因为这里的c(H+)和c(OH-)都只是水电离出来的.这不是中性溶液.分类讨论——
1.考虑水解.若是水解导致的pH变化,那么H+和OH-应全部由水电离产生.
(这时c(H+)不等于c(OH-),要特别注意.一楼不对)这不符合题意.舍去.
2.这是酸或碱的稀溶液,则H+和OH-并非全部有水电离产生,但由水电离产生的这部分满足
c(H+)=c(OH-)
所以c(H+)=c(OH-)=1.0×10 -10
所以pH=10,这是碱的稀溶液.
再补充一点:kw=c(H+)·c(OH-),这是指溶液中的总浓度,并非水电离产生的.1年前查看全部
- (2004•南通)化学中有许多概念是相对的,又是统一的.如图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系.
(2004•南通)化学中有许多概念是相对的,又是统一的.如图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系.

(1)如图可以看出,饱和溶液与浓溶液、稀溶液的关系是______.
(2)0.9%医用生理盐水可归于图中______区域(选填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”).现有一瓶接近饱和的NaCl溶液,若要使它变为饱和溶液,一般采用的方法是______或______.
(3)生产上要配制5000g10%的盐酸来清洗钢材,需38%的盐酸(密度为1.19/cm3)______mL(计算结果保留到小数点后一位). lbh19872001年前1
lbh19872001年前1 -
 a175609092 共回答了15个问题
a175609092 共回答了15个问题 |采纳率86.7%解题思路:(1)饱和溶液和不饱和溶液的本质区别是:继续加入该溶质看能否溶解,和溶液的浓稀没关系.
(2)不饱和溶液转变为饱和溶液的方法有:改变温度,增加溶质和蒸发溶剂.
(3)溶液稀释过程中溶质的质量始终不变.(1)从图中可以看出饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液.所以饱和溶液与浓溶液、稀溶液的关系是:饱和溶液可能是浓溶液,也可能是稀溶液.
(2)0.9%的生理盐水因为浓度太小,所以是稀溶液;而且也不是饱和溶液,因为在20℃食盐的溶解度是36克,饱和溶液的质量分数=[36/100+36]×100%=26.47%.所以应该属于Ⅲ区域;
接近饱和的NaCl溶液,要变为饱和溶液,采用的方法有:①降温,②加入NaCl,③蒸发溶剂.
(3)设需38%的盐酸的体积为x
5000g×10%=38%×1.19g/cm3 x
x=1105.7ml
故答案为:
(1)饱和溶液可能是浓溶液,也可能是稀溶液
(2)Ⅲ;加入NaCl;蒸发溶剂
(3)1105.7点评:
本题考点: 浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系;用水稀释改变浓度的方法.
考点点评: 此题考查的是有关浓、稀溶液与饱和溶液、不饱和溶液的关系,饱和溶液和不饱和溶液的转化及溶液稀释问题.知识覆盖面较大,很好的锻炼了学生对溶液部分基础知识的掌握.1年前查看全部
- 饱和溶液、不饱和溶液和溶液与浓溶液、稀溶液的关系是?
 wjwtdy1年前4
wjwtdy1年前4 -
 仰天长啸cc3 共回答了16个问题
仰天长啸cc3 共回答了16个问题 |采纳率93.8%稀溶液不一定是不饱和溶液,如饱和氢氧化钙溶液
浓溶液也不一定是饱和溶液,如70%的浓硫酸
总之,浓稀与是否饱和没有必然联系!1年前查看全部
- 下列稀溶液中,溶质的阴阳离子个数比为1:2的是的
下列稀溶液中,溶质的阴阳离子个数比为1:2的是的
A,(NH4)2SO4
B,NAHSO4
C.K2S
D.NA2HPO4
请问为什么?电离?ABCD都分析.
1:2是哪些离子? nnlmm1年前1
nnlmm1年前1 -
 542030819 共回答了19个问题
542030819 共回答了19个问题 |采纳率78.9%A、(NH4)2SO4 铵根离子水解生成氨水和氢离子,铵根减少
B、 NaHSO4 是强酸强碱盐,钠和硫酸氢根都是强酸强碱离子,没有水解和电离
C、硫离子一次水解产生硫氢根和氢氧根,二次生成硫化氢和氢氧根,硫离子减少,所以不是1:2
D、磷酸氢根是弱酸跟,电离水解都有可能.1年前查看全部
- 不饱和溶液和浓溶液的混合溶液 不饱和溶液和稀溶液的混合溶液
不饱和溶液和浓溶液的混合溶液 不饱和溶液和稀溶液的混合溶液
是什么溶液?为什么? vv_111年前4
vv_111年前4 -
 人心平平 共回答了22个问题
人心平平 共回答了22个问题 |采纳率95.5%不饱和溶液和浓溶液的混合溶液 一定是不饱和溶液,可能是浓溶液,
不饱和溶液和稀溶液的混合溶液,一定是不饱和溶液,可能是稀溶液1年前查看全部
- 强酸强碱稀溶液发生中和反应每生成一摩水都放出57.3kj吗
强酸强碱稀溶液发生中和反应每生成一摩水都放出57.3kj吗
若生成弱电解质时呢?
若生成不溶盐如ba(oh)2+h2so4==h2o+baso4呢? Vion_0441年前3
Vion_0441年前3 -
 都市守夜人 共回答了21个问题
都市守夜人 共回答了21个问题 |采纳率90.5%概念首先要搞清楚,中和反应的实质是氢离子和氢氧根离子反应生成水,而中和热的概念是1摩尔氢离子和1摩尔氢氧根离子反应生成一摩尔水所放出的热量.
只要是生成了1摩尔的水,放出的热量就肯定是57.3KJ,至于说生成弱电解质的时候,提到了水解.水解是中和反应的逆反应,所以水解是吸热的.但是,无论怎样,酸碱反应的时候,中和反应和水解反应本来就是在同一过程中的,所以生成了1摩尔水,放出的热量就肯定是57.3KJ.
学习化学要搞清楚概念,这个是很重要的.1年前查看全部
- 浓溶液稀释和稀溶液浓缩的计算将60%C时,质量分数为80%的硝酸铵溶液400克,恒温蒸发掉5克水,析出10.5克晶体,则
浓溶液稀释和稀溶液浓缩的计算
将60%C时,质量分数为80%的硝酸铵溶液400克,恒温蒸发掉5克水,析出10.5克晶体,则60%C是硝酸铵的溶解度是多少? oc767841年前1
oc767841年前1 -
 xk13m 共回答了19个问题
xk13m 共回答了19个问题 |采纳率94.7%5克水蒸发带出10.5克晶体,那么五克水中可以溶解10.5克晶体.溶解度为1051年前查看全部
- 强酸和强碱在稀溶液中完全中和生成1molH2O(l),放出57.3kJ热量,浓硫酸与氢氧化钠溶液反应生成1molH2O(
强酸和强碱在稀溶液中完全中和生成1molH2O(l),放出57.3kJ热量,浓硫酸与氢氧化钠溶液反应生成1molH2O(l),
反应放出57.3kJ热量,这句话为什么不对 wewelove1年前1
wewelove1年前1 -
 最佳cc 共回答了19个问题
最佳cc 共回答了19个问题 |采纳率100%浓硫酸与氢氧化钠溶液反应生成1molH2O(l),反应放出大于57.3kJ热量
因为浓硫酸稀析会放出一部分热量1年前查看全部
- 1 在稀溶液中,酸跟碱发生中和反应生成1mol水所放出的热量称为中和热.(条件不应该还加上强酸强碱吗.)
1 在稀溶液中,酸跟碱发生中和反应生成1mol水所放出的热量称为中和热.(条件不应该还加上强酸强碱吗.)
2 中和热包括物质溶解,电离,水合等过程中的热效应.求问哪里错了 leooe1年前2
leooe1年前2 -
 ywq_001 共回答了23个问题
ywq_001 共回答了23个问题 |采纳率95.7%抱歉刚才只回答了你一个问题,我没有仔细看题请谅解1年前查看全部
- 新制的饱和氯水慢慢滴入含酚酞的naoh的稀溶液中所用的仪器
新制的饱和氯水慢慢滴入含酚酞的naoh的稀溶液中所用的仪器
我知道 一个是 滴管 ,还有一个是什么? conanryoma1年前1
conanryoma1年前1 -
 毛毛虫_1980 共回答了17个问题
毛毛虫_1980 共回答了17个问题 |采纳率94.1%烧杯1年前查看全部
- 在T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向
在T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,T℃______25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=______.序号 氢氧化钡溶液的体积/mL 盐酸的体积/mL 溶液的pH ① 22.00 0.00 8 ② 22.00 18.00 7 ③ 22.00 22.00 6
(2)x=______,原Ba(OH)2稀溶液的物质的浓度为______.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2稀溶液时,沉淀正好达到最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为______,Na2SO4的物质的量浓度为______. 落地怕有瓦1年前1
落地怕有瓦1年前1 -
 丢丢841101 共回答了22个问题
丢丢841101 共回答了22个问题 |采纳率90.9%解题思路:(1)溶液中的离子积Kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;水的电离是吸热过程,升高温度,促进电离,Kw增大;
(2)根据实验①可知,氢氧化钡中c(OH-)=
=0.0001mol•L-1,则c[Ba(OH)2]=[1/2]c(OH-);再根据表中③的数据求出氢离子浓度;1×10−12 1×10−8
(3)根据硫酸根离子和氢氧化钡的关系式计算n(SO42-)总,根据混合溶液的pH计算原来溶液中c(H+),从而得出其pH;
根据硫酸根离子守恒计算硫酸钠的物质的量浓度.(1)溶液中的离子积Kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b),已知a+b=12,所以Kw=10-12;
水的电离是吸热过程,升高温度,促进电离,Kw增大,而25℃时Kw=10-14,所以当Kw=10-12时温度大于25℃,
故答案为:大于;10-12;
(2)根据实验①可知,当氢氧化钡溶液中没加盐酸时,溶液的pH=8,则溶液中c(OH-)=
1×10−12
1×10−8=0.0001mol•L-1,所以c[Ba(OH)2]=[1/2]c(OH-)=5×10-5mol•L-1;
根据实验③可知,当氢氧化钡和盐酸的体积相同时,溶液的PH=6,即盐酸与氢氧化钡恰好反应,所以c(H+)=c(OH-)=0.0001mol•L-1,则原来盐酸中溶液的pH=4,即x=4;
故答案为:4;5×10-5mol•L-1;
(3)据题意知n(SO42-)总=n[Ba(OH)2]=3L×5×10-5 mol/L=1.5×10-4 mol,
据完全反应时,c(OH-)过=
5×10−5mol/L×2×3L−1×c(H+)
4L×[4mL/20mL]=
10−12
10−7mol/L=10-5 mol/L,
解得:c(H+)=1×10-4 mol/L,pH=4;
n(Na2SO4)=n(SO42-)总-n(H2SO4)=1.5×10-4 mol-[1/2]×10-4 mol×1 L=1×10-4 mol,
所以:c(Na2SO4)=1×10-4 mol/L,
故答案为:4;1×10-4 mol/L.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;物质的量浓度的相关计算;pH的简单计算.
考点点评: 本题考查了水溶液中的离子积常数应用、酸碱混合的定量判断和计算、pH的简单计算等,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,试题侧重于对学生计算能力的考查.1年前查看全部
- 在某稀溶液中含有0.1mol HNO3和x mol H2SO4,向其中加入9.6g
在某稀溶液中含有0.1mol HNO3和x mol H2SO4,向其中加入9.6g 铜粉,充分反应后产生的气体在标准状况下的体积为2.24L,则x值至少为( )
A. 0.1
B. 0.12
C. 0.15
D. 0.2 featheir1年前1
featheir1年前1 -
 madcatsad 共回答了22个问题
madcatsad 共回答了22个问题 |采纳率86.4%解题思路:离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,9.6g铜粉的物质的量为[9.6g/64g/moL]=0.15mol,反应后生成NO气体,物质的量为[2.24L/22.4L/mol]=0.1mol,根据反应的离子方程式计算需要硫酸的物质的量.9.6g铜粉的物质的量为[9.6g/64g/moL]=0.15mol,反应后生成NO气体,物质的量为[2.24L/22.4L/mol]=0.1mol,
根据反应判断
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
3 2 8 2
0.15mol 0.1mol (2x+0.1)mol 0.1mol
要使充分反应后产生的气体在标准状况下的体积为2.24L,则有[2x+0.1/0.1=
8
2],x=0.15,为使铜全部溶解,生成气体体积为2.24L,硫酸的物质的量最少为0.15mol,
故选C.点评:
本题考点: 有关范围讨论题的计算.
考点点评: 本题考查硫酸的物质的量的计算,题目难度不大,本题注意利用离子方程式计算,并判断反应的物质的量的关系.1年前查看全部
- 在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=______.
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=______.
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______.
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.试分析其原因______. 石岩1年前1
石岩1年前1 -
 月朗星稀清晨夜 共回答了14个问题
月朗星稀清晨夜 共回答了14个问题 |采纳率92.9%解题思路:(1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;
(2)根据混合溶液的酸碱性计算氢离子浓度,从而计算溶液的pH;
(3)混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量;
(4)pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,氢离子和氢氧根离子恰好反应,根据盐的性质分析.(1)溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;故答案为:10-12;(2)酸中氢离子的物质的量=0.1mol/L×2×0.1L=0.02mol,碱中氢氧根离子的物质的量=0.4mol/L×0.1L=0.04mol/L,混合溶液中...
点评:
本题考点: pH的简单计算;离子积常数.
考点点评: 本题考查了离子积常数的有关计算,注意碱溶液中氢氧根离子浓度的计算方法,为易错点.1年前查看全部
- 有谁懂医用基础化学有谁比较懂医用化学的啊 我有一些题麻烦帮我解答一下啊 ( )16、一定温度下,稀溶液的蒸汽压下降决定于
有谁懂医用基础化学
有谁比较懂医用化学的啊 我有一些题麻烦帮我解答一下啊
( )16、一定温度下,稀溶液的蒸汽压下降决定于:
A.大气压强 B.溶质的本性 C.溶质的分子数 D.溶液的渗透浓度
( )17.浓度相同的NH4Cl与 NH3溶液按下列哪种比例混合,才能得到pH=9.25的缓冲溶液.(pK(NH3)=4.75)
A.一体积NH4Cl溶液与二体积NH3水溶液 B.二体积NH4Cl溶液与一体积NH3水溶液 C.三体积NH4Cl溶液与一体积NH3水溶液 D.等体积
( )18、某一级反应,当反应物浓度消耗一半时需要12分钟,则36分钟后反应物浓度为原始浓度的
A、1/6 B、1/8 C、1/3 D、1/4
( )19.有碳酸钠0.53g,求n( Na2CO3) 是多少?已知[Mr(Na2CO3)=106].将其溶于400 ml 的水中,配制成溶液,其浓度为多少?
A.n=0.005,c=0.0125mol/L B.n=0.010,c=0.0125 mol/L
C.n=0.005 c=0.025mol/L D.n=0.010,c=0.025mol/L
( )20酸碱质子理论认为:凡是能 (12) 的物质都是酸;凡是能 (13) 的物质都是碱.共轭酸的酸性越强,其共轭碱的碱性就越___(14)___.
(12)A.给出质子 B.接受质子 C.使石蕊变红 D.使酚酞无色
(13)A.给出质子 B.接受质子 C.使石蕊变蓝 D.使酚酞变红
(14)A.越强 B.越弱 C.不变 D.与其无关
( )21在乙炔分子中共含有σ键 (1) 个,π键 (2) 个.NH3分子中的N原子是以_(3)_杂化轨道成键的;H2O分子中的O原子是以_(4)_杂化轨道成键的.
(1) A.5 B.2 C.0 D.3
(2) A.3 B.5 C.2 D.0
(3) A.SP3 B.SP2 C.没有杂化 D.SP3不等性
(4) A.SP3不等性 B.SP2 C.SP3 D.SP
( )22、某电子的运动状态n = __(5)__,l = 3,m = -1,si = +1/2.
(5)A.2 B.3 C.4 D.-1/2
( )23、正常人血液的pH应维持在 (8) 范围,其中最重要的一个缓冲系是 (9) .(8) A.7.35-7.45 B.7.10-7.20 C.7.0-7.40 D.6.35-7.00
(9) A.H2PO4--HPO42- B.H2bO2-HbO2- C.HCO3--CO2(aq)
( )24、在下述分子中CCl4、 CHCl3、C2H4和CH2CCl2,极性分子有 (17) ,含有π键的分子有 (18) .
(17)A.CHCl3和CH2CCl2 B.CH2CCl2 C.CCl4和C2H4 D.CCl4
(18)A.CHCl3 B.CCl4 C.C2H4 D.C2H4和CH2CCl2
( )25、为简要说明σ键和π键 的主要区别,叙述最完整的为
A.σ键是指两个原子的原子轨道沿键轴方向以“头碰头”方式重叠所形成的共价键;而π键是指两个原子轨道垂直于键轴,以“肩并肩”方式重叠所形成的共价健.
B.除A.中所述内容外,σ键重叠程度大,较π键牢固.可单独存在于两原子之间,构成分子的骨架.
C.除B.中所述内容外,π键较σ键活泼,较易断开.
D.σ键和π键 的主要区别只是σ键能独立存在于两原子之间,而π键则不能. 最好看眼神1年前1
最好看眼神1年前1 -
 jornme 共回答了21个问题
jornme 共回答了21个问题 |采纳率95.2%16、D.溶液的渗透浓度
17、D.等体积 pH=pKa,所以是等体积
18、B、1/8 一半一半又一半,得到1/8
19、A.n=0.005,c=0.0125mol/L
20、A.给出质子 是酸 B.接受质子 是碱 B.越弱
21、D.3 σ键 C.2 π键 D.SP3不等性 A.SP3不等性
22、A.2
23、A.7.35-7.45 标准是7.4;C.HCO3--CO2(aq)
24、A.CHCl3和CH2CCl2 不对称就有极性;D.C2H4和CH2CCl2 π键含在双键里面
25、B 具体的区别如下:
σ键可以单独存在
π键一定要与σ键共存
σ键键能较大,由电子云沿轴对称重叠而成,重叠程度大,能绕键轴自由旋转
π键键能较小,是由p电子云从侧面重叠,易断,不能旋转
σ键不易极化,电子云分布比较集中
π键容易极化,电子云分散在对称平面上下,有较大流动性1年前查看全部
大家在问
- 1什么运用了凹面镜聚光原理是手电筒,探照灯,自行车尾灯,汽车灯
- 2趣说南极磷虾中.南极磷虾是一种小型甲壳类动物,给他取名为“南极磷虾”的原因是?
- 3形容不是最好的就是最坏的成语
- 4翻译提问This Nondisclosure Agreement (the "Agreement") is entere
- 5山重水复疑无路.呜呼,师道之不复可知矣.公子往数请之,朱亥故不复谢.的翻译
- 6The library of our school is much bigger than ___of yours A.
- 7英语翻译Determine who owns a zebra and whose favorite drink is m
- 8(三)(12分)阅读下面的文字,完成15-19小题。昆虫?间谍?/ 惟真①还记得日本科幻游戏《昆虫大战》吗?随着科学技术
- 9She is always good student.变否定句,并译
- 10用平行线设计图案
- 11神舟十号飞般的发射成功对我国有何重要意义?
- 12若(m+1)x2+mx-3m=0是关于x的一元一次方程则m=几 方程的解为几
- 13又到离别时 作文
- 14(10分)【地理——自然灾害与防治】
- 15在北京秋天天气怎么样?天气很凉快.有时有雨并且刮风. 翻译
