某融雪剂由氯化钙、氯化钠组成,其中氯化钠的质量分数为26%.取一份含有融雪剂的雪样充分溶于水后过滤,得到200g
 xinyuan292022-10-04 11:39:541条回答
xinyuan292022-10-04 11:39:541条回答A. 5.68g
B. 2.84g
C. 14.2g
D. 0.71g

已提交,审核后显示!提交回复
共1条回复
 烟光远 共回答了21个问题
烟光远 共回答了21个问题 |采纳率95.2%- 解题思路:样品中所含氯元素质量即融雪剂中氯化钙所含氯元素与氯化钠所含氯元素的质量和,所取200g样品中含有氯元素的质量即10g滤液中所含氯元素质量的20倍;根据氯化钙的化学式可求得氯化钙中钙元素质量分数,再利用10g滤液含钙元素的质量求中所含氯化钙质量,即可求得所含氯化钠质量,利用两物质质量求得10g滤液中含氯元素的质量即可解决问题.
10g滤液中含氯化钙的质量=0.12g÷[40/111]×100%=0.333g,则该滤液中含氯化钠的质量=0.333g÷(1-26%)×26%=0.117g;
10g滤液中含氯元素的质量=0.333g×[71/111]×100%+0.117g×[35.5/58.5]×100%=0.284g
则所取样品中含有氯元素的质量=0.284g×[200g/10g]=5.68g
故选A.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 根据溶液的均一性,所取200g样品中含有氯元素的质量即10g滤液中所含氯元素质量的20倍,此为解决问题时所必需考虑的. - 1年前
相关推荐
- (2009•延庆县一模)融雪剂含有硅酸钠(Na2SiO3)这种物质,其中Si元素的化合价是( )
(2009•延庆县一模)融雪剂含有硅酸钠(Na2SiO3)这种物质,其中Si元素的化合价是( )
A.+1价
B.+2价
C.+3价
D.+4价 牵了小猪泡MM1年前1
牵了小猪泡MM1年前1 -
 庶民自来 共回答了14个问题
庶民自来 共回答了14个问题 |采纳率85.7%解题思路:根据在化合物中正负化合价代数和为零,进行解答.根据在化合物中正负化合价代数和为零,可得硅酸钠(Na2SiO3)中Si元素的化合价为:
(+1)×2+x+(-2)×3=0,
解答x=+4;
故选D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;化学式的书写及意义;常见元素与常见原子团的化合价;有关化学式的计算和推断.
考点点评: 根据在化合物中正负化合价代数和为零计算指定元素化合价是学习化学必须掌握的知识.1年前查看全部
- 今年1月份的雪灾对我国南方的电力、交通造成很大的危害,有一种融雪剂含有Na 2 SiO 3 (硅酸钠),Na 2 SiO
今年1月份的雪灾对我国南方的电力、交通造成很大的危害,有一种融雪剂含有Na 2 SiO 3 (硅酸钠),Na 2 SiO 3 中Si元素的化合价为 [ ]A.+1价
B.+2价
C.+3价
D.+4价 gjw1231年前1
gjw1231年前1 -
 非凡5号 共回答了15个问题
非凡5号 共回答了15个问题 |采纳率86.7%D1年前查看全部
- (2008•从化市一模)今年春节前夕,我国南方出现了冰雪灾害,在这场抗击冰雪的战斗中,融雪剂发挥了-定的作用.某公司生产
(2008•从化市一模)今年春节前夕,我国南方出现了冰雪灾害,在这场抗击冰雪的战斗中,融雪剂发挥了-定的作用.某公司生产的融雪剂的成分是由氯化钠、氯化镁、硫酸铜、硝酸钠中的两种或两种以上的物质组成.某兴趣小组对融雪剂进行了如下的探究实验:
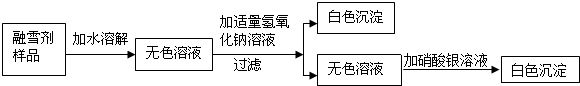
根据上述实验回答下列问题:
(1)该融雪剂一定不含______;一定含有______;可能含有的是______.
(2)加入氢氧化钠时发生反应的化学方程式是______;另一种白色沉淀的化学式是______. kingkong4121年前1
kingkong4121年前1 -
 zhuo125004 共回答了26个问题
zhuo125004 共回答了26个问题 |采纳率92.3%解题思路:融雪剂样品加水溶解得到无色溶液,可以判断样品中一定没有硫酸铜,因为硫酸铜溶液为蓝色;向无色溶液中加入氢氧化钠溶液可以得到白色沉淀,说明样品中一定含有氯化镁,因为只有氯化镁可以和氢氧化钠反应生成氢氧化镁白色沉淀;同时可以判断无色溶液的溶质一定有氯化钠,则加入硝酸银后产生的白色沉淀一定是氯化银了.
通过题目中的实验无法确定是否含有氯化钠和硝酸钠,这两种物质就是可能含有了.由题意可知融雪剂样品中可能含有的物质为:氯化钠、氯化镁、硫酸铜、硝酸钠中的两种或两种以上.结合实验分析这四种物质:硫酸铜溶液为蓝色;氯化镁可以和氢氧化钠发生反应生成白色沉淀氢氧化镁和氯化钠;氯化钠和硝酸钠不能与氢氧化钠反应.可以得出判断:样品中一定没有硫酸铜,一定含有氯化镁,可能含有氯化钠和硝酸钠.
由于氯化镁和氢氧化钠反应生成氯化钠,加入硝酸银溶液后生成的白色沉淀一定是氯化银.
故答案为:
(1)硫酸铜;氯化镁;氯化钠和硝酸钠.
(2)MgCl2+2NaOH═Mg(OH)2↓+2NaCl;AgCl.点评:
本题考点: 实验探究物质的组成成分以及含量;常用盐的用途;常见离子的检验方法及现象;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答通过实验判断物质组成的题目时,一定要抓住各物质的特性.比如颜色变化、产生沉淀、生成气体等,然后实验中每一步的现象做出正确判断.1年前查看全部
- 2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH
2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK).请回答:
(l)醋酸钾中C、H、O元素的质量比为______,原子个数比为______,
(2)钾元素的质量分数为______.(保留一位小数). 此花不待风吹信1年前0
此花不待风吹信1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 去年春节前,我国南方发生了特大冰雪灾害,为确保道路畅通,交通部门使用了大量的氯化钠融雪剂.下列关于该融雪剂的说法中,错误
去年春节前,我国南方发生了特大冰雪灾害,为确保道路畅通,交通部门使用了大量的氯化钠融雪剂.下列关于该融雪剂的说法中,错误的是( )
A. 氯化钠能融雪是因为其溶液的凝固点比水低
B. 氯化钠的大量使用会造成地下水污染
C. 使用氯化钠融雪,会加快钢铁桥梁的锈蚀
D. 使用大量氯化钠融雪,对公路周围农作物的生长无影响 椰风海韵G一夕1年前3
椰风海韵G一夕1年前3 -
 549514121 共回答了23个问题
549514121 共回答了23个问题 |采纳率87%解题思路:融雪剂中含有的氯化钠加入水中,能降低水的凝固点,从而加快雪的溶解,在水溶液中能电离出钠离子和氯离子增强溶液的导电性,加快了金属制品的锈蚀.A、氯化钠加入水中,能降低水的凝固点,故A正确;
B、氯化钠的大量使用,能增加水中盐的含量,会造成地下水污染,故B正确;
C、氯化钠在水溶液中能电离出钠离子和氯离子增强溶液的导电性,加快了金属制品的锈蚀,故C正确;
D、使用大量氯化钠融雪,增加了盐的含量,影响农作物的生长,故D错误,
故选D.点评:
本题考点: 常用盐的用途;水资源的污染与防治;金属锈蚀的条件及其防护.
考点点评: 本题口岸出了氯化钠的用途,完成此题,可以依据已有的氯化钠的性质进行.1年前查看全部
- 去年春节前,我国南方发生了特大冰雪灾害,为确保道路畅通,交通部门使用了大量的氯化钠融雪剂.下列关于该融雪剂的说法中,错误
去年春节前,我国南方发生了特大冰雪灾害,为确保道路畅通,交通部门使用了大量的氯化钠融雪剂.下列关于该融雪剂的说法中,错误的是( )
A. 氯化钠能融雪是因为其溶液的凝固点比水低
B. 氯化钠的大量使用会造成地下水污染
C. 使用氯化钠融雪,会加快钢铁桥梁的锈蚀
D. 使用大量氯化钠融雪,对公路周围农作物的生长无影响 hanbtao20011年前1
hanbtao20011年前1 -
 江玉枫 共回答了18个问题
江玉枫 共回答了18个问题 |采纳率100%解题思路:融雪剂中含有的氯化钠加入水中,能降低水的凝固点,从而加快雪的溶解,在水溶液中能电离出钠离子和氯离子增强溶液的导电性,加快了金属制品的锈蚀.A、氯化钠加入水中,能降低水的凝固点,故A正确;
B、氯化钠的大量使用,能增加水中盐的含量,会造成地下水污染,故B正确;
C、氯化钠在水溶液中能电离出钠离子和氯离子增强溶液的导电性,加快了金属制品的锈蚀,故C正确;
D、使用大量氯化钠融雪,增加了盐的含量,影响农作物的生长,故D错误,
故选D.点评:
本题考点: 常用盐的用途;水资源的污染与防治;金属锈蚀的条件及其防护.
考点点评: 本题口岸出了氯化钠的用途,完成此题,可以依据已有的氯化钠的性质进行.1年前查看全部
- 氯化钙融雪剂为什么可以融雪?
 ada_sun1年前5
ada_sun1年前5 -
 撩哥 共回答了27个问题
撩哥 共回答了27个问题 |采纳率85.2%兴湘氯化钙厂家:融雪剂的主要成份是盐类,氯化钙融雪剂是盐类融雪剂的一种,融雪原理表现在:1、盐类物质的溶解要吸收热量,有助于积雪的溶解.2、盐类融雪剂溶于水(雪)后,凝固点较低,如氯化钠(食盐主要成分)溶于水...1年前查看全部
- (2010•潍坊)冬季,大雪覆盖路面,给交通造成很多麻烦,散撒融雪剂可以使雪很快融化,有效地清除交通雪障.请回答:
(2010•潍坊)冬季,大雪覆盖路面,给交通造成很多麻烦,散撒融雪剂可以使雪很快融化,有效地清除交通雪障.请回答:
(1)除使用融雪剂外,常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的,锰钢属于______(填写序号字母).
A.合成材料B.合金C.金属材料D.化合物
(2)氯化钙是常用的融雪剂.工业上以碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产氯化钙的主要流程如下:
①滤渣的主要成分是______(填化学式);
②加盐酸酸化,其目的之一是除去未反应的氢氧化钙,写出反应的化学方程式______.
(3)已知盐酸盐(金属氯化物)跟AgNO3溶液反应生成白色沉淀.某公司生产的融雪剂由NaCl、NaNO3、MgCl2、CuSO4中的两种物质组成.小明为探究其成分,设计并完成下列实验:
请你推断:
融雪剂中一定不含的物质是______(填写名称),融雪剂中一定含有的物质是______(填化学式). asgood1年前1
asgood1年前1 -
 baby一一 共回答了22个问题
baby一一 共回答了22个问题 |采纳率95.5%解题思路:(1)金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称.包括纯金属、合金、金属材料金属间化合物和特种金属材料等;
(2)根据物质间反应生成沉淀的情况进行推断,即可正确解答;
(3)根据图示和已知条件,逐一分析,即可正确解答.(1)锰钢属于合金,合金也是金属材料.故选BC.
(2)①第一次反应的生成物有氯化钙、氯化钠、氯化铁和氯化铝,第二次反应加入过量氢氧化钙溶液,与 氯化铁和氯化铝反应生成氢氧化铁沉淀和氢氧化铝沉淀.故滤渣中的主要成份是氢氧化铁沉淀和氢氧化铝沉淀;
②盐酸与氢氧化钙反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)因为氢氧化镁是白色沉淀,氢氧化铜是蓝色沉淀,氯化钠与硝酸钠不与氢氧化钠反应,故可推断原混合物中一定没有硫酸铜;一定含有氯化镁;
故答案为:(1)BC;
(2)①Al(OH)3、Fe(OH)3;②Ca(OH)2+2HCl═CaCl2+2H2O;(3)硫酸铜,MgCl2.点评:
本题考点: 物质的鉴别、推断;合金与合金的性质;化学式的书写及意义;反应现象和本质的联系;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题主要是考查同学们的综合分析能力,不但要求同学们具备有关物质的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断.1年前查看全部
- 2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH
2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK).请回答:
(1)醋酸钾的相对分子质量为______;
(2)醋酸钾中C、H、O元素的质量比为______. 小黑51813141年前1
小黑51813141年前1 -
 ypp3 共回答了22个问题
ypp3 共回答了22个问题 |采纳率86.4%解题思路:(1)根据相对分子质量为组成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(1)醋酸钾的相对分子质量为12+1×3+12+16+16+39=98.
(2)醋酸钾中C、H、O元素的质量比为(12×2):(1×3):(16×2)=24:3:32.
故答案为:(1)98;(2)24:3:32.点评:
本题考点: 相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2011•奉贤区二模)今年冬天雪灾严重,对人们的生活造成一定的影响.为了扫除道路上的积雪,人们使用融雪剂,对于气温低于
(2011•奉贤区二模)今年冬天雪灾严重,对人们的生活造成一定的影响.为了扫除道路上的积雪,人们使用融雪剂,对于气温低于-30℃的严重地区,要采用醋酸钾(化学式CH3COOK)来进行融雪,该物质由______种元素组成;其中碳、氢元素的质量比为______;该物质的摩尔质量为______;0.5mol该物质的分子数为______.
 1190645521年前1
1190645521年前1 -
 ylxuehu 共回答了23个问题
ylxuehu 共回答了23个问题 |采纳率95.7%解题思路:根据醋酸钾(化学式CH3COOK)的化学式的含义可以确定其元素组成;化合物中各元素质量比=各原子的相对原子质量×原子个数之比;单位物质的量的物质所具有的质量,称为摩尔质量,在数值上等于该物质的相对原子质量或相对分子质量;一摩尔任何物质中含有的微粒个数是6.02×1023个;据此化学分析解答即可.根据醋酸钾的化学式CH3COOK可知,它是由碳、氢、氧、钾四种元素组成的;
化合物中各元素质量比=各原子的相对原子质量×原子个数之比,醋酸钾中碳、氢元素的质量比为(12×2):(1×3)=8:1;
醋酸钾的相对分子质量=12+1×3+12+16+16+39=98,摩尔质量在数值上等于该物质的相对分子质量,故答案为98g/mol;
一摩尔任何物质中含有的微粒个数是6.02×1023个,故0.5mol该物质的分子数为0.5×6.02×1023个=3.01×1023个.
故答案为:4;8:1;98g/mol;3.01×1023个.点评:
本题考点: 有关化学式的计算和推断;物质的元素组成;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 在雪上撒洒上融雪剂的作用冰面撒沙子的 作用撒锅底的草木灰在积雪上的科学道理 猜想 理由设计实验方案证明
 云飘飘妹1年前3
云飘飘妹1年前3 -
 重名的太多 共回答了25个问题
重名的太多 共回答了25个问题 |采纳率92%路上有雪并不可怕
最可怕的就是路上的雪融化以后结的冰
撒融雪剂的作用就是阻止雪水再结冰
主要机理就是融雪剂溶于水能降低溶液的凝固点
这个很好证明
去两个相同的杯子装满水
其中一杯水中要有融雪剂
两个水杯放在零摄氏度
不方融雪剂的水杯结了冰
另一个仍是溶液1年前查看全部
- (2011•广州)氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等.某工厂以石灰石为原料生产二水氯化钙(C
(2011•广州)氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等.某工厂以石灰石为原料生产二水氯化钙(CaCl2•2H2O)的流程如图.原料石灰石中含有杂质主要是MgCO3、MgSO4和Al2O3.

(1)石灰石粉溶解时,Al2O3发生反应的化学方程式为______.
(2)加入BaCl2除去的杂质离子是______;加入Ca(OH)2除去的杂质离子是______.
(3)检验“滤液”酸碱性,如果显碱性,还需加入适量的______(填化学式)提高产品纯度. 岭南夜猫1年前1
岭南夜猫1年前1 -
 系铃人 共回答了23个问题
系铃人 共回答了23个问题 |采纳率82.6%解题思路:(1)氧化铝为金属氧化物,金属氧化物与酸发生复分解反应生成盐和水;
(2)氯化钡能与溶液中的硫酸镁反应生成硫酸钡沉淀,由此可判断加入氯化钡除去了溶液中的硫酸根离子;氢氧化钙能与溶液中氯化镁、氯化铝生成氢氧化镁、氢氧化铝的沉淀,因此,加入的氢氧化钙可除去溶液中镁离子、铝离子;
(3)若滤液呈碱性,可说明前面操作所加氢氧化钙过量,为得到较纯净氯化钙,应加入稀盐酸进行中和.(1)氧化铝与盐酸反应生成氯化铝和水,化学方程式为Al2O3+6HCl=2AlCl3+3H2O;
(2)氯化钡能与溶液中的硫酸镁反应生成硫酸钡沉淀和氯化镁,因此,除去的杂质离子为硫酸根离子;氢氧化钙能与溶液中氯化镁、氯化铝反应生成氢氧化镁沉淀、氢氧化铝沉淀和氯化钙,因此,除去的杂质离子为镁离子、铝离子;
(3)如果滤液显碱性,则前后操作中加入的氢氧化钙过量,可加入稀盐酸与氢氧化钙反应生成氯化钙和水,除去氢氧化钙而得到较为纯净的氯化钙;
故答案为:(1)Al2O3+6HCl=2AlCl3+3H2O;
(2)硫酸根离子;镁离子、铝离子(或Mg2+、Al3+)
(3)HCl.点评:
本题考点: 碳酸钠、碳酸氢钠与碳酸钙;物质除杂或净化的探究;酸的化学性质;物质的相互转化和制备;书写化学方程式、文字表达式、电离方程式.
考点点评: 紧扣生产目的分析生产流程图,明确流程图中各操作在生产过程中的作用,整体把握生产过程,这是解答所提出的问题的基础.1年前查看全部
- 什么东西可以代替融雪剂啊?听大家说融雪剂对环境不好 有能代替它的就好了 环境需要大家的维护,小事做起…嘿 我家收集的电池
什么东西可以代替融雪剂啊?
听大家说融雪剂对环境不好 有能代替它的就好了 环境需要大家的维护,小事做起…嘿 我家收集的电池怎么处理呢?额 跑题了…
 KishiZhu1年前1
KishiZhu1年前1 -
 水瓶座的女子 共回答了16个问题
水瓶座的女子 共回答了16个问题 |采纳率93.8%可以用 化工盐或其他一切可溶物代替(不考虑价格和实用性)
因为水中溶解了其他物质,凝固点都会降低,就可以达到溶血的目的了
专业的我不敢随便说,毕竟这是我的知识所限,他们那专业的,大概也是抄袭别的网的.1年前查看全部
- 去冬今春,遵义市遭受了特大的雪凝灾害,给市民出行带来了诸多不便.在除雪过程中,融雪剂发挥了很大的作用.某公司生产的融雪剂
去冬今春,遵义市遭受了特大的雪凝灾害,给市民出行带来了诸多不便.在除雪过程中,融雪剂发挥了很大的作用.某公司生产的融雪剂是由NaCl、CuSO 4 、NaNO 3 、MgCl 2 中的两种或两种以上的物质组成.小佳为探究其成分,设计并完成了以下实验: 
根据以上实验,请你判断:
(1)该融雪剂中一定有的物质是______;一定没有的物质是______;不能确定的物质是______.
(2)写出产生白色沉淀的化学方程式______,该反应的基本类型是______反应. WjxhXJ1年前1
WjxhXJ1年前1 -
 本人在线 共回答了20个问题
本人在线 共回答了20个问题 |采纳率90%(1)融雪剂加水溶解得到无色溶液,硫酸铜溶于水得到蓝色溶液,说明融雪剂中没有硫酸铜;得到的无色溶液和氢氧化钠反应得到白色沉淀,因为氯化镁和氢氧化钠反应生成氢氧化镁白色沉淀和氯化钠,所以融雪剂中一定含有氯化镁;氯化钠、硝酸钠都能溶于水形成无色溶液,且都不和氢氧化钠反应,所以不能确定融雪剂中是否含有氯化钠和硝酸钠.(2)氯化镁和氢氧化钠反应生成氢氧化镁白色沉淀和氯化钠,化学方程为:MgCl 2 +2NaOH=Mg(OH) 2 ↓+2NaCl,此反应是两种化合物相互交换成分生成另外两种化合物的反应,是复分解反应.
故答案为:(1)MgCl 2 ; CuSO 4 ; NaCl,NaNO 3 .
(2)MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl,复分解.1年前查看全部
- 初三化学推断题3月4日,特大暴风雪袭击了我国东北地区,在这场抗击暴风雪的战斗中,融雪剂发挥了—定的作用。某公司生产的融雪
初三化学推断题
3月4日,特大暴风雪袭击了我国东北地区,在这场抗击暴风雪的战斗中,融雪剂发挥了—定的作用。某公司生产的融雪剂的成分是由氯化钠、氯化镁、硫酸铜、硝酸钠中的两种或两种以上的物质组成。某兴趣小组为探究其成分设计并完成了以下实验:根据上述实验推断该融雪剂组成可能是(1)____________;(2) ;(3) 。
写出在图示的实验中一定发生了的化学反应的方程式 。
 骑马出走的水手1年前2
骑马出走的水手1年前2 -
 一勿 共回答了21个问题
一勿 共回答了21个问题 |采纳率71.4%由图可知:
在第一步中:融雪剂溶与水后为无色溶液,而硫酸铜溶与水后显蓝色,可以推出其中无硫酸铜.
第二步中,与氢氧化钠反应能生成白色沉淀,则能满足此条件的只有氯化镁.
反应方程式为:MgCl2+2NaOH=2NaCl+Mg(OH)2↓
则可以得出,必然有MgCl2(氯化镁).
第三步反应:与硝酸银反应,有白色沉淀.
由于在供选答案中能与硝酸银反应的有氯化镁和氯化钠,由于在第二步中除去了氯化镁(由化学方程式可知),但是又引入氯化钠,同样能和硝酸银反应,因此不能确定是否含有氯化钠.
整个检验流程中无法检验硝酸钠,所以也无法确定否含硝酸钠.
根据推导过程得出:一定有氯化镁,可能有氯化钠,可能有硝酸钠.
则得出(1)可能的配方有3种:
①氯化镁和氯化钠 ②氯化镁和硝酸钠 ③氯化镁、氯化钠和硝酸钠
(2)由以上推导过程得出,必然发生的反应有2个:
①氯化镁和氢氧化钠反应:MgCl2+2NaOH=2NaCl+Mg(OH)2↓
②氯化钠(上个反应引如的杂质)和硝酸银反应:
NaCl+AgNO3=AgCl↓+NaNO31年前查看全部
- 今年1月份的雪灾对我国南方电力、交通造成了很大危害,在抗灾过程中常使用一种融雪剂硅酸钠(化学式为Na 2 SiO 3 )
今年1月份的雪灾对我国南方电力、交通造成了很大危害,在抗灾过程中常使用一种融雪剂硅酸钠(化学式为Na 2 SiO 3 )进行融雪,Na 2 SiO 3 中Si元素的化合价为( ) A.+1价 B.+2价 C.+3价 D.+4价  hz77091年前1
hz77091年前1 -
 玫瑰乌龙茶 共回答了24个问题
玫瑰乌龙茶 共回答了24个问题 |采纳率91.7%根据在化合物中正负化合价代数和为零,可得Na 2 SiO 3 中Si元素的化合价为:(+1)×2+x+(-2)×3=0,解答x=+4,
故选D.1年前查看全部
- 今年年初,我国南方地区遭遇了50年一遇的特大暴风雪袭击,在这场抗击暴风雪的战斗中,融雪剂发挥了巨大的作用.某公司生产的融
今年年初,我国南方地区遭遇了50年一遇的特大暴风雪袭击,在这场抗击暴风雪的战斗中,融雪剂发挥了巨大的作用.某公司生产的融雪剂的成分可能是由氯化钠、氯化镁、硫酸铜、硝酸钠中的两种物质组成.某兴趣小组为探究其成份设计了如下实验: 
请你回答下列问题:
(1)某同学认为融雪剂中一定不含有硫酸铜,你认为他的依据根是______.
(2)请写出步骤2当中发生的化学反应方程式______.
(3)根据以上试验步骤和现象,你认为融雪剂的可能组成有______. daxiaobenben1年前1
daxiaobenben1年前1 -
 xsj2000 共回答了19个问题
xsj2000 共回答了19个问题 |采纳率94.7%(1)因为融雪剂加入水得到无色溶液,所以一定不存在硫酸铜,因为硫酸铜溶于水溶液呈现蓝色;
(2)没有硫酸铜,加入氢氧化钠后能产生白色沉淀,只能是氢氧化钠与氯化镁反应产生氢氧化镁沉淀了,相互交换成分,再配平;
(3)通过前两步可知一定不存在硫酸铜,一定存在氯化镁,又因为融雪剂中有两种成分,所以可能是氯化镁和氯化钠或氯化镁和硝酸钠.
故答案为:(1)融雪剂加水溶解后(或步骤1后)形成无色溶液;
(2)MgCl 2 +2NaOH═2NaCl+Mg(OH) 2 ↓
(3)MgCl 2 和NaCl;MgCl 2 和NaNO 31年前查看全部
- (2008•汕头)2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要
(2008•汕头)2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用.其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH3COOK).请回答:
(1)醋酸钾中C、H、O元素的原子个数比为 ______
(2)醋酸钾中C、H、O元素的质量比为 ______
(3)醋酸钾的相对分子质量为 ______,钾元素的质量分数为 ______(保留一位小数). 追处小猪1年前1
追处小猪1年前1 -
 gymaple 共回答了13个问题
gymaple 共回答了13个问题 |采纳率76.9%解题思路:本题要根据醋酸钾的化学式来解答.
(1)利用化学式可以看出元素原子的个数,进一步得出原子个数比.
(2)C、H、O元素的质量比要利用原子个数和相对原子质量来解答.
(3)相对原子质量的和可得相对分子质量,钾元素的质量分数可用K的相对原子质量和醋酸钾的相对分子质量计算.(1)由CH3COOK可以看出,C、H、O元素的原子个数为2、3、2,故答案为:2:3:2.
(2)醋酸钾中C、H、O元素的质量比为:12×2:1×3:16×2═24:3:32,故答案为:24:3:32.
(3)醋酸钾的相对分子质量为12×2+1×3+16×2+39═98,钾元素的质量分数为[39/98×100%═39.8%,故答案为:98;39.8%.点评:
本题考点: 元素质量比的计算;化学式的书写及意义;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 主要考查了相对分子质量的计算方法,元素质量分数的求法以及利用相对质量求物质中所含元素的比值的方法,这些基本计算要求掌握.
化学式中各原子的相对原子质量的总和,就是相对分子质量.
某元素的质量分数=该元素分子的相对原子质量×原子个数相对分子质量]×100%.1年前查看全部
- 融雪剂 其化学成分XY2 ,X.Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mo
融雪剂 其化学成分XY2 ,X.Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol
 missgucaiqin1年前1
missgucaiqin1年前1 -
 yyyjmlzz031 共回答了14个问题
yyyjmlzz031 共回答了14个问题 |采纳率85.7%XY2 = X2+ + 2Y-,既然阳离子与阴离子电子层结构相同,那么阳离子和阴离子就都是含有54mol÷3mol=18个电子,而阳离子是带有2个单位正电荷的,其质子数为18 + 2 = 20,是Ca2+离子;阴离子带有1个单位的负电荷,其质子数为18 - 1 = 17,是Cl-离子.所以该融雪剂为CaCl2,氯化钙.1年前查看全部
- 冬季,大雪覆盖路面,给交通造成很多麻烦,散撒融雪剂可以使雪很快融化,有效地清除交通雪障。请回答:
冬季,大雪覆盖路面,给交通造成很多麻烦,散撒融雪剂可以使雪很快融化,有效地清除交通雪障。请回答:
(1)除使用融雪剂外,常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的,锰钢属于 (填写序号字母)。 A.合成材料 B.合金 C.金属材料 D.化合物
(2)氯化钙是常用的融雪剂。工业上以碳酸钙(含有少量Na + 、A1 3+ 、Fe 3+ 等杂质)生产氯化钙的主要流程如下:
①滤渣的主要成分是 (填化学式);
②加盐酸酸化,其目的之一是除去未反应的氢氧化钙,写出反应的化学方程式 。
(3)已知盐酸盐(金属氯化物)跟AgNO 3 溶液反应生成白色沉淀。某公司生产的融雪剂由NaCl、NaNO 3 、MgCl 2 、CuSO 4 中的两种物质组成。小明为探究其成分,设计并完成下列实验:
请你推断: 融雪剂中一定不含的物质是 (填写名称),融雪剂中一定含有的物质是 (填化学式)。  云中妃雨1年前1
云中妃雨1年前1 -
 xdwl18 共回答了17个问题
xdwl18 共回答了17个问题 |采纳率94.1%(1)BC
(2)①Al(OH) 3 ; Fe(OH) 3
②Ca(OH) 2 +2HCl==CaCl 2 +2H 2 O
(3)硫酸铜;MgCl 21年前查看全部
- 氯化钙在生活中常用作融雪剂,某工厂以石灰石为原料生产氯化钙的流程如下.原料石灰石中含有杂质主要是MgCO3、MgSO4
氯化钙在生活中常用作融雪剂,某工厂以石灰石为原料生产氯化钙的流程如下.原料石灰石中含有杂质主要是MgCO3、MgSO4

我想问问 为什么滤渣中主要成分是 baso4,ma(oh)2? 不能有ca(oh)2吗 ca(oh)2也很多啊.
 dvdsgd1年前1
dvdsgd1年前1 -
 yy2201229 共回答了21个问题
yy2201229 共回答了21个问题 |采纳率100%Mg(OH)2难溶,Ca(OH)2微溶,况且Ca(OH)2作为除杂剂和中和剂也只是稍微过量,并没有很大量,所以滤渣中没有Ca(OH)2.1年前查看全部
- 为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY 2 ,X、Y均为周期表前20号元素,其阳离子和阴离子的电子
为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY 2 ,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY 2 含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO 2 的三原子分子,且每个原子均达到了8e - 稳定结构,该分子的结构式为________,电子式为________,化学键类型为________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成______,其化学键类型为________;加热时生成______,其化学键类型为________,电子式为________。 明珠一筐1年前0
明珠一筐1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一种常用融雪剂的主要成分的化学式为XY 2 ,X原子的结构示意图为 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W
一种常用融雪剂的主要成分的化学式为XY 2 ,X原子的结构示意图为  ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ 2 型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ 2 型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、________
(3)下列说法正确的是________。
A.XY 2 和WZ 2 都为离子化合物
B.XY 2 中仅含离子键,WZ 2 中仅含极性共价键
C.H 2 Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________.
A.XY 2 的电子式:
B.WZ 2 的结构式:Z=W=Z
C.Y元素的单质与H 2 Z水溶液反应的离子方程式为:Y 2 +Z 2- ===2Y - +Z↓
D.用电子式表示XY 2 的形成过程为:
(5)冰雪的化学成分是H 2 O,水的沸点比H 2 Z的沸点高,其原因是_____________________。 hisokahl1年前1
hisokahl1年前1 -
 我爱苏苏 共回答了24个问题
我爱苏苏 共回答了24个问题 |采纳率87.5%(1)20;CaCl 2
(2)硫;碳
(3)B
(4)BD
(5)水分子间存在氢键1年前查看全部
- 冰的溶点与哪些因素有关?融雪剂原理是什么?
 ninek1年前2
ninek1年前2 -
 kuafu 共回答了19个问题
kuafu 共回答了19个问题 |采纳率94.7%冰的熔点是冰本身的物理性质,外界条件如气压对熔点有一点影响,但最为基本的决定因素是冰的纯净程度决定的.一般来说,含有杂质水结成的冰,都比纯水结成的冰低,原因是水的比热比普通物质都到.融雪剂原理是掺杂,至于掺杂物质是什么,则要详查.1年前查看全部
- 今年2008年1月的雪灾对我国南方的电力、交通造成很大的危害.有一种融雪剂含有Na2SiO3(硅酸钠),硅酸钠中硅元素的
今年2008年1月的雪灾对我国南方的电力、交通造成很大的危害.有一种融雪剂含有Na2SiO3(硅酸钠),硅酸钠中硅元素的化合价( )
A. +1
B. +2
C. +3
D. +4 red红雨1年前1
red红雨1年前1 -
 婆婆之一 共回答了18个问题
婆婆之一 共回答了18个问题 |采纳率100%解题思路:利用化合物中各元素化合价的代数和为零,计算化合物中指定元素的化合价.Na2SiO3(硅酸钠)中Na元素为+1价,O元素为-2价,设Si元素化合价为x
(+1)×2+x+(-2)×3=0
解之得 x=+4
故选:D点评:
本题考点: 有关元素化合价的计算;常见元素与常见原子团的化合价;化合价规律和原则.
考点点评: 根据常见元素的化合价,利用各元素化合价代数和为零的原则,可计算出组成中元素的化合价.1年前查看全部
- (2010•海淀区一模)某融雪剂由氯化钙、氯化钠组成,其中氯化钠的质量分数为26%.取一份含有融雪剂的雪样充分溶于水后过
(2010•海淀区一模)某融雪剂由氯化钙、氯化钠组成,其中氯化钠的质量分数为26%.取一份含有融雪剂的雪样充分溶于水后过滤,得到200g 滤液和 2g 杂质.取10g滤液进行测定,假设溶液中氯元素、钙元素、钠元素均来自于融雪剂,且杂质中不含可溶物,其中含钙元素的质量为0.12g.则所取样品中含有氯元素的质量为( )
A.5.68g
B.2.84g
C.14.2g
D.0.71g 绝情tt1231年前1
绝情tt1231年前1 -
 chdm 共回答了16个问题
chdm 共回答了16个问题 |采纳率93.8%解题思路:样品中所含氯元素质量即融雪剂中氯化钙所含氯元素与氯化钠所含氯元素的质量和,所取200g样品中含有氯元素的质量即10g滤液中所含氯元素质量的20倍;根据氯化钙的化学式可求得氯化钙中钙元素质量分数,再利用10g滤液含钙元素的质量求中所含氯化钙质量,即可求得所含氯化钠质量,利用两物质质量求得10g滤液中含氯元素的质量即可解决问题.10g滤液中含氯化钙的质量=0.12g÷[40/111]×100%=0.333g,则该滤液中含氯化钠的质量=0.333g÷(1-26%)×26%=0.117g;
10g滤液中含氯元素的质量=0.333g×[71/111]×100%+0.117g×[35.5/58.5]×100%=0.284g
则所取样品中含有氯元素的质量=0.284g×[200g/10g]=5.68g
故选A.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 根据溶液的均一性,所取200g样品中含有氯元素的质量即10g滤液中所含氯元素质量的20倍,此为解决问题时所必需考虑的.1年前查看全部
- 融雪剂在没有阳光和车轧的情况下能融化冰雪吗
 venusian1年前1
venusian1年前1 -
 程娟84 共回答了23个问题
程娟84 共回答了23个问题 |采纳率95.7%可以的,因为融雪剂融雪的原理是融雪剂溶于水(雪)后,其冰点在零度下,如,融雪剂(食盐主要成分)溶于水后冰点在-10℃,氯化钙在-20℃左右,醋酸类可达-30℃左右.盐类的溶解需要吸热以外,还有一个作用就是盐水的凝固点较低,因此在雪水中溶解了盐之后就难以再形成冰块.此外,雪融剂溶于水后,水中离子浓度上升,使水的液相蒸气压下降,但冰的固态蒸气压不变.为达到冰水混和物固液蒸气压等的状态,冰便溶化了.
水是一种特殊的物质,即结冰后密度变小(一般物质固态下的密度大于液态下的密度),因此,压强越大,冰的其熔点越低.常常见到,车轮碾过的地方雪往往易于融化就是这个道理.积雪的路面上洒上融雪剂后,再经车辆的碾压就更易使雪融化.然后融雪剂融化冰雪跟有没有阳光是不冲突的. 安徽合肥有一家做融雪剂的,如果需要可以跟他们联系,他们是安徽省道路连续四年中标的单位,他们家一款UNS1价格适中 主要融雪化冰效果特别好1年前查看全部
- 融雪剂除雪的原因是什么
 财经ss1年前1
财经ss1年前1 -
 mm7105 共回答了16个问题
mm7105 共回答了16个问题 |采纳率87.5%盐融水冰点降低,不容易上冻.1年前查看全部
- 北京一下雪就会撒融雪剂,融雪剂有害么?
北京一下雪就会撒融雪剂,融雪剂有害么?
北京一下雪就会撒融雪剂,融雪剂是什么成分哦?
怎么能把雪融掉呢?他对环境有害么?
有没有别的办法能融雪?前一段时间看到日本有一个除雪机器人. lyc3183761年前1
lyc3183761年前1 -
 Vincent畅 共回答了18个问题
Vincent畅 共回答了18个问题 |采纳率94.4%融雪剂主要成分是工业用盐.对人体无害.
大量使用会造成土壤盐分过高,导致大量行道树和绿篱死亡 .1年前查看全部
- 2008年春节前后,我国南方出现了罕见的“雪灾”,期间“融雪剂”发挥了重要的作用.融雪剂常分为两大类:一类是以醋酸钾为主
2008年春节前后,我国南方出现了罕见的“雪灾”,期间“融雪剂”发挥了重要的作用.融雪剂常分为两大类:一类是以醋酸钾为主要成分的有机融雪剂,该类融雪剂融雪效果好,无腐蚀损害,但价格高;另一类是以氯化钠、氯化钙、氯化镁、氯化钾等为主要成分的氯盐类融雪剂,通称为“化冰盐”,它的优点是便宜,价格仅为有机融雪剂的1/10,但对大型公共基础设施等的腐蚀很严重.
融雪的原理是:使用融雪剂后,水的冰点会______(填“升高”或“降低”).若飞机场使用融雪剂,应选择融雪剂的类别是______融雪剂. 梦中王了1年前1
梦中王了1年前1 -
 灰羽一只 共回答了16个问题
灰羽一只 共回答了16个问题 |采纳率100%使用融雪剂后,水的冰点会降低.故填:降低.
因为飞机场有大型公共基础设施,氯化钠、氯化钙、氯化镁、氯化钾等对大型公共基础设施等的腐蚀很严重.所以应该使用有机融雪剂.故填:有机.1年前查看全部
- 我过南方地区抗击暴风雪中融雪剂发挥了一定作用,其中一种融雪效果好,无污染的融雪剂的主要成分是醋酸钾(CH 3 COOK)
我过南方地区抗击暴风雪中融雪剂发挥了一定作用,其中一种融雪效果好,无污染的融雪剂的主要成分是醋酸钾(CH 3 COOK)请回答:
(1)醋酸钾中C、H、O的原子个数比是______;
(2)醋酸钾中C、H、O元素质量比是______;
(3)醋酸钾的相对分子质量为______;
(4)醋酸钾中钾元素的质量分数是______.(保留一位小数) 雨中泪水1年前1
雨中泪水1年前1 -
 晕到yy 共回答了16个问题
晕到yy 共回答了16个问题 |采纳率93.8%(1)1个醋酸钾分子中含有2个碳原子、3个氢原子、2个氧原子,则醋酸钾中C、H、O的原子个数比是2:3:2.
(2)醋酸钾中C、H、O元素质量比是(12×2):(1×3):(16×2)=24:3:32.
(3)醋酸钾的相对分子质量为12×2+1×3+16×2+39=98.
(4)醋酸钾中钾元素的质量分数是
39
98 × 100%≈39.8%.
故答案为:(1)2:3:2;(2)24:3:32;(3)98;(4 )39.8%.1年前查看全部
- (2011•西双版纳)现有一包融雪剂,可能是CuSO4、Na2CO3、NaCl、Na2SO4 四种物质中的一种
(2011•西双版纳)现有一包融雪剂,可能是CuSO4、Na2CO3、NaCl、Na2SO4 四种物质中的一种或几种.某实验小组的同学为了测定它的成分,设计了如下实验:

(1)提出问题:白色沉淀C的成分是什么?
(2)进行猜想:白色沉淀C是______.
(3)实验验证:请从下列试剂中选择试剂进行验证.
NaOH溶液、HCl溶液、HNO3溶液、Ca(OH)2溶液、CaCl2溶液、NaCl溶液.
(4)分析与结论:通过分析,融雪剂A中一定含有的成分是______.步骤 现象 结论 取白色沉淀C少许放于试管,并向试管中加入足量的______
现象:______泡产生且白色沉淀部分溶解______白色沉淀C中一定含有BaCO3和BaSO4.
反应的化学方程式______. 朱依猫1年前1
朱依猫1年前1 -
 秋落枫叶 共回答了21个问题
秋落枫叶 共回答了21个问题 |采纳率85.7%解题思路:根据硫酸铜在溶液中显蓝色,硫酸根离子、碳酸根离子和钡离子会产生硫酸钡沉淀、碳酸钡沉淀,硫酸钡沉淀不溶于酸,碳酸钡沉淀溶于酸,氯离子和银离子会生成氯化银沉淀等知识进行分析.融雪剂A加水溶解,得到无色溶液B,硫酸铜在溶液中显蓝色,所以融雪剂中一定不含硫酸铜,B溶液中加入氯化钡会生成白色沉淀C,所以C可能是碳酸钡、硫酸钡中的一种或两种,无色溶液D中加入硝酸银,生成白色沉淀,氯化钡引入了氯离子,所以不能确定融雪剂中是否含有氯化钠,所以,
(2)进行猜想:白色沉淀C是:碳酸钡和硫酸钡的化合物;
(3)结合题中所给的药品,可以用盐酸检验沉淀的成分,所以,
步骤现象结论
取白色沉淀C少许放于试管,并向试管中加入足量的 稀盐酸
现象:有气泡产生且白色沉淀部分溶解白色沉淀C中一定含有BaCO3和BaSO4.
反应的化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑(3)通过上面的实验现象可知:融雪剂A中一定含有的成分是:碳酸钠和硫酸钠.
故答案为:(2)碳酸钡和硫酸钡的化合物;
(3)稀盐酸,有气泡,白色沉淀部分溶解,BaCO3+2HCl=BaCl2+H2O+CO2↑;
(3)碳酸钠和硫酸钠.点评:
本题考点: 物质的鉴别、推断;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析所给混合物中各物质的性质,然后根据题中所给的实验现象进行判断,最后确定混合物的组成成分.1年前查看全部
- 融雪剂的成分
 搞怪一根葱1年前2
搞怪一根葱1年前2 -
 wangyiyi 共回答了19个问题
wangyiyi 共回答了19个问题 |采纳率89.5%目前不论国外还是国内,融雪剂主要分为两大类,一类是以醋酸钾为主要成分的有机融雪剂,虽然这一类融雪剂融雪效果好,没有什么腐蚀损害,但它的价格太高,一般只适用于机场等地.而另一类则是氯盐类融雪剂,包括氯化钠、氯化钙、氯化镁、氯化钾等,通称作‘化冰盐’.它的优点是便宜,价格仅相当于有机类融雪剂的1/10,但它对大型公共基础设施的腐蚀是很严重的.
氯盐类融雪剂的除雪作用有两点,除了盐类的溶解吸热以外,还有一个作用就是盐水的凝固点较低,因此在雪水中溶解了盐之后就难以再形成冰块,从而有利于排雪.
除了以上原理之外还有:
雪融剂溶于水后,水中离子浓度上升,使水的液相蒸气压下降,但冰的固态蒸气压不变.为达到冰水混和物固液蒸气压等的状态,冰便溶化了.这一原理也很好的解释了盐水不易结冰的道理.1年前查看全部
- 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子.
(1)该融雪剂的化学式是______;X与氢元素形成的化合物的电子式是______.
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是______;D与E能形成一种非极性分子,该分子的结构式为______;D所在族元素的氢化物中,沸点最低的是______.
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是______.
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为______. 非常66071年前1
非常66071年前1 -
 cnecn 共回答了23个问题
cnecn 共回答了23个问题 |采纳率87%解题思路:(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为543=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca、Y为Cl,(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;故E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,根据晶体结构与氢键判断氢化物沸点高低;(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素,元素Z的单质分子Z2中由3个共价键,则Z为氮元素,Si与N形成一种新型无机非金属材料为Si3N4;(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,则R为F元素,F2与NaOH溶液反应的产物之一是OF2,OF2中氧元素为+2,F元素为-1价,反应中O元素化合价不变,故F元素化合价还降低,有NaF生成,根据元素守恒有水生成,据此配平书写.融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为[54/3]=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca、Y为Cl,
(1)XY2是CaCl2;X与氢元素形成的化合物为CaH2,属于离子化合物,由钙离子与氢负离子构成,其电子式是 ,
,
故答案为:CaCl2; ;
;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,D的离子结构示意图是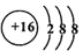 ;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,氧族元素中氢化物为分子晶体(Po除外),而水分子之间存在氢键,沸点最高,硫化氢相对分子质量小于硒化氢、碲化氢,H2S分子间作用力较小,故H2S的沸点最低,
;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,氧族元素中氢化物为分子晶体(Po除外),而水分子之间存在氢键,沸点最高,硫化氢相对分子质量小于硒化氢、碲化氢,H2S分子间作用力较小,故H2S的沸点最低,
故答案为: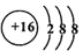 ;S=C=S;H2S;
;S=C=S;H2S;
(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素,元素Z的单质分子Z2中由3个共价键,则Z为氮元素,Si与N形成一种新型无机非金属材料为Si3N4,
故答案为:Si3N4;
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,则R为F元素,F2与NaOH溶液反应的产物之一是OF2,OF2中氧元素为+2,F元素为-1价,反应中O元素化合价不变,故F元素化合价还降低,有NaF生成,根据元素守恒有水生成,反应离子方程式为:2F2+2OH-=2F-+OF2+H2O,
故答案为:2F2+2OH-=2F-+OF2+H2O.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系、常用化学用语、物质结构与性质等,难度中等,氢化钙电子式与氟气与氢氧化钠溶液反应为易错点,注意氢化钙中氢离子电子式中2个电子为成对电子,不要分开书写,注意OF2不是氧化物,其中氧元素表现正化合价.1年前查看全部
- 由于我国北方某些城市在严冬时节曾用食盐融雪,造成土壤中含盐浓度偏高,使路旁的树木死亡.目前专家已研究出一种新型的融雪剂,
由于我国北方某些城市在严冬时节曾用食盐融雪,造成土壤中含盐浓度偏高,使路旁的树木死亡.目前专家已研究出一种新型的融雪剂,既能融化冰雪,又能起施肥养护树木的作用,具有上述作用的新型融雪剂的是( )
A. 氯化钠氯化钙
B. 氯化钠氯化镁
C. 氯化钠醋酸钙醋酸镁
D. 尿素硝酸钙硝酸镁 gamelive1年前1
gamelive1年前1 -
 yzx115000 共回答了19个问题
yzx115000 共回答了19个问题 |采纳率84.2%解题思路:利用此融雪剂会起到对树木起到施肥的作用进行分析探讨即可,由于尿素中含有氮元素是常见的化肥,所以可起到施肥的效果.解题的突破口在于对树木起到施肥养护的作用,在四个选项中只有D选项含有常用的化肥尿素,而其它选项均未找的可以作为树木肥料的物质.
故选D.点评:
本题考点: 常用盐的用途;常见化肥的种类和作用.
考点点评: 此题是一道生活实际考查题,解题的关键是抓住可做肥料这一突破口,属于一道生产中基础知识的考查题.1年前查看全部
- 2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用。其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH
2008年初,我国南方地区抗击暴风雪中融雪剂发挥了一定的作用。其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH 3 COOK)。请回答:
(1)醋酸钾中C、H、O元素的质量比为
(2)醋酸钾的相对分子质量为 ,钾元素的质量分数为 (保留一位小数)。(写出计算过程) 再见萤火虫w1年前1
再见萤火虫w1年前1 -
 anu822 共回答了19个问题
anu822 共回答了19个问题 |采纳率73.7%(1)24:3:32
(2)98;39.8%1年前查看全部
- 2008年初,在抗击我国南方地区罕见的冰雪灾害中,融雪剂发挥了一定的作用.
2008年初,在抗击我国南方地区罕见的冰雪灾害中,融雪剂发挥了一定的作用.
其中一种融雪效果好、无污染的融雪剂的主要成份是醋酸钾(CH 3 COOK).请回答:
(1)CH 3 COOK的相对分子质量是:______;
(2)CH 3 COOK中K元素的质量分数是:______(保留0.1%). a438h1年前1
a438h1年前1 -
 liuyanru 共回答了20个问题
liuyanru 共回答了20个问题 |采纳率85%(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得醋酸钾(CH 3 COOK)的相对分子质量为:12+1×3+12+16+16+39=98.
(2)根据化合物中元素的质量分数=
相对原子质量×原子个数
相对分子质量 ×100,醋酸钾(CH 3 COOK)中钾元素的质量分数=
39
98 ×100%=39.8%.
故答案为:(1)98;(2)39.8%.1年前查看全部
- 融雪剂除雪是什么变化
 wangbin051221年前1
wangbin051221年前1 -
 zhangsheng19 共回答了24个问题
zhangsheng19 共回答了24个问题 |采纳率87.5%物理变化 因为没有新物质生成1年前查看全部
- 今年春节前,我省发生了雪灾,为使道路通畅,交通部门使用了大量氯化钠融雪剂,下列说法错误的是
今年春节前,我省发生了雪灾,为使道路通畅,交通部门使用了大量氯化钠融雪剂,下列说法错误的是
A.氯化钠能融雪是因为它
B.使用氯化钠融雪,会加快钢铁桥梁的锈灼
C.氯化钠的大量使用会造成地下英用水污染的溶液凝固点比水低
D.使用氯化钠融雪,对公路周围农作物的生长无影响 lifeway1年前1
lifeway1年前1 -
 green5210 共回答了18个问题
green5210 共回答了18个问题 |采纳率94.4%D.使用氯化钠融雪,对公路周围农作物的生长无影响1年前查看全部
- 某融雪剂由氯化钙、氯化钠组成,其中氯化钠的质量分数为26%.取一份含有融雪剂的雪样充分溶于水后过滤,得到200g
某融雪剂由氯化钙、氯化钠组成,其中氯化钠的质量分数为26%.取一份含有融雪剂的雪样充分溶于水后过滤,得到200g 滤液和 2g 杂质.取10g滤液进行测定,假设溶液中氯元素、钙元素、钠元素均来自于融雪剂,且杂质中不含可溶物,其中含钙元素的质量为0.12g.则所取样品中含有氯元素的质量为( )
A. 5.68g
B. 2.84g
C. 14.2g
D. 0.71g yaoli19831年前1
yaoli19831年前1 -
 蓝调_ss 共回答了17个问题
蓝调_ss 共回答了17个问题 |采纳率100%解题思路:样品中所含氯元素质量即融雪剂中氯化钙所含氯元素与氯化钠所含氯元素的质量和,所取200g样品中含有氯元素的质量即10g滤液中所含氯元素质量的20倍;根据氯化钙的化学式可求得氯化钙中钙元素质量分数,再利用10g滤液含钙元素的质量求中所含氯化钙质量,即可求得所含氯化钠质量,利用两物质质量求得10g滤液中含氯元素的质量即可解决问题.10g滤液中含氯化钙的质量=0.12g÷[40/111]×100%=0.333g,则该滤液中含氯化钠的质量=0.333g÷(1-26%)×26%=0.117g;
10g滤液中含氯元素的质量=0.333g×[71/111]×100%+0.117g×[35.5/58.5]×100%=0.284g
则所取样品中含有氯元素的质量=0.284g×[200g/10g]=5.68g
故选A.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 根据溶液的均一性,所取200g样品中含有氯元素的质量即10g滤液中所含氯元素质量的20倍,此为解决问题时所必需考虑的.1年前查看全部
- 使用含有氯化钠的融雪剂会加快桥梁的腐蚀
使用含有氯化钠的融雪剂会加快桥梁的腐蚀
为什么 ccelii1年前1
ccelii1年前1 -
 pchenhui 共回答了21个问题
pchenhui 共回答了21个问题 |采纳率100%氯化钠是盐对钢铁可以形成原电池加速钢铁的腐蚀速度.所以对桥梁有腐蚀.1年前查看全部
- 融雪剂NaCl使冰雪融化是什么变化?
 lh3073071年前1
lh3073071年前1 -
 tinyants 共回答了19个问题
tinyants 共回答了19个问题 |采纳率89.5%物理1年前查看全部
- 融雪剂的原理是提高还是降低熔点?
融雪剂的原理是提高还是降低熔点?
降低凝固点这我知道
那么反过来说是熔点升高还是降低? 米兜1年前3
米兜1年前3 -
 经济界 共回答了17个问题
经济界 共回答了17个问题 |采纳率94.1%凝固点和熔点都是一样的啊1年前查看全部
- 工业上制取醋酸钾的化学方程式.醋酸钾是一种新型、环保的融雪剂,又称乙酸钾(CH3COOK).工业上由醋酸与氢氧化钾反应制
工业上制取醋酸钾的化学方程式.
醋酸钾是一种新型、环保的融雪剂,又称乙酸钾(CH3COOK).工业上由醋酸与氢氧化钾反应制得的. 天生我材必可用1年前1
天生我材必可用1年前1 -
 chilly0510 共回答了24个问题
chilly0510 共回答了24个问题 |采纳率83.3%工业上制取醋酸钾的化学方程式:CH3COOH+KOH=CH3COOK+H2O1年前查看全部
- 食盐做融雪剂的原因是 按照化学溶液方面的知识解释!
 769636361年前3
769636361年前3 -
 壶铃使人 共回答了19个问题
壶铃使人 共回答了19个问题 |采纳率89.5%“氯盐类”融雪剂的融雪原理是:“氯盐类”融雪剂溶于水(雪)后,其冰点在零度下,如,氯化钠 (食盐主要成分)溶于水后冰点在-10℃.盐水的凝固点比水的凝固点低,因此在雪水中溶解了盐之后就难以再形成冰块.此外,融雪剂溶于水后,水中离子浓度上升,使水的液相蒸气压下降,但冰的固态蒸气压不变.为达到冰水混和物固液蒸气压等的状态,冰便融化了.这一原理也能很好地解释了盐水不易结冰的道理.简单地说,就是融雪剂降低了雪的凝固点,使其更容易融化.大学中这一章节的解释好像是在非电解质稀溶液的依数性1年前查看全部
- 某公司生产的融雪剂是由氯化钠,硝酸钠,氯化镁,硫酸铜,中的两种或两种以上的物质组成的,小家为探究其成分,做了以下实验,
某公司生产的融雪剂是由氯化钠,硝酸钠,氯化镁,硫酸铜,中的两种或两种以上的物质组成的,小家为探究其成分,做了以下实验,
先取少量的融雪剂样品,加水溶解,变为无色溶液,再加入适量的氢氧化钠溶液,过滤后,有白色沉淀,溶液为无色,再向该无色溶液加澄清的硝酸银溶液,有白色沉淀.
问该融雪剂的成分可能是1 2 3,三种情况要三种答案.融雪剂除雪的原理是什么? yueh1年前1
yueh1年前1 -
 小志111 共回答了19个问题
小志111 共回答了19个问题 |采纳率89.5%成分:1、氯化镁 氯化钠 2、氯化镁 硝酸钠 3、氯化镁 硝酸钠 氯化钠
原理:主要是利用融雪作用的物质来降低水分的结冰温度,在降雪过程中融化新雪,防止积雪结冰.由于融雪剂的冰点较低,直接洒在路面的冰雪上,可以使冰冻的冰层积雪消冻成水.
解释:加水溶解为无色溶液,所以不含硫酸铜(硫酸铜溶液蓝色)
加氢氧化钠有白色沉淀,说明有氯化镁(MgCl2+2NaOH=Mg(OH)2↓(白色沉淀)+2NaCl)
向该无色溶液加澄清的硝酸银溶液,有白色沉淀,说明有氯离子存在,但不能判断是氯化镁中的还是氯化钠中的1年前查看全部
- (8分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY 2 ,X、Y为周期表前20号
(8分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY 2 ,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY 2 含有54 mol电子。
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的是 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D 与Y相邻,则D的离子
与Y相邻,则D的离子 结构示意图是 ;D与E能形成
结构示意图是 ;D与E能形成 一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 。
一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z 2 中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R 2 与NaOH溶液反应的产物之一是OR 2 ,该反应的离子方程式为 。 随缘125C1年前1
随缘125C1年前1 -
 意大利队主教练 共回答了12个问题
意大利队主教练 共回答了12个问题 |采纳率91.7%1年前查看全部
- 氯化钠等盐能作融雪剂,科学原理是
氯化钠等盐能作融雪剂,科学原理是
A nacl密度大
B nacl价格低
C nacl熔点高
D nacl熔点低 为爱牺牲1年前1
为爱牺牲1年前1 -
 不灭天龙 共回答了17个问题
不灭天龙 共回答了17个问题 |采纳率82.4%D,在-几十度都是液态1年前查看全部
- 今年我国南方很多地方遇到50年一遇的大雪灾,这次雪灾给人民的生产和生活带来了很多的不便,在交通疏导中使用了大量的融雪剂,
今年我国南方很多地方遇到50年一遇的大雪灾,这次雪灾给人民的生产和生活带来了很多的不便,在交通疏导中使用了大量的融雪剂,通常使用的融雪剂中有大量的氯化钠、氯化钙、氯化镁,这些物质用多了会对环境造成很多危害,对下列物质危害最小的是( )
A.桥梁
B.水
C.柏油马路
D.土壤 大力菜181年前1
大力菜181年前1 -
 li0916 共回答了18个问题
li0916 共回答了18个问题 |采纳率83.3%解题思路:融雪剂中含有大量的氯化钠、氯化钙、氯化镁,能降低水的凝固点,从而加快雪的溶解,在水溶液中能电离出金属离子和氯离子增强溶液的导电性,会增加水的硬度和含盐量,加快金属制品的锈蚀,对土壤造成污染.A、桥梁中含有大量的金属,融雪剂在水溶液中能电离出金属离子和氯离子增强溶液的导电性,加快了金属制品的锈蚀,危害较大;
B、氯化钠、氯化钙、氯化镁的大量使用,能增加水中盐的含量,会造成地下水污染,危害较大;
C、氯化钠、氯化钙、氯化镁等物质和柏油马路不反应,影响不大,故C正确;
D、使用大量融雪剂,增加了土壤中盐的含量,影响农作物的生长,危害较大.
故选C.点评:
本题考点: 常用盐的用途.
考点点评: 本题考查了氯化钠等盐酸盐的用途和对环境造成的危害,完成此题,要根据氯化钠等物质的性质进行分析解答.1年前查看全部
大家在问
- 1几道关于实数的计算题,1.√12-√(1/3)2.√80-√(4/5)+√0.23.(2√2-√3)*√3-√(2/3)
- 2在梯形ABCD中,∠B=45°,AD // BC,AD=3,DC=5,AB=4根2,动点M从B出发,沿线段BC以每秒2个
- 3用6块相同的长方形地砖拼成一个矩形.那么每个长方形地砖的面积是
- 48x-3*(50-x)=180 我老算错
- 5(2014•郑州一模)以下有关线性回归分析的说法不正确的是( )
- 6compare high-speed passenger train and plane.and discuss whi
- 7如图所示,轻杆BC的C点用光滑铰链与墙壁固定,杆的B点通过细绳AB使杆水平、细线与竖直墙壁保持30°的夹角.若在B点悬挂
- 8写一篇关于艺术品的作文500个字左右
- 9(25%+1)x+(x+6)×(1+20%)=66
- 10在路上看到老人跌倒,主动扶起跌倒的老人,却反被老人诬陷为撞人者。生活中的类似事件使我们遭遇“道德两难”选择。解决上述道德
- 11(-28)除以(-6+4)等于多少啊 (-6+4)怎么算啊,是负6加4还是6加4的相反数
- 12this picture has already been guessed by you (156382088)什么意思
- 13一条船顺水航行每小时行20千米,逆水航行每小时行15千米,已知这条船在该航道的甲、乙两港间往返一次要21小时.甲、乙两港
- 14如图是某种窗户的形状,其上部是半圆形,下部是边长相同的四个小正方形,已知下部分每小正方形的边长为a米,求:
- 15成语接龙:闷闷不乐,语无伦次.越多越好!

