银锌电池的负电极反应方程式为什么有时产物是ZnO+H20有时是Zn(OH)2
 我是笨笨SA2022-10-04 11:39:543条回答
我是笨笨SA2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 e2ala 共回答了19个问题
e2ala 共回答了19个问题 |采纳率84.2%- Zn(OH)2是弱碱,分解后就是ZnO+H20,一样的,考试不会打错,除非是大学生改
- 1年前
 jiangfengcoo 共回答了47个问题
jiangfengcoo 共回答了47个问题 |采纳率- 负极 锌失电子形成锌离子,但由于电解质的缘故,锌离子进一步与氢氧根生成氢氧化锌。
ZnO+H2O=Zn(OH)2 大似可看为这样,在高中学习中,不要把它拆开,还是写为氢氧化锌 - 1年前
 JEAN1949 共回答了2个问题
JEAN1949 共回答了2个问题 |采纳率- 2H2O+4e+O2=4(OH)-
貌似 - 1年前
相关推荐
- 银锌电池反应为什么Zn+两个氢氧根+失去两个电子==ZnO+H2O?一个氧离子+H2O==2个氢氧根?
 ling2001年前1
ling2001年前1 -
 renjie_rcm 共回答了15个问题
renjie_rcm 共回答了15个问题 |采纳率86.7%锌银电池负极是锌,电解质是氢氧化钾.
负极 锌失电子形成锌离子,但由于电解质的缘故,锌离子进一步与氢氧根生成氢氧化锌.
ZnO+H2O=Zn(OH)2 大似可看为这样,在高中学习中,不要把它拆开,还是写为氢氧化锌1年前查看全部
- 怎样写出原电池中的电极反应呀?怎样判断正负极是什么跟什么反应生成了什么?例如银锌电池为什么负极不是锌直接失电子而是和氢氧
怎样写出原电池中的电极反应呀?
怎样判断正负极是什么跟什么反应生成了什么?
例如银锌电池为什么负极不是锌直接失电子而是和氢氧根反应+失电子?
为什么锂电池的正极反应3SOCl2+8e-====SO32-+2S+6Cl-那么诡异……
这种东西要怎么看出来? kerrymm1年前2
kerrymm1年前2 -
 xkjack 共回答了21个问题
xkjack 共回答了21个问题 |采纳率95.2%1、抓原理:负极一定是失去电子,被氧化,正极一定是得到电子,被还原.
如负极Zn - 2e- = Zn 2+
2、抓介质,即环境.即后续反应.如Zn 2+ + 2 OH- = Zn(OH)2,两式相加即可得
负极实际反应:Zn - 2e- + OH- = Zn(OH)2
3、要善于抓正极+负极=总式的方法,写出简单的负极或正极,利用减法写另一极.如锂电池的负极反应式:Li-e=Li+,题中必然告诉你总式,相减即可得正极反应,3SOCl2+8e-====SO32-+2S+6Cl-(要保证电子相等再减).1年前查看全部
- 有一种纽扣微型电池,其电极分别是Ag2O和Zn.电解池是KOH溶液,所以俗称银锌电池,该电池的电极反应式为Zn+2OH-
有一种纽扣微型电池,其电极分别是Ag2O和Zn.电解池是KOH溶液,所以俗称银锌电池,该电池的电极反应式为Zn+2OH--2e=Zn(OH)2,Ag2O+H2O+2e=2Ag+OH-下列说法,正确的是( )
①锌为负极,Ag2O为正极②放电时,正极附近pH值上升③放电时,负极附近溶液pH值降低④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
A.①
B.①②④
C.①②③
D.①②③④ popann1年前1
popann1年前1 -
 xinyuhuanbao 共回答了19个问题
xinyuhuanbao 共回答了19个问题 |采纳率89.5%解题思路:根据电极反应式知,Zn失电子化合价升高为负极、Ag2O作正极,放电时,负极上消耗氢氧根离子、正极上生成氢氧根离子,根据溶液中氢氧根离子浓度变化确定溶液pH变化,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.①电极反应式中Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以锌为负极,Ag2O为正极,故正确;
②放电时,正极附近有氢氧根离子生成,导致溶液pH值上升,故正确;
③放电时,负极附近消耗氢氧根离子,导致溶液中氢氧根离子浓度降低,则pH值降低,故正确;
④放电是,电子从负极沿导线流向正极,则溶液中阴离子向负极方向移动,阳离子向正极方向移动,故错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,根据电极反应式中元素化合价变化确定正负极,再结合离子移动方向、正负极上发生的反应分析解答,题目难度不大.1年前查看全部
- 银锌电池广泛用作各种电子仪器的电源,其电极分别是Ag 2 O和锌,电解液为KOH溶液。电池反应是:Ag 2 O+Zn+H
银锌电池广泛用作各种电子仪器的电源,其电极分别是Ag 2 O和锌,电解液为KOH溶液。电池反应是:Ag 2 O+Zn+H 2 O="2Ag" +Zn(OH) 2 ,根据上述判断:
(1)原电池的正极是__________,负极是__________。
(2)原电池电极反应式为:负极_______________,正极______________。
(3)工作时原电池负极附近溶液的pH__________ (填“增大”、“不变”、“减小”)。 杨盛1年前1
杨盛1年前1 -
 lmtzff 共回答了28个问题
lmtzff 共回答了28个问题 |采纳率75%(5分)(1)Ag 2 O, Zn。
(2)Zn+ 2OH - -2e - =Zn(OH) 2 ;Ag 2 O+H 2 O+2e - =2Ag+ 2OH - 。 (3)减小
1年前查看全部
- 微型纽扣电池在现代生活中有广泛的应用,银锌电池为其中一种,其电极为Ag2O和Zn,KOH溶液为电解质,电极反应为:Zn+
 微型纽扣电池在现代生活中有广泛的应用,银锌电池为其中一种,其电极为Ag2O和Zn,KOH溶液为电解质,电极反应为:Zn+2OH=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH.
微型纽扣电池在现代生活中有广泛的应用,银锌电池为其中一种,其电极为Ag2O和Zn,KOH溶液为电解质,电极反应为:Zn+2OH=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH.
根据上述反应式,回答下列问题:
(1)写出电池的总反应式______.
(2)电池工作时,正极______电子(填“得到”、“失去”),失去电子的物质是______,负极区溶液的pH______(填“增大”、“减小”或“不变”,下同). 11月的ID1年前1
11月的ID1年前1 -
 床太小了 共回答了15个问题
床太小了 共回答了15个问题 |采纳率86.7%解题思路:原电池是将化学能转化为电能的装置,原电池中负极上失电子发生氧化反应,正极上得电子发生还原反应,在得失电子相等的条件下,将正负电极上电极反应式相加即得电池反应式,根据电极反应判断溶液pH的变化.(1)负极电极反应式为Zn+2OH--2e-=ZnO+H2O、正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以电池反应式为Zn+Ag2O=2Ag+ZnO,
故答案为:Zn+Ag2O=2Ag+ZnO;
(2)该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,Ag2O是正极得电子发生还原反应;负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O,则负极附近pH减小;
故答案为:得到;Zn;减小.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,题目难度不大,根据元素化合价变化确定正负极及反应类型,将正负极电极反应式相加得电池反应式,难点是电极反应式的书写.1年前查看全部
- 常用的钮扣电池为银锌电池,它分别以锌和氧化银为电极.放电时锌极上的电极反应是:Zn+2OH--2e=Zn(OH)2,氧化
常用的钮扣电池为银锌电池,它分别以锌和氧化银为电极.放电时锌极上的电极反应是:Zn+2OH--2e=Zn(OH)2,氧化银电极上的反应是:Ag2O+H2O+2e=2Ag+2OH-,下列判断中,正确的是( )
A.锌是负极,发生氧化反应,氧化银是正极,发生还原反应
B.锌是正极,发生氧化反应,氧化银是负极,发生还原反应
C.锌是正极,发生还原反应,氧化银是负极,发生氧化反应
D.锌是负极,发生还原反应,氧化银是正极,发生氧化反应 火花塞子工1年前1
火花塞子工1年前1 -
 wo爱上sandy 共回答了13个问题
wo爱上sandy 共回答了13个问题 |采纳率92.3%解题思路:在原电池中,失电子的金属为负极,发生失电子的氧化反应,得电子的物质是正极,在正极发生还原反应.根据题意:放电时锌极上的电极反应是:Zn+2OH--2e=Zn(OH)2,则金属锌发生失电子的氧化反应,所以金属锌为负极,氧化银电极上的反应是:Ag2O+H2O+2e=2Ag+2OH-,则氧化银发生得电子得还原反应,素以氧化银点极是正极.
故选A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查学生原电池的工作原理以及原电池中正负极的判断方法知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 纽扣式银锌电池的构造示意图如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag下列说法不正确的是(
 纽扣式银锌电池的构造示意图如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag下列说法不正确的是( )
纽扣式银锌电池的构造示意图如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag下列说法不正确的是( )
A.作负极,放电时Zn附近区域pH 变大
B.电子经外电路流向Ag2O极
C.放电过程不需要消耗KOH
D.正极反应:Ag2O+2H2O+2e-=2Ag+2OH- 0bluesky01年前1
0bluesky01年前1 -
 zzb1020 共回答了21个问题
zzb1020 共回答了21个问题 |采纳率90.5%解题思路:Zn+Ag2O+H2O=Zn(OH)2+2Ag中,负极反应为Zn+2OH--2e-=Zn(OH)2、正极反应为Ag2O+H2O+2e-=2Ag+2OH-,电子由负极流向正极,以此来解答.A.负极反应为Zn+2OH--2e-=Zn(OH)2,消耗氢氧根离子,则pH减小,故A错误;
B.Zn为负极,Ag2O为正极,则电子经外电路流向Ag2O极,故B正确;
C.总反应为Zn+Ag2O+H2O=Zn(OH)2+2Ag,不消耗KOH,故C正确;
D.正极上得到电子,则正极反应为Ag2O+H2O+2e-=2Ag+2OH-,故D正确;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池知识,题目难度不大,明确电极反应、原电池的正负极以及电池反应的关系,注意结合氧化还原反应来分析.1年前查看全部
- 微型纽扣电池在现代生活中有广泛应用.银锌电池电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2
微型纽扣电池在现代生活中有广泛应用.银锌电池电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=== ZnO+H2O;Ag2O+H2O+2e-=== 2Ag+2OH-.
使用过程中,电池负极区溶液的pH减小
嗯 我想问 为什么电池负极区溶液的pH减小
是因为氢氧根不断消耗的缘故吗 可是溶液中Ag2O+H2O+2e-=== 2Ag+2OH-.
不是又有氢氧根产生吗 不是说原电池电解质溶液中 阴离子向负极移动 那为什么会减小呢 唐风汉雨1年前2
唐风汉雨1年前2 -
 _blqk83fi_f_1f4c 共回答了23个问题
_blqk83fi_f_1f4c 共回答了23个问题 |采纳率95.7%电池负极区溶液的pH减小是因为氢氧根不断消耗的缘故,溶液中Ag2O+H2O+2e-=== 2Ag+2OH-,有氢氧根产生,导致正极区pH增大.电解质溶液中 阴离子向负极移动,也正确,不过,移动速度是很慢的,来不及中和.1年前查看全部
- 纽扣式银锌电池的构造示意图如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag.下列说法不正确的是(
 纽扣式银锌电池的构造示意图如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag.下列说法不正确的是( )
纽扣式银锌电池的构造示意图如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag.下列说法不正确的是( )
A.Zn作负极
B.电子经外电路流向Ag2O极
C.K+向Zn极移动
D.正极反应:Ag2O+H2O+2e−=2Ag+2OH- autmwater1年前1
autmwater1年前1 -
 向左不转弯 共回答了20个问题
向左不转弯 共回答了20个问题 |采纳率90%解题思路:根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极经外电路流向正极,溶液中阴离子向负极移动,阳离子向正极移动.A.该原电池中,锌失电子发生氧化反应而作负极,故A正确;
B.该原电池中,锌作负极,氧化银作正极,电子从负极锌经外电路流向正极氧化银,故B正确;
C.原电池放电时,钾离子向正极氧化银极移动,故C错误;
D.正极上氧化银得电子发生还原反应,电极反应式为:Ag2O+2e-+H2O═2Ag+2OH-,故D正确;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池工作原理,根据元素化合价的变化判断正负极,明确溶液中阴阳离子的移动方向即可解答,难度不大.1年前查看全部
- 微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极总反应为:Zn+
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极总反应为:Zn+Ag2O+H2O═Zn(OH)2+2Ag;根据上述反应式,判断下列叙述中正确的是( )
A.在使用过程中,电池负极区溶液的pH增大
B.电子由Ag20极经外电路流向Zn极
C.负极失去1mol电子时,正极生成108g银
D.Zn电极发生还原反应,Ag2O电极发生氧化反应 kuxiaotu1年前1
kuxiaotu1年前1 -
 qqandsh 共回答了18个问题
qqandsh 共回答了18个问题 |采纳率83.3%解题思路:该装置构成原电池,根据电极反应式知,锌作负极,氧化银作正极,负极上氢氧根离子参与反应,电子从负极沿导线流向正极,负极上发生氧化反应,正极上发生还原反应.A.根据电极反应式知,锌作负极,氧化银作正极,负极上氢氧根离子参与反应导致氢氧根离子浓度减小,则溶液的pH减小,故A错误;
B.锌是负极,氧化银是正极,电子从锌沿导线流向氧化银,故B错误;
C.负极失去1mol电子时,正极生成1mol银,质量为108g,故C正确;
D.负极锌失电子发生氧化反应,正极氧化银得电子发生还原反应,故D错误;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池原理,会根据得失电子判断正负极是解本题的关键,难度不大.1年前查看全部
- 一种金属微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和锌,电解质溶液为KOH溶液,电极反应为
一种金属微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和锌,电解质溶液为KOH溶液,电极反应为:Zn+2OH-═Zn(OH)2+2e- Ag2O+H2O+2e-═2Ag+2OH-总反应为:Ag2O+Zn+H2O═2Ag+Zn(OH)2根据上述反应式,判断下列叙述中,正确的是( )
A.在使用过程中,电池负极区溶液PH值减小
B.在使用过程中,电子由Ag2O极经外电路流向锌
C.Zn是正极,Ag2O是负极
D.工作一段时间后,KOH的物质的量明显减少 breathin1年前1
breathin1年前1 -
 晶晶潘 共回答了18个问题
晶晶潘 共回答了18个问题 |采纳率88.9%解题思路:根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,原电池中电流从正极流向负极,根据电极反应式可得电池总反应为Zn+Ag2O=ZnO+2Ag.A、负极电极反应为Zn+2OH-=ZnO+H2O+2e-,消耗氢氧根离子,溶液的pH减小,故A正确;
B、由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故B错误;
C、由电极反应式可知,Zn的化合价由0价升高到+2价,为原电池的负极,发生氧化反应,Ag2O是正极发生还原反应,故C错误;
D、正极电极反应为:Ag2O+H2O+2e-=2Ag+2OH-,负极电极反应:Zn+2OH-═Zn(OH)2+2e-,依据电子守恒分析,氢氧根离子基本不变,故D错误.
故选A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度不大,注意根据电极反应判断原电池的正负极以及电池反应.1年前查看全部
- 为什么银锌电池的反应式有的是Zn+Ag2O=ZnO+H2O,有的是Zn+Ag2O+H2O=Zn(OH)2+2Ag?
 夏威夷可纳1年前1
夏威夷可纳1年前1 -
 gxdc931 共回答了13个问题
gxdc931 共回答了13个问题 |采纳率84.6%这两个表达是一样的,因为产物不同所以方程式配平什么的会不同.不过高考来说,你记着一个就行了1年前查看全部
- 银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag 2 O和Zn,电解质溶液为KOH溶液,总反应为Ag 2 O+Zn+
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag 2 O和Zn,电解质溶液为KOH溶液,总反应为Ag 2 O+Zn+H 2 O=2Ag+Zn(OH) 2 ,下列说法中不正确的是()
A.原电池放电时,负极上发生反应的物质是Zn B.负极发生的反应是Zn+2OH - -2e - =Zn(OH) 2 C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强 D.溶液中OH - 向正极移动,K + 、H + 向负极移动  追夜1年前1
追夜1年前1 -
 matthew_zdf 共回答了16个问题
matthew_zdf 共回答了16个问题 |采纳率87.5%D
根据总反应Ag 2 O+Zn+H 2 O=2Ag+Zn(OH) 2 分析化合价变化可知,Zn在负极上失电子,Ag 2 O在正极上得电子,电解质溶液为KOH溶液,所以负极反应为Zn+2OH - -2e - =Zn(OH) 2 ,正极反应为Ag 2 O+2e - +H 2 O=2Ag+2OH - 。在负极区,OH - 被消耗,溶液碱性减弱,溶液中的OH - 作定向移动到负极来补充,正极区生成OH - ,溶液碱性增强,故D项错误。1年前查看全部
- 电子计算器所用的纽扣式电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e
电子计算器所用的纽扣式电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=Zn(OH)2、Ag2O+H2O+2e-=2Ag+2OH-.下列叙述中,不正确的是( )
A.电子由锌经导线流向Ag2O
B.Zn是正极发生氧化反应;Ag2O是负极发生还原反应
C.Zn是负极,发生氧化反应;Ag2O是正极,发生还原反应
D.工作时,负极区域溶液的pH减小,正极区域溶液的pH增大 KhAlaZ1年前1
KhAlaZ1年前1 -
 klxyoyo 共回答了17个问题
klxyoyo 共回答了17个问题 |采纳率88.2%解题思路:根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,原电池中电流从正极流向负极,根据电极反应式可得电池总反应为Zn+Ag2O=ZnO+2Ag.A、由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故A正确;
B、由电极反应式可知,Zn的化合价由0价升高到+2价,为原电池的负极,发生氧化反应,Ag2O是正极发生还原反应,故B错误;
C、由电极反应式可知,Zn的化合价由0价升高到+2价,为原电池的负极,发生氧化反应,Ag2O是正极发生还原反应,故C正确;
D、负极电极反应为Zn+2OH-=ZnO+H2O+2e-,消耗氢氧根离子,溶液的pH减小,正极电极反应为:Ag2O+H2O+2e-=2Ag+2OH-,生成氢氧根离子,该区域溶液的pH增大,故D正确.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度不大,注意根据电极反应判断原电池的正负极以及电池反应.1年前查看全部
- 银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
A. Ag
B. Zn(OH)2
C. Ag2O
D. Zn 毛毛毛帽子1年前2
毛毛毛帽子1年前2 -
 无极小子 共回答了14个问题
无极小子 共回答了14个问题 |采纳率100%解题思路:在原电池中,负极反应是原子失电子发生氧化反应的过程.在银锌二次电池中,根据反应:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H2O,放电时为原电池,活泼金属做负极,失电子发生氧化反应,根据电极反应应为锌.
故选D.点评:
本题考点: 电极反应和电池反应方程式.
考点点评: 本题主要考查学生电极反应的书写,要抓住电极反应的特点和规律,才能解决此种问题.1年前查看全部
- 钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质.当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流
钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质.当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流,此反应的化学方程式______.  uff19851年前1
uff19851年前1 -
 余姿乐 共回答了16个问题
余姿乐 共回答了16个问题 |采纳率93.8%根据置换反应的生成物中有单质和化合物,结合质量守恒定律可以判断生成物是氧化锌和银,锌和氧化银发生置换反应生成氧化锌和银,
故答案为:Zn+Ag 2 O═ZnO+2Ag,1年前查看全部
- 纽扣电池是一种微型银锌电池,在电池内装有氧化银和锌等物质,当电池工作时,是锌与氧化银反应生成一种单质和一种氧化物,从而产
纽扣电池是一种微型银锌电池,在电池内装有氧化银和锌等物质,当电池工作时,是锌与氧化银反应生成一种单质和一种氧化物,从而产生电流.其反应的化学方程式为:______.  尘枫蝶舞1年前1
尘枫蝶舞1年前1 -
 qlust 共回答了20个问题
qlust 共回答了20个问题 |采纳率80%根据置换反应的生成物中有单质和化合物,结合质量守恒定律可以判断生成物是氧化锌和银,整个反应的过程是:锌和氧化银发生置换反应生成氧化锌和银,
故答案为:Zn+Ag 2 O═ZnO+2Ag,1年前查看全部
- 有一种银锌电池.其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为Zn-2e-+2OH-=ZnO+H2O
有一种银锌电池.其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为Zn-2e-+2OH-=ZnO+H2OAg2O+2e-+H2O=2Ag+2OH-
下列各项中正确的是( )
A.银锌电池是一种低能电池
B.在使用过程中,电子由Ag2O极经外电路流向Zn极
C.原电池工作时,负极区溶液PH增大
D.Zn电极发生氧化反应,Ag2O电极发生还原反应 gsadfsjkjaa12haq1年前1
gsadfsjkjaa12haq1年前1 -
 静芷 共回答了19个问题
静芷 共回答了19个问题 |采纳率94.7%解题思路:根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,原电池中电流从正极流向负极,负极上发生氧化反应,正极上发生还原反应.A、银锌电池是一种高能电池,故A错误;
B、由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故B错误;
C、原电池放电时,负极上锌失电子和氢氧根离子反应生成氧化锌和水,导致负极附近氢氧根离子浓度降低,溶液的
PH值减小,故C错误;
D、由电极反应式知,负极上锌失电子发生氧化反应,正极上氧化银得电子发生还原反应,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理,难度不大,注意根据电极反应判断原电池的正负极.1年前查看全部
- 请问银锌电池的电极反应式是ZN+2OH--2e-=ZN(OH)2还是ZN+2OH--2e-=ZNO+H2O
 ynjiu1年前2
ynjiu1年前2 -
 条件是我方 共回答了20个问题
条件是我方 共回答了20个问题 |采纳率85%都行,看题目怎么说了.
不会让你单写电极反应式的,肯定会告诉你生成物是ZnO还是Zn(OH)2,
你看题就行了.1年前查看全部
- 微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是( )
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag20极经外电路流向Zn极
C.Zn是正极,Ag2O是负极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应 景如1年前1
景如1年前1 -
 jennywu1226 共回答了16个问题
jennywu1226 共回答了16个问题 |采纳率100%解题思路:该装置为原电池,根据电极反应式知,锌作负极,氧化银作正极,负极上氢氧根离子参与反应,电子从负极沿导线流向正极,负极上发生氧化反应,正极上发生还原反应.A.根据电极反应式知,锌作负极,负极的电极反应为:Zn+2OH--2e-=ZnO+H2O,负极上氢氧根离子参与反应导致氢氧根离子浓度减小,则溶液的pH减小,故A正确;
B.锌是负极,氧化银是正极,电子从锌沿导线流向氧化银,故B错误;
C.根据电极反应式知,锌失电子作负极,氧化银得电子作正极,故C错误;
D.根据电极反应式知,负极锌失电子发生氧化反应,正极氧化银得电子发生还原反应,故D错误;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池原理,会根据得失电子判断正负极是解本题的关键,结合氧化还原反应原理分析,题目难度不大.1年前查看全部
- 银锌电池(负极锌,正极氧化银,电解质氢氧化钾)的正极反应为什么是Ag2O+H2O+2e-=2Ag+2OH-
 书香情浓1年前1
书香情浓1年前1 -
 微笑不用代价 共回答了14个问题
微笑不用代价 共回答了14个问题 |采纳率92.9%1、电极反应也有氧化型(高化合价)和还原型(低化合价);
2、既然是银锌电池,则其还原型就确定了,Ag和锌单质;
3、其氧化型只能是高化合价,对银来说是+1价,对锌来说是+2价;
4、再根据环境(介质)来判断氧化型的存在方式:由于是KOH这种强碱性环境,Ag(+)肯定难以大量存在,2Ag(+) + 2OH(-) = Ag2O + H2O (因为AgOH常温下不稳定,分解为氧化银)所以氧化型是Ag2O;同理可以推出Zn(2+)也肯定难以大量存在,Zn(2+) + 4OH(-) = [Zn(OH)4](2-)
5、正极:Ag2O + H2O + 2e = 2Ag + 2OH(-)
6、负极:[Zn(OH)4](2-) + 2e = Zn + 4OH(-)
7、电池反应:Ag2O + Zn + H2O + 2OH(-) = 2Ag + [Zn(OH)4](2-)1年前查看全部
- 银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为
银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH - -2e-=ZnO+H 2 O;
Ag 2 O+H 2 O+2e- = 2Ag+2OH - ;总反应为:Ag 2 O+Zn=2Ag+ZnO,下列判断正确的是()A.锌为正极,Ag 2 O为负极 B.锌为负极,Ag 2 O为正极 C.原电池工作时,正极区PH减小 D.原电池工作时,负极区PH增大  橙埃1年前1
橙埃1年前1 -
 aeyou 共回答了18个问题
aeyou 共回答了18个问题 |采纳率83.3%B
原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以根据电极反应式可知,锌失去电子,作负极,负极区pH降低。氧化银得到电子,作正极,正极区pH增大。根据总反应式可知,溶液的pH不变,所以正确的答案选B。1年前查看全部
- 银锌电池两种反应式不同银锌电池一种反应是Zn+Ag2O=ZnO+2Ag另一种是锌和氧化银加水生氢氧化锌和银.这两种有什么
银锌电池两种反应式不同
银锌电池一种反应是Zn+Ag2O=ZnO+2Ag另一种是锌和氧化银加水生氢氧化锌和银.这两种有什么不同么? 爱上我没有明天1年前1
爱上我没有明天1年前1 -
 rock89757 共回答了19个问题
rock89757 共回答了19个问题 |采纳率78.9%前一种反应是一步进行,后一种反应由两步反应方程式和并而成.1年前查看全部
- 银锌电池中哪一级PH减小为什么
 Esther_387631年前2
Esther_387631年前2 -
 Summer我思故我在 共回答了23个问题
Summer我思故我在 共回答了23个问题 |采纳率100%阴极
锌在阳极失去电子,因此锌是逐渐消耗的
微型纽扣电池在现代生活中有广泛应用.银锌电池电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=== ZnO+H2O;Ag2O+H2O+2e-=== 2Ag+2OH-.
使用过程中,电池负极区溶液的pH减小
使用过程中,电子由Zn极经外电路流向Ag2O极
Zn极是负极,Ag2O极是正极
Ag2O电极发生还原反应,Zn电极发生氧化反应
判断原电池的正负极,可以从两个方面:微观,电子流出的一极是负极,电子流入的一极是正极.宏观,活泼的电极作负极,不活泼的电极作正极,电子从负极沿导线流入正极.1年前查看全部
- 化学原电池反应!我读高一学到银锌电池(以KOH为电解质溶液) 有关的反应为:Zn+Ag2O+H2O=Zn(OH)2+2A
化学原电池反应!
我读高一学到银锌电池(以KOH为电解质溶液) 有关的反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag(总反应) 正极反应:Zn-2e+2OH =Zn(OH)2 反之负极Ag2O参与了反应啊啊 不是负极不参与反应么 好像铅蓄电池也这样啊 给跪了QAQ
打错了。0.0 负极为zn 的反应'' 也就是说正极也是可能发生反应的么 谣言光芒1年前5
谣言光芒1年前5 -
 槽三公子 共回答了17个问题
槽三公子 共回答了17个问题 |采纳率88.2%负极一定参与反应被氧化 但是正极不一定参与反应
铅蓄电池
负极:Pb - 2e- + SO42- = PbSO4
正极:PbO2 + 2e- + SO42- + 4H+ = PbSO4 + 2H2O
总反应:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
楼楼请看负极是铅 发生了氧化反应的
楼楼你那个银锌电池(以KOH为电解质溶液)
负极:Zn + 2OH- -2e-=== ZnO + H2O 不是正极啦 是不是记错了1年前查看全部
- 银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为&
银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
A.锌为正极,Ag2O为负极
B.原电池工作时,正极区PH减小
C.锌为负极,Ag2O为正极
D.原电池工作时,负极区PH增大 liubing7710281年前1
liubing7710281年前1 -
 xzqsq 共回答了20个问题
xzqsq 共回答了20个问题 |采纳率100%解题思路:该原电池中,锌失电子发生氧化反应而作负极,银作正极,正极上氧化银得电子发生还原反应,负极上氢氧根离子参加反应,正极上生成氢氧根离子,根据氢氧根离子浓度变化确定电极附近pH变化,据此分析解答.A.根据电极反应式知,锌失电子发生氧化反应而作负极,氧化银作正极,故A错误;
B.原电池放电时,正极附近生成氢氧根离子,导致氢氧根离子浓度增大,则正极区pH增大,故B错误;
C.根据A知,锌作负极,氧化银作正极,故C正确;
D.原电池放电时,负极上氢氧根离子参加反应,导致负极附近氢氧根离子浓度降低,则pH减小,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,根据电极反应式中元素化合价变化来确定正负极,结合正负极附近氢氧根离子浓度变化来确定pH变化,难度不大.1年前查看全部
- 纽扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质。当电池工作时,主要是锌与氧化银反应生成一种单质和一种化合
纽扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质。当电池工作时,主要是锌与氧化银反应生成一种单质和一种化合物从而产生电流,此反应的化学方程式为 ,该反应属于 反应(填基本反应类型)。其中锌元素的化合价由 价转变为 价。
 方秋水1年前1
方秋水1年前1 -
 dt5089 共回答了19个问题
dt5089 共回答了19个问题 |采纳率84.2%Zn+Ag 2 O=2Ag+ZnO 置换 0 +2
从题目提供的信息,锌与氧化银反应可能得到的单质是氧气或银,但如果单质是氧气,锌与银两种元素无法组成化合物,所以单质只能是银。另一种物质是氧化锌。1年前查看全部
- 钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质.当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流
钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质.当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流,此反应的化学方程式______.
 麦田里的苏白1年前1
麦田里的苏白1年前1 -
 可可小老鼠 共回答了17个问题
可可小老鼠 共回答了17个问题 |采纳率94.1%解题思路:根据锌和氧化银发生置换反应,所以生成物中一定有单质和化合物进行分析.根据置换反应的生成物中有单质和化合物,结合质量守恒定律可以判断生成物是氧化锌和银,锌和氧化银发生置换反应生成氧化锌和银,
故答案为:Zn+Ag2O═ZnO+2Ag,点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;置换反应及其应用.
考点点评: 在解此类题时,首先根据置换反应的原理和质量守恒定律判断出生成物,然后根据方程式的书写规则书写方程式.1年前查看全部
- 如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn+Ag
 如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn+Ag2O═ZnO+2Ag根据以上提供的资料,下列说法正确的是( )
如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn+Ag2O═ZnO+2Ag根据以上提供的资料,下列说法正确的是( )
A.溶液中OH-向正极移动
B.放电时正极附近溶液的PH值升高
C.电池负极的电极反应为:Zn-2e-═Zn2+
D.电池工作时,生成1mol Ag就有2mol电子转移 喽喽豆1年前1
喽喽豆1年前1 -
 417271763 共回答了17个问题
417271763 共回答了17个问题 |采纳率94.1%解题思路:根据总方程式可知Zn为原电池的负极,发生反应为Zn+2OH--2e-═ZnO+H2O,Ag2O为原电池的正极,发生反应为Ag2O+H2O+2e-═2Ag+2OH-,原电池中电流从正极流向负极,溶液中阴离子流向负极,阳离子流向正极.A.溶液中OH-向负极移动,故A错误;
B.正极反应为Ag2O+H2O+2e-═2Ag+2OH-,放电时正极附近溶液的PH值升高,故B正确;
C.负极电极反应为Zn+2OH-=ZnO+H2O+2e-,故C错误;
D.正极电极反应为:Ag2O+H2O+2e-=2Ag+2OH-,当电路中每通过1mol电子,则生成1molAg,故D错误.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度不大,注意根据电极反应判断原电池的正负极以及电池反应.1年前查看全部
- 银锌电池的充放电过程:2Ag+Zn(OH)2=Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是?
银锌电池的充放电过程:2Ag+Zn(OH)2=Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是?
那为什么不是Zn(OH)2 小fisher1年前3
小fisher1年前3 -
 白话谎言 共回答了14个问题
白话谎言 共回答了14个问题 |采纳率78.6%因为有氢氧根离子存在,Zn(OH)2无法被氧化.1年前查看全部
- 微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2
微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e−═2Ag+2OH−下列叙述中,错误的是( )
A.在使用过程中,电池负极区溶液的C(OH-)减小
B.电池总反应为Zn+Ag2O═2Ag+ZnO
C.使用过程中,电子由Ag2O极经外电路流向Zn极
D.Zn电极为负极,Ag2O电极发生还原反应 3个X1年前1
3个X1年前1 -
 云初起23 共回答了23个问题
云初起23 共回答了23个问题 |采纳率95.7%解题思路:银锌电池的电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-,则Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,电子由负极流向正极,以此来解答.A.负极发生Zn+2OH--2e-═ZnO+H2O,c(OH-)减小,所以电池负极区溶液的pH减小,故A正确;
B.根据电极反应式可得电池总反应为Zn+Ag2O═ZnO+2Ag,故B正确;
C.该原电池中,锌作负极,氧化银作正极,电子从负极锌沿外电路流向正极氧化银,故C错误;
D.锌失电子作负极,氧化银作正极,正极上得电子发生还原反应,故D正确;
故选:C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池的工作原理,明确电极反应、正负极的判断、电子的流向即可解答,题目难度不大.1年前查看全部
- 常用的钮扣式银锌电池,放电时的电极反应式分别为:
常用的钮扣式银锌电池,放电时的电极反应式分别为:
Zn极:Zn+2OH - +2e - = Zn(OH) 2 Ag 2 O极:Ag 2 O+H 2 O+2e - =2Ag+2OH - 则下列说法中不正确的是()A.放电过程中[OH - ]不变 B.Zn为负极而Ag 2 O为正极 C.电解质溶液呈碱性 D.电子从Ag 2 O流出经用电器流入Zn极  victor-wang1年前1
victor-wang1年前1 -
 驾风使云 共回答了29个问题
驾风使云 共回答了29个问题 |采纳率79.3%D
1年前查看全部
- 纽扣式银锌电池的构造示意图如下图所示,
纽扣式银锌电池的构造示意图如下图所示,
电池的总反应为: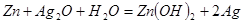
下列说法不正确的是A. 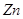 作负极
作负极B.电子经外电路流向 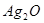 极
极C. 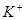 向
向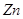 极移动
极移动D.正极反应: 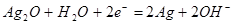
 西瓜霜润喉片1年前1
西瓜霜润喉片1年前1 -
 zhaoyang456 共回答了21个问题
zhaoyang456 共回答了21个问题 |采纳率90.5%C
在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据总反应式可知,锌是还原剂失去电子,氧化银是氧化剂,得到电子,所以锌是负极,氧化银是正极,因此只有选项C是错误的,其余都是正确的,答案选C。1年前查看全部
- 有一种纽扣微型电池,其电极分别是Ag 2 O和Zn。电解池是KOH溶液,所以俗称银锌电池,该电池的电极反应式为Zn+2O
有一种纽扣微型电池,其电极分别是Ag 2 O和Zn。电解池是KOH溶液,所以俗称银锌电池,该电池的电极反应式为Zn+2OH - +2e=Zn(OH) 2 ,Ag 2 O+H 2 O+2e=2Ag+OH - 下列说法,正确的是①锌为负极,Ag 2 O为正极②放电时,正极附近pH值上升③放电时,负极附近溶液pH值降低④溶液中阴离子向正极方向移动,阳离子向负极方向移动
A.① B.①②④ C.①②③ D.①②③④  honlang1131年前1
honlang1131年前1 -
 上电池的半导体 共回答了26个问题
上电池的半导体 共回答了26个问题 |采纳率92.3%C
①②③正确,①Zn作还原剂,作负极②正极产生OH ― , pH 升高③负极消耗OH ― ;④溶液中阴离子向负极方向移动,阳离子向正极方向移动1年前查看全部
- 高三原电池、如图为一种钮扣微型电池,其电极分别为Ag2O和Zn,电解质溶液中KOH溶液,俗称银锌电池,该电池的总反应式为
高三原电池、
如图为一种钮扣微型电池,其电极分别为Ag2O和Zn,电解质溶液中KOH溶液,俗称银锌电池,该电池的总反应式为:Zn+Ag2O===ZnO+2Ag;根据以上提供的资料,判断下列说法正确的是( )
A.负极反应为Zn—2e-===Zn2+
B.放电时正极附近溶液的pH升高
C.放电时负极附近溶液的pH升高
D.溶液中阴离子向正极方向移动,阳离子向负极方向移动
为什么A是错的,ZN不是负极么~

 酽茗1年前1
酽茗1年前1 -
 cengduan 共回答了16个问题
cengduan 共回答了16个问题 |采纳率93.8%写原电池电极方程式应该注意:
1、判断原电池的电极(判断正负极)
2、判断反应物
3、判断生成物(看处于什么环境,譬如酸性环境和碱性环境还有有氧环境)
4、检查方程式前后电荷是否一样
你的题目,显然在碱性环境下的,锌离子在碱性环境下不可能在离子形式存在!所以其电极方程式为:Zn+2OH- —2e- === ZnO+H2O 但为什么是ZnO而不是Zn(OH)2,这是要依据题目本意来的!有些电池中却可能是Zn(OH)2,而如果是酸性介质,则A选项是正确的!
又如:高中阶段中的氢气氧气燃料电池就可能有两种情况,假如以氢氧化钾溶液为电解质,则负极的产物为水,正极的产物为氢氧根离子!假如以硫酸为电解质,则负极的产物为氢离子,而正极为水!1年前查看全部
- 微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag 2 O和Zn,电解质溶液为
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag 2 O和Zn,电解质溶液为
KOH,电极反应为:Zn+2OH - -2e - =ZnO+H 2 O Ag 2 O+H 2 O+2e - =2Ag+2OH - 根据上述反应式,判断下列叙述正确的是[ ]A.在使用过程中,电池负极区溶液的pH减小
B.在使用过程中,电子由Ag 2 O极经外电路流向Zn极
C.Zn是负极,Ag 2 O是正极
D.Zn电极发生还原反应,Ag 2 O电极发生氧化反应 坐南朝北东升西落1年前1
坐南朝北东升西落1年前1 -
 sdf5f544sb2 共回答了17个问题
sdf5f544sb2 共回答了17个问题 |采纳率82.4%AC1年前查看全部
- 银锌电池广泛用作各种电子仪器的电源,它的充电放电过程可表示为:2Ag+Zn(OH) 2 =Ag 2 O+Zn+H 2 O
银锌电池广泛用作各种电子仪器的电源,它的充电放电过程可表示为:2Ag+Zn(OH) 2 =Ag 2 O+Zn+H 2 O
回答下列有关问题:
(1)电池的放电过程是______________(填“①”或“②”)。
(2)该电池属于______________ (填“酸”“碱”或“中”)性电池。
(3)反应①是______________ (填“放热”或“吸热”)反应。
(4)写出充电时的电极反应式:
阳极:___________________________________________________________。
阴极:___________________________________________________________。
(5)充电时,电池的正极应接电源的______________极。
(6)试简述回收该种废电池的意义__________________________________________________。 almondroca1年前1
almondroca1年前1 -
 羽琳翎 共回答了19个问题
羽琳翎 共回答了19个问题 |采纳率84.2%(1)②
(2)碱
(3)吸热
(4) 2Ag+2OH - -2e - =Ag 2 O+H 2 O Zn(OH) 2 +2e - =Zn+2OH -
(5)正
(6)可减少重金属Ag + 对环境的污染,又可将Ag回收利用。
关键是准确判断①②哪个是放电过程和充电过程。原电池反应是自发反应,由性质可知Ag 2 O有强氧化性,Zn有强还原性,所以②是自发反应,即放电反应。1年前查看全部
- 银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
A. Ag
B. Zn(OH)2
C. Ag2O
D. Zn 爱瓶子1年前4
爱瓶子1年前4 -
 凤梨咖啡 共回答了19个问题
凤梨咖啡 共回答了19个问题 |采纳率68.4%解题思路:在原电池中,负极反应是原子失电子发生氧化反应的过程.在银锌二次电池中,根据反应:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H2O,放电时为原电池,活泼金属做负极,失电子发生氧化反应,根据电极反应应为锌.
故选D.点评:
本题考点: 电极反应和电池反应方程式.
考点点评: 本题主要考查学生电极反应的书写,要抓住电极反应的特点和规律,才能解决此种问题.1年前查看全部
- 微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e=ZnO+H2O,Ag2O+H2O+2e=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO 根据上述反应式,判断下列叙述中,正确的是( )
A.在使用过程中,电池负极区溶液pH值增大
B.在使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应 打工祖母1年前1
打工祖母1年前1 -
 夜雨捂桐 共回答了18个问题
夜雨捂桐 共回答了18个问题 |采纳率83.3%解题思路:银锌电池的电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e=ZnO+H2O;Ag2O+H2O+2e=2Ag+2OH-,则Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,电子由负极流向正极,以此来解答.A.负极发生Zn+2OH--2e=ZnO+H2O,c(OH-)减小,所以电池负极区溶液的pH减小,故A错误;
B.Zn为负极,Ag2O为正极,则使用过程中,电子由Zn极经外电路流向Ag20极,故B错误;
C.Zn失去电子,Zn为负极,Ag2O得到电子是正极,故C正确;
D.Zn电极发生氧化反应,Ag2O电极发生还原反应,故D错误;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池的工作原理,明确电极反应、正负极的判断、电子的流向即可解答,题目难度不大.1年前查看全部
- 微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式分别为:
微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式分别为:Zn+2OH--2e-═ZnO+H2O,Ag2O+H2O+2e-═2Ag+2OH-,电池总反应式为Ag2O+Zn═2Ag+ZnO.根据上述反应式,判断下列叙述中正确的是( )
A. 在使用过程中,电池负极区溶液pH增大
B. 在使用过程中,电子由Ag2O极经外电路流向Zn极
C. 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D. 外电路中每通过0.2mol电子,正极的质量理论上减小1.6g jingping7141年前1
jingping7141年前1 -
 汤圆圆圆 共回答了17个问题
汤圆圆圆 共回答了17个问题 |采纳率88.2%解题思路:根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,原电池中电流从正极流向负极,根据电极反应式可得电池总反应为Zn+Ag2O=ZnO+2Ag.A、负极电极反应为Zn+2OH-=ZnO+H2O+2e-,消耗氢氧根离子,溶液的pH减小,故A错误;
B、由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故B错误;
C、由电极反应式可知,Zn的化合价由0价升高到+2价,为原电池的负极,发生氧化反应,Ag2O是正极发生还原反应,故C错误;
D、正极电极反应为:Ag2O+H2O+2e-=2Ag+2OH-,当电路中每通过0.2mol电子,正极的质量理论上减小的是0.1mol氧原子的质量,即0.1mol×(232-216)g/mol=1.6g,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度不大,注意根据电极反应判断原电池的正负极以及电池反应.1年前查看全部
- 二次银锌电池的电极反应式和总反应式是怎样的?
 激活发帖1年前1
激活发帖1年前1 -
 到底该添什么啊 共回答了19个问题
到底该添什么啊 共回答了19个问题 |采纳率78.9%负极Zn+20H- -2e-=ZnO+ H2O 正极Ag2O+H20+2e-=2Ag+20H- 电池总反应式:Zn+Ag2O=ZnO+2Ag1年前查看全部
- 在碱性条件下银锌电池的电极反应式
 百灵评论二辩1年前2
百灵评论二辩1年前2 -
 唯爱X辛 共回答了14个问题
唯爱X辛 共回答了14个问题 |采纳率100%正极:Ag
负极:Zn
电解质:OH-环境下
负极:Zn+2OH--2e=Zn(OH)2
正极:2H2O+2e-=2OH-+H2
总:Zn+2H2O=Zn(OH)2+H2
PS其实 Zn和Al 一样都是两性金属1年前查看全部
- 银锌电池反应是得到氧化锌还是氢氧化锌
 wdx8041年前1
wdx8041年前1 -
 xieab 共回答了18个问题
xieab 共回答了18个问题 |采纳率83.3%氧化锌1年前查看全部
- 钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质.当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流
钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质.当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流,此反应的化学方程式______.
 我是管钱的1年前3
我是管钱的1年前3 -
 bclz112 共回答了19个问题
bclz112 共回答了19个问题 |采纳率89.5%解题思路:根据锌和氧化银发生置换反应,所以生成物中一定有单质和化合物进行分析.根据置换反应的生成物中有单质和化合物,结合质量守恒定律可以判断生成物是氧化锌和银,锌和氧化银发生置换反应生成氧化锌和银,
故答案为:Zn+Ag2O═ZnO+2Ag,点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;置换反应及其应用.
考点点评: 在解此类题时,首先根据置换反应的原理和质量守恒定律判断出生成物,然后根据方程式的书写规则书写方程式.1年前查看全部
- 在银锌电池中,锌怎样失去离子的碱性条件下,锌与谁反应失去啊
 冬日的精灵儿1年前1
冬日的精灵儿1年前1 -
 Haiwon 共回答了15个问题
Haiwon 共回答了15个问题 |采纳率86.7%酸性电解质中
负极:Zn - 2e- ==Zn2+
正极:2H+ + 2e- ==H2
碱性电解质中
负极:Zn + 2OH- -2e-=== ZnO + H2O
正极:Ag2O + H2O + 2e- === 2Ag + 2OH-
电池的总反应式为:Ag2O + Zn ====== 2Ag + ZnO1年前查看全部
- 银锌电池放电时,负极上反应的物质为何是锌不是银?
 istart1年前2
istart1年前2 -
 cuo_xiao 共回答了20个问题
cuo_xiao 共回答了20个问题 |采纳率100%负极发生的是氧化反应,而锌比银活泼、更容易失电子而被氧化,所以由他们组成的原电池是由锌做负极、失电子被氧化.1年前查看全部
- 电子表和计算机的电源是微型银锌电池,其电极材料分别为Ag2O和Zn,电解液为KOH溶液,电极反应
电子表和计算机的电源是微型银锌电池,其电极材料分别为Ag2O和Zn,电解液为KOH溶液,电极反应
为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2 O+2e-=2Ag+2OH-,下列说法中正确的是()
A.Zn为正极,Ag2O为负极
B.电子由锌极经外电路流人Ag2O极
C.Zn为负极,Ag2O为正极
D.工作一段时间后,Zn的质量减少,Ag2O的质量增加
(化学原电池8) tyzhangzhr1年前2
tyzhangzhr1年前2 -
 joe407 共回答了14个问题
joe407 共回答了14个问题 |采纳率100%BC
在这个反应中,Zn失去电子,电路中规定流出电子的一极为负极,因此A错误,C正确.你看看这两个电极方程式就知道B是对的.D中,氧化银的质量也会减少.
我不知道你是哪个省的,有没有多选题1年前查看全部
- (2009•肥西县模拟)银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2[充电/
(2009•肥西县模拟)银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn 解婉婷1年前1
解婉婷1年前1 -
 萨达木 共回答了19个问题
萨达木 共回答了19个问题 |采纳率78.9%解题思路:在原电池中,负极反应是原子失电子发生氧化反应的过程.在银锌二次电池中,根据反应:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H2O,放电时为原电池,活泼金属做负极,失电子发生氧化反应,根据电极反应应为锌.
故选D.点评:
本题考点: 电极反应和电池反应方程式.
考点点评: 本题主要考查学生电极反应的书写,要抓住电极反应的特点和规律,才能解决此种问题.1年前查看全部
- 下列电池中不能充电的:A.镍镉电池 B.银锌电池 C.普通干电池 D.铅蓄电池
下列电池中不能充电的:A.镍镉电池 B.银锌电池 C.普通干电池 D.铅蓄电池
下列电池中不能充电的:
A.镍镉电池 B.银锌电池 C.普通干电池 D.铅蓄电池 misserick1年前1
misserick1年前1 -
 重头来过 共回答了17个问题
重头来过 共回答了17个问题 |采纳率82.4%C 【解析】充电电池之所以能够充电,原因是电池中的化学反应是可逆反应,能够通过外加电源,将电能转化为化学能,使放过电的电池恢复到原来的状态.如果其中的化学反应不可逆,电池就不能充电,普通干电池就是这样.故正确答案为C.1年前查看全部
大家在问
- 1列方程 某数与3的和的2倍等于-2 (2)某数的七倍与他的3倍的和为6
- 2对称中心对称轴专题(3)5.设函数y=sin(ωx+φ)(ω>0,φ∈(-π/2,π/2))的最小正周期为π且图象关于直
- 3三角形的中线角平分线内心外心内接圆外接圆垂心中心各有什么性质和公式概念
- 41,“他做为爱亲人的父亲”这句话对不对?
- 5已知椭圆C:(x^2)/2+y^2=1,O为坐标原点,右焦点记为F,点A和B都在椭圆上.
- 6sign estimation是什么意思?
- 7英语翻译“你一不会做工,二不会做饭,三不会大战.”主要这一.,二.三.首先申明不能用first,scend什么的,要用这
- 8在蒸腾作用试验中加入植物油的目的是什么?
- 9(2014•长宁区一模)化学与生活密切相关,下列说法正确的是( )
- 10【化学、价态问题】Fe一共有哪几个价态?
- 11中文翻译英文:他昨天清晨6点起床,然后洗脸和看早报
- 12林木高茂,略尽冬春意思
- 13函数单调性求参数取值范围~函数f(x)= (ax+1)/(x+2)在区间(-2,+∞)上单调递增,则实数a的取值范围是
- 14除去HCL气体用什么试剂
- 15一个S上面和下面各有一竖,这是那个国家的货币符号?
