在人工固氮的反应中,将氨气液化并及时分离出去不能既加快合成氨反应速率又提高原料转化率吗?
 696112532022-10-04 11:39:541条回答
696112532022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 hahazero 共回答了18个问题
hahazero 共回答了18个问题 |采纳率94.4%- 反应速率和温度有关.提高转化率和反应的平衡系数(压力)有关.不分离出氨,达到平衡后反应就会终止.及时分离出氨,有利于反应的进行,不过,需要考虑方案的经济性.
- 1年前
相关推荐
- 科学家一直致力于“人工固氮”的新方法研究.
科学家一直致力于“人工固氮”的新方法研究.

(1)目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ•mol-1.
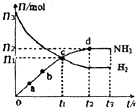
①673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示.下列叙述正确的是______.
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点 e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨.其实验装置如图,阴极的电极反应式______.
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)⇌2NH3(g)+[3/2]O2(g)△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a______0;△S______0(填“>”、“<”或“=”);该反应属于______T/K 303 313 323:] NH3生成量/(10-6mol) 4.8 5.9 6.0
A.一定自发B.一定不自发C.高温自发D.低温自发
②已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(l)=-571.6kJ•mol-1则N2(g)+3H2O(1)=2NH3(g)+[3/2]O2(g)△H=______kJ•mol-1. ztmlh41年前1
ztmlh41年前1 -
 只为你的我的你 共回答了17个问题
只为你的我的你 共回答了17个问题 |采纳率82.4%解题思路:(1)A.浓度越大反应速率越快;
B.a、b、c之后氢气的物质的量继续变化,未达到平衡,反应向正反进行;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动;
(2)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气;
(3)①由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,结合反应方程式中各物质的聚集状态解答;
②利用盖斯定律计算.(1)A.a点反应物的浓度大于b点,浓度越大反应速率越快,故a点反应速率更大,故A正确;
B.点c之后氢气的物质的量继续减小,未达到平衡,反应向正反进行,故B错误;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态,点d和点e处的n (N2)相同,故C正确;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动,氨气的物质的量减小,故D错误;
故选AC;
(2)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3,
故答案为:N2+6H++6e-=2NH3;
(3)①由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,则正反应应为吸热反应,a>0,由方程式可知反应生成气体的物质的量增多,则△S>0,所以该反应在高温下才能自发进行,选C,故答案为:>;>;C;
②已知:①N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则利用盖斯定律,将①×2-②×3可得,常温下氮气与水反应生成氨气与氧气的热化学方程式为2N2(g)+6H2O(l)=4NH3(g)+3O2(g),△H=2×(-92.4kJ•mol-1)-3×(-571.6kJ•mol-1)=+1536kJ•mol-1,所以反应N2(g)+3H2O(1)=2NH3(g)+[3/2]O2(g)中△H=+768kJ•mol-1
故答案为:+768.点评:
本题考点: 物质的量或浓度随时间的变化曲线;热化学方程式;焓变和熵变;化学平衡的影响因素.
考点点评: 本题主要考查了平衡的判断、电极反应、反应进行的方向、热化学方程式的书写等知识点,中等难度.1年前查看全部
- 请问人工固氮得到氨的化学方程式是什么?
 wangjw651年前3
wangjw651年前3 -
 Deanlily7 共回答了17个问题
Deanlily7 共回答了17个问题 |采纳率94.1%N2 + 3 H2 ==高温高压催化剂== 2 NH3
注意用可逆号!百度的框里无法输入可逆号1年前查看全部
- 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.恒温下,往一个4L的密闭容器中充入2molN2和5.2molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①5min内,消耗H2的平均反应速率为______时间/min 5 10 15 20 25 30 c(NH3)/mol•L-1 0.08 0.14 0.18 0.20 0.20 0.20
②N2的平衡转化率______
③计算此条件下该反应的化学平衡常数K=______.
④若维持容器体积不变,只升高温度化学平衡常数值______(填变大、变小、不变),正反应速率______(填变大、变小、不变).
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度______0.4mol•L-1(填大于、小于、等于)
⑥若维持容器体积不变,充入He使之压强增大一倍,正反应速率______(填变大、变小、不变),若维持压强不变,充入He,则平衡移动方向为______(填正移、逆移、不移) 5orange1年前1
5orange1年前1 -
 ytsw_yt 共回答了21个问题
ytsw_yt 共回答了21个问题 |采纳率90.5%解题思路:①5min内氨气的浓度变化量为0.08mol/L,根据v=[△c/△t]计算v(NH3),利用速率之比化学计量数之比计算v(H2);
②由表中数据可知,20min时反应达平衡状态,根据氨气的平衡浓度计算△n(NH3),利用物质的量变化量之比等于化学计量数之比计算△n(N2),再根据转化率定义计算;
③由表中数据可知,20min时反应达平衡状态,根据氨气的平衡浓度利用三段式计算其它组分的平衡浓度,代入平衡常数表达式计算;
④该反应正反应是放热反应,升高温度,正逆反应速率都增大,但逆反应速率增大更多,平衡向逆反应移动,平衡常数减小;
⑤根据②中计算可知,氮气的平衡浓度,温度维持不变,只将容器体积由4L变为2L,假定平衡不移动,N2的浓度为原平衡的2倍,实际压强增大,平衡向正反应方向移动,到达新平衡时N2的浓度小于原平衡的2倍,据此判断;
⑥维持容器体积不变,充入He使之压强增大一倍,反应混合物各组分的浓度不变,反应速率不变.若维持压强不变,充入He,体积增大,等效为降低压强,平衡向体积增大的方向移动.①5min内氨气的浓度变化量为0.08mol/L,故v(NH3)=0.08mol/L5min=0.016mol/(L•min),速率之比化学计量数之比,所以v(H2)=32v(NH3)=32×0.016mol/(L•min)=0.024mol/(L•min),故答案为:0.024mol/(L•m...
点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算,难度中等,是对基础知识的综合运用,注意三段式解题法的利用.1年前查看全部
- (2013•上海二模)科学家一直致力于“人工固氮”的新方法研究.
(2013•上海二模)科学家一直致力于“人工固氮”的新方法研究.

(1)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)⇌4NH3 (g)+3O2(g)+Q
已知该反应的平衡常数K与温度的关系如图1,则此反应的 Q______0 (填“>”“<”或“=”).
(2)常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______ (选填编号).
A.容器中气体的平均分子量不随时间而变化B. v(N2)/v(O2)=2:3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
(3)将反应生成的混合气体通入水中即可得氨水.用水稀释0.1mol•L-1氨水,溶液中随着水量的增加而增大的是______(填字母标号).
A.c(H+)×c(NH3•H2O)/c(OH-) B.c(NH4+)×c(OH-)/c(NH3•H2O)
C.c(H+)•c(OH-) D.C(H+) C(OH−)
(4)常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,请在图2中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图. yly7301年前1
yly7301年前1 -
 www456 共回答了24个问题
www456 共回答了24个问题 |采纳率83.3%解题思路:(1)根据温度对化学平衡的影响分析;
(2)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题.
(3)根据电离平衡常数、溶液中各微粒的浓度分析;
(4)在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,容器的体积扩大,N2的浓度增大,生成物的浓度减小,(1)平衡常数K与温度的关系可知,升高温度,平衡常数K增加,即平衡向正反应方向移动,所以正反应方向是吸热方向,所以a<0,故答案为:<;
(2)A.当反应达到平衡时,混合气体的总的物质的量不变,总质量不变,所以容器中气体的平均分子量不随时间而变化,故A正确;
B.无论反应是否达到平衡状态,v(N2)/v(O2)=2:3,所以当反应达到平衡时,v(N2)/v(O2)=2:3,故B正确;
C.当反应达到平衡时,混合气体的总质量不变,容器的体积不变,容器中气体的密度不随时间而变化,故C正确;
D.通入稀有气体,反应物的浓度不变,反应速率不变,故D错误;
故选:ABC;
(3)A.由NH3.H2O OH-+NH4+可知,Kb=
OH-+NH4+可知,Kb=
C(OH−)C(NH4+)
C(NH3•H2O),KW=C(H+)•C(OH-),所以
c(H+)×c(NH3•H2O)
c(OH−)=
KW
Kb×
C(NH4+)
C(OH−)=
KW
Kb×
n(NH4 +)
n(OH−),而温度不变,电离平衡常数不变,水的离子积不变,溶液中随着水量的增加,由NH3.H2O OH-+NH4+可知,n(OH-)增大,n(NH4+)增大,且两者相等,所以
OH-+NH4+可知,n(OH-)增大,n(NH4+)增大,且两者相等,所以
c(H+)×c(NH3•H2O)
c(OH−)不变,故A错误;
B.该式子是电离平衡常数表达式,温度不变,电离平衡常数不变,故B错误;
C.温度不变,水的离子积不变,故C错误;
D.温度不变,水的离子积不变,当稀释氨水时,溶液中氢氧根的浓度减小,氢离子的浓度增加,所以
c(H+)
C(OH−)增大,故D正确;
故答案为:D;
(4)4)在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,容器的体积扩大,N2的浓度增大,生成物的浓度减小,即V正增大,V逆减小,最终相等,图象为: ,故答案为:
,故答案为: .
.点评:
本题考点: 氮的固定;化学平衡建立的过程;化学平衡常数的含义;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查化学平衡的移动、化学平衡、弱电解质的电离等,明确稀释时电离平衡的移动及离子的物质的量、离子的浓度的变化是解答的关键,并注意离子积与温度的关系来解答.1年前查看全部
- 已知:N 2 (g)+3H 2 (g) 2NH 3 (g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法
已知:N 2 (g)+3H 2 (g)
 2NH 3 (g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH 3 (g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H 2 和1mol N 2 , 反应过程中对NH 3 的浓度进行检测,得到的数据如下表所示:
①5 min内,消耗N 2 的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H 2 、N 2 和NH 3 各2mol,此时该反应的v(N 2 ) 正 _______________v(N 2 ) 逆 (填写“>”、“=”或“<”=)。时间/min 5 10 15 20 25 30 c(NH 3 )/mol·L —1 0.08 0.14 0.18 0.20 0.20 0.20
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N 2 、H 2 、NH 3 的浓度之比为1:3:2
B.v(N 2 ) 正 =3v(H 2 ) 逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H 2 )="1.60mol" ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H 2 气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
请回答:N 2 H 2 NH 3 起始浓度(mol/L) 0.2 0.3 0.2 平衡浓度(mol/L) a b c
①各物质的平衡浓度可能是_______________.
A.c="0.5mol/L" B.b="0.5mol/L" C.c="0.4mol/L" D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N 2 在催化剂(掺有少量Fe 2 O 3 的TiO 2 )表面与水可发生下列反应:2N 2 (g)+6H 2 O(l) 4NH 3 (g)+3O 2 (g),此反应的△S__________0(填“
4NH 3 (g)+3O 2 (g),此反应的△S__________0(填“ ”、 “
”、 “ ”或“=”), △H=_____________。
”或“=”), △H=_____________。
(已知:H 2 的燃烧热为285.8 kJ/mol) 价值vv群1年前1
价值vv群1年前1 -
 gaoxingjiuha 共回答了10个问题
gaoxingjiuha 共回答了10个问题 |采纳率90%(1)①0.008mol.L -1 .min -1 ; 0.1; > (每空1分) ②C E (2分) ③CD (2分)
(2)①B(1分) ② 0.1<a<0.3 (2分) ③( I )3a="b+0.3 " (2分)(Ⅱ)c 2 /(a×b 3 )="0.1" (2分)
(3)> (1分) +1530 kJ/mol (2分)
略1年前查看全部
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:n2(g)+3h2(g)⇌3nh3(g),△h=-92.2kj/mol.合成氨工业中原料气n2可从空气中分离得到,h2可用甲烷在高温下与水蒸气反应制得.***合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50mpa.回答下列问题:
(1)合成氨工业中原料气压缩到30~50mpa的原因是______.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______.
(2)500℃、50mpa时,在容积为vl的容器中加入n mol n2、3n mol h2,反应达平衡后测得平衡常数为k1,此时n2的转化率为x.则k和x的关系满足k=4xv2 27n2(1−x)4 .若温度为400℃,平衡常数为k2,则k1______k2(填“<”、“=”或“>”)4xv2 27n2(1−x)4
(3)甲烷在高温下与水蒸气反应反应方程式为:ch4(g)+h2o(g)=co(g)+3h2(g).部分物质的燃烧热数据如下表:
已知1mol h2o(g)转变为1mol h2o(l)时放出44.0kj热量.物质 燃烧热(kj•mol-1) h2(g) -285.8 co(g) -283.0 ch4(g) -890.3
①写出co燃烧的热化学方程式co(g)+[1/2]o2(g)=co2(g)△h=-283.0kj•mol-1co(g)+[1/2]o2(g)=co2(g)△h=-283.0kj•mol-1.
②2h2(g)+o2(g)═2h2o(g)△h=______kj/mol. lijun1167161年前1
lijun1167161年前1 -
 jackjill2002 共回答了15个问题
jackjill2002 共回答了15个问题 |采纳率86.7%解题思路:(1)根据压强对化学平衡移动的影响以及温度、催化剂对反应速率的影响知识来回答;
(2)根据“三行式”来进行计算得出结论,对于放热反应,温度升高则平衡常数减小,反之增大;
(3)①根据物质燃烧热的概念来书写热化学方程式;
②根据盖斯定律来计算反应的焓变.(1)合成氨工业中原料气压缩到30~50MPa,加压有利于平衡正向移动,提高原料气的转化率,实际生产中采用400~500℃的高温,可以增加反应速率,缩短达到平衡的时间,
故答案为:加压有利于平衡正向移动,提高原料气的转化率;增加反应速率,缩短达到平衡的时间;
(2)根据题意:N2(g)+3H2(g)⇌2NH3(g),
初始物质的量:n 3n 0
变化物质的量:nx3nx2nx
平衡物质的量:n-nx 3n-3nx 2nx
则平衡常数为K1=
[NH3]2
[N2][H2]3=
(
2nx
V)2
(
n−nx
V)×(
3n−3nx
V)3=
4xV2
27n2(1−x)4,
该反应是热反应,温度升高则平衡常数减小,所以K1<K2,
故答案为:
4xV2
27n2(1−x)4;<;
(3)①1mol一氧化碳完全燃烧生成二氧化碳放出的热量是283KJ,即CO(g)+1/2O2(g)=CO2(g)△H=-283.0 kJ•mol-1,
故答案为:CO(g)+1/2O2(g)=CO2(g)△H=-283.0 kJ•mol-1;
②由表中数据可知:①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
②2H2O(l)=2H2O(g)△H=88.0kJ•mol-1,
利用盖斯定律,将①+②可得:2H2(g)+O2(g)═2H2O(g),△H=-571.6kJ•mol-1+88kJ•mol-1=-483.6kJ•mol-1,
故答案为:-483.6.点评:
本题考点: 合成氨条件的选择;热化学方程式;化学平衡常数的含义.
考点点评: 本题是一道综合性的考题,涉及化学反应速率、化学平衡的移动以及热化学部分的知识,难度较大,综合性强.1年前查看全部
- (2013•云南二模)人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化
(2013•云南二模)人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:
N2(g)+3H2O(l)⇌2NH3(g)+[3/2]O2(g)△H=+765.0kJ/mol.
目前工业合成氨的原理是:N2(g)+3H2(g)⇌2NH3(g)△H=-93.0kJ/mol.
回答下列问题:
(1)表示氢气燃烧热的热化学方程式为H2(g)+[1/2]O2(g)=H2O(l)△H=-286.0 kJ/molH2(g)+[1/2]O2(g)=H2O(l)△H=-286.0 kJ/mol.
(2)在恒温恒容密闭容器中进行N2和H2合成氨反应,下列能表示达到平衡状态的是______.
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个NN键的同时形成6a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如图所示.请回答下列问题:
①前25min内,用H2的浓度变化表示的化学反应平均速率是______.
②在25min末反应刚好达到平衡,则该温度下反应的平衡常数K=______(计算结果可用分数表示).若升高温度,该反应的平衡常数值将______(填“增大”、“减小”或“不变”).
(4)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=______.
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时n(NH3)=______mol. lhai0011年前1
lhai0011年前1 -
 gxming 共回答了12个问题
gxming 共回答了12个问题 |采纳率83.3%解题思路:(1)已知①2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
②N2(g)+3H2(g)⇌2NH3(g)△H=-93.0kJ/mol,利用盖斯定律将[②×2−①/6]可得氢气燃烧的热化学方程式;
(2)达到平衡时,正逆反应速率相等,各物质的浓度不变,以此衍生的一些物理量也不变,以此判断是否达到平衡状态;
(3)①根据图象中的浓度变化及时间计算出用H2的浓度变化表示的化学反应平均速率;
②根据平衡常数表达式计算出该反应的平衡常数;升高温度,平衡逆向移动,该反应的平衡常数值将减小;
(4)①设平衡时有x molN2转化,计算出转化的氮气的物质的量,再计算出氮气的转化率;
②α1 +α2 =1,说明这两个反应达到平衡时的状态完全相同,即加入的氨气为2mol.(1)已知①2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
②N2(g)+3H2(g)⇌2NH3(g)△H=-93.0kJ/mol,利用盖斯定律将[②×2−①/6]可得H2(g)+[1/2]O2(g)=H2O(l)△H=-286.0 kJ/mol,
故答案为:H2(g)+[1/2]O2(g)=H2O(l)△H=-286.0 kJ/mol;
(2)a.混合气体的压强不再发生变化,在恒温恒容密闭容器中,因为合成氨是气体分子数目减小的反应,混合气体的压强不再发生变化,说明达到平衡状态,故a正确;
b.混合气体的密度一直不发生变化,故b错误;
c.反应容器中N2、NH3的物质的量的比值不再发生变化,说能达到平衡,故c正确;
d.无论是否达到平衡状态,都存在单位时间内断开3a个H-H键的同时形成6a个N-H键,不能说明达到平衡状态,故d错误;
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比,三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比可能只是某一时刻的比值,不能证明是否达到平衡,故e错误;.
故答案为:ac;
(3)①根据图象可知曲线A代表氢气,v(H2)=[6.0−3.0/25]mol•L-1•min-1=0.12mol•L-1•min-1,故答案为:0.12 mol•L-1•min-1;
③在25 min 末反应刚好达到平衡,K=
c(NH3)2
c(N2)•c(H2)3=[4
1×32=
4/27];该反应是放热反应,若升高温度,平衡逆向移动,该反应的平衡常数值将减小,
故答案为:[4/27](或0.148、0.15);减小;
(4)①设平衡时有x molN2转化,
N2(g)+3H2(g)⇌2NH3(g)
起始物质的量:1mol 3mol 0
变化的物质的量:x 3x 2x
平衡物质的量:1-x 3-3x 2x
列式可得:4-2x=2.8,
解得x=0.6mol,α1 =[0.6mol/1mol]×100%=60%,
故答案为:60%;
②由α1 +α2 =1,说明这两个反应达到平衡时的状态完全相同,即加入的氨气为2mol,故答案为:2.点评:
本题考点: 物质的量或浓度随时间的变化曲线;反应热和焓变;化学平衡的影响因素.
考点点评: 本题考查较综合,涉及知识点较多,注意通过图象分析化学反应速率、化学平衡及计算问题,需要学生较强的观察能力及思维能力,难度较大.1年前查看全部
- 下列应用涉及氧化还原反应的是 A.粗盐提纯 B.人工固氮 C.工业制氧 D.玻璃刻字
 风雪凝霜1年前1
风雪凝霜1年前1 -
 1Z34S 共回答了16个问题
1Z34S 共回答了16个问题 |采纳率100%B
1年前查看全部
- 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436kJ•mol -1 ,N≡N键能为946kJ•mol -1 ,N-H键能为391kJ•mol -1 .写出合成氨反应的热化学方程式:______
(2)恒温下,往一个4L的密闭容器中充人5.2molH 2 和2molN 2 ,反应过程中对NH 3 的浓度进行检测,得到的数据如下表所示:
①5min内,消耗H 2 的平均反应速率为______时间/min 5 10 15 20 25 30 c(NH 3 )/mol•L -1 0.08 0.14 0.18 0.20 0.20 0.20
②N 2 的平衡转化率______
③此条件下该反应的化学平衡常数K=______.反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H 2 、N 2 和NH 3 各8mol,化学平衡将向______方向移动(填“正反应”或“逆反应”);化学平衡常数值______(填变大、变小、不变);
④若温度维持不变,只将容器体积由4L变为2L,达新平衡时N 2 的平衡浓度______0.4mol•L -1 (填大于、小于与等于) 会飞了1年前1
会飞了1年前1 -
 萧萧潇笑 共回答了25个问题
萧萧潇笑 共回答了25个问题 |采纳率68%(1)反应N 2 (g)+3H 2 (g)⇌2NH 3 (g)的反应热△H=946kJ•mol -1 +3×436kJ•mol -1 -2×3×391kJ•mol -1 =-92kJ•mol -1 ,故热化学方程式为:N 2 (g)+3H 2 (g)⇌2NH 3 (g)△H=-92kJ•mol -1 ,
故答案为:N 2 (g)+3H 2 (g)⇌2NH 3 (g)△H=-92kJ•mol -1 ;
(2)①由表中水解可知,5min内,氨气的浓度变化为0.08mol/L,故v(NH 3 )=
0.08mol/L
5min =0.016mol/(L•min),速率之比等于化学计量数之比,故v(H 2 )=
3
2 v(NH 3 )=
3
2 ×0.016mol/(L•min)=0.024mol/(L•min),故答案为:0.024mol/(L•min);
②由表中数据可知,20min达平衡,平衡时NH 3 的浓度为0.20mol/L,生成的氨气的物质的量为0.20mol/L×4L=0.8mol,由方程式N 2 (g)+3H 2 (g)⇌2NH 3 (g)可知,参加反应的氮气的物质的量为
1
2 ×0.8mol=0.4mol,所以氮气的转化率为:
0.4mol
2mol ×100%=20%,故答案为:20%;
③由表中数据可知,20min达平衡,平衡时NH 3 的浓度为0.20mol/L,则:
N 2 (g)+3H 2 (g)⇌2NH 3 (g)
开始(mol/L):0.5 1.3 0
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.4 1 0.2
故平衡常数k=
c 2 (N H 3 )
c( N 2 )• c 3 ( H 2 ) =
0. 2 2
0.4× 1 3 =1,
反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H 2 、N 2 和NH 3 各8mol,则此时各物质的浓度为:
H 2 为1mol/L+
8mol
4L =3mol/L,N 2 为0.4mol/L+
8mol
4L =2.4mol/L,NH 3 为0.2mol/L+
8mol
4L =2.2mol/L,故浓度商Qc=
2. 2 2
2.4× 3 3 <1,故反应向正反应进行,
平衡常数只受温度影响,温度不变平衡常数不变,
故答案为:1;正反应;不变;
④只将容器体积由4L变为2L,若平衡不移动氮气的浓度为原来2倍为0.8mol/L,但体积减小压强增大,平衡向正反应移动,故氮气的平衡浓度小于原平衡浓度的2倍,大于原平衡的浓度,即0.4mol/L<c(N 2 )<0.8mol/L,故答案为:大于.1年前查看全部
- 一种“人工固氮”的新方法是在光照条件下,N 2 在催化剂表面与水蒸气发生反应生成NH 3 和氧气. 已知:
一种“人工固氮”的新方法是在光照条件下,N 2 在催化剂表面与水蒸气发生反应生成NH 3 和氧气. 已知:
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:______;化学键 N≡N H-O N-H O=O 键能/kJ•mol -1 945 463 391 498
(2)进一步研究NH 3 生成量与温度的关系,部分实验数据见下表(反应时间3h):
①50℃时从开始到3h内以O 2 物质的量浓度变化表示的平均反应速率为______;T/℃ 30 40 50 生成NH 3 量/(10 -6 mo1/L) 4.8 5.9 6.0
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH 3 生成量的建议(请写出两条)______、______;
(3)氨是氮肥工业的重要原料.某化肥厂生产铵态氮肥(NH 4 ) 2 SO 4 的工业流程如下:
①往沉淀池中装入CaSO 4 悬浊液后,需先通入足量NH 3 ,再通入CO 2 的原因是______.
②煅烧炉中产生的固态副产品为______,生产流程中能被循环利用的物质X为______. 遗世的小龙女1年前1
遗世的小龙女1年前1 -
 lanrentaishan 共回答了16个问题
lanrentaishan 共回答了16个问题 |采纳率87.5%根据题目信息,N 2 在催化剂表面与水蒸气发生反应生成NH 3 和氧气,写热化学方程式的物质变化部分为:N 2 +3H 2 O
2NH 3 +
3
2 O 2 ,旧键断裂吸收的能量为:945kJ+6×463kJ=3723kJ,新键生成释放的能量为:6×391KJ+
3
2 ×498KJ=3093KJ所以△H=3723kJ•mol -1 -3093kJ•mol -1 =+630kJ•mol -1 ,故答案为:N 2 (g)+3H 2 O(g)
2NH 3 (g)+
3
2 O 2 (g);△H=+630kJ•mol -1 ;
(2)①50℃时从开始到3h内,根据化学反应速率公式v(NH 3 )=
△c
△t =
6.0× 10 -6 mol/l
3h =2.0×10 -6 (mol/(l•h)),氨气的反应速率和氧气的反应速率之比等于系数之比,即为4:3,故v(O 2 )=1.5×l0 -6 mol/(L•h)(或2.5×l0 -8 mol/(L•min),故答案为:1.5×l0 -6 mol/(L•h)(或2.5×l0 -8 mol/(L•min);
②加快化学反应速率的外界因素有升高温度、加大浓度、加大压强、使用催化剂等,对于该反应可以升高温度、增大压强,及时补充反应物等,故答案为:升高温度;增大压强;
(3)①先通入足量NH 3 ,再通入CO 2 的原因是:氨在水中溶解度大,使溶液呈碱性,有利于吸收CO 2 ,增大c(CO 3 2- ),促使CaSO 4 转化为CaCO 3 ,同时生成(NH 4 ) 2 SO 4 ,故答案为:氨在水中溶解度大,使溶液呈碱性,有利于吸收CO 2 ,增大c(CO 3 2- ),促使CaSO 4 转化为CaCO 3 ,同时生成(NH 4 ) 2 SO 4 ;
②碳酸钙高温分解生成氧化钙和二氧化碳,固态副产品为CaO(或生石灰),CO 2 (或二氧化碳)能被循环利用,故答案为:CaO(或生石灰);CO 2 (或二氧化碳).1年前查看全部
- (1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
 (1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨.其实验装置如图.阴极的电极反应式______;
(2)N2H4是一种高效清洁的火箭燃料.NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为______;
(3)8g N2H4(g)燃烧生成氮气和水蒸汽时,放出133.5kJ热量,写出该反应的热化学方程式______. cheglixin1年前1
cheglixin1年前1 -
 红霞飞来 共回答了18个问题
红霞飞来 共回答了18个问题 |采纳率88.9%解题思路:(1)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气;
(2)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
(3)根据热化学方程式的书写原则和注意问题写出;注意物质的聚集状态标注,焓变的正负号和单位.(1)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,故答案为:N2+6H++6e-=2NH3;
(2)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)8g N2H4(g)为0.25mol,已知0.25mol液态肼和足量双氧水反应生成氮气和水蒸气时放出133.5KJ的热量;肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-534KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-534KJ/mol.点评:
本题考点: 电解原理;热化学方程式.
考点点评: 本题考查了电极反应式书写、化学方程式书写、热化学方程式书写,题目难度中等.1年前查看全部
- (2013•惠州三模)科学家在最新“人工固氮”的研究报道认为在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
(2013•惠州三模)科学家在最新“人工固氮”的研究报道认为在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2(g)+6H2O(l)═4NH3 (g)+3O2(g)△H
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
(1)该反应的平衡常数表达式K=温度 T/K 303 313 323 NH3生成量/(10-6mol) 4.8 5.9 6.0 [NH3]4•[O2]3 [N2]2 ,△H______0(填“<”“>”“=”);[NH3]4•[O2]3 [N2]2
(2)若该反应在恒容下达到平衡,判断该反应达到平衡的依据为______(填字母):
A.压强不随时间改变 B.气体的密度不随时间改变
C.c(H2O)不随时间改变 D.单位时间里生成NH3和O2的物质的量之比4:3. 若藤非藤1年前1
若藤非藤1年前1 -
 gujiangfeng 共回答了14个问题
gujiangfeng 共回答了14个问题 |采纳率78.6%解题思路:(1)化学平衡常数表达式为:K=[生成物浓度幂次方/反应物浓度幂次方];图表分析温度升高氨气的平衡浓度增大,说明正反应是吸热反应;
(2)平衡状态的判断依据主要有正逆反应速率相等和各组分的浓度保持不变.(1)化学平衡常数表达式为:K=[生成物浓度幂次方/反应物浓度幂次方]=
[NH3]4•[O2]3
[N2]2;图表分析温度升高氨气的平衡浓度增大,说明正反应是吸热反应,
故答案为:
[NH3]4•[O2]3
[N2]2;△H>0;
(2)A、反应前后气体体积有变化,压强不变说明正逆反应速率相等,故A正确;
B、因为水是液态,密度不变说明水的量不再发生变化,反应达到平衡状态,故B正确;
C、水是液态,其浓度是常数,不随时间改变,所以c(H2O)不随时间改变不能说明反应达到平衡状态,故C错误;
D、生成NH3和O2的物质的量之比4:3,不能说明反应达到平衡状态,故D错误;
故选:AB.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查了平衡常数表达式、吸热反应的判断、外界条件对化学平衡移动的影响,题目难度中等.1年前查看全部
- 下列应用不涉及氧化还原反应的是 A.工业上利用N 2 和H 2 合成氨,实现人工固氮 B.实验室用NH 4 Cl和Ca(
下列应用不涉及氧化还原反应的是
A.工业上利用N 2 和H 2 合成氨,实现人工固氮 B.实验室用NH 4 Cl和Ca(OH) 2 制备NH 3 C.用FeCl 3 溶液作为“腐蚀液”刻蚀电路铜板 D.用Na 2 O 2 作潜水艇的供氧剂  期待海市蜃楼1年前1
期待海市蜃楼1年前1 -
 annezhuo 共回答了28个问题
annezhuo 共回答了28个问题 |采纳率92.9%B
1年前查看全部
- (2011•宁波模拟)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气.
(2011•宁波模拟)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气. 已知:
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:N2(g)+3H2O(g)化学键 N≡N H-O N-H O=O 键能/kJ•mol-1 945 463 391 498  2NH3(g)+
2NH3(g)+
O2(g);△H=+630kJ•mol-1N2(g)+3H2O(g)3 2  2NH3(g)+
2NH3(g)+
O2(g);△H=+630kJ•mol-1;3 2
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3h):
①50℃时从开始到3h内以O2物质的量浓度变化表示的平均反应速率为1.5×l0-6mol/(L•h)(或2.5×l0-8mol/(L•min)1.5×l0-6mol/(L•h)(或2.5×l0-8mol/(L•min);T/℃ 30 40 50 生成NH3量/(10-6mol/L) 4.8 5.9 6.0
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议(请写出两条)升高温度升高温度、增大压强增大压强;
(3)氨是氮肥工业的重要原料.某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:
①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4.
②煅烧炉中产生的固态副产品为CaO(或生石灰)CaO(或生石灰),生产流程中能被循环利用的物质X为CO2(或二氧化碳)CO2(或二氧化碳). 一样的阳光1年前1
一样的阳光1年前1 -
 天香百合宝贝 共回答了21个问题
天香百合宝贝 共回答了21个问题 |采纳率85.7%解题思路:(1)旧键的断裂吸收的能量和新键的生成释放的能量的差值即为反应的焓变值;
(2)①根据化学反应速率公式v=[△c/△t]进行计算即可;②影响化学反应速率的外界因素有温度、浓度、压强、催化剂等;
(3)①氨水显碱性,二氧化碳是酸性气体,保证原料气的充分利用,要考虑通气体的先后顺序;
②碳酸钙高温分解生成氧化钙和二氧化碳.根据题目信息,N2在催化剂表面与水蒸气发生反应生成NH3和氧气,写热化学方程式的物质变化部分为:N2+3H2O
 2NH3+
2NH3+
3
2O2,旧键断裂吸收的能量为:945kJ+6×463kJ=3723kJ,新键生成释放的能量为:6×391KJ+
3
2×498KJ=3093KJ所以△H=3723kJ•mol-1-3093kJ•mol-1=+630kJ•mol-1,故答案为:N2(g)+3H2O(g) 2NH3(g)+
2NH3(g)+
3
2O2(g);△H=+630kJ•mol-1;
(2)①50℃时从开始到3h内,根据化学反应速率公式v(NH3)=
△c
△t=
6.0×10-6mol/l
3h=2.0×10-6(mol/(l•h)),氨气的反应速率和氧气的反应速率之比等于系数之比,即为4:3,故v(O2)=1.5×l0-6 mol/(L•h)(或2.5×l0-8 mol/(L•min),故答案为:1.5×l0-6 mol/(L•h)(或2.5×l0-8 mol/(L•min);
②加快化学反应速率的外界因素有升高温度、加大浓度、加大压强、使用催化剂等,对于该反应可以升高温度、增大压强,及时补充反应物等,故答案为:升高温度;增大压强;
(3)①先通入足量NH3,再通入CO2的原因是:氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4,故答案为:氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4;
②碳酸钙高温分解生成氧化钙和二氧化碳,固态副产品为CaO(或生石灰),CO2(或二氧化碳)能被循环利用,故答案为:CaO(或生石灰);CO2(或二氧化碳).点评:
本题考点: 氮的固定;反应速率的定量表示方法;化学反应速率的影响因素.
考点点评: 本题是一道元素基化合物性质的综合题,难度较大,要求学生具备分析和解决问题的能力.1年前查看全部
- 工业上利用合成氨实现人工固氮.属于合成主要原料的是
工业上利用合成氨实现人工固氮.属于合成主要原料的是

人工固氮是什么? 蚕豆眼0071年前1
蚕豆眼0071年前1 -
 xieqiong 共回答了14个问题
xieqiong 共回答了14个问题 |采纳率100%我是干煤化工的,工业上都是选择最廉价的材料,空气中主要成分是N 所以肯定是从空气中净化得到N气的,其他选项都是经过化学反应得到的,相应的价格要贵.工业上多一道程序就要相应的多付出成本1年前查看全部
- (2010•聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
 (2010•聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
(2010•聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
(l)目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为______;t1时刻改变的反应条件是______.
②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是______(填序号).
a.
b.c(NH4+)•c(OH−) c(NH3•H2O)
c.c(H+).c(OH-)d.c(NH3•H2O) c(OH−) c(OH−) c(H+)
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式______.
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)⇌4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
①此合成反应的a______0,△S______0,(填“>”“<”或“=”).T/K 303 313 323 NH3生成量/(10-6mol) 4.8 5.9 6.0
②已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=______. kuailepeople1年前1
kuailepeople1年前1 -
 issacxeon 共回答了19个问题
issacxeon 共回答了19个问题 |采纳率78.9%解题思路:(1)①根据平衡移动的方向判断氢化物的体积分数的高低;t1时刻正逆反应速率都增大,且平衡向逆反应方向移动;
②加水稀释,促进一水合氨的电离,平衡向正方向移动;
(2)电解池的阴极发生得电子的还原反应;
(3)①根据物质的聚集状态判断△S;由表中数据判断升高温度平衡移动的方向,以此判断反应热;
②依据盖斯定律进行分析计算,通过合并热化学方程式得到焓变.(l)①t1时刻之后,改变外界条件逆反应速率大于正反应速率,平衡向逆反应方向移动,则氢化物的体积分数减小,则t0~t1氢化物的体积分数最高,t1时刻正逆反应速率都增大,且平衡向逆反应方向移动,应为升温,如增大压强,平衡向正反应分析移动,
故答案为:t0~t1; 升温;
②氨水中存在NH3•H2O⇌NH4++OH-,加水稀释,促进一水合氨的电离,平衡向正方向移动,则n(NH4+)、n(OH-)增大,c(OH-)减小,c(H+)增大,但弱电解质的电离平衡常数不变,水的离子积常数不变,故答案为:bd;
(2)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3;
(3)根据物质的聚集状态判断△S增大;由表中数据判断升高温度平衡向正方向移动,则△H>0,故答案为:①>;>;
②已知①N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol;氢气的燃烧热285.8kJ/mol,反应的热化学方程式为②H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol
以上两热化学方程式消去氢气合并,①×2+②×6得到热化学方程式为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)△H=+1530kJ/mol,
故答案为:+l530kJ/mol.点评:
本题考点: 化学反应速率与化学平衡图象的综合应用;用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了化学平衡的计算,速率、平衡常数的计算,平衡状态的判断依据和方法,影响平衡的因素分析,盖斯定律的应用,考查角度广,题目综合性强,较难.1年前查看全部
- 下列应用不涉及氧化还原反应的是( ) A.工业上利用N 2 和H 2 合成氨,实现人工固氮 B.实验室用NH 4 Cl
下列应用不涉及氧化还原反应的是( ) A.工业上利用N 2 和H 2 合成氨,实现人工固氮 B.实验室用NH 4 Cl和Ca(0H) 2 制备NH 3 C.用FeCl 3 溶液作为“腐蚀液”刻蚀电路铜板 D.用Na 2 O 2 作潜水艇的供氧剂  开心小顺子1年前1
开心小顺子1年前1 -
 xiaochong0 共回答了11个问题
xiaochong0 共回答了11个问题 |采纳率90.9%A.反应生成氨气时,N、H元素的化合价变化,发生氧化还原反应,故A不选;
B.用NH 4 Cl和Ca(0H) 2 制备NH 3 ,没有元素的化合价变化,不发生氧化还原反应,故B选;
C.反应生成氯化铜和氯化亚铁,Fe、Cu元素的化合价变化,发生氧化还原反应,故C不选;
D.用Na 2 O 2 作潜水艇的供氧剂,反应生成氧气,O元素的化合价变化,发生氧化还原反应,故D不选;
故选B.1年前查看全部
- (12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N 2 (
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:n 2 (g)+3h 2 (g)
 3nh 3 (g) △ h =-92.2kj/mol。合成氨工业中原料气n 2 可从空气中分离得到,h 2 可用碳在高温下与水蒸气反应制得。***合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50mpa。回答下列问题:
3nh 3 (g) △ h =-92.2kj/mol。合成氨工业中原料气n 2 可从空气中分离得到,h 2 可用碳在高温下与水蒸气反应制得。***合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50mpa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:
c(s) + h 2 o(g) h 2 (g) + co(g)△h =" +131.3" kj ,△s =" +133.7" j/k
h 2 (g) + co(g)△h =" +131.3" kj ,△s =" +133.7" j/k
该反应在低温下能否自发 (填:能或否)。
(2)合成氨工业中原料气压缩到30~50mpa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(3)已知在400℃时,n 2 (g)+ 3h 2 (g) 2nh 3 (g) 的k=0.5。
2nh 3 (g) 的k=0.5。
①在400℃时, 2nh 3 (g) n 2 (g)+ 3h 2 (g)的k= (填数值)。
n 2 (g)+ 3h 2 (g)的k= (填数值)。
②400℃时,在0.5l的反应容器中进行合成氨反应,一段时间后,测得n 2 、h 2 、nh 3 的物质的量分别为2mol、1mol、2mol,则此时反应v(n 2 ) 正 v(n 2 ) 逆 (填:>、<、=、不能确定)。
③500℃、50mpa时,在容积为2l的容器中加入1 mol n 2 、3 mol h 2 ,反应达平衡后测得平衡常数为 k ,此时n 2 的转化率为 x 。则 k 和 x 的关系满足 k = 。
④在三个相同容器中各充入1 moln 2 和3molh 2 ,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号)。
a.图Ⅰ可能是不同压强对反应的影响,且p 2 >p 1 b.图Ⅱ可能是不同压强对反应的影响,且p 1 >p 2 c.图Ⅲ可能是不同温度对反应的影响,且t 1 >t 2 d.图Ⅱ可能是同温同压下,催化剂性能:1>2  1010400911年前1
1010400911年前1 -
 pignotfat 共回答了17个问题
pignotfat 共回答了17个问题 |采纳率94.1%1年前查看全部
- 科学家一直致力于“人工固氮”的新方法研究。
科学家一直致力于“人工固氮”的新方法研究。
(1)目前合成氨技术原理为:N 2 (g)+3H 2 (g) 2NH 3 (g) △H=-92.4kJ/mol。
2NH 3 (g) △H=-92.4kJ/mol。
①673K,30MPa下,上述合成氨反应中n(NH 3 )和n(H 2 )随时间变化的关系如图所示。下列叙述正确的是
_________。
②在容积为2. 0L恒容的密闭容器中充入0.80mol N 2 (g)和1.60mol H 2 (g),反应在673K、30MPa下达到平衡时,NH 3 的体积分数为20%。该条件下反应N 2 (g)+3H 2 (g)  2NH 3 (g)的平衡常数K=____________。
2NH 3 (g)的平衡常数K=____________。
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H + ),实现了高温常压下高转化率的电解合成氨。其实验装置如图阴极的电极反应式___________________。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N 2 在催化剂(掺有少量Fe 2 O 3 的TiO 2 )表面与水发生下列反应:N 2 (g)+3H 2 O(l)  2NH 3 (g)+3/2O 2 (g) △H=akJ/mol进一步研究NH 3 生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
2NH 3 (g)+3/2O 2 (g) △H=akJ/mol进一步研究NH 3 生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表: 
①此合成反应的a______0;△S_____0,(填“>”、“<”或“=”)
②已知:N 2 (g)+3H 2 (g) 2NH 3 (g) △H=-92.4kJ/mol 2H 2 (g)+O 2 (g)=2H 2 O(l) △H=-571. 6kJ/mol
2NH 3 (g) △H=-92.4kJ/mol 2H 2 (g)+O 2 (g)=2H 2 O(l) △H=-571. 6kJ/mol
则N 2 (g)+3H 2 O(l)=2NH 3 (g)+3/2O 2 (g) △H=__________kJ/mol nanayi1年前1
nanayi1年前1 -
 envyyou 共回答了20个问题
envyyou 共回答了20个问题 |采纳率85%(1)①AC;②16/15(或1. 07或1. 1)
(2)N 2 +6H + +6e - =2NH 3
(3)①>;>;②+765kJ/mol1年前查看全部
- (2011•门头沟区模拟)科学家一直致力于“人工固氮”的方法研究.
(2011•门头沟区模拟)科学家一直致力于“人工固氮”的方法研究.
(1)目前合成氨的技术原理为:(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ/molN2
该反应的能量变化如图1所示.
①在反应体系中加入催化剂,反应速率增大,E2的变化是:______.(填“增大”、“减小”或“不变”).
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1mol,H2为0.3mol,NH3为0.1mol.该条件下H2的转化率为______.
③欲提高②容器中H2的转化率,下列措施可行的是______.
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨.其实验装置如图2所示.阴极的电极反应式为______.
(3)根据最新“人工固氮”的研究报道,在常温、常 压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)4NH3(g)+3O2(g);△H=a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
①此合成反应的a______0.(填“大于”、“小于”或“等于”)T/K 303 313 323 NH3生成量/(10-6mol) 4.8 5.9 6.0
N2(g)+3H2(g)2NH3(g);△H=-92.4kJ/mol
②已知
O2(g)+2H2(g)2H2O(l);△H=-571.6kJ/mol则2N2(g)+6H2O(l)4NH3(g)+3O2(g);△H=______kJ/mol
(4)NH4Cl溶液呈酸性,这是由于N
水解的缘故.则NH4Cl在重水(D2O)中水解的离子方程式是______.H +4
 qinglian21年前1
qinglian21年前1 -
 yzhp1984 共回答了21个问题
yzhp1984 共回答了21个问题 |采纳率95.2%解题思路:(1)①催化剂可以降低反应的活化能,增大反应速率;
②根据化学方程式进行计算;
③根据化学平衡移动原理的有关知识来回答;
(2)电解池的阴极发生得电子的还原反应;
(3)①根据温度对化学平衡移动方向的影响来判断反应的吸放热情况;
②根据盖斯定律计算焓变;
(4)根据水解的实质来书写水解方程式.(1)①催化剂可以降低反应的活化能,增大反应速率,而E1即为活化能,E2=E1+△H,所以E2会减小,
故答案为:减小;
②根据化学方程式:N2(g)+3H2(g)⇌2NH3(g)
初始浓度;0.6 0.450
变化浓度:0.50.15 0.1
平衡浓度:0.1 0.3 0.1
[0.15/0.45]×100%≈33.3%,故答案为:33.3%;
③根据化学平衡:N2(g)+3H2(g)⇌2NH3(g),
A.向容器中按原比例再充入原料气,则压强增大,平衡向右移动,氢气的转化率增大,故A正确;
B.向容器中再充入惰性气体,则各组分浓度不变,平衡不移动,氢气的转化率不变,故B错误;
C.改变反应的催化剂,不影响平衡的移动,氢气的转化率不变,故C错误;
D.液化生成物分离出氨,平衡向右移动,氢气的转化率增大,故D正确;
故选AD.
(2)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3,
故答案为:N2+6H++6e-=2NH3;
(3)①温度对化学平衡移动方向的影响是:温度越高,氨气的量越大,所以升高温度,平衡向右进行,反应是吸热反应,故答案为:大于;
②已知:a、N2(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ/mol;
b、O2(g)+2H2(g)═2H2O(l);△H=-571.6kJ/mol,
则反应2N2(g)+6H2O(l)═4NH3(g)+3O2(g)等于2a-3b;
所以△H=2×(-92.4kJ/mol)-3×(-571.6kJ/mol)=+1530.0kJ/mol,
故答案为:1530.0;
(4)NH4Cl在重水(D2O)中水解的实质是铵根和中水中的OD-反应的结果,离子方程式是NH4++D2O⇌NH3•HDO+D+,故答案为:NH4++D2O⇌NH3•HDO+D+.点评:
本题考点: 氮的固定;用盖斯定律进行有关反应热的计算;电极反应和电池反应方程式;催化剂的作用;化学平衡的影响因素;盐类水解的应用.
考点点评: 本题考查学有关热化学、电化学以及化学平衡移动原理可计算知识,考查角度广,难度大.1年前查看全部
- 天然固氮和人工固氮,雷雨发庄稼的原理
 永前菜市1年前1
永前菜市1年前1 -
 爱上网友错了吗 共回答了22个问题
爱上网友错了吗 共回答了22个问题 |采纳率86.4%将空气中的游离氮转化为化合态氮的过程,称为固氮(nitrogen fixation)
人工固氮和天然固氮
1、人工固氮
工业上通常用H2和N2 在催化剂、高温、高压下合成氨
最近,两位希腊化学家,位于Thessaloniki的阿里斯多德大学的George Marnellos和MichaelStoukides发明了一种合成氨的新方法(Science,2Oct.1998,P98).在常压下,令氢与用氦稀释的氮分别通入一加热到570℃的以锶-铈-钇-钙钛矿多孔陶瓷(SCY)为固体电解质的电解池中,用覆盖在固体电解质内外表面的多孔钯多晶薄膜的催化,转化为氨,转化率达到78%;对比:几近一个世纪的哈伯法合成氨工艺通常转化率为10至15%!他们用在线气相色谱检测进出电解池的气体,用HCl吸收氨引起的pH变化估算氨的产率,证实提高氮的分压对提高转化率无效;升高电流和温度虽提高质子在SCY中的传递速度却因SCY导电率受温度限制,升温反而加速氨的分解.
2、天然固氮
闪电能使空气里的氮气转化为一氧化氮,一次闪电能生成80~1500kg的一氧化氮.这也是一种自然固氮.自然固氮远远满足不了农业生产的需求.
豆科植物中寄生有根瘤菌,它含有氮酶,能使空气里的氮气转化为氨,再进一步转化为氮的化合物.固氮酶的作用可以简述如下:
除豆科植物的根瘤菌外,还有牧草和其他禾科作物根部的固氮螺旋杆菌、一些原核低等植物——固氮蓝藻、自生固氮菌体内都含有固氮酶,这些酶有固氮作用.这一类属自然固氮的生物固氮.
人工固氮长期以来,人们期望着农田中粮食作物能像豆科植物一样有固氮能力,以减少对 化肥的依赖.70年代首先实现了细菌之间的固氮 ... 目前主要在合成氨中实现人工固氮. 所有的含氮化学肥料也主要是由氨加工制成的.
人称这种合成氨方法为"哈伯-博施法",这是具有世界意义的人工固氮技术的重大成就. 是化工生产实现高温、高压、催化反应的第一个里程碑.合成氨的原料来自空气、煤和水, 因此是最经济的人工固氮法,从而结束了人类完全依靠天然氮肥的历史.1年前查看全部
- 下列反应属于人工固氮的是( ) A.N 2 和O 2 在雷电的作用下生成NO B.NO和O 2 反应生成NO
下列反应属于人工固氮的是( )
A.N 2 和O 2 在雷电的作用下生成NO B.NO和O 2 反应生成NO 2 C.N 2 和H 2 反应生成NH 3 D.NO 2 和H 2 O反应生成HNO 3 和NO  风的哭泣1年前1
风的哭泣1年前1 -
 血祭者 共回答了18个问题
血祭者 共回答了18个问题 |采纳率88.9%C
游离态的氮转化为化合态的氮的过程是氮的固定。BD不是氮氮固定,A是自然固氮,所以答案选C。1年前查看全部
- (2012•天津模拟)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO
(2012•天津模拟)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)═4NH3 (g)+3O2(g)△H=a kJ•mol-1进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下:
(1)此合成反应的a______0,△S______0 (填“>”“<”或“=”)温度 T/K 303 313 323 NH3生成量/(10-6mol) 4.8 5.9 6.0
(2)N2(g)+3H2(g)═2NH3 (g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ•mol-1,则2N2(g)+6H2O(l)═4NH3 (g)+3O2(g)△H=______. zhengliwei1年前1
zhengliwei1年前1 -
 微笑的柠檬 共回答了17个问题
微笑的柠檬 共回答了17个问题 |采纳率94.1%解题思路:(1)由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,结合反应方程式中各物质的聚集状态解答;
(2)利用盖斯定律计算.(1)由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,则正反应应为吸热反应,a>0,由方程式可知反应生成气体的物质的量增多,则△S>0,故答案为:>;>;
(2)已知:①N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则利用盖斯定律,将①×2-②×3可得常温下氮气与水反应生成氨气与氧气的热化学方程式为2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
△H=2×(-92.4kJ•mol-1)-3×(-571.6kJ•mol-1)=+1536kJ•mol-1,
故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1536kJ•mol-1.点评:
本题考点: 反应热和焓变.
考点点评: 该题考查热化学方程式的书写、反应热的计算,是高考中的常见题型,试题基础性强,难易适中.1年前查看全部
- (2014•烟台模拟)合成氨技术的发明使工业化人工固氮成为现实.
 (2014•烟台模拟)合成氨技术的发明使工业化人工固氮成为现实.
(2014•烟台模拟)合成氨技术的发明使工业化人工固氮成为现实.
(1)已知N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为______.
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1______K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡______移动(填“向左”、“向右”或“不”).
②T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=______.达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡______移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)⇌H2O(l)+CO(NH2)2(l)△H,
在一定压强下测得如下数据:
①则该反应△H______0,表中数据a______d,b______f(均选填“>”、“=”或“<”).温度/℃
CO2转化率%n(NH3) n(CO2) 100 150 200 1 19.6 27.1 36.6 1.5 a b c 2 d e f
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______. lpvip91年前1
lpvip91年前1 -
 modern3957 共回答了17个问题
modern3957 共回答了17个问题 |采纳率70.6%解题思路:(1)依据热化学方程式定量关系计算分析,气体n=[V/22.4],计算物质的量结合热化学方程式计算得到;
(2)①图象分析,A点氨气含量大于B点,说明温度越高,氨气含量越少,平衡逆向进行,平衡常数减小,恒温恒压加入惰性气体,体积增大压强减小,平衡向气体体积增大的分析进行,逆向进行;
②依据平衡转化率计算生成的氨气,结合平衡三段式列式计算,反应速率V=[△c/△t],依据平衡常数概念和平衡浓度计算得到,依据题干浓度计算浓度商和平衡常数比较;
(3)①分析图表当氨气和二氧化碳物质的量之比等于1,随温度升高,CO2转化率增大,说明反应正向进行,正向是吸热反应,氨气和二氧化碳物质的量之比增大,平衡正向进行,二氧化碳转化率增大,依据化学平衡影响因素和平衡三段式分析判断;
②循环利用原料.(1)已知N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时物质的量=[33.6L/22.4L/mol]=1.5mol,放出的热量=[1.5mol×92.2KJ/2mol]=69.15kJ,
故答案为:69.15kJ;
(2)①图象分析,A点氨气含量大于B点,说明温度越高,氨气含量越少,平衡逆向进行,平衡常数减小,温度T1、T2时的平衡常数分别为K1、K2,则K1>K2,恒温恒压加入惰性气体,体积增大压强减小,平衡向气体体积增大的分析进行,逆向进行,平衡向左移动;
故答案为:>;向左;
②T2温度时,图象分析可知,平衡时氨气含量为20%,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,设消耗氮气浓度为x,
N2(g)+3H2(g)⇌2NH3(g)
起始量(mol/L) 2.1 1.5 0
变化量(mol/L) x 3x 2x
平衡量(mol/L) 2.1-x1.5-3x 2x
平衡时氨气含量为20%,[2x/3.6--2x]=20%
x=0.3mol/L
则v(H2)=[3×0.3mol/L/10min]=0.09 mol•L-1•min-1;
平衡浓度c(NH3)=0.6mol/L,c(H2)=0.6mol/L,c(N2)=1.8mol/L
K=
0.62
0.63×1.8=0.93
达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,个物质浓度为:(NH3)=0.6mol/L+0.4mol/L=1mol/L,c(H2)=0.6mol/L+0.4mol/L=1mol/L,c(N2)=1.8mol/L+0.4mol/L=2.2mol/L
Q=
12
13×2.2=0.45<K=0.93,反应正向进行;
故答案为:0.09 mol•L-1•min-1;向右;
(3)①分析图表当氨气和二氧化碳物质的量之比等于1,随温度升高,CO2转化率增大,说明反应正向进行,正向是吸热反应,△H>0;氨气和二氧化碳物质的量之比增大,平衡正向进行,二氧化碳转化率增大,a<d,依据图表数据反应是吸热反应,b<c,e<f,b<e,得到;b<f;
故答案为:>;<;<;
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应净化后重新充入合成塔内,循环利用,提高原料利用率;
故答案为:净化后重新充入合成塔内,循环利用,提高原料利用率.点评:
本题考点: 化学平衡的计算;有关反应热的计算;化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式计算,图象分析判断化学平衡、反应速率、平衡常数计算应用,掌握平衡移动原理是关键,题目难度中等.1年前查看全部
- 科学家一直致力于“人工固氮”的方法研究.目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气:
科学家一直致力于“人工固氮”的方法研究.目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气:
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ•mol-1
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ•mol-1
请写出氮气和氢气在高温高压催化剂条件下生成氨气的热化学方程式:______.
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:______,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是______ (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______.
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g).
①写出该反应的平衡常数表达式:K=[NO]4•[H2O]6 [NH4]•[O2]5 .[NO]4•[H2O]6 [NH4]•[O2]5
②在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是______(填字母代号).
a.增大压强b.适当升高温度c.增大O2的浓度d.选择高效催化剂. scgyl1年前1
scgyl1年前1 -
 axfaxf 共回答了25个问题
axfaxf 共回答了25个问题 |采纳率92%解题思路:(1)依据热化学方程式和盖斯定律计算分析得到;
(2)依据原子守恒书写化学方程式,依据原电池原理分析判断电极反应,燃料电池,燃料在负极失电子发生氧化反应;
(3)①化学平衡常数K=[生成物浓度系数幂次方/反应物浓度系数幂次方];
②依据化学平衡移动原理结合 反应特征分析判断.(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
依据盖斯定律,(③×3-②+①×2)÷2,得到:
氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4 kJ•mol-1;
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4 kJ•mol-1;
(2)氨气在纯氧中燃烧,生成一种单质和水,反应的化学方程式:4NH3+3O2
点燃
.
2N2+6H2O,氨气一氧气燃料电池,燃料在负极发生氧化反应,则通入氨气的电极是负极;碱性条件下,该电极发生反应的电极反应式为:2NH3+6OH--6e-=N2+6H2O,
故答案为:4NH3+3O2═2N2+6H2O;负极;2NH3+6OH--6e-=N2+6H2O;
(3)①反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)的平衡常数表达式K=[生成物浓度系数幂次方/反应物浓度系数幂次方]=
[NO]4•[H2O]6
[NH4]•[O2]5,故答案为:
[NO]4•[H2O]6
[NH4]•[O2]5;
②4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g).在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,
a.反应是气体体积增大的反应,增大压强,反应速率增大,平衡逆向进行,故a不符合;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,故b不符合;
c.增大O2的浓度,平衡正向进行,反应速率增大,故c符合;
d.选择高效催化剂只能改变化学反应速率,但不改变化学平衡,故d不符合;
故答案为:c.点评:
本题考点: 化学平衡的影响因素;用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理.
考点点评: 本题考查了热化学方程式和盖斯定律计算应用,原电池原理和电极反应书写应用,影响化学平衡因素分析判断,掌握基础是关键,题目难度中等.1年前查看全部
- (2010•徐州三模)大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法.科学家一直致力“人工固氮”新方法的研究.
 (2010•徐州三模)大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法.科学家一直致力“人工固氮”新方法的研究.
(2010•徐州三模)大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法.科学家一直致力“人工固氮”新方法的研究.
(1)有关大气固氮(以N2+02⇌2N0为例)、人工固氮(以N2+3H2⇌2NH3为例)反应的平衡常数K的值如下表.
下列说法正确的是______.(填字母)反应 N2+02⇌2N0
N2+3H2⇌2NH3温度/℃ 27 2000 100 400 K 3.84×10-31 0.1 3.4×109 2.0x104
a.大气固氮与人工固氮都是放热反应
b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+02(g)=2H20(1)△H=-571.6kJ•mol-1
据报道,在常温、常压、光照、催化剂的条件下,N2可以与水反应,则反应
N2(g)+3H20(l)=2NH3(g)+[3/2]O2(g)的△H=______KJ•mol-1.
(3)某研究小组在673K、30MPa下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)⇌2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.
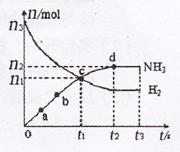
①下列叙述正确的是______.(填字母)
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673K升至773K,则n(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)v(H2)=
mol/(L.s)3n2 2Vt2 .
mol/(L.s)3n2 2Vt2
③若开始时n(N2)=n(H2),则反应的平衡常数K=n22V2 (n3−
)×(n3−n2 2
)33n2 2 (用代数式表示).n22V2 (n3−
)×(n3−n2 2
)33n2 2  科西嘉走廊的猫1年前1
科西嘉走廊的猫1年前1 -
 dzhn20 共回答了19个问题
dzhn20 共回答了19个问题 |采纳率78.9%解题思路:(1)a.化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关;
b.大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小;
c.合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高;
d.由K可知,常温下难人工合成氨;
(2)由①N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,②2H2(g)+02(g)=2H20(1)△H=-571.6kJ•mol-1,
根据盖斯定律可知,则①-②×[3/2]得到反应N2(g)+3H20(l)=2NH3(g)+[3/2]O2(g);
(3)①由图可知,为合成氨的反应,t2时达到平衡,该反应为放热反应;
②结合v=[△c/△t]计算;
③开始时n(N2)=n(H2),平衡时c(NH3)=
mol/L,c(H2)=n2 V
mol/L,c(N2)=n3−
n23 2 V
mol/L,以此计算K.n3−
n21 2 V (1)a.由K可知,大气固氮为吸热反应,而人工固氮是放热反应,故a错误;
b.大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小,没有实际意义,故b正确;
c.合成氨是放热反应,常温下合成氨气需要合适的催化剂,则寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向,故c正确;
d.由表格中K的数据与温度可知,在常温下,人工固氮难进行,故d错误;
故答案为:bc;
(2)由①N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,②2H2(g)+02(g)=2H20(1)△H=-571.6kJ•mol-1,
根据盖斯定律可知,则①-②×[3/2]得到反应N2(g)+3H20(l)=2NH3(g)+[3/2]O2(g),则△H=-92.4kJ/mol-(-571.6kJ•mol-1)×[3/2]=+765.0 kJ•mol-1,
故答案为:+765.0;
(3)①由图可知,为合成氨的反应,t2时达到平衡,该反应为放热反应;
A.a→b为正反应阶段,则点a的正反应速率比点b的大,故A正确;
B.点c在t2时之前,没有达到化学平衡状态,故B错误;
C.若t3时由673K升至773K,平衡逆向移动,则n(H2)将增大,故C正确;
故答案为:AC;
②开始到平衡时反应的平均速率(以H2的浓度变化表示)v(H2)=[△c/△t]=
3n2
2Vt2mol/(L.s),故答案为:
3n2
2Vt2mol/(L.s);
③开始时n(N2)=n(H2),平衡时c(NH3)=
n2
Vmol/L,c(H2)=
n3−
3
2n2
Vmol/L,c(N2)=
n3−
1
2n2
Vmol/L,则K=
(
n2
V)2
(
n3−
3
2n2
V)3×
n3−
1
2n2
V=
n22V2
(n3−
n点评:
本题考点: 化学平衡的计算;用盖斯定律进行有关反应热的计算;化学平衡建立的过程;化学平衡常数的含义;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查化学平衡常数及影响因素、意义,反应速率计算等,题目难度中等,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关,侧重计算能力及分析能力的考查.1年前查看全部
- 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)根据下图提供的信息,写出该反应的热化学方程式______,如图的曲线中______(填“a”或“b”)表示加入
铁触媒(催化剂)的能量变化曲线.
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是______.
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1L的容器中加入1mol N2、3mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a.则K和a的关系是K=4a2 27(1−a)4 .4a2 27(1−a)4
(4)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据.
实验编号 T(℃) n (N2)/n(H2) P(MPa) ⅰ 450 1/3 1 ⅱ 1/3 10 ⅲ 480 10
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨.其实验装置如图.阴极的电极反应式为______.实验编号 T(℃) n (N2)/n(H2) P(MPa) ⅰ 450 1/3 1 ⅱ 1/3 10 ⅲ 480 10  i13571年前1
i13571年前1 -
 唐朝_com 共回答了19个问题
唐朝_com 共回答了19个问题 |采纳率94.7%解题思路:(1)根据图1计算出反应热,写出热化学方程式.注意物质状态,反应热符号等;催化剂能降低反应的活化能;(2)根据平衡状态的判断依据判断;只要满足正反应速率等于逆反应速率,即可判断;(3)根据“三行式”来进行计算得出结论;(4),ⅱ应只改变压强,ⅲ应只改变温度;(5)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气.(1)由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,
所以合成氨的热化学反应方程式为N2(g)+3H2(g)⇌2NH3(g)△H═-92kJ/mol,催化剂能降低反应的活化能,b活化能较低,故答案为:N2(g)+3H2(g)⇌2NH3(g);△H=-92 kJ•mol-1;b;
(2)A.3υ(H2)正=2υ(NH3)逆说明:v (NH3)逆:v (H2)正═3:2不等于对应化学计量数之比,即正反应速率不等于逆反应速率,故A错误; B.单位时间内生成n mol N2的同时生成2n molNH3说明正反应速率等于逆反应速率,故B正确;
C.体积不变,气体的质量不变,密度也会不变,用密度不变无法区分非平衡状态和平衡状态,故C错误;
D.反应N2(g)+3H2(g)⇌2NH3(g)是反应前后气体的总物质的量不相等的反应,当体积固定时,根据阿伏伽德罗定律可知,温度、体积相同时,气体的物质的量之比等于压强之比,容器内气压不随时间变化,说明气体的总物质的量不再发生变化,即说明可逆反应达到了化学平衡状态,故D正确.
故选B D;
(3)根据题意:N2(g)+3H2(g)⇌2NH3(g),
初始物质的量浓度:1 3 0
变化物质的量浓度:a 3a2a
平衡物质的量浓度:1-a 3-3a 2a
则平衡常数为K=
[NH3]2
[N2][H2]3=
(2a )2
(1−a)(3−3a)3=
4a2
27(1−a)4,故答案为:
4a2
27(1−a)4;
(4)该实验为了寻找合成NH3的适宜条件,ⅱ应只改变压强,ⅲ应只改变温度,所以应填入的数据为:450;[1/3],故答案为:450;[1/3];
(5)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,故答案为:N2+6H++6e-=2NH3.点评:
本题考点: 热化学方程式;原电池和电解池的工作原理;化学平衡状态的判断.
考点点评: 本题考查了化学平衡的计算,速率、平衡常数的计算,平衡状态的判断依据和方法,影响平衡的因素分析,题目综合性强,较难.1年前查看全部
- 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮
方法。已知:N 2 (g) + 3H 2 (g) 2NH 3 (g) △H=-92.4 kJ/mol。
2NH 3 (g) △H=-92.4 kJ/mol。
恒温下,往一个4L的密闭容器中充人2molN 2 和5.2molH 2 ,反应过程中对NH 3 的浓度进行检测,得到的数据如下表所示:时间/min 5 10 15 20 25 30 c(NH 3 )/mol·L —1 0.08 0.14 0.18 0.20 0.20 0.20
①5min内,消耗H 2 的平均反应速率为____________
②N 2 的平衡转化率
③计算此条件下该反应的化学平衡常数K=__________________________。
④若维持容器体积不变,只升高温度化学平衡常数值 (填变大、变小、不变),正反应速率 (填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N 2 的平衡浓度 0.4
mol·L —1 (填大于、小于、等于)
⑥若维持容器体积不变,充入He使之压强增大一倍,正反应速率 (填
变大、变小、不变),若维持压强不变,充入He,则平衡移动方向为 (填正移、逆移、不移) wangxiaofeng19841年前1
wangxiaofeng19841年前1 -
 hh狂想阿 共回答了21个问题
hh狂想阿 共回答了21个问题 |采纳率100%①0.024mol·L -1 ·min -1 ②20% ③ O.1 (mol·L -1 ) -2 [或0.1]
④ 变小,变大 ⑤大于 ⑥不变,逆移
略1年前查看全部
- 下列过程属于人工固氮的是( )
下列过程属于人工固氮的是( )
A.分离液态空气制氮气
B.闪电时N2转化为NO
C.工业合成氨
D.豆科作物根瘤菌将N2转化为含氮化合物 浪漫夜之子1年前1
浪漫夜之子1年前1 -
 mengzhichu 共回答了18个问题
mengzhichu 共回答了18个问题 |采纳率94.4%解题思路:人工固氮是人为的条件下将氮元素的单质转化为化合物的过程,然后根据选项解答.A、分离液态空气制氮气,是氮气的状态发生改变,不属于氮的固定,更不是人工固氮,故A错误;
B、闪电时N2转化为NO,属于自然固氮,故B错误;
C、工业合成氨是N2与H2在一定条件下反应生成NH3,属于人工固氮,故C正确;
D、豆科作物根瘤菌将N2转化为含氮化合物,属于生物固氮,故D错误.
故选:C.点评:
本题考点: 氮的固定.
考点点评: 本题考查学生氮的固定以及分类方面的知识,注意知识的积累是解题的关键,难度不大.1年前查看全部
- (2008•揭阳一模)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为
(2008•揭阳一模)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:n2(g)+3h2(g)⇌2nh3(g)△h=-92.2kj/mol.合成氨工业中原料气n2可从空气中分离得到,h2可用甲烷在高温下与水蒸气反应制得.***合成氨工业目前的生产条件为:
催化剂-铁触媒,温度-400~500℃,压强-30~50mpa.
回答下列问题:
(1)合成氨工业中原料气压缩到30~50mpa的原因是______.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______.
(2)500℃、50mpa时,在容积为vl的容器中加入n mol n2、3n mol h2,反应达平衡后测得平衡常数为k,此时n2的转化率为x.则k和x的关系满足k=4x2v2 27n2(1−x)4 .4x2v2 27n2(1−x)4
(3)有人设想寻求合适的催化剂和电极材料,以n2、h2为电极反应物,以hcl-nh4cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______.
(4)已知h2(g)、co(g)、ch4(g)三种物质的燃烧热分别是-285.8kj•mol-1、-283.0kj•mol-1、
-890.3kj•mol-1,1mol h2o(g)转变为1mol h2o(l)时放出44.0kj热量.甲烷在高温下与水蒸气反应的化学方程式为:ch4(g)+h2o(g)=co(g)+3h2(g).那么该反应的反应热△h______ 0 (填>、=或<). xiejiangfei1年前1
xiejiangfei1年前1 -
 失去理想 共回答了16个问题
失去理想 共回答了16个问题 |采纳率93.8%解题思路:(1)由外界条件对化学平衡以及化学反应速率的影响分析;
(2)计算平衡时各物质的浓度,进而计算平衡常数;
(3)N2在正极发生还原反应生成NH4+,以此书写电极反应式;
(4)根据燃烧热写出热化学方程式,利用盖斯定律计算.(1)合成氨反应的化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol,反应物气体的化学计量数大于生成物气体的化学计量数,则加压有利于平衡正向移动,提高原料气的转化率,升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间.
故答案为:加压有利于平衡正向移动,提高原料气的转化率;增加反应速率,缩短达到平衡的时间;
(2)N2(g)+3H2(g)⇌2NH3(g)
起始:[n/V]mol/L [3n/V]mol/L0
转化:[nx/V]mol/L [3nx/V]mol/L [2nx/V]mol/L
平衡:
n(1−x)
Vmol/L
3n(1−x)
Vmol/L [2nx/V]mol/L
则平衡常数为:K=
(
2nx
V)2
(
n(1−x)
V)×(
3n(1−x)
V)3=
4x2V2
27n2(1−x)4,
故答案为:
4x2V2
27n2(1−x)4;
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池,N2在正极发生还原反应生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,
故答案为:N2+6e-+8H+=2NH4+;
(4)根据题中信息可知:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+[1/2]O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,>0,
故答案为:>.点评:
本题考点: 合成氨条件的选择;反应热和焓变;化学电源新型电池;化学平衡常数的含义.
考点点评: 本题考查化学平衡的计算以及盖斯定律的应用,题目难度中等,解答本题时注意把握计算方法,平衡常数的计算以及电极方程式的书写是化学原理模块常考查内容.1年前查看全部
- 合成氨(人工固氮)高中化学题填空题,
合成氨(人工固氮)高中化学题填空题,
 就是不知道怎么写代数a
就是不知道怎么写代数a  苏辛秦晏1年前1
苏辛秦晏1年前1 -
 优雅着yy 共回答了16个问题
优雅着yy 共回答了16个问题 |采纳率87.5%N2+3H2==2NH3 相差
1 3 2 2
压强比等于物质的量的比,所以,开始时为1.5+4.5=6mol/L,反应后为6/amol/L
减少的物质的量为6-6/a,相当于反应中相差的2,所以,反应的N2为(6-6/a)/2=3-3/a
因此,转化率为(3-3/a)/1.5=2-2/a1年前查看全部
- 氮是地球上含量丰富的元素之一.为了科学合理地利用氮元素,科学家一直致力于“人工固氮”新方法的研究.
氮是地球上含量丰富的元素之一.为了科学合理地利用氮元素,科学家一直致力于“人工固氮”新方法的研究.
(1)目前有关人工固氮的主要反应是:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
①已知:N≡N的键能是942kJ•mol-1,H-H的键能是431.2kJ•mol-1,则N-H的键能是______kJ•mol-1
②某研究小组在400℃、30MPa下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)⇌2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.从开始到平衡时,反应的平均速率H2的浓度变化表示v(H2)=
mol/(L•s)3n2 2Vt2 .
mol/(L•s)3n2 2Vt2
③在下列措施中,既能加快合成氨化学反应速率,又能提高原料转化率的是______.
A.向密闭容器中按原比例再充入原料气B.向密闭容器中再充入稀有气体
C.缩小容器的体积,增大反应体系的压强D.将氨气液化并及时分离出去
(2)据报道,在常温、常压、光照、催化剂的条件下,N2也可以与水直接反应生成氨气和氧气,从而实现氮的固定.又已知:2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ•mol-1,则反应2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)的△H=______kJ•mol-1. lllkkk01091年前1
lllkkk01091年前1 -
 mj369151193 共回答了17个问题
mj369151193 共回答了17个问题 |采纳率94.1%解题思路:(1)①反应物总键能-生成物总键能=反应热,据此计算;②根据化学反应速率v=△c△t来计算;③根据影响化学反应速率和化学平衡移动的因素来回答;(2)根据盖斯定律来计算化学反应的焓变.(1)①根据N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,设N-H的键能是x,则942kJ•mol-1+3×431.2kJ•mol-1-2x=-92.4kJ•mol-1,解得x=388kJ•mol-1,
故答案为:388;
②根据化学反应速率v=[△c/△t]=
3n2
V
t2=
3n2
2Vt2mol/(L•s),故答案为:
3n2
2Vt2mol/(L•s);
③A.向密闭容器中按原比例再充入原料气,相当于增大压强,可以加快合成氨化学反应速率,又能使平衡右移,提高原料转化率,故A正确;
B.向密闭容器中再充入稀有气体,各个组分浓度不变,化学反应速率不变,化学平衡不移动,故B错误;
C.缩小容器的体积,增大反应体系的压强,可以加快合成氨化学反应速率,又能使平衡右移,提高原料转化率,故C正确;
D.将氨气液化并及时分离出去,可以减慢反应速率,使化学平衡正向移动,提高原料转化率,故D错误.
故答案为:AC;
(2)已知:①N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1;②2H2(g)+O2(g)⇌2H2O(l)△H=-571.6kJ•mol-1,根据盖斯定律,反应2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g)可以是①×2-3×②得到,即反应的焓变)△H=(-92.4kJ•mol-1)×2-3(-571.6kJ•mol-1)=1530kJ•mol-1.
故答案为:1530.点评:
本题考点: 有关反应热的计算;化学平衡的影响因素;物质的量或浓度随时间的变化曲线.
考点点评: 本题综合考查学生热化学、化学反应速率和平衡移动等方面的知识,属于综合知识的考查,难度不大.1年前查看全部
- (2013•德州模拟)科学家一直致力于“人工固氮”的新方法研究.据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量
(2013•德州模拟)科学家一直致力于“人工固氮”的新方法研究.据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和O2.
(1)已知:①H2(g)+[1/2]O2(g)═H2O(l)△Hl=-285.6kJ/mol
②N2(g)+3H2(g)⇌2NH3(g)△H2=-92.2kJ/mol
写出此条件下氮气和水反应的热化学方程式______.
(2)氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H<0,此反应的化学平衡常数表达式为c4(NO)c6(H2O) c4(NH3)c5(O2) ,若此反应起始的物质的量相同,则如图所示的关系图正确的是______(填序号)c4(NO)c6(H2O) c4(NH3)c5(O2) 
在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2min到第4min时,O2的平均反应速率为______mol•L-1•min-1.时间/浓度 c(NH3)(mol/L) c(O2)(mol/L) c(NO)(mol/L) 起始 0.8000 1.600 0.000 第2min 0.6000 a 0.2000 第4min 0.3000 0.9750 0.5000 第6min 0.3000 0.9750 0.5000 第8min 0.7000 1.475 0.1000
②反应在第2min时改变了条件,改变的条件可能是______.
③在第6min时,改变了反应的条件,该平衡向______移动(填“左”或“右”). 婉冰1年前1
婉冰1年前1 -
 3xny 共回答了9个问题
3xny 共回答了9个问题 |采纳率88.9%解题思路:(1)根据盖斯定律计算求出△H;
(2)根据化学方程式写出平衡常数表达式;根据影响平衡的因素分析;
①根据参加反应的氨气的量求出氧气的量,然后求出反应速率;
②容积固定的密闭容器,因此改变压强无影响,有速率变快,所以是升高温度或加了催化剂;
③在第6min时,反应物增加说明平衡向逆方向移动.(1)先根据反应物和生成物写出方程2N2(g)+6H2O(l)=4NH3(g)+3O2(g),在根据目标方程改写分方程,方程①×6再反写,与方程②×2相加,
所以△H=△H2-6△Hl═-92.2×2+285.6×6=1529.22kJ/mol;故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1529.2kJ/mol;
(2)根据化学方程式写出平衡常数表达式K=
c4(NO)c6(H2O)
c4(NH3)c5(O2);故答案为:
c4(NO)c6(H2O)
c4(NH3)c5(O2);
A、反应的△H<0,升高温度平衡逆移,氨气浓度增大,故1200℃的曲线应在上面,故A错误;
B、该反应正方向为计量数增大的方向,所以增大压强平衡逆移,NO的含量减少,故B正确;
C、升高温度平衡逆移,水的含量减小,故C错误;
D、加催化剂平衡不移动,反应速率加快,故D正确;
故答案为:B、D;
①第2min到第4min,参加反应的氨气为c(NH3)=0.6-0.3=0.3mol•L-1参加反应的氧气为:c(O2)=[5/4]×0.3mol•L-1=0.24mol•L-1
v(O2)=
c(O2)
t=0.1875 mol•L-1•min-1,故答案为:0.1875;
②容积固定的密闭容器,因此改变压强无影响,因为速率变快,所以是升高温度或加了催化剂,故答案为:升高温度或使用催化剂;
③在第6min时,反应物增加说明平衡向逆方向移动,故答案为:左.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡建立的过程;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查了利用盖斯定律求算反应热,化学平衡移动,平衡常数,反应速率的计算,综合性较强.1年前查看全部
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.

(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应.在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00mol•L-1,c(N2)=3.00mol•L-1,c(NH3)=4.00mol•L-1,此温度下该反应的平衡常数K=______.
(2)在三个相同容器中各充入1mol N2和3mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示.下列说法中正确的是______(填字母,下同).
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气
具有良好的应用前景.已知通过乙醇制取氢气有如下两条路线:
a、CH3CH2OH(g)+H2O(g)⇌4H2(g)+2CO(g)△H=+255.58kJ/mol
b、CH3CH2OH(g)+1/2O2(g)⇌3H2(g)+2CO(g)△H=+13.76kJ/mol
下列说法错误的是:______
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大
D.降低温度,可提高b路线中乙醇的转化率. julle1年前1
julle1年前1 -
 玉手点将 共回答了19个问题
玉手点将 共回答了19个问题 |采纳率89.5%解题思路:(1)根据k=
计算平衡常数;c2(NH3) n(N2)•c3(H2)
(2)根据外界条件对平衡移动的影响分析;
(3)A.从原料消耗的角度来看,消耗等量乙醇a路线生产氢气多;
B.从能量消耗的角度来看,b路线消耗能量少;
C.a路线消耗很多能量;
D.该反应为吸热反应,降低温度,逆移.(1)k=
c2(NH3)
n(N2)•c3(H2)=
4.002
3.00×9.003=7.32×10-3,故答案为:7.32×10-3;
(2)A.增大压强,平衡向正反应分析移动,氨气的含量增大,故A错误;
B.图Ⅱ应是催化剂对反应的影响,故B错误;
C.温度升高,平衡向逆反应分析移动,氨气的含量降低,故C错误;
D.图Ⅱ中两种途径平衡状态相同,应是催化剂对平衡的影响,1反应速率大,催化效果好,故D正确;
故答案为:D;
(3)A.从原料消耗的角度来看,消耗等量乙醇a路线生产氢气多,故A正确;
B.从能量消耗的角度来看,b路线消耗能量少,故B正确;
C.与b路线相比,a路线消耗很多能量,所以在实际生产中意义不大,故C正确;
D.该反应为吸热反应,降低温度,逆移,所以乙醇转化率降低,故D错误;
故答案为:D.点评:
本题考点: 化学平衡常数的含义;化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查较为综合,涉及化学平衡,化学反应与能量以及电化学知识,题目难度较大,本题注意电极反应式的书写,注意利用盖斯定律计算反应热的方法.1年前查看全部
- (2013•黄冈模拟)科学家一直致力于“人工固氮”的方法研究.目前合成氨的技术原理为氮气 和氢气在高温高压催化
(2013•黄冈模拟)科学家一直致力于“人工固氮”的方法研究.目前合成氨的技术原理为氮气 和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个2L的密闭容器中充入2mol N2和6mol H2,反应达平衡时生成NH3的浓度为0.5mol/L,并放出Q kJ热量,该反应的热化学方程式可表示为______.
 lisahall1年前1
lisahall1年前1 -
 6519888999 共回答了19个问题
6519888999 共回答了19个问题 |采纳率94.7%解题思路:一定条件下,向一个2L的密闭容器中充入2mol N2和6mol H2,反应达平衡时生成NH3的浓度为0.5mol/L,物质的量为1mol,并放出Q kJ热量,则生成2molNH3放热2QKJ,依据热化学方程式书写方法标注物质聚集状态和对应反应焓变;一定条件下,向一个2L的密闭容器中充入2mol N2和6mol H2,反应达平衡时生成NH3的浓度为0.5mol/L,物质的量为1mol,并放出Q kJ热量,则生成2molNH3放热2QKJ,依据热化学方程式书写方法标注物质聚集状态和对应反应焓变,反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-2QkJ/mol;
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-2QkJ/mol;点评:
本题考点: 热化学方程式.
考点点评: 本题考查了热化学方程式书写方法和注意问题,掌握基础是关键,题目较简单.1年前查看全部
- 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g);△H=-92.
 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ•mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ•mol-1.在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.点d和点e处的n(N2)不相同
D.点e反应达到化学平衡状态,反应停止 悦成ai飞飞1年前1
悦成ai飞飞1年前1 -
 股海媚儿 共回答了16个问题
股海媚儿 共回答了16个问题 |采纳率75%解题思路:A.浓度越大反应速率越快;
B.a、b、c之后氢气的物质的量继续变化,未达到平衡,反应向正反进行;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态;
D.d、e对应氢气、氨气的物质的量不变,处于平衡状态是动态平衡.A.a点反应物的浓度大于b点,浓度越大反应速率越快,故a点反应速率更大,故A正确;
B.点c之后氢气的物质的量继续减小,未达到平衡,反应向正反进行,故B错误;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态,点d和点e处的n (N2)相同,故C错误;
D.d、e对应氢气、氨气的物质的量不变,处于平衡状态,平衡时动态平衡丙未停止,故D错误;
故选A.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查了化学平衡影响因素分析,注意图象变化的分析判断,掌握平衡调整和移动原理是关键,题目较简单.1年前查看全部
- 下列过程属于人工固氮的是( )
下列过程属于人工固氮的是( )
A.分离液态空气制氮气
B.工业合成氨
C.闪电时N2转化为NO
D.豆科作物根瘤菌将N2转化为含氮化合物 海损1年前1
海损1年前1 -
 瓶瓶盖 共回答了18个问题
瓶瓶盖 共回答了18个问题 |采纳率94.4%解题思路:人工固氮是人为的条件下将氮元素的单质转化为化合物的过程,据此解答.A.分离液态空气制氮气,属于物理变化,氮元素化合价不变,不属于固氮,故A不选;
B.工业合成氨是N2与H2在一定条件下反应生成NH3,属于人工固氮,故B选;
C.闪电时N2转化为NO,属于自然固氮,故C不选;
D.豆科作物根瘤菌将N2转化为含氮化合物,属于生物固氮,属于生物固氮,故D不选;
故选:B.点评:
本题考点: 氮的固定.
考点点评: 本题考查氮的固定及分类,根据概念即可解答,难度不大.1年前查看全部
- 下列反应属于人工固氮的是 [ ] A、N 2 和O 2 在雷电的作用下生
下列反应属于人工固氮的是 [ ]
A、N 2 和O 2 在雷电的作用下生成NO
B、NO和O 2 反应生成NO 2
C、N 2 和H 2 反应生成NH 3
D、NO 2 和H 2 O反应生成HNO 3 和NO banpresto1年前1
banpresto1年前1 -
 yanjie10 共回答了24个问题
yanjie10 共回答了24个问题 |采纳率87.5%C1年前查看全部
- 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据下图提供的信息,写出该反应的热化学方程式______________,下图的曲线中_________(填“a” 或“b”)表示加入铁触媒的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是_______
A.3v(H 2 )正=2v(NH 3 )逆
B.单位时间内生成n mol N 2 的同时生成2n molNH 3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1 L的容器中加入1 mol N 2 、3 mol H 2 ,反应达平衡后测得平衡常数为K,此时N 2 的转化率为a。则K和a的关系是K=________。
(4)为了寻找合成NH 3 的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H + ),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为_________________________ 。 
 yzw007671年前1
yzw007671年前1 -
 小小K 共回答了17个问题
小小K 共回答了17个问题 |采纳率88.2%1年前查看全部
- 人工固氮的意义是什么?
 yu_641年前2
yu_641年前2 -
 roy82556573 共回答了22个问题
roy82556573 共回答了22个问题 |采纳率86.4%最终来讲是为农业生产提供氮肥.因为氮肥是大多是植物最需要的三种肥料之一,有助于叶片的生长发育.
传统方法是用化学方法提取氮肥,但这样效率太低.后来有人发现豆科植物根部共生的根瘤菌能从空气中吸收氮并固定入土壤(空气的半数以上成分都是氮,很充足.)于是有人就把需要氮的植物和豆科植物混种.
后来又有人把根瘤菌能够产生固氮作用的基因转入其他植物.效果就不用我说啦!人工固氮也差不多.
请 加分1年前查看全部
- 人工固氮是化学变化吗?
 ewebsunny1年前3
ewebsunny1年前3 -
 要的就是这种感觉 共回答了23个问题
要的就是这种感觉 共回答了23个问题 |采纳率91.3%人工固氮主要是针对生物固氮而言,通过化学方法,制备出类似生物“固氮菌”的物质,使空气中的氮气在常温常压下与水及二氧化碳等反应,转化为氨态氮或铵态氮,进而实现人工合成大量的蛋白质等,最终实现工厂化生产蛋白质食品.
【人工固氮有新物质生成,所以是属于化学变化】1年前查看全部
- 下列叙述正确是的 A.人工固氮的过程一定涉及到氧化还原反应 B.1mol氯气在反应中一定得到2mol电子 C.1mol钠
下列叙述正确是的
A.人工固氮的过程一定涉及到氧化还原反应 B.1mol氯气在反应中一定得到2mol电子 C.1mol钠在足量氧气中燃烧生成Na 2 O 2 ,失去2mol电子 D.发生化学反应时,失去电子越多的金属原子,还原能力越强  黑黑百合1年前1
黑黑百合1年前1 -
 oo梧桐深院 共回答了27个问题
oo梧桐深院 共回答了27个问题 |采纳率96.3%A
1年前查看全部
- 大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以 为例)、人工固氮(以
为例)、人工固氮(以 为
为
例)反应的平衡常数 的值如下表。
的值如下表。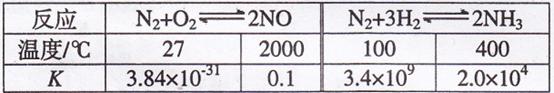
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知: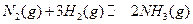
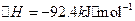
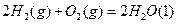
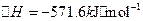
据报道,在常温、常压、光照、催化剂的条件下,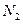 可以与水反应,则反应
可以与水反应,则反应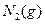 +
+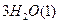 =
=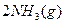 +3/2
+3/2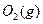 的
的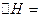
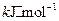
(3)某研究小组在673 k、30 mpa下,在体积为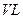 的
的
密闭容器中进行反应: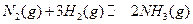 ,
,
其 和
和 随时间变化的关系如图所示。
随时间变化的关系如图所示。
①下列叙述正确的是 填字母
a.点a的正反应速率比点b的大
b.点c处反应达到化学平衡状态
c.若如时由673 k升至773 k,则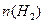 将增大
将增大
②从开始到平衡时反应的平均速率(以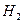 的浓度变化表示)v(
的浓度变化表示)v(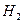 )= .
)= .
③若开始时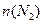 =
=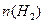 ,则反应的平衡常数k= (用代数式表示).
,则反应的平衡常数k= (用代数式表示). hf_snowolf1年前1
hf_snowolf1年前1 -
 shanghai11265 共回答了22个问题
shanghai11265 共回答了22个问题 |采纳率90.9%(1)bc(2)+765.0 kJ·mol -1
(3)①AC②3 n 2 /(2 Vt 2 ) mol/(L·s)③ n 2 2 V 2 /[( n 3 - n 2 /2)×( n 3 -3 n 2 /2) 3 ]
略1年前查看全部
- 人工固氮的化学方程式
 比亚迪0011年前1
比亚迪0011年前1 -
 bzod 共回答了12个问题
bzod 共回答了12个问题 |采纳率91.7%N2+3H2=高温高压催化剂,可逆=2NH31年前查看全部
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N 2 (g)+3H
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N 2 (g)+3H 2 (g) 
2(((NH 3 (g)△H=-92.2kJ/mol.合成氨工业中原料气N 2 可从空气中分离得到,H 2 可用甲烷在高温下与水蒸气反应制得.
(1)在一容积固定的密闭容器中注入N 2 和H 2 两种气体,发生上述反应.在某温度下达到平衡时各物质的浓度分别为c(H 2 )=9.00mol/L,c(N 2 )=3.00mol/L,c(NH 3 )=4.00mol/L,此温度下该反应的平衡常数为______.
(2)三个相同容器中各充入1molN 2 和3molH 2 ,在不同条件下反应并达到平衡,氨的体积分数随时间的变化如图所示.下列说法正确的是______(填序号).
A.图I可能是不同压强对反应的影响,且P 2 >P 1
B.图Ⅱ可能是不同压强对反应的影响,且P 1 >P 2
C.图Ⅲ可能是不同温度对反应的影响,且T 1 >T 2
D.图Ⅱ一定是在同温同压下不同催化剂对反应的影响,且催化剂效果1>2
(3)将水蒸气通过红热的炭即产生水蒸气,化学方程式为:C(s)+H 2 O(g)
H 2 (g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发______(填:能或否).
(4)甲烷在高温下与水蒸气反应反应方程式为:CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g).部分物质的燃烧热数据如下表:
已知1mol H 2 O(g)转变为1mol H 2 O(l)时放出44.0kJ热量.写出CH 4 和H 2 O在高温下反应的热化学方程式______.物质 燃烧热(kJ•mol -1 ) H 2 (g) -285.8 CO(g) -283.0 CH 4 (g) -890.3
(5)有人设想寻求合适的催化剂和电极材料,以N 2 、H 2 为电极反应物,以HCl-NH 4 Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______. 乔襄1年前1
乔襄1年前1 -
 dongege 共回答了20个问题
dongege 共回答了20个问题 |采纳率85%(1)k= c 2 (N H 3 ) n( N 2 )• c 3 ( H 2 ) = 4. 00 2 3.00×9.0 0 3 =7.32×10 -3 ,故答案为:7.32×10 -3 ;(2)A.增大压强,平衡向正反应分析移动,氨...1年前查看全部
- 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响. (1) 500℃、50MPa时,在容
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响. (1) 500℃、50MPa时,在容
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.
(1) 500℃、50MPa时,在容积为5L的密闭容器中加入4 mol N2、8 mol H2,反应达平衡时N2的转化率为25%,该反应的平衡常数为K,则K=__________________.
(2) 500℃、50MPa时,在容积为5L的密闭容器中,按下列配比作为起始物质,达到平衡后N2的转化率仍为25%的是_____________
A.2molN2+4molH2 B.2molN2+4molH2+ 6molHe
C.4molN2+8molH2+6molHe D.3molN2+5molH2+2molNH3
(3)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 .
(4)合成氨工厂常通过测定反应前后混合气体的密度来确定N2的转化率.某工厂测得反应前合成塔中N2和H2混合气体的密度为0.554g•L-1,从合成塔出来的混合气体在相同条件下密度为0.693g•L-1(密度均在标准状况下测定),则该合成氨厂N2的转化率_____________.
(4)的理由
 sonic11221年前1
sonic11221年前1 -
 百色mm网 共回答了24个问题
百色mm网 共回答了24个问题 |采纳率91.7%(1) N2 + 3H2 = 2NH3
起始: 0.8 1.6 0
转化: 0.2 0.6 0.4
平衡: 0.6 1.0 0.4
K=c(NH3)^2 / [c(N2)·c(H2)^3]=(0.4)^2÷[0.6×(1.0)^3]=4/15.
(2)C、D.
(3)阳极反应:3H2 - 6e- = 6H+;阴极反应:N2 + 6e- + 6H+ = 2NH3.
(4)因为气体密度均为标准状况下测得,设原反应混合气中N2的物质的量为amol,H2的物质的量为bmol:气体总质量为28a+2b=(a+b)×22.4×0.554,解得:a/b=2/3.
又根据质量守恒定律,反应前后气体总质量不变.
在同温同压同质量情况下,气体密度之比就等于其体积比的倒数,同时等于气体物质的量之比的倒数.
N2 + 3H2 = 2NH3
起始: a b 0
转化: n 3n 2n
平衡: a-n b-3n 2n
(a+b) / [(a-n)+(b-3n)+2n)=0.693 / 0.554,且a/b=2/3.解得转化率:n/a×100%=25%.1年前查看全部
- 氨氧化法制硝酸是人工固氮吗
 luiagjc1年前2
luiagjc1年前2 -
 zldetiantang 共回答了10个问题
zldetiantang 共回答了10个问题 |采纳率90%先理解固氮的概念:是指氮元素从游离态的单质即氮气转化为化合态的氮.氨氧化法中氮元素本来就是化合态,转化为硝酸不能称为固氮.更谈不上是什么固氮了.1年前查看全部
- 工业商利用合成氨进行人工固氮.反应原理?要化学方程式.
 天使爱ss1年前1
天使爱ss1年前1 -
 孤狼吼月 共回答了23个问题
孤狼吼月 共回答了23个问题 |采纳率69.6%目前主要是工业合成氨,即:N2十3H2=(高温高压催化剂)=2NH3.400-500du Fe催化剂
利用高温提供高能量,段N2的3键 H2单键,便可从新合成,新建.但是个可逆反应.理由就是NH键也会被高能量断开又变回N2的3键 H2单键.要控制好反应进度,得到最高效益.1年前查看全部
- 什么是仿生固氮?氮的固定方法有自然固氮和人工固氮.人工固氮又分为工业固氮和仿生固氮.请问,仿生固氮是怎么回事?
 dsfgwergoiu1年前1
dsfgwergoiu1年前1 -
 高个子小女人 共回答了25个问题
高个子小女人 共回答了25个问题 |采纳率88%自然固氮中有一个根瘤菌固氮作用显著,知道这一个东西吧,将空气中的氮转化为亚硝酸根硝酸根!仿生学是仿照自然生物特殊的生存方式,用人工合成、培养提供条件完成在生物体所特有的那个功能1年前查看全部
大家在问
- 1一个关于副词的英语选择题Do you dress differently because of what you see
- 2填空(用序号填写)下列物质中①金刚石 ②Ar ③N
- 3结晶牛胰岛素是什么东西?语言请尽量通俗化.
- 4我和祖父的园子课后生字有哪些五年级课文是生字有哪些
- 5《虽有嘉肴》这篇文言文对你有怎样的启发?
- 6离情别意在古诗词中是个永恒的话题,王维在《送元二使安西》中用
- 7下列是一些有名的诗句,请把诗句中运用借代的词语指出来.1、孤帆远影碧空尽,唯见长江天际流.2、何以解忧,唯有杜康.3、田
- 8读《会飞的木箱》有感 作文
- 9谁有2010年成功小故事大道理 100-150字
- 10已知角a的终边经过点P(x,-√2)(x不等于0),且cosa=(√3)x/6,则sina+1/tana的值
- 11科学知识与生活有着密切的联系。对下列生活现象的解释正确的是: [ ] A
- 12用8丶9丶0这3个数可以组成多少个不同的3位数?
- 13I am afraid that there's no ___for you two in my car.
- 14A、B、C、D四人进行中国象棋比赛,每两个人之间都要赛一场.结果A胜了D,并且A、B
- 15一个三位数将最左边的数已到最右边,比原来小45;且百位上的数字比十位和个位组成的数小3,求原数





