互称同位素的不同核素为什么具有几乎完全相同的化学性质?
 ca134742022-10-04 11:39:541条回答
ca134742022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 dhaze 共回答了12个问题
dhaze 共回答了12个问题 |采纳率75%- 因为同位素的不同核素,它们都具有相同的质子数或核电荷数,这些原子电子排布一样,即结构一样,所以化学性质几乎完全相同.
- 1年前
相关推荐
- x元素原子核内质子数35,它有中子数为46和44同位素,x相对原子质量79.9,中子数为44的原子在x个数百分比为
 三月的天真1年前1
三月的天真1年前1 -
 我没名字123 共回答了17个问题
我没名字123 共回答了17个问题 |采纳率100%同位素质量数分别为35+46=81,35+44=79,x+y=1,81x+79y=79.9.自己算x,y,44对应y1年前查看全部
- 已知自然界中铱(Ir)有两种质量数分别为191和193的核素,而铱元素的相对原子质量为192.22.这两种同位素的原子个
已知自然界中铱(Ir)有两种质量数分别为191和193的核素,而铱元素的相对原子质量为192.22.这两种同位素的原子个数比应为( )
A. 39:61
B. 61:39
C. 1:1
D. 39:11 W _ii1年前0
W _ii1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有下列各组物质A.O 2 和O 3 互为同位素的是____(填序号,下同);互为同素异形体的是____;互为同分异构体的
有下列各组物质
A.O 2 和O 3
互为同位素的是____(填序号,下同);互为同素异形体的是____;互为同分异构体的是____;是同种物质的是____。  我知道11年前1
我知道11年前1 -
 xiaoyu_sz 共回答了13个问题
xiaoyu_sz 共回答了13个问题 |采纳率100%B;A;C;DE1年前查看全部
- 分子的定义是什么怎么样的分子能被称为同一种分子?如果它的原子是同位素关系呢?那组成的分子是相同还是不同
 吸烟不伤肺1年前5
吸烟不伤肺1年前5 -
 blw1234 共回答了20个问题
blw1234 共回答了20个问题 |采纳率85%分子组成与结构都相同的分子可以称为同一种分子.
好多元素有同位素,如氢元素有普通氢、重氢、超重氢,氧元素有氧-16、氧-18.在中学化学中,由同种元素的不同核素组成的物质被认为是不同种物质(分子),如普通水和重水.但是这样的不同物质除了物理性质不同以外,认为化学性质基本一样.1年前查看全部
- 1922年英国物理学家阿斯顿因质谱仪的发明、同位素和质谱的研究荣获了诺贝尔化学奖。若速度相同的同一束粒子由左端射入质谱仪
1922年英国物理学家阿斯顿因质谱仪的发明、同位素和质谱的研究荣获了诺贝尔化学奖。若速度相同的同一束粒子由左端射入质谱仪后的运动轨迹如图所示,则下列相关说法中正确的是 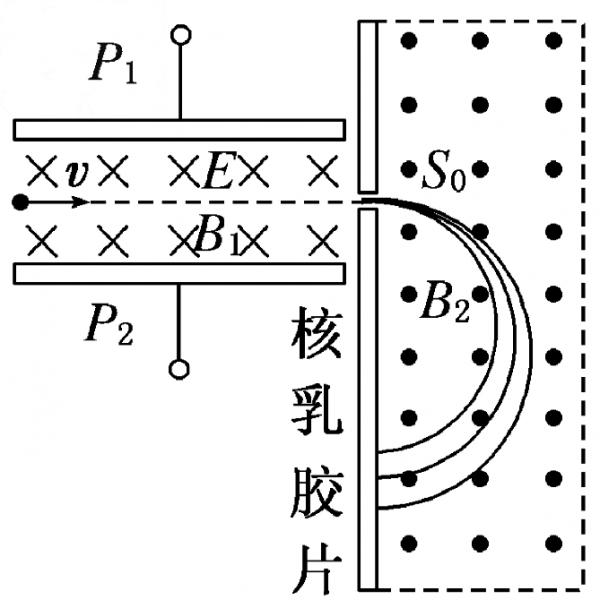 [ ]
[ ]A.该束带电粒子带负电
B.速度选择器的 P 1 极板带正电
C.在 B 2 磁场中运动半径越大的粒子,质量越大
D.在 B 2 磁场中运动半径越大的粒子,比荷 q / m 越小 埃下1年前1
埃下1年前1 -
 weimmbo 共回答了16个问题
weimmbo 共回答了16个问题 |采纳率81.3%BD1年前查看全部
- 已知碳有几种同位素?
 glider0011年前2
glider0011年前2 -
 hfhj03080728 共回答了27个问题
hfhj03080728 共回答了27个问题 |采纳率88.9%3种,碳12,碳13,碳141年前查看全部
- 钴元素包括一系列同位素,不是所有的同位素都有放射性的,不知道他们搞的是哪一种
钴元素包括一系列同位素,不是所有的同位素都有放射性的,不知道他们搞的是哪一种
这玩意还是不要在人口密集地区搞 yxd58881年前1
yxd58881年前1 -
 hddewhb 共回答了19个问题
hddewhb 共回答了19个问题 |采纳率89.5%这里是每个人自己的家园呀,我们不要一个被科学游戏污染的天空 查看原帖1年前查看全部
- 有以下说法:A.原子核放出β粒子后,转变成的新核所对应的元素是原来的同位素B.卢瑟福的α粒子散射实验揭示了原子核具有复杂
有以下说法:
A.原子核放出β粒子后,转变成的新核所对应的元素是原来的同位素
B.卢瑟福的α粒子散射实验揭示了原子核具有复杂的结构
C.光电效应实验揭示了光的粒子性
D.玻尔在研究原子结构中引进了量子化的观念
E.氢原子从低能级跃迁到高能级要放出光子
F.原子核的比结合能越大,表示原子核越稳定
其中正确的说法是______. 东晋散人1年前1
东晋散人1年前1 -
 梦幻仙儿 共回答了28个问题
梦幻仙儿 共回答了28个问题 |采纳率96.4%解题思路:同位素是质子数相同,而中子数不同的同一类原子.根据质量数和电荷数确定新核与旧核是否是同位素.卢瑟福的α粒子散射实验揭示了原子具有核式结构.玻尔在研究原子结构中引进了量子化的观念.氢原子从低能级跃迁到高能级吸收的能量只能等于初末能级之差.A、β粒子的符号是
0−1e,根据质量数和电荷数得知,原子核放出β粒子后,新核与旧核的质量数相同,而质子数多一个,新核与旧核不可能是同位素.故A错误;
B、卢瑟福的α粒子散射实验中α粒子发生大角度偏转,提出了原子具有核式结构.故B错误;
C、光电效应实验揭示了光的粒子性,故C正确;
D、玻尔在研究原子结构中引进了量子化的观念,故D正确;
E、氢原子从低能级跃迁到高能级要吸收光子.故E错误;
F、原子核的比结合能越大,表示原子核越稳定.故F正确.
故选:CDF.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 本题考查了光电效应、玻尔的理论、同位素等知识点,关键掌握这些知识点的基本概念和基本规律,难度不大.1年前查看全部
- 金刚石和石墨是不是互为同位素?
 huweicct1年前2
huweicct1年前2 -
 ww001 共回答了23个问题
ww001 共回答了23个问题 |采纳率95.7%当然不是.同位素指的是元素.金刚石和石墨是物质,物质由元素组成.同一元素的质子数相同,电子数可能不同.质子数相同,电子数不同的同一元素称为同位素.
举个反例.水和冰,形态不同,都由水分子组成,显然不能说它们是同位素哦.1年前查看全部
- H(只标明了质子数为1,没有标明质量数)和D互称为同位素,
H(只标明了质子数为1,没有标明质量数)和D互称为同位素,
H(只标明了质子数为1,没有标明质量数)是核素对吗? 尹姬1年前1
尹姬1年前1 -
 拥有空无 共回答了16个问题
拥有空无 共回答了16个问题 |采纳率87.5%H(只标明了质子数为1,没有标明质量数),这样的话,可看做是H元素,不能看做核素,因而也不能与D、T互称同位素.
化学学习也是首先确定研究对象啊,指代不明是大忌,就会出现这样的麻烦.1年前查看全部
- 同位素原子丰度比值计算元素Y的相对原子质量为M,它在自然界存在两种同位素aY,bY(a,b都是左上角标),则这两种同位素
同位素原子丰度比值计算
元素y的相对原子质量为m,它在自然界存在两种同位素ay,by(a,b都是左上角标),则这两种同位素原子在自然界的丰度之比为______
..可以***:(a-m)/(m-b) 5jrhfcdrc1年前1
5jrhfcdrc1年前1 -
 鱼和水的永恒 共回答了22个问题
鱼和水的永恒 共回答了22个问题 |采纳率100%方法1:
设丰度之比为x:1,(aY的丰度为x,bY的为1.前面不比后面) 【 楼主给的答案是后面比前面】
则M = (ax +b) / (x+1 )
M×(x+1)=ax +b Mx+M=ax +b (M-a)x=b-M 则x=(b-M)/(M-a)=(M-b)/(a-M)
方法2:
十字交叉法
aY :a M-b
M
bY :b a-M
丰度之比为 M-b
——
a-M1年前查看全部
- 一道关于化学同位素的题.如图、首先我不知道式子如何得来、其次第三小问的后两个分句不是很理解==
 神仙JOJO1年前2
神仙JOJO1年前2 -
 以ww大服人 共回答了21个问题
以ww大服人 共回答了21个问题 |采纳率90.5%式子是课本原话,去查课本,后两句就是说同位素的不同只影响核反应性质,物质状态的不同只影响化学性质1年前查看全部
- 1.已知某元素一种同位素的n个原子的质量为m g,其相对原子质量为M,则氯元素的一种同位素(上37)Cl的一个院子的质量
1.已知某元素一种同位素的n个原子的质量为m g,其相对原子质量为M,则氯元素的一种同位素(上37)Cl的一个院子的质量为____g.
2.自然界崩有两种同位素:(上10)B和(上11)B 又测得崩的相对原子质量是10.8.求10B和11B的原子个数比
3.已知氢的三种同位素中,(上3下1)H(T)是人工制得,在自然界中并不存在.氢元素的相对原子质量为1.008.(上1下1)则H占自然界中氢元素的原子个数的分数和质量分数分别为多少?
4.已知氯元素的近似相对原子质量为35.5,求由(上23)Na、(上35下17)Cl、(上37下17)Cl构成的10gNaCl中含有的(上37下17)Cl负离子为多少克?
“上”代表质量数 “下”代表质子数 当帅哥容易么1年前1
当帅哥容易么1年前1 -
 smalldogdog 共回答了12个问题
smalldogdog 共回答了12个问题 |采纳率100%(1)37m/nM
(2)1/4
(3)数量比99.2% 质量比98.41%
(4)1.58g1年前查看全部
- 同位素的化学性质相似,物理性质不同 是否正确
 xpmao1年前1
xpmao1年前1 -
 活来又vv去 共回答了10个问题
活来又vv去 共回答了10个问题 |采纳率90%同位素之间是核外电子数相同而中子数不同,核素的质量数是核外电子数与中子数的总和,所以同位素的质量数不同 (质量,应该算是物理性质吧...) 同位素的化学性质是由电子数决定的,所以相同.1年前查看全部
- x元素原子核内质子数35,它有中子数为46和44同位素,x相对原子质量79.9,中子数为44的原子在x元素中所占的物质的
x元素原子核内质子数35,它有中子数为46和44同位素,x相对原子质量79.9,中子数为44的原子在x元素中所占的物质的量分数为
 yaya_0551年前1
yaya_0551年前1 -
 niliwei 共回答了23个问题
niliwei 共回答了23个问题 |采纳率100%X元素的两种同位素的相对原子质量分别为81和79
设中子数为44的原子在x元素中所占的物质的量分数为a,那么中子数为46的原子在x元素中所占的物质的量分数为1-a
81a+79(1-a)=79.9
解得a=45%1年前查看全部
- 硅有Si28和Si30两种同位素,氯有Cl35和Cl37两种同位素,则硅和氯化合生成的分子共有几种
 经互会轨缝图1年前1
经互会轨缝图1年前1 -
 fxygl 共回答了18个问题
fxygl 共回答了18个问题 |采纳率88.9%10种不同分子,9种不同分子量.1年前查看全部
- 天然元素cu是由天然铜是由同位素Cu(质量数为63)和Cu(质量数为65)组成的,铜元素的相对原子质量为63.55,则这
天然元素cu是由
天然铜是由同位素Cu(质量数为63)和Cu(质量数为65)组成的,铜元素的相对原子质量为63.55,则这两种同位素原子的物质的量之比 randy355071年前1
randy355071年前1 -
 绿叶恋爱 共回答了25个问题
绿叶恋爱 共回答了25个问题 |采纳率84%63x+65y=63.55(x+y)
x/y=1.45/0.55=29/111年前查看全部
- 谁能告诉我氢元素的同位素是什么?它们原子核内分别有几个中子?
 nick_yangjl1年前2
nick_yangjl1年前2 -
 董邦祥 共回答了24个问题
董邦祥 共回答了24个问题 |采纳率75%氕 氘 氚啊
分别是0 ,1,2,1年前查看全部
- 已知(16)O和(18)O是氧的同位素,有(16)O、(18)O、H、T、D五种原子,可以构成双氧水分子,其种类有:
已知(16)O和(18)O是氧的同位素,有(16)O、(18)O、H、T、D五种原子,可以构成双氧水分子,其种类有:
A、12种
B、14种
C、16种
D、18种
-------------------------------------------------------------
看起来貌似是排列与组合?如果是这样算的话请给出计算过程 hnxinlan1年前7
hnxinlan1年前7 -
 好玩PKWC笑场 共回答了19个问题
好玩PKWC笑场 共回答了19个问题 |采纳率94.7%H-O-O-H
用1、2、3分别代表H、D、T
用16、18代表(16)O、(18)O
若2个H一样,即3种情况:1-1,2-2,3-3
那么,放在中间的2个O原子各有3种情况,即,16-16,18-18,16-18
所以,有3×3=9种
若2个H不一样,即3种情况:1-2,1-3,2-3
那么,放在中间的2个O原子各有4种情况,即,16-16,18-18,16-18,18-16
所以,有3×4=12种
因此,共有21种
这道题目出来,一直是有问题的,就在于,1-16-18-2与1-18-16-2是不一样的1年前查看全部
- (2007•武汉模拟)一个静止的放射性同位素的原子核15P衰变为14Si,另一静止的天然放射性元素的原子核 2
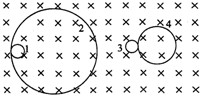 (2007•武汉模拟)一个静止的放射性同位素的原子核15P衰变为14Si,另一静止的天然放射性元素的原子核
(2007•武汉模拟)一个静止的放射性同位素的原子核15P衰变为14Si,另一静止的天然放射性元素的原子核
Th衰变为23490
Pa,在同一磁场中,得到衰变后粒子的轨迹为1、2、3、4,如图所示.轨迹1、2、3、4依次是( )23491
A.
Pa、电子、正电子、14Si23491
B.
Pa、电子、14Si、正电子23491
C.14Si、正电子、电子、
Pa23491
D.正电子、14Si、
Pa、电子23491 asteriskzyf1年前1
asteriskzyf1年前1 -
 pangqiankunq 共回答了18个问题
pangqiankunq 共回答了18个问题 |采纳率94.4%解题思路:放射性元素的原子核,沿垂直于磁场方向放射出一个粒子后进入匀强磁场,在洛伦兹力的作用下都做匀速圆周运动.放射性元素放出粒子,动量守恒,由半径公式r=[mv/qB]=[P/qB],分析α粒子和β粒子与反冲核半径关系,根据洛伦兹力分析运动轨迹是内切圆还是外切圆,判断是哪种衰变.放射性元素放出正电子时,正粒子与反冲核的速度相反,而电性相同,则两个粒子受到的洛伦兹力方向相反,两个粒子的轨迹应为外切圆.
而放射性元素放出β粒子时,β粒子与反冲核的速度相反,而电性相反,则两个粒子受到的洛伦兹力方向相同,两个粒子的轨迹应为内切圆.
放射性元素放出粒子时,两带电粒子的动量守恒.由半径公式r=[mv/qB]=[P/qB],可得轨迹半径与动量成正比,与电量成反比,而正电子和β粒子的电量比反冲核的电量小,则正电子和β粒子的半径比反冲核的半径都大,故轨迹1、2、3、4依次是:
23491Pa、电子、14Si、正电子.
故选:B.点评:
本题考点: 原子核衰变及半衰期、衰变速度;牛顿第二定律;向心力;带电粒子在匀强磁场中的运动.
考点点评: 放射性元素放射后,两带电粒子的动量是守恒.正好轨迹的半径公式中也有动量的大小,所以可以研究半径与电荷数的关系.1年前查看全部
- 某元素的一种同位素X,含N个中子,他与H原子组成HmX分子.在agHmX中所含质子的物质的量是.
 东漂1年前1
东漂1年前1 -
 水间得语 共回答了26个问题
水间得语 共回答了26个问题 |采纳率88.5%少个条件吧,要知道X的质量数,否则没法做,我假设质量数为A
答案:a/(A+m)(A-N+m)mol
解析:A是某元素的一种同位素X的原子质量数,1×m 是m个H原子的原子质量数
所以(A+m)是一个 HmX 的相对分子质量,换句话说 HmX 的摩尔质量为(A+m)g/mol
则 a g HmX 分子的物质的量即为 a/(A+m)mol
A是某元素的一种同位素X的原子质量数,N是其一个原子的中子数
所以一个X原子的质子数为(A-N),一个 HmX 分子的质子数为(A-N+m)
所以 a/(A+m)mol HmX分子所含有的质子的物质的量为a/(A+m)(A-N+m)mol
即 a gHmX中含质子的物质的量是a/(A+m)(A-N+m)mol1年前查看全部
- O2和O3是不是同位素,为什么?
 hc_qiqi1年前5
hc_qiqi1年前5 -
 g352e 共回答了19个问题
g352e 共回答了19个问题 |采纳率94.7%臭氧与氧气互为同素异形体.
臭氧具有不稳定特性和很强的氧化能力.臭氧是由一个氧分子(O2)携带一个氧原子(O)组成.1年前查看全部
- 关于化学的,什么是同系物、同分异构体、同位素、同素异形体.请举例出各个问题的例子.
 nethurricane1年前4
nethurricane1年前4 -
 sbuuyq 共回答了12个问题
sbuuyq 共回答了12个问题 |采纳率91.7%同系物仅应用于有机化学,是指“结构相似的,分子结构之间仅相差一个或若干个-CH2-的分子”,当然苯酚和苯醇除外比如甲烷和丙烷就是结构相似并相差两个-CH2-同分异构体也是有机化学里的概念,是指分子是相同但结构不同的不同分子,比如乙酸和甲酸甲酯同位素是指同种元素的不同原子,也就是质子数相同中子数不同的原子,比如氕氘氚同素异形体是指相同元素的不同单质,比如石墨和金刚石1年前查看全部
- (2009•丰台区二模)同位素的发现为探明许多生命的奥秘起了很重要的作用.
(2009•丰台区二模)同位素的发现为探明许多生命的奥秘起了很重要的作用.
(1)用18O标记二氧化碳,使其参与光合作用,再经有氧呼吸,则18O转移的途径是______
A.C18O2→(CH218O)→H218O
B.C18O2→(CH218O)→C18O2
C.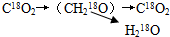
D.C18O2→18O2
(2)如果用含15N的蛋白质饲料饲养体内不含15N的大白鼠,较长一段时间后,从大白鼠的组织中分离出下列物质,其中含有15N的是______(多选)
A.脂肪酸B.淀粉酶C.肌糖元D.生长激素
(3)1952年,赫尔希和蔡斯利用同位素标记完成了噬菌体侵染细菌的实验,实验的部分过程如下:
①写出以上实验的部分操作过程.
第一步:______
第二步:______
②以上实验的最后结果说明______.
③现已制备好分别含3H、14C、15N、18O、32P、35S等6种放射性同位素的培养基,植物愈伤组织细胞,动物组织细胞,大肠杆菌及其他必需的器材.请从中选取所需材料,实现第一步操作.
实验原理:______.
实验步骤:
A.______.
B.______.
C.______. fatd1年前1
fatd1年前1 -
 春花秋月夏莲冬雪 共回答了17个问题
春花秋月夏莲冬雪 共回答了17个问题 |采纳率94.1%解题思路:噬菌体侵染细菌的过程:吸附→注入(注入噬菌体的DNA)→合成(控制者:噬菌体的DNA;原料:细菌的化学成分)→组装→释放.噬菌体侵染细菌的实验步骤:分别用35S或32P标记噬菌体→噬菌体与大肠杆菌混合培养→噬菌体侵染未被标记的细菌→在搅拌器中搅拌,然后离心,检测上清液和沉淀物中的放射性物质.(1)二氧化碳是光合作用的原料,在暗反应中合成有机物;有机物在有氧呼吸的第二阶段,形成二氧化碳和氢,所以18O转移的途径是C18O2→(CH218O)→C18O2.
(2)脂肪酸和肌糖元的组成元素只有C、H、O三种,而淀粉酶和生长激素的组成元素有C、H、O、N四种,所以用含15N的蛋白质饲料饲养体内不含15N的大白鼠,较长一段时间后,从大白鼠的组织中分离出的淀粉酶和生长激素中含有15N.
(3)①噬菌体侵染细菌的实验操作过程是:第一步:用35S标记噬菌体的蛋白质外壳;第二步:用35S标记的噬菌体与细菌混合.
②实验结果说明噬菌体的蛋白质外壳没有进入到细菌体内.
③实验原理:由于噬菌体没有细胞结构,只能在细菌细胞内进行寄生生活.
实验步骤:A.选取含35S放射性同位素的培养基进行高压蒸气灭菌;B.向培养基中接种大肠杆菌,置于适宜的环境中培养;C.用上述大肠杆菌培养噬菌体.
故答案为:
(1)B
(2)BD
(3)①第一步:用35S标记噬菌体的蛋白质外壳
第二步:用35S标记的噬菌体与细菌混合
②噬菌体的蛋白质外壳没有进入到细菌体内
③实验原理:噬菌体只能在细菌细胞内进行寄生
实验步骤:
A.选取含35S放射性同位素的培养基进行高压蒸气灭菌
B.向培养基中接种大肠杆菌,置于适宜的环境中培养
C.用上述大肠杆菌培养噬菌体点评:
本题考点: 噬菌体侵染细菌实验;蛋白质的结构和功能的综合;光反应、暗反应过程的能量变化和物质变化.
考点点评: 本题考查同位素示踪、噬菌体侵染细菌实验的相关知识,意在考查学生的识记能力和判断能力,运用所学知识综合分析问题和解决问题的能力.1年前查看全部
- 下列叙述正确的是( )A. 168O2和 188O2互为同位素,物理性质相似B.CO2和CO属于同素异形体,所以性质不
下列叙述正确的是( )
A.
O2和168
O2互为同位素,物理性质相似188
B.CO2和CO属于同素异形体,所以性质不同
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s);△H>0.所以石墨比金刚石稳定 超客博客1年前1
超客博客1年前1 -
 g0am0 共回答了9个问题
g0am0 共回答了9个问题 |采纳率88.9%解题思路:A、质子数相同,中子数不同的同种元素的不同原子互称同位素;
B、CO2和CO都是化合物,不是同一种元素组成的结构不同的单质;
C、明矾没有强氧化性不能杀菌消毒;
D、根据物质具有的能量越高越不稳定分析.A、质子数相同,中子数不同的同种元素的不同原子互称同位素,
168O2和
188O2互为都是分子,不是同位素,故A错误;
B、CO2和CO都是化合物,不是同一种元素组成的结构不同的单质,故B错误;
C、明矾中的铝离子在水中水解生成氢氧化铝胶体能吸附水中的悬浮颗粒,从而起到净水作用,但是明矾没有强氧化性不能杀菌消毒,漂白粉具有强氧化性能杀菌消毒,故C错误;
D、已知C(石墨,s)=C(金刚石,s)△H>0,说明石墨的能量比金刚石的低,所以石墨稳定,故D正确;
故选D.点评:
本题考点: 同位素及其应用;同素异形体;反应热和焓变;氯、溴、碘及其化合物的综合应用;镁、铝的重要化合物.
考点点评: 本题考查了同位素、酮素异形体的概念、明矾净水、物质稳定性的判断,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.1年前查看全部
- 中和热的定义是什么?互为同位素的原子属于同种元素嘛?
 qw03121年前1
qw03121年前1 -
 banyuetan315 共回答了17个问题
banyuetan315 共回答了17个问题 |采纳率94.1%酸与碱中和生成1molH2O的反应热叫做中和热
应该是稀酸和稀碱.
属于,但不是同种原子1年前查看全部
- 下列叙述错误的是( )A. 13C和14C属于同一种元素,它们互为同位素B. 1H和2H是不同的核素,它们的质子数相等
下列叙述错误的是( )
A. 13C和14C属于同一种元素,它们互为同位素
B. 1H和2H是不同的核素,它们的质子数相等
C. 14C和14N的质量数相等,它们的中子数不等
D. 6Li和7Li的电子数相等,中子数也相等 wjlwz31年前1
wjlwz31年前1 -
 misskongkong 共回答了9个问题
misskongkong 共回答了9个问题 |采纳率100%解题思路:根据原子表示法的知识,元素符号左上角数字表示质量数,左下角数字表示质子数,质量数-质子数=中子数,质子数相同而中子数不同的同种元素的原子互为同位素.A、13C和14C属于同一种元素,质子数相同而中子数不同,它们互为同位素,故A正确;
B、1H和2H是氢元素的不同核素,质子数相同均为1,故B正确;
C、14C和14N的质量数相等,质子数分别为6、7,中子数分别为:14-6=8、14-7=7,它们的中子数不等,故C正确;
D、6Li和7Li的电子数相等均为3,中子数分别为:6-3=3、7-3=4,不相等,故D错误.
故选D.点评:
本题考点: 同位素及其应用;质量数与质子数、中子数之间的相互关系.
考点点评: 本题是对教材概念的考查,可以根据所学知识进行回答,较简单.1年前查看全部
- 下图表示用同位素32P、32S和31P、35S分别标记噬菌体和大肠杆菌的DNA和蛋白质,然后进行“噬菌体侵染细菌的实验”
下图表示用同位素32P、32S和31P、35S分别标记噬菌体和大肠杆菌的DNA和蛋白质,然后进行“噬菌体侵染细菌的实验”,侵染后产生的子代噬菌体和亲代噬菌体形态完全相同,而子代噬菌体的DNA分子与蛋白
 hhumour1年前1
hhumour1年前1 -
 liguoyang123 共回答了20个问题
liguoyang123 共回答了20个问题 |采纳率85%亲代噬菌体中,DNA注入大肠杆菌,而蛋白质外壳留在菌体外.所以大肠杆菌中会含有32P和31P,32P和31P都可能作为子代噬菌体DNA的材料.但由于只有35S,所以蛋白质中只能含有35S.1年前查看全部
- 为什么天然存在的某种元素里,无论是游离态还是化合态,各种同位素所占的原子个数百分比一般是不变的?
 sunboylhb1年前4
sunboylhb1年前4 -
 huiyao 共回答了17个问题
huiyao 共回答了17个问题 |采纳率82.4%地球上的元素丰度(包括不同同位素的丰度)大体上决定于形成太阳系的前太阳星云的元素组成.除了氢氦之外,所有的重元素都是之前存在的恒星内部的核反应产生的,这些恒星在短时间内以超星爆发的形式抛出大量物质,这些物质形成的星云在成份上比较均一.太阳系就是从这样一个成份相对均一的星云中诞生的.
化学变化是不会改变同位素丰度的,而除了某些同位素的放射性衰变之外,地表不具备自然发生核反应的条件.故地表天然存在的同位素丰度大体稳定.不过有些原始陨石中可能存在没有经历太阳系形成时的均化过程的颗粒物质,其元素丰度和natural abundance有较大偏差.1年前查看全部
- ★先看大题图:1)质子数与中子数不相等的核素有__________________;互称同位素的核素有_________
★先看大题图:

1)质子数与中子数不相等的核素有__________________;互称同位素的核素有___________________.
中子数相等的不同元素的原子是_________________.
2)现有10.0g由
和

组成的水分子的物质的量为________;其中含质子数为________NA;中子数为_______________个.
3)由

和

构成的CO2摩尔质量为______________.标准状况下9.2g这种CO2所占有的体积约为_______________. 雪花美人1年前1
雪花美人1年前1 -
 Shabl 共回答了19个问题
Shabl 共回答了19个问题 |采纳率84.2%h1 c14 o18;hi&h2;o16&o18
0.2,2,2na
50,0.184*22.41年前查看全部
- 核素与同位素的区别
 亲亲宝贝BB1年前2
亲亲宝贝BB1年前2 -
 单Cheng票 共回答了16个问题
单Cheng票 共回答了16个问题 |采纳率87.5%核素是指具有一定数目质子和一定数目中子的一种原子.
同位素是指质子数相同,中子数不同的原子,例如C12、C13和C141年前查看全部
- 同种元素的同位素之间组成的化合物有什么区别?
同种元素的同位素之间组成的化合物有什么区别?
比如:氢中的H,D,T
碳中的C-12,C-13
氯中的Cl-35,Cl-37
由他们组成的同种化合物是同一种化合物吗?(表达的不清楚,理解即可)
他们的理化性质相似吗? uuhhh1年前2
uuhhh1年前2 -
 雨婷uu 共回答了19个问题
雨婷uu 共回答了19个问题 |采纳率89.5%不算化合物,仍然算单质.你列举的这些都是天然存在的同位素,氢,碳,氯单质中本来就含有这些同位素原子.
它们的化学性质相似(并不是完全相同,因为实际上键能与原子质量相关,尤其对于氢的同位素原子,这种“同位素效应”非常明显),故用化学方法难以分开.物理性质有一定区别,主要体现在密度,熔沸点,放射性衰变等方面(你的例子中,只有T会衰变).1年前查看全部
- 如何理解元素、原子、核素、分子、同位素?
 adld04151年前2
adld04151年前2 -
 威尔士gg 共回答了20个问题
威尔士gg 共回答了20个问题 |采纳率80%元素:所有核电荷数(即质子数)相同的原子的总称
原子:参与化学反应的最小粒子,由原子核和核外电子组成.
核素:所有核内质子数和中子数均相同的原子的总称(注意中子数必须相同)
分子:保持物质物理和化学性质的最小粒子,由原子通过成键形成
同位素:核电荷数(即质子数)相同,但中子数不同的核素,它们在周期表中在同一格.如C-12和C-14,二者核内均有6个质子,但分别有6个和8个中子1年前查看全部
- 为了估算水库中水的体积,可取一瓶无毒的放射性同位素的水溶液,测得瓶内溶液每分钟衰变
为了估算水库中水的体积,可取一瓶无毒的放射性同位素的水溶液,测得瓶内溶液每分钟衰变
6×107次,已知这种同位素的半衰期为2天.现将这瓶溶液倒入水库,8天后可以认为已均匀分布在水库中,这时取1.0m3水库中的水样,测得水样每分钟衰变20次.同此可知水库中水的体积为_________m3. s23381年前1
s23381年前1 -
 cook-fish 共回答了18个问题
cook-fish 共回答了18个问题 |采纳率83.3%由于其半衰期是2,
故8天之后该溶液每分钟衰变总次数为:N=6*10^7*(1/2)^4=3.75*10^6 次
故由比例关系得:N/n=V总/V样
故水库水的体积为:V总=N*V样/n=3.75*10^6*1/20=1.875*10^5m^31年前查看全部
- 某元素的一种同位素R的质量数为A,含有N个中子.此同位素R可与质量数为18的O形成化合物R2O3,则WgR2O3中含
某元素的一种同位素R的质量数为A,含有N个中子.此同位素R可与质量数为18的O形成化合物R2O3,则WgR2O3中含
有质子-------mol,含有中子---------mol 我知言1年前1
我知言1年前1 -
 平宝宝 共回答了14个问题
平宝宝 共回答了14个问题 |采纳率85.7%因为元素R的质量数为A,所以R2O3的相对分子质量为A*2+18*3=A*2+54.所以WgR2O3的物质的量为W/(2A+54)mol.R的质量数为A,中子数为N,所以质子数为(A-N).
一个R2O3(分子)中含有中子2N+3*10=2N+30个.所以WgR2O3含有的中子数为(2N+30)*W/(2A+54)mol.
一个R2O3(分子)中含有质子2(A-N)+3*8=2(A-N)+24.所以WgR2O3含有的质子数为(2(A-N)+24)*W/(2A+54)mol.1年前查看全部
- 如图是动物某分泌细胞.向细胞内注射用放射性同位素3H标记的亮氨酸,一段时间后,在细胞外检测到含有放射性的分泌蛋白质.请回
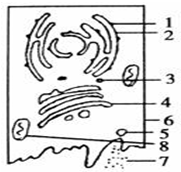 如图是动物某分泌细胞.向细胞内注射用放射性同位素3H标记的亮氨酸,一段时间后,在细胞外检测到含有放射性的分泌蛋白质.请回答下列问题:(在[]内填写图中序号,并在序号后写出该结构的名称)
如图是动物某分泌细胞.向细胞内注射用放射性同位素3H标记的亮氨酸,一段时间后,在细胞外检测到含有放射性的分泌蛋白质.请回答下列问题:(在[]内填写图中序号,并在序号后写出该结构的名称)
(1)最初的时间里,被3H标记的亮氨酸会出现在______.
(2)[3]和[5]都叫囊泡,分别由图中的______和______形成.
(3)此后放射性物质依次出现在(写标号)______结构里.
(4)2、4、6、8等结构和功能上是紧密联系的统一整体,被称为______. 五岳归来1年前1
五岳归来1年前1 -
 舞鬼者maxxis 共回答了23个问题
舞鬼者maxxis 共回答了23个问题 |采纳率100%解题思路:据图可知,图示为分泌分泌蛋白的细胞,图中1、2、3、4、5、6、7分别代表的结构是核糖体、内质网、囊泡、高尔基体、囊泡、细胞膜、分泌蛋白、线粒体.(1)H3标记的亮氨酸首先在附着在内质网上核糖体上合成分泌蛋白.
(2)据图可知,囊泡[3]来自于内质网,囊泡[5]来自于高尔基体.
(3)分泌蛋白在核糖体合成后,然后在内质网和高尔基体加工,故此后放射性物质依次出现在加工场所内质网和高尔基体,最终经细胞膜分泌到细胞外.
(4)生物膜系统是指在真核细胞中,细胞膜、核膜以及内质网、高尔基体、线粒体等由膜围绕而成的细胞器,在结构和功能上是紧密联系的统一整体,它们形成的结构体系,称为细胞的生物膜系统.
故答案为:
(1)[1]附着在内质网上的核糖体
(2)[2]内质网[4]高尔基体
(3)2、3、4、5
(4)生物膜系统点评:
本题考点: 细胞器之间的协调配合.
考点点评: 本题结合分泌蛋白合成与分泌过程图,考查细胞结构和功能、细胞器之间的协调配合,要求考生识记细胞中各结构的图象,能准确判断图中各结构的名称;识记细胞中各细胞器的功能,掌握分泌蛋白的合成与分泌过程,能结合所学的知识准确答题.1年前查看全部
- 下列各组物质中属于同位素的是( )
下列各组物质中属于同位素的是( )
A.O2和O3
B.正丁烷和异丁烷
C.12C和14C
D.Na2O和Na2O2 Cecilia_rr1年前1
Cecilia_rr1年前1 -
 wdmzjlc 共回答了16个问题
wdmzjlc 共回答了16个问题 |采纳率81.3%解题思路:根据质子数相同,而中子数不同的原子互为同位素来分析解答.A、O2和O3是由氧元素组成的不同单质,互为同素异形体,故A错误;
B、正丁烷与异丁烷是分子式相同,但结构不同的有机化合物,互为同分异构体,故B错误;
C、12C和14C是质子数相同,但中子数不同的原子,互为同位素,故C正确;
D、Na2O和Na2O2是由钠元素和氧元素组成的不同的化合物,故D错误;
故选:C.点评:
本题考点: 同位素及其应用.
考点点评: 本题主要考查同位素、同素异形体、同分异构体等概念,明确概念的要点即可解答,难度不大.1年前查看全部
- 几道生物遗传题1.在真核和原核细胞中遗传信息的遗传方向、2.用同位素分别标记什么物质可以分别来研究DNA复制和转录?3.
几道生物遗传题
1.在真核和原核细胞中遗传信息的遗传方向、2.用同位素分别标记什么物质可以分别来研究DNA复制和转录?3.DNA病毒侵入宿主细胞时遗传信息的传递方向、4.逆转录病毒的侵入宿主细胞时遗传信息的传递方向、5.不含逆转录酶的RNA病毒侵入宿主细胞时遗传信息的传递方向 akencz1年前1
akencz1年前1 -
 并不重要 共回答了19个问题
并不重要 共回答了19个问题 |采纳率89.5%1,DNA>RNA>蛋白质.2,分别标记DNA和RNA.3,DNA>RNA>蛋白质.4,RNA>DNA>RNA>蛋白质.5,RNA>蛋白质产生逆转录酶,然后逆转录RNA>DNA.1年前查看全部
- 铜有两种天然同位素:质量数为63,中子数为29的铜和质量数为65,中子数为29的铜.则质量数为65的铜的质量分数约为?
 Rochawi剑1年前1
Rochawi剑1年前1 -
 清青123456 共回答了16个问题
清青123456 共回答了16个问题 |采纳率93.8%设63的铜x,65铜为1-x
63*x+65(1-x)=铜相对原子质量
求x
您的题目不完整
欢迎追问~1年前查看全部
- 质谱仪是测量带电粒子的质量和分析同位素的重要工具.如图所示为质谱仪的原理示意图.现利用这种质谱仪对氢元素进行测量.氢元素
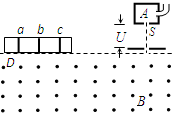 质谱仪是测量带电粒子的质量和分析同位素的重要工具.如图所示为质谱仪的原理示意图.现利用这种质谱仪对氢元素进行测量.氢元素的各种同位素从容器A下方的小孔S无初速度飘入电势差为U的加速电场.加速后垂直进入磁感应强度为B的匀强磁场中.氢的三种同位素氕、氘、氚的电量之比为1:1:1,质量之比为1:2:3,它们最后打在照相底片D上,形成a、b、c三条“质谱线”.关于三种同位素进入磁场时速度大小的排列顺序和a、b、c三条“质谱线”的排列顺序,下列判断正确的是( )
质谱仪是测量带电粒子的质量和分析同位素的重要工具.如图所示为质谱仪的原理示意图.现利用这种质谱仪对氢元素进行测量.氢元素的各种同位素从容器A下方的小孔S无初速度飘入电势差为U的加速电场.加速后垂直进入磁感应强度为B的匀强磁场中.氢的三种同位素氕、氘、氚的电量之比为1:1:1,质量之比为1:2:3,它们最后打在照相底片D上,形成a、b、c三条“质谱线”.关于三种同位素进入磁场时速度大小的排列顺序和a、b、c三条“质谱线”的排列顺序,下列判断正确的是( )
A.进入磁场时速度从大到小排列的顺序是氚、氘、氕
B.进入磁场时速度从大到小排列的顺序是氕、氘、氚
C.a、b、c三条质谱线依次排列的顺序是氕、氘、氚
D.a、b、c三条质谱线依次排列的顺序是氚、氘、氕 拍手跳1年前1
拍手跳1年前1 -
 qsz1981 共回答了18个问题
qsz1981 共回答了18个问题 |采纳率100%解题思路:根据qU=[1/2]mv2求出粒子进入偏转磁场的速度,知道三种粒子进入磁场的速度大小关系,再根据qvB=m
求出R与什么因素有关,从而得出a、b、c三条“质谱线”的排列顺序.v2 R A、根据qU=[1/2]mv2得,v=
2qU
m.比荷最大的是氕,最小的是氚,所以进入磁场速度从大到小的顺序是氕、氘、氚.故A错误、B正确.
C、进入偏转磁场有qvB=m
v2
R,
解得:R=[mv/qB]=
1
B
2mU
q,氕比荷最大的,轨道半径最小,c对应的是氕,氚比荷最小,则轨道半径最大,a对应的是氚.故C错误,D正确.
故选:BD.点评:
本题考点: 质谱仪和回旋加速器的工作原理.
考点点评: 解决本题的关键知道根据qU=[1/2]mv2可求出速度,知道速度与比荷有关,以及知道根据qvB=mv2R可求出轨道半径与比荷有关.1年前查看全部
- 氧的同位素18 8 O的质子数是多少?
 联翩1年前1
联翩1年前1 -
 13518090127 共回答了15个问题
13518090127 共回答了15个问题 |采纳率100%氧元素有三种不同的同位素,但它的质子数是不会变的,就是8,标在元素的左下标,左上标的18是它的质量数,也就是说它的中子数为10.1年前查看全部
- 在学同位素的时候提到的原子百分率是什么意思
 yeminjun1年前1
yeminjun1年前1 -
 末路菜花 共回答了13个问题
末路菜花 共回答了13个问题 |采纳率84.6%以原子百分数表示的地壳中某种元素各同位素的相对含量.例如,氧的同位数16O、17O、18O的原子百分数(%)为99.76、0.04和0.20.
计算元素的相对原子质量会用到
元素的相对原子质量=MA·a%+MB·b%+MC·c%+…(式中MA,MB,MC…是各同位素的相对原子质量,a%,b%,c%…是各同位素原子百分数1年前查看全部
- 甲烷与丙烷 A.互为同位素 B.互为同素异形体 C.互为同分异构体 D.互为同系物
甲烷与丙烷 A.互为同位素 B.互为同素异形体 C.互为同分异构体 D.互为同系物
16上8下 O 与 17上8下 O 互为? z51791年前4
z51791年前4 -
 lship 共回答了19个问题
lship 共回答了19个问题 |采纳率100%D
A
如还有疑问~欢迎追问1年前查看全部
- 下列各组物质中,互称为同位素的是( )
下列各组物质中,互称为同位素的是( )
A.氧气和臭氧
B.
C和126
C146
C.甲烷和乙烷
D.正丁烷和异丁烷 等待感觉1年前1
等待感觉1年前1 -
 清冷的白月亮 共回答了18个问题
清冷的白月亮 共回答了18个问题 |采纳率100%解题思路:有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素;具有相同分子式而结构不同的化合物互为同分异构体;
结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
相同元素组成,不同形态的单质互为同素异形体.A.氧气和臭氧都是由氧元素形成的不同单质,互为同素异形体,故A错误;
B.126C和146C质子数相同,中子数不同,互为同位素,故B正确;
C.甲烷和乙烷结构相似,分子组成相差1个“CH2”原子团,互为同系物,故C错误;
D.正丁烷和异丁烷分子式相同,结构不同,互为同分异构体,故D错误,
故选B.点评:
本题考点: 同位素及其应用.
考点点评: 本题考查同位素、同素异形体、同分异构体、同系物的概念,难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.1年前查看全部
- 互为同位素的原子质子数一定相同
 明天收购dd1年前5
明天收购dd1年前5 -
 menghuo123 共回答了12个问题
menghuo123 共回答了12个问题 |采纳率91.7%具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.这是定义.首先,同位素的适用范围是核素,不是原子;其次,质量数相同只是满足同位素的条件之一,还要看中子数是否相同,才可以判断1年前查看全部
- 铀元素的平均相对原子质量为238.0289 它有三种同位素 238-92U 235-92U 234-92U,其中中子数为
铀元素的平均相对原子质量为238.0289 它有三种同位素 238-92U 235-92U 234-92U,其中中子数为146的同位素所占原子百分数应最接近于
A 99% B 50% C 10% D无法确定 转瞬即逝anni1年前1
转瞬即逝anni1年前1 -
 老--屋 共回答了16个问题
老--屋 共回答了16个问题 |采纳率81.3%铀的质子数为92,中子数为146,则质量数为238.三个同位素中的第一种.
平均相对原子质量=质量数1×原子百分数+质量数2×原子百分数+质量数3×原子百分数+……
这个只有三个,用三个就可以了.
238.0289=238×原子百分数+235×原子百分数+234×原子百分数
其实不用算,就可以看出来,为A.1年前查看全部
- 用含同位素氧18的甲醇与浓硫酸和冰醋酸混合加热,其化学方程式为多少?生成有机物的名称为___,在反应
用含同位素氧18的甲醇与浓硫酸和冰醋酸混合加热,其化学方程式为多少?生成有机物的名称为___,在反应
中甲醇提供___,醋酸提供___,从而生成水 albertxian1年前4
albertxian1年前4 -
 yaotianyue 共回答了19个问题
yaotianyue 共回答了19个问题 |采纳率94.7%浓硫酸,加热
CH3(18)OH+CH3COOH===>CH3CO(18)OCH3+H2O,18指的同位素
乙酸甲酯
甲醇提供H,醋酸提供羟基1年前查看全部
- 同位素就是质子数相同中子数不同的原子 这话哪错了?
 chenyuanchi1101年前3
chenyuanchi1101年前3 -
 若是偶然 共回答了19个问题
若是偶然 共回答了19个问题 |采纳率89.5%科技名词定义
中文名称:同位素 英文名称:isotope 定义1:具有相同原子序数(即质子数相同,因而在元素周期表中的位置相同),但质量数不同,亦即中子数不同的一组核素.所属学科:电力(一级学科);核电(二级学科) 定义2:中子数不同的同一种元素的一种原子形式,包括稳定同位素和放射性同位素.所属学科:生态学(一级学科);全球生态学(二级学科)1年前查看全部
- 1.某元素的各种同位素原子的近似相对原子质量怎么求?2.某元素的近似相对原子质量怎么求?
1.某元素的各种同位素原子的近似相对原子质量怎么求?2.某元素的近似相对原子质量怎么求?
3.元素的种类取决于 a微粒电子书 b微粒质子数 c原子质量数 d原子核电荷数
4.相对原子表中H喂1.00794这是 a一种氢原子的相对原子质量
b所有氢原子质量的平均值
c三种氢原子的平均相对原子质量
d氢元素的平均相对原子质量
写好编号,要直观易懂.谢 blindunicorn1年前2
blindunicorn1年前2 -
 ss上机l 共回答了27个问题
ss上机l 共回答了27个问题 |采纳率92.6%就是质量数
如有质量数为a(含量x%)和b(含量y%)及c(含量z%)的原子组成:M=x%a+y%b+z%c
d
d1年前查看全部
大家在问
- 1In 1983,a huge ape model was put on the Empire State Buildin
- 2在三角形ABC中,AB=2厘米,AC=1厘米,角平分线AD=1厘米,求ABC的面积
- 3预备年级第一学期英语重点,词组,语法,时态.
- 4有一种蓝色晶体它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点而CN-l离子位于立方体的棱上
- 5(2010•嘉兴)若自然数n使得三个数的加法运算“n+(n+1)+(n+2)”产生进位现象,则称n为“连加进位数”.例如
- 6为什么圆内一条弦所对的劣弧和优弧分别所对的圆周角的读书之和等于180度?请证明!
- 7我的学校生活 作文
- 8下列方法中,不能用于实验室制取氨气的是 A.将烧瓶中的浓氨水加热 B.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 C.在
- 9红色方框里的题.
- 10已知氧气的密度为1.43g/L,空气的密度为1.29g/L,一般情况下,正常成年人每分钟吸入8L氧气.问正常成年人每分钟
- 11英语翻译中间有三个空有没有大虾推荐我加一个英语圈
- 12-a的丨m-3丨的方b与ab丨4n丨方式同类项,且m与n互为负倒数,求n-mn-3(-m-n)-(-m)-11的值
- 13用英语翻译1.我叔叔是邮递员.他每天早晨送信(deliver)2.吸烟有害,请不要吸烟(be harmful to)3.
- 14读下面两幅图,完成下列问题。 小题1:两幅图中所表示的空气环流运动,均属于 ( ) A.大气环流 B.海陆风 C.
- 15关于x的分式方程1-x分之3+x-1分之m=1的解为正数,则m的取值范围是?
