试剂瓶为何放碱改用橡胶塞?放酸呢?
 zzzjenny2022-10-04 11:39:541条回答
zzzjenny2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 逸安居士 共回答了18个问题
逸安居士 共回答了18个问题 |采纳率94.4%- 试剂瓶要看放什么东西,不能一概而论,橡胶也分很多种类,不同橡胶可耐受的物质也不同,天然橡胶瓶塞耐弱酸弱碱没问题,但装油就会溶胀,丁腈橡胶塞耐大部分油类,但装二丁脂就不合适,丁基橡胶密封气体很好,但不耐油类东西,要是试剂瓶装的是王水,就没有合适的橡胶塞了.
试剂瓶放碱为什么不用瓶盖,因为瓶子的成分里面有一种叫硅酸钠的东西,遇到碱会微溶,溶解后在磨砂口造成封口粘接,会打不开. - 1年前
相关推荐
- 盛有以下6种盐溶液的试剂瓶标签被腐蚀,试加以鉴别
盛有以下6种盐溶液的试剂瓶标签被腐蚀,试加以鉴别
AgNO3 Pb(NO3)2 ZnSO4 Al2(SO4)3 NH4NO3 MnSO4 keke_2401年前2
keke_2401年前2 -
 bilv05 共回答了11个问题
bilv05 共回答了11个问题 |采纳率81.8%如果现实世界遇到这个问题的解决办法是,丢了.1年前查看全部
- 取用溴的时候,为什么不能倾倒试剂瓶,而要用长吸管插入覆盖水层的液溴下面吸取?
 小小猫851年前1
小小猫851年前1 -
 竟自游 共回答了18个问题
竟自游 共回答了18个问题 |采纳率88.9%因为倾倒的时候会把用于液封的水层给倒出来,也由于溴易挥发和有毒性,那样操作会使溴泄露,造成人体中毒和污染空气.1年前查看全部
- 初三化学实验题学校实验室有A、B、C三瓶无色溶液放错了试剂瓶,它们可能是硫酸、碳酸钠、氢氧化钠溶液,现给你酚酞试液和稀盐
初三化学实验题
学校实验室有A、B、C三瓶无色溶液放错了试剂瓶,它们可能是硫酸、碳酸钠、氢氧化钠溶液,现给你酚酞试液和稀盐酸.请你设计一个实验方案,把它们一一鉴别出来.
实验操作 预计出现的现象 你的结论
 dwamd1年前1
dwamd1年前1 -
 喜欢孤独的猫 共回答了21个问题
喜欢孤独的猫 共回答了21个问题 |采纳率100%取三支洁净的试管,分别取少量上述三种溶液.
滴加酚酞,不变色的为硫酸,变红的是碳酸钠、氢氧化钠溶液.
滴加稀盐酸,颜色消失并产生气体的为碳酸钠,红色逐渐消失,无其他明显现象的是氢氧化钠.1年前查看全部
- 某生在实验室发现一没有瓶塞的试剂瓶,里面装有白色固体试剂,瓶上标签已经严重腐蚀,看不清上面的字迹,但可以判断里面所盛试剂
某生在实验室发现一没有瓶塞的试剂瓶,里面装有白色固体试剂,瓶上标签已经严重腐蚀,看不清上面的字迹,但可以判断里面所盛试剂由三种元素组成.为确定该白色固体的成分,他取少量该固体配成无色溶液A,然后进行了以下实验: 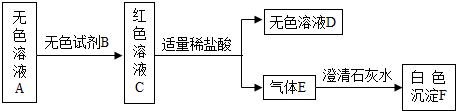
(1)无色试剂B是______(填名称),气体E是______(填化学式,下同),白色沉淀F是______.
(2)若无色溶液D中只含一种溶质NaCl(不考虑前面加入的B试剂),则无色溶液A中一定含有______.
(3)结合题目所给信息判断:原试剂瓶内所盛白色固体可能是______或______. zcmorning1年前1
zcmorning1年前1 -
 aiye1209 共回答了18个问题
aiye1209 共回答了18个问题 |采纳率94.4%(1)根据二氧化碳能使澄清石灰水变浑浊,可推断气体E为二氧化碳,F为碳酸钙;酚酞遇碱性溶液变红色,可推断无色溶液中可能有碳酸钠,碳酸钠与盐酸溶液反应生成氯化钠,水和二氧化碳,故答案为:酚酞;CO 2 ;CaCO 3 ;
(2)若无色溶液D中只含一种溶质NaCl,则无色溶液A中一定含有Na 2 CO 3 ,故答案为:Na 2 CO 3 ;
(3)结合题目所给信息判断:原试剂瓶内所盛白色固体可能是:Na 2 CO 3 或K 2 CO 3 .1年前查看全部
- (2013•杨浦区一模)如图是某浓盐酸试剂瓶上标签的部分内容.通过计算回答下列问题: 盐酸(分析纯)
(2013•杨浦区一模)如图是某浓盐酸试剂瓶上标签的部分内容.通过计算回答下列问题:
(1)该浓盐酸的质量是多少克?盐酸(分析纯)
化学式:HCl
质量分数:36%
密度:1.18g/ml
体积:500mL
(2)将该瓶浓盐酸全部配制成溶质质量分数为11.8%(密度约为1.06g/ml)的盐酸,需加入水多少ml(ρ水=1g/ml);
(3)将石灰石100g与足量稀盐酸充分反应(假设杂质不与稀盐酸反应),得到CO2 0.6mol.
①0.6mol CO2其质量是______克.
②该石灰石含碳酸钙的质量分数是多少? i13571年前1
i13571年前1 -
 单片仁 共回答了13个问题
单片仁 共回答了13个问题 |采纳率100%解题思路:(1)依据体积和其密度进行计算即可;
(2)依据稀释前后溶质的质量不变的有关知识解答即可;
(3)根据化学方程式的有关基本计算解答即可;(1)盐酸的质量=Vρ=500mL×1.18g/mL=590g;
设稀盐酸的质量是x
590g×36%=x×11.8%
x=1800g
水的质量=1800g-590g=1210g;则水的体积为[1210g/1g/mL]=1210mL;
(2)①0.6mol CO2其质量是0.6mol×44g/mol=26.4g
②设反应的碳酸钙质量是y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
y 26.4g
[100/y=
44
26.4g]
y=60g
所以该石灰石中碳酸钙的质量分数为
60g
100g×100%=60%
故答案为:(1)该浓盐酸的质量是590克.
(2)将该瓶浓盐酸全部配制成溶质质量分数为11.8%(密度约为1.06g/ml)的盐酸,需加入水1210g;
(3)①26.4;②该石灰石含碳酸钙的质量分数是60%;点评:
本题考点: 根据化学反应方程式的计算;用水稀释改变浓度的方法.
考点点评: 此题是对溶液以及化学方程式计算的考查题,解题的关键是掌握相关计算的基本步骤和方法;1年前查看全部
- (2006•顺义区一模)实验室用棕色试剂瓶盛放浓硝酸,由此猜测浓硝酸可能具有的化学性质是( )
(2006•顺义区一模)实验室用棕色试剂瓶盛放浓硝酸,由此猜测浓硝酸可能具有的化学性质是( )
A.它是深棕色液体
B.它是见光易分解的物质
C.它是易跟氧气反应的物质
D.它具有挥发性 天天天崖呀1年前1
天天天崖呀1年前1 -
 踢败 共回答了17个问题
踢败 共回答了17个问题 |采纳率100%解题思路:在实验室中见光易分解的物质通常保存在棕色试剂瓶中,同时也能够说明这种物质的化学性质不稳定,所以可以根据这一知识点进行分析并作出判断.在实验室中通常用棕色的试剂瓶来盛放见光易分解的物质,而浓硝酸用棕色试剂瓶盛放,所以可以推断浓硝酸是见光易分解的物质,同时也可以判断出硝酸银的化学性质不稳定,至于它的颜色、是否易跟氧气反应、是否具有挥发性则无法得出;
故选B.点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 熟练掌握实验室中存放药品的注意事项,存放固体通常用广口瓶,而存放液体试剂通常用细口瓶,而见光易分解的药品通常放在棕色试剂瓶中.1年前查看全部
- 久盛石灰水的试剂瓶内壁常附有一层白膜
久盛石灰水的试剂瓶内壁常附有一层白膜
这层白膜为什么是碳酸钙呢?为什么不是因为水挥发了所以氢氧化钙析出么?白膜为什么不是氢氧化钙 long911年前3
long911年前3 -
 daishengli1980 共回答了22个问题
daishengli1980 共回答了22个问题 |采纳率90.9%如果是氢氧化钙析出的话,一般也是在底部之类的吧,没有道理一定要在内壁.而碳酸钙不一样,它是二氧化碳和氢氧化钙的反应产物,肯定是在水和空气的交界处,所以往往附在内壁.1年前查看全部
- 实验室装蒸馏水的大器皿叫什么啊靠近底部有开口,可以接橡胶管,作为出水口容量十升左右,样式像试剂瓶,只是一侧底部有开口
 derapfel1年前6
derapfel1年前6 -
 雪梨汁 共回答了17个问题
雪梨汁 共回答了17个问题 |采纳率94.1%下口瓶,通常有5千毫升、1万毫升规格等等.在瓶塞和瓶颈中部各有一个孔(为了放气).1年前查看全部
- (2004•云南)下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(2004•云南)下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)欲配置100g溶质质量分数为14.6%的稀盐酸,需用这种盐酸多少毫升?(计算结果精确到0.1)盐酸(分析纯)
化学式:HCl相对分子质量:36.5
密度:1.18g/cm3质量分数:36%
(2)取上述配置得到的足量稀盐酸与6.5g锌充分反应后,理论上可制得氢气多少克? xj_75607801年前1
xj_75607801年前1 -
 心语b6 共回答了21个问题
心语b6 共回答了21个问题 |采纳率95.2%解题思路:(1)欲正确解答本题,需根据溶质质量不变和溶质质量分数公式列出方程式,进而求出需用盐酸的体积.
(2)欲正确解答本题,需根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可求出制得氢气的质量.(1)设需用盐酸的体积为x
100g×14.6%=x×1.18g/cm3×36%
解得x=34.4cm3.
(2)设生成的氢气的质量为y
Zn+2HCl=ZnCl2+H2↑
65 2
6.5g y
[65/6.5g=
2
y]
解得y=0.2g.
答:(1)欲配制14.6%的稀盐酸100g,需用这种盐酸34.4mL.
(2)6.5g锌与足量的稀盐酸充分反应,理论上可制得氢气0.2g.点评:
本题考点: 有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 本题主要考查学生根据化学方程式和质量分数公式进行计算的能力.1年前查看全部
- 实验室存放溶液的试剂瓶不能用磨口玻璃塞的是?
 随便转转然后看看1年前6
随便转转然后看看1年前6 -
 keychar 共回答了23个问题
keychar 共回答了23个问题 |采纳率87%强碱的水溶液,以及HF等可以和玻璃主要成分反应的东西.
以NaOH为例
玻璃的主要成分是SiO2,NaOH会与之反应生成Na2SiO3也就是通常说的玻璃胶,磨口处比较粗糙,接触面积也更大,所以便无法打开了.
2NaOH+SiO2=Na2SiO3+H2O
HF会腐蚀玻璃.
4HF+SiO2=SiF4↑+2H2O1年前查看全部
- (2006•南充)下列试剂瓶标签上的化学式书写错误的是( )
(2006•南充)下列试剂瓶标签上的化学式书写错误的是( )
A.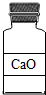
B.
C.
D.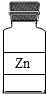
 jacques271年前1
jacques271年前1 -
 tanyuwa 共回答了11个问题
tanyuwa 共回答了11个问题 |采纳率90.9%已知钙元素的化合价为+2价,镁元素+2价,钠元素+1价,氧元素-2价,氯元素与金属形成化合物时显-1价;利用化合价的原则(在化合物中正、负化合价的代数和为零),则:
A、氧化钙:(+2)+(-2)=0,符合化合价的原则,故A正确;
B、氯化镁:(+2)+(-1)≠0,不符合化合价的原则,故B错误;
C、氯化钠:(+1)+(-1)=0,符合化合价的原则,故C正确;
D、锌:为金属单质,其化学式直接由元素符号表示,故D正确.
故选:B.1年前查看全部
- 碘水要放在棕色试剂瓶么RT为什么
 FABFairy1年前1
FABFairy1年前1 -
 luoniao 共回答了23个问题
luoniao 共回答了23个问题 |采纳率95.7%氯水,溴水及碘水的保存:棕色试剂瓶 避光保存 随用随配
碘水有效成分是碘,碘的物理性质是极易升华,而且碘蒸汽本身有刺激性气味且有毒,因此要用棕色试剂瓶保存(棕色试剂瓶反射了大部分红外线,并且降低的入射光的亮度,从而减弱光的热效应)1年前查看全部
- 氢氧化钾能储存在具有磨口玻璃塞的试剂瓶里吗?
 酒花1年前2
酒花1年前2 -
 冰_凌 共回答了13个问题
冰_凌 共回答了13个问题 |采纳率84.6%不能.
玻璃塞的主要组成物质是SiO2,它会和碱反应,使玻璃瓶口黏合.
KOH是强碱,故不能用磨口玻璃塞的试剂瓶保存.
除碱之外,玻璃塞试剂瓶还不能盛放水玻璃(成分Na2SiO3,溶液显碱性),氢氟酸.1年前查看全部
- 下列黄色不属于因化学反应而产生的现象的是( ) A.无色试剂瓶中的浓HNO 3 呈黄色 B.久置的KI溶液呈黄色 C.
下列黄色不属于因化学反应而产生的现象的是( ) A.无色试剂瓶中的浓HNO 3 呈黄色 B.久置的KI溶液呈黄色 C.鸡蛋白遇浓HNO 3 呈黄色 D.在普通玻璃导管口点燃纯净H 2 时,火焰呈黄色  青青草马兰头1年前1
青青草马兰头1年前1 -
 dasheng1965 共回答了10个问题
dasheng1965 共回答了10个问题 |采纳率90%A.浓硝酸见光易分解生成二氧化氮,久置于空气中若变黄色,是因溶解了二氧化氮的原因,发生了化学反应,故A错误;
B.碘化钾溶液具有还原性,久置于空气中易被氧化为碘单质,使溶液为黄色,发生了化学反应,故B错误;
C.鸡蛋白是蛋白质,鸡蛋白溶液遇浓硝酸呈黄色,发生了化学反应,故C错误;
D.玻璃中含有钠元素,焰色反应呈黄色,该颜色变化是物理变化,故D正确.
故选D.1年前查看全部
- 下列说法正确的是( )A.浓硝酸和浓硫酸都应该保存在棕色试剂瓶中B.NaOH溶液用带有橡胶塞的试剂瓶保存C.工业制得的
下列说法正确的是( )
A.浓硝酸和浓硫酸都应该保存在棕色试剂瓶中
B.NaOH溶液用带有橡胶塞的试剂瓶保存
C.工业制得的浓盐酸、浓硝酸通常带有黄色是由于含有Fe3+杂质
D.铝制或铁制容器可贮运浓硫酸、浓硝酸和浓盐酸这三大强酸 好想吃猪肉1年前1
好想吃猪肉1年前1 -
 minnie108 共回答了15个问题
minnie108 共回答了15个问题 |采纳率93.3%解题思路:A、浓硝酸见光分解,应该保存在棕色试剂瓶中,而浓硫酸不分解,不需要保存在棕色试剂瓶中;
B、氢氧化钠具有腐蚀性,能够与玻璃中的二氧化硅反应,不能使用玻璃塞,所以使用橡胶塞;
C、工业盐酸中因含有少量FeCl3显黄色,而浓硝酸中显示黄色原因为其分解产生的二氧化氮所致;
D、铁和铝在常温下能够与浓硝酸、浓硫酸发生钝化,可以用铝制或铁制容器可贮运浓硫酸、浓硝酸,而浓盐酸能够与铁和铝反应.A、浓硫酸不具有分解性,不需要保存在棕色试剂瓶中,故A错误;
B、氢氧化钠能够与玻璃中的二氧化硅反应,所以不能使用玻璃塞,应该盛放在带有橡胶塞的试剂瓶中,故B正确;
C、浓硝酸容易发生生成二氧化氮,使溶液显示黄色,浓硝酸中不含有铁离子,故C错误;
D、铁和铝能够与浓盐酸反应,不能使用铁制或者铝制的容器盛放浓盐酸,故D错误;
故选:B.点评:
本题考点: 化学试剂的存放.
考点点评: 本题考查了常见化学试剂的存放,题目难度不大,注意掌握常见化学试剂的性质及正确的保存方法,试题有利于培养学生灵活应用所学知识的能力.1年前查看全部
- 这两个物质颜色变化的原因红墨水中加入一定量木炭,红墨水褪色 久置于无色试剂瓶中的浓硝酸呈黄色
 linbenben1年前2
linbenben1年前2 -
 ztbfsy 共回答了23个问题
ztbfsy 共回答了23个问题 |采纳率100%墨水是胶体,加木炭褪色是因为木炭吸附分散质(类似明矾净水)
无色瓶中浓硝酸呈黄色是因为浓硝酸见光易分解为NO2,一种红棕色气体,溶于浓硝酸故显黄色1年前查看全部
- 装有酸试剂瓶上的标签被腐蚀 提如下
装有酸试剂瓶上的标签被腐蚀 提如下
瓶中可能是硫酸 硫酸钠 硫酸镁中的一种 标签上有20%的字样 硫酸溶解度:于水任意互溶 硫酸钠溶解度:19.0 硫酸镁溶解度:39.0 问一定不是: 剩下俩种请选其一进行实验证明 shuwangz1年前1
shuwangz1年前1 -
 ly870702052 共回答了15个问题
ly870702052 共回答了15个问题 |采纳率100%一定不是硫酸钠 ,因为 饱和溶液的质量分数才为 19/119=16% 那就可能是 H2SO4,或者MgSO4 取样,向溶液中加入锌片,产生气泡的是H2SO4溶液,没有明显现象的是MgSO4溶液1年前查看全部
- 装置;有一个试剂瓶中装有BaCL2溶液,用带有三个导管(中间一个导管,两边各一个导管,且中间的导管不伸入液面以下,另外两
装置;有一个试剂瓶中装有BaCL2溶液,用带有三个导管(中间一个导管,两边各一个导管,且中间的导管不伸入液面以下,另外两个要)的橡胶塞塞住瓶口.
①某同学先将SO2通入该装置从(左边的导管通进去);一段时间后再将大量的NO2(右边的导管通进去)也通入该装置,可观查到
A.通入SO2后溶液无明显现象(为什么呢?没有BaSO3产生吗?)BaCL2换做CaCL2也这样吗?
B.通入NO2后开始产生沉淀.(为什么)
另外,由此实验可以得到HNO3比H2SO4酸性强的结论吗? 饼干20051年前2
饼干20051年前2 -
 带头盔的熊 共回答了19个问题
带头盔的熊 共回答了19个问题 |采纳率84.2%通入SO2如果反应,则生成BaSO3,但是同时有HCl生成,可以把BaSO3反应掉(强酸制弱酸)
通入NO2之后,生成HNO3,具有强氧化性,把SO2氧化成SO3(H2SO4),BaSO4是不溶于强酸的白色沉淀
CaCl2同理
不能得到HNO3酸性比H2SO4酸性强
只能得到氧化性HNO3强1年前查看全部
- 试剂瓶中的钠为什么没有金属光泽?
 jerry豪1年前4
jerry豪1年前4 -
 剑风1116 共回答了20个问题
剑风1116 共回答了20个问题 |采纳率95%煤油中也应该会溶解很少量的氧气,会发生如下变化:
4Na+O2=2Na2O ,2Na2O+O2=2Na2O2
钠表面是Na2O和Na2O2的混合物,再加上表面吸附的煤油的颜色,看起来就没有金属光泽了.1年前查看全部
- 鉴别淀粉溶液和氯化钠溶液有两试剂瓶的标签模糊不清,只知道是淀粉溶液和氯化钠溶液,用3种方法鉴别
 无阻风雨1年前1
无阻风雨1年前1 -
 若古 共回答了13个问题
若古 共回答了13个问题 |采纳率100%法一:加入硝酸银,出现不溶于硝酸的白色沉淀且现象明显者为氯化钠溶液;
法二:用光束直射试剂瓶,溶液中出现“通路”的为淀粉溶液;
法三:做焰色反应实验,焰色为黄色的为氯化钠溶液.
这是我自己的想法,希望对你有所帮助!1年前查看全部
- 保存碘的试剂瓶用橡胶塞溴用玻璃塞的原因是什么?
 游子平平1年前1
游子平平1年前1 -
 lihua201099 共回答了21个问题
lihua201099 共回答了21个问题 |采纳率95.2%橡皮塞的组成有机物中有部分含碳碳双键,具有强氧化性的溴水会腐蚀橡皮塞,因此只能使用玻璃塞.碘也具有氧化性,不能用橡胶塞.单质碘保存在暗处广口、配有玻璃塞的棕色玻璃瓶中.液体保存于细口瓶,固体保存于广口瓶.1年前查看全部
- 下列物质的保存方法,正确的是A.带橡胶塞的试剂瓶保存液溴时,加少量水密封
下列物质的保存方法,正确的是A.带橡胶塞的试剂瓶保存液溴时,加少量水密封
B.液氯密闭保存在钢瓶中
C.氢氟酸保存在棕色试剂瓶中
D.碘通常保存在无色试剂瓶中 wenxin02751年前1
wenxin02751年前1 -
 owen_hn 共回答了14个问题
owen_hn 共回答了14个问题 |采纳率100%选 B
B、正确.液氯保存在钢瓶中.钢瓶表面为绿色.氧气瓶是蓝色
C、错误.棕色瓶肯定是玻璃制品,氢氟酸能腐蚀玻璃,不能保存在玻璃瓶中,要保存在塑料瓶中
D、错误.碘易升华,要避光,保存在棕色瓶中.1年前查看全部
- 在广口瓶用药匙取用药品时为什么要将试剂瓶倾斜?
 jrh20031年前1
jrh20031年前1 -
 精神论 共回答了20个问题
精神论 共回答了20个问题 |采纳率100%由药匙的设计形状来看,当广口瓶倾斜的时候,正好可以最大量的取出药品,所以要将试剂瓶倾斜1年前查看全部
- 在实验室里硅酸钠溶液存放在带玻璃塞的试剂瓶中
在实验室里硅酸钠溶液存放在带玻璃塞的试剂瓶中
这句话为什么不对 belle51201年前5
belle51201年前5 -
 labuzhi 共回答了16个问题
labuzhi 共回答了16个问题 |采纳率87.5%很高兴收到你的求助.
我翻了一下 我的笔记,首先我要告诉你硅酸钠并不是一种正盐,它的水溶液是成碱性的.因为瓶子里表面是光滑的相当于有一层保护膜,所以不会反应.但是打磨过的瓶盖就不一样了.
因为磨口玻璃粗糙,硅酸钠会附着在上面并和空气中的二氧化碳反应并硬化,硅酸钠会使玻璃塞与瓶口粘连在一起分离不开.硅酸钠会附着在上面并和瓶口的二氧化碳反应并硬化,这样就打不开瓶子了.下面有反应原理.
还有玻璃瓶同样不能储存氢氧化钠溶液,它和瓶塞反应,也会黏住瓶盖.
SiO2+2NaOH=Na2SiO3+H2O
Na2SiO3+CO2+H2o=H2SiO3沉淀+Na2CO3
呵呵,就是这样的了,望采纳,谢谢.1年前查看全部
- 下列试剂中,①氧化铜粉末;②块状石灰石、③金属锌颗粒;④试剂瓶中的稀盐酸溶液.
下列试剂中,①氧化铜粉末;②块状石灰石、③金属锌颗粒;④试剂瓶中的稀盐酸溶液.
可以用钥匙取用的是 ;可以用镊子取用的是 ;可以用滴管取用的是 ; hfhz1年前3
hfhz1年前3 -
 ffyykkxx 共回答了18个问题
ffyykkxx 共回答了18个问题 |采纳率88.9%可以用药匙取用的是粉末状的药品 因此 1
可以用镊子取用的是块状物品或者颗粒 所以是2 3
可以用滴管取用的是 液体试剂 所以是41年前查看全部
- 物理问题1.三个完全相同的小试剂瓶,里面分别装满了蒸馏水、盐水和酒精三种无色透明的液体, 你能否不打开试剂瓶将它们区别开
物理问题
1.三个完全相同的小试剂瓶,里面分别装满了蒸馏水、盐水和酒精三种无色透明的液体, 你能否不打开试剂瓶将它们区别开?请说明你的做法和理由. J_J_cool1年前2
J_J_cool1年前2 -
 好想买辆车 共回答了14个问题
好想买辆车 共回答了14个问题 |采纳率85.7%可以根据密度来求.因为是三个完全相同的小试剂瓶,而且是装满,所以它们的体积相同,因为密度是酒精大于蒸馏水大于盐水,所以质量也是酒精大于蒸馏水大于盐水,用天平称就能区别了.1年前查看全部
- 如果将盛有水玻璃的试剂瓶敞口放在空气中,可观察到的现象是
 zhouzhaobin1年前1
zhouzhaobin1年前1 -
 344970720 共回答了22个问题
344970720 共回答了22个问题 |采纳率86.4%Na2SiO3+CO2+H2O==H2SiO3(沉淀)+Na2CO3
产生了白色的沉淀.1年前查看全部
- 下列关于实验操作的叙述中正确的是……( ) A.从试剂瓶中取出的任何药品,若有剩余均不能放回原试剂瓶 B.任何可燃性气
下列关于实验操作的叙述中正确的是……()
A.从试剂瓶中取出的任何药品,若有剩余均不能放回原试剂瓶 B.任何可燃性气体点燃之前都必须检验纯度 C.用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中,以避免液体洒落 D.在中和滴定的实验过程中,目光要密切注视滴定管中的液面,以避免过量滴加  浴火而生1年前1
浴火而生1年前1 -
 男子汉36318 共回答了23个问题
男子汉36318 共回答了23个问题 |采纳率87%B
A、一般药品剩余不能放回原试剂瓶,但像金属钾或金属钠,取出大块切割完后剩余部分必须放回原试剂瓶;
B、正确;
C、用胶头滴管向试管中滴加液体,必须将滴管垂直于试管口的上方,不能伸入试管里面(特殊情况例外,如制取氢氧化亚铁时);
D、滴定时眼睛应注意观察锥形瓶中溶液颜色的变化,同时注意滴加液体的流速。1年前查看全部
- 从试剂瓶中取出药品有剩余怎么办
 mikewolf791年前1
mikewolf791年前1 -
 第一节 共回答了18个问题
第一节 共回答了18个问题 |采纳率88.9%放入一个专门收集该药品的瓶中,以备在定性实验或对药品纯度要求不严格的实验中1年前查看全部
- 小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成
小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.
他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:
①可能是NaOH; ②可能是Na 2 CO 3 ; ③可能是NaOH与Na 2 CO 3 的混合物.
为了验证猜想,他们分别做了下面的实验.
(1)小刚取少量白色粉末,滴加稀盐酸,有气体生成.由此小刚认为白色粉末是Na 2 CO 3 .
请判断小刚所得结论是否正确,并简述理由.______.
(2)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军认为白色粉末是NaOH.请判断小刚所得结论是否正确,并简述理由.______. 78771年前1
78771年前1 -
 暖暖四月天 共回答了20个问题
暖暖四月天 共回答了20个问题 |采纳率90%(1)根据取少量白色粉末,滴加稀盐酸,有气泡产生,则可能是Na 2 CO 3 ,也可能是NaOH与Na 2 CO 3 的混合物;
故答案为:不正确,这一反应只能证明有碳酸钠,也可能是NaOH与Na 2 CO 3 的混合物;
(2)根据碳酸钠水溶液呈强碱性,也能使无色酚酞溶液,变为红色;故答案为:不正确,因为碳酸钠溶液也呈碱性;1年前查看全部
- 1.长期存放石灰水的试剂瓶内壁会出现一层不溶于水的白色物质,该物质是 (填名称),形成该物质的化学反应 式 ,要除去这种
1.长期存放石灰水的试剂瓶内壁会出现一层不溶于水的白色物质,该物质是 (填名称),形成该物质的化学反应 式 ,要除去这种白色不溶物可用 ,再用水冲洗,有关化学反应式 .
 zxc345671年前1
zxc345671年前1 -
 ┻破╋ 共回答了18个问题
┻破╋ 共回答了18个问题 |采纳率88.9%碳酸钙
Ca(OH)2+CO2--CaCO3+H2O
用盐酸洗
CaCO3+2HCl--CaCl2+CO2+H2O1年前查看全部
- 暑假,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因
暑假,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
经过反复思考,同学们认为白色粉末还可能是______的混合物.白色粉末的成分 形成的原因 可能是CaCO3 石灰水与空气中CO2反应;
化学方程式为:______可能是______ 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解.于是他得出粉末中一定有CaCO3的结论.乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是:______.OH- Cl- CO32- NO3- Ca2+ 微 溶 不 溶
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
(3)交流与反思:实验步骤 可能观察到的现象 结论 取上述试管中的上层清液,滴加1~2无色酚酞试液 ______ ______ 往上述试管中的残留的固体中加入稀盐酸 ______ 白色粉末中______(选填“有”或“无”)CaCO3 由上述实验可知白色粉末的成分是:______.
①通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是______(选填序号).
A.密封保存B.使用前,临时配制C.禁止使用这种试剂
②清洗装石灰水试剂瓶内壁上的白色粉末时,家庭里可以用______代替稀盐酸. tdl80311年前1
tdl80311年前1 -
 wuyulunbii 共回答了13个问题
wuyulunbii 共回答了13个问题 |采纳率84.6%解题思路:(1)二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,氢氧化钙微溶于水,并且溶解度随着温度的升高而减小;
(2)氢氧化钙溶液显碱性,能使酚酞试液变红色,碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;
(3)对于易变质的溶液来说,应该密封保存或使用前临时配制;显酸性的物质能和氢氧化钙、碳酸钙反应生成相应的物质.(1)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故填:Ca(OH)2+CO2=CaCO3↓+H2O.
因为暑假气温较高,氢氧化钙的溶解度降低或溶剂蒸发,石灰水中的氢氧化钙能够结晶析出,所以白色粉末有可能是氢氧化钙.
故填:Ca(OH)2.
白色粉末有可能是碳酸钙和氢氧化钙的混合物.
故填:CaCO3和Ca(OH)2.
(2)加入少量的水、振荡,发现有白色固体不溶解,不能说明粉末中一定有碳酸钙,因为氢氧化钙微溶于水,当加入少量的水时,不溶解的白色固体也可能是氢氧化钙.
故填:氢氧化钙微溶于水,当加入少量的水时,不溶解的白色固体也可能是氢氧化钙.
取上述试管中的上层清液,滴加1~2无色酚酞试液,酚酞试液变红色,说明白色固体中含有氢氧化钙.
故填:酚酞试液变红色;白色固体中含有氢氧化钙.
往上述试管中的残留的固体中加入稀盐酸,有气泡产生,说明白色粉末中有碳酸钙.
故填:有气泡产生;有.
由上述实验可知白色粉末的成分是CaCO3和Ca(OH)2.
故填:CaCO3和Ca(OH)2.
(3)①对于易变质的溶液来说,应该密封保存或使用前临时配制;不能禁止使用易变质的溶液.
故填:AB.
②食醋中含有醋酸,显酸性,可以代替稀盐酸除去装石灰水试剂瓶内壁上的白色粉末.
故填:食醋.点评:
本题考点: 实验探究物质的组成成分以及含量;证明碳酸盐;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.1年前查看全部
- 盛石灰水的试剂瓶时间久了,内壁常附有一层白膜
盛石灰水的试剂瓶时间久了,内壁常附有一层白膜
先问一下白膜是什么?
如要除去这层白膜,最好的方法:
A.用盐酸 B.先用盐酸,再用水
为什么? scarlotta1年前1
scarlotta1年前1 -
 dingweiguang 共回答了15个问题
dingweiguang 共回答了15个问题 |采纳率73.3%白膜是 CaCO3
选B
2HCl+CaCO3=CaCl2+H2O+CO2
反应后水洗干净1年前查看全部
- 某兴趣小组同学发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标
某兴趣小组同学发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标
签破损.
【提出问题】这瓶试剂的成分是什么?
【设计并实验】
(1)小明用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断这是一种碱性溶液.对他的操作方法、测量结果及结论的评价,正确的是______;
A.方法正确,结果正确,且结论正确
B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确
D.方法正确,结果正确,但结论不正确
(2)小明认为它是Ba(OH)2溶液,小俊认为它是Ba(NO3)2溶液.要进一步确定它的成分,小俊认为只需选择上图已有的试剂就能把它鉴别出来.他们又进行了实验.
操作步骤 实验现象 结论及化学方程式 取样滴入盛有二氧化碳的集气瓶中 ______ 该物质是______溶液(填名称)
相关的化学方程式______ imadam1年前1
imadam1年前1 -
 爱干净的苍蝇 共回答了21个问题
爱干净的苍蝇 共回答了21个问题 |采纳率90.5%解题思路:(1)用pH试纸测定溶液酸碱度的方法是:用干燥、洁净的玻璃棒蘸取溶液,滴在干燥的pH试纸上,再与标准比色卡对照,即可得溶液的pH;
(2)二氧化碳能和氢氧化钡反应生成碳酸钡沉淀和水,不能和硝酸钡反应.(1)把溶液滴到湿润的pH试纸上,相当于稀释了该溶液,如果是酸性溶液,测定的pH偏大,如果是碱性溶液,测定的pH偏小,但是酸碱性不能发生改变;
小明测定的溶液的PH大于7,显碱性,结论正确,但是方法不正确,测定的pH偏小.
故填:B.
(2)氢氧化钡溶液显碱性,硝酸钡溶液显中性,所以该溶液是氢氧化钡溶液,当把氢氧化钡溶液滴入盛有二氧化碳的集气瓶中时,溶液变浑浊,反应的化学方程式为:
CO2+Ba(OH)2═BaCO3↓+H2O.
故填:试剂变浑浊;氢氧化钡;CO2+Ba(OH)2═BaCO3↓+H2O.点评:
本题考点: 缺失标签的药品成分的探究;溶液的酸碱度测定;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.1年前查看全部
- 溴的试剂瓶为何要加水
 无忌上人1年前1
无忌上人1年前1 -
 ii横陈 共回答了15个问题
ii横陈 共回答了15个问题 |采纳率93.3%密度比水小在溴上面,防止其蒸发1年前查看全部
- 如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
 如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
如图为某盐酸试剂瓶上标签的部分内容.请仔细阅读后计算:
(1)欲配制14.6%的稀盐酸100g,需要这种盐酸多少克?
(2)用上述配得的稀盐酸与足量的锌充分反应,可制得氢气多少克? 最爱纯纯1年前1
最爱纯纯1年前1 -
 xiang00nian 共回答了23个问题
xiang00nian 共回答了23个问题 |采纳率91.3%解题思路:(1)根据加水稀释前后溶液中溶质质量相等,由标签查得盐酸的溶质质量分数为20%,然后由稀释前后溶质质量相等的关系,计算需要这种盐酸的质量;
(2)锌与盐酸反应生成氯化锌和氢气,根据反应的化学方程式,由消耗HCl的质量计算制得氢气的质量.(1)需要标签注明质量分数为20%的盐酸的质量=[100g×14.6%/20%]=73g;
(2)设可制得氢气质量为x
Zn+2HCl═ZnCl2+H2↑
73 2
100g×14.6% x
[73/100g×14.6%]=[2/x] x=0.4g
故答案为:(1)73g;(2)0.4g.点评:
本题考点: 一定溶质质量分数的溶液的配制;有关溶质质量分数的简单计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 加水稀释时,稀释前溶液的质量×溶液的溶质质量分数=稀释后溶液质量×溶液的溶质质量分数.1年前查看全部
- 现有一瓶未开启的浓盐酸,试剂瓶标签上的部分内容如下图所示,欲将10mL的浓盐酸稀释为7.3%的稀盐酸,需加水多少克?
 ShinIChi_NO11年前1
ShinIChi_NO11年前1 -
 rd8hqsmu 共回答了17个问题
rd8hqsmu 共回答了17个问题 |采纳率100%47.2g1年前查看全部
- 图一至十四是酒精(化学名称为乙醇)试剂瓶标签的部分内容.阅读后回答下列问题.(1)未开启前该液体的质量为多少克?(2)欲
图一至十四是酒精(化学名称为乙醇)试剂瓶标签的部分内容.阅读后回答下列问题.(1)未开启前该液体的质量为多少克?(2)欲配置两百克溶质质量分数为百分之七十五的酒精溶液需取用这种酒精多少毫升?
 cigw1年前1
cigw1年前1 -
 老兄LHM 共回答了21个问题
老兄LHM 共回答了21个问题 |采纳率76.2%(1)未开启前质量:
质量=体积×密度=500ml×0.81g/ml=405g
(2)200g 75%的酒精溶液,含有乙醇: 200×75%=150g
所以需要95%的乙醇: 150÷95%=157.89g
体积为: 157.89÷0.81 =173.5ml1年前查看全部
- 下列叙述不正确的是( )A.实验剩余的任何药品不能放回原试剂瓶B.用规格为10mL的量筒量取6mL的液体C.使用胶头滴
下列叙述不正确的是( )
A.实验剩余的任何药品不能放回原试剂瓶
B.用规格为10mL的量筒量取6mL的液体
C.使用胶头滴管时,应使滴管始终垂直向下,一般不得伸入容器内
D.粗盐提纯操作的顺序是:溶解、过滤、蒸发、结晶 4598969381年前1
4598969381年前1 -
 找不到离开你的门 共回答了16个问题
找不到离开你的门 共回答了16个问题 |采纳率93.8%解题思路:A.钠可以放回原瓶;
B.量筒精确到0.1;
C.胶头滴管加液时,不能伸入容器,更不能接触容器.应垂直悬空于容器上方0.5 cm处;
D.粗盐的提纯操作为溶解、过滤、蒸发、结晶.A.对化学实验剩余药品,大多是不可以放回原瓶的,但是极少数例外,如金属钠切下一小块后可放回原瓶,故A错误;
B.量筒精确到0.1,可量取6mL的液体,故B正确;
C.胶头滴管应垂直悬空于容器上方,以免污染液体,故C正确;
D.粗盐的提纯操作顺序为溶解、过滤、蒸发、结晶,故D正确.
故选A.点评:
本题考点: 化学试剂的存放;计量仪器及使用方法;化学实验操作的先后顺序.
考点点评: 本题考查化学实验的基本操作,题目难度不大,注意相关基本实验操作的实验注意事项.1年前查看全部
- 下列说法不正确的是( )A.实验时,用剩的药品要放回到原试剂瓶中,以免浪费B.实验时,如果没有说明液体药品的用量时,应
下列说法不正确的是( )
A.实验时,用剩的药品要放回到原试剂瓶中,以免浪费
B.实验时,如果没有说明液体药品的用量时,应取1~2mL
C.给试管里的液体加热时,试管要与桌面成45度角
D.用量筒量取液体时,应使视线与量筒内液体的凹液面的最低处保持水平 hdb20061年前1
hdb20061年前1 -
 lanxin20004 共回答了15个问题
lanxin20004 共回答了15个问题 |采纳率100%解题思路:A、根据有的药品会被空气污染进行分析;
B、根据液体的取用规则进行分析;
C、根据给试管加热时的操作进行分析;
D、根据量筒的使用规则进行分析.A、实验时,剩余的药品有可能在空气中已经变质或者已被空气污染,不能放回原瓶,故A错误;
B、实验时,没有说明用量的液体取用1~2mL故B正确;
C、对试管加热时,试管与桌面成45°夹角,故C正确;
D、在对量筒读数时,视线要与液体的凹液面的最低处保持水平,故D正确;
故选:A.点评:
本题考点: 实验操作注意事项的探究;常用仪器的名称和选用.
考点点评: 本题主要考查了在时要操作时的操作要领,在平时的学习中要加强基础知识的记忆.1年前查看全部
- 浓盐酸的现象打开盛有浓盐酸的试剂瓶的盖后有什么现象?为什么?
 liyyachu1年前1
liyyachu1年前1 -
 yechuzhou 共回答了21个问题
yechuzhou 共回答了21个问题 |采纳率90.5%会有酸雾生成
因为盐酸是易挥发性酸,瓶内有挥发出来的HCl气体分子,打开瓶塞HCl遇到空气中的水蒸气便变成酸雾,因为是液态,所以不是烟,是雾1年前查看全部
- 分别打开盛有浓硫酸和你浓盐酸的试剂瓶,瓶口出现白雾的是什么?
 zhidong8711年前1
zhidong8711年前1 -
 brave11121 共回答了18个问题
brave11121 共回答了18个问题 |采纳率94.4%是浓盐酸 盐酸有挥发性 越浓挥发性越强 挥发出的HCl与空气中的水气结合成盐酸小液滴 形成白雾1年前查看全部
- 化学实验课上,同学们发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有些白色粉末.课后,为了弄清楚白色粉末的成分及形成原因,他们进行了
化学实验课上,同学们发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有些白色粉末.课后,为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分猜想和成因分析:
表1:对白色粉末成分的猜想和成因分析:
(2)设计实验:白色粉末的成分 形成原因
可能是CaCO3石灰水与空气中的CO2反应,化学方程式为:______ 可能是______ 溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 经过反复思考,同学们认为白色粉末还可能是______的混合物.
甲同学取白色粉末装入试管中,加入少量水振荡,发现有白色固体不溶解.为了得到较严密的结论,他们进行了如表2所示的实验,请完成下列实验报告:
由上述实验可知白色粉末的成分是______.实验步骤 可能观察到的现象 结论 取上述试管中的上层清液,滴加1~2滴无色酚酞试液
______
______往上述试管残留的固体中加入稀盐酸
______白色粉末中有CaCO3  77775811年前1
77775811年前1 -
 包青天 共回答了22个问题
包青天 共回答了22个问题 |采纳率95.5%解题思路:(1)根据形成原因来完成对该白色固体的成分的猜想,其中氢氧化钙的溶解度随温度的升高而降低,可以据此解答;
(2)根据物质的溶解度性可知,碳酸钙不溶于水,但氢氧化钙微溶于水,所以要验证该白色固体的组成可以结合氢氧化钙和碳酸钙的性质来选择酚酞试液和盐酸来检验,可以据此解答该题.(1)若白色固体为碳酸钙,则应该是氢氧化钙和二氧化碳反应而生成的,故可以写出该反应的化学方程式;
当然该白色固体也可能是水的蒸发而导致氢氧化钙析出;
如果氢氧化钙是部分被反应成了碳酸钙,那么此时白色固体也可能是碳酸钙和氢氧化钙的混合物;
(2)根据物质的溶解度性可知,碳酸钙不溶于水,但氢氧化钙微溶于水,所以加入酚酞后溶液要变为红色,说明固体中含有氢氧化钙,加入稀盐酸后固体全部溶解且产生了气泡,说明存在中碳酸钙;由上述实验可以知道该白色固体为氢氧化钙和碳酸钙的混合物.
故答案为:(1)
白色粉末的成分 形成原因
可能是CaCO3 石灰水与空气中的CO2反应,化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O
可能是 Ca(OH)2 溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出
经过反复思考,同学们认为白色粉末还可能是 氢氧化钙和碳酸钙 的混合物.(2)
实验步骤 可能观察到的现象 结论
取上述试管中的上层清液,滴加1~2滴无色酚酞试液
溶液变红
白色粉末中含有氢氧化钙
往上述试管残留的固体中加入稀盐酸
固体溶解,产生气泡 白色粉末中有CaCO3氢氧化钙和碳酸钙的混合物.点评:
本题考点: 实验探究物质的组成成分以及含量;证明碳酸盐;固体溶解度的影响因素;酸碱指示剂及其性质;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 该考点的命题方向主要是以实验探究兼计算题的形式,给出有关的信息提示和相关数据,让学生通过实验探究,分析推断出该物质的组成成分;然后让学生根据有关的化学方程式和该物质的组成成分,进行综合计算.题型主要是实验探究题兼计算题的综合题型.中考的重点是考查学生通过实验的方法和有关化学方程式的计算,来研究物质的组成成分以及含量能力.1年前查看全部
- 暑假过后,同学们在帮老师整理实验室时,发现一瓶久置的敞口石灰石水试剂瓶的瓶壁和瓶塞周围有一些白色粉末,为了弄清楚白色粉末
暑假过后,同学们在帮老师整理实验室时,发现一瓶久置的敞口石灰石水试剂瓶的瓶壁和瓶塞周围有一些白色粉末,为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
【提出问题】白色粉末的成分是什么
【进行猜想】
猜想一:白色粉末为碳酸钙(请写出碳酸钙产生的化学方程式)______.
猜想二:白色粉末为碳酸钙和氢氧化钙的混合物;
猜想三:白色粉末为氢氧化钙(暑假气温较高,由于氢氧化钙的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出)
【查阅资料】部分碱、盐溶解性表
【设计实验】1 OH- Cl- CO32- Ca2+ 微 溶 不
(1)甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解.于是他得出粉末中一定有CaCO3的结论.乙同学认为甲同学的结论不严密,理由是______
(2)为了得出较严密的结论,他们又进行了如下实验,请完成下列实验报告:
【交流与反思】实 验 步 骤 可能观察到的现象 猜想二正确 ①取(1)试管中的上层清液,滴加1~2滴无色酚酞试液.
______②往(1)中试管的残留固体中加入稀盐酸. 有气泡产生.
(1)通过上述实验的探究,同学们对实验室易变质的溶液时的保存和使用提出了下列建议,其中合理的是______(填序号).
A.密封保存B.使用前临时配制C.禁止使用这种试剂.
(2)冰同学又找了一瓶久置的氢氧化钠溶液,取少量溶液样品于试管中,滴加酚酞试液,溶液变红,于是他认为样品中一定会有氢氧化钠,该结论是否正确?______(选填“是”或“否”),请说明理由______(3)请你写出另外一种常温下在空气中会变质的药品______. 叶子茶楼1年前1
叶子茶楼1年前1 -
 SSDD136 共回答了20个问题
SSDD136 共回答了20个问题 |采纳率85%解题思路:【进行猜想】
氢氧化钙能和空气中的二氧化碳反应生成碳酸钙和水;
【设计实验】
(1)氢氧化钙微溶于水,少量的水中溶解的氢氧化钙很少,因此取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,不能说明粉末中一定有碳酸钙;
(2)碳酸钙不溶于水,氢氧化钙微溶于水,氢氧化钙的水溶液显碱性,能使酚酞试液变红色;
碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;
【交流与反思】
(1)对实验室易变质的溶液应该密封保存,最好是使用前临时配制;
(2)氢氧化钠溶液能够吸收空气中的二氧化碳,并且能和二氧化碳反应生成碳酸钠和水;
通常情况下,氧化钙能和水反应生成氢氧化钙.【进行猜想】
石灰水能够吸收空气中的二氧化碳,并且能和二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故填:Ca(OH)2+CO2═CaCO3↓+H2O.
【设计实验】
(1)因为氢氧化钙微溶于水,所以取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解时,不能说明粉末中一定含有碳酸钙,也可能是氢氧化钙.
故填:氢氧化钙微溶于水,不溶解的白色固体可能是氢氧化钙.
(2)如果粉末中含有氢氧化钙,则向试管中的上层清液中滴加无色酚酞试液时,酚酞试液变红色;
如果粉末中含有碳酸钙,则向试管中的残留固体中加入稀盐酸时,会产生气泡.
故填:酚酞试液变红色.
【交流与反思】
(1)对实验室易变质的溶液应该密封保存,或使用前临时配制,但是不能禁止使用这种试剂.
故填:AB.
(2)因为氢氧化钠溶液能够吸收空气中的二氧化碳,氢氧化钠和二氧化碳反应生成的碳酸钠溶液显碱性,也能使酚酞试液变红色,所以取少量溶液样品于试管中,滴加酚酞试液时溶液变红,不能说明样品中一定含有氢氧化钠.
故填:氢氧化钠和二氧化碳反应生成的碳酸钠溶液显碱性,也能使酚酞试液变红色.
(3)常温下氧化钙能和水反应生成氢氧化钙而变质.
故填:氧化钙.点评:
本题考点: 实验探究物质的组成成分以及含量;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.1年前查看全部
- 下列清洗方法错误的是( )A. 用肥皂洗涤久置石灰水的试剂瓶B. 用酒精清洗残留碘的试管C. 用洗涤剂清洗餐具上的油污
下列清洗方法错误的是( )
A. 用肥皂洗涤久置石灰水的试剂瓶
B. 用酒精清洗残留碘的试管
C. 用洗涤剂清洗餐具上的油污
D. 用汽油清洗沾在手上的油漆 月光影子1年前1
月光影子1年前1 -
 yc52 共回答了16个问题
yc52 共回答了16个问题 |采纳率93.8%解题思路:A、根据石灰水的主要成分性质和变质后的成分及性质判断.
B、根据碘溶于酒精的性质判断.
C、根据洗涤剂去油污的原理判断.
D、根据汽油的去污原理判断.A、石灰水的主要成分是氢氧化钙,能和空气中的二氧化碳反应生成碳酸钙和水而变质,碳酸钙不溶于水也不和肥皂反应,不能用肥皂洗涤,所以错误;故A符合题意;
B、根据碘溶于酒精的性质,所以用酒精清洗残留碘的试管,正确;故B不符合题意;
C、洗洁净中有乳化剂,具有乳化功能,可以用它清洗餐具上的油污,正确.故C不符合题意;
D、油漆易溶解于汽油,可以用汽油清洗沾在手上的油漆,正确.故D不符合题意;
故选A.点评:
本题考点: 玻璃仪器的洗涤;溶解现象与溶解原理;乳化现象与乳化作用.
考点点评: 生活中或实验室中洗涤的原理主要有三种,一是利用化学反应把不溶物变成可溶物而洗去,二是利用乳化作用原理,把油污变成细小的油滴,形成乳浊液而洗去,三是利用溶解原理,把物质溶解于水形成溶液而洗去,在洗涤时,要根据被洗涤的物质成分选择合适的原理和方法.1年前查看全部
- (2008•常德)某化学实验室有一瓶黑色固体粉末X(X是纯净物),因试剂瓶标签破损无法确定其成分.为此小军进行了以下实验
(2008•常德)某化学实验室有一瓶黑色固体粉末X(X是纯净物),因试剂瓶标签破损无法确定其成分.为此小军进行了以下实验,请你参与他的探究:
(一)探究X的成分
【猜想与假设】物质X可能是______;
【实验设计与实施】取两份等量的X样品,进行实验一、实验二: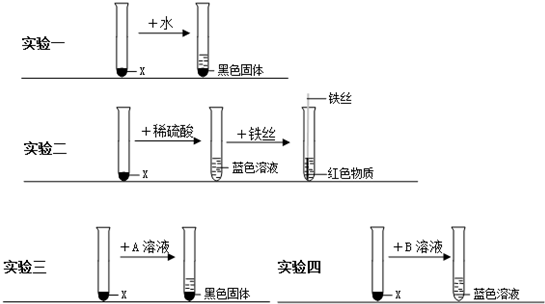
【实验分析与结论】
①从“实验一”小军得出X的物理性质是:______;
②从“实验二”小军推断出X的化学式是______;
③“实验二”中向蓝色溶液插入铁丝发生反应的化学方程式是______.
(二)探究X与稀硫酸的反应
(1)稀硫酸中含有H2O、H+、SO42-等粒子,其中属于分子的有______;属于离子的有______;
(2)小军分析“实验一、二”后认为:可能是稀硫酸中的H+或SO42-使X溶解.
为确定稀硫酸中何种粒子使X溶解,他继续设计了实验三、实验四进行探究:
“实验三”中的A可能是______(填化学式,下同),“实验四”中的B可能是______;
(3)小军通过上述实验证明:稀硫酸中的______(填离子符号)才能使X溶解;
(4)某同学建议小军:要确定稀硫酸中何种粒子使X溶解,只需进行实验一、二、三即可.你是否同意该同学的观点?______(填“同意”或“不同意”) handgun1年前1
handgun1年前1 -
 zfj25 共回答了18个问题
zfj25 共回答了18个问题 |采纳率88.9%(一)【猜想与假设】初中化学实验室常见的黑色粉末有CuO、MnO2、Fe3O4、铁粉、炭粉等,根据以实验知,能和硫酸等物质反应,可猜想为氧化铜,故答案为:CuO【实验分析与结论】①从“实验一”可知,X不溶于水,故答案...1年前查看全部
- 现有两只没有标签、外观相同的试剂瓶,内盛500ml无色澄清的液体
现有两只没有标签、外观相同的试剂瓶,内盛500ml无色澄清的液体
一瓶是饱和NaCi,一瓶是H20.写出五种鉴别的方法
我只想出来三种:尝一尝、滴入AgNo3、电解
各位帮下忙,还有什么方法,非常感谢!
 不雅笔名1年前1
不雅笔名1年前1 -
 放大镜看世界 共回答了25个问题
放大镜看世界 共回答了25个问题 |采纳率96%还可以放冰箱里冷冻,饱和NaCi在零度不会结冰.
或者根据密度不同,分别放入同一物体,下沉深度较深的是水.
还可以加热蒸发,生成晶体的是氯化钠溶液1年前查看全部
- 化学科代表小聪与小明同学帮助实验老师整理化学药品室时,发现分别放在两个试剂瓶中的两片用砂纸磨得光亮的银白色金属,未贴标签
化学科代表小聪与小明同学帮助实验老师整理化学药品室时,发现分别放在两个试剂瓶中的两片用砂纸磨得光亮的银白色金属,未贴标签.到底它们是哪种金属?两位同学首先对这两种金属X和Y的金属活动性顺序进行实验探究.
(1)进行猜想:
①科代表小聪猜想:活动性X大于Y.
②小明同学猜想:活动性Y大于X.
(2)设计实验方案、进行实验、获得知识.完成如下实验报告,并回答后续有关问题.
(3)上述实验之前,实验老师只知道X、Y是银铁中的各一种,则根据实验结果说明Y就是______.实验室急需一定量的Y粉末,科代表小聪认为可用现有的X金属粉末和Y的盐溶液、蒸馏水等药品,配以必要的仪器来制得急需的Y粉末,原因是(用反应的化学方程式表示)______.①实验步骤 ②实验现象 ③结论
______金属Y表面无明显变化,金属X的表面有气泡冒出.
将燃着的木条放在装金属X的试管口,气体燃烧
______
科代表小聪的猜想:______
(“正确”或“正确”)
(4)实验老师经实验分析得知制得的Y粉末中含有未反应完的X粉末,若用化学方法将杂质X粉末除去,两个同学经讨论、交流一致认为可选用的除杂质试剂是______. 文兰梦境1年前1
文兰梦境1年前1 -
 CD公主1 共回答了19个问题
CD公主1 共回答了19个问题 |采纳率89.5%解题思路:金属的活动性顺序的应用主要表现在两个方面:一是只有排在氢前面的金属才能与酸发生置换反应,生成盐和氢气;二是只有排在前面的金属才能把后面的金属从它的盐溶液中置换出来;化学方程式的书写主要做好以下几个方面:反应物、生成物、反应条件、化学式的书写、配平、沉淀气体的标注等.(2)根据已完成的实验报告可以看出,验证X与Y的活动性采用的是加酸的方法,可以加入稀盐酸或稀硫酸,X表面冒泡,说明X>H,Y表面无变化,说明H>Y,所以本题答案为:
实验步骤 实验现象 结论
将金属X、Y分别放入试管中,再分别加入稀盐或稀硫酸酸 金属的活动性为X>Y
不正确(3)根据实验现象可知,X>H>Y,而铁>氢>银,所以Y就是银,铁能将银从其盐溶液中置换出来,所以本题答案为:银或Ag,2AgNO3+Fe═2Ag+Fe(NO3)2;
(4)因为铁>氢>银,铁能与酸反应而银不能,所以除去银粉中含有铁粉,可以用酸溶液.
故答案为:(2)
实验步骤 实验现象 结论
将金属X、Y分别放入试管中,再分别加入稀盐或稀硫酸酸 金属的活动性为X>Y
不正确(3)银;2AgNO3+Fe═2Ag+Fe(NO3)2;
(4)盐酸(或稀硫酸).点评:
本题考点: 金属活动性的探究;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:(1)求该浓盐酸的物质的量浓度.
右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:(1)求该浓盐酸的物质的量浓度.

盐酸的物质的量浓度为c=[1000*0.365*11.8g/cm3]/36.5g/mol 分母上不用换算成dm3吗? 末班车没我的位置1年前1
末班车没我的位置1年前1 -
 grace916 共回答了17个问题
grace916 共回答了17个问题 |采纳率94.1%不用,密度的单位是:g/cm3,1年前查看全部
大家在问
- 1提取下列材料的要点,整合成一个单句,为“遗传”下定义。
- 2My hometown has changed g_ since 1990.
- 3奇函数中f(-a)等于多少
- 4翻开那一本本相册,那一幕幕今人难忘的回忆,我就( )
- 5把一根长20厘米的圆木棍截成相等的两根圆木棍,表面积增加了56.52平方厘米.原来的圆木棍的表面积是多少平
- 6对于我们来说,互相帮助是非常重要的.(It is …for sb.to do sth.)
- 7谁有《不落别处》的阅读答案?
- 8初二上物理第三章单元检测卷
- 9底面半径是一分米,高5厘米的圆柱体,它的侧面积是( ),表面积是( ),体积是()
- 10(1)计算:8×12+(32−24)(32+24)
- 11Do you think the stars will beat the Bulls?Yes.They have bet
- 12很感兴趣地谈纶。词语
- 13已知ab互为相反数,mn互为倒数,求(a+b)又m/n+(-2mn)的值
- 14氨气与稀盐酸的反应方程
- 15[ ]diffcult the task may be,we will try our best to complete
