火箭推进器的化学燃料燃烧为什么有动力而且火箭速度高于燃料喷射速度
 芷因2022-10-04 11:39:541条回答
芷因2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 寒光摄影 共回答了20个问题
寒光摄影 共回答了20个问题 |采纳率95%- 化学燃料燃烧产生大量气体并受热膨胀,向后急速喷出,使火箭得到一个向前的反作用力.
生成气体喷射速度很快,是大于火箭速度的(因为火箭质量大于气体质量). - 1年前
相关推荐
- (2005•宁夏)火箭推进器中盛有液态肼(X)和双氧水(H2O2),当它们混合反应时,放出大量的热量,有关反应为方程式X
(2005•宁夏)火箭推进器中盛有液态肼(X)和双氧水(H2O2),当它们混合反应时,放出大量的热量,有关反应为方程式X+2H2O2=N2+4H2O,据此判断肼的化学式( )
A.N2
B.N2H4
C.NH2
D.NH3 祝枝山说聊斋1年前1
祝枝山说聊斋1年前1 -
 zhangyn121 共回答了21个问题
zhangyn121 共回答了21个问题 |采纳率100%解题思路:本题考查的是质量守恒定律,其内容是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和.在化学反应中,从微观上原子种类、原子数目和原子的质量都不变;从宏观上元素种类和物质的总质量不变.本题中根据方程式X+H2O2=N2+2H2O,判断肼的化学式为N2H2.A、反应后4个氢原子,因此反应前也应该是4个氢原子,故选项错误;
B、反应后8个氢原子、2个氮原子,因此反应前也应该是8个氢原子和2个氮原子,故选项正确;
C、反应前后氢原子和氮原子数目也都不相等,故选项错误;
D、反应前后氢原子和氮原子数目都不相等,故选项错误;
故选B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本考点是有关质量守恒定律的探究题,要抓住要点:五个一定不变,一个一定变.有关质量守恒定律的考题在中考中经常出现,还要注意等号两边各原子的数目必须相等,本考点经常出现在选择题和实验题中.1年前查看全部
- 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H202),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H202),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知一定量的液态肼和足量H202(1)反应,生成2mol水蒸气时,放出320.4kJ的热量.
(1)写出该反应的热化学方程式______.
(2)已知H20(g)=H20(l)△H=-44.lkJ•mol-1,则8g液态肼和足量H202(l)反应生成氮气和液态水时,放出的热量是______kJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是______.
(4)肼还可以被N204氧化,2N2H4(g)+N204(g)═3N2(g)+4H20(g)△H
已知:N2(g)+202(g)═N204(g)△H1;
N2H4(g)+O2(g)═N2(g)+2H20(g)△H2;
则△H=______. 绝版的纯1年前1
绝版的纯1年前1 -
 lzyhl1 共回答了18个问题
lzyhl1 共回答了18个问题 |采纳率94.4%解题思路:(1)热化学方程式的书写:标明物质的聚集状态;焓变符号中的“+”和“-”代表吸热和放热,化学反应的焓变和物质的量相对应;
(2)依据热化学方程式和盖斯定律计算得到;
(3)根据燃烧产物无污染来分析;
(4)依据热化学方程式和盖斯定律计算得到对应反应焓变.(1)已知一定量的液态肼和足量H202(1)反应,生成2mol水蒸气时,放出320.4kJ的热量,生成4mol水蒸气反应放热640.8KJ,反应的热化学方程式为:
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-640.8kJ•mol-1;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-640.8kJ•mol-1;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-640.8kJ•mol-1;
②H20(g)=H20(l)△H=-44.lKJ•mol-1,
②×4+①得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.2kJ•mol-1;
则8g液态肼物质的量=[8g/32g/mol]=0.25mol和足量H202(l)反应生成氮气和液态水时,放出的热量是204.3KJ;
故答案为:204.3;
(3)除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气;
故答案为:生成物为氮气和水,不污染空气;
(4)已知:①N2(g)+202(g)═N204(g)△H1
②N2H4(g)+O2(g)═N2(g)+2H20(g)△H2
依据热化学方程式和盖斯定律计算,②×2-①得到 2N2H4(g)+N204(g)═3N2(g)+4H20(g)△H=2△H2-△H1 ,
故答案为:2△H2-△H1.点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 本题考查了热化学方程式书写方法和盖斯定律计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 在飞船的火箭推进器中常装有液态肼(A)和过氧化氢(H 2 O 2 ),它们混合时的反应方程式为:2H 2 O 2 + A
在飞船的火箭推进器中常装有液态肼(A)和过氧化氢(H 2 O 2 ),它们混合时的反应方程式为:2H 2 O 2 + A === N 2 + 4H 2 O,则肼(A)的化学式为
A.N 2 H 2 B.N 2 H 4 C.2NH 2 D.N 2 H 4 O 2 zhangmeng00591年前1
zhangmeng00591年前1 -
 lxdailsn 共回答了25个问题
lxdailsn 共回答了25个问题 |采纳率88%B
考点:
专题:化学式推断十字法.
分析:根据化学变化前后原子的种类、数目不变,由反应的化学方程式2H 2 O 2 +A═N 2 ↑+4H 2 O,推断反应中反应物A的分子构成,根据分子的构成确定A物质的化学式.
由反应的化学方程式2H 2 O 2 +A═N 2 ↑+4H 2 O,可得知反应前后N、H、O原子的个数分别为
反应前 反应后
N原子 0 2
H原子 4 8
O原子 4 4
根据化学变化前后原子的种类、数目不变,可判断物质A的每个分子由2个N原子和4个H原子构成,则物质A的化学式为N 2 H 4 ;
故选B.1年前查看全部
- 偏二甲肼是火箭推进器的常用燃料,其化学式是C2H8N2,试计算:
偏二甲肼是火箭推进器的常用燃料,其化学式是C2H8N2,试计算:
(1)该物质中碳元素与氢元素质量比为______
(2)该物质中碳元素的质量分数为______
(3)120g该物质中含氮元素的质量为______. hot86781年前0
hot86781年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列说法错误的是( )A. 火箭推进器的反应N2H4+2H2O2═X2+4H2O中的X2为N2B. 某镍氢电池(NiO
下列说法错误的是( )
A. 火箭推进器的反应N2H4+2H2O2═X2+4H2O中的X2为N2
B. 某镍氢电池(NiOOH中氧元素为-2价)反应H2+2NiOOH═2Ni(OH)2中Ni的化合价由+3价变为+2价
C. 炼钢就是把生铁中的碳、硫、磷全部除去
D. 用灯帽盖熄酒精灯火焰的原理是隔绝空气 亲吻影子1年前1
亲吻影子1年前1 -
 c031008 共回答了17个问题
c031008 共回答了17个问题 |采纳率100%解题思路:A、由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X2的化学式.
B、根据在化合物中正负化合价代数和为零,结合含镍元素的化学式进行解答本题.
C、根据炼钢的原理进行分析判断.
D、根据灭火的原理进行分析判断.A、根据反应的化学方程式N2H4+2H2O2=X2+4H2O,反应物中氮、氢、氧原子个数分别为2、8、4,反应后的生成物中氮、氢、氧原子个数分别为0、8、4,根据反应前后原子种类、数目不变,则一个X2中分子中含有2个氮原子,则X2的化学式为N2,故选项说法正确.
B、氧元素显-2价,设NiOOH中镍元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)+(-2)+(+1)=0,则x=+3价;氢氧根显-1价,设Ni(OH)2中镍元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:y+(-1)×2=0,y=+2价,故选项说法正确.
C、炼钢是通过化学方法和物理方法降低生铁中的含碳量,除去硫、磷等一些元素,故选项说法错误.
D、用灯帽盖熄酒精灯火焰是利用了隔绝空气的原理,故选项说法正确.
故选C.点评:
本题考点: 质量守恒定律及其应用;有关元素化合价的计算;灭火的原理和方法.
考点点评: 本题难度不大,掌握原子守恒来确定物质的化学式的方法、利用化合价的原则计算指定元素的化合价的方法、炼钢与灭火的原理即可正确解答本题.1年前查看全部
- 偏二甲肼是火箭推进器的常用燃料,根据偏二甲肼的化学式C2H8N2,你知道哪些信息?请至少写出三点.
偏二甲肼是火箭推进器的常用燃料,根据偏二甲肼的化学式C2H8N2,你知道哪些信息?请至少写出三点.
C2
2是右下角的下标H8也一样 liyongxiaohu1年前1
liyongxiaohu1年前1 -
 朝闻游子 共回答了19个问题
朝闻游子 共回答了19个问题 |采纳率94.7%是有机物,
是碳氢化合物的衍生物
燃烧后可生成NO2,CO2,H2O
有氨基
这是04年左右的高考原题,具体的我忘了1年前查看全部
- 1、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反
1、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(25℃、101 kPa下测得的热量).
(1)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是 心事往事1年前1
心事往事1年前1 -
 双儿飞飞 共回答了20个问题
双儿飞飞 共回答了20个问题 |采纳率90%1.从0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量,算出16g液态肼与液态双氧水反应生成气态水时放出的热量.
2.n摩尔气态水--n摩尔液态水热量算出.注意吸热或放热!+ -
3.加和下即可1年前查看全部
- 2008年9月25日,中国“神舟七号”飞船载人航天再次取得成功.火箭推进器的常用燃料是偏二甲肼[C2H8N2],该物质是
2008年9月25日,中国“神舟七号”飞船载人航天再次取得成功.火箭推进器的常用燃料是偏二甲肼[C2H8N2],该物质是由______种元素组成,它的分子中碳、氢、氮原子的个数比为______(填最简整数比).
 山水相逢cocoo1年前1
山水相逢cocoo1年前1 -
 时逢1234 共回答了22个问题
时逢1234 共回答了22个问题 |采纳率95.5%解题思路:根据物质的化学式分析其元素组成;
根据标在元素符号右下角的数字表示一个分子中所含原子的个数;进行解答.根据偏二甲肼的化学式[C2H8N2]可知偏二甲肼由C,H,N 三种元素组成;
根据标在元素符号右下角的数字表示一个分子中所含原子的个数;可知偏二甲肼中碳、氢、氮原子的个数比为:
2:8:2=1:4:1;
故答案为:3; 1:4:1.点评:
本题考点: 有关化学式的计算和推断;分子、原子、离子、元素与物质之间的关系.
考点点评: 解答本题必须区分清元素的质量比与原子个数比,才能顺利解答本题.1年前查看全部
- (1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已
 (1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
①写出热化学方程式______.
②已知H2O(1)=H2O(g)△H=+44kJ/mol,则64g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是______ kJ.
(2)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为:______
(3)已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol-1①
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-543kJ•mol-1②
[1/2]H2(g)+[1/2]F2(g)═HF(g)△H=-269kJ•mol-1③
H2(g)+[1/2]O2(g)═H2O(g)△H=-242kJ•mol-1④
①写出肼(N2H4)和NO2反应的热化学方程式______.
②有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为______
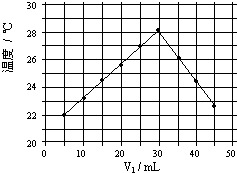
(4)将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).填写下列空白:
①做该实验时环境温度______22℃(填>、<、=)
②NaOH溶液的浓度约为______mol/L. yz弓长张1年前1
yz弓长张1年前1 -
 帅帅蜗牛t 共回答了16个问题
帅帅蜗牛t 共回答了16个问题 |采纳率100%解题思路:(1)①根据热化学方程式的书写方法,标注物质聚集状态和计算对应反应的焓变写出;
②根据盖斯定律结合热化学方程式来书写;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)①依据热化学方程式和盖斯定律计算得到;
②依据热化学方程式,结合目标热化学方程式,利用盖斯定律计算得到;
(4)①从图示观察的起始温度即为实验时的温度;
②由图可知,恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL可知,消耗的氢氧化钠溶液的体积为20mL,以此求出两者的体积比值、计算NaOH浓度.(1)①0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=641.625 kJ•mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1;
②因①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1,②H2O(l)═H2O(g)△H=+44kJ•mol-1,根据盖斯定律,①-②×4,得N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ•mol-1,所以64g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为1635.25kJ,
故答案为:1635.25;
(2)在反应N2+3H2⇌2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×bkJ+akJ=(a+3b)kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×ckJ=6ckJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为=(a+3b)kJ-6ckJ,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-(6c-a-3b)kJ•mol-1;
(3)①由热化学方程式和盖斯定律可知,
①N2(g)+2O2(g)=2NO2(g)△H=67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
依据盖斯定律②×2-①得到,2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ•mol-1;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ•mol-1 ;
②由已知热化学方程式和盖斯定律可知,
①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
②[1/2]H2(g)+[1/2]F2(g)=HF(g)△H=-269kJ•mol-1
③H2(g)+[1/2]O2(g)=H2O(g)△H=-242kJ•mol-1
依据盖斯定律①-③×2+②×4得到:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;
故答案为:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;
(4)①根据实验结果图2所示内容,可以知道该实验开始时温度一定是低于22℃,故答案为:<;
②恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL,消耗的氢氧化钠溶液的体积为20mL,所以V1/V2=3/2;
设恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+NaOH═NaCl+H2O
11
1.0mol•L-1×0.03L n
则n=1.0mol•L-1×0.03L=0.03mol,
所以浓度C=[0.03mol/0.02L]=1.5mol/L;
故答案为:1.5.点评:
本题考点: 热化学方程式;有关反应热的计算;用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了热化学方程式的计算和盖斯定律的计算应用,结合中和反应考查了同学们观察分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答理解实质,掌握基础是解题关键,题目难度中等.1年前查看全部
- 火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol
火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol
H 2 O 2 混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为________________________。
(2)又已知H 2 O(l)=H 2 O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是
________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________。 ☆紫衣侯☆1年前1
☆紫衣侯☆1年前1 -
 ww的猫猫 共回答了15个问题
ww的猫猫 共回答了15个问题 |采纳率86.7%(1)N 2 H 4 (l)+2H 2 O 2 (l)==N 2 (g) +4H 2 O(g) △H=-644.25 KJ/mol
(2)410.125
(3)产物不会造成环境污染1年前查看全部
- 2008年9月25日,中国“神舟七号”飞船载人航天再次取得成功.火箭推进器的常用燃料是偏二甲肼(C2H8N2),该物质是
2008年9月25日,中国“神舟七号”飞船载人航天再次取得成功.火箭推进器的常用燃料是偏二甲肼(C2H8N2),该物质是由______种元素组成,它的分子中碳、氢、氮原子的个数比为______;偏二甲肼(C2H8N2)的式量为______.
 觅月1年前1
觅月1年前1 -
 wwning402 共回答了29个问题
wwning402 共回答了29个问题 |采纳率86.2%解题思路:根据偏二甲肼的化学式C2H8N2分析其元素组成和每个分子中元素原子个数比,它的式量=(碳的相对原子质量×碳原子个数)+(氢的相对原子质量×氢原子个数)+(氮的相对原子质量×氮原子个数);由题意知偏二甲肼的化学式为C2H8N2,其元素组成为C、H、N三种,分子中右下角的数字表示原子个数,所以碳、氢、氮原子的个数比为2:8:2即1:4:1;它的式量=12×2+1×8+14×2=60;
故答案为:3;1:4:1;60点评:
本题考点: 有关化学式的计算和推断;相对分子质量的概念及其计算.
考点点评: 该题以“神舟七号”飞船的燃料偏二甲肼为背景,考查化学式的意义,必须分清元素的质量比与原子个数比,有利于学生兴趣的培养.1年前查看全部
- (2014•大丰市二模)化学支撑科技,促进我国航天事业迅速发展.在飞船的火箭推进器中常装有液态肼[N2H4]和过氧化氢[
(2014•大丰市二模)化学支撑科技,促进我国航天事业迅速发展.在飞船的火箭推进器中常装有液态肼[N2H4]和过氧化氢[H2O2],它们混合时的反应方程式为:2H2O2+N2H4═N2+4X,则下列说法正确的是( )
A.该化学方程式中X的化学式为H2O
B.反应前后原子总数发生变化
C.该反应为置换反应
D.氮是地壳中含量最高的非金属元素 418251511年前1
418251511年前1 -
 在沉默中期待 共回答了17个问题
在沉默中期待 共回答了17个问题 |采纳率88.2%解题思路:A、根据质量守恒定律和化学方程式进行考虑;
B、根据反应前后各原子个数相等来考虑;
C、根据置换反应的特点考虑;
D、根据地壳中元素的含有情况考虑.A、根据质量守恒定律和2H2O2+N2H4═N2+4X,可知该化学方程式中X的化学式为H2O;故正确;
B、根据质量守恒定律可知化学反应前后各原子个数必然相等,所以其原子总数一定相等,故错误;
C、置换反应的特点是反应物与生成物均是一种单质与一种化合物,而该反应的反应物是两种化合物,故不是置换反应;故错误;
D、地壳中含量最多的元素是氧元素,不是氮元素,故错误;
故选:A.点评:
本题考点: 质量守恒定律及其应用;地壳中元素的分布与含量;反应类型的判定.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力.结合质量守恒的应用及反应类型的判断对所列问题分析探讨即可.1年前查看全部
- 关于燃烧热的化学题火箭推进器内的燃料为联氨N2H4(l),氧化剂为N2O4(g),燃烧后生成N2(g)和H2O(l).写
关于燃烧热的化学题
火箭推进器内的燃料为联氨N2H4(l),氧化剂为N2O4(g),燃烧后生成N2(g)和H2O(l).写出配平的化学方程式,利用△fHm 计算燃烧1molN2H4(l)的反应热△cHm (N2H4,l)(该值即为N2H4(l)的燃烧热).已知△fHm ( N2H4,l)=50.63 kJ·mol-1,△fHm (N2O4,g)=9.16 kJ·mol-1,△fHm ( H2O,l)=-285.83 kJ·mol-1. 穆罕默德苏莱曼1年前1
穆罕默德苏莱曼1年前1 -
 andyxuxiao 共回答了19个问题
andyxuxiao 共回答了19个问题 |采纳率94.7%2N2H4(l)+N2O4(g)=3N2(g)+4H20(l) ; △fHm=(-285.83)*4-50.63*2-9.16=-1253.74kJ·mol-1
N2H4(l)+3O2(g)=N2O4(g)+2H2O(l);△cHm=9.16+2*(-285.83)-50.63=-613.13kJ·mol-1
计算过程都写上了.希望能有所帮助.1年前查看全部
- (2011•白云区一模)火箭推进器中常用的液体原料有肼(X)和过氧化氢(H2O2).这是因为肼与过氧化氢等强氧化剂混合能
(2011•白云区一模)火箭推进器中常用的液体原料有肼(X)和过氧化氢(H2O2).这是因为肼与过氧化氢等强氧化剂混合能自燃产生巨大能量.它们二者混合所发生反应的化学方程式为:X+2H2O2=N2+4H2O,请根据质量守恒定律推断肼的化学式是( )
A.NH3
B.N2H2
C.N2H4
D.N2H6 hxq41921年前1
hxq41921年前1 -
 烟卷的徒弟 共回答了18个问题
烟卷的徒弟 共回答了18个问题 |采纳率88.9%解题思路:在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变.由反应的化学方程式X+2H2O2=N2+4H2O可知,每个X中含有2个氮原子和4个氢原子,是N2H4.
故选C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 在化学反应中遵循质量守恒定律,参加反应的物质的质量总和等于反应后生成的物质的质量总和.1年前查看全部
- 下列说法错误的是( ) A.火箭推进器的反应N 2 H 4 +2H 2 O 2 =X 2 +4H
下列说法错误的是( )
A.火箭推进器的反应N 2 H 4 +2H 2 O 2 =X 2 +4H 2 O中X 2 为N 2 B.某镍氢电池(NiOOH中氧元素为-2价)反应H 2 +2NiOOH=2Ni(OH) 2 中Ni的化合价由+3价变为+2价 C.炼钢就是把生铁中的碳、硫、磷全部除去 D.用灯帽盖熄酒精灯火焰的原理是隔绝空气  红酒咖啡不了情1年前1
红酒咖啡不了情1年前1 -
 wwwmao 共回答了17个问题
wwwmao 共回答了17个问题 |采纳率94.1%C
1年前查看全部
- 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)写出该反应的热化学方程式______.
(2)已知H2O(l)═H2O(g)△H=+44kJ•mol-1,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是______kJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是______. uk20041年前1
uk20041年前1 -
 米青米青 共回答了17个问题
米青米青 共回答了17个问题 |采纳率94.1%解题思路:(1)根据热化学方程式的书写方法;
(2)根据盖斯定律来书写;
(3)根据燃烧产物无污染来分析.(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=641.625 kJ•mol-1,故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1;
(2)因①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1,②H2O(l)═H2O(g)△H=+44kJ•mol-1,根据盖斯定律,①-②×4,
得N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ•mol-1,所以16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为408.8kJ,故答案为:408.8;
(3)除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气,故答案为:生成物为氮气和水,不污染空气.点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.1年前查看全部
- 一道热化学反应方程式的书写火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8
一道热化学反应方程式的书写
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量).4/10N2H4+8/10H2O2=4/10N2+16/10H2O.^H=256.7kj/mol 对不?先忽略角标告诉我这样写有无问题 me_apmO1年前2
me_apmO1年前2 -
 zz198363 共回答了21个问题
zz198363 共回答了21个问题 |采纳率90.5%对的1年前查看全部
- 火箭推进器中盛有液态肼(X)和液态双氧水(H2O2),他们反映的化学方程式为2HO2+X=N2+4H2O,则肼(X)的
 b9wt1年前2
b9wt1年前2 -
 closer_xw 共回答了13个问题
closer_xw 共回答了13个问题 |采纳率92.3%N2H41年前查看全部
- 在火箭推进器中装有强还原肼(N2H4)和强氧化剂(H2O2),当他们混合时,即产生大量的N2和水蒸气,并放出大量热.已知
在火箭推进器中装有强还原肼(N2H4)和强氧化剂(H2O2),当他们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65KJ的热量.(1)写出该反应的热化学方程式__________ (2)已知H2O(l)===H2O(g);△H=+44KJ•mol-¹,则16g液态肼燃烧生成氮气和液态水时,放出的热量是_____KJ.(3)上述反应应用与火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________.(4)已知N2(g)+2O2(g)===2NO2(g);△H=+67.7KJ•mol-¹,N2H4(g)+O2(g)===N2(g)+2H2O(g);△H=-534KJ•mol-¹,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_________ 希望有能力的朋友,
 dsl101d1年前1
dsl101d1年前1 -
 青尘ii 共回答了22个问题
青尘ii 共回答了22个问题 |采纳率90.9%N2H4(g)+2H2O2(l)=>N2(g)+4H2O(g)+641.625KJ
276.81KJ
不产生污染环境的气体
2N2H4(g)+2NO2(g)=>3N2(g)+4H2O(g) + 1135.7KJ1年前查看全部
- 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4+2H2O2⇌
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4+2H2O2⇌N2+4H2O,已知0.4mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量.
(1)反应的热化学方程式为______.
(2)又已知:H2O(l)⇌H2O(g);△H=+44kJ/mol.则16g液态肼和足量的液态双氧水反应生成液态水时放出的热量是______kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有很大的优点是______
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是______
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为______. 渗透的月光1年前1
渗透的月光1年前1 -
 dragon1688 共回答了17个问题
dragon1688 共回答了17个问题 |采纳率94.1%解题思路:(1)根据热化学方程式的书写原则和注意问题写出;注意物质的聚集状态标注,焓变的正负号和单位;
(2)根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
(3)根据反应产生的物质性质分析判断;
(4)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
氢氧燃料碱性电池中,负极上氢气失去电子.(1)已知0.4mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量,肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5KJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.5KJ/mol;
②H2O(l)=H2O(g);△H=+44KJ/mol,408.8KJ;
由盖斯定律①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(L)△H=-817.6KJ/mol;化学方程式中32g全部反应放热817.5KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408.75KJ,
故答案为:408.75;
(3)强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合时,即产生大量的氮气和水蒸汽,除释放大量热量和快速产生大量气体外,还有很突出的优点是,产物为氮气和水,无污染;
故答案为:产物为氮气和水,无污染;
(4)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O;
故答案为:C;H2+2OH--2e-=2H2O.点评:
本题考点: 有关反应热的计算;电极反应和电池反应方程式.
考点点评: 本题考查了热化学方程式的书写方法和注意问题,盖斯定律的应用,原电池和燃料电池的电极反应,明确原电池与氧化还原反应的关系及负极发生氧化反应是解答本题的关键,题目难度不大.1年前查看全部
- 发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合时,
发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热,写出该反应的化学方程式______,该反应用于火箭推进器的优点是______.  fy133931年前1
fy133931年前1 -
 vivian_jie 共回答了15个问题
vivian_jie 共回答了15个问题 |采纳率86.7%液态肼和过氧化氢反应会生成水蒸气和氮气,故答案为:N 2 H 4 +2H 2 O 2 =4H 2 O↑+N 2 ↑
因为从液态肼和双氧水反应的化学方程式可以看出,生成物只有水和氮气,不会造成粉尘等污染,故答案为:产物无污染.
故答案为:N 2 H 4 +2H 2 O 2 =4H 2 O↑+N 2 ↑;产物无污染.1年前查看全部
- 在火箭推进器中装有强还原剂肼(N 2 H 4 )和强氧化剂H 2 O 2 ,当它们混合时,即产生大量N 2 和水蒸气,并
在火箭推进器中装有强还原剂肼(N 2 H 4 )和强氧化剂H 2 O 2 ,当它们混合时,即产生大量N 2 和水蒸气,并放出大量热,已知0.4mol液态肼与足量液态H 2 O 2 反应,生成氮气和水蒸气,放出256.65KJ热量.
(1)写出该反应的热化学方程式______.
(2)已知H 2 O(l)=H 2 O(g)-44KJ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是______KJ.
(3)上述反应用于火箭推进器,除释放出大量热和快速产生大量气体外,还有一个很突出的优点是______. 叽里呱啦拉拉拉1年前1
叽里呱啦拉拉拉1年前1 -
 dazhangqigu 共回答了24个问题
dazhangqigu 共回答了24个问题 |采纳率91.7%(1)0.4mol液态肼和足量H 2 O 2 反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N 2 H 4 (l)+2H 2 O 2 (l)═N 2 (g)+4H 2 O(g)△H=-641.625 kJ•mol -1 ,
故答案为:N 2 H 4 (l)+2H 2 O 2 (l)═N 2 (g)+4H 2 O(g)△H=-641.625 kJ•mol -1 ;
(2)因①N 2 H 4 (l)+2H 2 O 2 (l)═N 2 (g)+4H 2 O(g)△H=-641.625 kJ•mol -1 ,②H 2 O(l)═H 2 O(g)△H=+44kJ•mol -1 ,根据盖斯定律,①-②×4,
得N 2 H 4 (l)+2H 2 O 2 (l)═N 2 (g)+4H 2 O(l)△H=-817.625 kJ•mol -1 ,所以16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为408.8kJ,故答案为:408.8;
(3)除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气,故答案为:生成物为氮气和水,不污染空气.1年前查看全部
- (2011•句容市一模)“嫦娥一号”发射的火箭推进器中装有液态肼(用A表示)和过氧化氢(H2O2),它们混合时的化学反应
(2011•句容市一模)“嫦娥一号”发射的火箭推进器中装有液态肼(用A表示)和过氧化氢(H2O2),它们混合时的化学反应方程式为:2H2O2+A
N2+4H2O,则肼(A)的化学式为( )点燃 .
A.N2H2
B.N2H4
C.NH2
D.N2H4O2 liai19851年前1
liai19851年前1 -
 lileilei0001 共回答了17个问题
lileilei0001 共回答了17个问题 |采纳率94.1%解题思路:根据化学反应前后原子的个数不变来做这道题.反应后有氢原子:8个,氧原子:4个,氮原子:2个,故反应前也应该有这些,故A中有氢原子个数为:8-4=4个,氧原子个数为:4-4=0个,氮原子个数为:2-0=2个
故A中有2个氮原子,4个氢原子,故A的化学式应为:N2H4
A、是N2H2,故A不正确
B、是N2H4,故B正确
C、是NH2,故C不正确
D、是N2H4O2,故D不正确
故选B点评:
本题考点: 质量守恒定律及其应用;有关化学式的计算和推断.
考点点评: 掌握质量守恒定律的内容及其应用;掌握有关化学式的计算和推断的方法1年前查看全部
- 偏二甲肼是火箭推进器的常用燃料,根据偏二甲肼的化学式,写出3点信息.
 dzdz3331年前1
dzdz3331年前1 -
 脸色单纯 共回答了15个问题
脸色单纯 共回答了15个问题 |采纳率93.3%楼主你漏写了偏二甲肼的化学式.
偏二甲肼的化学式是C2H8N2.
根据为个化学式可得的信息是:
1.是有机物;
2.其组成中含有碳、氢、氮三种元素;
3.每个偏二甲肼分子含有2个碳原子、8个氢原子、2个氮原子;
4.燃烧后可生成N2,CO2,H2O1年前查看全部
- 火箭推进器中盛有强还原剂N2H4(l)和强氧化剂H2O2(l),当它们混合反应时,即产生大量N2(g)和H2O(g),并
火箭推进器中盛有强还原剂N2H4(l)和强氧化剂H2O2(l),当它们混合反应时,即产生大量N2(g)和H2O(g),并放出
火箭推进器中盛有强还原剂N2H4(l)和强氧化剂H2O2(l),当它们混合反应时,即产生大量N2(g)和H2O(g),并放出大量热,已知0.4molN2H4(l)和0.8molH2O2(l)反应生成N2和H2O(g)时,放出256.7kJ热量。
(
已知H2O(l)=H2O(g);△H=+44kJ/mol,则16gN2H4(l)与足量H2O2(l)反应生成N2和H2O(l)时,放出的热量为______________kJ。 柳焚余1年前1
柳焚余1年前1 -
 cjfg 共回答了21个问题
cjfg 共回答了21个问题 |采纳率85.7%N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.63kJ/mol
(641.63=-256.652/0.4)
而4H2O(g)=4H2O(l) △H=-44×4=-176KJ/mol
一加
N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H=-817.63kJ/mol
而1molN2H4是 32g,放热是817.63kJ
那么16g就是817.63/2=408.815kJ1年前查看全部
- (12分)在火箭推进器中装有强还原剂肼(N 2 H 4 )和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放
(12分)在火箭推进器中装有强还原剂肼(N 2 H 4 )和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.0kJ的热量。
(1)写出过氧化氢和肼的电子式:过氧化氢 ,肼 。
(2)写出液态肼与足量液态过氧化氢反应生成氮气和气态水反应的热化学方程式 。
(3)已知H 2 O(1)=H 2 O(g) △ H =+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是 kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是 。 dorabluemon1年前0
dorabluemon1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于宇宙飞船的动力问题.宇宙不是真空的吗,火箭推进器的原理不是利用作用力和反作用力的原理吗?那火箭在宇宙中喷火不就有两个
关于宇宙飞船的动力问题.
宇宙不是真空的吗,火箭推进器的原理不是利用作用力和反作用力的原理吗?那火箭在宇宙中喷火不就有两个问题吗?1.没有空气,怎么喷火?
2,火向什么东西作用了力让火箭得到了反作用力使火箭前进? 淡蓝无泪1年前1
淡蓝无泪1年前1 -
 kk8008 共回答了22个问题
kk8008 共回答了22个问题 |采纳率86.4%首先,反冲和有没有空气没有关系,不知道你学没学到动量守恒定律,作用和反作用在火箭的加速问题中其实就是火箭和喷出的气体(也就是火箭内部燃料)之间的作用,燃料向后喷出,火箭往前走,是不是真空无所谓的.
补充点知识,现在火箭出了一种新的加速方式,就是利用宇宙中的粒子,捕获粒子然后通过火箭的电场(动力装置)加速向后射出从而获得向前的动力1年前查看全部
- (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量.
①写出该反应的热化学方程式______.
②又已知H2O(l)=H2O(g),△H=44kJ•mol-1,则16g液态肼与液态双氧水反应生成液态水时放出的热量是______kJ.
(2)实验室用足量的金属锌与体积、浓度一定的稀硫酸反应制取氢气时(不考虑温度变化),要想使反应速率减慢,又不影响产生氢气的总量,下列措施中能达到目的是______.
①加入少量固体碳酸钠;②加入少量固体醋酸钠;
③加入适量的硫酸钠溶液;④加入适量的硝酸钠溶液;
⑤滴加少量CuSO4溶液;⑥加热. 美凝1年前1
美凝1年前1 -
 四毛天圣 共回答了16个问题
四毛天圣 共回答了16个问题 |采纳率68.8%解题思路:(1)①反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
②结合上述写出的热化学方程式和谁转化的热化学方程式,根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
(2)要使氢气的生成速率减慢,但又不影响其总量,则减小氢离子浓度,而不能减小氢离子的物质的量,以此来解答.(1)①反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为[256/0.4]kJ=640kJ,
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640 kJ•mol-1;
②a、N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;
b、H2O(g)=H2O(l)△H=-44KJ/mol;
依据盖斯定律a+b×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817KJ/mol;化学方程式中32g全部反应放热817KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408kJ,
故答案为:408;
(2)①加入少量固体碳酸钠,会和硫酸之间反应,产生二氧化碳,能使使反应速率减慢,会影响产生氢气的总量,故错误;
②加入少量固体醋酸钠,会和硫酸之间反应生成醋酸,醋酸是弱酸,能使使反应速率减慢,不会影响产生氢气的总量,故正确;
③加入适量的硫酸钠溶液,减小氢离子浓度,而不能减小氢离子的物质的量,则反应速率减慢,不影响氢气的总量,故正确;
④加入适量的硝酸钠溶液,相当于溶液中含有硝酸,和金属反应不会产生氢气,所以会影响氢气的总量,故错误;
⑤滴加少量CuSO4溶液,会形成原电池,加快反应速率,故错误;
⑥加热会加快反应速率,故错误;
故选②③.点评:
本题考点: 热化学方程式;化学反应速率的影响因素.
考点点评: 本题考查热化学方程式的书写、化学反应速率的影响因素,为高频考点,把握氢离子浓度、物质的量的变化为解答的关键,注意发生的氧化还原反应是否生成氢气,题目难度不大.1年前查看全部
- (2008•抚州)“嫦蛾一号”发射的火箭推进器中盛有液态肼(X)和双氧水(H2O2),当它们混合反应时放出大量的热,其反
(2008•抚州)“嫦蛾一号”发射的火箭推进器中盛有液态肼(X)和双氧水(H2O2),当它们混合反应时放出大量的热,其反应为:X+2H2O2═N2+4H2O.据此判断该液态肼(X)的化学式是( )
A.N2H2
B.N2H4
C.NH2
D.N2H4O2 xixihahano11年前1
xixihahano11年前1 -
 藤儿sunshine 共回答了24个问题
藤儿sunshine 共回答了24个问题 |采纳率95.8%解题思路:由题意“X+2H2O2═N2+4H2O”,根据化学反应前后原子的种类与数目不发生改变可以推测液态肼(X)的化学式.由反应为:X+2H2O2═N2+4H2O,根据质量守恒定律的元素守恒,可知肼(X)中含有氮元素、氢元素;在根据元素的一种个数反应前后不变,则可以推测液态肼(X)的化学式为N2H4.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想,根据反应前后元素种类、原子的个数不变,来处理问题.1年前查看全部
- 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4+2H2O2?N2+4H2O,已知0.4mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量.
(1)反应的热化学方程式为______.
(2)又已知:H2O(l)?H2O(g);△H=+44kJ/mol.则16g液态肼和足量的液态双氧水反应生成液态水时放出的热量是______kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有很大的优点是______
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是______
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为______.
 qx5121年前1
qx5121年前1 -
 Ailiangliang 共回答了17个问题
Ailiangliang 共回答了17个问题 |采纳率82.4%(1)已知0.4mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量,肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5KJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.5KJ/mol;
②H2O(l)=H2O(g);△H=+44KJ/mol,408.8KJ;
由盖斯定律①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(L)△H=-817.6KJ/mol;化学方程式中32g全部反应放热817.5KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408.75KJ,
故答案为:408.75;
(3)强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合时,即产生大量的氮气和水蒸汽,除释放大量热量和快速产生大量气体外,还有很突出的优点是,产物为氮气和水,无污染;
故答案为:产物为氮气和水,无污染;
(4)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O;
故答案为:C;H2+2OH--2e-=2H2O.1年前查看全部
- (2014•沈阳一模)在飞船的火箭推进器中常装有液态肼[N2H4]和过氧化氢[H2O2],它们混合时的反应方程式为:2H
(2014•沈阳一模)在飞船的火箭推进器中常装有液态肼[N2H4]和过氧化氢[H2O2],它们混合时的反应方程式为:2H2O2+N2H4═N2+nH2O,则下列说法正确的是( )
A.该反应为置换反应
B.反应前后原子总数发生变化
C.该化学方程式中n=4
D.氮是地壳中含量最高的元素 阿弥陀佛541491年前1
阿弥陀佛541491年前1 -
 happypastrol 共回答了17个问题
happypastrol 共回答了17个问题 |采纳率94.1%解题思路:A、根据置换反应的特点考虑;
B、根据反应前后各原子个数相等来考虑;
C、根据质量守恒定律中的原子守恒考虑;
D、根据地壳中元素的含有情况考虑.A、置换反应的特点是反应物与生成物均是一种单质与一种化合物,而该反应的反应物是两种化合物,故不是置换反应;
B、根据质量守恒定律可知化学反应前后各原子个数必然相等,所以其原子总数一定相等,故错误;
C、根据质量守恒定律可知反应前后各原子个数相等,反应物中有8个氢原子,生成物中要想有8个氢原子,n必须为4,故正确;
D、地壳中含量最多的元素是氧元素,不是氮元素,故错误;
故选C.点评:
本题考点: 置换反应及其应用;地壳中元素的分布与含量;质量守恒定律及其应用.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力.结合质量守恒的应用及反应类型的判断对所列问题分析探讨即可.1年前查看全部
- 在火箭推进器中装有还原剂肼(N 2 H 4 )和强氧化剂H 2 O 2 ,当它们混合时,即产生大量的氮气和水蒸气,并放出
在火箭推进器中装有还原剂肼(N 2 H 4 )和强氧化剂H 2 O 2 ,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量.
(1)写出肼和过氧化氢的结构式肼______,过氧化氢______.
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是______.
(3)写出肼和双氧水反应的热化学方程式______.
(4)已知H 2 O(l)═H 2 O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是______.
(5)发射卫星时可用肼(N 2 H 4 )为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.已知:
N 2 (g)+2O 2 (g)=2NO 2 (g)△H=+67.7kJ/mol
N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O (g)△H=-543kJ/mol
H 2 (g)+F 2 (g)=HF (g)△H=-538kJ/mol
2H 2 (g)+O 2 (g)=2H 2 O (g)△H=-484kJ/mol
则肼与NO 2 完全反应的热化学方程式为______.有人认为若用F 2 (g)代替二氧化氮作氧化剂,则反应释放能量更大,N 2 H 4 (g)和F 2 (g)反应的热化学方程式:______. happywin研究室1年前0
happywin研究室1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2009•莆田)2008年9月25日,中国“神舟七号”飞船载人航天再次取得成功.火箭推进器的常用燃料是偏二甲肼[C2H
(2009•莆田)2008年9月25日,中国“神舟七号”飞船载人航天再次取得成功.火箭推进器的常用燃料是偏二甲肼[C2H8N2],该物质是由______种元素组成,它的分子中碳、氢、氮原子的个数比为______(填最简整数比).
 jixm1年前1
jixm1年前1 -
 一直都爱你 共回答了14个问题
一直都爱你 共回答了14个问题 |采纳率64.3%解题思路:根据偏二甲肼的化学式分析其元素组成和每个分子中元素原子个数比.由题意知偏二甲肼的化学式为C2H8N2,其元素组成为C、H、N三种,分子中右下角的数字表示原子个数,所以碳、氢、氮原子的个数比为2:8:2即1:4:1.
故答案为:(1)3;
(2)1:4:1.点评:
本题考点: 化学式的书写及意义.
考点点评: 该题以“神舟七号”飞船的燃料偏二甲肼为背景,考查化学式的意义,生动活泼,有利于学生兴趣的培养.1年前查看全部
- 2003年10月15日,中国“神州五号”飞船载人航天取得成功.偏二甲肼是火箭推进器的常用燃料.根据偏二甲肼的化学式
2003年10月15日,中国“神州五号”飞船载人航天取得成功.偏二甲肼是火箭推进器的常用燃料.根据偏二甲肼的化学式
C2H8N2,你知道哪些信息?(即化学式表示的意义,回答不要求涉及反应.)请写出三点:
(1)相对原子质量______.(2)______(3)______. 绿葡萄嘟嘟1年前1
绿葡萄嘟嘟1年前1 -
 异域娃娃 共回答了16个问题
异域娃娃 共回答了16个问题 |采纳率81.3%解题思路:相对分子质量为构成分子的各原子的相对原子质量之和;化学式表示的意义有:①表示一种物质,②表示该物质的元素组成,③表示物质的一个分子,④表示物质的分子的构成等.偏二甲肼的相对原子质量为:12×2+1×8+14×2=60.
由偏二甲肼的化学式(C2H8N2)的化学式可知:表示偏二甲肼这种物质;表示偏二甲肼是由碳、氢、氮三种元素组成的;表示1个偏二甲肼分子;表示1个偏二甲肼分子是由2个碳原子、8个氢原子和2个氮原子构成的.
故答案为:(1)60;(2)表示偏二甲肼是由碳、氢、氮三种元素组成的;(3)1个偏二甲肼分子等.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题难度不大,考查化学式的含义,掌握化学式的含义并能灵活运用是正确解答本题的关键.1年前查看全部
- 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)写出该反应的热化学方程式______.
(2)已知H2O(l)═H2O(g);△H=+44kJ•mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是______kJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是______.
(4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ•mol-1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=-534kJ•mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______.
(5)已知:N2(g)+2O2 (g)=2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O (g)△H=-543kJ/mol
[1/2]H2(g)+[1/2]F2 (g)=HF(g)△H=-269kJ/mol
H2(g)+[1/2]O2 (g)=H2O(g)△H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:______. lhb91281年前1
lhb91281年前1 -
 蓝天情圣 共回答了20个问题
蓝天情圣 共回答了20个问题 |采纳率85%解题思路:(1)计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
(2)根据盖斯定律书写计算;
(3)根据燃烧产物无污染来分析;
(4)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式;
(5)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式;(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1;
②H2O(l)═H2O(g)△H=+44kJ•mol-1,
依据盖斯定律①-②×4得到,N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ•mol-1;
16g液态肼物质的量为0.5mol,燃烧生成氮气和液态水时,放出的热量是:
817.625 kJ×0.5=408.8KJ;
故答案为:408.8;
(3)除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气,故答案为:生成物为氮气和水,不污染空气.;
故答案为:生成N2和H2O,对环境无污染;
(4)①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
(5)①N2(g)+2O2 (g)=2NO2 (g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O (g)△H=-543kJ/mol
③[1/2]H2(g)+[1/2]F2 (g)=HF(g)△H=-269kJ/mol
④H2(g)+[1/2]O2 (g)=H2O(g)△H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式,依据盖斯定律①-③×2+②×4得到:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;点评:
本题考点: 热化学方程式;有关反应热的计算;用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了热化学方程式的计算和盖斯定律的计算应用,理解实质,掌握基础是解题关键,题目较简单.1年前查看全部
- 在火箭推进器中装有强还原剂肼(N 2 H 4 )和强氧化剂(H 2 O 2 ),当它们混合时,即产生大量的N 2 和水蒸
在火箭推进器中装有强还原剂肼(N 2 H 4 )和强氧化剂(H 2 O 2 ),当它们混合时,即产生大量的N 2 和水蒸气,并放出大量热。已知0.4mol液态肼和足量H 2 O 2 反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式______________________________________。
(2)已知H 2 O(l)== H 2 O(g) ΔH=+ 44kJ·mol -1 ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
_______________________________________________。 longshang1231年前1
longshang1231年前1 -
 撒欢蹦高MUA 共回答了16个问题
撒欢蹦高MUA 共回答了16个问题 |采纳率87.5%(1)N 2 H 4 (l)+2H 2 O 2 (l)==N 2 (g)+4H 2 O(g) ΔH=641.625kJ·mol -1
(2)408.8
(3)燃烧产物不污染环境1年前查看全部
- (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量.
①写出该反应的热化学方程式______.
②又已知H2O(l)=H2O(g),△H=44kJ•mol-1,则16g液态肼与液态双氧水反应生成液态水时放出的热量是______kJ.
(2)实验室用足量的金属锌与体积、浓度一定的稀硫酸反应制取氢气时(不考虑温度变化),要想使反应速率减慢,又不影响产生氢气的总量,下列措施中能达到目的是______.
①加入少量固体碳酸钠;②加入少量固体醋酸钠;
③加入适量的硫酸钠溶液;④加入适量的硝酸钠溶液;
⑤滴加少量CuSO4溶液;⑥加热. dzuojun1年前1
dzuojun1年前1 -
 yinger365 共回答了19个问题
yinger365 共回答了19个问题 |采纳率89.5%解题思路:(1)①反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
②结合上述写出的热化学方程式和谁转化的热化学方程式,根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
(2)要使氢气的生成速率减慢,但又不影响其总量,则减小氢离子浓度,而不能减小氢离子的物质的量,以此来解答.(1)①反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为[256/0.4]kJ=640kJ,
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640 kJ•mol-1;
②a、N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;
b、H2O(g)=H2O(l)△H=-44KJ/mol;
依据盖斯定律a+b×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817KJ/mol;化学方程式中32g全部反应放热817KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408kJ,
故答案为:408;
(2)①加入少量固体碳酸钠,会和硫酸之间反应,产生二氧化碳,能使使反应速率减慢,会影响产生氢气的总量,故错误;
②加入少量固体醋酸钠,会和硫酸之间反应生成醋酸,醋酸是弱酸,能使使反应速率减慢,不会影响产生氢气的总量,故正确;
③加入适量的硫酸钠溶液,减小氢离子浓度,而不能减小氢离子的物质的量,则反应速率减慢,不影响氢气的总量,故正确;
④加入适量的硝酸钠溶液,相当于溶液中含有硝酸,和金属反应不会产生氢气,所以会影响氢气的总量,故错误;
⑤滴加少量CuSO4溶液,会形成原电池,加快反应速率,故错误;
⑥加热会加快反应速率,故错误;
故选②③.点评:
本题考点: 热化学方程式;化学反应速率的影响因素.
考点点评: 本题考查热化学方程式的书写、化学反应速率的影响因素,为高频考点,把握氢离子浓度、物质的量的变化为解答的关键,注意发生的氧化还原反应是否生成氢气,题目难度不大.1年前查看全部
- 偏二甲肼是火箭推进器的常用燃料与N2O4点燃反应的化学方程式
 aimiren1年前1
aimiren1年前1 -
 gogo547 共回答了19个问题
gogo547 共回答了19个问题 |采纳率89.5%C2H8N2+2N2O4=2CO2+3N2+4H2O
C2H8N2+2N2O4=2CO2+3N2+4H2O是正确的1年前查看全部
- 偏二甲是火箭推进器的常用燃料.化学式C2N8N2写出化学式意义.
 pillowpoppy1年前3
pillowpoppy1年前3 -
 冰色点点 共回答了16个问题
冰色点点 共回答了16个问题 |采纳率87.5%化学式应为C2H8N2,意义:一个偏二甲肼分子中有两个碳,8个氢,两个氮原子.1年前查看全部
- 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量.
(1)反应的热化学方程式为______.
(2)又已知H2O(l)=H2O(g);△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是______KJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______.
发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.
已知:N2 (g)+2O2 (g)=2NO2 (g)△H=+67.7kJ/mol
N2H4 (g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ/mol
1/2H2 (g)+1/2F2 (g)=HF (g)△H=-269kJ/mol
H2 (g)+1/2O2(g)=H2O (g)△H=-242kJ/mol
(4)肼和二氧化氮反应的热化学方程式为______
(5)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:______. eriiba1年前1
eriiba1年前1 -
 特别爱特别井 共回答了15个问题
特别爱特别井 共回答了15个问题 |采纳率93.3%解题思路:(1)依据反应物和生成物配平书写化学方程式,根据定律关系判断,0.4mol液态肼和0.8mol H2O2混合恰好反应,所以1mol液态肼完全反应放出641.75kJ的热量;
(2)H2O(l)=H2O(g)△H=+44kJ/mol,依据盖斯定律计算分析得到;
(3)根据肼燃烧产物是氮气和水蒸气,都是无污染的物质来回答;
(4)依据热化学方程式和盖斯定律计算得到;
(5)依据热化学方程式,结合目标热化学方程式,利用盖斯定律计算得到.(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为[256.625kJ/0.4]=641.63kJ,所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;
依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75kJ/mol,
而16g液态肼物质的量为0.5mol,与液态双氧水反应生成液态水时放出的热量=0.5mol×817.75kJ/mol=408.875kJ,
故答案为:408.875.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是氮气和水是无污染物质,故答案为:产物环保无污染;
(4)①N2(g)+2O2(g)=2NO2(g)△H=67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
依据盖斯定律②×2-①得到,2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ•mol-1;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ•mol-1 ;
(5)①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
②[1/2]H2(g)+[1/2]F2(g)=HF(g)△H=-269kJ•mol-1
③H2(g)+[1/2]O2(g)=H2O(g)△H=-242kJ•mol-1
依据盖斯定律①-③×2+②×4得到:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1.点评:
本题考点: 有关反应热的计算;热化学方程式.
考点点评: 本题考查了热化学方程式的书写,盖斯定律的应用和反应热的计算,其中盖斯定律的应用一直是考查的热点,注意掌握,题目难度中等.1年前查看全部
- (1)火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产
(1)火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应时,放出256kJ的热量.请写出该反应的热化学方程式:______.
(2)工业上由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:TiO 2 →(步骤Ⅰ)TiCl 4
(步骤Ⅱ)TiMg.800℃.Ar
写出步骤Ⅱ中TiCl 4 →Ti的化学反应方程式______.
已知:①C(s)+O 2 (g)=CO 2 (g)△H=-393.5kJ-mol -1
②2CO(g)+O 2 (g)=2CO 2 (g)△H=-566kJ-mol -1
③TiO 2 (s)+2Cl 2 (g)=TiCl 4 (s)+O 2 (g)△H=+141kJ-mol -1
则反应TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=______kJ-mol -1 . 巴雅1年前1
巴雅1年前1 -
 南美漂流瓶 共回答了16个问题
南美漂流瓶 共回答了16个问题 |采纳率100%(1)强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热;已知0.4mol液态肼与足量液态双氧水反应时,放出256kJ的热量;则1mol液态肼完全反应放出热量为:640KJ;标注物质聚集状态和对应焓变,热化学方程式为:N 2 H 4 (l)+2H 2 O 2 (l)=N 2 (g)+4H 2 O(g)△H=-640KJ/mol
故答案为:N 2 H 4 (l)+2H 2 O 2 (l)=N 2 (g)+4H 2 O(g)△H=-640KJ/mol;
(2)工业上由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:TiO 2 →(步骤Ⅰ)TiCl 4
Mg.800℃.Ar
(步骤Ⅱ)Ti
步骤Ⅱ中TiCl 4 →Ti的化学反应方程式为:TiCl 4 +2Mg=MgCl 2 +Ti;
依据盖斯定律结合热化学方程式计算:
①C(s)+O 2 (g)=CO 2 (g)△H=-393.5kJ?mol -1
②2CO(g)+O 2 (g)=2CO 2 (g)△H=-566kJ?mol -1
③TiO 2 (s)+2Cl 2 (g)=TiCl 4 (s)+O 2 (g)△H=+141kJ?mol -1
①×2-②+③得到:TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=-80KJ/mol;
故答案为:TiCl 4 +2Mg=MgCl 2 +Ti;
TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=-80KJ/mol;1年前查看全部
- 发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合时,即产生大量的氮气
发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热,写出该反应的化学方程式______,该反应用于火箭推进器的优点是______.
 臻锋1年前3
臻锋1年前3 -
 liuliju 共回答了20个问题
liuliju 共回答了20个问题 |采纳率85%解题思路:根据偏二甲肼和双氧水反应水生成氮气和水蒸气进行分析;根据化学方程式所表现出的信息进行分析第二个空.液态肼和过氧化氢反应会生成水蒸气和氮气,故答案为:N2H4+2H2O2=4H2O↑+N2↑
因为从液态肼和双氧水反应的化学方程式可以看出,生成物只有水和氮气,不会造成粉尘等污染,故答案为:产物无污染.
故答案为:N2H4+2H2O2=4H2O↑+N2↑;产物无污染.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生对所学知识在特殊环境下的应用.学生需充分考虑特定因素,才能正确答题.1年前查看全部
- (1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应
(1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应
(1)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,请写出该反应的热化学方程式.______
(2)已知N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol 请写出用NO2做氧化剂时的热化学方程式(产物为N2和H2O)______,通过上述数据可知,在O2、NO2两者间,火箭发射通常用______做氧化剂,原因是______.
 很认真地用kk1年前1
很认真地用kk1年前1 -
 yuanaji 共回答了22个问题
yuanaji 共回答了22个问题 |采纳率95.5%(1)根据化学反应的焓变意义,结合图中给出反应的焓变,得到热化学方程式为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol,
故答案为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol;
(2)二氧化氮和肼反应生成氮气和水,N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g),
已知反应①N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol;
②N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol,
所求反应可以是①-②×[1/2]得到,所以N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g)的焓变△H=-567.85kJ/mol,
对比反应①和②,可以看出消耗相同的N2H4 产生的热量更多,并且NO2的沸点更高,更容易储存,
故答案为:N2H4(g)+NO2(g)═[3/2]N2(g)+2H2O(g)△H=-567.85kJ/mol;NO2;消耗相同的N2H4 产生的热量更多,NO2的沸点更高,更容易储存.1年前查看全部
大家在问
- 1六十五等于几
- 2已知a,b,C,为三个都不为0的个有理数,求a分之a的绝对值十b分之b的绝对值十c分之c的绝对值十abc分之abc的绝对
- 3(2010•武清区二模)今年春晚刘谦表演的近景魔术如真似幻,让人大饱眼福,陈老师也在化学晚会上表演如下魔术:用毛笔蘸取一
- 4此时此刻突然有点想你英语怎么说
- 5下列反应中,有单质生成,但不属于置换反应的是( )
- 6英语翻译Sports people are a great example of what happens if you
- 7徐海滨《吼秦腔》一文的阅读题答案?
- 836个同学排队做游戏,每两个女生中间是两个男生,第一个是女生,这个队伍中男生有多少人?
- 9下面左图为细胞分裂过程中细胞核内DNA含量变化的曲线图,右图表示某二倍体动物的一
- 10甲,乙两辆汽车同时从一条公路的东西两地相向而行,甲车每小时行96千米,乙车的速度是甲车的7/8,4小时后两车相遇.东、西
- 11英语翻译An important new study into teenage attitudes surprising
- 12利用化学性质区分白醋和白酒两种物质
- 13Te Quiero 的读音请懂西班牙语的朋友用中文把以上短语的读音标注一下!
- 14s开头ny结尾的英语单词求助啊 还有 cl_ _dy r_ _ny sn_ _y
- 15I never care about what everyone was concerned for but you w
