N2O4=(可逆反应)2 NO2中,容器内气体密度不发生变化是否平衡?
 satum2022-10-04 11:39:541条回答
satum2022-10-04 11:39:541条回答恒容装置里~~

已提交,审核后显示!提交回复
共1条回复
 ymy3511551 共回答了10个问题
ymy3511551 共回答了10个问题 |采纳率90%- 不能这样说
密度=质量/体积
1、如果在恒压装置里可以这样说
2、如果在恒容装置里,气体体积不变,化学反应不改变质量变化,所以无论什么时候密度都不变.所以恒容装置不能这么说 - 1年前
相关推荐
- 一个为可逆反应的化学反应,该反应为放热反应,那么降低温度的话,会不会缩短反应到达平衡的时间?为什么?
 开拓85271年前1
开拓85271年前1 -
 Greathopes 共回答了13个问题
Greathopes 共回答了13个问题 |采纳率76.9%反应达到平衡的时间是与化学反应速率有关的,降低温度只能对平衡的移动产生影响,温度对反应的影响是温度对速率的影响.1年前查看全部
- 三价铁与碘离子是可逆反应么
 天际苍穹1年前1
天际苍穹1年前1 -
 dfllq 共回答了22个问题
dfllq 共回答了22个问题 |采纳率95.5%是的,可以验证一下.如果反应后三价铁与碘离子都有剩余说明就是可逆的,如果,不可逆,必有一种是不存在的.像含有三价铁与碘离子反应后的溶液中加入 CCI4振荡后,油层显紫色 , 然后 上层水溶液滴加KSCN后溶液呈血红色这...1年前查看全部
- 水和氯气反应生成氯化氢和次氯酸的反应是可逆反应么?为什么我们教科书上没注明?
水和氯气反应生成氯化氢和次氯酸的反应是可逆反应么?为什么我们教科书上没注明?
如题
 sngy1年前1
sngy1年前1 -
 zhongmingxuan 共回答了28个问题
zhongmingxuan 共回答了28个问题 |采纳率78.6%是 可逆反应,
因为我们的教科书上面 在高一的教材中并没有明确的指出让高一的学生掌握可逆反应.1年前查看全部
- 怎么看化学反应达到平衡状态?可逆反应怎么看达到平衡了呢?希望大家帮下,最好具体点!
 guanggao5191年前2
guanggao5191年前2 -
 coork 共回答了18个问题
coork 共回答了18个问题 |采纳率88.9%第一大类方法:本质性判断.化学平衡状态的本质性标志是:“正反应与逆反应的速率相等”.这样就可以直接或间接地衍生出以下6种判断方式:
(1)从速率的角度描述:同一物质的生成速率等于消耗速率;
(2)从速率的角度描述:处于可逆方程式同一侧(即两者同为反应物或两者同为生成物)的不同种物质,必须一种物质生成同时另一种物质消耗,且两者的速率之比等于化学方程式中化学计量数之比;
(3)从速率的角度描述:处于可逆方程式不同侧(即一为反应物,另一为生成物)的不同种物质,必须两种物质同时生成或同时消耗,且两者的速率之比等于化学方程式中化学计量数之比;
(4)从时间和物质的生消量的角度描述:单位时间内消耗掉某物质的量与生成该物质的量相等;
(5)从断键角度描述:如H2+I2 2HI的反应,单位时间内断裂一个H—H键的同时,形成一个H—H键,或形成一个I—I键,或断裂2个H—I键;
(6)从能量角度描述:绝热容器中,反应放出的热量与吸收的热量相等,即体系温度不变.
第二大类方法:特征性判断.化学平衡状态的特征性标志是:“反应混合物中各组分的浓度保持不变.”这样,就又可以直接或间接地衍生出以下5种判断方式:
(7)反应混合物中和物质的物质的量浓度保持不变;
(8)反应混合物中各物质的物质的量分数、质量分数、体积分数(对气体物质而言)等保持不变;
(9)反应混合物中各物质的物质的量、质量、分子数等保持不变;
(10)反应混合物中某一种反应物的转化率、某一生成物的产率等保持不变;
(11)反应混合物中某些特征,如某组分有颜色,体系的颜色不再改变时.
第三大类方法:整体性判断.化学平衡状态可以从各组分来判断以外,对于有些可逆反应,还可以采取反应混合物的整体情况来判断.
如:对于mA(g)+nB(g) pC(g)+qD(g) (其中m+n≠p+q)
或者mA(s)+nB(g) pC(g)+qD(g) (其中n≠p+q)
等可逆反应而言,只要出现下列几种情况时,也达到了平衡状态:
(12)定温、定容条件下,总压强保持不变;
(13)定温、定压条件下,总体积保持不变;
(14)定容条件下,气体密度保持不变(仅指除气体外还有固、液物质反应或生成的反应)
(15)总物质的量保持不变;
(16)总分子数保持不变.
特别要提醒的是:当上述反应中气体计量数相等时,上述(12)—(16)情况在反应的任一过程中都会保持不变.1年前查看全部
- 可逆反应到了化学平衡之后,正反方向的两个反应都停止而不再进行,
可逆反应到了化学平衡之后,正反方向的两个反应都停止而不再进行,
并请说明理由谢谢 逍遥的虫子1年前1
逍遥的虫子1年前1 -
 先做个小记号 共回答了22个问题
先做个小记号 共回答了22个问题 |采纳率100%不是,可逆反应到了平衡之后,只是相对停止,是因为正反应和逆反应速率相等,所以表面看起来没有反应,可是从微观上讲,还是在继续反应的!1年前查看全部
- 可逆反应的化学反应速率怎么求为什么等于计量数之比?不是正反应进行的时候 逆反应不也在进行吗?为什么老师都叫我先看正反应
可逆反应的化学反应速率怎么求
为什么等于计量数之比?不是正反应进行的时候 逆反应不也在进行吗?为什么老师都叫我先看正反应 再看逆反应?两个同时进行怎么能这样看?我怎么老想不明白 siyuandn1年前1
siyuandn1年前1 -
 lala9287 共回答了18个问题
lala9287 共回答了18个问题 |采纳率100%我知道你为什么想不明白 ,因为我以前跟你犯了一个同样的错误.
1.化学反应速率=浓度/时间 ,因为时间相等,所以化学反应速率的变化就等于浓度的变化.浓度的变化,其本质就是溶液内所含该物质的量减少或者增加了,而化学计量数是溶液中这种物质的量,其变化的量也就是体现了浓度变化的量.二者是成正比例关系,所以其比值是相等的.
2.我想你没有明白为什么正反应进行的时候你反应也在进行.什么是可逆反应呢?在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应.请你好好理解这句话,因为正逆反应发生所需要的外界条件相同,所以两种反应会同时进行.
3.你错就错在你以为正逆反应的反应物同时存在
比如A+B==C ,该可逆反应先加入A和B,生成C,因为该反应是可逆反应,正逆反应所需要的条件相同,于是生成了C以后,C就会生成A和B,这时A和B继续反应生成C,而C也不断生成A+B ,所以当正反应发生以后,生成了生成物,然后生成物在相同条件下生成反应物,两种反应同时进行1年前查看全部
- 可逆反应写热化学方程式时写可逆符号还是"=",若吸热,△H要不要写"+"?
 weiwei11011年前1
weiwei11011年前1 -
 tyhty 共回答了14个问题
tyhty 共回答了14个问题 |采纳率78.6%写可逆符号 要写“+”1年前查看全部
- 可逆反应的反应热的定义
 fujiayan111年前1
fujiayan111年前1 -
 szby731 共回答了16个问题
szby731 共回答了16个问题 |采纳率93.8%可逆反应的反应热是反应物完全反应后放出或吸收的热量,不是达到平衡时的,比如3mol氢气和1mol氮气合成氨的反应,一定指生成2mol氨释放出得的热量.
ΔH就是指生成相应物质的量的生成物,需要相应反应物的物质的量的对应热量.
N2+3H2(可逆符号=)2NH3 △H=-92.4KJ/mol
程表现的是完全反应的反应热 也就是说 生成2molNH3的反应热或反应1molN2,3molH2的反应热.
在温度和总体积不变的情况下,取1molH2和3molH2在密闭的容器中,生成的NH3小于2mol ,反应热总小于92.4KJ1年前查看全部
- 可逆反应A(g)+2B(g) 2C(g)+Q(Q>0),在一定条件下达到平衡.
可逆反应A(g)+2B(g) 2C(g)+Q(Q>0),在一定条件下达到平衡.
若改变条件,将变化情况(增大、减小、不变)填入空格
⑶保持温度和压强不变加入稀有气体,则C的物质的量__减小___.
⑷保持温度和体积不变加入稀有气体,则A的转化率__不变__.
⑸若温度和体积不变,反应从A、B开始至平衡,在这个变化过程中,
容器内气体的密度___不变___ ,压强__增大__. 其实最爱熏衣草1年前1
其实最爱熏衣草1年前1 -
 大蛮妖 共回答了21个问题
大蛮妖 共回答了21个问题 |采纳率85.7%A(g)+2B(g) 2C(g)+Q(Q>0),
反应的特点:气体体积减小;放热反应
⑶保持温度和压强不变加入稀有气体,则C的物质的量__减小___.
此题特点是压强不变,稀有气体和反应无关,但是由于压强不变,即容器有活塞,随稀有气体增加,活塞会向上动,相当于对反应增大体积,所以,平衡逆向动,C变少.
⑷保持温度和体积不变加入稀有气体,则A的转化率__不变__.
此题的特点是体积不变,即恒容,容器没有活塞,稀有气体增加,对反应没有任何影响,平衡不动,C不变.
以上两个问题的关键是气体反应,改变体积,改变压强应该是“改变参与反应的气体的压强,平衡会移动”
⑸若温度和体积不变,反应从A、B开始至平衡,在这个变化过程中,
容器内气体的密度___不变___ ,压强__增大__.
即从左边开始反应,恒容容器,气体从3mol变成2mol,气体总质量不变,恒容,总体积不变,所以密度不变.
但是气体物质的量在减少,所以压强应该是减小,答案错了.1年前查看全部
- 一定条件下,可逆反应X+3Y==2Z ,若X.Y.Z的起始溶度为C1.C2.C3.平衡时,XYZ的溶度分别为0.1 ,0
一定条件下,可逆反应X+3Y==2Z ,若X.Y.Z的起始溶度为C1.C2.C3.平衡时,XYZ的溶度分别为0.1 ,0.3,0.0
那么CI的取值范围是0〈CI〈0.14
这个范围是怎么求出来的啊
SORRY啊 Z的溶度是0.08 65970851年前1
65970851年前1 -
 来自南方的郎 共回答了15个问题
来自南方的郎 共回答了15个问题 |采纳率80%怎么可能Z的浓度是0呢?1年前查看全部
- 一定条件下,可逆反应X(g)+3Y(g)=2Z(g)若X.Y.Z起始浓度分别为c1.c2.c3(均不为0,单位是mol/
一定条件下,可逆反应X(g)+3Y(g)=2Z(g)若X.Y.Z起始浓度分别为c1.c2.c3(均不为0,单位是mol/L),
当达到平衡是X.Y.Z的浓度分别为0.1mol/L,0.2mol/L,0.08mol/L,则下列判断不合理的是( ) A.c1:c2=1:3 B.平衡是,Y 和Z的反应速率之比为3:2 C.X.Y的转化率不相等 Dc1的取值范围为0 我承认我是醒目1年前1
我承认我是醒目1年前1 -
 被他溶化 共回答了13个问题
被他溶化 共回答了13个问题 |采纳率92.3%c1年前查看全部
- 可逆反应的速率也会受到温度的影响吗?
 努力存钱1年前2
努力存钱1年前2 -
 GK-123 共回答了10个问题
GK-123 共回答了10个问题 |采纳率100%当然
温度升高正逆反应速率都不同程度的增大,而最后平衡会向吸热反应方向移动.1年前查看全部
- 只有可逆反应才有化学平衡常数吗?
 qq来qq1年前1
qq来qq1年前1 -
 dashman 共回答了26个问题
dashman 共回答了26个问题 |采纳率92.3%是的.如果是单先反应,如Cao+H2O=Ca(OH)2.只要一方没消耗完,反应就继续进行.直到以防消耗完为止.当然这是理论.1年前查看全部
- 可逆反应的转化率为什么等于1?以N2+3H2=2NH3为例 ,当分别以1摩尔N2,3摩尔H2和2摩尔NH3投料时,为什么
可逆反应的转化率为什么等于1?
以N2+3H2=2NH3为例 ,当分别以1摩尔N2,3摩尔H2和2摩尔NH3投料时,为什么两反应转化率和为1?
两反应是在不同容器中进行的. 851261年前1
851261年前1 -
 鬼谷子jeven 共回答了16个问题
鬼谷子jeven 共回答了16个问题 |采纳率100%都是气体 处于平衡状态了 转化率也许错了吧1年前查看全部
- 可逆反应中怎么求转化率啊RT
 jinjiang1年前1
jinjiang1年前1 -
 csdn3141 共回答了18个问题
csdn3141 共回答了18个问题 |采纳率77.8%找一种反应体系中的物质,转化率等于该物质反应掉的量除以该物质反应前的总量1年前查看全部
- 在恒容的密闭容器中,可逆反应X(s)+Y(g)=2Z(g)▷H>0
在恒容的密闭容器中,可逆反应X(s)+Y(g)=2Z(g)▷H>0
达到平衡时,下列说法正确的是
A:充入少量He使容器内压强增大,平衡正移
B:升高温度,平衡向正反应方向移动,容器内压强减小
C:继续加入少量X,再次平衡时,Y的转化率增大
D:继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小 bx091年前1
bx091年前1 -
 lihuimin7711 共回答了14个问题
lihuimin7711 共回答了14个问题 |采纳率92.9%选D
解析:
A 恒温恒容时,充入稀有气体,总压增大,分压不变,浓度不变,所以平衡不移动.
B 温度升高,平衡向正反应方向移动,生成气体的物质的量增大,所以容器内压强增大.
C加入X,X是固体,不影响化学平衡,所以Y的转化率不变.
D 加入Y,平衡向正向移动,但加入的量多,转化的少,所以再次平衡时,Y的体积分数比上次平衡小.1年前查看全部
- 别看标题,看这里的:在一定温度下,某密闭容器中存在反应:2SO2(g)+O2(g)=2SO3(g)《可逆反应》.已知SO
别看标题,看这里的:在一定温度下,某密闭容器中存在反应:2SO2(g)+O2(g)=2SO3(g)《可逆反应》.已知SO2、O2起始浓度分别为0.4mol.L^(-1)、1.0mol.L^(-1),经测定该反应在该温度下的平衡常数K约等于19.试判断当SO2转化率为50%时,该反应是否达到平衡状态?若未达到,将向哪个方向进行
 裟霎1年前1
裟霎1年前1 -
 秦岭 共回答了22个问题
秦岭 共回答了22个问题 |采纳率95.5%转化率为0.5时 so2有0.2mol o2有0.9mol so3
有0.2mol 所以 k=2 不完全 向正方向 对不?1年前查看全部
- 可逆反应的化学反应速率与压强有什么关系
可逆反应的化学反应速率与压强有什么关系
如果反应中增加压强的话,那么化学平衡是向正方向移动还是逆反应方向移动啊,这一部分的能教我吗,还有化学平衡具体是什么啊 manterocn1年前3
manterocn1年前3 -
 tt娃娃14 共回答了19个问题
tt娃娃14 共回答了19个问题 |采纳率94.7%对于这样的反应,首先看左右反应物与生成物前系数的合是否相等,若相等,则反应中压强是不变的(对于气体而言)
从压强方面看:
增大压强,平衡向气体物质的量减少的方向移动(即系数小的方向)
减小压强,平衡向气体物质的量增加的方向移动
从温度方面看:
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
从浓度方面看:
增加反应物的浓度或减小生成物的浓度,平衡正向移动
减小反应物的浓度或增加生成物的浓度,平衡逆向移动
从催化剂方面看:
平衡不受催化剂的影响
或者根据勒夏特列原理可知:
若改变影响平衡的一个条件,平衡总是要向能够减弱这种改变的方向移动.1年前查看全部
- N2O4=2NO2是可逆反应么?正反应是吸热还是放热?
N2O4=2NO2是可逆反应么?正反应是吸热还是放热?
反应在常温下就直接进行么?该反应中N2O4和NO2的状态各是什么?(固、液气)
到底是吸热还是放热啊? CB04031年前5
CB04031年前5 -
 沥沥熏熏 共回答了17个问题
沥沥熏熏 共回答了17个问题 |采纳率94.1%是可逆的,正反应吸热.1年前查看全部
- (1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0达到平衡的标志是______(
 (1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0达到平衡的标志是______(填编号)
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0达到平衡的标志是______(填编号)
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)=V(NH3逆)
⑦单位时间内3mol H-H键断裂的同时2mol N-H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2)向某体积固定的密闭容器中加入0.3mol A、0.1mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示.已知在反应过程中混合气体的平均分子量没有变化.请回答:
①密闭容器的体积是______ L.
②若t1=15s时,则t0-t1阶段以C物质浓度变化表示的反应速率为v(C)=______.
③写出反应的化学方程式:______.
④B的起始物质的量是______.
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:H2(g)+[1/2] O2(g)=H2O(g)△H=-241.8 kj/molH2(g)+[1/2] O2(g)=H2O(g)△H=-241.8 kj/mol.若1g水蒸气转化为液态水放热2.44kJ,则反应2H2(g)+O2(g)═2H2O(l)△H=______ kJ•mol-1. id_4191年前1
id_4191年前1 -
 kjyshhh 共回答了27个问题
kjyshhh 共回答了27个问题 |采纳率92.6%解题思路:(1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(2)①根据图象中A的起始浓度及物质的量求算体积;
②根据图象中C的浓度变化求算其反应速率;
③A的浓度减小为反应物,C的浓度增大为生成物,且反应前后计量数相同,根据反应物质的变化量之比等于计量数比求算;
④B为生成物,根据反应的量和平衡时的量求出初始量;
(3)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式,方程中的热量和化学计量数要对应;根据m=nM计算1mol水的质量为18g,进而计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热.(1)①速率之比等于对应物质的化学计量数之比,反应开始后一直成立,不能说明反应达到平衡状态,故①错误;
②当体系达平衡状态时,反应混合物各组分的物质的量浓度不变,故②正确;
③该反应正方向为计量数减小的反应,随着反应进行压强不断减小,当压强不变时,反应达到平衡状态,故③正确;
④反应容器的体积不变,气体的质量守恒,所以密度始终不变,密度不变时不能说明反应达到平衡状态,故④错误;
⑤单位时间内生成n mol N2表示逆速率,生成3n mol H2表示逆速率,都表示逆速率,不能说明反应达到平衡状态,故⑤错误
⑥2V(N2正)=V(NH3逆),即氮气的正速率与氨气的逆速率之比等于计量数之比,则反应达到平衡状态,故⑥正确;
⑦单位时间内3molH-H键断裂等效于6mol N-H键形成,同时6mol N-H键断裂,故⑦错误;
⑧混合气体的物质的量逐渐减小,质量不变,则平均相对分子质量逐渐增大,当平均相对分子质量不变时,即是平衡状态,故⑧正确;
故答案为:②③⑥⑧;
(2)①由图象可知A的起始浓度为0.15mol/L,A的物质的量为0.3mol,则体积为V=[n/c]=[0.3mol/0.15mol/L]=2L;
故答案为:2;
②由图象C的浓度变化为c(C)=0.11mol/L-0.05mol/L=0.06mol/L,则其反应速率为v(C)=
c(C)
t=[0.06mol/L/15s]=0.004 mol•L-1•s-1;
故答案为:0.004;
③A的浓度较小为反应物,A的浓度变化为:0.15mol/L-0.06mol/L=0.09mol/L,C的浓度增大为生成物,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,则A、C的计量数之比为3:2,在反应过程中混合气体的平均分子量没有变化,则反应前后计量数相同,所以B为生成物,且计量数为1,所以反应方程式为:3A⇌B+2C;
故答案为:3A⇌B+2C;
④B为生成物,B的变化量为[1/2]×△c(C)=[1/2]×0.06mol/L=0.03mol/L,B的平衡浓度为0.05mol/L,则B的起始浓度为0.05mol/L-0.03mol/=0.02mol/,则物质的量为0.02mol/L×2L=0.04mol;
故答案为:0.04mol;
(3)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+[1/2]O2(g)=H2O(g)△H=-241.8kJ/mol;
1g水蒸气转化成液态水放热2.44kJ,故18g水蒸气转化成液态水放出热量2.44kJ×18=43.92kJ,故反应H2(g)+[1/2]O2(g)═H2O(l)的反应热△H=-(241.8kJ/mol+43.92kJ/mol)=-285.72kJ/mol;所以反应2H2(g)+O2(g)═2H2O(l)△H=-571.48kJ/mol;
故答案为:H2(g)+[1/2]O2(g)=H2O(g)△H=-241.8kJ/mol;-571.4.点评:
本题考点: 物质的量或浓度随时间的变化曲线;热化学方程式;化学平衡建立的过程;化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断、反应速率的计算、反应方程式的确定、热化学方程式的书写等,题目涉及的内容较多,侧重于考查学生对所学知识的综合应用能力,题目难度中等.1年前查看全部
- 可逆反应达到化学平衡状态的特征是正逆反应速率相等,那么这个正逆反应速率是指同一物质的正逆反应速率还是反应物与生成物的正逆
可逆反应达到化学平衡状态的特征是正逆反应速率相等,那么这个正逆反应速率是指同一物质的正逆反应速率还是反应物与生成物的正逆反应速率或者都行?
 luck10191年前3
luck10191年前3 -
 ygp12 共回答了9539个问题
ygp12 共回答了9539个问题 |采纳率0.2%是同一物质的速度; 由于速度之比等于系数之比,也可以用系数相同的物质来替换。1年前查看全部
- 1.)催化剂能使可逆反应正、逆反应速率同时加快吗.
1.)催化剂能使可逆反应正、逆反应速率同时加快吗.
---------------
2.)可逆反应 M+NQ 达到平衡时,下列说法正确的是()
A.M.N.Q三种物质的浓度一定相等.
B.反应混合物各成分的百分组成不再变化、
---------------
3.下列说法正确的是()
A.化学反应放热还是吸热,取决于反应条件.
B.放热反应都不需要加热就可以发生.
C.反应条件是加热的反应都是吸热反应、
4.在原电池中,电子流出的一极是负极,发生氧化反应吗? ivia21年前5
ivia21年前5 -
 5108h 共回答了19个问题
5108h 共回答了19个问题 |采纳率94.7%1 正确 催化剂是让反映可以进行,而不仅仅是加快反映速度
2 B 反映达到平衡之后,正向逆向反映速度相等,所以各物质浓度不变
3 A 但是不准确 取决于反应物的性质,但是三个答案里A就最符合了
4 是 失去电子 化合价升高 氧化反映1年前查看全部
- 下列图象描述正确的是( ) A.根据图①可判断可逆反应A 2 (g)+3B 2 (g)⇌2AB 3 (g)正反应是吸热
下列图象描述正确的是( ) 
A.根据图①可判断可逆反应A 2 (g)+3B 2 (g)⇌2AB 3 (g)正反应是吸热反应 B.图②表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强大 C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 D.根据图④溶解度与溶液pH关系,若除去CuSO 4 溶液中的Fe 3+ 可向溶液中加入适量CuO,调节至pH在4左右  倚诺1年前1
倚诺1年前1 -
 xxd4183 共回答了22个问题
xxd4183 共回答了22个问题 |采纳率90.9%A.通过图象知,升高温度,正逆反应速率都增大,但逆反应速率大于正反应速率,平衡向逆反应方向移动,则正反应是放热反应,故A错误;
B.通过图象结合“先拐先平数值大”知,乙的压强大于甲,增大压强,平衡向正反应方向移动,则反应物含量减小,故B错误;
C.溶液的导电性与溶液中离子的浓度成正比,醋酸是弱电解质,向醋酸中通入氨气,醋酸和氨气反应生成强电解质醋酸铵,溶液中离子浓度增大,导电性增强,故C错误;
D.在pH=4左右,氢氧化铁的浓度最小,接近为0,氢氧化铜浓度最大,若除去CuSO 4 溶液中的Fe 3+ 可向溶液中加入适量CuO,调节至pH在4左右,使铁离子转变成氢氧化铁沉淀而除去,故D正确;
故选D.1年前查看全部
- 可逆反应达到化学平衡时,正&逆反应速率都为0吗?
 linshifan521年前1
linshifan521年前1 -
 nattan109 共回答了20个问题
nattan109 共回答了20个问题 |采纳率85%答:否
化学平衡是“动态平衡”,即达到平衡状态时,正、逆反应速率相等,且均不为零.也就是说,平衡状态下,方程中任何一种物质的生成速率,都等于该物质的消耗速率,故方程中任何一种物质的浓度都不再变化.1年前查看全部
- 高一化学有关可逆反应的 详解写明白了
高一化学有关可逆反应的 详解写明白了
在密闭容器中进行如下反应X2+Y2=2Z已知X2 Y2 Z的起始浓度是0.1mo/l 0.3mol/l和0.2mol/l在一定条件下,当反应达到平衡时,各物质的浓度可能是
A Z为0.3mol/l B Y2为0.35
C X2为0.2 D Z为0.4
后面mol/l懒得写了 老师还没讲但题目有了! ice_reep1年前1
ice_reep1年前1 -
 素雅鸟 共回答了18个问题
素雅鸟 共回答了18个问题 |采纳率100%用极值法,先将反应物全部变成生成物
X2 + Y2= 2Z
c起 0.1 0.3 0.2
C变 0.1 0.1 0.2
C终 0 0.2 0.4
所以D错,因为可逆反应不能完全反应
将生成物全转化为反应物
X2 + Y2= 2Z
c起 0.1 0.3 0.2
C变 0.1 0.1 0.2
C终 0.2 0.4 0
所以C错因为可逆反应不能完全反应
0.21年前查看全部
- X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y←可逆反应→2Z,达到平衡后
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y←可逆反应→2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质之比为3:2,则Y的转化率最接近于:
A、33% B、40% C、50% D、67% 最爱贾宝玉1年前5
最爱贾宝玉1年前5 -
 reazo 共回答了21个问题
reazo 共回答了21个问题 |采纳率90.5%选择D
设X Y 都是充入的 5 mol
X+2Y可逆符号2Z设Y的转化率是 a
所以反应的X是2.5a Y反应了5a 生成Z是 5a
反应过后的x=5-2.5a Y= 5-5a 生成物z = 5a
反应物一起剩余的 (5-2.5a)+(5-5a)=10-7.5a
所以混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2
列式可得
(10-7.5a):(5a)=3:2
所以a = 0.6666666666
所以最接近D1年前查看全部
- 可逆反应2HI(g)可逆H2(g)+I(g) 为什么碘化氢的量不同不会影响平衡时各成分的百分含量?
 arq8221年前1
arq8221年前1 -
 fcsqfcym 共回答了19个问题
fcsqfcym 共回答了19个问题 |采纳率89.5%反应前后分子数不变,因此无论增压降压,增容降容,K=[H2]x[I2]/[HI]2 都是不变的,因此如果只有碘化氢投入,量不会影响百分含量1年前查看全部
- 可逆反应A(s)+B(可逆符号)C达到平衡后,B的转化率与压强、温度的关系如图所示.下列说法正确的是
可逆反应A(s)+B(可逆符号)C达到平衡后,B的转化率与压强、温度的关系如图所示.下列说法正确的是
A.B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体,正反应是吸热反应
C.B是气体,C是固体,正反应是放热反应
D.B、C都是气体,正反应是放热反应
 redbeanpig1年前1
redbeanpig1年前1 -
 liujinwen001 共回答了17个问题
liujinwen001 共回答了17个问题 |采纳率88.2%A
B1年前查看全部
- 高二化学 平衡问题如图,11题,为什么选D?D为什么是因为可逆反应不到底来排除的?如果是完全反映,我觉得是4Q不是3Q
 城市乌鸦-0081年前2
城市乌鸦-0081年前2 -
 紫液泡影 共回答了16个问题
紫液泡影 共回答了16个问题 |采纳率100%B肯定是对的.(等同平衡原理)
D错在:这里的逆反应吸热应该是Q2啊.每mol反应中有2molC做反应物.1年前查看全部
- 某兴趣小组为探究温度和压强对可逆反应X(g)+Y(g)=Z(g)+W(g)的影响
某兴趣小组为探究温度和压强对可逆反应X(g)+Y(g)=Z(g)+W(g)的影响
某兴趣小组为探究温度和压强对可逆反应X(g)+Y(g)=Z(g)+W(g)的影响,进行如下实验:一定条件下,向容积为1L的密度容器中通入1molX 和1molY,反应达到平衡后,测得容器中X,Y,Z的物质的量浓度均是0.5mol.L^-1,然后改变外界条件(其他条件不变),A,B.C,D四位同学所得数据可能正确的是:( )
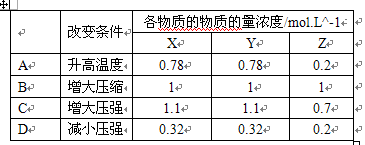
X(g)+Y(g)=Z(g)+W(g)改为
X(g)+Y(g)=Z(g)+W(s) chengyu7131年前1
chengyu7131年前1 -
 地势坤46 共回答了15个问题
地势坤46 共回答了15个问题 |采纳率93.3%丫的,我就说嘛.B,C都是错的,因为一开始就是加的1 1的 关系.
变化V=1 减压平衡会向体积增大的方向进行.所以D选项是错误的.
A选项,先算未改变条件之前的K =2 改变之后为0.3 K在减小,说明升温平衡逆向移动,A B 都增大,Z减小1年前查看全部
- 2A (g)+2B(g) 可逆反应生成 4C(g)+ 2D(s) 与等效平衡(80分,我要正确答案)
2A (g)+2B(g) 可逆反应生成 4C(g)+ 2D(s) 与等效平衡(80分,我要正确答案)
气体的总量不变.那么在等温恒容条件下,如果在甲容器中加2mol A ,2molB.CD起始都为零以及在乙中加入2mol A ,2molB,4mol C,2molD.(D是固体其余为气体)那么平衡时两个能不能形成等效平衡?为什么?(我觉得是可以的,因为固体不影响反应速率,感激. 大眼东健1年前3
大眼东健1年前3 -
 忽胖忽瘦的弹簧 共回答了17个问题
忽胖忽瘦的弹簧 共回答了17个问题 |采纳率82.4%对于2mol A,2molB,4mol C,2molD,把C和D全部转化成A和B后,A物质的量 = 2+2 = 4mol,B物质的量 = 2+2 = 4mol
所以只需比较2mol A,2mol B和4mol A,4mol B是否是等效平衡.
现在题目说在等温恒容条件下,而这个反应的反应前后气体体积不变.等容反应反应前后气体体积不变,反应物又成正比,所以两者是等效的.1年前查看全部
- 由可逆反应测绘出图象,纵坐标为生成物在平衡混合物中百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象,纵坐标为生成物在平衡混合物中百分含量,下列对该反应的判断正确的是( )
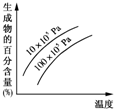 A. 反应物中一定有气体
A. 反应物中一定有气体
B. 生成物中一定有气体
C. 正反应一定是放热反应
D. 正反应一定是吸热反应 louisa_cy1年前1
louisa_cy1年前1 -
 artnoc 共回答了19个问题
artnoc 共回答了19个问题 |采纳率78.9%解题思路:“定一议二”:温度不变时,增大压强,生成物的百分含量降低,说明平衡逆向移动,逆向为体积缩小方向,而题中未给出具体的可逆反应,但是可以确定生成物中一定有气体,压强不变时,升高温度,生成物的百分含量增大,说明平衡正向移动,正向为吸热反应.根据图示可以看出:压强不变,温度升高,产物的百分含量增大,所以平衡正向移动,反应是吸热的,温度不变,压强增大,产物的百分含量减小,所以平衡逆向移动,逆向为体积缩小方向,而题中未给出具体的可逆反应,但是可以确定生成物中一定有气体.
故选BD.点评:
本题考点: 产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题考查学生影响化学平衡移动的因素:温度、压强,注意“定一议二”法的应用,难度中等.1年前查看全部
- 可逆反应的转化率问题增大一种反应物的浓度,可提高另一种反应物的转化率,但它本身的转化率反而降低.这是为什么?主要是"它本
可逆反应的转化率问题
增大一种反应物的浓度,可提高另一种反应物的转化率,但它本身的转化率反而降低.这是为什么?主要是"它本身的转化率反而降低"我不懂, lhp04131年前2
lhp04131年前2 -
 llxmaggie 共回答了22个问题
llxmaggie 共回答了22个问题 |采纳率95.5%转化率=转化量/初始量
如A+B=C
加入使A平衡向右,B的转化率变大.但是平衡是微弱的,A转化率分母增加的较多,所以降低
这个问题用"有效碰撞"理论来解释最为准确.
设可逆反应为:A(气)+B(气)+C+D
固定A的起始量,增大B的起始量.
显然,B的起始量越大,则每个B分子受到A分子碰撞的机率就越小.(鸟群中的每只鸟,要比独飞的鸟受到鹰攻击的机率更小)
而B的转化率与"单位时间内,单个B分子受到的有效碰撞次数成正比."
故B的起始量越大,B的转化率就越低.
奇妙的是,如果转变看问题的角度,B的起始量越大,则每个A碰撞到B的机率就越大,则A的转化率就越高.(鹰向鸟群冲刺比向单只鸟冲刺更易碰到鸟.当然,前提是鹰不要被鸟群吓倒,嘿嘿.)
这也就是说,提高哪种反应物的起始量,哪种反应物的转化率就会降低,而其他反应物的转化率就会升高.1年前查看全部
- 可逆反应X(g)+3Y(g)=2Z(g).Y和X的生成速率之比为3:2.可以说明是平衡状态吗?
 xujibo05961年前1
xujibo05961年前1 -
 slina2008666 共回答了18个问题
slina2008666 共回答了18个问题 |采纳率88.9%可以1年前查看全部
- 可逆反应aA(g)+bB(g)⇌cC(g)+dD(g)(C%为C的百分含量)有如图关系:则下列叙述中正确的是( )
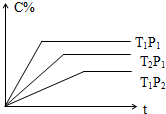 可逆反应aA(g)+bB(g)⇌cC(g)+dD(g)(C%为C的百分含量)有如图关系:则下列叙述中正确的是( )
可逆反应aA(g)+bB(g)⇌cC(g)+dD(g)(C%为C的百分含量)有如图关系:则下列叙述中正确的是( )
A.a+b>c+d,正反应为放热反应
B.a+b>c+d,正反应为吸热反应
C.a+b<c+d,正反应为放热反应
D.a+b<c+d,正反应为吸热反应 娃哈哈3z1年前1
娃哈哈3z1年前1 -
 紫球菊 共回答了20个问题
紫球菊 共回答了20个问题 |采纳率100%解题思路:由图象可知,在P1条件下,T1到达平衡时间少说明反应速率大,则T1>T2,在T1条件下,P1到达平衡时间少说明反应速率大,则P1>P2,根据温度、压强对化学平衡移动的影响解答该题.由图象可知,在P1条件下,T1到达平衡时间少说明反应速率大,则T1>T2,而在T1时C%较大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应;
在T1条件下,P1到达平衡时间少说明反应速率大,则P1>P2,而在P1时C%较大,说明增大压强平衡向正反应方向移动,则
a+b>c+d,
故选B.点评:
本题考点: 体积百分含量随温度、压强变化曲线.
考点点评: 本题考查化学平衡移动图象问题,题目难度中等,本题注意通过比较温度、压强对C%的含量的影响以及达到平衡状态的时间比较温度、压强的大小,该类题目为常考查知识.1年前查看全部
- 可逆反应a+b=2c 放热反应 升高温度,减少压强速率怎么变
 枫致1年前1
枫致1年前1 -
 青风名月 共回答了16个问题
青风名月 共回答了16个问题 |采纳率87.5%升高温度,逆反应增强,减小压强反应速率不变1年前查看全部
- 可逆反应X+Y=Z达到平衡时,的一个问题,谢谢回答~!
可逆反应X+Y=Z达到平衡时,的一个问题,谢谢回答~!
有一个选项是,若Y是气体,增大X的浓度,可使Y的转化率升高, 是对的
但我感觉若X是纯液或纯固,这个选项不就错了么,谢谢,~! 柏邦妮1年前1
柏邦妮1年前1 -
 兜兜的镜子 共回答了20个问题
兜兜的镜子 共回答了20个问题 |采纳率90%浓度只针对溶液而言.
纯液或纯固不存在浓度的说法.1年前查看全部
- 可逆反应mA(s)+nB(g)⇌pC(g)(正反应放热),在一定温度下,反应体系中B的体积分数与压强的关系如图,有关叙述
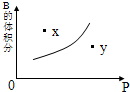 可逆反应mA(s)+nB(g)⇌pC(g)(正反应放热),在一定温度下,反应体系中B的体积分数与压强的关系如图,有关叙述正确的是( )
可逆反应mA(s)+nB(g)⇌pC(g)(正反应放热),在一定温度下,反应体系中B的体积分数与压强的关系如图,有关叙述正确的是( )
A.n>p
B.m+n<p
C.x点比y点混合物的反应速率慢
D.x点时混合物的v正>v逆 bluerainbow221年前1
bluerainbow221年前1 -
 juhua1350 共回答了20个问题
juhua1350 共回答了20个问题 |采纳率95%解题思路:由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,由于A为固体则有n<p,在曲线上的点为平衡状态,以此来解答该题.A.由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,则有n<p,故A错误;
B.由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,则有n<p,由于A为固体,所以m+n与p的关系不确定,故B错误;
C.由图象可以看出x点的压强小于y点压强,压强越大,反应速率越大,故x点比y点混合物的反应速率慢,故C正确;
D.x点位于曲线上方,未达到平衡状态,由图象可以看出,当B的含量减小时,可趋向于平衡,则应是向正反应方向移动,即v正>v逆,故D正确.
故选:CD.点评:
本题考点: 体积百分含量随温度、压强变化曲线.
考点点评: 本题考查化学平衡曲线问题,题目难度不大,本题注意分析纵坐标随横坐标变化的趋势,特别是曲线的上的点与曲线外的点的区别.1年前查看全部
- 可逆反应2SO 2 (气)+O 2 (气)⇌2SO 3 (气)在向逆反应进行时,正反应速率和逆反应速率( ) A.大于
可逆反应2SO 2 (气)+O 2 (气)⇌2SO 3 (气)在向逆反应进行时,正反应速率和逆反应速率( ) A.大于 B.小于 C.等于 D.不能确定  hetaopan1年前1
hetaopan1年前1 -
 kittyhmx 共回答了15个问题
kittyhmx 共回答了15个问题 |采纳率86.7%可逆反应2SO 2 (气)+O 2 (气)⇌2SO 3 (气)在向逆反应进行,以三氧化硫的速率为例,说明相同时间内三氧化硫消耗的多、生成的少,则正反应速率小于逆反应速率,
故选:B.1年前查看全部
- 可逆反应未达平衡时升高温度,反应一定正向移动吗?为什么?
 菊花教黄瓜mm1年前1
菊花教黄瓜mm1年前1 -
 lidongdong426 共回答了15个问题
lidongdong426 共回答了15个问题 |采纳率93.3%首先我默认为你的问题只是温度变化,其它条件不变,我认为不一定.化学平衡是吉布斯自由能变(detaG)为‘0’时.detaG0,则逆向.温度同时加速了正逆反应的速率,只不过增加速度的多少不同.关于反应方向要看此刻是detaG0,大于0,必向逆;小于0必向正.
如果你是高中生,可能还不知道detaG的含义,那就这么想吧:其实你所见的每一个可逆反应是没有真正意义上的正、逆方向的,每时每刻左边的物质变为右边的同时又有部分右边的变为左边的.化学书上化学反应式的方向是认为通常情况下,左边变为右边的比右边变为左边的多,于是右边物质积累,左边物质减少,直到平衡.这么看,极端的例子左边物质没有而同时如果右边的物质很多,那么不管温度怎么升高,都会是逆反应发生,只是速度问题而已.而正反应开始根本不可能发生!1年前查看全部
- 为什么可逆反应的正反应限度大,逆反应限度就小?
 长女孩1年前1
长女孩1年前1 -
 musiccoffee 共回答了17个问题
musiccoffee 共回答了17个问题 |采纳率94.1%同一温度 同一个反应方程式,正反应和逆反应的平衡常数互为倒数
平衡常数数值的大小是反应进行程度的标志.它能很好地表示出反应进行的完全程度.一个反应的K值越大,说明平衡时生成物的浓度越大,反应物剩余浓度越小,反应物的转化率也越大,也就是正反应的趋势越强.反之亦然.
那么请试想 一个正数很大 那么它的倒数就很小1年前查看全部
- 在一定温度下,可逆反应X(g)+3Y(g)=2Z(g),达到平衡的标志是:
在一定温度下,可逆反应X(g)+3Y(g)=2Z(g),达到平衡的标志是:
A.Z生成的速率与Z分解的速率相等
B.单位时间生成n mol X,同时生成3 n mol Y
C.V正(X)=3V逆(Y)
D.X、Y、Z的分子数比为1:3:2
意思说C是错的
可我觉得C也是对的啊,为什么C是错的呢? incjdzg1年前2
incjdzg1年前2 -
 all_jr 共回答了20个问题
all_jr 共回答了20个问题 |采纳率90%C错在,如果是平衡,应该是有
3v正(X)=V逆(Y)
选项中两个反了.
B 是反应中任何时候都是如此
D则与平衡无关
答案选A1年前查看全部
- 可逆反应x(g)+2Y(g)→3z(g) xyz起始浓度分别c1c2c3,达到平衡时分别为0.1 0.2 0.06 xy
可逆反应x(g)+2Y(g)→3z(g) xyz起始浓度分别c1c2c3,达到平衡时分别为0.1 0.2 0.06 xy的转化率为什么相等?
 gyf117ty1年前1
gyf117ty1年前1 -
 duhuang 共回答了9个问题
duhuang 共回答了9个问题 |采纳率88.9%这个当然相等啊!平衡浓度X Y的比还是1:2,说明转化时X Y是按照1:2转化的,所以 Z Y的转化率就相等啦1年前查看全部
- 可逆反应A(g)+3B(g)=2C(g),在恒温恒容容器中加入2molC,达到平衡后再加入1/3molA,1molB,4
可逆反应A(g)+3B(g)=2C(g),在恒温恒容容器中加入2molC,达到平衡后再加入1/3molA,1molB,4/3molC,平衡怎么移动?
 harkyo1年前1
harkyo1年前1 -
 雨打背 共回答了21个问题
雨打背 共回答了21个问题 |采纳率90.5%平衡向右移动吧,加入1/3摩尔A和1摩尔的B相当于加入2/3摩尔的C,即一共再加入了2摩尔的C,因为是恒容假设当它达到原来的平衡时,容器内的压强大于原来压强,而A、B前面的系数比C前面的系数大,所以压强增大使平衡向减少压强的方向进行,即向右移1年前查看全部
- 可逆反应A(g)+B(g)=2C(g).生成物C体积分数随着温度升高先增大后减小
可逆反应A(g)+B(g)=2C(g).生成物C体积分数随着温度升高先增大后减小
这是为什么?该反应的正反应为什么是放热反应? ybh19931年前1
ybh19931年前1 -
 雪枭 共回答了20个问题
雪枭 共回答了20个问题 |采纳率100%因为开始反应向正反应方向进行,温度越高反应速率越快,所以生成物C体积分数随着温度升高增大;但是由于此反应是放热反应,升高温度化学平衡向吸热反应方向移动,所以平衡又向逆反应方向进行,因此生成物C体积分数随着温度升高先增大后减小.
该反应的正反应是放热反应是因为生成物C体积分数随着温度升高先增大后减小,开始平衡向正反应方向进行,所以C体积分数增大,但是达到平衡后,升高温度平衡向吸热反应方向移动,由于C的体积分数减小,所以说明正反应是放热反应.1年前查看全部
- 一定条件下,可逆反应X(g)+3Y(g)⇌2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时
一定条件下,可逆反应X(g)+3Y(g)⇌2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A. c1:c2=1:3
B. 平衡时,Y和Z的生成速率之比为3:2
C. 达平衡过程中,X、Y浓度减小
D. c1的取值范围为0<c1<0.14 mo/L oO妖惜罗Oo1年前4
oO妖惜罗Oo1年前4 -
 我_男女男 共回答了15个问题
我_男女男 共回答了15个问题 |采纳率86.7%解题思路:A、平衡时X、Y的浓度之比为1:3,X、Y按1:3反应,故X、Y起始浓度之比为1:3;
B、平衡时,不同物质表示的正、逆速率之比等于化学计量数之比,据此判断;
C、不能确定反应向哪个方向到达的平衡状态,可能向左反应到达的平衡;
D、若向右到达的平衡c1的值最大,若向左到达的平衡c1的值最小,据此计算判断.A、平衡时X、Y的浓度之比为1:3,X、Y按1:3反应,故X、Y起始浓度之比为1:3,故A正确;
B、平衡时,不同物质表示的正、逆速率之比等于化学计量数之比,Y的生成速率表示逆反应少量,Z的生成速率表示正反应速率,Y和Z的生成速率之比为3:2,等于化学计量数之比,处于平衡状态,故B正确;
C、若反应向左进行到达平衡,X、Y浓度增大,故C错误;
D、若向右到达的平衡c1的值最大,平衡时Z的浓度为0.08mol/L,由于Z的浓度开始不是0,故Z的浓度变化小于0.08mol/L,由方程式可知,X的浓度变化量小于0.04mol/L,故c1<0.14 mo/L,若向左到达的平衡c1的值最小,平衡时X、Y的浓度为1:3,等于化学计量数,可以是Z分解生成,由于X的起始浓度大于0,故0<c1<0.14 mo/L,故D正确;
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 考查化学平衡的有关计算,难度中等,D选项中利用极限法判断取值反应,注意X、Y平衡浓度不等于化学计量数之比的情况.1年前查看全部
- 可逆反应A(g)+3B(g)⇌2C(g)+2D(g),在四种不同的情况下的反应速率分别为:
可逆反应A(g)+3B(g)⇌2C(g)+2D(g),在四种不同的情况下的反应速率分别为:
①υ(A)=0.15mol/(L•s)
②υ(B)=0.6mol/(L•s)
③υ(C)=0.30mol/(L•s)
④υ(D)=0.2mol/(L•s).
该反应进行最快的是( )
A.①
B.②
C.③
D.④ tianlailai1年前1
tianlailai1年前1 -
 vivinl 共回答了15个问题
vivinl 共回答了15个问题 |采纳率100%解题思路:首先反应速率的单位相同,同一化学反应中,同一时间段内,各物质的反应速率之比等于其化学计量数之比,据此先把不同物质的反应速率换算成同一物质的反应速率进行比较.对于A(g)+3B(g)⇌2C(g)+2D(g),都转化为用B表示的速率进行比较:
①υ(A)=0.15mol/(L•s),反应速率之比等于其化学计量数之比,则v(B)=3v(A)=0.45mol/(L•s);
②υ(B)=0.6mol/(L•s);
③υ(C)=0.30mol/(L•s),反应速率之比等于其化学计量数之比,则v(B)=1.5v(A)=1.5×0.30mol/(L•s)=0.45mol/(L•s);
④υ(D)=0.2mol/(L•s),反应速率之比等于其化学计量数之比,则v(B)=1.5v(A)=1.5×0.2mol/(L•s)=0.3mol/(L•s);
故反应速率②>①=③>④,
故选B.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 比较反应速率常用的两种方法:(1)归一法:将同一反应中的不同物质的反应速率转化成同一物质的反应速率,再较小比较.(2)比值法:用各物质的量表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.
比较反应速率时注意(1)反应速率的单位要相同(2)单位时间内反应物或生成物的物质的量变化大,反应速率不一定快,反应速率是用单位时间内浓度的变化量来表示的.1年前查看全部
- 在恒温恒容容器中,可逆反应C(s)+H2O(g)=CO(g)+H2(g)不一定达平衡状态的是!
在恒温恒容容器中,可逆反应C(s)+H2O(g)=CO(g)+H2(g)不一定达平衡状态的是!
气体的压强不变,为什么这个不能,我觉得是一定啊! vfrs1年前1
vfrs1年前1 -
 dd岛啊六 共回答了24个问题
dd岛啊六 共回答了24个问题 |采纳率91.7%答案可能错了吧1年前查看全部
- 将气体A,B置于容器为2L的密闭容器内,发生如下反应:3A(g)+B(g)=(可逆反应)2C(g)+2D(g),反应进行
将气体A,B置于容器为2L的密闭容器内,发生如下反应:3A(g)+B(g)=(可逆反应)2C(g)+2D(g),反应进行到10s到达
平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量0.8mol,则:
(1)用A来表示该反应的速率为:_______,_______;
(2)B的转化率为:________;
(3)平衡时D的浓度是:____________,反应进行到20s时D的浓度为_______________.
(4)容器中起始混合气体的物质的量与平衡混合气体的物质的量之比为_________.
(5)反映到达限度的前VA正_______3VB逆(填) yuyu9111年前1
yuyu9111年前1 -
 dulcetliu 共回答了17个问题
dulcetliu 共回答了17个问题 |采纳率88.2%3A(g) + B(g) = (可逆反应) 2C(g) + 2D(g),
起始量 3 1 0 0
变化量 1.2 0.4 0.8 0.8
平衡时 1.8 0.6 0.8 0.8
1)用A来表示该反应的速率为:VA =(1.2/2)/10 =0.06mol/(L.S);
2)B的转化率为:0.4/1 =0.4 =40%;
3)平衡时D的浓度是:0.8/2 =0.4mol/L,反应进行到20s时D的浓度为_0.4mol/L.
(4)容器中起始混合气体的物质的量与平衡混合气体的物质的量之比为:1:1
5)反应到达限度的前VA正>3VB逆1年前查看全部
大家在问
- 1have a population of 怎么翻译
- 2"my slop over only belong to me"翻译成中文是什么意思
- 3小明从飞机上跳下来,为什么没摔死
- 4英语翻译after selecting tentative values of length,bredth ,depth
- 5小明拿了十元钱买作业本每本作业本0.8元买了x本后找回3.6元的等量关系怎么写?
- 6Paraphrase:His success came at a price.
- 7were you buzy last weekend?
- 8判断题:”’螳螂捕蝉,黄雀在后’构成了一条食物链”这句话对不对?
- 9求无盖纸盒的表面积,求无盖纸盒的容积
- 10jenny often asks me __ her with her english.A.help B.helping
- 11星星的亮度都一样吗短一点
- 12现有中、外籍教师40名,学生250名,教师经验丰富,学生活跃,具合作精神!
- 13五一班有48人五二班有54人如果把这两个班的同学分别排队要使每排的人数相同,每排最多有几人每个班一共排了几排?
- 14‘千年梦圆在今朝’第九自然段表示人们为了梦想坚持不懈、锲而不舍的词语是哪些,每个词说明了什么
- 1546.2除以0.2这个算式的意义是:________________(请写上答案)_____________.
