铁盐能净水吗?原理?举例
 生评论法2022-10-04 11:39:546条回答
生评论法2022-10-04 11:39:546条回答
已提交,审核后显示!提交回复
共6条回复
 流浪人444 共回答了11个问题
流浪人444 共回答了11个问题 |采纳率100%- 能,三价铁盐和高铁酸盐都行
举例
高铁酸钠,具有强氧化性
把水中的细菌什么的都氧化了(好处一,化学变化)
自己变成三价铁,形成氢氧化铁胶体,对杂质进行吸附(好处二,物理变化)
同时三价铁和人体内的某些还原剂(如Vc)生成二价铁(好处三,补血)
原理就是水解和氧化还原
这种净水剂比明矾好,明矾只有好处二,而过多的铝离子让人老年痴呆... - 1年前
 山野桃花 共回答了1个问题
山野桃花 共回答了1个问题 |采纳率- 可以净水,一般有两种原理,一是利用氢氧化铁胶体对水中杂质的吸附性,二是高价,也就是正六价的铁酸盐的氧化性消毒
- 1年前
 ygp12 共回答了9539个问题
ygp12 共回答了9539个问题 |采纳率0.2%- 可以.
Fe3+ + 3H2O ==== Fe(OH)3(胶体) + 3H+ - 1年前
 aaqqaz 共回答了385个问题
aaqqaz 共回答了385个问题 |采纳率- 铁盐能净水
原理:利用铁离子水解生成Fe(OH)3胶体,Fe(OH)3胶粒带电 利用带电粒子的吸附性而净水
实例:氯化铁,硫酸铁等
FeCl3+3H2O(沸水)=Fe(OH)3(胶体)+3HCl - 1年前
 黄队 共回答了46个问题
黄队 共回答了46个问题 |采纳率- 三价铁离子水解会产生胶状的 Fe(OH)3有吸附性
可以吸附水中杂质,例子不好举,现在一般不用了 - 1年前
 听雨鱼 共回答了35个问题
听雨鱼 共回答了35个问题 |采纳率- 铁离子水解生成氢氧化铁胶体
胶体具有吸附悬浮小颗粒的功能 - 1年前
相关推荐
- 铁盐做净水剂
 花好月圆好1年前1
花好月圆好1年前1 -
 qq114712835 共回答了21个问题
qq114712835 共回答了21个问题 |采纳率95.2%FeCl3+3H2O=(可逆符号)=Fe(OH)3 + 3HCl
生成的氢氧化铁是凝絮状的,可以吸附杂质一起沉淀,达到净化效果O(∩_∩)O~1年前查看全部
- 铁盐转化为亚铁盐实验中,加入了FECL3溶液 后 加入了HCL 再加的铁钉,
铁盐转化为亚铁盐实验中,加入了FECL3溶液 后 加入了HCL 再加的铁钉,
为什么要加HCL? 小鱼大愚1年前1
小鱼大愚1年前1 -
 超级阳光 共回答了23个问题
超级阳光 共回答了23个问题 |采纳率91.3%加入HCI是为了抑制亚铁盐水解.1年前查看全部
- (2014•晋中模拟)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(2014•晋中模拟)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
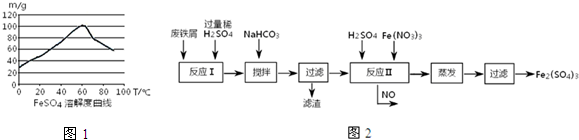
(1)用铁屑与稀硫酸反应制备FeSO4
①若要提高FeSO4生成速率,采取下列措施中正确的是______.
A.使用浓硫酸铁屑反应
B.使用磨细的铁粉反应
C.控制温度50-70℃
D.温度越高一定有利
②在上述述反应过程中,常会伴随发生
反应:4Fe2++O2+4H+═4Fe3++2H2O 若要
减少产品FeSO4中Fe2+的含量,采取下列措施中正确的是______
A.控制稀硫酸的浓度不能太高
B.用蒸馏水水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持
>1n(Fe) n(H2SO4)
D.反应中应经常添加Fe2(SO4)3搅拌.
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3其反应及操作流程如图:
①加入NaHCO3并搅拌,将混合溶液pH调至______范围内,使杂质沉淀过滤除去.
②反应Ⅱ中反应的离子方程式是:______沉淀物 Fe(OH)3 Fe(OH)2 Al(OH)3 Cu(OH)2 开始沉淀 2.3 7.5 3.4 4.7 完全沉淀 3.2 9.7 4.4 6.7
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是______,气体X与NO配比的比例是______.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是______. 长袖飞花1年前1
长袖飞花1年前1 -
 guo185519160 共回答了18个问题
guo185519160 共回答了18个问题 |采纳率88.9%解题思路:(1)①一般增大接触面积、增大浓度、增大压强、升高温度,反应的反应速率增大,以此来解答;
②A.稀硫酸的浓度太高,4Fe2++O2+4H+⇌4Fe3++2H2O平衡向正反应方向移动;
B.浓硫酸配制反应所需的稀硫酸应该是浓硫酸注入水中;
C.反应中保持n(Fe)/n(H2SO4)>1,铁过量,铁和三价铁反应生成二价铁离子;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子;
(2)①用含有少量Cu、Al的废铁屑制备Fe2(SO4)3,用硫酸溶解后溶液中含有亚铁离子、铜离子和铝离子,加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5,使铜离子和铝离子全部转化为沉淀,而亚铁离子未沉淀;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,根据得失电子守恒和原子守恒书写离子反应方程式;
③一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将反应Ⅱ产生的NO配比一种气体O2,混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染;
(3)三价铁离子具有强氧化性,硫离子具有还原性,发生氧化还原生成硫和硫化亚铁,据此解答;(1)①A.使用浓硫酸与铁屑反应,浓硫酸与铁屑发生钝化,反应停止,故A错误;
B.使用磨细的铁粉反应,增大了反应物的接触面积,反应速率加快,故B正确;
C.控制温度在50~70℃,温度较高,反应速率快,在该温度硫酸亚铁的溶解度最大,利于反应的进行,故C正确;
D.温度越高,硫酸亚铁的溶解度变小,不利于反应的进行,故D错误;
故选:BC;
②A.较浓的硫酸对于4Fe2++O2+4H+⇌4Fe3++2H2O等于增大反应物氢离子的浓度,平衡向生成三价铁离子的方向移动,所以需控制稀硫酸的浓度不能太高,故A正确;
B.浓硫酸的密度比水大,浓硫酸配制反应所需的稀硫酸,应该是浓硫酸注入去O2蒸馏水,否则水进入浓硫酸发生飞溅易发生事故,故B错误;
C.当反应中保持n(Fe)/n(H2SO4)>1时,铁过量,过量的铁和三价铁离子反应Fe+2Fe3+=3Fe2+,可减少产品FeSO4中Fe3+的含量,故C正确;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子,增加产品FeSO4中Fe3+的含量,故D错误;
故答案为:A、C;
(2)①用硫酸溶解含有少量Cu、Al的废铁屑,溶液中含有亚铁离子、铜离子和铝离子,根据沉淀与PH之间的关系表可知,当PH等于6.7时,铜离子全部转化为氢氧化铜沉淀,铝离子全部转化为氢氧化铝沉淀,此时亚铁离子为沉淀,当PH大于7.5时,亚铁离子开始沉淀,所以PH在6.7~7.5之间,
故答案为:6.7~7.5;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,二价铁离子变为三价铁离子失去1个电子,硝酸根离子得到三个电子变成一氧化氮,所以亚铁离子和三价铁离子前的系数都为3,再根据原子守恒,该离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4;
(3)根据信息用Fe2(SO4)3处理含S2-污水时,有淡黄色悬浮物产生的是硫,黑色沉淀是硫化亚铁,根据得失电子守恒,硫离子变为单质硫失去2个电子,三价铁离子变为二价铁,得到1个电子,所以三价铁离子和硫化亚铁前的系数都为2,根据原子守恒,该反应的离子反应方程式为2Fe3++3S2-=2FeS↓+S,
故答案为:2Fe3++3S2-=2FeS↓+S;点评:
本题考点: 硫酸亚铁的制备;化学反应速率的影响因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查铁屑与稀硫酸反应制备FeSO4,读懂工艺流程,熟练运用氧化还原反应原理、平衡移动原理是解答的关键,题目难度中等.1年前查看全部
- 300多年前,著名化学家波义耳发现了铁盐与没食子酸(结构式如图所示)的显色反应,并由此发明了蓝黑墨水.与制造蓝黑墨水相关
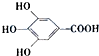 300多年前,著名化学家波义耳发现了铁盐与没食子酸(结构式如图所示)的显色反应,并由此发明了蓝黑墨水.与制造蓝黑墨水相关的基团可能是( )
300多年前,著名化学家波义耳发现了铁盐与没食子酸(结构式如图所示)的显色反应,并由此发明了蓝黑墨水.与制造蓝黑墨水相关的基团可能是( )
A.苯环
B.羧基
C.羧基中的羟基
D.酚羟基 wbc1979981年前1
wbc1979981年前1 -
 yckaixin 共回答了15个问题
yckaixin 共回答了15个问题 |采纳率93.3%解题思路:没食子酸含有酚羟基,可发生取代、氧化和颜色反应,含有羧基,具有酸性,可发生取代反应.没食子酸含有酚羟基,可发生取代、氧化和颜色反应,铁盐与没食子酸(结构式如图所示)的显色反应,应是铁盐与酚羟基发生颜色反应的结果.
故选D.点评:
本题考点: 有机物分子中的官能团及其结构.
考点点评: 本题考查有机物的结构和性质,侧重于有机物官能团的性质的考查,注意根据题给信息结合有机物的官能团的概念进行判断,题目难度不大.1年前查看全部
- 已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余
已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液.写出整个实验过程中所发生的有关反应的化学方程式______.______,______.
 ysjxds1年前3
ysjxds1年前3 -
 elan0325 共回答了15个问题
elan0325 共回答了15个问题 |采纳率86.7%解题思路:根据题意,+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液,铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,铁和盐酸反应生成氯化亚铁和氢气,据此进行分析解答.铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl2+H2↑.
+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,则铁能与氯化铁溶液反应生成氯化亚铁溶液,反应的化学方程式是:Fe+2FeCl3═3FeCl2.
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2HCl═FeCl2+H2↑;Fe+2FeCl3═3FeCl2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余
已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液.写出整个实验过程中所发生的有关反应的化学方程式______.
 benrb1年前1
benrb1年前1 -
 hunter_sz 共回答了15个问题
hunter_sz 共回答了15个问题 |采纳率100%解题思路:根据题意,+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液,铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl2+H2↑.
+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,则铁能与氯化铁溶液反应生成氯化亚铁溶液,反应的化学方程式是:Fe+2FeCl3═3FeCl2.
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2HCl═FeCl2+H2↑;Fe+2FeCl3═3FeCl2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 可溶性铁盐与可溶性碳酸盐或碳酸氢盐反应生成气体沉淀
 zheniang1年前1
zheniang1年前1 -
 frxxfsx11 共回答了12个问题
frxxfsx11 共回答了12个问题 |采纳率91.7%Fe(3+)+3H2O==Fe(OH)3+3H(+)
2H(+)+CO3(2-)=CO2+H2O
H(+)+HCO3(2-)=CO2+H2O
第一个反应是个平衡,后面两个是放出气体的,可促进第一个向正方向移动,当Fe(OH)3达到一定浓度后就有沉淀产生,进一步促进反应.1年前查看全部
- 当用新买来的铝锅或铝壶烧水时,遇到水的地方会变灰黑色,可判断此地的水中含有铁盐,为什么
 微光挡风寒1年前2
微光挡风寒1年前2 -
 shichaoyi 共回答了16个问题
shichaoyi 共回答了16个问题 |采纳率93.8%遇到水的地方会变灰黑色,说明生成了四氧化三铁(四氧化三铁是黑色的),从而说明有铁盐.
先是铝将铁置换出来,然后是铁加热被氧化生成四氧化三铁.1年前查看全部
- 已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余
已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液.写出整个实验过程中所发生的有关反应的化学方程式______.______,______.
 nikai_68681年前3
nikai_68681年前3 -
 各耍各 共回答了18个问题
各耍各 共回答了18个问题 |采纳率100%解题思路:根据题意,+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液,铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,铁和盐酸反应生成氯化亚铁和氢气,据此进行分析解答.铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl2+H2↑.
+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,则铁能与氯化铁溶液反应生成氯化亚铁溶液,反应的化学方程式是:Fe+2FeCl3═3FeCl2.
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2HCl═FeCl2+H2↑;Fe+2FeCl3═3FeCl2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 求常见的钠盐,钾盐,铵盐,铁盐 他们的化学式及名称
 微笑的木棉花1年前1
微笑的木棉花1年前1 -
 LuChen00 共回答了30个问题
LuChen00 共回答了30个问题 |采纳率86.7%1年前查看全部
- (2013•房山区二模)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
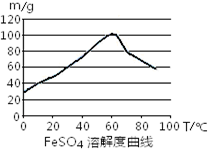 (2013•房山区二模)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(2013•房山区二模)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为______.若要提高
FeSO4生成速率,采取下列措施中正确的是______.
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+⇌4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是______.
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4)>1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行______、冷却、过滤、洗涤即得FeSO4•7H2O晶体.
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下: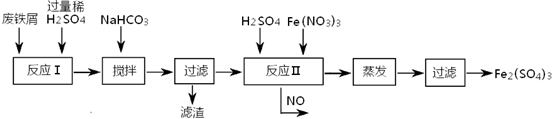
①加入NaHCO3并搅拌,将混合液pH调控至______范围内,使杂质沉淀过滤除去.
②反应Ⅱ中反应的离子方程式是:______.沉淀物 Fe(OH)3 Fe(OH)2 Al(OH)3 Cu(OH)2 开始沉淀 2.3 7.5 3.4 4.7 完全沉淀 3.2 9.7 4.4 6.7
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是______,气体X与NO配比的比例是______.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是______. sskila1年前1
sskila1年前1 -
 1e503132 共回答了13个问题
1e503132 共回答了13个问题 |采纳率100%解题思路:(1)①根据离子方程式的书写规则来进行书写;一般增大接触面积、增大浓度、增大压强、升高温度,反应的反应速率增大,以此来解答;
②A.稀硫酸的浓度太高,4Fe2++O2+4H+⇌4Fe3++2H2O平衡向正反应方向移动;
B.浓硫酸配制反应所需的稀硫酸应该是浓硫酸注入水中;
C.反应中保持n(Fe)/n(H2SO4)>1,铁过量,铁和三价铁反应生成二价铁离子;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子;
③不溶性固体和溶液的分离,应为过滤操作;
(2)①用含有少量Cu、Al的废铁屑制备Fe2(SO4)3,用硫酸溶解后溶液中含有亚铁离子、铜离子和铝离子,加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5,使铜离子和铝离子全部转化为沉淀,而亚铁离子未沉淀;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,根据得失电子守恒和原子守恒书写离子反应方程式;
③一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将反应Ⅱ产生的NO配比一种气体O2,混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染;
(3)三价铁离子具有强氧化性,硫离子具有还原性,发生氧化还原生成硫和硫化亚铁,据此解答;(1)①铁屑与稀硫酸反应:H2SO4+Fe═FeSO4+H2↑,铁为单质写化学式,硫酸是强酸拆写成离子形式,硫酸亚铁是强电解质拆写成离子形式,所以离子方程式为Fe+2H+=Fe2++H2↑;
A.使用浓硫酸与铁屑反应,浓硫酸与铁屑发生钝化,反应停止,故A错误;
B.使用磨细的铁粉反应,增大了反应物的接触面积,反应速率加快,故B正确;
C.控制温度在50~70℃,温度较高,反应速率快,在该温度硫酸亚铁的溶解度最大,利于反应的进行,故C正确;
D.控制温度在80~100℃,稀硫酸在100℃变成了气态,不利于铁和稀硫酸充分反应,在该温度硫酸亚铁的溶解度变小,不利于反应的进行,故D错误;
故答案为:Fe+2H+=Fe2++H2↑;B、C;
②A.较浓的硫酸对于4Fe2++O2+4H+⇌4Fe3++2H2O等于增大反应物氢离子的浓度,平衡向生成三价铁离子的方向移动,所以需控制稀硫酸的浓度不能太高,故A正确;
B.浓硫酸的密度比水大,浓硫酸配制反应所需的稀硫酸,应该是浓硫酸注入去O2蒸馏水,否则水进入浓硫酸发生飞溅易发生事故,故B错误;
C.当反应中保持n(Fe)/n(H2SO4)>1时,铁过量,过量的铁和三价铁离子反应Fe+2Fe3+=3Fe2+,可减少产品FeSO4中Fe3+的含量,故C正确;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子,增加产品FeSO4中Fe3+的含量,故D错误;
故答案为:A、C;
③用铁屑与稀硫酸反应制备FeSO4,含有不溶性固体过量的铁,过量的铁和溶液硫酸亚铁分离,应为过滤操作,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4•7H2O晶体,
故答案为:过滤;
(2)①用硫酸溶解含有少量Cu、Al的废铁屑,溶液中含有亚铁离子、铜离子和铝离子,根据沉淀与PH之间的关系表可知,当PH等于6.7时,铜离子全部转化为氢氧化铜沉淀,铝离子全部转化为氢氧化铝沉淀,此时亚铁离子为沉淀,当PH大于7.5时,亚铁离子开始沉淀,所以PH在6.7~7.5之间,
故答案为:6.7~7.5;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,二价铁离子变为三价铁离子失去1个电子,硝酸根离子得到三个电子变成一氧化氮,所以亚铁离子和三价铁离子前的系数都为3,再根据原子守恒,该离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4;
(3)根据信息用Fe2(SO4)3处理含S2-污水时,有淡黄色悬浮物产生的是硫,黑色沉淀是硫化亚铁,根据得失电子守恒,硫离子变为单质硫失去2个电子,三价铁离子变为二价铁,得到1个电子,所以三价铁离子和硫化亚铁前的系数都为2,根据原子守恒,该反应的离子反应方程式为2Fe3++3S2-=2FeS↓+S,
故答案为:2Fe3++3S2-=2FeS↓+S;点评:
本题考点: 制备实验方案的设计;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查铁屑与稀硫酸反应制备FeSO4,读懂工艺流程,熟练运用氧化还原反应原理、平衡移动原理是解答的关键,题目难度中等.1年前查看全部
- 铁盐,铝盐,谁先与氢氧化钠反应RT,反应生成什么?
 wawj07091年前1
wawj07091年前1 -
 gay345 共回答了19个问题
gay345 共回答了19个问题 |采纳率84.2%先与铁盐反应 生成Fe(OH)3 沉淀 和钠盐 铝盐与NAOH 生成Al(OH)3 沉淀和钠盐1年前查看全部
- Ag会和HCL反应吗?如果会,铁和稀盐酸反应生成亚铁盐,为什么不是铁盐?是不是所有在H后面的金属都不会和HCl反应?
 wza135911年前7
wza135911年前7 -
 hudieguizu 共回答了20个问题
hudieguizu 共回答了20个问题 |采纳率85%不可以,但是AgCl可以和浓HCl生成H[AgCl2]配位化合物溶解
Ag可以和HF生成配合物溶解,可以和HI生成AgI沉淀溶解,因为在HI溶液中Ag的电极电势为负值1年前查看全部
- 铁盐是不是都有氧化性?所有的铁盐
 qingwufenyang1年前1
qingwufenyang1年前1 -
 liudongchang 共回答了15个问题
liudongchang 共回答了15个问题 |采纳率93.3%不是,二价铁盐除硝酸盐以外无氧化性,三价铁盐有氧化性.1年前查看全部
- 为什么补铁剂一般都用亚铁盐如硫酸亚铁,而不用铁盐,如硫酸铁?
 yy栀子1年前4
yy栀子1年前4 -
 tongyi1969 共回答了22个问题
tongyi1969 共回答了22个问题 |采纳率90.9%铁是人体所必需的元素,为红细胞合成血红素必不可少的物质.吸收到骨髓的铁进入骨髓细胞,聚集到线粒体中与原卟啉结合形成血红素,血红素与球蛋白结合成为血红蛋白,进而发育为成熟的红细胞.缺铁时,血红素生成减少,红细胞中血红蛋白相应减少.
缺铁性贫血的最佳治疗方法就是补充铁剂.在众多的铁剂当中,硫酸亚铁由于其不良反应较少,且价格便宜,所以,目前为止它仍是治疗缺铁性贫血的基本药物.1年前查看全部
- 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
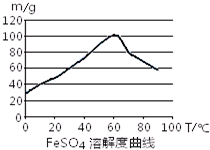 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+⇌4Fe3++2H2O
FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是______(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.此处:硫酸浓度应选择______(a.浓硫酸 b.10moL•L-1硫酸 c.3moL•L-1硫酸 d.任意浓度硫酸);温度宜控制在______;加热的同时需适当补充水,原因是______.反应中应保持
______1(填“<”、“>”或“=”).n(Fe) n(H2SO4)
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是______. 音乐的孩子1年前1
音乐的孩子1年前1 -
 ww555 共回答了27个问题
ww555 共回答了27个问题 |采纳率96.3%解题思路:(1)由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法;
(2)在室温下,Fe在浓硫酸中会发生钝化现象,在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水;由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右;
为防止硫酸亚铁晶体析出,加热的同时需适当补充水,为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些;
(3)稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯.(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法,故答案为:倾析;
(2)在室温下,Fe在浓硫酸中会发生钝化现象.在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水,不能得到硫酸亚铁,所以要用3moL/L硫酸.由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右.为防止硫酸亚铁晶体析出,加热的同时需适当补充水.为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些.所以反应中应保持n(Fe)/n(H2SO4)>1.
故答案为:c;60℃左右;防止硫酸亚铁晶体析出;>;
(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯,
故答案为:抑制Fe2+、NH4+的水解.点评:
本题考点: 硫酸亚铁的制备.
考点点评: 本题考查铁盐、亚铁盐的实验方案的设计、评价、反应原理、盐类的水解等知识,题目综合性强,为高考高频考点,特别注意学习化工生产中涉及用于混合物分离和提纯的方法.1年前查看全部
- 提问初三化学天然水中溶解有一些铁盐.为什么新买来的铝锅烧开水后,在水面会留下一道黑色的印痕?
 cxcxyl1年前3
cxcxyl1年前3 -
 PoringBo 共回答了15个问题
PoringBo 共回答了15个问题 |采纳率100%Al把水中的fe离子置换出来了,或可能有些重金属离子,但这个现实可能性并不大(除非是被污染的河水)
氧化~~~
但其实如果水是自来水的话完全没有必要疑神疑鬼的,因为新的铝制品在首次使用后,都容易出现变黑.自然现象
铝锅第一次用,最好先煮或盛放带油的东西,使油类塞满锅壁上的细小凹孔,以便增加防腐能力,要是先煮粥也行.应注意的是,新铝锅不要先烧水或蒸馒头.不然,锅底变黑,不好看.不过,铝锅用的时间长了,里面一般都会出现黑色斑点或白色沉淀物,这对人体无害,可以不擦掉.若想擦掉也可以,只要加一点醋洗刷或烧一下即可退去.1年前查看全部
- 一次探究实验课上,老师为同学们准备了三杯溶液,分别是镁盐、铁盐、银盐的溶液中的一种,将三杯溶液标记为l、2、3号,进行下
一次探究实验课上,老师为同学们准备了三杯溶液,分别是镁盐、铁盐、银盐的溶液中的一种,将三杯溶液标记为l、2、3号,进行下列探究活动.
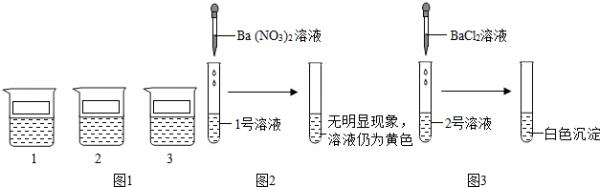
【提出问题】三种溶液中的溶质分别是什么?
探究实验1
【表达与交流】甲同学认为l号溶液中的溶质不是硫酸铁,一定是硝酸铵,你认为他的结论(1)______(填“正确”或“不正确”).
探究实验2
【反思与评价】乙同学认为2号溶液中的溶质一定是硫酸镁,请你对乙同学的结论给与评价(2)______.
探究实验3
根据上述实验,丙同学取少量2号溶液少量分别与l号和3号溶液混合,均立即出现有(3)______生成的现象,由此小组同学确定了三种溶液中分别含有的溶质.(实验中不涉及微溶性物质)
【解释与结论】探究实验3中2号与3号溶液混合发生反应的化学方程式为(4)______,请帮助他们将三种溶液中溶质的化学式填写在烧杯的标签上. coogy1年前1
coogy1年前1 -
 hjj11 共回答了17个问题
hjj11 共回答了17个问题 |采纳率76.5%解题思路:钡离子和硫酸根离子产生硫酸钡沉淀,而1号溶液中加入硝酸钡溶液后没有沉淀产生,说明在1号溶液中不含有硫酸根离子,氯化钡溶液中钡离子容易和硫酸根离子产生硫酸钡沉淀,其中的氯离子也可能和银离子产生氯化银沉淀,所以根据图3中的实验可以判断在2号溶液中,所以可以判断在2号溶液中含有硫酸根离子或是银离子;而探究实验3中,将2号溶液分别与l号和3号溶液混合后应该产生白色沉淀,而题给的三种溶液中没有能够和硫酸根离子结合形成沉淀的,所以可以判断在2号溶液中含有银离子,而没有硫酸根离子,即2号溶液为硝酸银溶液,而1号溶液和3号溶液中都含有氯离子,它们分别为氯化镁和氯化铁溶液;可以据此解答该题.(1)硝酸铵中含有的阳离子为铵根离子,所以溶液不是硫酸镁,更不可能含有硝酸铵,故甲同学的说法不正确;
(2)氯化钡溶液中含有钡离子也含有氯离子,所以当把氯化钡溶液加入到2号溶液时形成的沉淀可能是硫酸钡也可能是氯化银,即不能断定该溶液就是硫酸镁溶液;
(3)钡离子和硫酸根离子产生硫酸钡沉淀,而1号溶液中加入硝酸钡溶液后没有沉淀产生,说明在1号溶液中不含有硫酸根离子,氯化钡溶液中钡离子容易和硫酸根离子产生硫酸钡沉淀,其中的氯离子也可能和银离子产生氯化银沉淀,所以根据图3中的实验可以判断在2号溶液中,所以可以判断在2号溶液中含有硫酸根离子或是银离子;而探究实验3中,将2号溶液分别与l号和3号溶液混合后应该产生白色沉淀,而题给的三种溶液中没有能够和硫酸根离子结合形成沉淀的,所以可以判断在2号溶液中含有银离子,而没有硫酸根离子,即2号溶液为硝酸银溶液,而1号溶液和3号溶液中都含有氯离子,它们分别为氯化镁和氯化铁溶液;
(4)根据(3)的解答可以知道2号溶液为硝酸银溶液,而3号溶液可以是氯化镁溶液,它们反应的化学方程式为:MgCl2+2AgNO3═Mg(NO3)2+2AgCl↓.
故答案为:(1)不正确;
(2)不正确.2号溶液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸镁,因为硫酸镁能与氯化钡反应生成硫酸钡白色沉淀;也可能含有硝酸银,因为硝酸银也能与氯化钡反应生成氯化银白色沉淀,因此乙同学认为2号溶液中的溶质一定是硫酸镁是错误的;
(3)白色沉淀;
(4)MgCl2+2AgNO3═Mg(NO3)2+2AgCl↓.点评:
本题考点: 实验探究物质的组成成分以及含量.
考点点评: 解答这类题目时,首先,赏析问题情景,找到实验探究的反应原理,再根据实验的反应原理,利用所称取的样品进行实验探究,分析推断出该物质的组成成分.1年前查看全部
- 已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余
已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液.写出整个实验过程中所发生的有关反应的化学方程式______.  wangyoucao12341年前1
wangyoucao12341年前1 -
 只想拥抱你 共回答了19个问题
只想拥抱你 共回答了19个问题 |采纳率89.5%铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe 2 O 3 +6HCl═2FeCl 3 +3H 2 O.
铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl 2 +H 2 ↑.
+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,则铁能与氯化铁溶液反应生成氯化亚铁溶液,反应的化学方程式是:Fe+2FeCl 3 ═3FeCl 2 .
故答案为:Fe 2 O 3 +6HCl═2FeCl 3 +3H 2 O;Fe+2HCl═FeCl 2 +H 2 ↑;Fe+2FeCl 3 ═3FeCl 2 .1年前查看全部
- (2010•上海模拟)资料表明:有许多金属的盐对双氧水的分解具有催化作用.为比较铁盐和铜盐对H2O2分解的催化效果,某同
(2010•上海模拟)资料表明:有许多金属的盐对双氧水的分解具有催化作用.为比较铁盐和铜盐对H2O2分解的催化效果,某同学设计了下图所示的实验.请回答:
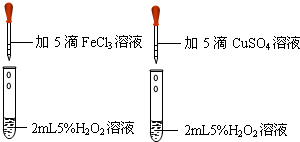
(1)请写出双氧水分解的化学方程式2H2O2
2H2O+O2↑MnO2 .2H2O2.
2H2O+O2↑MnO2 .
(2)该实验可通过观察______来得出结论.有同学提出将药品CuSO4改为CuCl2更为合理,其理由是______,你认为还有什么其它改进方法?______. 水中百花1年前1
水中百花1年前1 -
 黄沙飞扬 共回答了19个问题
黄沙飞扬 共回答了19个问题 |采纳率68.4%解题思路:双氧水能在催化剂的作用下生成水和氧气,要设计实验比较铁盐和铜盐对H2O2分解的催化效果,要注意实验变量的控制,以确保实验结果的客观准确性.(1)过氧化氢在二氧化锰的催化作用下能生成水和氧气,所以本题答案为:2H2O2
MnO2
.
2H2O+O2↑;
(2)比较铁盐和铜盐对H2O2分解的催化效果,就是观察产生气泡的快慢,硫酸铜和氯化铁的酸根离子不同,可能影响实验结果,故将酸根离子改成相同的,可以排除酸根对实验结果的影响,所以本题答案为:反应产生气泡快慢;使酸根相同,排除酸根的影响因素;将FeCl3改为Fe2(SO4)3.点评:
本题考点: 盐的化学性质;实验探究物质变化的条件和影响物质变化的因素;化学实验方案设计与评价;催化剂的特点与催化作用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了催化剂对过氧化氢分解因素的影响,完成此题,可以依据已有的知识进行.1年前查看全部
- 什么是聚合铁盐絮凝剂?
 junyineicun1年前2
junyineicun1年前2 -
 wangjing_ay 共回答了26个问题
wangjing_ay 共回答了26个问题 |采纳率84.6%絮凝是聚合物的高分子链在悬浮的颗粒与颗粒之间发生架桥的过程.“架桥”就是聚合物分子上不同链段吸附在不同颗粒上,促进颗粒与颗粒聚集. 絮凝剂为有机聚合物,多数分子量较高,并有特定的电性(离子性)和电荷密度(离子度). 实际过程要比上述理论复杂得多.由于混凝剂/絮凝剂都是高分子物质,同一产品中大大小小的分子都有,所谓“分子量”只是一个平均概念.所以,在用某一混凝剂或絮凝剂处理污水是,“电中和”和“架桥”作用会交织在一起同时发生.絮凝过程是多种因素综合作用的结果,目前仍有一些没有认清和解决的问题.就我们所知,絮凝过程与絮凝剂分子结构、电荷密度、分子量有关;与悬浮颗粒表面性质、颗粒浓度、比表面积有关;与介质(水)的pH值、电导、水中其他物质的存在、水温、搅动情况等因素有关.因此尽管有理论和经验可循,用实验来选择絮凝剂仍然是不可缺少的.1年前查看全部
- 问一问各种铁盐,铜盐的颜色是什么样的
问一问各种铁盐,铜盐的颜色是什么样的
还有红砖的红色哪来的,硫酸铁与硫酸亚铁颜色一样吗? lumaokai1年前1
lumaokai1年前1 -
 jjklover 共回答了22个问题
jjklover 共回答了22个问题 |采纳率86.4%硫酸铁中铁是+3价,+3价铁在溶液中显黄色;硫酸亚铁中铁是+2价,+2价铁在溶液中显绿色.红砖的红色是由于红砖中含有三氧化二铁(也是铁锈的成分).
+2价的铜盐显蓝绿色,当铜离子浓度高时,偏向蓝色;铜离子浓度低时,偏向绿色.1年前查看全部
- 用重铬酸钾测定铁盐中含铁量的实验,可以不加指示剂,直接把重铬酸钾做指示剂吗?重铬酸钾不是有颜色的吗?
 zhang888211年前3
zhang888211年前3 -
 运河鱼 共回答了20个问题
运河鱼 共回答了20个问题 |采纳率90%其实你说的也没错,可是要是反应完成了后你再加上去也是那颜色,不好把握质量,也就不能很好根据质量守恒来算铁的质量了,最好是用指示剂.这是经验.给分把 谢谢 有疑问的可以问我 支持的点下1年前查看全部
- 铝壶表面不是有氧化铝吗?为什么加热会和铁盐反应
 ajay5171年前3
ajay5171年前3 -
 ee帐户 共回答了18个问题
ee帐户 共回答了18个问题 |采纳率94.4%铁盐主要以Fe3+的形式存在,而Fe3+在加热的条件下水解的程度加大,Fe3++3H2O===Fe(OH)3+2H+,H+能与氧化铝反应1年前查看全部
- 亚铁盐___色,铁盐___色 氯化亚铁与锌的反应方程式______ 氯化铁与锌的反应方程式_______
亚铁盐___色,铁盐___色 氯化亚铁与锌的反应方程式______ 氯化铁与锌的反应方程式_______
氯化亚铁与铜的反应方程式______ 氯化铁与铜的反应方程式_______ 谁知道谁1年前2
谁知道谁1年前2 -
 dongcunzhabao 共回答了30个问题
dongcunzhabao 共回答了30个问题 |采纳率100%绿
棕黄
zn+fecl2=zncl2+fe
2fecl3+3zn=2fe+3zncl2
不反应
2fecl3+cu=2fecl2+cucl21年前查看全部
- 铝置换铁盐中的铁方程式铝能把自来水中溶有的铁盐中的铁置换出来,方程式是什么?铁和水化合生成四氧化三铁的方程式
 qinyuan11年前1
qinyuan11年前1 -
 blackbolt 共回答了23个问题
blackbolt 共回答了23个问题 |采纳率82.6%2Al+3FeCl2=3Fe+2AlCl31年前查看全部
- 铜单质与可溶性银盐反应;铜单质与可溶性铁盐反应.方程式?
铜单质与可溶性银盐反应;铜单质与可溶性铁盐反应.方程式?
应该是离子方程式吧? 榴溜1年前1
榴溜1年前1 -
 虎头蛇尾 共回答了21个问题
虎头蛇尾 共回答了21个问题 |采纳率95.2%Cu+2AgNO3=Cu(NO3)2+2Ag
Cu+2FeCl3=CuCl2+2FeCl2
Cu+2Ag+ =Cu2+ + 2Ag
Cu+2Fe3+ =Cu2+ + 2Fe2+1年前查看全部
- 钡盐、银盐、铜盐、铁盐、亚铁盐、铝盐溶解性
钡盐、银盐、铜盐、铁盐、亚铁盐、铝盐溶解性
与这些阴离子搭配
亚硫酸根离子、亚硝酸根离子、卤离子 1952551年前1
1952551年前1 -
 水舞花影 共回答了18个问题
水舞花影 共回答了18个问题 |采纳率100%亚硫酸根:钡盐不溶、银盐不溶不稳、铜盐不溶不稳、铁盐不存在、亚铁盐不溶不稳、铝盐不存在
亚硝酸根离子:钡盐不溶、铜盐不溶、铁盐不存在、亚铁盐不溶、铝盐不存在
氟离子:钡盐不溶、银盐溶、铜盐溶、铁盐易配合、亚铁盐易配合、铝盐不溶
其它卤离子:钡盐溶、银盐不溶、铜盐溶、铁盐溶(FeI3不存在)、亚铁盐溶、铝盐溶1年前查看全部
- 在铁盐和亚铁盐的一些性质中,氯化铁溶液中加入铁粉、KSCN溶液.再加氯水振荡.溶液变红.如果铁粉过量,将溶液变红色的试管
在铁盐和亚铁盐的一些性质中,氯化铁溶液中加入铁粉、KSCN溶液.再加氯水振荡.溶液变红.如果铁粉过量,将溶液变红色的试管振荡由会看到什么现象,为什么?
 芙蓉nn的妹妹1年前1
芙蓉nn的妹妹1年前1 -
 无敌小魔王 共回答了20个问题
无敌小魔王 共回答了20个问题 |采纳率95%血红色溶液褪色.
因为铁粉过量,发生反应:2Fe3+ +Fe=3Fe2+
二价铁不能与KSCN溶液发生显色反应.1年前查看全部
- 铁盐可以有哪些颜色分别怎么制取?
铁盐可以有哪些颜色分别怎么制取?
其实不一定要铁盐…是想做一个水中写字的实验,想要伴随尽可能多的变色效果== 绝对V痴心1年前2
绝对V痴心1年前2 -
 比多兽 共回答了22个问题
比多兽 共回答了22个问题 |采纳率100%1.氯化铁是黄色
氯气与单质铁燃烧
2Fe+3Cl2=点燃=2FeCl3
2,氯化亚铁,浅绿色
2HCl+Fe=H2(气体)+FeCl21年前查看全部
- 铁盐一般是什么颜色
 热线baoding1年前3
热线baoding1年前3 -
 绒绒蓉蓉 共回答了17个问题
绒绒蓉蓉 共回答了17个问题 |采纳率88.2%三价铁盐,习惯称为铁盐,一般是黄褐色,红褐色;
二价铁盐,也就亚铁盐,一般是绿色、淡绿色.
这里指晶体或粉末.1年前查看全部
- 铁盐属于重金属盐吗
 DDDD19761年前1
DDDD19761年前1 -
 儿为 共回答了27个问题
儿为 共回答了27个问题 |采纳率92.6%重金属目前尚无严格的定义,化学上跟据金属的密度把金属分成重金属和轻金属,常把密度大于4.5g/cm3的金属称为重金属.如:金、银、铜、铅、锌、镍、钴、铬、汞、镉等大约45种.
铁盐一般不归为重金属,但过量时会造成损伤.
铁:是在人体内对氧化有催化作用,但铁过量时会损伤细胞的基本成分,如脂眆酸、蛋白质、核酸等;导致其他微量元素失衡,特别是钙、镁的需求量.1年前查看全部
- 化学置换反应是不是铁在置换反应后不可能被转换成铁盐,只能转换成亚铁盐,为啥?(如果理论太高深滴话还是不要讲了)如果是,那
化学置换反应
是不是铁在置换反应后不可能被转换成铁盐,只能转换成亚铁盐,为啥?(如果理论太高深滴话还是不要讲了)
如果是,那么还有那些元素置换反应后转换为亚盐 213811年前1
213811年前1 -
 我最动听 共回答了21个问题
我最动听 共回答了21个问题 |采纳率85.7%铁在置换反应后不可能被转换成铁盐,只能转换成亚铁盐是对的
因为亚铁的还原性比三价铁离子强
有多个正化合价的元素置换反应后转换为亚盐
楼上的那个说错了
铁和浓硫酸,稀硝酸,浓硝酸这些氧化性强的酸反应,生成铁盐(就是正三价的),这句话没错,但这就不是置换反应了,而是氧化还原反应1年前查看全部
- 有铁盐生成的中和反应
 amulet02181年前4
amulet02181年前4 -
 南风不识家 共回答了21个问题
南风不识家 共回答了21个问题 |采纳率90.5%Fe(OH)3+3HCl=FeCl3+3H2O
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
Fe(OH)2+2HCl=FeCl2+2H2O
Fe(OH)2+H2SO4=FeSO4+2H2O1年前查看全部
- 铁与什么反应能生成亚铁盐,是置换反应吗,还有铁与什么反应能生成铁盐,是复分解反应吗?
铁与什么反应能生成亚铁盐,是置换反应吗,还有铁与什么反应能生成铁盐,是复分解反应吗?
请具体讲详细一点,不过请在初中能接受的范围内讲,太深奥的话听不懂 appleLee1年前3
appleLee1年前3 -
 g5sh 共回答了18个问题
g5sh 共回答了18个问题 |采纳率88.9%一般的酸
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
比Fe不活泼的金属的盐
Fe + CuSO4 = FeSO4 + Cu
根据金属活动性顺序表
K,Ca,Na,Mg,Al,Zn,Fe,……H,Cu,Hg,Ag,Pt,Au
前面的可以置换出后面的
所以是置换反应,1年前查看全部
- 铁的标准溶液如何配置我要做原子吸收,需要配标准溶液.是用纯铁配呢?还是用什么铁盐配呢?
 kenhzp1年前4
kenhzp1年前4 -
 什么名字才能用 共回答了12个问题
什么名字才能用 共回答了12个问题 |采纳率91.7%说的不是单质吧,这不溶于水!铁离子?用氯化铁吧!1年前查看全部
- 制取氢氧化铁胶体为什么不用铁盐和碱制?
 粉红的花朵1年前2
粉红的花朵1年前2 -
 七万ID 共回答了20个问题
七万ID 共回答了20个问题 |采纳率85%用铁盐和碱制氢氧根离子与铁离子反应过快,形成的氢氧化铁颗粒过大,容易沉淀,不能形成稳定的氢氧化铁胶体1年前查看全部
- 铁与氯化铜的反应为什么不能得到三价的铁盐
 lxc19631年前4
lxc19631年前4 -
 dailiforward 共回答了17个问题
dailiforward 共回答了17个问题 |采纳率100%铁与比铁弱的金属的盐发生置换反应只能得到亚铁离子,铁与强氧化性物质反应才能得到三价铁离子,如Br21年前查看全部
- 铁盐与亚硫酸盐或铁离子与亚硫酸根的反应方程式
 jjaijj3331年前1
jjaijj3331年前1 -
 123zky 共回答了19个问题
123zky 共回答了19个问题 |采纳率100%2FE3+ +H2O +SO32-=SO42-+2FE2++2H+1年前查看全部
- 水的的微量铁的测定中为什么用硫酸铁铵配制标准溶液?而不能用如氯化铁之类的铁盐?
 linolupeng1年前1
linolupeng1年前1 -
 zisu2677 共回答了19个问题
zisu2677 共回答了19个问题 |采纳率94.7%我的理解是硫酸铁铵应该比较稳定,氯化铁应该容易被还原成氯化亚铁吧1年前查看全部
- 为什么制备氢氧化铁胶体用绿化而不直接用氢氧化铁或其他铁盐
 daphne20081年前1
daphne20081年前1 -
 goyy 共回答了26个问题
goyy 共回答了26个问题 |采纳率88.5%Fe(OH)3难溶于水,用来配制时间很长,也很麻烦.用氯化铁是因为加入沸水中可以铁水解产生的氯化氢挥发掉,可使平衡右移产生更多Fe(OH)3而其它盐水解后的酸一般都不易挥发掉.1年前查看全部
- 钠在铁盐中可以置换出铁吗?在铜中呢?
 无处投递的心1年前1
无处投递的心1年前1 -
 张七扒 共回答了11个问题
张七扒 共回答了11个问题 |采纳率90.9%如果是溶液的话钠会直接和水反应生成氢氧化钠,不与盐反应;但在熔融状态下的话是可以的1年前查看全部
- 关于铁盐与亚铁盐的生成铁与什么反应是生成铁盐贴于什么反应是生成亚铁盐?
 紫色葡萄梦1年前3
紫色葡萄梦1年前3 -
 红红火火888 共回答了22个问题
红红火火888 共回答了22个问题 |采纳率90.9%与氧化性酸生成铁盐,如浓硫酸、硝酸
与非氧化性酸生成亚铁盐,如稀硫酸、盐酸
但是亚铁盐还原性太强,空气中放置,早晚变成铁盐1年前查看全部
- Fe 的制取,还要铁盐和亚铁盐的离子反应式
 风景haohao1年前3
风景haohao1年前3 -
 su147258369 共回答了11个问题
su147258369 共回答了11个问题 |采纳率81.8%铁的制取,一般用c还原氧化铁得到铁单质
就是工业炼铁啊.
还有很多得到铁的方法,在此不再赘述们如果需要的话就问我
欢迎追问1年前查看全部
- 铁盐 亚铁盐 水解方程式什么时候要写沉淀符号
铁盐 亚铁盐 水解方程式什么时候要写沉淀符号
有时候要写 有时候不要写 但不知道什么时候 samdam1年前2
samdam1年前2 -
 琳子nora 共回答了19个问题
琳子nora 共回答了19个问题 |采纳率94.7%一般写符号表示反应进行的比较彻底,常见的是双促水解,就是说铁盐和弱酸盐混合,或者说弱酸铁盐,像向铁盐中加入硫化钠,碳酸钠,或者硫化铁、碳酸铁加入水中等
一般强酸铁盐溶液如水解程度较小,不加沉淀符号,像氯化铁的水解1年前查看全部
- 高一离子反应在酸性溶液中,软锰矿(MnO2)和黄铜矿(CuFeS2)可以相互作用,生成铜盐、锰盐和铁盐.请写出反应的离子
高一离子反应
在酸性溶液中,软锰矿(MnO2)和黄铜矿(CuFeS2)可以相互作用,生成铜盐、锰盐和铁盐.请写出反应的离子方程式.
找不到答案.下面的是我写的...不知道对不对,若有错误,望高手指正.若无错误,请高手帮忙分析S为什么要到+6价而不是其它价态(我是靠经验和感觉写的SO4 2-...)好的追加分数
9MnO2 + 2Fe2+ + 2S2- + 20H+ ------ 9Mn2+ + 2Fe3+ + 2SO4 2- + 10H2O
回2L,在CUFES2中CU是不是+2价啊...我刚学氧化还原,只知道最简单的情形:要是CU是+1价的话,那FE就是+3价,这两个离子不是不能共存的啊.,难道固态的时候可以?所以我觉的CUFES2中CU是+2价...没变价,就不要写了... 止风静树1年前1
止风静树1年前1 -
 大唐王朝300年 共回答了28个问题
大唐王朝300年 共回答了28个问题 |采纳率96.4%你写的是有问题的.
首先,MnO2和CuFeS2都是不溶于水的.所以不能写成离子.(通常矿石都是不溶于水的,要不下场雨不就没矿石了么?这是常识哦)
第二,CuFeS2中,Cu是+1价,Fe是+3价.注意一个问题.也许老师会告诉你,Cu2+比Cu+稳定,但是注意,那是在水溶液中而不是在空气中!水溶液中稳定的原因是存在水化热.在空气中,Cu+比较稳定.而同样在空气中,Fe2+很溶液被氧化成Fe3+.另外,Cu+不能和Fe3+共存是热力学问题,而在矿石中还存在动力学问题,这不在高中学习范围内.
在酸性条件下,+4价的Mn的确可以将S氧化到+6价.所以总反应方程式是
2CuFeS2 + 17MnO2 + 36H+ = 2Cu2+ + 2Fe3+ + 17Mn2+ +4SO4 2- +18H2O1年前查看全部
- 氢氧化钠中混有碳酸钠能用铁盐铜盐除吗 为什么用铁盐铜盐会被碳酸钠干扰
氢氧化钠中混有碳酸钠能用铁盐铜盐除吗 为什么用铁盐铜盐会被碳酸钠干扰
说错了 鉴别变质氢氧化钠溶液中是否存在氢氧化钠 落晴空1年前1
落晴空1年前1 -
 roma631 共回答了19个问题
roma631 共回答了19个问题 |采纳率94.7%你好:
这是因为铁盐铜盐既能与氢氧化钠反应,又能与碳酸钠反应.
Fe3+ + 3OH- ===Fe(OH)3↓ Cu2+ + 2OH- === Cu(OH)2↓
3CO3 2- + 2Fe3+ +3H2O === 2Fe(OH)3 ↓+ 3CO2↑
碳酸钠与铜盐反应生成的是碱式碳酸铜以及氢氧化铜的混合物,与反应条件有关.
望采纳.1年前查看全部
- 用离子方程式表示铁盐能用于净水的原理
 wfl3001年前1
wfl3001年前1 -
 fgh20070324 共回答了17个问题
fgh20070324 共回答了17个问题 |采纳率100%铁盐和亚铁盐也可用做净水剂.若向自来水中加入亚铁盐,亚铁离子首先与自来水中残留的氯气产生氧化反应,生成三价铁离子,从而提高了混凝效果.
2Fe2+ +Cl2=2Fe3+ + 2Cl-
然后铁盐都可水解,生成氢氧化铁:Fe3+ + 3H2O=Fe(OH)3+3H+
净水的就是Fe(OH)3这种胶体了,净水的原理简单说跟活性炭一样,疏松多孔的物质容易吸附小颗粒杂质1年前查看全部
大家在问
- 1磷元素的最低和最高价态分别是多少?它的单质能与氧气反应生成一种吸水性很强
- 2一个物体随着传送带向右运动,当传送带突然停止运动时,物体受摩擦力方向是?
- 3六年级关于比的一些问题1.王师傅2小时加工零件48个,时间与加工数的比是( )麻烦早点回答
- 4天平的每个砝码都有一定的质量,它们的质量在下述情况中会发生变化的是( )
- 5Mg的第一电离能比Al大,为什么熔沸点比它小?
- 6一块铁块,在下列情况下,它的质量将发生变化的是
- 7求解关于减数分裂染色体数目的问题:假设染色体数目为2n,分一期间,染色体复制成为4n,则染色单体共有8n
- 8如图,长方形ABCD中E是AB的中点,F是BC上一点,且CF=三分之一BC,问长方形ABCD的面积是阴影部分的多少倍
- 9使紫色石蕊试液变红的溶液那说明是酸性溶液,其中为什么不能同时共存铁离子镁离子硝酸根离子氯离子
- 10All the things in wander 怎么翻译?
- 11甲乙两艘轮船从相距680千米的两个港口相对而行,甲船出发1小时后乙船才开始航行.
- 12生物学中分生、分化、分裂有什么不同?
- 13同学们已经知道原子由原子核和核外电子构成,科学研究还发现电子在原子核外是分层排布的
- 141.如何鉴别水和双氧水?2.烧杯中盛有水,两个体积相等的集气瓶中都充满了氧气,夹紧止水夹,并迅速将分别乘有适量燃烧着的红
- 15一元二次方程应用题.甲商店将每件进价为8元的某种商品按每件10元出售,一天可售出100件.

