亚铁盐___色,铁盐___色 氯化亚铁与锌的反应方程式______ 氯化铁与锌的反应方程式_______
 谁知道谁2022-10-04 11:39:542条回答
谁知道谁2022-10-04 11:39:542条回答氯化亚铁与铜的反应方程式______ 氯化铁与铜的反应方程式_______

已提交,审核后显示!提交回复
共2条回复
 dongcunzhabao 共回答了30个问题
dongcunzhabao 共回答了30个问题 |采纳率100%- 绿
棕黄
zn+fecl2=zncl2+fe
2fecl3+3zn=2fe+3zncl2
不反应
2fecl3+cu=2fecl2+cucl2 - 1年前
 边边丫 共回答了13个问题
边边丫 共回答了13个问题 |采纳率- 亚铁盐绿色 铁盐 黄色 FeCl₂+Zn===ZnCl₂+Fe 2 FeCl₃+3Zn===3ZnCl₂+2Fe
氯化亚铁与铜的反应方程式不反应 氯化铁与铜的反应方程式 不反应 - 1年前
相关推荐
- 亚铁盐中铁含量的测定实验中铁样为什么要先溶于酸中,而不直接溶于蒸馏水中?还有本实验铁含量的理论值是多少啊
 完美的爱11年前1
完美的爱11年前1 -
 lifergb 共回答了10个问题
lifergb 共回答了10个问题 |采纳率100%因为二价铁离子容易水解,溶于酸可以一直水解.
理论值就是分子中铁的含量.1年前查看全部
- 已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余
已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液.写出整个实验过程中所发生的有关反应的化学方程式______.______,______.
 ysjxds1年前3
ysjxds1年前3 -
 elan0325 共回答了15个问题
elan0325 共回答了15个问题 |采纳率86.7%解题思路:根据题意,+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液,铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,铁和盐酸反应生成氯化亚铁和氢气,据此进行分析解答.铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl2+H2↑.
+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,则铁能与氯化铁溶液反应生成氯化亚铁溶液,反应的化学方程式是:Fe+2FeCl3═3FeCl2.
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2HCl═FeCl2+H2↑;Fe+2FeCl3═3FeCl2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余
已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液.写出整个实验过程中所发生的有关反应的化学方程式______.
 benrb1年前1
benrb1年前1 -
 hunter_sz 共回答了15个问题
hunter_sz 共回答了15个问题 |采纳率100%解题思路:根据题意,+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液,铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl2+H2↑.
+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,则铁能与氯化铁溶液反应生成氯化亚铁溶液,反应的化学方程式是:Fe+2FeCl3═3FeCl2.
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2HCl═FeCl2+H2↑;Fe+2FeCl3═3FeCl2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 怎样配制和保存亚铁盐溶液
 福提多宝鱼1年前2
福提多宝鱼1年前2 -
 lic4000 共回答了24个问题
lic4000 共回答了24个问题 |采纳率91.7%配制亚铁盐溶液要先加入过量的Fe再加入适量的HCl在防止Fe2+水解的时候也可以保证Fe2+不被氧化;
亚铁盐的还原性很强,保存时要加些铁粉保存,根据这一点可以知道,是往铁粉慢慢加盐酸,这样可以确保开始铁是过量,防止有些亚铁离子被氧化.1年前查看全部
- 锌与可溶性亚铁盐还是与三价铁盐反应,为什么
 jutu06141年前1
jutu06141年前1 -
 qpiori 共回答了23个问题
qpiori 共回答了23个问题 |采纳率95.7%三价铁,根据三价铁离子可以把铁氧化,锌又比铁活泼推测得1年前查看全部
- 已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余
已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液.写出整个实验过程中所发生的有关反应的化学方程式______.______,______.
 nikai_68681年前3
nikai_68681年前3 -
 各耍各 共回答了18个问题
各耍各 共回答了18个问题 |采纳率100%解题思路:根据题意,+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液,铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,铁和盐酸反应生成氯化亚铁和氢气,据此进行分析解答.铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl2+H2↑.
+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,则铁能与氯化铁溶液反应生成氯化亚铁溶液,反应的化学方程式是:Fe+2FeCl3═3FeCl2.
故答案为:Fe2O3+6HCl═2FeCl3+3H2O;Fe+2HCl═FeCl2+H2↑;Fe+2FeCl3═3FeCl2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- (2013•房山区二模)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
 (2013•房山区二模)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(2013•房山区二模)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为______.若要提高
FeSO4生成速率,采取下列措施中正确的是______.
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+⇌4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是______.
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4)>1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行______、冷却、过滤、洗涤即得FeSO4•7H2O晶体.
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下: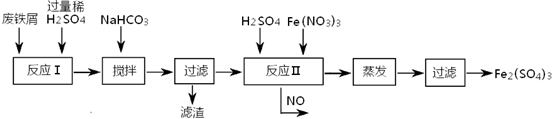
①加入NaHCO3并搅拌,将混合液pH调控至______范围内,使杂质沉淀过滤除去.
②反应Ⅱ中反应的离子方程式是:______.沉淀物 Fe(OH)3 Fe(OH)2 Al(OH)3 Cu(OH)2 开始沉淀 2.3 7.5 3.4 4.7 完全沉淀 3.2 9.7 4.4 6.7
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是______,气体X与NO配比的比例是______.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是______. sskila1年前1
sskila1年前1 -
 1e503132 共回答了13个问题
1e503132 共回答了13个问题 |采纳率100%解题思路:(1)①根据离子方程式的书写规则来进行书写;一般增大接触面积、增大浓度、增大压强、升高温度,反应的反应速率增大,以此来解答;
②A.稀硫酸的浓度太高,4Fe2++O2+4H+⇌4Fe3++2H2O平衡向正反应方向移动;
B.浓硫酸配制反应所需的稀硫酸应该是浓硫酸注入水中;
C.反应中保持n(Fe)/n(H2SO4)>1,铁过量,铁和三价铁反应生成二价铁离子;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子;
③不溶性固体和溶液的分离,应为过滤操作;
(2)①用含有少量Cu、Al的废铁屑制备Fe2(SO4)3,用硫酸溶解后溶液中含有亚铁离子、铜离子和铝离子,加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5,使铜离子和铝离子全部转化为沉淀,而亚铁离子未沉淀;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,根据得失电子守恒和原子守恒书写离子反应方程式;
③一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将反应Ⅱ产生的NO配比一种气体O2,混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染;
(3)三价铁离子具有强氧化性,硫离子具有还原性,发生氧化还原生成硫和硫化亚铁,据此解答;(1)①铁屑与稀硫酸反应:H2SO4+Fe═FeSO4+H2↑,铁为单质写化学式,硫酸是强酸拆写成离子形式,硫酸亚铁是强电解质拆写成离子形式,所以离子方程式为Fe+2H+=Fe2++H2↑;
A.使用浓硫酸与铁屑反应,浓硫酸与铁屑发生钝化,反应停止,故A错误;
B.使用磨细的铁粉反应,增大了反应物的接触面积,反应速率加快,故B正确;
C.控制温度在50~70℃,温度较高,反应速率快,在该温度硫酸亚铁的溶解度最大,利于反应的进行,故C正确;
D.控制温度在80~100℃,稀硫酸在100℃变成了气态,不利于铁和稀硫酸充分反应,在该温度硫酸亚铁的溶解度变小,不利于反应的进行,故D错误;
故答案为:Fe+2H+=Fe2++H2↑;B、C;
②A.较浓的硫酸对于4Fe2++O2+4H+⇌4Fe3++2H2O等于增大反应物氢离子的浓度,平衡向生成三价铁离子的方向移动,所以需控制稀硫酸的浓度不能太高,故A正确;
B.浓硫酸的密度比水大,浓硫酸配制反应所需的稀硫酸,应该是浓硫酸注入去O2蒸馏水,否则水进入浓硫酸发生飞溅易发生事故,故B错误;
C.当反应中保持n(Fe)/n(H2SO4)>1时,铁过量,过量的铁和三价铁离子反应Fe+2Fe3+=3Fe2+,可减少产品FeSO4中Fe3+的含量,故C正确;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子,增加产品FeSO4中Fe3+的含量,故D错误;
故答案为:A、C;
③用铁屑与稀硫酸反应制备FeSO4,含有不溶性固体过量的铁,过量的铁和溶液硫酸亚铁分离,应为过滤操作,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4•7H2O晶体,
故答案为:过滤;
(2)①用硫酸溶解含有少量Cu、Al的废铁屑,溶液中含有亚铁离子、铜离子和铝离子,根据沉淀与PH之间的关系表可知,当PH等于6.7时,铜离子全部转化为氢氧化铜沉淀,铝离子全部转化为氢氧化铝沉淀,此时亚铁离子为沉淀,当PH大于7.5时,亚铁离子开始沉淀,所以PH在6.7~7.5之间,
故答案为:6.7~7.5;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,二价铁离子变为三价铁离子失去1个电子,硝酸根离子得到三个电子变成一氧化氮,所以亚铁离子和三价铁离子前的系数都为3,再根据原子守恒,该离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4;
(3)根据信息用Fe2(SO4)3处理含S2-污水时,有淡黄色悬浮物产生的是硫,黑色沉淀是硫化亚铁,根据得失电子守恒,硫离子变为单质硫失去2个电子,三价铁离子变为二价铁,得到1个电子,所以三价铁离子和硫化亚铁前的系数都为2,根据原子守恒,该反应的离子反应方程式为2Fe3++3S2-=2FeS↓+S,
故答案为:2Fe3++3S2-=2FeS↓+S;点评:
本题考点: 制备实验方案的设计;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查铁屑与稀硫酸反应制备FeSO4,读懂工艺流程,熟练运用氧化还原反应原理、平衡移动原理是解答的关键,题目难度中等.1年前查看全部
- 请问铝可以把铁从亚铁盐溶液中置换出来吗,注意不是铝热
请问铝可以把铁从亚铁盐溶液中置换出来吗,注意不是铝热
即可以发生
2Al+3Fe2+ =2Al3+ +3Fe的反应吗
网上有人说可以有人说不可以,说不可以的说是Al Fe亚铁都 表现还原性,但是亚铁肯定也有氧化性啊
这个活泼金属置换不活泼金属的反应能否发生,Al的还原性肯定大于Fe 亚铁离子的氧化性大于铝
应该符合氧化还原反应的规律啊!
到底行不行 danielle13141年前1
danielle13141年前1 -
 心你就快 共回答了11个问题
心你就快 共回答了11个问题 |采纳率72.7%可以.
根据置换反应规律,活动性强的金属可以从活动性弱的金属的盐溶液中置换出活动性弱的金属.
所以没问题,肯定能发生.
你是中学的,就根据课本上来就行了,不用管网上那些乱七八糟.1年前查看全部
- 化学试剂--碱性亚铁盐的名称谁知道
化学试剂--碱性亚铁盐的名称谁知道
碱性亚铁盐的其他的名称叫什么?或者化学方程式是什么? zhangjiaze1年前2
zhangjiaze1年前2 -
 我是秦佑 共回答了24个问题
我是秦佑 共回答了24个问题 |采纳率91.7%碱性亚铁盐的意思是在碱性条件下的亚铁酸盐.
比如FeCl2在NaOH中就叫氢氧化钠的氯化亚铁,也叫碱性氯化亚铁.把这一类盐统称为碱性亚铁盐!1年前查看全部
- Ag会和HCL反应吗?如果会,铁和稀盐酸反应生成亚铁盐,为什么不是铁盐?是不是所有在H后面的金属都不会和HCl反应?
 wza135911年前7
wza135911年前7 -
 hudieguizu 共回答了20个问题
hudieguizu 共回答了20个问题 |采纳率85%不可以,但是AgCl可以和浓HCl生成H[AgCl2]配位化合物溶解
Ag可以和HF生成配合物溶解,可以和HI生成AgI沉淀溶解,因为在HI溶液中Ag的电极电势为负值1年前查看全部
- 配制可溶性亚铁盐溶液时,为什么要加入少量的铁分啊?
配制可溶性亚铁盐溶液时,为什么要加入少量的铁分啊?
坐等 hiahia771年前1
hiahia771年前1 -
 xx飘蓬客 共回答了19个问题
xx飘蓬客 共回答了19个问题 |采纳率89.5%亚铁与氧气发生氧化还原反应,升价形成铁,说亚铁不稳定原因在此,易于空气,卤素反应,易被氧化.同时它可与过氧化氢,铁等还原剂反应生成铁,放一些铁,被氧化的亚铁又与铁反应生成铁,不加杂质又防亚铁变质1年前查看全部
- 为什么补铁剂一般都用亚铁盐如硫酸亚铁,而不用铁盐,如硫酸铁?
 yy栀子1年前4
yy栀子1年前4 -
 tongyi1969 共回答了22个问题
tongyi1969 共回答了22个问题 |采纳率90.9%铁是人体所必需的元素,为红细胞合成血红素必不可少的物质.吸收到骨髓的铁进入骨髓细胞,聚集到线粒体中与原卟啉结合形成血红素,血红素与球蛋白结合成为血红蛋白,进而发育为成熟的红细胞.缺铁时,血红素生成减少,红细胞中血红蛋白相应减少.
缺铁性贫血的最佳治疗方法就是补充铁剂.在众多的铁剂当中,硫酸亚铁由于其不良反应较少,且价格便宜,所以,目前为止它仍是治疗缺铁性贫血的基本药物.1年前查看全部
- 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+⇌4Fe3++2H2O
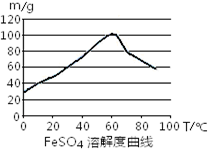
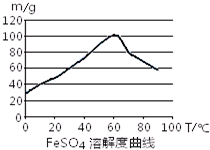
FeSO4在水中的溶解度见图.
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,分离出液体的方法通常不用过滤,使用的操作是______(填写操作名称).
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液.此处:硫酸浓度应选择______(a.浓硫酸 b.10moL•L-1硫酸 c.3moL•L-1硫酸 d.任意浓度硫酸);温度宜控制在______;加热的同时需适当补充水,原因是______.反应中应保持
______1(填“<”、“>”或“=”).n(Fe) n(H2SO4)
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在.如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是______. 音乐的孩子1年前1
音乐的孩子1年前1 -
 ww555 共回答了27个问题
ww555 共回答了27个问题 |采纳率96.3%解题思路:(1)由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法;
(2)在室温下,Fe在浓硫酸中会发生钝化现象,在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水;由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右;
为防止硫酸亚铁晶体析出,加热的同时需适当补充水,为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些;
(3)稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯.(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法,故答案为:倾析;
(2)在室温下,Fe在浓硫酸中会发生钝化现象.在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水,不能得到硫酸亚铁,所以要用3moL/L硫酸.由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右.为防止硫酸亚铁晶体析出,加热的同时需适当补充水.为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些.所以反应中应保持n(Fe)/n(H2SO4)>1.
故答案为:c;60℃左右;防止硫酸亚铁晶体析出;>;
(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯,
故答案为:抑制Fe2+、NH4+的水解.点评:
本题考点: 硫酸亚铁的制备.
考点点评: 本题考查铁盐、亚铁盐的实验方案的设计、评价、反应原理、盐类的水解等知识,题目综合性强,为高考高频考点,特别注意学习化工生产中涉及用于混合物分离和提纯的方法.1年前查看全部
- 亚铁盐与氨水反应的现象和方程式是什么
亚铁盐与氨水反应的现象和方程式是什么
亚铁盐与盐酸酸化的硝酸钾反应的现象和方程式
亚铁盐与双氧水和盐酸反应的方程式的什么 hanfengyun1231年前1
hanfengyun1231年前1 -
 紫川清瘦 共回答了20个问题
紫川清瘦 共回答了20个问题 |采纳率95%亚铁盐与氨水反应的现象和方程式是什么
Fe2+ + 2NH3.H2O = Fe(OH)2 + 2NH4^+
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
产生白色絮状沉淀,并迅速变成灰绿色,最后变成红褐色
亚铁盐与盐酸酸化的硝酸钾反应的现象和方程式
即Fe2+与H+与NO3^-发生氧化还原反应
3Fe2+ + NO3^- + 4H+ = 3Fe3+ + NO + 2H2O
溶液由浅绿色逐渐变成棕黄色,产生无色气体,在试管口变成红棕色.
亚铁盐与双氧水和盐酸反应的方程式的什么
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O1年前查看全部
- (2009•广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见
 (2009•广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
(2009•广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
回答下列问题:
(1)Na2CO3溶液可以除油污,原因是(用离子方程式表示)______.
(2)判断铁屑与硫酸基本反应完全的现象是______.
(3)某同学认为铁屑与硫酸反应不需精确温度,因此不使用热水浴加热,改用酒精灯断断续续加热维持温度,该做法的不妥之处是______.
(4)“趁热过滤”后的滤液有时略显黄色,分析其原因是(用离子方程式表示)______.
(5)忽略油污质量,本实验中应称量(NH4)2SO4固体的质量为______g.
(6)若上述流程用于大量生产,“冷却结晶”后的母液最佳处理方法是______. 潜水很多年1年前1
潜水很多年1年前1 -
 xvxzf 共回答了18个问题
xvxzf 共回答了18个问题 |采纳率88.9%解题思路:(1)Na2CO3溶液中CO32-水解使Na2CO3溶液呈碱性,用显碱性的Na2CO3溶液洗去,铁屑表面有油污.
(2)不再有气泡产生(或只有极少量气泡产生)时,铁屑与硫酸基本反应完全.
(3)温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全.
(4)Fe2+易被氧气氧化为Fe3+.
(5)由工艺流程可知,5g铁屑中含有不溶性杂质2.2g,所以铁的质量为2.8g,物质的量为0.05mol,由硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]可知,需要0.05mol(NH4)2SO4,根据m=nM计算(NH4)2SO4固体质量.
(6)冷却结晶后的母液中含有FeSO4、(NH4)2SO4,要充分利用原料.(1)Na2CO3溶液中CO32-水解CO32-+H2O
 HCO3-+OH-,使Na2CO3溶液呈碱性,用显碱性的Na2CO3溶液洗去表面油污.
HCO3-+OH-,使Na2CO3溶液呈碱性,用显碱性的Na2CO3溶液洗去表面油污.
故答案为:CO32-+H2O HCO3-+OH-.
HCO3-+OH-.
(2)不再有气泡产生(或只有极少量气泡产生)时,说明铁屑与硫酸基本反应完全.
故答案为:不再有气泡产生(或只有极少量气泡产生).
(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全,氢气易燃烧,容易发生危险.
故答案为:若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全.
(4)Fe2+易被氧气氧化为Fe3+,反应离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O.
故答案为:4Fe2++O2+4H+=4Fe3++2H2O.
(5)由工艺流程可知,5g铁屑中含有不溶性杂质2.2g,所以铁的质量为5g-2.2g=2.8g,物质的量为[2.8g/56g/mol]=0.05mol,由硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]可知,需要0.05mol(NH4)2SO4,所以称量(NH4)2SO4固体质量为0.05mol×132g/mol=6.6g.
故答案为:6.6
(6)冷却结晶后的母液中含有FeSO4、(NH4)2SO4,要充分利用原料,所以“冷却结晶”后的母液最佳处理方法是循环使用.
故答案为:循环使用.点评:
本题考点: 制备实验方案的设计;铁的化学性质;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查盐类水解、物质性质、物质分离提纯等有关实验操作、实验条件控制、化学计算以及综合运用知识解决问题的能力等.题目难度中等.注意基础知识的全面掌握.1年前查看全部
- 用重铬酸钾法测定亚铁盐中亚铁含量时,指示剂除了二苯胺磺酸钠还可以用什么做指示剂?
 郝三弄1年前0
郝三弄1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为什么铁与酸反应,与盐溶液反应都生成亚铁盐?
 施此1年前1
施此1年前1 -
 decolau 共回答了30个问题
decolau 共回答了30个问题 |采纳率90%酸是非强氧化性酸盐的氧化性都不能把铁氧化为三价1年前查看全部
- (2004•闵行区模拟)已知高价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,且亚铁盐溶液呈浅绿色.现有一研究性学习小组
(2004•闵行区模拟)已知高价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,且亚铁盐溶液呈浅绿色.现有一研究性学习小组的同学将一带锈的铁钉浸入足量稀硫酸中,发现最终溶液显浅绿色.请你帮他们写出整个实验过程中发生反应的化学方程式:
①______,
②______,
③______. 晨晓若1年前1
晨晓若1年前1 -
 xishanmuyun 共回答了19个问题
xishanmuyun 共回答了19个问题 |采纳率94.7%解题思路:带锈的铁钉浸入足量稀硫酸中,铁锈的主要成分氧化铁与硫酸反应生成硫酸铁和水,当铁锈反应完露出铁时,铁与硫酸反应生成硫酸亚铁和氢气,铁还能与硫酸铁溶液反应生成硫酸亚铁;根据书写方程式的原则写出化学方程式.带锈的铁钉浸入足量稀硫酸中,铁锈的主要成分氧化铁与硫酸反应生成硫酸铁和水,当铁锈反应完露出铁时,铁与硫酸反应生成硫酸亚铁和氢气,铁还能与硫酸铁溶液反应生成硫酸亚铁;化学方程式为:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2OFe+H2SO4=FeSO4+H2↑ Fe2(SO4)3+Fe=3FeSO4
故答案为:①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O②Fe+H2SO4=FeSO4+H2↑③Fe2(SO4)3+Fe=3FeSO4点评:
本题考点: 酸的化学性质.
考点点评: 本题考查化学方程式的书写,根据题中信息写出符合题目要求的化学方程式.1年前查看全部
- 已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余
已知+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐.现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉有剩余,最终得到一种浅绿色溶液.写出整个实验过程中所发生的有关反应的化学方程式______.  wangyoucao12341年前1
wangyoucao12341年前1 -
 只想拥抱你 共回答了19个问题
只想拥抱你 共回答了19个问题 |采纳率89.5%铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe 2 O 3 +6HCl═2FeCl 3 +3H 2 O.
铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl 2 +H 2 ↑.
+3价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,则铁能与氯化铁溶液反应生成氯化亚铁溶液,反应的化学方程式是:Fe+2FeCl 3 ═3FeCl 2 .
故答案为:Fe 2 O 3 +6HCl═2FeCl 3 +3H 2 O;Fe+2HCl═FeCl 2 +H 2 ↑;Fe+2FeCl 3 ═3FeCl 2 .1年前查看全部
- 重铬酸钾法测定亚铁盐中的铁(用容量瓶配置样
重铬酸钾法测定亚铁盐中的铁(用容量瓶配置样
重铬酸钾法测定亚铁盐中的铁(用容量瓶配置样
品溶液,二苯胺磺酸钠为指示剂),如果滴定管未洗
净,滴定时管壁挂有液滴,将导致测定结果偏______,
如果不加H3PO4,将导致测定结果偏___________.测定
操作中需用操作液润洗的器有_____移液管____. 我在浙浙老去1年前1
我在浙浙老去1年前1 -
 ypjiang 共回答了12个问题
ypjiang 共回答了12个问题 |采纳率100%1.滴定时管壁挂有液滴,将导致测定结果偏高.
因为标准溶液被稀释,滴定体积增多,代入公式后,结果肯定是偏高了.
2.如果不加H3PO4,将导致测定结果偏低.
因为在滴定过程中,不断产生FE3+,呈现黄色,导致终点(紫色)提前,加入H3PO4后,会使FE3+生成配合物,消除黄色对终点的观察.
3.测定操作中需用操作液润洗的器有滴定管移液管容量瓶.
滴定管和移液管要润洗是必须的,对于容量瓶,因为要考虑到水中铁的影响,也应该润洗.其实,对于你这个实验,我感觉没必要用到容量瓶,之前就应该称取少量式样.
我写了这么多,真的希望你能够追加的分给我,以后有问题还可以一起讨论的1年前查看全部
- (小)已知高价铁盐和铁粉可发生化合反应生成亚铁盐.现把r根带锈的铁钉放入足量的饿硫酸溶液r,待充分反应后溶液变成淡绿色,
(小)已知高价铁盐和铁粉可发生化合反应生成亚铁盐.现把r根带锈的铁钉放入足量的饿硫酸溶液r,待充分反应后溶液变成淡绿色,写出这r过程r所发生的化学反应方程式:
①______;②______;③______.
(2)新制备的生石灰是很好的干燥剂,但在空气r放置时间稍长的生石灰干燥效果却不好,其原因是(用化学方程式表示):______、______. amy10801年前1
amy10801年前1 -
 记性最好的时候 共回答了25个问题
记性最好的时候 共回答了25个问题 |采纳率100%解题思路:(1)带锈的铁钉浸入足量稀硫酸中,铁锈的主要成分氧化铁与硫酸反应生成硫酸铁和水,当铁锈反应完露出铁时,铁与硫酸反应生成硫酸亚铁和氢气,铁还能与硫酸铁溶液反应生成硫酸亚铁;根据书写方程式的原则写出化学方程式.
(2)生石灰的主要成分是氧化钙,具有吸水性常用作干燥剂,可与水反应生成氢氧化钙,而氢氧化钙容易和空气中的二氧化碳反应生成碳酸钙.(1)带锈的铁钉浸入足量稀硫酸中,铁锈的主要成分氧化铁与硫酸反应生成硫酸铁和水,当铁锈反应完露出铁时,铁与硫酸反应生成硫酸亚铁和氢气,铁还能与硫酸铁溶液反应生成硫酸亚铁;故它们的化学方程式分别为:①三e2O3+3H2SO4=三e2(SO4)3+3H2O;②三e+H2SO4=三eSO4+H2↑;③三e2(SO4)3+三e=3三eSO4
(2)生石灰的成分为氧化钙,可与水反应生成氢氧化钙,常用作干燥剂,氢氧化钙容易和空气中的二氧化碳反应生成碳酸钙,所以化学方程式为:6小O+H2O═6小(OH)2,6小(OH)2+6O2═6小6O3↓+H2O.
故答案为:
(1)①三e2O3+3H2SO4=三e2(SO4)3+3H2O;②三e+H2SO4=三eSO4+H2↑;③三e2(SO4)3+三e=3三eSO4
(2)6小O+H2O═6小(OH)2,6小(OH)2+6O2═6小6O3↓+H2O.点评:
本题考点: 金属的化学性质;生石灰的性质与用途;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查化学方程式的书写,根据题中信息写出符合题目要求的化学方程式.1年前查看全部
- 请问最便宜的亚铁盐是什么?请问最便宜的亚铁盐或亚铁化合物是什么?除了氯化亚铁呢?
 wkk12345671年前1
wkk12345671年前1 -
 那么多 共回答了18个问题
那么多 共回答了18个问题 |采纳率94.4%氯化亚铁,存储不需要很麻烦,只要在其溶液中加入铁粉就可以了.
硫酸亚铁也可,硝酸亚铁就不行了,不稳定,除此外就没有常用的了1年前查看全部
- (2010•宝鸡一模)(2011•长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到1
 (2010•宝鸡一模)(2011•长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(2010•宝鸡一模)(2011•长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(1)写出铜溶解于上述混合液的离子方程式______.
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是______ g,溶液中的c(SO
)=______ mol/L.2−4
(3)若欲在如图所示的装置中发生(1)中的反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中.
正、负极判断 电极材料 电极反应式 X极 ______ ______ ______ Y极 ______ ______ ______  sgchris1年前1
sgchris1年前1 -
 cc78 共回答了19个问题
cc78 共回答了19个问题 |采纳率89.5%解题思路:(1)铜和铁离子反应生成亚铁离子和铜离子;
(2)根据原子守恒计算铜的质量;根据电荷守恒计算硫酸根离子浓度;
(3)若欲在如图所示的装置中发生(1)中的反应,则铜电极是负极,不如铜活泼的金属或导电的非金属作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应.(1)Cu与Fe2(SO4)3反应生成CuSO4和FeSO4,铜和铁离子反应生成亚铁离子和铜离子,离子反应方程式为:Cu+2Fe3+═Cu2++2Fe2;
故答案为:Cu+2Fe3+═Cu2++2Fe2+;
(2)溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,故c(H+)=c(Cu2+)=0.1mol/L,故n(Cu2+)=0.1mol/L×0.1L=0.01mol,溶解铜的质量为0.01mol×64g/mol=0.64g;反应后溶液中的阳离子为:Fe3+、Fe2+、Cu2+、H+,而Cu+2Fe3+═Cu2++2Fe2+,可见Fe2+的物质的量浓度为Cu2+的两倍,依据溶液中的电荷守恒规律,故0.1mol/L×3+0.2mol/L×2+0.1mol/L×2+0.1mol/L×1=c(SO42-)×2,解得c(SO42-)=0.5mol/L;
故答案为:0.64 0.5;
(3)若欲在如图所示的装置中发生(1)中的反应,则铜电极是负极,不如铜活泼的金属或导电的非金属作正极,所以X电极是负极,
负极上电极反应式为:Cu-2e-═Cu2+,碳(石墨、金、铂、银)作正极,正极上铁离子得电子发生还原反应,电极反应式为:2Fe3++2e-═2Fe2+;
故答案为:
正、负极判断 电极材料 电极反应式
X极 负极 铜 Cu-2e-═Cu2+
Y极 正极 碳 2Fe3++2e-═2Fe2+点评:
本题考点: 电解原理;离子方程式的书写.
考点点评: 本题考查原电池原理、物质的量的有关计算等知识点,根据原电池的构成条件、电极反应及原子守恒、电荷守恒来分析解答即可,难度不大.1年前查看全部
- 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用下图所示电
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用下图所示电
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁溶液与烧碱溶液反应制得白色纯净的Fe(OH)2沉淀,应用下图电解实验可以制得白色纯净的Fe(OH)2沉淀,两电极材料分别为石墨和铁.电解液c可以是()A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2 请主要说一下电子的转移以及物质的产生 joygirl1年前1
joygirl1年前1 -
 zhang414 共回答了13个问题
zhang414 共回答了13个问题 |采纳率100%铁做阳极,失电子,电子转移到电源的正极.
石墨做阴极,得电子,电子来自于电源的负极.
无图,BC都可能
B.NaCl溶液 白色沉淀在两个电极之间产生
C.NaOH溶液 白色沉淀在铁电极附近产生.
A 导电性太差
D 无OH-生成.1年前查看全部
- 配制可溶性亚铁盐溶液时,如果加铜粉会有什么后果
配制可溶性亚铁盐溶液时,如果加铜粉会有什么后果
离子方程式 lixuemei5251年前2
lixuemei5251年前2 -
 250bm 共回答了18个问题
250bm 共回答了18个问题 |采纳率83.3%纯的亚铁溶液不会有反应,不过如果要少部分亚铁离子被氧化为铁离子的话就会和铜粉发生反应,铁离子被还原成亚铁离子,铜被氧化成铜离子.(亚铁离子在空气中极易被氧化)
O2 + Fe2+ → O2-(在水中以H2O存在) + Fe3+
2Fe3+ +Cu → 2Fe2+ +Cu2+1年前查看全部
- 为了不影响后续检验亚铁盐,检验硫酸盐可用的试剂是用 A用硝酸酸化的硝酸钡溶液 B用盐酸酸化的氯化钡溶液
为了不影响后续检验亚铁盐,检验硫酸盐可用的试剂是用 A用硝酸酸化的硝酸钡溶液 B用盐酸酸化的氯化钡溶液
为什么要选盐酸酸化的氯化钡? 又见炊烟_1年前3
又见炊烟_1年前3 -
 翼天唯我 共回答了20个问题
翼天唯我 共回答了20个问题 |采纳率95%必然不能用A,因为硝酸酸化的硝酸钡会使二价铁离子氧化,所以不能用,
而盐酸就没有影响了!而且若溶液中有亚硫酸根的话也不会影响1年前查看全部
- 已知高价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,且亚铁盐溶液呈浅绿色.现有一研究性学习小组的同学将一带锈的铁钉浸入
已知高价铁盐与铁粉在溶液中能发生化合反应,生成亚铁盐,且亚铁盐溶液呈浅绿色.现有一研究性学习小组的同学将一带锈的铁钉浸入足量稀硫酸中,发现最终溶液显浅绿色.请你帮他们写出整个实验过程中发生反应的化学方程式:
①______,
②______,
③______. 本人正迷茫1年前1
本人正迷茫1年前1 -
 回贴第一oo 共回答了17个问题
回贴第一oo 共回答了17个问题 |采纳率94.1%带锈的铁钉浸入足量稀硫酸中,铁锈的主要成分氧化铁与硫酸反应生成硫酸铁和水,当铁锈反应完露出铁时,铁与硫酸反应生成硫酸亚铁和氢气,铁还能与硫酸铁溶液反应生成硫酸亚铁;化学方程式为:
Fe 2 O 3 +3H 2 SO 4 =Fe 2 (SO 4 ) 3 +3H 2 OFe+H 2 SO 4 =FeSO 4 +H 2 ↑ Fe 2 (SO 4 ) 3 +Fe=3FeSO 4
故答案为:①Fe 2 O 3 +3H 2 SO 4 =Fe 2 (SO 4 ) 3 +3H 2 O②Fe+H 2 SO 4 =FeSO 4 +H 2 ↑③Fe 2 (SO 4 ) 3 +Fe=3FeSO 41年前查看全部
- 钡盐、银盐、铜盐、铁盐、亚铁盐、铝盐溶解性
钡盐、银盐、铜盐、铁盐、亚铁盐、铝盐溶解性
与这些阴离子搭配
亚硫酸根离子、亚硝酸根离子、卤离子 1952551年前1
1952551年前1 -
 水舞花影 共回答了18个问题
水舞花影 共回答了18个问题 |采纳率100%亚硫酸根:钡盐不溶、银盐不溶不稳、铜盐不溶不稳、铁盐不存在、亚铁盐不溶不稳、铝盐不存在
亚硝酸根离子:钡盐不溶、铜盐不溶、铁盐不存在、亚铁盐不溶、铝盐不存在
氟离子:钡盐不溶、银盐溶、铜盐溶、铁盐易配合、亚铁盐易配合、铝盐不溶
其它卤离子:钡盐溶、银盐不溶、铜盐溶、铁盐溶(FeI3不存在)、亚铁盐溶、铝盐溶1年前查看全部
- 在铁盐和亚铁盐的一些性质中,氯化铁溶液中加入铁粉、KSCN溶液.再加氯水振荡.溶液变红.如果铁粉过量,将溶液变红色的试管
在铁盐和亚铁盐的一些性质中,氯化铁溶液中加入铁粉、KSCN溶液.再加氯水振荡.溶液变红.如果铁粉过量,将溶液变红色的试管振荡由会看到什么现象,为什么?
 芙蓉nn的妹妹1年前1
芙蓉nn的妹妹1年前1 -
 无敌小魔王 共回答了20个问题
无敌小魔王 共回答了20个问题 |采纳率95%血红色溶液褪色.
因为铁粉过量,发生反应:2Fe3+ +Fe=3Fe2+
二价铁不能与KSCN溶液发生显色反应.1年前查看全部
- 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(3)若欲在如图所示的装置中发生(1)中的反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中.
正、负极判断 电极材料 电极反应式
X极
Y极
解析:
正、负极判断 电极材料 电极反应式
X极 负极 铜 Cu-2e-===Cu2+
Y极 正极 碳 2Fe3++2e-===2Fe2+
阴极为什么没有铜离子生成CU 千疮百孔1年前1
千疮百孔1年前1 -
 点燃半支烟 共回答了21个问题
点燃半支烟 共回答了21个问题 |采纳率81%阴极还原反应,氧化性强的离子先反应,Fe3+先反应,然后才是Cu2+反应.1年前查看全部
- 请问芬顿试剂除了亚铁盐、双氧水外还有些什么组分?
 黑桃吃红桃1年前1
黑桃吃红桃1年前1 -
 珠江情缘部落 共回答了16个问题
珠江情缘部落 共回答了16个问题 |采纳率87.5%芬顿试剂是由过氧化氢和硫酸亚铁盐配成的氧化试剂.过氧化氢和Fe(2+)(上标下同)反应形成HO*游离基:
Fe(2+)+HO:OH---→Fe(3+)+OH(-)+HO*
为芳香化合物的羟基化试剂:
Ar---------→(H2O2+FeSO4)----→ArOH
可作醇等的氧化试剂、可用于醛糖的降级,生成少一个碳原子的醛糖,此法称为鲁夫-芬顿醛糖降级法.1年前查看全部
- 铁与什么反应能生成亚铁盐,是置换反应吗,还有铁与什么反应能生成铁盐,是复分解反应吗?
铁与什么反应能生成亚铁盐,是置换反应吗,还有铁与什么反应能生成铁盐,是复分解反应吗?
请具体讲详细一点,不过请在初中能接受的范围内讲,太深奥的话听不懂 appleLee1年前3
appleLee1年前3 -
 g5sh 共回答了18个问题
g5sh 共回答了18个问题 |采纳率88.9%一般的酸
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
比Fe不活泼的金属的盐
Fe + CuSO4 = FeSO4 + Cu
根据金属活动性顺序表
K,Ca,Na,Mg,Al,Zn,Fe,……H,Cu,Hg,Ag,Pt,Au
前面的可以置换出后面的
所以是置换反应,1年前查看全部
- 亚铁盐与H2O2的离子反应方程式
 79240821年前1
79240821年前1 -
 hunter0112 共回答了21个问题
hunter0112 共回答了21个问题 |采纳率76.2%2Fe^(2+) + H2O2 + 2H+=== 2Fe^(3+) + 2H2O
不知道这个能不能看清.1年前查看全部
- 离子方程式 配制可溶性亚铁盐溶液时,不能加铜粉
 hantang11201年前2
hantang11201年前2 -
 lznyf 共回答了15个问题
lznyf 共回答了15个问题 |采纳率93.3%配制可溶性亚铁盐溶液要加铁粉而不是铜粉
加铁粉是为了防止Fe2+被氧化
若加铜粉,则Fe2+被氧化生成Fe3+
与Cu反应
Fe3+ + Cu =Fe2+ + Cu2+1年前查看全部
- 盐酸和亚铁盐反应的离子方程式是什么?
 霜落无痕1年前3
霜落无痕1年前3 -
 不爱不值得爱的人 共回答了22个问题
不爱不值得爱的人 共回答了22个问题 |采纳率90.9%离子方程式:4Fe2+ + NO3- + 4H+ = 4Fe3+ + NO↑ + 2H2O1年前查看全部
- 如何保存亚铁盐溶液,防止其被氧化,为什么?
 郑帅哥1年前3
郑帅哥1年前3 -
 秀哥龙头 共回答了8个问题
秀哥龙头 共回答了8个问题 |采纳率87.5%加入铁粉,铁粉和亚铁盐是还原剂,且铁粉的还原性比亚铁盐强,先与空气中的氧气反应,使亚铁盐不会被氧化.1年前查看全部
- 急求亚铁盐、磷酸盐、锂盐这三个化学药品的存放方法?
 薄荷green1年前1
薄荷green1年前1 -
 lpf_81 共回答了17个问题
lpf_81 共回答了17个问题 |采纳率94.1%亚铁盐存放时要在瓶中放少量铁粉;磷酸盐与锂盐存放要避潮和避光1年前查看全部
- 检验亚铁盐的试剂用什么?现象又是什么?
 zhqttkl1年前2
zhqttkl1年前2 -
 长天一色001 共回答了18个问题
长天一色001 共回答了18个问题 |采纳率94.4%先加硫氰化钾溶液,无明显现象,再滴加双氧水,溶液呈现血红色,可证明有铁离子,说明原溶液中有亚铁盐.1年前查看全部
- 制取亚铁盐盐酸和还原性铁粉制亚铁盐是不是用铁和盐酸反应
 爱如尘1年前1
爱如尘1年前1 -
 珊瑚娃娃 共回答了20个问题
珊瑚娃娃 共回答了20个问题 |采纳率90%是的
但要注意加酸,即可减缓亚铁被氧化,又可以抑制亚铁离子水解
制固态亚铁盐一般很有难度,大多数时候可以用比较稳定的摩尔盐
摩尔盐是亚铁盐的复盐(硫酸亚铁铵),分子式为(NH4)2SO4·FeSO4·6H2O,是分析化学中常用的还原剂.
制取:将新制的FeSO4与(NH4)2SO4混合制成.因为(NH4)2SO4溶液呈酸性,所以Fe2+较稳定.1年前查看全部
- 关于铁盐与亚铁盐的生成铁与什么反应是生成铁盐贴于什么反应是生成亚铁盐?
 紫色葡萄梦1年前3
紫色葡萄梦1年前3 -
 红红火火888 共回答了22个问题
红红火火888 共回答了22个问题 |采纳率90.9%与氧化性酸生成铁盐,如浓硫酸、硝酸
与非氧化性酸生成亚铁盐,如稀硫酸、盐酸
但是亚铁盐还原性太强,空气中放置,早晚变成铁盐1年前查看全部
- 写出还原铁粉在胃酸的作用下转化为亚铁盐的化学方程式
写出还原铁粉在胃酸的作用下转化为亚铁盐的化学方程式
请您帮帮我,我马上要这个答案,谢谢! 好可爱阿1年前1
好可爱阿1年前1 -
 ht3v 共回答了22个问题
ht3v 共回答了22个问题 |采纳率95.5%Fe+2HCl=FeCl2+H2(气体)1年前查看全部
- 在K2CR2O7法测定亚铁盐中Fe的含量实验中重铬酸钾为什么可用来直接配制标准溶液
 audrey_zw1年前2
audrey_zw1年前2 -
 十年021 共回答了19个问题
十年021 共回答了19个问题 |采纳率84.2%K2CR2O7不会发生水解反应,因为重铬酸是强酸,且无色,.
而且K2CR2O7中CR为+6价,具有氧化性会与亚铁反应,再根据溶液颜色的变化,可以确定反应完成没有.1年前查看全部
- 铁在胃中变成亚铁盐的化学式
 浩野飞鸿1年前3
浩野飞鸿1年前3 -
 rantao120 共回答了18个问题
rantao120 共回答了18个问题 |采纳率83.3%Fe+2HCl=FeCl2+H2↑(必须有气体符号和配平)1年前查看全部
- Fe 的制取,还要铁盐和亚铁盐的离子反应式
 风景haohao1年前3
风景haohao1年前3 -
 su147258369 共回答了11个问题
su147258369 共回答了11个问题 |采纳率81.8%铁的制取,一般用c还原氧化铁得到铁单质
就是工业炼铁啊.
还有很多得到铁的方法,在此不再赘述们如果需要的话就问我
欢迎追问1年前查看全部
- 氢氧化钠和亚铁盐反应方程式(先到先得O(∩_∩)O~)
氢氧化钠和亚铁盐反应方程式(先到先得O(∩_∩)O~)
方程式就行 心如刀绞11271年前2
心如刀绞11271年前2 -
 发wegwg 共回答了15个问题
发wegwg 共回答了15个问题 |采纳率100%以硫酸亚铁为例:FeSO4+2NaOH=Fe(OH)2↓+Na2SO41年前查看全部
- 铁盐 亚铁盐 水解方程式什么时候要写沉淀符号
铁盐 亚铁盐 水解方程式什么时候要写沉淀符号
有时候要写 有时候不要写 但不知道什么时候 samdam1年前2
samdam1年前2 -
 琳子nora 共回答了19个问题
琳子nora 共回答了19个问题 |采纳率94.7%一般写符号表示反应进行的比较彻底,常见的是双促水解,就是说铁盐和弱酸盐混合,或者说弱酸铁盐,像向铁盐中加入硫化钠,碳酸钠,或者硫化铁、碳酸铁加入水中等
一般强酸铁盐溶液如水解程度较小,不加沉淀符号,像氯化铁的水解1年前查看全部
- 大学化学问题,关于莫尔盐为什么莫尔盐的氧化还原稳定性比一般的亚铁盐高?(常作为亚铁离子的标准试剂使用)
 旭日一派1年前1
旭日一派1年前1 -
 晨mu 共回答了23个问题
晨mu 共回答了23个问题 |采纳率95.7%大概是因为铵离子在水溶液中能创造出酸性环境,在酸性条件下,亚铁离子的还原能力比在碱性环境下差很多.由此可以推断出,没有明显氧化能力的弱碱阳离子的硫酸盐(只要不与亚铁离子反应的阴离子盐皆可,例如高氯酸盐)与硫酸亚铁混合,都将稳定二价铁离子.1年前查看全部
- 铝盐与其他盐反应吗 铁盐(亚铁盐)与其他盐反应吗
 阿不的人1年前2
阿不的人1年前2 -
 zeroluo 共回答了20个问题
zeroluo 共回答了20个问题 |采纳率85%可以反应,只要有沉淀生成或气体产生或弱电解质产生,比如有个更特殊的Al盐加NaCO3可以双水解生成Al(oH)3沉淀和CO2气体1年前查看全部
大家在问
- 1kg的完整形式
- 2帮修改下面的句子,改成一般疑问句 :
- 3开关垂直配管内为什么有三条线?书上说一零一火还有一条开关控制线.
- 4在观察了叶片的结构后,晓东将刚摘下的叶片放人70度的热水中,很快发现叶片表面产生许多的小气泡,并且下表皮的气泡比上表皮的
- 5怎样做高中的知识笔记,使其更美观
- 6must领导的一般疑问句Must do I do homework?怎么回答这类问题?Must I do homewor
- 70.1mol的单质Cl2与50mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Brˉ的物质的量之比
- 8《只有一个地球》读后感
- 9求《展望未来》1册第一单元单词~
- 10冬天花生油沉淀了能不能吃
- 11在光滑的水平桌面上,放着一条张为L(L>h)、质量为m的粗细均匀的铁链,铁链沿桌子边缘下垂部分的长度为L/2,并从此位置
- 12只工作不玩耍,聪明的脑袋也会变傻 英文
- 13从文中可以看出张秀才有哪些性格特点
- 14David was late for school two years ago的疑问句和否定句.
- 15初一数学题实数ab在数轴上的位置如图所示
