2Na+O2=Na2O2 1molNa转移多少电子
 沙漠蚁2022-10-04 11:39:545条回答
沙漠蚁2022-10-04 11:39:545条回答
已提交,审核后显示!提交回复
共5条回复
 piggy0421 共回答了17个问题
piggy0421 共回答了17个问题 |采纳率94.1%- 1mol Na由0价变为正1价,失去1mol电子
- 1年前
 匪首雨亭 共回答了23个问题
匪首雨亭 共回答了23个问题 |采纳率95.7%- 1NA
要过程可追问 - 1年前
 弹指逸笑 共回答了1个问题
弹指逸笑 共回答了1个问题 |采纳率- 一摩尔Na转移一摩尔电子,只看升价的,一摩尔钠全部变成正一价的钠,所以转移一摩尔
- 1年前
 greentea_21 共回答了41个问题
greentea_21 共回答了41个问题 |采纳率- 1
- 1年前
 ragerma 共回答了12个问题
ragerma 共回答了12个问题 |采纳率- 由0价变为+1价 1mol转移1mol
- 1年前
相关推荐
- 1molNa转变为Na+时失去的电子数为
1molNa转变为Na+时失去的电子数为
怎么算? yoyoung1年前4
yoyoung1年前4 -
 xh0i4n 共回答了29个问题
xh0i4n 共回答了29个问题 |采纳率82.8%一个Na失去一个电子,转变为Na+
1molNa转变为Na+时失去1mol电子,也就是1阿伏加德罗常数个电子.1年前查看全部
- 高一新生化学选择在0.5molNa2co3中含有A.0.5molCO3 2-B.1molNa+c.60.2*1023mo
高一新生化学选择
在0.5molNa2co3中含有
A.0.5molCO3 2-
B.1molNa+
c.60.2*1023molNa+
D.1.5个O
这题A.B困扰了 我很久.感觉都对..请给出答案,并说明另1个错的理由
在线等急 管不住的风WSP1年前3
管不住的风WSP1年前3 -
 蔷薇阿亮 共回答了18个问题
蔷薇阿亮 共回答了18个问题 |采纳率100%A是错的
因为CO3 2- 会在水中水解
生成 HCO3- 和 H2CO3
虽然是少量的
但做单选时 就不可以忽略了1年前查看全部
- 1molNa与2mol100毫升HCL反应.求产生气体的物质的量
 这个id太恶心1年前1
这个id太恶心1年前1 -
 vivianren9 共回答了20个问题
vivianren9 共回答了20个问题 |采纳率85%判断 明显盐酸不足量 但Na还是会和水反应 所以Na完全反应完
我们知道 2Na-----对应----H2
2 1
1 0.5 所以产生H2 0.5mol1年前查看全部
- 1molNa转变为Na*时失去的电子数为多少?
 shuangxue78901年前3
shuangxue78901年前3 -
 bilisi 共回答了18个问题
bilisi 共回答了18个问题 |采纳率94.4%1个Na原子变成Na离子,需要失去1个电子.
因此1molNa转变为Na*时失去的电子数为1mol,即6.02*10^23个1年前查看全部
- 将1molna与1molal放入质量为m克(足量)的水中,所得溶液密为ρ g/cm3,则该溶液的物
将1molna与1molal放入质量为m克(足量)的水中,所得溶液密为ρ g/cm3,则该溶液的物
将1molna与1molal放入质量为m克(足量)的水中,所得溶液密为ρ g/cm3,则该溶液的物质的量浓度为多少 zhhnoriko1年前1
zhhnoriko1年前1 -
 yy87913714 共回答了22个问题
yy87913714 共回答了22个问题 |采纳率86.4%将1molna与1molal放入质量为m克(足量)的水中,生成1mol的NaAlO2,并放出2mol 氢气
溶液的总质量=m+23+27-4=m+46
该溶液的物质的量浓度=1000p/(m+46) mol/L1年前查看全部
- (1)Na 2 CO 3 的摩尔质量为______,1molNa 2 CO 3 中约含有______个氧原子.
(1)Na 2 CO 3 的摩尔质量为______,1molNa 2 CO 3 中约含有______个氧原子.
(2)将0.1molCO 2 通入含0.2molNaOH的溶液中,恰好完全反应.
①反应的化学方程式为______;
②生成的Na 2 CO 3 的物质的量为______mol,质量为______g.
(3)反应后所得的溶液的pH______7(填“>”、“=”、“<”). dengweibo1年前1
dengweibo1年前1 -
 桐栖梧 共回答了15个问题
桐栖梧 共回答了15个问题 |采纳率93.3%(1)根据摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量,因此Na 2 CO 3 的摩尔质量为:106g/mol;
1molNa 2 CO 3 中含有3mol氧原子,所以1molNa 2 CO 3 中约含有 3×6.02×10 23 个氧原子;
故答案为:106g/mol; 3×6.02×10 23 ;
(2)①根据反应物与生成物,CO 2 与NaOH反应的化学方程式为:2NaOH+CO 2 =Na 2 CO 3 +H 2 O;
故答案为:2NaOH+CO 2 =Na 2 CO 3 +H 2 O;
②设生成的Na 2 CO 3 的物质的量为 x mol
2NaOH+CO 2 =Na 2 CO 3 +H 2 O
1 1
0.1 x
x=0.1
106g/mol×0.1mol=10.6 g
故答案为:0.1;10.6;
(3)根据Na 2 CO 3 溶液呈强碱性,所以反应后所得的溶液的pH>7; 故答案为:>.1年前查看全部
- 试回答下列问题:(1)漂粉精在空气中长期露置时会变质,则其变质的有关化学方程式为______.(2)把1molNa和1m
试回答下列问题:
(1)漂粉精在空气中长期露置时会变质,则其变质的有关化学方程式为______.
(2)把1molNa和1mol Mg分别投入到过量且等体积的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为m a ______m b
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为______mol/L.
②标准状况下,1.00L水(密度:1.00g•cm -3 )吸收______L的HCl可制得上述浓盐酸.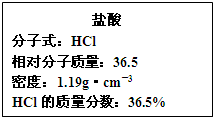
 望月仙1年前1
望月仙1年前1 -
 品浪 共回答了14个问题
品浪 共回答了14个问题 |采纳率92.9%(1)因碳酸的酸性大于次氯酸,故漂粉精中的Ca(ClO) 2 与二氧化碳反应发生反应:
Ca(ClO) 2 +CO 2 +H 2 O=CaCO 3 ↓+2HClO,符合强酸制弱酸.
故答案为:Ca(ClO) 2 +CO 2 +H 2 O=CaCO 3 ↓+2HClO
(2)0.1mol的Mg为2.4g,置换出0.1mol氢气即0.2g的氢气,差量为2.4g-0.2g=2.2g,即溶液增重2.2g;0.1mol的Na为2.3g,置换出0.05mol氢气即0.1g的氢气,差量为2.3g-0.1g=2.2g,即溶液增重2.2g,而原来盐酸的质量相等,所以反应后两溶液的质量相等.
故答案为:等于
(3)①设盐酸的体积为VL,则溶质的质量为V×1000mL×1.19g•cm -3 ×36.5%,溶质的物质的量为
V×1000mL×1.19g•c m -3 ×36.5%
36.5mol/L =11.9Vmol,所以溶质的物质的量浓度为
11.9Vmol
VL =11.9mol/L.
②1.00L水(密度:1.00g•cm -3 )的质量为1000g,设HCl气体的体积为VL,则
W=
m(溶质)
m(溶液) ×100%=
VL
22.4L/mol ×36.5g/mol
VL
22.4L/mol ×36.5g/mol+1000g ×100%=36.5%,解得V=353
故答案为:3531年前查看全部
- 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA,
 玩具经营1年前1
玩具经营1年前1 -
 留住孤独 共回答了20个问题
留住孤独 共回答了20个问题 |采纳率90%正确1年前查看全部
- 1molNa被氧化成Na2O2转移1mol电子,而1molCH3CH2OH被氧化成CO2却转移12mol电子?前者升高1
1molNa被氧化成Na2O2转移1mol电子,而1molCH3CH2OH被氧化成CO2却转移12mol电子?前者升高1价为什么不要乘以2,而后者升高6价却乘了2?
 tangxin5201年前2
tangxin5201年前2 -
 仙界 共回答了16个问题
仙界 共回答了16个问题 |采纳率75%1molNa每个Na原子升一价成离子当然是1mol电子,1mol乙醇中有两个C好不好.当然乘二1年前查看全部
- 试回答下列问题:(1)漂粉精在空气中长期露置时会变质,则其变质的有关化学方程式为______.(2)把1molNa和1m
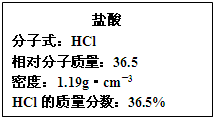 试回答下列问题:
试回答下列问题:
(1)漂粉精在空气中长期露置时会变质,则其变质的有关化学方程式为______.
(2)把1molNa和1mol Mg分别投入到过量且等体积的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma______mb
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为______mol/L.
②标准状况下,1.00L水(密度:1.00g•cm-3)吸收______L的HCl可制得上述浓盐酸. 囫囵1年前1
囫囵1年前1 -
 干牛怡 共回答了11个问题
干牛怡 共回答了11个问题 |采纳率100%解题思路:(1)根据漂粉精与二氧化碳反应书写化学方程式;
(2)根据差量法求出盐酸增重的质量,判断反应后溶液的质量;
(3)①设溶液的体积为VL,再求出溶质的物质的量,代入公式求出物质的量浓度;
②先求出水的质量,设HCl气体的体积为VL,根据质量百分数等于溶质的质量除以溶液的质量,求出溶质的体积;(1)因碳酸的酸性大于次氯酸,故漂粉精中的Ca(ClO)2与二氧化碳反应发生反应:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,符合强酸制弱酸.
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(2)0.1mol的Mg为2.4g,置换出0.1mol氢气即0.2g的氢气,差量为2.4g-0.2g=2.2g,即溶液增重2.2g;0.1mol的Na为2.3g,置换出0.05mol氢气即0.1g的氢气,差量为2.3g-0.1g=2.2g,即溶液增重2.2g,而原来盐酸的质量相等,所以反应后两溶液的质量相等.
故答案为:等于
(3)①设盐酸的体积为VL,则溶质的质量为V×1000mL×1.19g•cm-3×36.5%,溶质的物质的量为
V×1000mL×1.19g•cm−3×36.5%
36.5mol/L=11.9Vmol,所以溶质的物质的量浓度为[11.9Vmol/VL]=11.9mol/L.
②1.00L水(密度:1.00g•cm-3)的质量为1000g,设HCl气体的体积为VL,则
W=
m(溶质)
m(溶液)×100%=
VL
22.4L/mol×36.5g/mol
VL
22.4L/mol×36.5g/mol+1000g×100%=36.5%,解得V=353
故答案为:353点评:
本题考点: 氯、溴、碘及其化合物的综合应用;化学方程式的有关计算;物质的量浓度的相关计算.
考点点评: 本题考查了盐酸的性质以及根据溶质质量分数求出物质的量浓度,利用溶质质量分数求出溶质的质量和体积.1年前查看全部
- 1molNa燃烧生成Na2O2失去的电子数为2nA为什么错啊?
 wjc0303091年前1
wjc0303091年前1 -
 炼不成的钢铁 共回答了18个问题
炼不成的钢铁 共回答了18个问题 |采纳率94.4%1molNa燃烧,Na --->Na+ 共1NA电子,别看产物,看Na的化合价即可.
❤您的问题已经被解答~~(>^ω^1年前查看全部
- 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子,怎么算的
 黑木泽1年前1
黑木泽1年前1 -
 _玫瑰_ 共回答了19个问题
_玫瑰_ 共回答了19个问题 |采纳率84.2%因为是足量O2,故无Na剩余.1molNa全显+1价.所以失去1mol电子,即NA个电子.1年前查看全部
- 关于高一mol和离子1》1molNa所含的电子的物质的量是?mol2》12gMg成为Mg2+时,失去电子的物质的量为?m
关于高一mol和离子
1》1molNa所含的电子的物质的量是?mol
2》12gMg成为Mg2+时,失去电子的物质的量为?mol
3》0.5molNa2SO4中,含有的Na+数约为多少个,硫酸根离子的物质的量是多少,硫酸根的离子的质量是多少g 起舞不清影1年前4
起舞不清影1年前4 -
 笑看人生29 共回答了21个问题
笑看人生29 共回答了21个问题 |采纳率90.5%1.1molNa所含的电子的物质的量是11mol
2.12gMg成为Mg2+时,失去电子的物质的量为1mol
3.0.5molNa2SO4中,含有的Na+数约为6.02*10^23个,硫酸根离子的物质的量是3.01*10^23,硫酸根的离子的质量是48g1年前查看全部
- 为什么1molNa与足量氧气反应生成的是Na2O2而不是Na2O?
为什么1molNa与足量氧气反应生成的是Na2O2而不是Na2O?
不是说加热才生成Na2O2的么? 禾子棉袄1年前1
禾子棉袄1年前1 -
 demonknight 共回答了17个问题
demonknight 共回答了17个问题 |采纳率88.2%它是一个连续的反应,先省呈Na2O的因为O2过量就继续反映生成Na2O2了 4Na+O2==2Na2O 2Na2O+O2==2Na2O 加热下直接生成Na2O2的,只是快一点1年前查看全部
- 将1molNa和1molAl的混合物投入足量水中,产生气体在标准状况下的体积为( )
将1molNa和1molAl的混合物投入足量水中,产生气体在标准状况下的体积为( )
A. 11.2L
B. 22.4L
C. 33.6L
D. 44.8L 唐小胖ii1年前2
唐小胖ii1年前2 -
 贞齐 共回答了24个问题
贞齐 共回答了24个问题 |采纳率87.5%解题思路:首先发生反应:2Na+2H2O=2NaOH+H2↑,根据钠计算生成氢气、氢氧化钠的物质的量,然后发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,进行过量计算,根据不足量的物质的量计算生成氢气的物质的量,两部分氢气之和为总的氢气的物质的量,再个V=nVm计算体积.首先1molNa与水反应,则:
2Na+2H2O=2NaOH+H2↑
1mol 1mol 0.5mol
然后发生反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知1molAl消耗1molNaOH,故Al与NaOH恰好完全反应,生成氢气为1mol×[3/2]=1.5mol,
故生成氢气的总体积为(0.5mol+1.5mol)×22.4L/mol=44.8L,
故选D.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度不大,清楚发生的反应是关键,注意铝与氢氧化钠反应的过量计算.1年前查看全部
- 1molNa,1molNa+,1molOH-所含的物质的量分别是多少
1molNa,1molNa+,1molOH-所含的物质的量分别是多少
写错,是所含电子的物质的量分别是什么 summerson1年前1
summerson1年前1 -
 被他溶化 共回答了13个问题
被他溶化 共回答了13个问题 |采纳率92.3%都是1摩尔啊.
MOL嘛 就是物质的量的单位咯
恩
第一个是 11摩尔 因为每个NA有11个电子
第二个 10摩尔 以内NA+是NA失去了一个电子 也就有10个电子
第三个 每摩尔有8+1+1摩尔电子 就是10摩尔1年前查看全部
- 1mol物质的电子怎么求1molNa含有电子数——1molN2含有电子数——0.5molCO2含有电子数——
 jlefxnhjfb1年前1
jlefxnhjfb1年前1 -
 青湖的雪梨 共回答了20个问题
青湖的雪梨 共回答了20个问题 |采纳率90%用物质的量乘以每个原子中的电子数再乘以阿伏伽德罗常数.如1molNa含有电子数=1*11*6.02*10(23次方)1年前查看全部
- 现有①1mol纯净的Na 2 CO 3 ②1molNa 2 CO 3 和NaHCO 3 的混合物
现有①1mol纯净的Na 2 CO 3 ②1molNa 2 CO 3 和NaHCO 3 的混合物,下列描述正确的是( ) A.分别与足量盐酸反应时①消耗盐酸量少 B.分别与足量氯化钡溶液反应时①产生的沉淀多 C.分别配成等体积的溶液时②的c(Na + )大 D.相同条件下,分别与足量盐酸反应时放出的CO 2 体积相等  130life1年前1
130life1年前1 -
 WWWW9906 共回答了21个问题
WWWW9906 共回答了21个问题 |采纳率90.5%A、1mol碳酸钠消耗2molHCl,1mol碳酸氢钠消耗1molHCl,物质的量相同时,消耗盐酸:Na 2 CO 3 >NaHCO 3 ,所以1mol纯净的Na 2 CO 3 和1molNa 2 CO 3 和NaHCO 3 的混合物与足量盐酸反应时,②消耗盐酸少,...1年前查看全部
- 1molna与足量的o2反应,转移的电子数为?急
1molna与足量的o2反应,转移的电子数为?急
我知道可以用na失一电子算但为啥不能列反应式算?其他同类型的题却可以,感激不尽, uu杨神经1年前1
uu杨神经1年前1 -
 zyyhh2008 共回答了17个问题
zyyhh2008 共回答了17个问题 |采纳率82.4%1个Na,反应后变成钠离子,转移一个电子.
所以1mol钠反应,转移1mol的电子数,也就是阿佛加德罗常数个.1年前查看全部
- 1molNa原子中约含有多少个电子?用NA表示阿伏加德罗常数
 jickyquan1年前1
jickyquan1年前1 -
 fofaixaoxi 共回答了17个问题
fofaixaoxi 共回答了17个问题 |采纳率88.2%11NA1年前查看全部
- 把1molNa,Si的混合物投入适量水中产生的气体在标况下的体积范围
 ankenwang1年前1
ankenwang1年前1 -
 爱你很高兴 共回答了21个问题
爱你很高兴 共回答了21个问题 |采纳率95.2%如果都是硅,体积是0.
如果都是钠元素,体积是0.5mol气体的体积,也就是11.2L,体积在这两个之间的都有可能,因此范围是0-11.2L.1年前查看全部
- 我知道1molNa原子变成Na离子,需要失去1个电子,但为什么失去的电子数为1mol?
 amycaisha1年前5
amycaisha1年前5 -
 好困哦 共回答了15个问题
好困哦 共回答了15个问题 |采纳率93.3%一个钠原子变成钠离子需要失去一个电子,比例为1:1.所以1molNa原子变成Na+就需要1*1mol=1mol电子.1年前查看全部
- 1molNa转变为钠离子时失去的电子数为( )
1molNa转变为钠离子时失去的电子数为( )
A3.01×10的23次方
B6.02×10的23次方
C1.204×10的23次方
D6.02×10的24次方
某盐的溶液中含有钠离子、镁离子、氯离子、硫酸根离子四种离子,若钠离子为0.2mol,镁离子为0.4mol,氯离子为0.4mol了,则硫酸根离子物质的量为( )
A0.1mol
B0.3mol
C0.5mol
D0.15mol 十年网龄1年前1
十年网龄1年前1 -
 cyx52013 共回答了21个问题
cyx52013 共回答了21个问题 |采纳率95.2%1.选B 钠失去电子变成Na+ 每摩尔Na失去一摩尔电子 也就是1NA
而1NA=6.02*10 23次方
2.选B 无论什么溶液,只要是溶液,一定呈电中性,也就是溶液中的正离子所带电荷=负离子所带电荷数
溶液中Na+和Mg2+ 所带电荷总数 0.2+0.4*2=1.0mol
而氯离子Cl-所带电荷 0.4*1=0.4mol因此硫酸根必须带1.0-0.4=0.6mol电荷数
每摩尔硫酸根所带电荷2mol 所以硫酸根物质的量是 0.6/2=0.3mol1年前查看全部
- 高中化学书上的一句原话:①1mol任何物质粒子数相同.My question:1molNaCl不是含有1molNa离子与
高中化学书上的一句原话:①1mol任何物质粒子数相同.My question:1molNaCl不是含有1molNa离子与1molCl离子,总共有2mol粒子,不是与①的说法矛盾了吗?难道可以说是1molNaCl粒子,但好像没有这样的粒子吧.
 zc9621191年前1
zc9621191年前1 -
 越海风 共回答了16个问题
越海风 共回答了16个问题 |采纳率87.5%NaCl是由Na离子和Cl离子组成的; 举个例子,两只鞋是一双鞋 ,一双鞋即1molNaCl,其中的两只鞋相当于钠离子和氯离子,各一只,即各1mol1年前查看全部
- 1molNa被氧化生成Na2O2失去多少个电子
 浪中小船1年前3
浪中小船1年前3 -
 蓝雨玫瑰 共回答了21个问题
蓝雨玫瑰 共回答了21个问题 |采纳率81%1个钠变为+1价钠离子,失去一个电子,1摩尔钠原子变成Na2O2,失去的电子就是1摩尔,即1NA个电子.1年前查看全部
- 1molNa离子、NH3、OH离子、F离子分别含有多少NA电子,需要计算过程
 firedragon501年前1
firedragon501年前1 -
 qzqs 共回答了19个问题
qzqs 共回答了19个问题 |采纳率89.5%钠离子 钠是第十一号元素,一个钠原子含电子数为11,钠离子是钠原子失去一个电子形成的,故一个钠离子含10个电子,1mol钠离子 当然就是含 10NA个电子咯,1mol粒子就是1NA个
氨气 氮 7电子 氢 1电子 一共有一个氮原子和3个氢原子 故 一个氨分子含有7+1*3=10个电子 所以1mol氨分子中含10NA电子
氢氧根离子 氧 8电子 氢 1电子 氢氧根带一个单位负电,说明得到了一个电子,故一个氢氧根含有8+1+1=10个电子,同理 10NA
氟离子 是氟原子得到一个电子形成的 带一个单位负电荷 一个氟原子有9个电子 一个负离子有10个电子 ,同理 10NA1年前查看全部
- 已知20摄氏度时1molNa失去1mol电子所需的能量为650kJ,则Na的第一电离能为650kj,为什么不对?
 drzb8321年前2
drzb8321年前2 -
 ibmp650 共回答了19个问题
ibmp650 共回答了19个问题 |采纳率78.9%气态电中性基态原子失去一个电子转化为气态基态正离子所需要的能量叫做第一电离能
20度的时候钠不是气态的1年前查看全部
- 1molNa与足量O2反应能生成Na2Ohe Na2O2的混合物吗?
 jeffrey00301年前1
jeffrey00301年前1 -
 遗忘失落 共回答了21个问题
遗忘失落 共回答了21个问题 |采纳率76.2%不是吧!如果在点燃情况下,应该基本上全是过氧化钠(Na2O2),但是常温缓慢反应应该只生成氧化钠(NaO)1年前查看全部
- 高二有机化学(酸和酯):某有机物A的分子式为C8H8O4,1molA可分别与3molNa、2molNaOH、1molNa
高二有机化学(酸和酯):某有机物A的分子式为C8H8O4,1molA可分别与3molNa、2molNaOH、1molNaHCO3恰好反应
又知A为芳香族化合物,苯环上的一氯化物有4种,则A的结构简式可能是_____ 爱家者1年前0
爱家者1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- Na与稀硫酸反应的化学方程式Na与稀硫酸分几步反应?请写出各步的化学方程式1molNa与稀硫酸反应会生成多少mol的H2
Na与稀硫酸反应的化学方程式
Na与稀硫酸分几步反应?请写出各步的化学方程式
1molNa与稀硫酸反应会生成多少mol的H2? 秋天11111年前1
秋天11111年前1 -
 dally66360 共回答了20个问题
dally66360 共回答了20个问题 |采纳率85%就一步
2Na+H2SO4===Na2SO4+H2
钠与水反应实质就是钠和水电离出来的氢离子反应
硫酸是强酸,钠就先和他反应了1年前查看全部
大家在问
- 13--5题 选择 七年级数学下学期期末测试题 相交线、平行线与平移
- 2哪位大神帮我看看这些工程力学的题怎么做
- 31个4*4(亦共16个小正方形组成)中有多少个正方形?
- 4英语翻译It's not necessary to be the same .I like to have friend
- 5AB是圆O的直径,点E,F分别是OA,OB的中点,且EC⊥AB,FD⊥AB,EC,FD交圆O于C,D两点,求证:弧AC=
- 6在平面直角坐标系中,直线l1的解析式为y=x-3,直线l2过原点且l2与直线l1交于点P(-2,a).
- 7证明函数极限:若x-->2,则5x+2-->12.
- 8若ab互为相反数,则(3b+2a)-(2b-3a)=
- 9图上距离 5厘米,比例尺1:40000,求实际距离
- 10主语后面的's缩写比如 I's ……,这种缩了只有一个S的时候有些什么情况?第三人称后面的S缩写可不可以是HAS的缩写,
- 11花间一壶酒,
- 12读南亚地形图分析回答:(1)图中序号所代表的地形区为:①______平原 ②:______河;④______山
- 13求大学英语作文《Online Shopping》 120词语
- 14已知数列1,2x,3x^2,...,nx^n-1(x≠0),求前n项和
- 15y=log1/2(sinx-cosx)取得最小值是?x=?
