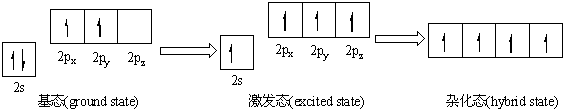
杂化轨道问题:原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道.
 ww立tt2022-10-04 11:39:542条回答
ww立tt2022-10-04 11:39:542条回答
杂化轨道问题:原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道.
这句话为什么是对的, 不等性杂化轨道的能量就不相同.题中说成键时能重新组合成能量相等的新轨道,能量相等不是错的么?
这句话为什么是对的, 不等性杂化轨道的能量就不相同.题中说成键时能重新组合成能量相等的新轨道,能量相等不是错的么?

已提交,审核后显示!提交回复
共2条回复
 呀在月明 共回答了12个问题
呀在月明 共回答了12个问题 |采纳率75%- 这句话是对的.杂化轨道理论的大意是:几个原子有能量相近的空轨道,当这些原子试图耦合成分子或原子团时,它们之间的轨道会由于量子力学的关系进行相互之间的协调,最后到了一个最佳平衡点.在这个平衡时间点,几个原子相互耦合趋势形成的轨道能量基本平分秋色,轨道能量也是能够达到成键的量度,于是在瞬间形成了分子或原子团.我们把此时到达稳定态的电子轨道形态叫做杂化轨道,这个中间的耦合过程叫做杂化.所以说这句话是对的,最后生成的每一个杂化轨道的能量都是一样的,否则生成的化合物就会因为轨道能量不均产生分离,最后也不会产生实质意义上的化学变化.希望能对您有所帮助!
- 1年前
 ipaq_3630 共回答了1546个问题
ipaq_3630 共回答了1546个问题 |采纳率- 轨道能量相等,但是在轨道上有什麽东西就不一定了.
而东西不同就导致了最终呈现出来的结果不同. - 1年前
相关推荐
- 杂化电子排布杂化时电子是如何进入轨道的?比如碳,形成的四个杂化sp3 中原有电子的排布,形成甲烷时电子的排布.键与空轨道
杂化电子排布
杂化时电子是如何进入轨道的?比如碳,形成的四个杂化sp3 中原有电子的排布,形成甲烷时电子的排布.键与空轨道的关系 chun59751年前2
chun59751年前2 -
 wzy212 共回答了16个问题
wzy212 共回答了16个问题 |采纳率87.5%杂化就是不同类型能量相近的原子轨道重新组合的过程,甲烷中碳原子是sp3杂化,1个2s轨道和3个2p轨道杂化,形成4个sp3杂化轨道,呈四面体形.派键是由两个原子的p能级电子采用肩并肩式重叠,以取得原子轨道最大重叠而形成的共价键轨道.杂化的轨道只能形成'西格玛'键,未参与杂化的p轨道才形成派键.希望这些能解决你的问题1年前查看全部
- 水中氧原子的孤电子对数杂化轨道的解释我懂,就是用公式:1/2(a-xb)我算起来是一对.
 ggggwxfj1年前2
ggggwxfj1年前2 -
 男女歌手 共回答了24个问题
男女歌手 共回答了24个问题 |采纳率87.5%H2O中的O原子的孤电子对数是2对:
按价层电子对互厅模型可以计算:
中心原子O,价电子数是6
与H成键电子数是:1*2
孤对电子数:1/2(6-1*2)=21年前查看全部
- FeCI3中各原子的杂化方式及空间构型
 kk额会更好1年前2
kk额会更好1年前2 -
 高春宁 共回答了18个问题
高春宁 共回答了18个问题 |采纳率83.3%sp3d21年前查看全部
- 如何确定乙醛的杂化类型C2H4O 第一个碳周围4个σ键,而另外一个碳只有三个σ键和一个π键.这样怎么来判断杂化类型?
 路在何方5141年前2
路在何方5141年前2 -
 曾姆暗沙海鸥 共回答了18个问题
曾姆暗沙海鸥 共回答了18个问题 |采纳率83.3%甲基碳四根键是立体结构,是sp3杂化.醛基碳是平面结构,是sp2杂化1年前查看全部
- 求元素符号,Xw4的空间构型,杂化轨道类型,W2Y的空间结构
求元素符号,Xw4的空间构型,杂化轨道类型,W2Y的空间结构
W,X,Y,Z四种元素依次增大,其中Y原子的L电子层中,成对电子和未成对电子占据轨道数相同,无空轨道,X原子的L电子层中未成对电子数与Y相同,还有空轨道,WZ的原子序数相差10,Z原子的第一电离能在同周起中最低 小-鸟-依-人1年前2
小-鸟-依-人1年前2 -
 小洁的窝 共回答了15个问题
小洁的窝 共回答了15个问题 |采纳率100%Y,既然L层有成对电子说明2s已经填满.假设只有1对成对电子,那麼未成对电子就是1个,所以是2s22p1的B.也有可能是2对成对电子,那麼就占据了2个轨道,剩下两个单电子占据另外两个轨道,是2s22px22py12pz1的O.又因为题目说屋空轨道所以把B排除,Y=O.
O只有2个成单电子,而X的成单电子和Y相同,所以X也是2个.而X原子序数比O小,且有空轨道,那麼只有C.
Z的第一电离能在同周期中最低,那麼只有可能是碱金属,所以Z=Na,W就是H.
XW4=CH4,sp3杂化.
H2O是V形分子.1年前查看全部
- 配合物Mn(C5H5)(CO)3中Mn的杂化方式是什么?为什么?
 wxcsunrise1年前1
wxcsunrise1年前1 -
 gdx22 共回答了11个问题
gdx22 共回答了11个问题 |采纳率100%在研究d区金属的羰基或茂配合物时,由于配体提供的电子较多,金属更倾向于接受电子形成稀有气体核外电子的排布结构,即形成18个核外电子的结构.Mn的价电子数是7,C5H5提供5个π电子,三个CO共提供6个,形成7+5+6=18个电子.
如果硬要说杂化方式的话,可能是d2sp3等性杂化,Mn价层的7个电子中有6个电子填充在未参与杂化的3个d轨道中,还剩下的1个电子与C5H5中非双键C上的1个电子成对填入一个杂化轨道,同时C5H5中的两个双键上的π电子对和三个CO提供的3对电子填入剩下的5个杂化轨道,构成八面体配位结构.1年前查看全部
- 基态Be价层电子构型为2s2,表面看是不能形成共价键的.但杂化后可形成BeCl2.请教下为什么说表面看不成键
 mgo1391年前1
mgo1391年前1 -
 eaglesu 共回答了18个问题
eaglesu 共回答了18个问题 |采纳率72.2%Be的最外层有2个电子 一般这样结构的比较容易完全失去2个电子 形成离子键.
所以表面上看不能形成共价键,不是不能成键.1年前查看全部
- XeOF4中心原子采取什么杂化方式呢?其分子空间构型是什么样的呢?(07.3.2.3)
XeOF4中心原子采取什么杂化方式呢?其分子空间构型是什么样的呢?(07.3.2.3)
莫非是
↑ ↑↑↑ ↑↑(↑↓)?
为什么不是sp3d3呢? 再龙吟细细1年前1
再龙吟细细1年前1 -
 蓝色静脉 共回答了26个问题
蓝色静脉 共回答了26个问题 |采纳率88.5%应该是sp3d2杂化,是四方锥形1年前查看全部
- NPCl3的结构嗯.我想说的是.形成三聚体时,N-P之间的成键情况而已.(成键类型,成键轨道,两个原子各自的杂化方式.
 mustberich1年前2
mustberich1年前2 -
 1只特立独行的猪 共回答了13个问题
1只特立独行的猪 共回答了13个问题 |采纳率92.3%纠正一下,是(PNCL2)3,就是一个六圆环,N sp2
P sp3 pai键为d(P)-d(N)
N的sp2轨道被4个电子占据,一条是lp,另两条与P形成P-N键,第五个电子占据Pz轨道形成pai键
P的sp3轨道中4个电子近似成四面体,2个P-N,两个P-CL,d轨道中第五个电子成pai键1年前查看全部
- 为什么氯酸根,次氯酸根,高氯酸根中的氯原子杂化方式相同?
为什么氯酸根,次氯酸根,高氯酸根中的氯原子杂化方式相同?
ClO- ClO2- ClO3- ClO4- 四种原子中氯原子杂化方式为什么相同?
另外,原子杂化方式怎样判断?、【中学阶段】 konimeter1年前2
konimeter1年前2 -
 chzhwei 共回答了16个问题
chzhwei 共回答了16个问题 |采纳率93.8%为什么不同?
判断的方法就是,根据VSEPR来判断
计算中心原子的价层电子对数,n=1/2*(中心原子价电子数+配位原子提供的电子*配位原子个数)/2
n=2为sp,n=3为sp2,以此类推1年前查看全部
- 关于C的杂化CO2的杂化是C中2S和p上的空轨道杂化?CO是C中的S2和p上单电子的一个轨道杂化?我说的第一个问题对了?
关于C的杂化
CO2的杂化是C中2S和p上的空轨道杂化?
CO是C中的S2和p上单电子的一个轨道杂化?
我说的第一个问题对了?那么麻烦再解释下CO的杂化把 ,你说的没看懂 本oo传人1年前1
本oo传人1年前1 -
 一刀火 共回答了13个问题
一刀火 共回答了13个问题 |采纳率92.3%CO2的杂化是C中2S和p上的空轨道杂化?
是SP杂化就是2个S和2个P杂化,按比例1:1 生产的杂化几何形状是直线型
CO是C中的S2和p上单电子的一个轨道杂化?
这个是比较复杂的O上的孤对电子做反馈π键与C结合实际是
=
O → C1年前查看全部
- 杂化轨道中,什么情况下会sp3、sp2、sp杂化
杂化轨道中,什么情况下会sp3、sp2、sp杂化
比如说是,在原子在价电子有什么特征时,分别是sp3、sp2、sp杂化 pifu12341年前1
pifu12341年前1 -
 dy72127 共回答了19个问题
dy72127 共回答了19个问题 |采纳率89.5%当价电子为 ns2np2 时,s 亚层上的一个电子易被激发到p亚层,而形成四个sp3杂化轨道 当价电子为 ns2np1 时,s 亚层上的一个电子易被激发到p亚层,而形成三个sp2杂化轨道 当价电子为 ns2np0 时,s 亚层上的一个电子易被激发到p亚层,而形成两个sp杂化轨道1年前查看全部
- 乙烯干吗不是SP3杂化C的2S和2个2P杂化成3个SP轨道位于一个平面,剩下一个电子填到2P(2Pz)上去,这样不是有3
乙烯干吗不是SP3杂化
C的2S和2个2P杂化成3个SP轨道位于一个平面,剩下一个电子填到2P(2Pz)上去,这样不是有3个SP轨道参与杂化吗?干吗还是SP2而不是SP3?
上面打错了,我是问有3个P轨道参与(2个与S杂化,1个填电子),怎么不是SP3 nn宪兵1年前3
nn宪兵1年前3 -
 老牛不老 共回答了13个问题
老牛不老 共回答了13个问题 |采纳率92.3%如果一个分子是SP3杂化,那么它的空间构型为四面体,SP2杂化为平面三角形 ,而乙烯分子的碳原子和两个氢原子 不可能形成四面体结构.这是原因一.
第二,碳原子的2S轨道是一个原子轨道,加上2个2P轨道,一共是3个原子轨道,而SP2就是需要3个原子轨道的杂化,因此也不能形成SP3这样的4个原子轨道的杂化方式.
中1年前查看全部
- 18、乙烯分子中的C是( )杂化.19、乙炔分子中的C是( )杂化.
18、乙烯分子中的C是( )杂化.19、乙炔分子中的C是( )杂化.
18、乙烯分子中的C是( )杂化.
A、sp3 B、sp2 C、sp D 、dsp2
19、乙炔分子中的C是( )杂化.
A、sp3 B、sp2 C、sp D 、dsp2 ELLY55661年前1
ELLY55661年前1 -
 唐僧唐僧唐僧 共回答了19个问题
唐僧唐僧唐僧 共回答了19个问题 |采纳率84.2%,c,这种简单的可以看乙烯是双键,那周围有3个键,没有故对电子,所以是sp2,乙炔同理.1年前查看全部
- 分子结构问题(高手进)①乙烯每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道这句话怎么不对呢②能提供孤
分子结构问题(高手进)
①乙烯每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道
这句话怎么不对呢
②能提供孤对电子与某些金属离子形成配位键的物质有什么特点
哥几个细一点答
thanks chenlan99661年前3
chenlan99661年前3 -
 dirkshab 共回答了16个问题
dirkshab 共回答了16个问题 |采纳率100%①乙烯是sp2型杂化,为平面三角形结构(对于一个C),既然是杂化,就必然不能说一个价电子占据一个2p轨道了,因为有一个垂直于分子平面的2p轨道就没有参与杂化,每一个碳的三个价电子中的两个形成C-H西格玛键,另一个形成C-C西格玛键.另外,垂直于分子平面的两个p轨道还会形成定域π键(不是离域的,ssln1994这位朋友好似对定域离域没有概念).明显,三个杂化轨道中的每一个有三分之二的p成分,三分之一的s成分..你那句话的错误是显而易见的.
②你的问法很奇怪,是想了解配合物的特点吗?1年前查看全部
- 苯胺中的氮原子是什么杂化类型?苯胺和苯酚分子中的氢原子是否一定都在同一平面上?已经找到答案北大的有机化学书上明确讲到苯酚
苯胺中的氮原子是什么杂化类型?
苯胺和苯酚分子中的氢原子是否一定都在同一平面上?
已经找到答案北大的有机化学书上明确讲到苯酚中的氧原子发生sp2杂化,而苯胺中的N原子却发生的是sp3杂化,但不知道为什么是这样? 燕过无痕5201年前2
燕过无痕5201年前2 -
 snajo 共回答了23个问题
snajo 共回答了23个问题 |采纳率91.3%sp3杂化
氮原子有三个未充满电子的2p轨道,如果用来成键,键角应该是90°,但是实际上在许多化合物中键角都接近109°,所以在这些化合物中,氮是用sp3杂化轨道和其他原子成键的.氨具有棱锥型的结构,氮用sp3杂化轨道与碳原子和两个氢原子形成三个sp3杂化轨道,成冷椎体,氮上尚有一对孤对电子,占据另一个sp3杂化轨道,处于棱锥体的顶端,类似第四个“基团”,这样,氮的空间排布基本上近似碳的四面体结构,氮在四面体的中心.1年前查看全部
- 下列分子的空间构型可用sp 2 杂化轨道来解释的是______(填序号)①CH 4 ②CH 2 =CH 2 ③C 6
下列分子的空间构型可用sp 2 杂化轨道来解释的是______(填序号)①CH 4 ②CH 2 =CH 2 ③C 6 H 6 ④CH≡CH⑤NH 3 ⑥BF 3 .  hbxfcyj1年前1
hbxfcyj1年前1 -
 树叶飘过的秋 共回答了18个问题
树叶飘过的秋 共回答了18个问题 |采纳率94.4%①CH 4 分子中碳原子杂化轨道数为4,所以采取sp 3 杂化,故错误;
②CH 2 =CH 2 分子中每个碳原子杂化轨道数为3,所以采取sp 2 杂化,故正确;
③C 6 H 6 分子中碳原子杂化轨道数为3,所以采取sp 2 杂化,故正确;
④CH≡CH分子中每个碳原子杂化轨道数为2,所以采取sp杂化,故错误;
⑤NH 3 分子中氮原子杂化轨道数为4,所以采取sp 3 杂化,故错误;
⑥BF 3 分子中硼原子杂化轨道数为3,所以采取sp 2 杂化,故正确.1年前查看全部
- 下列关于杂化轨道的叙述中,不正确的是 A.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 B.分子中中心原子
下列关于杂化轨道的叙述中,不正确的是
A.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 B.分子中中心原子通过sp 3 杂化轨道成键时,该分子不一定为正四面体结构 C.杂化前后的轨道数不变,但轨道的形状发生了改变 D.sp 3 、sp 2 、sp杂化轨道的夹角分别为109°28′、120°、180°  当风不再吹过1年前1
当风不再吹过1年前1 -
 fenjiexing 共回答了14个问题
fenjiexing 共回答了14个问题 |采纳率100%A
1年前查看全部
- 关于C的sp2杂化问题C本来是有2s2,2p2的.杂化后不就变为1s2,2p3了.为什么还叫sp2杂化呢
 ailihk8201年前1
ailihk8201年前1 -
 zjttcjb 共回答了14个问题
zjttcjb 共回答了14个问题 |采纳率100%什么是sp2杂化,是一条S轨道和三条P轨道杂化.一共三条P轨道,其中有两条去参杂化,还剩下一条P.
杂化前,只有一条S,一条P各有两个电子,所以叫2s22p2,还有两条P轨道是空的.
杂化后,三条sp2杂轨道各有一个电子.那条没有参与的P轨道也有一个电子.
还有就是你有一个概念错误,这一条S和两条P去杂化,杂化了之后就不是原来的S或P轨道了,已经混和之后重新规划了.只有一条P轨道,是没有参与杂化的.一理杂化了,就没是了.
你有一个红鸡蛋,我有三个白鸡蛋.你出一个,我出两个,都打在一个碗里做三个鸡蛋饼.做完了之后,你不能说一个是红鸡蛋做的,另两个是白鸡蛋做的.都已经混了,只能说是三个混合饼.如果还可以做的话,就只有我的剩下的一个白鸡蛋可以做一个纯的,由一个白鸡做的饼了.1年前查看全部
- 用中心价层电子对数如何判断非单中心分子的杂化轨道形式?
用中心价层电子对数如何判断非单中心分子的杂化轨道形式?
不是说不能用中心价层电子对数公式来解释非单中心分子的杂化轨道形式吗?那例如乙烯,乙炔,苯等这样的不是由一个原子作为中心原子的分子该怎样计算呀?
如何得知乙烯中碳原子是由2px,2py和2s形成sp2杂化轨道的,而乙炔中C原子中2s和2px轨道形成sp杂化轨道,可以用特殊方法计算出其杂化轨道呢?例如,单中心分子可用中心价层电子对数公式来解释 dzqhdlx1年前1
dzqhdlx1年前1 -
 xinxiyewu 共回答了20个问题
xinxiyewu 共回答了20个问题 |采纳率95%用杂化轨道理论.
在形成分子的过程中,由于原子间的相互影响,若干类型不同而能量相近的原子轨道相互混杂,重新组合成一组能量相等,成分相同的新轨道,这一过程称为杂化.经过杂化而形成的新轨道叫做杂化轨道,杂化轨道与其他原子轨道重叠时形成σ共价键.原子在形成分子的过程中,为了使所成化学键强度更大,更有利于体系能量的降低,总趋向于将原来的原子轨道进一步线性组合,以形成新的原子轨道.
价键理论对共价键的本质和特点做了有力的论证,但它把讨论的基础放在共用一对电子形成一个共价键上,在解释许多分子、原子的价键数目及分子空间结构时却遇到了困难.例如C原子的价电子是2s22p2,按电子排布规律,2个s电子是已配对的,只有2个p电子未成对,而许多含碳化合物中C都呈4价而不是2价,可以设想有1个s电子激发到p轨道去了.那么1个s轨道和3个p轨道都有不成对电子,可以形成4个共价键,但s和p的成键方向和能量应该是不同的.而实验证明:CH4分子中,4个C-H共价键是完全等同的,键长为114pm,键角为109°28'.BCl3,BeCl2,PCl3等许多分子也都有类似的情况.为了解释这些矛盾,1928年鲍林(Pauling)提出了杂化轨道概念[1],丰富和发展了的价键理论.他根据量子力学的观点提出:在同一个原子中,能量相近的不同类型的几个原子轨道在成键时,可以互相叠加重组,成为相同数目、能量相等的新轨道,这种新轨道叫杂化轨道.C原子中1个2s电子激发到2p后,1个2s轨道和3个2p轨道重新组合成4个sp3杂化轨道,它们再和4个H原子形成4个相同的C-H键,C位于正四面体中心,4个H位于四个顶角.
杂化轨道种类很多,如三氯化硼(BCl3)分子中B有sp2杂化轨道,即由1个s轨道和2个p轨道组合成3个sp2杂化轨道,在氯化铍(BeCl2)中有sp杂化轨道,在过渡金属化合物中还有d轨道参与的sp3d和sp3d2杂化轨道等.以上几例都是阐明了共价单键的性质,至于乙烯和乙炔分子中的双键和三键的形成,又提出了σ键和π键的概念.如把两个成键原子核间联线叫键轴,把原子轨道沿键轴方向“头碰头”的方式重叠成键,称为σ键.把原子轨道沿键轴方向“肩并肩”的方式重叠,称为π键.例如在乙烯(CH2= CH2)分子中有碳碳双键(C=C),碳原子的激发态中2px,2py和2s形成sp2杂化轨道,这3个轨道能量相等,位于同一平面并互成120℃夹角,另外一个pz轨道未参与杂化,位于与平面垂直的方向上.碳碳双键中的sp2杂化如下所示.
这3个sp2杂化轨道中有2个轨道分别与2个H原子形成σ单键,还有1个sp2轨道则与另一个C的sp2轨道形成头对头的σ键,同时位于垂直方向的pz轨道则以肩并肩的方式形成了π键.也就是说碳碳双键是由一个σ键和一个π键组成,即双键中两个键是不等同的.π键原子轨道的重叠程度小于σ键,π键不稳定,容易断裂,所以含有双键的烯烃很容易发生加成反应,如乙烯(H2C=CH2)和氯(Cl2)反应生成氯乙烯(Cl—CH2—CH2—Cl).
乙炔分子(C2H2)中有碳碳三键(HC≡CH),激发态的C原子中2s和2px轨道形成sp杂化轨道.这两个能量相等的sp杂化轨道在同一直线上,其中之一与H原子形成σ单键,另外一个sp杂化轨道形成C原子之间的σ键,而未参与杂化的py与pz则垂直于x轴并互相垂直,它们以肩并肩的方式与另一个C的py,pz形成π键.即碳碳三键是由一个σ键和两个π键组成.这两个π键不同于σ键,轨道重叠也较少并不稳定,因而容易断开,所以含三键的炔烃也容易发生加成反应
杂化轨道限于最外层电子,而在第一层的两个电子不参与反应,而在其他层上有许多的轨道,电子会从能量低的层“跃迁”到能量高的层,而原来能量低的层是因为电子的运动方向相反,而跃迁以后电子就只向一种方向运动,所以能量会高.并且反应以后组成的能量介于原来的S轨道和P轨道能量之间.1年前查看全部
- C,O,H形成相对分子质量为60的一元羧酸分子,c元素以——和——杂化成键?
 franktao1年前2
franktao1年前2 -
 一代新贵 共回答了17个问题
一代新贵 共回答了17个问题 |采纳率76.5%CH3COOH
CH3中,C为sp3
COOH中,C为sp21年前查看全部
- 下列说法中正确的是( )A.乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键B.sp3杂化轨道是由任意的1个s轨
下列说法中正确的是( )
A.乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C.凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形
D.凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 zhgao13301年前1
zhgao13301年前1 -
 小小灵芝 共回答了13个问题
小小灵芝 共回答了13个问题 |采纳率92.3%解题思路:A.碳碳三键中含有一个σ键和两个π键,每个碳原子含有2个σ键且不含孤电子对,每个碳原子都有两个未杂化的2p轨道肩并肩重叠形成两个π键;
B.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道为杂化轨道;
C.根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数,n=3,sp2杂化,不含孤电子对其分子构型都是平面三角形,否则不是;
D.根据价层电子对互斥理论确定其杂化方式,如果价层电子对为2,则中心原子以sp杂化轨道成键,AB2型的共价化合物,其中心原子A不一定采用sp杂化轨道成键;A.乙炔分子的结构式H-C≡C-H,中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+[1/2]×(4-2×2)=2,采取sp杂化,每个碳原子都有两个未杂化的2p轨道形成π键,故A正确;
B.sp3杂化轨道是指同一电子层内,1个s轨道和3个p轨道杂化,形成能量相等的四个sp3杂化轨道,故B错误;
C.中心原子采取sp2杂化的分子,n=3,sp2杂化,不含孤电子对其分子构型都是平面三角形,否则不是,如二氧化硫分子中,价层电子对数=2+
1
2×(6-2×2)=3,所以采取sp2杂化,含有一对孤电子对,所以立体构型为V型,故C错误;
D.AB2型的共价化合物,其中心原子A价层电子对为2,则中心原子以sp杂化轨道成键,如氯化铍分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,AB2型的共价化合物,也有不采用sp杂化轨道成键,如二氧化硫分子中,价层电子对数=2+
1
2×(6-2×2)=3,所以采取sp2杂化,故D错误;
故选A.点评:
本题考点: 原子轨道杂化方式及杂化类型判断;判断简单分子或离子的构型.
考点点评: 本题考查了杂化轨道、分子空间结构等,题目难度中等,注意把握杂化轨道理论的应用,注意判断中心原子的价层电子对以及孤对电子数的判断.1年前查看全部
- 重键(双键或三键)杂化的过程是什么样的
重键(双键或三键)杂化的过程是什么样的
请说明CO2中的C是如何杂化的 六碗粥1年前1
六碗粥1年前1 -
 lixiaoxiao1990 共回答了17个问题
lixiaoxiao1990 共回答了17个问题 |采纳率100%这个东西是比较复杂的啊!
如果你学了价层电子对互斥理论那就方便讲了.
一般化合物中氧族元素为负价是不看做供出电子云的,所以CO2中C有4个价电子,所以有:4/2=2,所以C的杂化为sp杂化,为线性结构.
一般的:
你首先要了解双键的成键形式,双键中有两种键,一种是电子云头碰头成的σ键,另一种是肩并肩(靠电子云的两侧重叠)成的π键,用于成π的电子是不参与杂化的,所以CH2=CH2(乙烯)中C的杂化形式为sp2杂化((C上用于杂化的电子数+3×H的价电子)/2=(3+3×1)/2=3),而重氮基(-N=N-)为sp2杂化.
另外还应该注意另一种所谓的双键—配位键,实际上应该用"→"表示(由于配位键是一个原子单方面给另一给原子提供电子对作为共用电子对(是共价键)所以得到电子云的原子是得到了两个电子,但仍参与受出体的电子杂化,所以有如下:
硝酸根:,O
,||
,[O-N ]-
,||
,O
实际应该是:
,O
,↑
,[O-N ]-
,↓
,O
所以N→O上的O的杂化为sp3杂化((氧的六个价电子+N供出的一个电子对)/2=4),而N为sp2杂化(注意这里由于共轭效应O上得到的一个电子会转移到N上面来也参N的电子杂化).
而叁键就简单一些由于叁键三不存在有配位键的表达,所以所以按双键的第一种情况来分析,如N三N(N2,氮气)N的杂化为sp杂化,但也有特殊的如:(BN)n(n∈N+)中B看上去无杂化(为s杂化,即可看作无杂化),但事实上为sp2杂化,因为事实上(BN)n中B是与周围三个N成键的,而不是只与一个N成叁键;所以如果要推断一个原子的杂化就要弄清楚它所在物质的晶形(一般金属晶体无杂化、分子晶体按一般讨论、原子晶体则无重键).
总之必须具体情况具体讨论!1年前查看全部
- 判断下列分子(或离子)的空间结构型,并指出其中原子的杂化轨道类型.
判断下列分子(或离子)的空间结构型,并指出其中原子的杂化轨道类型.
CO2 CH4 BF3
钴离子 H2O lanlan0121年前1
lanlan0121年前1 -
 一一汗 共回答了18个问题
一一汗 共回答了18个问题 |采纳率88.9%CO2 直线型,C:sp
CH4 正四面体,C:sp3
BF3 平面三角形,B:sp2
钴离子 六水合钴或六氨合钴离子是八面体,Co:d2sp3
H2O 折线型,O:sp31年前查看全部
- SP3不等性杂化的解释在分子结构中:SP3杂化有两种,一种是等性杂化,一种是不等性杂化,请说明一下不等性杂化
 神经习习1年前1
神经习习1年前1 -
 梦想飘飞 共回答了17个问题
梦想飘飞 共回答了17个问题 |采纳率94.1%等性与不等性的差别在于杂化轨道是否都是成键的电子轨道
CH4属于等性杂化,NH3属于不等性杂化.CH4四个轨道都用来成键,而NH3中有三个轨道用来成键,还有一个被一对孤对电子占据,四个轨道作用不同,所以称不等性杂化1年前查看全部
- 如何计算中心原子的杂化类型
 yiny23561年前1
yiny23561年前1 -
 黄妖怪 共回答了25个问题
黄妖怪 共回答了25个问题 |采纳率96%杂化类型的判断依据是vsepr构型
核心是求价层电子对数
若价层电子对数是2,则是sp杂化,若价层电子对数是3,则是sp2杂化,若价层电子数是4,则是sp3杂化.若若价层电子数是5,则是s2p3杂化
一般掌握到sp3就行了.
那么如何求价层电子对数呢?
有公式
价层电子对数=西格玛键对数+(a-bx)/2
后面的(a-bx)/2就是中心原子的孤对电子数
举个例子
(1)CH4
它有4个西格玛键,孤对电子对数是0,所以价层电子对数为4,则是sp3杂化
再举个例子
(2)NH3
它有3个西格玛键,孤独电子对数是1,所以价层电子对数为4,则是sp3杂化
不懂再问.1年前查看全部
- 轨道杂化的解释有机物的形成
 meicotnog1年前1
meicotnog1年前1 -
 ycl-93 共回答了19个问题
ycl-93 共回答了19个问题 |采纳率94.7%详情你可以去参考北大出版的结构化学.具体忘记了.有机化学中,主要讲碳原子的电子轨道sp3sp2sp三种杂化形式.s轨道属于内层轨道,p轨道属于外层轨道,碳最外层有四个电子,表示为2s2/2p2,s轨道排满了,两个p轨道只有一个轨道上面排了两个自旋方向相同的电子.
如果分子需要sp3杂化,s轨道和三个p轨道就会能量平均化,形成四个sp3杂化轨道.每个轨道上都会有一个电子,然后这四个轨道去与其他碳原子或氢原子等结合,参考CH4
如果分子需要sp2杂化,s轨道跟两个p轨道能力平均化,形成3个sp2杂化轨道.,这种轨道要比p轨道低,而且这个轨道与sp2轨道垂直(三个p轨道是相互垂直的,参考空间三维坐标轴),可以形成π键.参考CH2=CH2
如果分子需要sp杂化,s轨道和一个p轨道就会能量平均化,形成两个个sp杂化轨道.另外两个p轨道与这个轨道垂直,而且相互垂直,参考乙炔结构1年前查看全部
- 杂化轨道 AmBn型 的公式 是 n +中心原子的价电子?
杂化轨道 AmBn型 的公式 是 n +中心原子的价电子?
和为2 则sp ; 为3 则sp2;为4 则sp3 nslin38291年前1
nslin38291年前1 -
 why为什么 共回答了18个问题
why为什么 共回答了18个问题 |采纳率88.9%不对.你算一下 CO2 中 C 的杂化方式就明白了.应该是 sp,你算出来是 sp21年前查看全部
- sp2,sp3轨道杂化的过程激发态是什么?杂化以后又怎样?只是成键能力增强了这么简单吗?
 深嗳琳1年前1
深嗳琳1年前1 -
 gullion 共回答了15个问题
gullion 共回答了15个问题 |采纳率80%这是化学问题呀!怎么放在电脑中了.不过既然看到了,就给你一个回答吧.
首先要明白一个轨道能级的概念.电子在围绕核放置时,其能量是固定的,按能量级大小分别可以分为S、P、D、F四个能级.其中第一层最多有两个电子,即只有一个S轨道;第二、三层最多有8个电子,包含一个S轨道和一个P轨道;第四层最多的18个电子,包含一个S、一个P、一个D轨道;……依次类推,目前已知的原子中电子最多的一层包含32个电子,包含SPDF轨道各一个.
在各轨道中,S轨道包含一个轨道,最多可有两个自旋方向相反的电子,当轨道电子为零空或满时处于稳定状态,即类似氢离子和氦原子的状态.P轨道包含三个轨道,最多可容纳6个电子,当三个轨道为全空、全満时为稳定状态,当三个轨道各只有一个电子时,由于电子自旋方向相同时,也处于一种稳定状态,称为亚稳定状态;D轨道有五个轨道,最多容纳10个电子,稳定状态理由同上;F轨道有7个轨道,最多容纳14个电子,稳定状态理由也同上.
当原子失去电子时,它首先失去的是外层的电子,当电子由高层轨道向低层轨道转移时,称为“跃迁”,此时多余的能量将被释放出,这就是化学反映中发光、发热的原因.同理,当电子吸收了外界能量,使其轨道由低层次向高层次转移时,称为“激发”,处于激发态的电子很不稳定,很快便会向低轨道(正常轨道)“跃迁”,同时放出恒定的能量,如果是发光,同发出的是单纯的色光,即“激光”.激光就是利用一些物质(如红宝石)能够稳定的被激发→跃迁的原理进行的.
至于成键能力,这只是有关于化合价的一些概念.明白了轨道杂化的概念,共价键等概念就太好理解了.
最后举一个例子,可能对你理解上述这些概念有好处
碳(C)是第6位元素,在其原子中含有6个电子,其电子轨道是1s2 2s2 2p2,其中第2级轨道形成杂化轨道,在2S和2P轨道中四个电子呈自旋方向相同状态,即形成类似2S1 2P3的状态,此时原子处于亚稳定状态.这就是碳为何稳定的原因.
其他的,可参考一些化学参考书,感觉这应该是大学里学的东西.1年前查看全部
- 俄歇效应就是电子轨道杂化么
 石榴花_1111年前1
石榴花_1111年前1 -
 寻找摩卡散兵 共回答了16个问题
寻找摩卡散兵 共回答了16个问题 |采纳率81.3%俄歇效应是原子发射的一个电子导致另一个或多个电子(俄歇电子)被发射出来而非辐射X射线(不能用光电效应解释),使原子、分子成为高阶离子的物理现象,是伴随一个电子能量降低的同时,另一个(或多个)电子能量增高的跃迁过程.
1.在成键的过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新原子轨道,这种轨道重新组合的方式称为杂化(hybridization),杂化后形成的新轨道称为杂化轨道(hybrid orbital).2.杂化轨道的角度函数在某个方向的值比杂化前的大得多,更有利于原子轨道间最大程度地重叠,因而杂化轨道比原来轨道的成键能力强(轨道是在杂化之后再成键).电子云的形状
3.杂化轨道之间力图在空间取最大夹角分布,使相互间的排斥能最小,故形成的键较稳定.不同类型的杂化轨道之间夹角不同,成键后所形成的分子就具有不同的空间构型.
可以看出二者明显不同.
俄歇效应是电子发生能量交换的现象
而杂化轨道理论只是一个理论,而不是一个现象1年前查看全部
- 如何判断这一类型中心原子轨道的杂化类型?如N2H4、C2H2、C2H4、C3H8、CO2等.没
如何判断这一类型中心原子轨道的杂化类型?如N2H4、C2H2、C2H4、C3H8、CO2等.没
如何判断这一类型中心原子轨道的杂化类型?
如N2H4、C2H2、C2H4、C3H8、CO2等.
没有明显的ABm类型的不会... jhlhzmandy1年前1
jhlhzmandy1年前1 -
 ytiaid 共回答了24个问题
ytiaid 共回答了24个问题 |采纳率83.3%这一类没必要用价层电子对互斥理论来解释.直接画电子式判断.以c为中心原子的,全部单键就是sp3杂化,双键的就是Sp2杂化,这里双键指的是单双键,像CO2里两个双键就是sp杂化了.形成三键就是sp杂化.至于N2H4,可以看作NH3中一个H被氨基取代.和氨气一样,sp3杂化1年前查看全部
- 有机化学中用杂化来解释键长键能的问题
有机化学中用杂化来解释键长键能的问题
小弟大学有机化学坐的飞机 不好意思啊
1.用杂化理论解释为什么 甲烷 乙炔 乙烯的 C-H键键长不同,
这个这么说?
根据我的理解杂化之后形成的电子云重叠 sp3最大 sp最小那么 重叠面积达就表示键长最小,
2.关于解离键能为什么这个会是甲烷最大
因为我看来sp结合应该是s的成分最多啊,那么sp结合应该离原子核更近,那么键能应该最大啊,但事实却是相反的这是为什么
真的非常不好意思 gpower19841年前4
gpower19841年前4 -
 风流客林敦 共回答了27个问题
风流客林敦 共回答了27个问题 |采纳率85.2%这样吧,因为我只是高中的化学,说出给你听听我的理解.
首先甲烷乙炔乙烯这些都是 碳氢化合物 这个没有问题吧
要理解这个化学键的长度 需要知道原子核和电子之间的关系 还有原子核的重量
一个碳原子 原子核只有这么大的(体积和重量) 最外层电子有4个 那么在对于这个碳原子来说它只能够有那么大的力量来吸引电子 或者说其它原子的化合
就拿甲烷来说 它的碳氢键是比较近的 这是相对于乙炔 来说为什么呢 是因为原子核的体积和重量还有“力”来说的.你可以发挥想象力 希望你能够很好的理解化学键
对了未来的科技——— 物理---->化学---->生物科技1年前查看全部
- 请问如何判定某化合物的杂化轨道?比如NO3-.还有s和p到底是什么.
 孙小方1年前2
孙小方1年前2 -
 东湖风 共回答了24个问题
东湖风 共回答了24个问题 |采纳率95.8%呃.这个讲复杂了就讲不完了.
s和p是轨道啊.简单说来,一个电子层中能量最低的轨道是s(1个)接下来是p(3个)d(5个)f(7个)
这个对电子层排布有影响,比如钠
(1s)2 (2s)2 (2p)6 (3s)1
电子先填充了能量较低的s轨道~
至于判断嘛~要先用VSEPR理论的~(不知道就自己去百度下吧~这个有点多~)
比如NO3-,N最外层6个电子~就是平面三角形~
于是就是sp2杂化啦~1年前查看全部
- 一.单选题1.CH4分子中C采取的是()杂化.A.SPB.SP2C.SP3D.以上均不是2.若过程改为液态H2O在100
一.单选题
1.CH4分子中C采取的是()杂化.
A.SP
B.SP2
C.SP3
D.以上均不是
2.若过程改为液态H2O在100℃、1.013 ´ 10^(5) Pa下蒸发,W、Q、ΔU、ΔH、ΔS和ΔG热力学数据中为零的是()
A.W
B.Q
C.△G
D.△H
3.H2S的沸点低于H2O的原因是()
A分子间力
B氢键
C范德华力
D共价键
4.对于N2+3H2=2NH3+Q是使用催化剂的可逆反应,生产中的温度()
A.越低越好
B.越高越好
C.在催化剂使用范围内适当低些
D.以上都可以
5.关于下列元素第一电离能的大小的判断,正确的是()
N>O
C>N
B>C
B>Be
6.某体系在失去15 kJ热给环境后,体系的内能增加了5 kJ,则体系对环境所作的功是()
A.20kJ
B.10kJ
C.10kJ
D.20kJ
7.下列物质中何者具有T型结构?()
A.BCl3
B.PH3
C.NO3^(-)
D.ClF3
8.核外某电子的主量子数n=4,它的角量子数l可能的取值有()
A.1
B.2
C.3
D.4
二.多选题
1.能够发生有效碰撞的条件是()
A恰当取向
B分子数足够多
C足够能量
D以上三个都是
2.四种分子和离子中:既是Bronsted酸又是Bronsted碱的是()
A.NH3
B.Cu^(2+)
C.Cl^(-)
D.HCO3^(-)
3.四种分子和离子中:既是Lewis碱又是Bronsted碱的是()
A.NH3
B.Cu^(2+)
C.Cl^(-)
D.HCO4^(-)
4.分子间作用力包括
A.色散力
B.取向力
C.诱导力
D.范德华力
5.离子键的主要特征是()
A.方向性
B.没有方向性
C.饱和性
D.没有饱和性
6.价键理论的要点是()
A.电子配对原理
B.最大重叠原理
C.泡利不相容原理
D.价层电子对互斥理论
7.稀溶液的“依数性”包括()
A蒸汽压
B沸点
C渗透压
D凝固点
8.共价键的参数有哪些?()
A键长
B键能
C键角
D键的极性
9.下面所给定几种溶剂中,呈酸性的是()
ANaCN
BNaH2PO4
CNH4AC
DHAC
10.按照分散系中分散相粒子的大小可以将分散系分为()
A粗分散系
B胶体分散系
C分子分散系
D原子分散系
三.判断题
请回答:A.正确 或者 B.错误
1.稀释HAC溶液后,电离度增大,酸性增大.
2.共价键的极性与成键两原子的电负性差有关,电负性越小,共价键的极性就越大
3.比较下列元素的电负性的大小:O 197812681年前1
197812681年前1 -
 米米哝 共回答了26个问题
米米哝 共回答了26个问题 |采纳率80.8%CDBCAB(+10kJ)DD
AC
AD
AC
ABC
BC
AB
BCD
ABC
BD
ABC
错错错对对
错(是铜的话是对)错对对错
错对错错错
错对对1年前查看全部
- 什么情况下原子轨道会发生杂化
 gggg1年前2
gggg1年前2 -
 野非 共回答了19个问题
野非 共回答了19个问题 |采纳率78.9%一般原子形成分子时都要杂化,要么sp3、sp2或sp.1年前查看全部
- 杂化轨道的判断怎么确定中心原子的孤电子对数,c原子的孤电子对数应该是1个 为什么co2中c的孤电子对数是0 怎么确定啊
 向右左拐1年前2
向右左拐1年前2 -
 禾木123 共回答了26个问题
禾木123 共回答了26个问题 |采纳率96.2%有个算孤电子对的公式啊,co2就是1/2(4-2*2)=0了.1年前查看全部
- 书上说N经SP3杂化后,其中1个杂化轨道由一孤对电子占据,这句话是不是指N经SP3后形成的化合物中N上的SP3轨道总有一
书上说N经SP3杂化后,其中1个杂化轨道由一孤对电子占据,这句话是不是指N经SP3后形成的化合物中N上的SP3轨道总有一个要被孤对电子占据呢?氧也一样吗?
 快乐伙伴1年前2
快乐伙伴1年前2 -
 不要太夸张 共回答了16个问题
不要太夸张 共回答了16个问题 |采纳率100%不是的,要看情况
比如 NH4+ 这个离子中N是sp3 杂化,但是没有N没有孤对电子
而NH3 这个分子中 N也是 sp3杂化,N有一对孤对电子.
O一般是形成2个键 ,因此O为中心原子的时候,O通常有2 对孤对电子,比如 H2O中 O为 sp3杂化,O就有2对孤对电子
凡是sp3杂化的原子要是形成4个键了,比如和4个原子相连,那么它就没有孤对电子了,反之就有孤对电子.1年前查看全部
- hcooh分子为什么是平面结构,用碳原子杂化轨道加以解释
 rexl1年前2
rexl1年前2 -
 zxcvb0987 共回答了22个问题
zxcvb0987 共回答了22个问题 |采纳率95.5%HCOOH
H-C-O-H
.||
.O
碳原子是sp2杂化,是平面三角形结构,所以与碳原子相连的三个原子以及碳原子共面.
而羟基氧其实也是sp2杂化,另外一个p轨道和碳氧双键的π键形成p-π共轭
所以甲酸五个原子共面1年前查看全部
- 高中化学-选修5《结构化学》杂化轨道类型判断公式
高中化学-选修5《结构化学》杂化轨道类型判断公式
就是怎么判断 是sp杂化、sp2杂化、sp3杂化、 阿里巴巴811年前2
阿里巴巴811年前2 -
 甜菜CJ 共回答了12个问题
甜菜CJ 共回答了12个问题 |采纳率100%首先要确定分子的空间构型.然后就能判断.具体是:
直线型:sp杂化
平面三角型:sp2杂化
四面体型:sp3杂化1年前查看全部
- 碳原子SP杂化的问题(追分)急!
碳原子SP杂化的问题(追分)急!
当碳原子跟4个氢原子形成甲烷时.碳原子的1个2S轨道和3个2P轨道会发生混杂.得到4个相同轨道.那问题来了.那1个碳原子何来3个2P轨道?它不是只有1个2P轨道吗?
那是不是碳只有2个电子占P轨道.P轨道也分PX.PY.PZ的吗?就是说不是6个电子占P轨道也会出现PX.PY.PZ的吧? 龙-五1年前7
龙-五1年前7 -
 ruotongbb 共回答了23个问题
ruotongbb 共回答了23个问题 |采纳率91.3%是本来有1个2S 轨道,2个2P 轨道.1S2 2S2 2P2
但是,2S轨道上有1个电子激发到了 空着的 2P 轨道上,这样,2S 轨道只有1个电子,2P轨道有了3个电子.
然后,那个2S轨道假如和3个P轨道杂化,就成了 SP3 杂化,
若2S轨道和2个P轨道杂化,就成了 SP2 杂化,(还多一个P轨道去形成 "怕哎"键,就有了碳碳双键)
若2S轨道1个P轨道杂化,就成了 SP 杂化,(还多2个P轨道去形成 "怕哎"键,就有了碳碳叁键)
补充问题的回答: 激发后, 碳有3个电子占P轨道1年前查看全部
- 化学中的轨道杂化是怎么回事,简略
 新的约定1年前3
新的约定1年前3 -
 花臧 共回答了11个问题
花臧 共回答了11个问题 |采纳率81.8%杂化,是原子形成分子过程中的理论解释,具体有sp(如BeCl2)、sp2(如BF3)、sp3(如CH4)、sp3d(如PCl5)、sp3d2(如 SF6) 杂化等等.
杂化轨道理论的要点:
在成键过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新的原子轨道,这种轨道重新组合的过程称为杂化(hybridization),杂化后形成的新轨道称为 杂化轨道(hybrid orbital).
杂化的类型:
等性杂化:全部由成单电子的轨道参与的杂化叫做等性杂化.
不等性杂化:有孤对电子轨道参与的杂化叫做不等性杂化.
杂化轨道的类型取决于原子所具有的价层轨道的种类和数目以及成键数目等.常见的有:
sp杂化:sp杂化是指由原子的一个ns和一个np轨道杂化形成两个sp杂化轨道,每个sp杂化轨道各含有1/2s成分和1/2p成分,两个轨道的伸展方向恰好相反,互成180度夹角,形成σ键.
sp2杂化:原子以一个ns和两个np轨道杂化,形成三个能量相同sp2杂化轨道,每个杂化轨道各含1/3s成分和2/3p成分.三个杂化轨道间的夹角为120度.
sp3杂化:由一个ns和三个np轨道杂化形成四个能量等同的sp3杂化轨道.每个sp3轨道都含有1/4s成分和3/4p成分.
另外,从化学式是看不出杂化类型的,要根据以上的原理分析原子层的电子数来判断杂化类型,实在不行就死机硬背,就那几个典型的杂化化学式1年前查看全部
- 如何判断原子的杂化轨道类型?例如给你C2H2,怎么判断C原子的杂化轨道类型属于sp1杂化的?
如何判断原子的杂化轨道类型?例如给你C2H2,怎么判断C原子的杂化轨道类型属于sp1杂化的?
为什么C6H6的杂化轨道类型是sp2?一定要知道空间分子结构吗?还是可以通过计算得来的?如何计算呢? 逍菩1年前1
逍菩1年前1 -
 田鸡变王子 共回答了17个问题
田鸡变王子 共回答了17个问题 |采纳率88.2%如果一个粒子可以写成ABmEn的形式(A,B是不同元素,E是孤对电子,m,n分别是B和E的数量),那麼通过计算m+n的值可以判断是什麽杂化.
n=1/2*(中心原子的价电子数-粒子所带电荷数的代数值-m*B原子达到最外层稳定结构所需要的电子数).出现小数则进位.
当m+n=2,是sp杂化,=3是sp2,=4是sp3,=5是sp3d,=6是sp3d2,一般常见的就是2,3,4,5,6这几个数字了.
比如CO32-,中心原子C价电子数是4,带2个单位负电荷,O原子达到最外层稳定结构需要2个电子.那麼:
n=1/2(4-(-2)-3*2)=0,m+n=3,所以是sp2杂化.
又比如NO2,N价电子是5,O需要2个电子,n=1/2(5-2*2)=0.5进位取1,m+n=3所以也是sp2杂化.1年前查看全部
- 为什么原子杂化轨道数不变根据图像 轨道明明多了一个啊
为什么原子杂化轨道数不变
根据图像 轨道明明多了一个啊
 beijingjacky1年前2
beijingjacky1年前2 -
 云奚若 共回答了15个问题
云奚若 共回答了15个问题 |采纳率93.3%轨道杂化本来轨道总数不变的,但一般的如果没看杂化,那么一般是p 轨道成键,而杂化后,s 轨道杂化后也能成键,所以楼主觉得多了一个轨道1年前查看全部
- 2009年广东高考题27题(3)硫酸铜晶体中氧是什么杂化
2009年广东高考题27题(3)硫酸铜晶体中氧是什么杂化
27.铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(3)胆矾CuSO4·5H2O可写成[Cu(H2O4)]SO4 ·H2O,其结构示意图如下:
下列说法正确的是__________(填字母).
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(3)B、D
请问硫酸根的氧是什么杂化?我只会中心原子硫的杂化,水中氧的杂化,硫酸根的氧是什么杂化不知道,请讲的详细些, 长歌采薇9451年前1
长歌采薇9451年前1 -
 yxb5372 共回答了11个问题
yxb5372 共回答了11个问题 |采纳率81.8%水中的氧原子都是sp3杂化,硫酸根中的O是周围原子,周围原子不讨论杂化方式.
水分子和铜原子之间是配位键,水中氢原子与氧原子之间是共价键,硫酸根与铜原子之间是离子键,所以B对.
有离子键当然是离子晶体,图中虚线表示就是氢键,所以C选项的前半句是错的;后半句正确.
晶体中有两种水:一种水与周围原子之间只有氢键,另外一种水与铜原子之间还有配位键(箭头所指就是配位键),既然水与周围分子间作用力不同,作用力的大小当然也不同,所以会分步失去,D对.1年前查看全部
- 为什么SOCl2既可以作Lewis酸,又可以作Lewis碱?在SeOCl2Py2中Se原子采取什么杂化类型,说明Se与每
为什么SOCl2既可以作Lewis酸,又可以作Lewis碱?在SeOCl2Py2中Se原子采取什么杂化类型,说明Se与每个配位原子的成键类型,并画出该分子所有可能的几何构型.(
 szwy6281年前1
szwy6281年前1 -
 才女人生 共回答了20个问题
才女人生 共回答了20个问题 |采纳率95%因为氧的孤对可以给出,是lewis碱,硫显正价,可以接受电子是lewis酸1年前查看全部
- 为什么[Ti(H2O)6]3+ 杂化方式是d2sp3,这样3d不是有两个轨道空着了吗?
为什么[Ti(H2O)6]3+ 杂化方式是d2sp3,这样3d不是有两个轨道空着了吗?
那为什么不可以是sp3d2呢? yinuo6661年前1
yinuo6661年前1 -
 灰色的思念 共回答了18个问题
灰色的思念 共回答了18个问题 |采纳率100%Ti的电子排布为[Ar]3d24s2,带三个单位正电荷的话,d轨道上只有一个电子.两个空的3d轨道和1个空的4s轨道、3个空的4p轨道杂化成为6个d2sp3轨道.
一般来说,六配位的配合物的中心离子都是d2sp3杂化,因为这样的杂化轨道分布是正八面体型的.
3d轨道比4d轨道能量低,根据能量最低原理,先用3d轨道杂化成键.1年前查看全部
- 诱导效应会改变阿尔法,贝塔碳上的杂化方式吗?
诱导效应会改变阿尔法,贝塔碳上的杂化方式吗?
我是说出现不等性杂化,并不是彻底改变杂化方式…… yun3781年前2
yun3781年前2 -
 老麦牛奶 共回答了24个问题
老麦牛奶 共回答了24个问题 |采纳率95.8%当然会了,有可能会在瞬间造成sp3到sp2的改变噢~(当然了,得有前提条件)说实话,就算是乙烷,它们之间的碳碳键都和碳氢键是有区别的,只不过有机化学都是以杂化和HMO法为主,杂化的处理方式就是定域轨道,不是很考虑周围原子对轨道的影响,但是要考虑对轨道内电子的影响噢~1年前查看全部
- 任何情况下 轨道都能发生杂化吗?
 guanxing821年前2
guanxing821年前2 -
 海盗9i0 共回答了18个问题
海盗9i0 共回答了18个问题 |采纳率83.3%杂化理论是微粒解释分子构型而提出的,有中心原子的分子可以适用杂化理论,如水的中心原子是氧原子.双原子分子一定是直线形的,不用杂化理论.1年前查看全部
大家在问
- 1同学们招待客人.
- 2细菌的生存需要许多条件,如需要什么?适宜的什么?还有什么?
- 3两平面相互垂直,是不是两平面内的直线要么垂直要么平行?
- 4质量守恒定律练习题(初三的),各位高手快请帮帮忙啊
- 5人体内有了蛋白质就会产生酶吗
- 6Aithough he failed,he has done his___(well)
- 7有一次,甲乙丙三位朋友合乘一辆出租车,讲好大家平摊车费,甲行全程的3分之1处下车,到了全程的3分之2处乙下车,最后丙1人
- 8为什么H2+中,反键轨道与原来的原子轨道能量差大于成键轨道与原来原子轨道能量差
- 92x+3分之x=14这个式子中的x等于几?
- 10to express one's pleasure for sb's success这句话什么意思啊?
- 11“荣誉”的英文简写只要3个单词的简写形式
- 12有一天几个盗贼商议怎样分配偷来的布匹,若每人6匹剩5匹,若每人7匹少8匹,请问共有几个盗贼,几匹布?
- 13盗贼瓜分一批赃物,若每人分4匹,则布匹剩20匹,若每人分8匹,则有一人得到但少几匹,盗贼,布匹各多
- 14怎么判断通电圆环的磁感线方向
- 15英语翻译即的歌词The Frozen World Won't you open for me The door to y
