将25℃101KPa条件下的氯化氢(HCl)气体49.6L,通入492mL水中,(已知水的密度为:1.00g/mL),得
 duduwangwang2022-10-04 11:39:541条回答
duduwangwang2022-10-04 11:39:541条回答(1)求此盐酸的质量分数?
(2)求此盐酸的物质的量浓度?
(3)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?

已提交,审核后显示!提交回复
共1条回复
 wth3166 共回答了15个问题
wth3166 共回答了15个问题 |采纳率93.3%- 解题思路:(1)盐酸的质量分数=[氯化氢质量/溶液总质量]×100%来计算;
(2)根据公式c=[1000ρw%/M]来计算;
(3)溶液稀释前后溶质的物质的量保持不变.(1)25℃101KPa条件下的氯化氢(HCl)气体49.6L的物质的量是[49.6L/24.8L/mol]=0.2mol,通入492mL水中,积水的质量是492g,此盐酸的质量分数=[2mol×36.5g/mol/2mol×36.5g/mol+492g]×100%≈12.9%,答:此盐酸的质量分数是12.9%;
(2)此盐酸的物质的量浓度c=[1000ρw%/M]=[1000×1.13×12.9%/36.5]mol/L≈4.0mol/L,答:此盐酸的物质的量浓度是4.0mol/L;
(3)设稀释后溶液的体积是V毫升,则4.0mol/L×20.0 mL=VmL×1.00 mol/L,解得V=80mL,答:稀释后溶液的体积是80毫升.点评:
本题考点: 溶液中溶质的质量分数及相关计算.
考点点评: 本题考查学生溶液中溶质的质量分数以及物质的量浓度等相关计算问题,可以根据所学知识进行回答,难度不大. - 1年前
相关推荐
- 25℃ 101kPa时:H2(g)+1/2O2(g)===H2O(g);△H=-241.8 kJ/mol.则下列说法或表
25℃ 101kPa时:H2(g)+1/2O2(g)===H2O(g);△H=-241.8 kJ/mol.则下列说法或表达正确的是?
A.H2的燃烧值为241.8kJ/mol
B.H2(g)+1/2O2(g)===H2O(l);△H-241.8kJ/mol
D.1mol H2 与 1/2mol O2的总能量小于H2O(g)的总能量 shanghua1001年前2
shanghua1001年前2 -
 酒鬼花生米 共回答了23个问题
酒鬼花生米 共回答了23个问题 |采纳率95.7%A错,因为H2O(g),没有达到稳定状态.所以H2的燃烧值大于241.8kJ/mol
B正确 因为H2O(g)====H2O(L) 要放出热量,所以数值大过241.8kJ/mol,加多了-号,所以△H1年前查看全部
- 气体溶解度与压强的关系初三(九年级) 书上说 溶解度是气体在101KPA时 某种温度下溶解的体积 非标准状况下的体积要转
气体溶解度与压强的关系
初三(九年级) 书上说 溶解度是气体在101KPA时 某种温度下溶解的体积 非标准状况下的体积要转化成标准状况计算 是不是说只有在一标准大气压下溶解的气体才叫溶解度啊 我是这么理解的 但是好像不对 能否给解释则个?、 橙草1年前1
橙草1年前1 -
 小宝弟弟 共回答了20个问题
小宝弟弟 共回答了20个问题 |采纳率95%气体的溶解度,受到温度和压强的影响,温度越高,溶解度越小;压强越大,溶解度越大.一般定义气体的溶解度时,是规定在 101kPa 下的数据,如果不是这个压强,溶解度数据肯定要变化的1年前查看全部
- 下列说法正确的是 A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 B.酸和碱发生中和反应生
下列说法正确的是
A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 C.燃烧热或中和热是反应热的种类之一 D.在稀溶液中,1molCH 3 COOH和1mol NaOH完全中和时放出的热量为57.3kJ  a_wei781年前1
a_wei781年前1 -
 huidukongjian 共回答了17个问题
huidukongjian 共回答了17个问题 |采纳率100%C
本题旨在考查对燃烧热、中和热的定义的理解,特别是两概念中应注意的问题1年前查看全部
- 在标准状况(273K、101KPa)下……
在标准状况(273K、101KPa)下……
是表示273千、101千帕的意思?273K或101K都是标准状况? wujinhenry1年前4
wujinhenry1年前4 -
 wangpanluanli 共回答了22个问题
wangpanluanli 共回答了22个问题 |采纳率77.3%273k就是温度为零度
k是开氏温度
度是摄氏度
101kpa指的是标准大气压
273K或101K都是标准状况?还要要指定标准大气压的.1年前查看全部
- 在25摄氏度,101kPa条件下,将20L O2通入10L CH4和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温
在25摄氏度,101kPa条件下,将20L O2通入10L CH4和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
(1)若剩余气体的体积是12L,则原CH4和H2的混合气中
V(CH4)=_____L,V(H2)=_____L.
(2) 若剩余气体的体积为aL,则原CH4和H2的混合气中
V(CH4):V(H2)=_____. lemon601年前1
lemon601年前1 -
 zp555 共回答了17个问题
zp555 共回答了17个问题 |采纳率94.1%(1)设CH4和H2的体积分别为X、Y
CH4 + 2O2 =点燃= CO2 + 2H2O △V减少体积
1 2 1 2
X 2X X 2X
2H2 + O2 =点燃= 2H2O △V减少体积
2 1 3
Y 0.5Y 1.5Y
X+Y=10L
2X+1.5Y=20L+10L-12L=18L
解得X=6L
Y=4L
(2)设CH4和H2的体积分别为X、Y
CH4 + 2O2 =点燃= CO2 + 2H2O △V减少体积
1 2 1 2
X 2X X 2X
2H2 + O2 =点燃= 2H2O △V减少体积
2 1 3
Y 0.5Y 1.5Y
X+Y=10L
2X+1.5Y=20L+10L-aL=30L-aL
X=30-2a
Y=2a-20
X:Y=(30-2a):(2a-20)=(15-a):(a-10)
希望我的回答能对你的学习有帮助!1年前查看全部
- 已知反应:①101kPa时,2H2 (g)+O2(g)═2H2O(g);△H=-484kJ•mol-1
已知反应:①101kPa时,2H2 (g)+O2(g)═2H2O(g);△H=-484kJ•mol-1
②稀溶液中,H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1
下列结论正确的是( )
A.氢气的燃烧热大于242kJ•mol-1
B.①的反应热为484kJ•mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.31kJ•mol-1
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 aris_z1年前1
aris_z1年前1 -
 三千烦恼随风飘 共回答了16个问题
三千烦恼随风飘 共回答了16个问题 |采纳率81.3%解题思路:A、物质的燃烧热是指完全燃烧1mol物质生成最稳定的产物过程所放出的热量;
B、反应①为放热反应,△H<0;
C、稀硫酸与稀NaOH溶液反应的中和热为△H=-57.31kJ•mol-1;
D、醋酸是弱酸电离吸热.A、由反应①可知,1mol氢气燃烧生成气态水放出的热量为242 kJ,气态水变为液态水要放热,故1mol氢气完全燃烧生成液态水放出的热量大于242 kJ,所以氢气的燃烧热大于242kJ•mol-1,故A正确;
B、反应①为放热反应,△H<0,所以①的反应热为-484kJ•mol-1,故B错误;
C、稀硫酸与稀NaOH溶液反应的中和热为57.31kJ•mol-1或△H=-57.31kJ•mol-1,故C错误;
D、醋酸是弱酸电离吸热,所以稀醋酸与稀NaOH溶液反应生成1mol水,放出热量小于57.3kJ,故D错误;
故选A.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.1年前查看全部
- 一般压力锅的压强是多少?一般的压力锅看到表明压强20-70KPa,可是一个大气压还101KPa,这是为什么,求换算公式,
一般压力锅的压强是多少?
一般的压力锅看到表明压强20-70KPa,可是一个大气压还101KPa,这是为什么,求换算公式,我觉得压力锅应该有1.5-2个大气压 西风不语1年前1
西风不语1年前1 -
 cobralw 共回答了19个问题
cobralw 共回答了19个问题 |采纳率73.7%高压锅内的压强要看气孔的直径和限压阀的质量,若气孔直径3mm,限压阀的质量100g,则 限压阀产生的压强 P=mg/S=0.1*10/(3.14*0.003^2/4)=141542.82 Pa
内部水蒸气的最大压强 P1=P+P0=141542.82 +1.0x10^5= 241542.82 Pa,相当于大气压的2.4154282倍 .此时高压锅内水的沸点125.7摄氏度.1年前查看全部
- 在400℃、101kPa时,3L某烃A在mL氧气中完全燃烧,燃烧后测得气体体积为
在400℃、101kPa时,3L某烃A在mL氧气中完全燃烧,燃烧后测得气体体积为
(m+6)L(气体体积均在同温同压下测定),则:
(1)烃A应满足的条件是?
(2)当m=21时,烃A可能的分子式有?
(3)若烃A在常温下为气态物质,求m的取值范围. 昏迷中1年前1
昏迷中1年前1 -
 xn_hld 共回答了17个问题
xn_hld 共回答了17个问题 |采纳率94.1%注意400度,生成的H2O是气体
设烃为CxHy
CxHy + (x+y/4)O2 = xCO2 + y/2H2O----体积增加
1---------(x+y/4)--------------------(x+y/2-1-x-y/4)
3---------m过量-----------------------------3
解得,y=8
(1)烃A应满足的条件是?----H原子数是8
(2)当m=21时,烃A可能的分子式有?
此时要保证O2还是过量的
同时,由于H原子数是8,则C原子数最小为3,否则不能结合那么多的H
m/(x+y/4) > 3
21/(x+y/4) >3
即,x < 5
可能分子式是,C3H8、C4H8
(3)若烃A在常温下为气态物质,求m的取值范围.
保证,x < 5
即,x最小为3,最大为4
代入,即,m/(x+y/4) > 3
得到,m大于等于181年前查看全部
- 气体摩尔体积的计算120摄氏度,101kpa时的气体摩尔质量
 敏敏娃娃1年前1
敏敏娃娃1年前1 -
 第814次求婚 共回答了16个问题
第814次求婚 共回答了16个问题 |采纳率100%V=22.4*393/273=32.2L1年前查看全部
- 已知反应:①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol
已知反应:①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.
下列结论正确的是( )
A. 碳的燃烧热小于110.5 kJ/mol
B. ①的反应热为221 kJ/mol
C. 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ 六月迷鹿1年前1
六月迷鹿1年前1 -
 youshuo_lcd 共回答了16个问题
youshuo_lcd 共回答了16个问题 |采纳率93.8%解题思路:A、CO燃烧生成二氧化碳继续放出热量;
B、反应热包含符号,①的反应热为-221 kJ•mol-1;
C、根据中和热的概念分析;
D、醋酸是弱电解质,电离需吸收热量.A、由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,故A错误;
B、反应热包含符号,①的反应热为-221 kJ•mol-1,故B错误;
C、中和热是稀溶液中强酸和强碱反应生成1mol水放出的热量,△H=-57.3 kJ/mol,所以稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol,故C错误;
D、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D正确;
故选:D.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.1年前查看全部
- 在101kPa和25°C时,有关反应的热化学方程式如下:
在101kPa和25°C时,有关反应的热化学方程式如下:
C(s)+1/2 O 2 (g)=CO(g) △H 1 = -110.5KJ/mol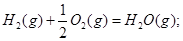
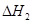 =
=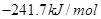
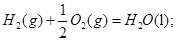
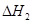 =
=
下列说法正确的是()A. 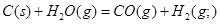 ;
;
B. 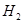 燃烧热的化学方程式为:
燃烧热的化学方程式为: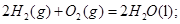
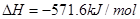
C. 
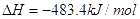
D. 
 tivy_sea1年前1
tivy_sea1年前1 -
 乡村假日 共回答了11个问题
乡村假日 共回答了11个问题 |采纳率100%1年前查看全部
- 25℃101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.
25℃101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( ) A.2H + (aq)+SO 4 2- (aq)+Ba 2+ (aq)+2OH - (aq)=BaSO 4 (s)+2H 2 O(l)△H=-57.3 kJ/mol B.C 8 H 18 (l)+
O 2 (g)=8CO 2 (g)+9H 2 O(g)△H=-5518 kJ/mol25 2 C.KOH(aq)+
H 2 SO 4 (aq)=1 2
K 2 SO 4 (aq)+H 2 O(l)△H=-57.3 kJ/mol1 2 D.2C 8 H 18 (g)+25O 2 (g)═16CO 2 (g)+18H 2 O(l)△H=-5518 kJ/mol  pdslf1年前1
pdslf1年前1 -
 jieyong07 共回答了20个问题
jieyong07 共回答了20个问题 |采纳率90%A、反应热化学方程式中生成的是2mol水,生成硫酸钡沉淀也放热,反应的中和热不是57.3kJ/mol,故A错误;
B、反应热化学方程式中生成的水是气体,不是稳定氧化物,故B错误;
C、符合中和热的概念,故C正确;
D、热化学方程式中不是1mol物质燃烧,故D错误;
故选C.1年前查看全部
- 在25℃、101kPa的条件下,断裂1mol H-H键吸收436kJ 能量,断裂1mol
在25℃、101kPa的条件下,断裂1mol H-H键吸收436kJ 能量,断裂1mol Cl-Cl键吸收243kJ能量,形成1mol H-Cl键放出431kJ能量.H2+Cl2═2HCl的化学反应可用如图表示:
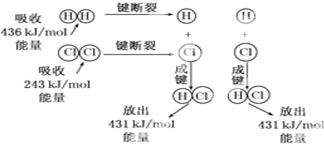
请回答下列有关问题:
(1)反应物断键吸收的总能量为______.
(2)生成物成键放出的总能量为______.
(3)判断H2+Cl2═2HCl是______(填“吸收”或“放出”)能量.
(4)反应物的总能量______(填“>”或“<”)生成物的总能量. su345201年前1
su345201年前1 -
 喀纳斯人 共回答了18个问题
喀纳斯人 共回答了18个问题 |采纳率88.9%解题思路:(1)反应物断键吸收的总能量为氢气和氯气的键能和;
(2)生成物成键放出的总能量为2molHCl的总键能;
(3)根据生成物的键能与反应物的键能的大小关系分析;
(4)根据生成物的键能与反应物的键能的大小关系分析.(1)反应物断键吸收的总能量为氢气和氯气的键能和,则反应物断键吸收的总能量为436+243=679KJ,故答案为:679KJ;
(2)生成物成键放出的总能量为2molHCl的总键能,则生成物成键放出的总能量为431×2=862KJ,故答案为:862KJ;
(3)反应热=生成物的键能减反应物的键能=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,△H<0,所以该反应为放热反应,故答案为:放出;
(4)由(3)可知△H<0,该反应为放热反应,所以反应物的总能量>生成物的总能量,故答案为:>.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查了化学反应与能量的变化,注意根据键能判断△H,难度不大,注意知识的积累.1年前查看全部
- 已知相同温度和压强下,气体的体积比等于气体的分子个数比.在20℃,101kPa条件下,将12L氧气 与8L一氧化
已知相同温度和压强下,气体的体积比等于气体的分子个数比.在20℃,101kPa条件下,将12L氧气 与8L一氧化
若剩余气体的体积为12L,则原混合气体中一氧化碳的体积为( )
若剩余气体的体积为VL,则原混合气体中一氧化碳和氢气的体积比为( )
若剩余气体的体积为VL,V的取值范围是( )
条件不完整 下面这个才完整:已知相同温度和压强下,气体的体积比等于气体的分子个数比。在20℃,101kPa条件下,将12L氧气 与8L一氧化碳与氢气的混合气相混合,使其完全燃烧后恢复到原来的压强和温度 偶像梁朝伟1年前3
偶像梁朝伟1年前3 -
 时光不再了 共回答了19个问题
时光不再了 共回答了19个问题 |采纳率100%2CO+O2=2CO2 2H2+O2=2H2O
由此可见,不论CO与H2的体积比是多少,混合气体反应消耗氧气的量是一定的,是4L,还有8L氧气过量.
第一问:剩余气体的体积为12L,其中8L是氧气,还有4L是二氧化碳,因为在20℃,101kPa条件下,水是液态.所以一氧化碳的体积为4L.
第二问:剩余气体的体积为VL,其中8L还是氧气,那么二氧化碳为(V-8)L,则混合气体中,一氧化碳体积为(V-8)L,氢气为(16-V)L.
第三问:要用到极限算法,假设混合气体全为一氧化碳,则反应生成8L二氧化碳,V=8+8=16;假设混合气体全为氢气,则反应生成水,V=8.V的取值范围是81年前查看全部
- 下表中列出了25℃、101kPa时一些物质的燃烧热数据
下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C-H键:413.4kJ/mol、H-H键:436.0kJ/mol.则下列叙述正确的是( )物质 CH4 C2H2 H2 燃烧热/kJ/mol 890.3 1299.6 285.8
A.C≡C键能为796.0 kJ/mol
B.2CH4(g)+2O2(g)═2H2O(l)△H=-890.3 kJ/mol
C.H2(g)+[1/2]O2(g)═H2O(g)△H=-285.8 kJ/mol
D.2CH4(g)═C2H2(g)+3H2(g)△H=-376.4 kJ/mol 1000lvy1年前1
1000lvy1年前1 -
 ronin05 共回答了15个问题
ronin05 共回答了15个问题 |采纳率93.3%解题思路:A.依据化学反应的焓变=反应物总键能-生成物的总键能;
B.燃烧热是1mol可燃物燃烧放出的热量;
C.燃烧热是指可燃物燃烧生成稳定的化合物时放出的热量,H生成液态水;
D.2CH4(g)═C2H2(g)+3H2(g)为吸热反应,△H>0.A.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H3=-890.3kJ/mol①,C2H2(g)+[5/2]O2(g)═2CO2(g)+H2O(l)△H=-1299.6 kJ/mol②,H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol③,依据②+③×3-①×2可得:C2H2(g)+3H2(g)═2CH4(g)△H=-376.4 kJ/mol,△H=反应物总键能-生成物总键能=C≡C键的键能+2×413.4kJ/mol+3×436.0kJ/mol-8×413.4kJ/mol=-376.4KJ/mol,则C≡C键的键能=796.0 kJ/mol,故A正确;
B.燃烧热是1mol可燃物燃烧放出的热量,B中△H=-890.3×2 kJ/mol,故B错误;
C.氢气燃烧热必须是生成液态水是放出的热量,故C错误;
D.由A可知:C2H2(g)+3H2(g)═2CH4(g)△H=-376.4 kJ/mol,则 2CH4(g)═C2H2(g)+3H2(g)△H=+376.4 kJ•mol-1,故D错误;
故选:A.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查了燃烧热的应用,掌握燃烧热的定义和盖斯定律的运用是解答本题的关键,题目难度中等.1年前查看全部
- 在300K和101kPa条件下,已知丁烷气中含有百分之一的硫化氢则硫化氢的分压为多少
 Nancy2201年前0
Nancy2201年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列有关说法正确的是( )A.25℃101kPa时,CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-Q
下列有关说法正确的是( )
A.25℃101kPa时,CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-Q kJ/mol,则甲烷的燃烧热为Q kJ/mol
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的△H<0
C.反应N2(g)+3H2(g)⇌2NH3(g)△H<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):
H2(g)+Cl2(g)=2HCl(g)△H1=-Q1 kJ/mol H2(g)+Br2(g)=2HBr(g)△H2=-Q2 kJ/mol则△H1<△H2 鸿运历1年前1
鸿运历1年前1 -
 飞翼炎 共回答了18个问题
飞翼炎 共回答了18个问题 |采纳率88.9%解题思路:A、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
B、根据反应可知△S>0,室温下不能自发进行,说明该反应的△H>0,;
C、升高温度,平衡向吸热的方向移动;
D、Cl的非金属性强,Cl-Cl键能较大,放出的热量更多,反应热有正负值.A、CH4的稳定氧化物是CO2(g)和H2O(l),故甲烷的燃烧热大于Q kJ/mol,故A错误;
B、CaCO3(s)═CaO(s)+CO2(g)气体的量增大,△S>0,因为室温下不能自发进行,说明该反应的△H>0,故B错误;
C、由于正反应方向为放热反应,升高温度,平衡向逆反应方向移动,H2的平衡转化率减小,故C错误;
D、Cl的非金属性强,Cl-Cl键能较大,放出的热量更多,所以△H1<△H2,故D正确.
故选:D.点评:
本题考点: 燃烧热;反应热的大小比较.
考点点评: 本题考查化学能与热能的转化,题目难度不大,易错点为A,注意比较反应热的角度,可从键能的角度比较.1年前查看全部
- 已知25℃、101kpa条件下:
已知25℃、101kpa条件下:
(1)4Al(s)+3O 2 (g)═2Al 2 O 3 (s);△H=-2834.9kJ•mol -1
(2)4Al(s)+2O 3 (g)═2Al 2 O 3 (s);△H=-3119.1KJ•mol -1
由此得出的结论正确的是( )A.3mol氧气生成2mol臭氧放出的热量284.2kJ B.等质量的O 2 比O 3 的能量高 C.O 3 比O 2 稳定,由O 2 变为O 3 的化学反应为放热反应 D.O 2 比O 3 稳定,由O 2 变为O 3 的化学反应为吸热反应  第296次求婚1年前1
第296次求婚1年前1 -
 szdl 共回答了18个问题
szdl 共回答了18个问题 |采纳率94.4%已知25℃、101kpa条件下:
(1)4AI(s)+30 2 (g)═2A1 2 0 3 (s);△H=-2834.9kJ•mol -1
(2)4A1(s)+20 3 (g)═2Al 2 O 3 (s);△H=-3119.1KJ•mol -1
根据盖斯定律(1)-(2)得到:30 2 (g)═20 3 (g)△H=-2834.9kJ•mol -1 -(-3119.1KJ•mol -1 )=284.1KJ/mol,
A、氧气转化为臭氧是吸热反应,3mol氧气生成2mol臭氧吸收的热量284.2kJ,故A错误;
B、等质量的O 2 比O 3 的能量低,故B错误;
C、由O 2 变为O 3 的化学反应为吸热反应,故C错误;
D、由O 2 变为O 3 的化学反应为放热反应,故D正确;
故选D.1年前查看全部
- 25℃和101kPa时,甲烷、丙炔(C3H4)和丙烯组成的混合烃10mL与50mL氧气混合,完全燃烧后,除去水蒸气,恢复
25℃和101kPa时,甲烷、丙炔(C3H4)和丙烯组成的混合烃10mL与50mL氧气混合,完全燃烧后,除去水蒸气,恢复到原来的温度和压强,气体总体积为37.5mL,原混合烃中丙烯的体积分数为( )
A.50%
B.25%
C.75%
D.12.5% 黑金战甲1年前1
黑金战甲1年前1 -
 raining1981123 共回答了13个问题
raining1981123 共回答了13个问题 |采纳率84.6%解题思路:发生反应有:CH4+2O2=CO2+2H2O,C3H4+4O2=3CO2+2H2O,C3H6+[9/2]O2=3CO2+3H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,CH4和丙炔(C3H4)反应后体积缩小的量是相同的,故可将两者看成是一种物质,设丙炔(C3H4)一共为xmL,C3H6为ymL,利用气体体积缩小了(10+50-37.5)mL=22.5mL及混合气体的体积来列等式计算出丙烯的体积,进而计算丙烯的体积分数.除去水蒸气,恢复到原来的温度和压强,则:
CH4+2O2=CO2+2H2O△V
121 2
C3H4+4O2=3CO2+2H2O△V
1432
C3H6+[9/2]O2=3CO2+3H2O△V
14.53 2.5
CH4和C3H4反应后体积缩小的量是相同的,故可将两者看成是一种物质,
设CH4和C3H4一共为xmL,C3H6为ymL,
则:总体积为:①x+y=10,气体体积减小为:②2x+2.5y=(10+50-37.5)mL=22.5mL
根据①②解得:x=5,y=5,
则原混合烃中丙烯的体积分数为:[5mL/10mL]×100%=50%,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算、化学方程式有关计算,题目难度中等,解答关键是根据方程式判断体积变化,把甲烷与丙炔看作一个组分,从而转化为两组分混合,注意差量法的应用.1年前查看全部
- 在101kpa.150°C的条件下,0.01mol某烷烃充分燃烧后,将生成的气体通过盛有足量浓硫酸的洗气瓶,浓硫酸增重1
在101kpa.150°C的条件下,0.01mol某烷烃充分燃烧后,将生成的气体通过盛有足量浓硫酸的洗气瓶,浓硫酸增重1.26g,然后再通过碱石灰,气体完全被吸收,碱石灰质量增重2.64g,1.求该烷烃的分子式,该烷烃有几种同分异构体,2.若该烷烃的一氯代物有2中同分异构体,写出该烷烃的结构简式并命名
 迷失的阳光1年前2
迷失的阳光1年前2 -
 allllallll 共回答了17个问题
allllallll 共回答了17个问题 |采纳率100%浓硫酸增重1.26g,也就是水,碱石灰增重2.64g,就是二氧化碳
也就是0.01mol'烷烃燃烧生成1.26g水和2.64g二氧化碳,从而可以知道烷烃化学式是C6H14 同分异构体是5种
2 烷烃是 2.3 甲基丁烷 结构式不好画1年前查看全部
- 在25℃,101kPa条件下,将15LO2通入10LCO和H2的混合气体,使其完全燃烧,干燥后,恢复到原来温度和压强.
在25℃,101kPa条件下,将15LO2通入10LCO和H2的混合气体,使其完全燃烧,干燥后,恢复到原来温度和压强.
剩余气体为aL,求a的取值范围 minmindong1年前1
minmindong1年前1 -
 krxtx 共回答了11个问题
krxtx 共回答了11个问题 |采纳率100%解决混合物问题的一个重要方法是极值法,对于本题来说,就是假设10L气体全部是CO算出一极值,全都是H2再算出一极值.
CO,H2均与O2按2:1反应,所以氧气过量.当10L气体全部是CO时,2CO + O2 = 2CO2,减少体积为参加反应的氧气体积,10L CO消耗5L O2,故a = 15+10-5=20L.当10L气体全部是H2时,2H2 + O2 = 2H2O,水为液态,减少体积为参加反应的氢气和氧气体积,故减少15升,余10升,a=10L.
所以答案为10<a<20(不能等于,等于就不是混合气体了)1年前查看全部
- 在120C°,101KPA 的甲烷和过量的O2的混合物,用电火花引燃{CH4+2O2=CO2+2H2O}.恢复到原来温度
在120C°,101KPA 的甲烷和过量的O2的混合物,用电火花引燃{CH4+2O2=CO2+2H2O}.恢复到原来温度和压强后
测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比是:
A.2:1 B.1:2 C.1:7 D.7:1 仿佛刹那成佛1年前3
仿佛刹那成佛1年前3 -
 raykee 共回答了27个问题
raykee 共回答了27个问题 |采纳率92.6%气体密度为H2 15倍说明平均相对分子量是30
反应中左右系数和相同,则气体mol数无变化,则相对分子量也无变化.
所以用甲烷与氧气做十字相乘
CH4:16 2
30
O2 :32 4
所以是B.1:21年前查看全部
- 通常状况下,①水是一种没有颜色、没有气味、没有味道的透明液体,②在101KPa,4℃时水的密度最大,约为1g?cm-3.
通常状况下,①水是一种没有颜色、没有气味、没有味道的透明液体,②在101KPa,4℃时水的密度最大,约为1g?cm-3.③在此压强下,将水加热到100℃就可以使其变成水蒸气.④在通电的条件下,水能分解出氢气和氧气.⑤水是一种宝贵的自然资源.
请回答下列问题:
(1)水的物理性质有:______;
(2)水的化学性质有:______;
(3)上述叙述中的物理变化是______.
 锐锐乖1年前1
锐锐乖1年前1 -
 小顾的伤疤 共回答了23个问题
小顾的伤疤 共回答了23个问题 |采纳率95.7%(1)①水是一种没有颜色、没有气味、没有味道的透明液体,②在101KPa,4℃时水的密度最大,约为1g?cm-3.这些性质不需要通过化学变化表现出来,属于水的物理性质.故填:①②.
(2)④在通电的条件下,水能分解出氢气和氧气需要通过化学变化表现出来,属于水的化学性质.故填:④
(3)③在此压强下,将水加热到100℃就可以使其变成水蒸气,变化过程中没有新物质生成,属于物理变化.故填:③.1年前查看全部
- 为什么干冰在0度,101kPa是气体,不是固体?
 jamie_zsj1年前1
jamie_zsj1年前1 -
 exiula 共回答了15个问题
exiula 共回答了15个问题 |采纳率93.3%这是物质特性,没法解释
101kPa就是标准大气压
干冰就是co2
沸点-78.5℃(升华)1年前查看全部
- 在25摄氏度、101kPa时,甲烷、乙炔和乙烯组成的混合烃32mL,与过量氧气混合并完全燃
在25摄氏度、101kPa时,甲烷、乙炔和乙烯组成的混合烃32mL,与过量氧气混合并完全燃
与过量氧气混合并完全燃烧,恢复到原来的温度和压强,气体总体积缩小56ml,原混合烃中乙炔的体积分数为
速求 秋之梦_zy1年前1
秋之梦_zy1年前1 -
 zooneer 共回答了24个问题
zooneer 共回答了24个问题 |采纳率95.8%列出燃烧反应方程式就一目了然,50%1年前查看全部
- 在25摄氏度,101KPa条件下,将15L O2通入10LCO和H2的混合气体中,使其完全燃烧,恢复至原来的温度和压强
在25摄氏度,101KPa条件下,将15L O2通入10LCO和H2的混合气体中,使其完全燃烧,恢复至原来的温度和压强
(1)若剩余气体体积是15L,则原来的混合气体中CO,H2的体积分别是多少
(2)若剩余气体体积是aL,则CO,H2的体积比为多少
(3)若剩余气体体积是aL,则a的取值范围是什么
要分析过程,到晚上9点30, shuang4567891年前2
shuang4567891年前2 -
 shhbjcom 共回答了21个问题
shhbjcom 共回答了21个问题 |采纳率100%首先要知道,同温同压下,气体的体体积比即为物质的量之比(这是由气体的状态方式来的,pv=nRT)
两种气体与氧气的反应为:
2CO + O2 = 2CO2
2H2 + O2 = 2H2O
1.根据上面的反应定量关系可知5L的氧气可以与10L的CO和H2混合气刚好完全反应.则知道,燃烧后的气体中有15-5=10L氧气未参加反应.
CO反应后生成同样体积的CO2;H2反应后生成同样体积的H2O
设原来的混合气中有xL的CO,有(10-x)L的H2,则反应后生成的CO体积是xL,因为生成的H2O被干燥掉了,则剩余的气体体积复原后体积15=10(未参加反应的氧气)+x(CO2的体积)
得出CO2的体积是x=5L
则原混合气中的CO为5L,H2为10-5=5L
2.若剩余气体体积为aL,则根据1中的假设,得到:
a=10(未反应的氧气) +x(生成的CO2)
得出生成的CO2的体积为x=(a-10)L
即原混合气中含CO的体积为(a-10)L;H2的体积为10-(a-10)=20-aL
原来的混合气中的CO和H2的体积比为(a-10):(20-a)
3.a的取值为(a-10)>0 且 (20-a)>0 即 大于10小于201年前查看全部
- 在25℃、101kPa条件下,将15L氧气通入10L一氧化碳和氢气的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和
在25℃、101kPa条件下,将15L氧气通入10L一氧化碳和氢气的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
若剩余气体的体积为aL,则原CO和H2的混合气体中,V(CO):V(H2)=____,并求出a的取值范围 ningyifei5581年前2
ningyifei5581年前2 -
 9004769 共回答了18个问题
9004769 共回答了18个问题 |采纳率83.3%2CO+O2=2CO2 体积减少1
2H2+O2=2H2O 体积减少3
H2和CO的耗氧量相等都是1个消耗0.5个,
所以10LCO和H2混合物消耗O2为5L,所以剩余O2为10L.
反应后CO2(a-10)L,则CO为(a-10)L.体积减少(a-10)/2 L.
气体总减少量为(25-a)L
所以H2反应的减少量为(25-a)-(a-10)/2=(30-3a/2)L所以H2的体积为:
2/3*[(30-3a/2)]=20-a所以V(CO):V(H2)=(a-10):(20-a).
a-10>0所以a>10;
20-a1年前查看全部
- 在500℃、101KPa条件下,发生如下反应:N2(g)+3H2(g)=2NH3(g);△H=-Qkj/m
在500℃、101KPa条件下,发生如下反应:N2(g)+3H2(g)=2NH3(g);△H=-Qkj/m
在500℃、101KPa条件下,发生如下反应:N2(g)+3H2(g)=2NH3(g);△H=-Qkj/mol(Q>0).将amolN2与bmolH2充入一容积可变的密闭容器中,达到平衡时NH3的体积分数为40%
(1)若温度和压强保持不变,平衡时密闭容器的体积与起始体积之比为---------------
(2)平衡时放出的热量为-----------------kj 利矛1年前1
利矛1年前1 -
 旋转的雪花 共回答了13个问题
旋转的雪花 共回答了13个问题 |采纳率100%N2(g)+3H2(g)=2NH3(g)
a b 0
x 3x 2x
a-x b-3x 2x
2x:(a-x+b-3x)=40%推出a+b=7x
(1)平衡体积与起始体积之比:(a-x+b-3x+2x):(a+b) =5x:7x=5:7
(2)生成2molNH3的热效应是Q,现在生成了2xmol,即2(a+b)/7mol,所以平衡时放出的热量为(a+b)Q/71年前查看全部
- 温度为273k,压强高于101kpa时,气体摩尔体积小于22.4升每摩尔这句话对吗
 觉得杀牛好的猪1年前2
觉得杀牛好的猪1年前2 -
 小雨丝丝下 共回答了19个问题
小雨丝丝下 共回答了19个问题 |采纳率89.5%温度越高,气体分子间距离越大,体积越大;
压强越大,气体分子间距离越小,体积越小
温度为273K(即0'C),是标准条件下的温度,压强高于101kPa,却是高于标准条件下时的压力,所以气体摩尔体积小于22.4 L/mol.这句话正确.1年前查看全部
- CO,H2,O2,组成的混合气体60ml,在一定条件下恰好完全反应,测得生成物在101Kpa,120摄氏度下对空气的相对
 蝴蝶也煽情1年前2
蝴蝶也煽情1年前2 -
 andy1014 共回答了15个问题
andy1014 共回答了15个问题 |采纳率80%你的条件少了,而且没问题.不过照应可以知道你需要知道的东西,因为高中的化学题目,太熟悉了.一般会问混合气体中CO,H2,O2的体积.1年前查看全部
- 3.在25℃,101kPa条件下,将15L氧气通入10L一氧化碳和氢气的混合气体中,使其完全燃烧,干燥后,恢复至原来的
3.在25℃,101kPa条件下,将15L氧气通入10L一氧化碳和氢气的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.(2002年全国高考题)
(1)若剩余气体的体积是15L,则原 和 的混合气中 ________L,____________L.
(2)若剩余气体的体积是 L,则原 和 的混合气中 ______.
(3)若剩余气体的体积为 L,则 的取值范围是_______. 真爱无悔5201年前1
真爱无悔5201年前1 -
 wenwenchen1116 共回答了17个问题
wenwenchen1116 共回答了17个问题 |采纳率94.1%5 5
(a-10):(20-a)
(10,20)
2CO+O2=2CO2 2H2+O2=2H2O 其中co与O2的体积比为2:1,H2与O2的体积比也为2:1,10LCO与H2的混合气完全燃烧需要5LO2,故O2的过量了;又知道在在25℃,101kPa条件下,H2O 为液体,故完全燃烧后剩下的气体为CO2 和O2的混合气体,设原混合气体有xLCO,则有(10-x)LO2,根据上面的两个反应式可知反应后得到的CO2体积为xL,消耗的氧气的体积一共为5L,在剩下的O2为10L,又知道剩余的体积为15L,则有x+10=15,解得x=5,则10-x=5;
如果剩余的体积为aL,则有x+10=a,则x=a-10;则10-x=20-a;
这些都是实际存在的气体,则x要大于零,10-x也要大于零,即a-10大于零,20-a也要大于零,最后可以解得a小于20大于10,即(10,20)
祝你学好化学,加油1年前查看全部
- 273K,101kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态)这句话对不对
 笑七下1年前1
笑七下1年前1 -
 世界杯倒时差中 共回答了18个问题
世界杯倒时差中 共回答了18个问题 |采纳率100%不对273K 101kPa,水开始结冰,水结成冰体积变大,固态体积>液态体积 d(液态)1年前查看全部
- 在20度温度下,压强为101kpa时1mol的氧气和1mol的二氧化碳为什么所含的分子数相等?
在20度温度下,压强为101kpa时1mol的氧气和1mol的二氧化碳为什么所含的分子数相等?
不是2和3吗? 别自作聪明1年前2
别自作聪明1年前2 -
 fei00fei 共回答了20个问题
fei00fei 共回答了20个问题 |采纳率85%根据阿伏伽德罗定律,在同温同压条件下相同体积气体具有相同的分子数.在20度温度下,压强为101kpa时1mol的氧气和1mol的二氧化碳所含的分子数相等,所含原子数之比为2:31年前查看全部
- 273K 101kPa ,水分子间平均距离d:d(气态)>d(液态)>d(固态
273K 101kPa ,水分子间平均距离d:d(气态)>d(液态)>d(固态
273K 101kPa 是甚么意思 英仙旋臂同盟1年前2
英仙旋臂同盟1年前2 -
 linzeqiuzi 共回答了20个问题
linzeqiuzi 共回答了20个问题 |采纳率90%273K就是0℃,101kPa 就是1标准大气压.1年前查看全部
- 120摄氏度,101kPa时,两种气态烃的混合物2L完全燃烧,得到相同状况下3L CO2和3L水蒸气.这两种烃可能组成是
120摄氏度,101kPa时,两种气态烃的混合物2L完全燃烧,得到相同状况下3L CO2和3L水蒸气.这两种烃可能组成是(答案CH4和C2H2)
 yizhi11年前1
yizhi11年前1 -
 amazingcong 共回答了14个问题
amazingcong 共回答了14个问题 |采纳率85.7%若这道题目是选择题,可以用代入答案拼凑出这个答案.
2L气态烃混合物燃烧得到3LCO2&3LH2O
可知气态烃与产物物质的量比为1:1.5
所以假设气态烃化学式为CxHy,有
CxHy+(x+y/4)O2=(burnning)1.5CO2+1.5H2O
根据质量守恒,可以推知方程式中x=1.5;y=3
即混合物的组成式为:C1.5H3
所以混合物的两个组分每分子碳原子数一个要大于1.5,一个要小于1.5(所以甲烷是肯定存在的);每分子氢原子数要一个大于3一个小于3.
已知有一种物质是甲烷,那么另一种烃要求碳原子数大于1.5,氢原子数小于3,所以可以得出可能是乙炔(也可以是其他满足这一要求的烃,但在结构稳定性上,乙炔是作为首选考虑的).1年前查看全部
- 1.在237K的温度下,1mol某气体的体积为22.4L,该气体的压强一定为101KPa,这句话对吗?为什么?
1.在237K的温度下,1mol某气体的体积为22.4L,该气体的压强一定为101KPa,这句话对吗?为什么?
2.一同学将两颗基本一样的石头用细线相连,从三楼烟台手捏一颗小石头伸出阳台外让他们由静止落下,落地时间差为t,又从五楼阳台重复操作,时间差为t1,请猜测t,t1的关系
第二个也要原因啊! sujiancool1年前4
sujiancool1年前4 -
 lisen16888 共回答了18个问题
lisen16888 共回答了18个问题 |采纳率77.8%(1)正确.根据克拉珀龙方程PV=nRT,温度,体积,摩尔确定则压强也确定.(R为气体普适恒量)
(2)t=根号(2H/g)-根号[2(H-l)/g]
t1=根号(2H1/g)-根号[2(H1-l)/g](H1>H)
t-t1=根号(2H/g)+根号[2(H1-l)/g]-根号[2(H-l)/g]-根号(2H1/g)
即比较:根号(H1-l)-根号(H-l)与根号(H1)-根号H的大小
显然左边大于右边,t-t1>0(左边*[根号(H1-l)+根号(H-l)],右边**[根号(H1)+根号(H)],发现两边相等,显然左边大于右边)
t>t11年前查看全部
- 在273℃,101kPa条件下,1L某气态烃与适量氧气恰好完全反应生成二氧化碳和水蒸气,测得其体积为bL,将bL气体通入
在273℃,101kPa条件下,1L某气态烃与适量氧气恰好完全反应生成二氧化碳和水蒸气,测得其体积为bL,将bL气体通入足量的CaCl2充分吸收后,测得气体的体积变为aL,则该烃分子中碳氢原子个数比为
A.a:b
B.a:(a-b)
C.a:(b-2a)
D.a:2(b-a) yjykl1年前1
yjykl1年前1 -
 crazysushu 共回答了18个问题
crazysushu 共回答了18个问题 |采纳率100%无水CaCl2是用来吸水的,所以反应后的气体体积比
V(CO2):V(H2O)=a:(b-a)
所以碳氢原子个数比为
a:2(b-a)
所以.选D1年前查看全部
- 将含过量氧气和乙烯及某烷烃的混合气体20L点燃反应后体积仍为20L(120℃101kPa)求烷烃分子式及乙烯的体积
将含过量氧气和乙烯及某烷烃的混合气体20L点燃反应后体积仍为20L(120℃101kPa)求烷烃分子式及乙烯的体积
将反应后的气体通过足量的碱石灰,剩余气体2L,若仅通过浓硫酸,则体积变为10L. gaga9851年前2
gaga9851年前2 -
 wangysxxj 共回答了17个问题
wangysxxj 共回答了17个问题 |采纳率100%根据C2H4+3O2=2CO2+2H2O可知,在120℃101kPa下气体的体积是保持不变的,也就是说烷烃也应该如此,设烷烃的化学式为CxH2x+1,则其燃烧的化学方程式为2CxH2x+1+(3x+1)O2=2xCO2+(2x+2)H2O,也即满足2+3x+1=2x+2x+2,解得x=1,即烷烃的化学式为CH4.碱石灰能吸收水和二氧化碳,但不能吸收多余的氧气,所以剩余两升为过量的氧气,反应生成CO2和H2O的体积共18L,浓硫酸只能吸收水分,最后剩余的体积中含有过量的2L氧气和8L生成的二氧化碳,所以反应中还生成了10L的H2O.设CH4为xL,C2H4 为yL,通过化学方程式可知分别生成CO2 xL、2yL,分别生成H2O 2xL,2yL,列方程组x+2y=8;2x+2y=10,便可解得x=2L,y=3L.1年前查看全部
- 下列说法不正确的是( )A.同温同压下,体积相同的任何气体单质均含有相同数目的原子数B.25℃、101KPa时,28g
下列说法不正确的是( )
A.同温同压下,体积相同的任何气体单质均含有相同数目的原子数
B.25℃、101KPa时,28g CO气体的物质的量是1 mol
C.等质量的乙炔和苯,含有相同数目的原子数
D.1 mol O2占有的体积为22.4L时,O2所处的条件不一定是标准状况 芫荽青1年前0
芫荽青1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1、根据热化学方程式(在101kPa时)∶ S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/m
1、根据热化学方程式(在101kPa时)∶ S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/mol
分析下列说法中正确的是
A.1mol S燃烧放出的热量为297.23kJ
B.S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C.S(s) + O2(g) = SO2(s) 放出的热量小于297.23kJ
D.形成1mol SO2的化学键释放的能量小于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的能量
2.已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol.若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3.下列关系式中正确的是
A.Q1<Q3<Q2 B.Ql<Q2<Q3 C.Q1<Q2=Q3 D.Q1=Q2=Q3
特别是第二题 岁月胡同1年前3
岁月胡同1年前3 -
 五哥_mm 共回答了21个问题
五哥_mm 共回答了21个问题 |采纳率81%B硫固体变为气体要吸热,S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C同理,S(s) + O2(g) = SO2(s) 放出的热量大于297.23kJ ,而不是小于
D、正因为本反应是方热反应,形成1mol SO2的化学键释放的能量小大于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的能量 ,而不是小于
A说得太笼统,连个限制条件都没有,错
B对
中和热的条件就是稀强酸与稀强碱.
①稀醋酸为弱酸,电离出氢离子时吸热,反应时放热自然少
②浓硫酸溶于水放热,放热就多
③稀硝酸等于中和热
A1年前查看全部
- 某同学在20°C,101KPa时测得0.86g氢气的体积为10.3L,试通过计算分析这位同学的实验结果是否合理?(误差
某同学在20°C,101KPa时测得0.86g氢气的体积为10.3L,试通过计算分析这位同学的实验结果是否合理?(误差
(误差在正负2范围内均可看作合理) 是20°C不是标况 zzzwbd5201年前4
zzzwbd5201年前4 -
 meteor2004 共回答了14个问题
meteor2004 共回答了14个问题 |采纳率92.9%气体状态方程:pV = nRT
现在p = 101KPa,T = 293K,n = 0.86/2 = 0.43mol,V = 1.03*10^(-2) m^3
所以解得R = pV/nT = 8.257
R的真实值为8.314
误差 = (8.314 - 8.257)/8.314 = 0.69%
所以结果合理.1年前查看全部
- 下列描述中,错误的是( )A.在压强为101kPa时,氧气在-183℃时变为淡蓝色液体B.空气是一种十分重要的天然资源
下列描述中,错误的是( )
A.在压强为101kPa时,氧气在-183℃时变为淡蓝色液体
B.空气是一种十分重要的天然资源
C.若大量有害物质进入空气中,仅靠大自然的自净能力,大气还能保持洁净
D.按体积分数计,呼出气体中氮气的含量最高 jojo_yh1年前1
jojo_yh1年前1 -
 simmons 共回答了20个问题
simmons 共回答了20个问题 |采纳率100%解题思路:A、根据氧气的性质分析判断;
B、根据空气的应用分析;
C、根据空气的污染分析;
D、根据呼出气体的成分分析.A、在压强为101kPa时,氧气在-183℃时变为淡蓝色液体,描述正确;
B、空气是一种十分重要的天然资源,描述正确;
C、若大量有害物质进入空气中,仅靠大自然的自净能力,不能净化,大气会受到污染,描述错误;
D、按体积分数计,呼出气体中氮气的含量最高,描述正确.
故选C.点评:
本题考点: 氧气的物理性质;吸入空气与呼出气体的比较;空气对人类生活的重要作用;空气的污染及其危害.
考点点评: 本题的难度不大,了解空气的成分及各成分的性质等知识是解答本题的基础.1年前查看全部
- 在101kPa时,1mol CH4完全燃烧生成CO2和液态H2O,放出890.3kJ的热量,CH4的燃烧热为多少?100
在101kPa时,1mol CH4完全燃烧生成CO2和液态H2O,放出890.3kJ的热量,CH4的燃烧热为多少?1000L CH4(标准状况)燃烧后所产生的热量为多少?
 执一可薇1年前1
执一可薇1年前1 -
 lysleonlai 共回答了20个问题
lysleonlai 共回答了20个问题 |采纳率95%解题思路:根据燃烧热定义1mol可燃物完全燃烧生成稳定的化合物时所放出的热量求CH4的燃烧热;
根据燃烧热化学方程式以及反应中的热量与物质的量成正比来求解1000L CH4(标准状况)燃烧后所产生的热量.在101kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出890.3kJ的热量,根据燃烧热的概念,CH4的燃烧热△H=-890.3kJ/mol,热化学方程式为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol;
1000L CH4(标准状况)的物质的量是n=[v
vm=
1000L/22.4L/mol]=[1000/22.4]mol,
所以产生的热量为[1000/22.4]×890.3kJ≈39745.5kJ,
答:CH4的燃烧热为△H=-890kJ/mol;1000L CH4(标准状况)燃烧后所产生的热量为39745.5kJ.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查了燃烧热的概念分析应用,理解燃烧热概念是解题关键,题目难度不大.1年前查看全部
- 碳酸氢钠和氯化铵如何分离在常温(20摄氏度)和常压(101KPa)下,如何分离这两种可溶于水的物质.
 梅暮1年前1
梅暮1年前1 -
 Donver_975 共回答了14个问题
Donver_975 共回答了14个问题 |采纳率92.9%这是 侯得榜 的制纯碱的反应 中的一步
加热混合固体 氯化铵 分解为氯化氢和氨气
而碳酸氢钠分解温度略高
氯化氢和氨气遇冷化合成氯化铵(类似升华和凝华)
从而分离1年前查看全部
- 298K、101KPa时,11.2LO3中含有的氧原子数为1.5NA.这句话对吗?why?
 云也淡淡风也轻轻1年前4
云也淡淡风也轻轻1年前4 -
 悦铃 共回答了23个问题
悦铃 共回答了23个问题 |采纳率95.7%错,标准状况是温度为0摄氏度,即273.15K,压强为一个标准大气压.非标准状态下,不能用摩尔体积计算,所以错了.1年前查看全部
- .已知25℃、101kPa条件下
.已知25℃、101kPa条件下
已知25℃、101kPa条件下:
4Al(s)+3O2(g)==2Al2O3;△H=-2834.9kJ•mol-1
4Al(s)+2O3(g)==2Al2O3;△H=-3119.1kJ•mol-1
由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
怎么判断O2 O3哪个稳定
"该反应吸热,说明破坏O2的化学键需吸收的热量比生成O3的化学键所放出的热量多,那么当然是O2更加稳定了。" 对于这句话 我觉得只能说明“破坏3mol O2的化学键需吸收的热量比生成2mol O3的化学键所放出的热量多” 而不能比较1molO2与O3 克敏1年前4
克敏1年前4 -
 花谢花不开 共回答了22个问题
花谢花不开 共回答了22个问题 |采纳率95.5%你可以把6mol氧原子的能量看成能量的最高值,那么破坏3mol O2的化学键需吸收的热量就是6mol氧原子能量减去3mol O2的能量,而生成2mol O3的化学键所放出的热量就是6mol氧原子能量减去2mol O3的能量,现在第一个放热多,说明3mol O2的能量低于2mol O3的能量(题目说等质量).
其实,中学化学中,我们只要记住:物质的能量越高越不稳定;反应放热越多生成物越稳定.
所以是选A,D中由O2变O3(能量由低到高)为吸热反应,所以错.1年前查看全部
- 25℃、101kPa.使1.0g钠与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,求生成1molNaCl的反
25℃、101kPa.使1.0g钠与足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,求生成1molNaCl的反应热.
 luke2221年前3
luke2221年前3 -
 rr辛苦了 共回答了15个问题
rr辛苦了 共回答了15个问题 |采纳率86.7%2Na+Cl2==点燃==2NaCl,1.0g钠反应放出17.87KJ热量,
所以生成1molNaCl,需要反应1molNa,即23g钠,所以放出的热量为23×17.87=411.01KJ1年前查看全部
- 25℃和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强
25℃和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75% 585947231年前1
585947231年前1 -
 wzl1978 共回答了23个问题
wzl1978 共回答了23个问题 |采纳率87%解题思路:根据有机物燃烧的化学反应方程式,分析反应前后气体体积的变化,利用气体体积缩小了72mL及混合气体的体积来列等式计算出乙炔的体积,最后计算乙炔的体积分数.由乙烷、乙炔和丙烯燃烧的方程式可知,除去水蒸气,恢复到原来的温度和压强,
C2H6+[7/2]O2=2CO2+3H2O△V
1[7/2]2 2.5
C2H2+[5/2]O2=2CO2+H2O△V
1[5/2]2 1.5
C3H6+[9/2]O2=3CO2+3H2O△V
1[9/2] 32.5
则C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质即可,
设C2H6和C3H6一共为xmL,C2H2为ymL,
则有
x+y=32
2.5x+1.5y=72,解得y=8mL,
混合烃中乙炔的体积分数为
8
32×100%=25%,
故选B.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查学生利用有机物燃烧的化学反应方程式进行体积分数的计算,明确气体体积缩小的量及将乙烷和丙烯看成一种物质是解答的关键.1年前查看全部
- 400K、101KPa时,10ml某气态烃与50ml氧气混合,完全燃烧后生成二氧化碳和水蒸气,体积变为65ml.
400K、101KPa时,10ml某气态烃与50ml氧气混合,完全燃烧后生成二氧化碳和水蒸气,体积变为65ml.
(1)该烃在组成上应该有 个氢原子.
(2)若该烃为烯烃,其结构简式和名称为 和 .
(3)该烃能否为芳香烃的蒸气?;为什么?. 似水d年华1年前1
似水d年华1年前1 -
 xqc258 共回答了27个问题
xqc258 共回答了27个问题 |采纳率96.3%设烃为CxHy,则其完全燃烧通式为
CxHy+(x+0.25y)O2→xCO2+0.5yH2O
其中xCO2与氧气的一部分,即xO2等体积抵消,因此实际影响体积变化的为
CxHy+0.25yO2→0.5yH2O
题中,气体燃烧前后体积增加了65-(10+50)=5ml
10ml烃所需的氧气为2.5y ml,生成的水蒸汽体积为5y ml,增加了5y-(10+2.5y)=(2.5y-10) ml;因此2.5y-10=5,解得y=6【第一问答案】
单烯烃时,由CnH2n通式可得n=3,为丙烯,结构简式CH3CH=CH2【第二问答案】
(10ml丁二烯不可能在50ml氧气内完全燃烧,碳数更多的烯烃当然更不可能)
第三问,芳香烃中含有苯环,因此每个分子中至少有6个C;而仅仅6个C完全燃烧为CO2就需要6倍于烃体积的氧气,再加上H和更多的C更不可能.因此10ml芳香烃蒸汽不可能在50ml氧气里完全燃烧.1年前查看全部
大家在问
- 1下列关于高倍物镜的叙述正确的是( )
- 2一个弹簧测力计,一边施加4N拉力,一边施加6N拉力,求测力计示数,以及运动状态.
- 3取两毫升的硫酸铜溶液于试管中,滴加几滴烧碱溶液,观察到的现象是 反映的化学方程式为 再向试管中滴加稀盐酸,观察到的现象时
- 4小红从甲地到乙地,以每分钟50m的速度,走了2分钟后,她想,如果照这样的速度就会迟到2分钟,于是她多走10米
- 5"我变老了,"用英文如何翻译?
- 6开明出版社出版一种书,今年每册书的成本比去年增加25%,但是仍保持原价,因此每本利润下降了25%,那么去年这
- 7四季景色的四字词语
- 8怎么记单词 给一个方法.本人是内种 记得快忘得快的.并且还记不住汉语.求个适合本人的方法
- 9写出句子所缺单词.1.I think I’ve l___ the way.Can you help me?
- 10一辆自行车的轮胎外直径约是60cm,若每分转200圈,通过一座长2200m的桥,大约要几分?(得数保留整数)
- 11小明身高比小芳矮1/8,小明身高是小芳身高的多少
- 12选择题《1》等腰直角三角形友《》条对称轴.《1》1 《2》3《3》无数
- 13DNA复制时,DNA聚合酶先与-35区的DNA序列(即启动子)结合,然后滑动到-10区开始转录
- 14下列4种元素是按在地壳中的含量由大到小的顺序排列是( )
- 151.光滑水平地面上有用水平细绳相连的两个物体AB,质量分别为m1,m2,当用大小为F水平向右的力拉着他们做匀加速直线运动

