Cu片碳棒共同组成原电池Cu片碳棒同时进入到稀硫酸中,并连接好闭合回路会形成原电池,阴极和阳极的反应式是什么?总反应方程
 zljlily2022-10-04 11:39:541条回答
zljlily2022-10-04 11:39:541条回答Cu片碳棒同时进入到稀硫酸中,并连接好闭合回路会形成原电池,阴极和阳极的反应式是什么?总反应方程式?
实验证明会发生原电池反应

已提交,审核后显示!提交回复
共1条回复
 南kk木棉jewel 共回答了15个问题
南kk木棉jewel 共回答了15个问题 |采纳率80%- ...
不能发生原电池反应.铜的电极电势比氢高. - 1年前
相关推荐
- 锌锰干电池中碳极上NH4+获电子生H2 妨碍碳棒与NH4+接触 增大电池内阻 产生极化作用
锌锰干电池中碳极上NH4+获电子生H2 妨碍碳棒与NH4+接触 增大电池内阻 产生极化作用
这句话中, 就这样了阿1年前2
就这样了阿1年前2 -
 林锐 共回答了21个问题
林锐 共回答了21个问题 |采纳率100%电极上有(净)电流流过时,电极电势偏离其平衡值(可逆值)的现象称作极化.当电极上有气体产生时,这种差异会变得很大.电极的极化有浓差极化和电化学极化.气体引起的极化属于电化学极化的一种.
“极化作用”指的就是产生了极化这种现象.它使得电极电势不再等于可逆情况下的电极电势了.
一般来说,电解的时候只需要略大于原电池的电势差就可以,但是有极化作用存在下时,需要比前面的数值大很多的电势差反应才可以发生.因此往往需要“去极化”.1年前查看全部
- 2朋友们帮帮忙,面试测试题,1.以碳棒作为电极电解CUSO4溶液,请写出阴极和阳极的电极反应方程式
 ifiona21年前2
ifiona21年前2 -
 liuxiaoyi_ 共回答了17个问题
liuxiaoyi_ 共回答了17个问题 |采纳率94.1%阳极:2H2O===4H++O2+4e-
阴极:2CU2++4e-==2CU1年前查看全部
- (1)用碳棒作电极,电解下列水溶液:
(1)用碳棒作电极,电解下列水溶液:
①Na 2 SO 4 溶液 ②AgNO 3 溶液 ③KCl溶液 ④CuCl 2 溶液。
通过相同电量时,阴极产生的气体物质的量相同的是(填序号)_________;通过相同电量时,产生的气体总物质的量由多到少的排列顺序是(填序号)__________。
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(2)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关。已知:
H 2 (g)+Cl 2 (g)=2HCl(g) △H=-185 kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol,则E(H-Cl)=_______________
(3) 已知Fe 2 O 3 (s)+3CO(g)=2Fe(s)+3CO 2 (g) △H=-25 kJ/mol
3Fe 2 O 3 (s)+CO(g)=2Fe 3 O 4 (s)+CO 2 (g) △H=-47kJ/mol
Fe 3 O 4 (s)+CO(g)=3FeO(s)+CO 2 (g) △H=+19kJ/mol
请写出CO还原FeO的热化学方程式:_________________________________。
(4)如图所示的装置:
该装置中Cu极为_____极;当铜片的质量变化了12.8g时,a极上消耗的O 2 在标准状况下的体积为
_______L。 露露王1年前1
露露王1年前1 -
 chy_yoyo 共回答了18个问题
chy_yoyo 共回答了18个问题 |采纳率83.3%(1)①③;③①④②
(2)434KJ/mol
(3)FeO(s)+CO(g)==Fe(s)+CO 2 (g) △H=-11kJ/mol
(3)阳;2.24L1年前查看全部
- 初二科学题导体.半导体.分辨~大地、人体、汗水、橡皮、干木头、塑料、油、瓷、硅、碳棒、锗、水银、铁诸物质中,属于导体的是
初二科学题导体.半导体.分辨~
大地、人体、汗水、橡皮、干木头、塑料、油、瓷、硅、碳棒、锗、水银、铁诸物质中,属于导体的是_____________________________,属于半导体的是_____________________________. hedywang1年前2
hedywang1年前2 -
 xiaoyukitty 共回答了16个问题
xiaoyukitty 共回答了16个问题 |采纳率87.5%大地、人体、汗水、橡皮、干木头、塑料、油、瓷、硅、碳棒、锗、水银、铁诸物质中,属于导体的是____________大地、人体、汗水、、碳棒、水银、铁_________________,属于半导体的是_____________硅、锗________________.1年前查看全部
- 用铜电镀铁时,可以用碳棒作阳极,氯化铜溶液作电镀液,铁作阴极吗?为什么?电镀的本质是什么?
 陽光魅力1年前3
陽光魅力1年前3 -
 O四鲜烤麸O 共回答了15个问题
O四鲜烤麸O 共回答了15个问题 |采纳率86.7%可以 阳极 4氢氧根离子-4e——2H2O+O2
阴极2铜离子+4e——2Cu
阳极的镀层金属失去电子,形成金属阳离子进入溶液,在溶液中的金属阳离子在阴极待镀物品上得到电子,表面覆盖一层镀层金属1年前查看全部
- 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
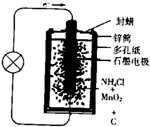
(1)如图是干电池的基本构造图,干电池工作时正极上的反应是N
+e−=NH3↑+H +4
H2↑则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.1 2
(2)锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中.
(3)氯化铵、氯化锌的提取、分离和检验.①如何从黑色粉末中提取NH4Cl和ZnCl2的晶体混合物?写出简要的实验步骤:______.
②用什么方法可将NH4Cl和ZnCl2的晶体混合物分离开?______.
③写出证明ZnCl2晶体中含Zn2+的操作步骤及实验现象:______(已知Zn(OH)2是两性氢氧化物且能溶解于氨水)
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等,可用灼烧的方法除去杂质.该实验中需要用到的主要仪器除酒精灯外,还有______. 潮海听萧1年前1
潮海听萧1年前1 -
 破案咔叽 共回答了20个问题
破案咔叽 共回答了20个问题 |采纳率95%解题思路:(1)锌锰干电池中,锌作为负极,失去电子;MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气;
(2)①根据不溶物以及NH4Cl和ZnCl2的性质选择分离的方法,不溶物质可直接过滤,用结晶的方法分离NH4Cl和ZnCl2;
②根据NH4Cl易分解的性质选取分离方法;
③Zn2+中不管是先滴加强碱性或弱碱性溶液都能先出现白色沉淀,后沉淀溶解;
④加热固体操作需要坩埚,一般来说需要坩埚钳、三脚架、玻璃棒等仪器.(1)在锌锰干电池中,活泼金属锌为电池负极,反应式为Zn-2e-=Zn2+,MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气,反应式为
2MnO2+H2=Mn2O3+H2O,故答案为:Zn-2e-=Zn2+;2MnO2+H2=Mn2O3+H2O;
(3)①黑色粉末既有可溶性的NH4Cl和ZnCl2,又有不溶物,所以可以采用溶解、过滤、结晶的办法得到ZnCl2和NH4Cl的混合物,
故答案为:向黑色粉末中加入一定量的蒸馏水充分搅拌溶解,过滤,将滤液蒸发浓缩、冷却结晶,再过滤,所得晶体即为ZnCl2和NH4Cl的混合物;
②NH4Cl具有热不稳定性,而且稳定性降低时又能马上化合生成氯化铵,因此可以采用加热方法,故答案为:加热;
③Zn2+中不管是先滴加强碱性或弱碱性溶液都能先出现白色沉淀,后沉淀溶解,
故答案为:取少量ZnCl2于试管中溶解,将溶液平均分为两等份,分别滴加足量NaOH溶液和氨水,两支试管中均为先后白色沉淀生成,后沉淀又溶解;
④灼烧操作需要坩埚,转移坩埚需要坩埚钳,坩埚需要放置在三脚架或铁架台的铁圈上的泥三角中,灼烧过程中要用玻璃棒搅拌,
故答案为:坩埚、坩埚钳、三脚架、泥三角、玻璃棒.点评:
本题考点: 常见化学电源的种类及其工作原理;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是以实验为主的综合题,考查物质的提取、分离、检验及电化学知识,题目较为综合,具有一定难度,学习中注意化学实验知识的积累.1年前查看全部
- 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题 (1)若两池中均为CuSO 4 溶液,反应一段时间后:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题 
(1)若两池中均为CuSO 4 溶液,反应一段时间后:
有红色物质析出的是甲池中的_____棒,乙池中的____棒。乙池中阳极的电极反应式是_____________。
(2)若两池中均为饱和NaCl溶液:
写出乙池中总反应的离子方程式____________________。
甲池中碳极上电极反应式是____________________,乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”)。
将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为___________________。
若乙池转移0.02 mol e - 后停止实验,池中溶液体积是200 mL,则溶液混合均匀后的PH=______。 linzi三1年前1
linzi三1年前1 -
 fczf888 共回答了20个问题
fczf888 共回答了20个问题 |采纳率95%1年前查看全部
- 原电池里的碳棒做正极,以及电解池里面两根碳棒做阴阳极,怎么反应的?
原电池里的碳棒做正极,以及电解池里面两根碳棒做阴阳极,怎么反应的?
快考试了,化学反应原理这本书一直很混乱,真心请求帮助.
一直不是很理解碳棒是如何反应的,希望能各举一个例子,给出方程式, 公交车上的女子1年前1
公交车上的女子1年前1 -
 k69jg 共回答了12个问题
k69jg 共回答了12个问题 |采纳率91.7%碳棒一般不反应,起传递电子导电作用,怎么反应要看得失电子强弱,比如电解饱和食盐水也就是氯碱工业,先分析溶液中的离子,判断什么离子优先放电(可以认为优先得失电子即反应,这个规律教材上应该有),通电时电源负极富集电子,阴极H 得电子变成氢气,电源正极Cl-失电子变成Cl2,所以这一极是电子流出被氧化是阳极.构成原电池基本条件是闭合回路和自发的氧化还原反应,比如氢氧原电池,通氧气的一极一般是正极,因为氧气一般是得电子变负价,O2 4e- 2H2O——4OH-(中性电解质),负极一般是失电子能力强被氧化的如氢气,H2-2e-——2H ,总反应式即两者相加,2H2 O2~2H2O
我也是高中生,以前没认真读书也怕这个的,多看看书,不要怕就不做,多做多问1年前查看全部
- 普通手电电池里含有什么物质除了碳棒以外,还有什么化学成分?废旧电池外皮腐蚀后,会有一些白色的粉末附着在上面,请问这是什么
普通手电电池里含有什么物质
除了碳棒以外,还有什么化学成分?
废旧电池外皮腐蚀后,会有一些白色的粉末附着在上面,请问这是什么东西?
废旧电池外皮腐蚀后,会有一些白色的粉末附着在上面,请问这是什么东西?这个主要问题 xxyyyzzzz1年前1
xxyyyzzzz1年前1 -
 jlzr 共回答了18个问题
jlzr 共回答了18个问题 |采纳率83.3%锌锰干电池是最常见的化学电源.干电池的外壳(锌)是负极,中间的碳棒是正极,在碳棒的周围是细密的石墨和去极化剂MnO2的混合物,在混合物周围再装入以NH4Cl溶液浸润的ZnCl2,NH4Cl和淀粉或其他填充物(制成糊状物).为了避免水的蒸发,干电池用蜡封好.干电池在使用时的电极反应为
碳极:
2NH4+ + 2e- = 2NH3 + H2
+)H2 + 2MnO2 = 2MnO(OH)
锌极:Zn - 2e- = Zn2+
总反应:Zn + 2MnO2 + 2NH4+ = 2MnO(OH) + 2NH3 + Zn2+
从反应式看出:加MnO2是因为碳极上NH 离子获得电子产生H2,妨碍碳棒与NH 的接触,使电池的内阻增大,即产生“极化作用”.添加MnO2就能与H2反应生成MnO(OH).这样就能消除电极上氢气的集积现象,使电池畅通.所以MnO2起到消除极化的作用,叫做去极剂.
此外,普通碱性干电池,也是用Zn和MnO2或HgO做反应物,但在KOH碱性条件下工作.例如汞电池是最早应用的微型电池,有Zn(负极)和HgO(正极)组成,电解质为KOH浓溶液,电极反应为
负极:Zn(s) + 2OH- Zn(s) + H2O + 2e-
正极:HgO(s) + H2O + 2e- Hg(1) + 2OH-
总反应:Zn(s) + HgO(s) ZnO(s) + Hg (1)
电动势为1.35V,特点是在有效使用期内电势稳定.另有一种氧化银电池由Zn和Ag2O组成,电解质为碱性溶液,电动势为1.5V.1年前查看全部
- 硫酸做电解质,碳棒为电极的电解池电极反应方程式
硫酸做电解质,碳棒为电极的电解池电极反应方程式
正极的和负极的还有总的都写下, TTT8881年前1
TTT8881年前1 -
 shaojiang 共回答了16个问题
shaojiang 共回答了16个问题 |采纳率93.8%阴极:2H+ + 2e = H2
阳极:2H2O -4e =4H+ + O2
总反应:2H2O=2H2↑+O2↑(电解)1年前查看全部
- 干电池中碳棒接电源正负极后,会有什么现象?能短路么?
干电池中碳棒接电源正负极后,会有什么现象?能短路么?
我把干电池拆了之后,拿出来的碳棒,接触家用电压电源后会变红麽?能否短路? sxy_gf1年前1
sxy_gf1年前1 -
 pyddq 共回答了17个问题
pyddq 共回答了17个问题 |采纳率88.2%1) 要测试碳棒的电阻,然后根据你的电源的容量考虑施加多大电压.
2) 能否会变红,决定于你施加了多大电压.当碳棒获得足够大的功率时,自然会变红.
3) 碳棒变红后带来的一个问题是燃烧.碳棒主要成分是石墨,高温下在空气中是会燃烧的.
4) 不要冒然将220V电压加到碳棒上,碳棒的电阻是很小的.1年前查看全部
- 电解饱和食盐水制烧碱时为何用碳棒作阳极,铁棒作阴极
电解饱和食盐水制烧碱时为何用碳棒作阳极,铁棒作阴极
同上 无烟往日1年前8
无烟往日1年前8 -
 qianjing997 共回答了17个问题
qianjing997 共回答了17个问题 |采纳率88.2%阳极接在电源正极上,电源正极会不断地吸电子,所以只能挂惰性电极,如炭棒和Pt等,若挂其他,如铁棒,那么电子被电源正极吸收,Fe会变成铁离子,从而进入电解液中,你会很快看到铁棒不见了.那至于为什么用炭棒而不用Pt,则是价格关系.炭棒便宜.
而阴极接在电源负极上,电源负极在不断产生电子,所以挂什么并没有什么大的关系,挂铁的话,反而保护了铁不变为铁离子.其实负极挂炭棒什么的,也可.在工业生产中一般阴极不用铁棒而做成铁网,增大反应接触面.而炭不易做成网状,所以选用炭棒.课本上电解饱和食盐水制烧碱时为何用碳棒作阳极,铁棒作阴极,是为了与实际生产线类似.1年前查看全部
- 电解池里,ZnCl2做电解液,碳棒做阴极,锌棒做阳极,阳极有什么现象?
 xiaopotian1年前1
xiaopotian1年前1 -
 紫烟若水 共回答了20个问题
紫烟若水 共回答了20个问题 |采纳率75%阳极失电子,由于Cl比Zn活泼,所以Cl先失电子,产生Cl21年前查看全部
- 请问一下碳棒是导体还是绝缘体
 wspwspawp1年前1
wspwspawp1年前1 -
 桑三又木 共回答了15个问题
桑三又木 共回答了15个问题 |采纳率86.7%导体……1年前查看全部
- 哪些是绝缘体?空气 钨丝 油 大地 盐水 碳棒 陶瓷 人体中,属于绝缘体的有哪些?最好阐述下理由、、、、悬赏看回答定、、
哪些是绝缘体?
空气 钨丝 油 大地 盐水 碳棒 陶瓷 人体中,属于绝缘体的有哪些?
最好阐述下理由、、、、
悬赏看回答定、、、
空气不是绝缘体吗? sahara的虫1年前3
sahara的虫1年前3 -
 9941 共回答了19个问题
9941 共回答了19个问题 |采纳率100%不善于导电的物体是绝缘体,但是绝缘体与导体之间没有绝对的界限,会受温度的影响.
陶瓷 是绝缘体.1年前查看全部
- 3、下列物质中不能导电的是 ( )A氯化钾溶液 B澄清石灰水 C酒精 D石墨碳棒
 苏文威1年前1
苏文威1年前1 -
 股华 共回答了15个问题
股华 共回答了15个问题 |采纳率86.7%C A中有氯离子和钾离子等自由移动的离子,可以导电.B中有OH离子和CA离子.D是导体.可以导电1年前查看全部
- 电化学腐蚀条件?碳棒和铁棒用导线连接同放于NaCl里面,为何要发生电化学腐蚀,而不是形成一个单纯的原电池用水中的氢离子反
电化学腐蚀条件?
碳棒和铁棒用导线连接同放于NaCl里面,为何要发生电化学腐蚀,而不是形成一个单纯的原电池用水中的氢离子反应成氢气 xiaoheizi5201年前1
xiaoheizi5201年前1 -
 幸福如昙花一现 共回答了16个问题
幸福如昙花一现 共回答了16个问题 |采纳率93.8%这就是一个原电池,发生的是吸氧腐蚀,溶液中没有大量的氢离子,就不能生成氢气,如果是酸性溶液就会放氢气1年前查看全部
- 电解硫酸锌,正极为锌,负极碳棒,求方程式.
 weilai5001年前1
weilai5001年前1 -
 yangliuqing0607 共回答了15个问题
yangliuqing0607 共回答了15个问题 |采纳率80%阳极:Zn - 2e- = Zn2+
阴极:Zn2+ + 2e- = Zn1年前查看全部
- 为什么电解饱和食盐水中,要用碳棒作为殃及材料,铁棒作为阴极材料?
为什么电解饱和食盐水中,要用碳棒作为殃及材料,铁棒作为阴极材料?
RT
今天下午之前.
越快分越高 xenos1年前1
xenos1年前1 -
 alandxue 共回答了15个问题
alandxue 共回答了15个问题 |采纳率80%其实不用规定的这么严格
碳棒做阳极主要是为了防止阳极的材料反映,而碳棒是不反应的
若金属做阳极就反应了.
阴极也不一定用铁棒,用碳棒也可以1年前查看全部
- 用铝棒做阴极电解饱和食盐水会腐蚀么?(碳棒做阳极)
用铝棒做阴极电解饱和食盐水会腐蚀么?(碳棒做阳极)
有人说电解池阴极是被保护的,所以铝不会被氢氧化钠腐蚀 xulan07191年前5
xulan07191年前5 -
 wysz1 共回答了13个问题
wysz1 共回答了13个问题 |采纳率100%会的
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
反应会生成NaOH ,NaOH 会和铝发生反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑1年前查看全部
- 干燥的纸是导体吗?碳棒呢?
 4077844951年前1
4077844951年前1 -
 小bk 共回答了19个问题
小bk 共回答了19个问题 |采纳率94.7%干燥的纸不是导体,碳棒是很好的导体~1年前查看全部
- Mg fe cu 碳棒 h2so4溶液 cuso4溶液 组成原电池
Mg fe cu 碳棒 h2so4溶液 cuso4溶液 组成原电池
Mg Fe Cu 碳棒 H2SO4溶液 CUSO4溶液 可组成哪几种原电池 所有的结果 memory9999991年前2
memory9999991年前2 -
 yqq2007 共回答了17个问题
yqq2007 共回答了17个问题 |采纳率94.1%负极:1 Mg 2Mg 3Mg 4fe 5 fe 正极:1 Fe 2CU 3碳棒 4cu 5 碳棒 电解质溶液:1 2 3 4 5H2SO4 或 cuso4溶液 这里10种1年前查看全部
- 【化学判断题一道】下面这句话为什么不对?错在哪里?“在以碳棒为两极的电解池中,氢离子向阴极方向移动;在铜锌原电池(稀硫酸
【化学判断题一道】
下面这句话为什么不对?错在哪里?
“在以碳棒为两极的电解池中,氢离子向阴极方向移动;在铜锌原电池(稀硫酸做电解液)中,氢离子向负极方向移动.” 撒旦_an1年前2
撒旦_an1年前2 -
 zhutao929 共回答了14个问题
zhutao929 共回答了14个问题 |采纳率100%在铜锌原电池(稀硫酸做电解液)中,氢离子向负极方向移动 错了
H+应向正极移动,所以在铜锌原电池试验中可以看到的现象是铜片上有气泡冒出1年前查看全部
- 将铁片和碳棒用导线连接起来后同时放入食盐溶液中
将铁片和碳棒用导线连接起来后同时放入食盐溶液中
是否会形成原电池?若是,则形成的过程是怎样的;若否,则为什么? lowellkai1年前2
lowellkai1年前2 -
 上班老迟到2 共回答了23个问题
上班老迟到2 共回答了23个问题 |采纳率91.3%会形成,这是铁的吸氧腐蚀
负极:Fe-2e-=Fe2+
正极:2H2O+4e-+O2=4OH-1年前查看全部
- l硫酸铜电解池失电子疑问求解决两个碳棒的那种电解池,放电的是氢氧根,为什么阳极换成铜,那放电的就变成CU拉?
 YXXXY1年前2
YXXXY1年前2 -
 是这样的么 共回答了26个问题
是这样的么 共回答了26个问题 |采纳率84.6%硫酸铜溶液电解,用碳棒作电极时,碳棒是惰性电极.阴极:铜离子放电.阳极:氢氧根离子比硫酸根更易放电,故氢氧根放电.但电极改为铜时,由于铜是可以失电子的还原性金属,在此电解条件下,铜优于氢氧根先失电子.所以放电的就变成铜了.1年前查看全部
- 阳极为铜 阴极为碳棒 电解硫酸钠有什么现象
阳极为铜 阴极为碳棒 电解硫酸钠有什么现象
表示据说会出现白色沉淀什么的凌乱了. 月下清茶1年前3
月下清茶1年前3 -
 shsqthk 共回答了15个问题
shsqthk 共回答了15个问题 |采纳率73.3%补充一下,实际上阳极的铜可能会溶解成亚铜离子,生成CuOH和Cu2O,因此实际上你会观察到黄色沉淀(总之不是蓝色的).暴露于空气中静置约1天后,你会观察到沉淀转化为蓝色的Cu(OH)2.
如果不相信,可以自己做实验验证一下.1年前查看全部
- 电解饱和食盐水时,通电时为什么要在负极插铁棒,在正极插碳棒哪?
电解饱和食盐水时,通电时为什么要在负极插铁棒,在正极插碳棒哪?
用其他的来代替能行吗? chowteen1年前1
chowteen1年前1 -
 ym043650 共回答了19个问题
ym043650 共回答了19个问题 |采纳率89.5%首先要纠正你一个错误,电解时是说阴阳极而不是正负极.
电解时,阳极发生氧化反应,只要阳极不用活泼金属就可以了.不一定阴极一定要铁棒,阳极要碳棒.但千万不能阳极用铁棒(原因:铁棒会反应).
在氯碱工业(电解饱和食盐水制氢氧化钠的工业)中,阳极就是用碳钢网,阴极用钛网.
如果你还没有学到高二,你就简单了解一下吧.1年前查看全部
- 电解槽中连接正极的为碳棒,是阳极,为什么阳极发生氧化反应?
 mizua1年前3
mizua1年前3 -
 letiantian 共回答了17个问题
letiantian 共回答了17个问题 |采纳率100%阳极发生氧化反应是定义决定的.
至于连接阳极的为什么是正极——由正负极的定义,电流在外电路中从正极流向负极,并在电源内电路中由负极流向正极形成回路;作为载流子的电子的定向运动方向和电流方向相反.发生氧化还原反应时,两极之间积累局部电荷产生电势差,由于电解质溶液中不能传递电子,电子只能在内电路中由正极向负极定向运动,因此正极失去电子,发生氧化反应,于是由定义,和正极连接的这一极就是阳极.
注意碳是惰性电极,本身不参与氧化还原反应,只起到传导电流的作用;参与反应的是它附近的电解质溶液.
====
[原创回答团]1年前查看全部
- 铜丝 铝条 尼龙线 玻璃棒 盐水 稀硫酸 干木棒 瓷棒 碳棒.哪些是导体
铜丝 铝条 尼龙线 玻璃棒 盐水 稀硫酸 干木棒 瓷棒 碳棒.哪些是导体
哪些是导体 哪些是绝缘体 月光凌乱1年前1
月光凌乱1年前1 -
 轻雪飞扬1 共回答了18个问题
轻雪飞扬1 共回答了18个问题 |采纳率88.9%导体:铜丝 铝条 盐水 稀硫酸 碳棒
绝缘体 就是剩下的哈
应该是这样的.1年前查看全部
- 原电池中,铁做负极,碳棒做正极,电解质是饱和氯化钠溶液,为什么碳棒上的反应为氧气得电子和水反应生成氢氧根离子,我觉得是氢
原电池中,铁做负极,碳棒做正极,电解质是饱和氯化钠溶液,为什么碳棒上的反应为氧气得电子和水反应生成氢氧根离子,我觉得是氢离子得电子生成氢气 解释是这个:1.这个是典型的吸氧腐蚀,就是在电解液中没有大量的氢离子的情况下(电解液呈中性或碱性时)由氧气得电子!2.而你所说的氢离子得电子那是析氢腐蚀(也就是电解液中有大量氢离子,即电解液呈酸性时)的情况!
再看这个题目,电解液为饱和的氯化钠溶液,呈中性,则应该发生1的情况,即吸氧腐蚀,由氧气得电子.
但当铜做负极,碳棒做正极,电解液为氯化铁溶液时,为什么是铁离子得电子,按上面的解释应该是氧气得电子,搞不懂,不甚感激! 8305211年前1
8305211年前1 -
 okr7 共回答了21个问题
okr7 共回答了21个问题 |采纳率85.7%(⊙o⊙)…其实你要知道的是.铁离子在溶液中是有很强的氧化性的.他的氧化性比氢离子和氢氧根都大的多.他太强大了,有他在氢离子氢氧根都只能歇着了.
而且有铁离子的溶液酸性都不小,至少PH要在3以下,因为酸性太小铁离子就水解了.所以就算轮,也是氢离子不是氢氧根.1年前查看全部
- 干电池外部电流方向为什么自由电子方向与电流方向相反电流由碳棒流向锌筒原因何在
 逸尘2341年前3
逸尘2341年前3 -
 tronycai 共回答了13个问题
tronycai 共回答了13个问题 |采纳率100%1、因为电流的定义是正电荷移动方向,而电子是负电荷,所以电流的方向与自由电子的方向相反.
2、这是由于电池内部化学反应决定的:你说的这种干电池中锌在反应中失去电子变成带正电的锌离子,失去的电子通过电池外部的导线流回到电池的正极(碳棒).这样就形成了电池外部从正极(碳棒)到负极(锌筒)的电流.在电池内部电流从负极流向正极,电流在电池内外形成环路.1年前查看全部
- 碳棒是导体还是绝缘体
 tianyamh1年前4
tianyamh1年前4 -
 liyulong7210 共回答了21个问题
liyulong7210 共回答了21个问题 |采纳率100%碳棒是真空炉加热管,是导体,导电性能一般,主要是靠电阻发热来加热设备炉体.1年前查看全部
- 在甚麽条件下碳棒可变成金刚石 在甚麽条件下电池中的碳棒可变成金刚石
 ssrj19821年前1
ssrj19821年前1 -
 shdisney 共回答了16个问题
shdisney 共回答了16个问题 |采纳率93.8%在一定温度,压强下石墨可变成金刚石.
一般环境下完不成这个反应1年前查看全部
- 关于原电池的两个问题Cu和Zn在硫酸锌作电解质溶液时,为什么一开始能产生电流?为什么铜与碳棒在硫酸钠做电解质时能进行电解
关于原电池的两个问题
Cu和Zn在硫酸锌作电解质溶液时,为什么一开始能产生电流?
为什么铜与碳棒在硫酸钠做电解质时能进行电解?
(阳极反应:铜失去电子形成铜离子,阴极反应:氢离子得到电子形成氢气)
为什么会有电极反应中会有氢离子的存在?
参考书上是这么说的 注意是一开始有电流 之后就没有了 shadeying1年前5
shadeying1年前5 -
 haipma 共回答了13个问题
haipma 共回答了13个问题 |采纳率100%不能吧.Cu Zn与ZnSO4不反应.
- - 我囧.
第2个问题,能电解.这个要怎么解释.- -
第3个,由放电顺序可知.
水能电离出H+.且H+比Na+先放电.
如果是参考书上说的是硫酸锌的话,要构成原电池的话,就还要用到盐桥,使原原电池构成双液原电池,且能产生持续稳定的电流.这与题意矛盾了啊..
所以,参考书上说的 应该是用硫酸铜做电解质,一开始有电流是因为发生了氧化还原反应.
负极:锌失电子得到锌离子
正极:铜得电子得到铜单质
后来没有电流的原因是 锌从硫酸铜溶液中置换出的铜单质覆盖在锌表面,一段时间后 锌的表面镀上铜,而铜不与硫酸铜反应,所以一段时间后就没有电流.1年前查看全部
- 关于电解食盐水的我用铁丝作负极,碳棒作正极 发现电解后-极处水变浑浊,慢慢水变黑,水面上有一层恶心的红棕色漂浮物,下方水
关于电解食盐水的
我用铁丝作负极,碳棒作正极 发现电解后-极处水变浑浊,慢慢水变黑,水面上有一层恶心的红棕色漂浮物,下方水呈深绿色,好像都是絮状物.这是怎么会事?
为什么实验室中不会发生这种现象?如果我两极都用碳棒会怎么样?
还有漂浮在水面上的固体片状物是什么东西? 病毒性心肌炎1年前1
病毒性心肌炎1年前1 -
 bolindajia 共回答了19个问题
bolindajia 共回答了19个问题 |采纳率94.7%原电池称电极为正负极,电解槽称电极为阴阳极.正常情况下阳极:2Cl--2e-==Cl2↑阴极:2H++2e-==H2↑你说的是阴阳极反接则铁作阳极,阳极:Fe - 2e- === Fe2+阴极:2H+ + 2e- === H2 ↑ 总反应:Fe + 2H2O===Fe(OH)2↓+H2↑在空气中 Fe(OH)2会进一步反应4Fe(OH)2 + O2 +2H2O===4Fe(OH)31年前查看全部
- 某研究性学习小组的课题为“Mg-Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如图所示(C1、C2均为碳棒),
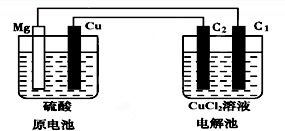 某研究性学习小组的课题为“Mg-Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如图所示(C1、C2均为碳棒),按要求填写下列空格.
某研究性学习小组的课题为“Mg-Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如图所示(C1、C2均为碳棒),按要求填写下列空格.
(1)铜片上的现象是______,该极的电极反应式为______.
(2)C1极的名称为______,C2极的电极反应式为______.
(3)下列关于该装置中电子 流向的叙述中正确的是______.
A.从镁电极经导线流向C1极B.从C1极经导线流向镁电极
C.从铜电极经导线流向C2极D.从C2极经导线流向铜电极
(4)原电池中稀硫酸的体积为200mL,物质的量浓度为1.5mol•L-1,当电解池中某碳棒上产生3.36L(标准状况)气体时,求:
①有______个电子通过了电线(NA=6.02×1023).
②此时原电池溶液中H+的物质的量浓度为______mol/L(不考虑溶液体积变化). filter1年前1
filter1年前1 -
 雄鹰翱翔001 共回答了19个问题
雄鹰翱翔001 共回答了19个问题 |采纳率89.5%解题思路:(1)原电池中Mg作负极失电子,Cu作正极,Cu上氢离子得电子生成氢气;
(2)与原电池的负极相连为阴极,与原电池的正极相连为阳极,阳极上氯离子失电子;
(3)电子从负极流向阴极,电子从阳极流向正极;
(4)①根据电极方程式中电子与物质的关系分析;
②根据气体的体积计算硫酸的物质的量,再根据物质的量浓度公式计算.(1)原电池中Mg作负极失电子,Cu作正极,Cu上氢离子得电子生成氢气,其电极反应式为2H++2e=H2↑,
故答案为:有气泡生成;2H++2e=H2↑;
(2)C1极与原电池的负极相连为阴极,C2与原电池的正极相连为阳极,阳极上氯离子失电子生成氯气,其电极反应式为2Cl--2e-=Cl2↑;
故答案为:阴极;2Cl--2e-=Cl2↑;
(3)电子从负极流向阴极,则从镁电极经导线流向C1极,从阳极流向正极,所以从C2极经导线流向铜电极;
故答案为:AD;
(4)①2Cl--2e-=Cl2↑ 转移电子
22.4L 2×6.02×1023个
3.36L 1.806×1023个
故答案为:1.806×1023;
(2)装置中转移的电子为:n=
1.806×1023
6.02×1023=0.32mol
Zn+H2SO4 =ZnSO4 +H2↑ 转移电子
1mol 2mol
0.15mol0.3mol
c(H2SO4)=[n/V]=[0.2×1.5−0.15/0.2]=0.75mol/L,则c(H+)=2c(H2SO4)=1.5mol/L,
故答案为:1.5.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理和电解池原理的应用,以原电池和电解池为载体考查了反应方程式的有关计算,正确找出各物质间的关系是解本题的关键,题目难度中等.1年前查看全部
- 用铜作阳极点解食盐水生成什么我用碳棒做阴极然后搅拌溶液就出现褐色沉淀是为什么?还有那褐色的东西是什么?
 幸福麻烦鬼1年前1
幸福麻烦鬼1年前1 -
 czh89 共回答了18个问题
czh89 共回答了18个问题 |采纳率83.3%氢氧化亚铜吧...好久不学化学关于颜色有点忘了.不过有可能是氧化亚铜..
对电解进行分析,
电解前,溶液中:
阳离子:氢离子,钠离子
阴离子:氯离子,氢氧根离子
由得失电子规律,
阳极上:离子或原子失去电子,铜失去电子显然比氯或是氢氧根失去电子要容易(金属元素,可以从元素周期表上看出来的也),显然是阳极铜失去电子,变为铜离子进入溶液.
阴极上:离子或原子得到电子,可以得到电子的只有钠离子或是氢离子,相比之下显然氢离子容易得到电子,生成氢气溢出.
这样,我们溶液中就有:铜离子,氢氧根离子,钠离子,氯离子,进行反应的话也就是可以生成氢氧化亚铜沉淀,别的颜色不对啊.
所以只能是氢氧化亚铜了,氢氧化亚铜不是很稳定的说,会分解的得到氧化亚铜.
这个生成物个人认为应该与溶液的浓度有关,因为溶液的浓度过低的话铜失去电子也会少,但是铜足量(过量),电解条件下的话生成不稳定的亚铜很正常不是么~
一般来说如果实验操作和溶液都没问题的话应该不会生成别的吧?
另外反正也是做实验再做实验验证一下呗~
沉淀取出来,冲洗干净后,拿一部分加硫酸溶解,看颜色,再加浓硫酸,氧化后看颜色.要是精确一点的话再用盐酸滴定,至沉淀全部溶解,计算一下到底是氧化还是氢氧化就好了应该.1年前查看全部
- 关于干电池,正确的说法是A 锌筒是电源正极B 碳棒是电源正极C 两极可以用导线连接D 不能持续供电某一导体,第一次通电时
关于干电池,正确的说法是
A 锌筒是电源正极
B 碳棒是电源正极
C 两极可以用导线连接
D 不能持续供电
某一导体,第一次通电时,在秒内通过其横截面的电量为库仑,第二次通电时,秒内通过横截面积的电量是库仑
A 第一次通电的电流强度大
B 第一次通电的电流强度小
C 两次通电的电流强度一样
D 无法判断 初夏的记忆0001年前1
初夏的记忆0001年前1 -
 kij6141030 共回答了16个问题
kij6141030 共回答了16个问题 |采纳率93.8%一般的干电池是碳棒为正极,当两极用导线相连时,电池可通电,但电池会因为短路而烧坏.
第二题嘛,应该是一样大的.1年前查看全部
- 两极是碳棒,电解硫酸亚铁溶液
 balisang1年前1
balisang1年前1 -
 tonghouqiong 共回答了17个问题
tonghouqiong 共回答了17个问题 |采纳率88.2%排除电极与溶液的反应(一般用石墨电极不容易发生副反应),得到氢气和氧气.
阴极:4OH--4e===2H2O+O2↑ 阳极:2H++2e=H2↑ 电极总反应:4OH-+4H+==(通电)==O2↑+H2↑+2H2O
O(0)-(-II) O2+2H2O+4e-=4OH- 0.401
S(VII)-(VI) S2O82-+2e-=2SO42- 2.010
Fe(II)-(0) Fe2++2e-=Fe -0.447
H(I)-(0) 2H++2e-=H2 0.0000
硫酸亚铁中存在氢离子.
因为EH+/H2EOH-/O2(电极反应是是它们的逆反应,电极电势也要以相反数体现),即在电极指发生氢氧根离子的还原反应.1年前查看全部
- 某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
 某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑
(1)请在右边方框中画出能够实现这一反应的装置图______.
(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的
①实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色.
请你分析其原因______.
②假设按照该方案进行实验,且收集到碳棒上产生气体体积为11.2L(标准状况下).则该过程中铜片上发生的反应式为______.
③此时要使溶液恢复到实验前的状态,需加入______(写出该物质的化学式),其质量为______. 天zz涯1年前1
天zz涯1年前1 -
 穿越夜的思念 共回答了13个问题
穿越夜的思念 共回答了13个问题 |采纳率76.9%解题思路:(1)实现该反应,选择Cu为阳极,电解质为硫酸;
(2)碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色,其电解实质为电解水,C棒为阳极生成氧气,Cu棒上生成氢气,若一段时间恢复原状态,应加入等量的水.(1)若发生Cu+H2SO4(稀)=CuSO4+H2↑,利用电解来实现,则Cu为阳极,C为阴极,电解质为硫酸,装置如图
 ,故答案为:
,故答案为: ;
;
(2)①碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色,其电解实质为电解水,即两极与电源的正负极接反了,故答案为:两极与电源的正负极接反了;
②Cu棒上生成氢气,发生的电极反应为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
③碳棒上产生气体体积为11.2L为氧气,其物质的量为[11.2L/22.4L/mol]=0.5mol,由2H2O
电解
.
O2↑+2H2↑,则要恢复原样加入H2O的质量为0.5mol×2×18g/mol=18g,
故答案为:H2O;18g.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,明确电极材料的选择与发生的电极反应是解答本题的关键,注意电解后使溶液恢复原样,应从元素及质量守恒的角度来分析,题目难度不大.1年前查看全部
- 下边材料中哪些能导电:1铁 2干木头 3食盐溶液 4碳棒 5陶瓷 6人体 7玻璃 8潮湿木头 9干棉纱 10铝条
 lanjing_03081年前1
lanjing_03081年前1 -
 kekesun 共回答了25个问题
kekesun 共回答了25个问题 |采纳率96%1,3,4,6,8,101年前查看全部
- 铝做高压电线 2.石墨作铅笔笔芯 3.电池外要包一层锌皮 4.电池中有一根石墨碳棒 5.电池上有一个铜帽
铝做高压电线 2.石墨作铅笔笔芯 3.电池外要包一层锌皮 4.电池中有一根石墨碳棒 5.电池上有一个铜帽
下列所举的个物质的用途可以用相似的性质来解释的一组是————,这是因为该组都具有较好的————性
 prince281年前1
prince281年前1 -
 星空模拟 共回答了16个问题
星空模拟 共回答了16个问题 |采纳率93.8%下列所举的个物质的用途可以用相似的性质来解释的一组是(145)铝做高压电线 、电池中有一根石墨碳棒 、电池上有一个铜帽,这是因为该组都具有较好的(导电性)性1年前查看全部
- 电解池中两极为铁和碳棒,电解液可以为纯水吗?
电解池中两极为铁和碳棒,电解液可以为纯水吗?
如果可以,那么生成的沉淀是在两极之间的溶液中生成还是在电极上生成? hxy12121年前3
hxy12121年前3 -
 aa一族 共回答了20个问题
aa一族 共回答了20个问题 |采纳率90%纯水是极弱电解质,理论上是可以,如果你有耐心等上几天到几个月的话````因为铁被氧化,进入溶液,所以电导率会随反应进程而逐渐增大,还是可行的.如果惰性电极电解纯水的话,几百年都有可能.
生成的沉淀在两极之间.1年前查看全部
- 如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
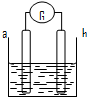 A. a为负极,是铁片,烧杯中的溶液为硫酸
A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 huilibing1年前1
huilibing1年前1 -
 茑尾 共回答了20个问题
茑尾 共回答了20个问题 |采纳率95%解题思路:两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,说明该装置构成了原电池,其中a极是正极,根据原电池的工作原理和规律来回答.A、a极上有大量气泡生成,说明a是正极,应该是碳棒,负极b是铁片,烧杯中的溶液可以为硫酸,故A错误;
B、a极上有大量气泡生成,说明a是正极,应该是碳棒,负极b是铁片,烧杯中的溶液不可以为硫酸铜,否则正极上会析出金属铜,故B错误;
C、a极上有大量气泡生成,说明a是正极,应该是碳棒,烧杯中的溶液可以为硫酸,故C正确;
D、a极上有大量气泡生成,说明a是正极,应该是碳棒,烧杯中的溶液为硫酸铜时,正极上会析出金属铜,故烧杯中的溶液不能是为硫酸铜溶液,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生原电池的工作原理和放电规律,可以根据教材知识来回答,难度不大.1年前查看全部
- 我知道铜在空气中变成cu2(oh)2co3,那么铜棒和碳棒用导线连接放在氯化钠溶液中,就应该是吸氧腐蚀,要是把电解质溶液
我知道铜在空气中变成cu2(oh)2co3,那么铜棒和碳棒用导线连接放在氯化钠溶液中,就应该是吸氧腐蚀,要是把电解质溶液换成盐酸或氢氧化钠,那是什么腐蚀,两极电极反应式是啥,
我知道把电解质溶液换成盐酸或氢氧化钠,肯定还是吸氧腐蚀,因为要是析氢腐蚀,就是铜能和盐酸反应了。cu2(oh)2co3和盐酸反应是强酸制弱酸,但cu2(oh)2co3和氢氧化钠为什么不反应 coolma19841年前2
coolma19841年前2 -
 xqfed88gn18c6 共回答了20个问题
xqfed88gn18c6 共回答了20个问题 |采纳率90%答:是吸氧腐蚀.
正极反应:2(H2O)+O2+4e=4(OH-) (这好难表达化学式好,完全正确的写法写不出来)
负极反应:Cu+2(OH-)-2e=Cu(OH)2↓
假如Cu2(OH)2CO3能和NaOH反应,就会生成Cu(OH)2与Na2CO3
而Cu(OH)2在碱性环境下是沉淀的,它会在反应物表面形成一层阻碍反应进行的膜,只要反应还能进行,在能反应的地方膜就会加厚,直到膜把两反应物完全分开而停止反应.1年前查看全部
- 用铜和碳棒做电极电解水生成什么用铜做阳极,用碳棒做阴极,生成的淡蓝色的东西是什么?
 jiangbo_andy1年前4
jiangbo_andy1年前4 -
 llna8 共回答了16个问题
llna8 共回答了16个问题 |采纳率87.5%因为阳极是活泼电极,阳极参加氧化还原反应,阳极铜失去电子变为铜离子电极反应为:
阳极:Cu-2e^-=Cu2+
阴极:2H2O+2e-=H2+2OH-
所以会生成淡蓝色的氢氧化铜.
望采纳,谢谢!1年前查看全部
- 下列关于化学电源的叙述错误的是 [ ] A.普通锌锰干电池中碳棒为正极
下列关于化学电源的叙述错误的是 [ ]A.普通锌锰干电池中碳棒为正极
B.铅蓄电池中覆盖着PbO 2 的电极板是负极板
C.氢氧燃料电池的正极是通入氧气的那一极
D.碱性锌锰干电池单位质量输出的电能比普通锌锰干电池多 oo的季节SP1年前1
oo的季节SP1年前1 -
 SB客星 共回答了17个问题
SB客星 共回答了17个问题 |采纳率94.1%B1年前查看全部
- 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池中均为CuSO 4 溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒.
②乙池中阳极的电极反应式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______.
②甲池中碳极上电极反应式是______,乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”).
③若乙池转移0.02mol e - 后停止实验,池中溶液体积是200mL,则溶液混合均匀后的所得NaOH溶液的物质的量浓度为______.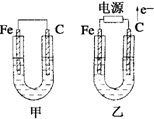
 花迪1年前1
花迪1年前1 -
 yahx 共回答了14个问题
yahx 共回答了14个问题 |采纳率85.7%(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出,故答案为:碳;铁;
②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH - -4e - =2H 2 O+O 2 ↑,故答案为:4OH - -4e - =2H 2 O+O 2 ↑;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,方程式为:2NaCl+2H 2 O
通电
.
Cl 2 ↑+H 2 ↑+2NaOH,
故答案为:2NaCl+2H 2 O
通电
.
Cl 2 ↑+H 2 ↑+2NaOH;
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,O 2 +2H 2 O+4e - =4OH - ,乙装置中,碳棒是阳极,发生失电子的氧化反应,
故答案为:O 2 +2H 2 O+4e - =4OH - ;氧化反应;
③电解氯化钠溶液的方程式为:2NaCl+2H 2 O
通电
.
Cl 2 ↑+H 2 ↑+2NaOH,乙池转移0.02mole - 后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=
n
V =
0.02mol
0.2L =0.1mol/L,故答案为:0.1mol/L.1年前查看全部
大家在问
- 1“左侧的IO3-通过阴离子交换膜向右侧移动”,为什么?这个离子交换膜是怎回事?在这里干什么用?
- 2两堆煤重量不等,先从甲堆中运走24吨到乙堆,而乙堆又运入8吨,现乙堆煤的重量正好等于甲堆煤重量的3倍,
- 3关于冲量,下列说法中正确的是( )
- 4(选择题)将颗粒饱满的种子分为甲.乙两组,在25℃ ~ 30℃温度下分别播种,甲组种在潮湿肥沃的土壤里,乙组种在潮湿贫瘠
- 5搜集一首关于友情的诗歌,要有节奏
- 6下列溶剂能溶解单质碘和溴,但不能把碘和溴从碘水和溴水中提取出来
- 71平方米50平方分米=______平方米.(填分数)
- 8已知函数f(x)=lg([2x/2+x]+a),其中a为常数,且a≥-2.
- 912′=?°=?″ 35°30′=?° 45°24′=?° 26.25°=?′ 57°27=?
- 10若果实红色为显性,黄色为隐性.用红色苹果花粉给黄色去雄雌蕊授粉后,所结的果实是什么颜色?
- 11(2009•南京一模)构建知识网络,理清物质间的相互关系,是化学学习中的一种重要方法.如图中连线两端的物质可以相互反应.
- 12怎样从长方形里面截取最大面积的正方形
- 13电磁感应,电感,感抗的区别?感抗总是阻碍交流电吗?有没有为了阻碍磁通量的减少,而增加了电流?
- 14四年级两个班共有学生100人,如果从一班分10名学生到二班,这时两个班的人数就相等,两班原来各有多少名学生?
- 15水螅的体壁是由外胚层和内胚层两层什么细胞构成的?

