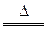铁元素在人类生活中扮演着非常重要的角色,不仅仅是重要的建筑材料,也是人体必须的微量元素.每年钢铁的腐蚀带来巨大的经济损失
 金尼尼2022-10-04 11:39:541条回答
金尼尼2022-10-04 11:39:541条回答请回答下列问题:
(1)请比较以上三个装置中右侧导管中红墨水的高度:______>______>______请写出A装置中,钢铁锈蚀时正极反应的电极反应式______
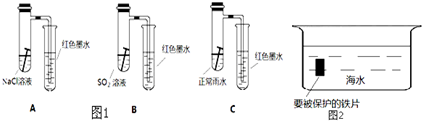
(2)钢铁的防腐有重大的意义,生活中常将金属制品放在干燥处或者涂上矿物油予以保护,现请你从电化学角度设计一种方法保护图中钢铁以免被腐蚀,请将图2完成:

已提交,审核后显示!提交回复
共1条回复
 古逢 共回答了9个问题
古逢 共回答了9个问题 |采纳率100%- 解题思路:(1)强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,A装置溶液呈中性,铁发生吸氧腐蚀,正极上氧气得电子发生还原反应;
(2)作原电池正极或电解池阴极的金属被保护.(1)强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,A装置溶液呈中性,铁发生吸氧腐蚀,B、C溶液呈酸性,铁发生析氢腐蚀,但B中酸性较强,所以铁发生腐蚀严重,发生吸氧腐蚀时左边试管中压强减小,右边导管中红墨水上升,B、C右边导管中红墨水下降,且B下降比C多,所以右侧导管中红墨水高度:A>C>B;
A中铁发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,
故答案为:A>C>B;O2+4e-+2H2O=4OH-;
(2)作原电池正极或电解池阴极的金属被保护,所以Fe可以连接比铁活泼的金属或连接电源负极, 故答案为:
故答案为: .
.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查金属腐蚀与防护,明确原电池原理和电解池原理即可解答,知道钢铁发生析氢腐蚀和吸氧腐蚀的条件、区别,知道防止金属被腐蚀的方法,题目难度不大. - 1年前
相关推荐
- 200克赤铁矿(主要成分为三氧化二)中若含有的铁元素的质量112克,则此铁矿石中三氧化二铁的质量分数是
200克赤铁矿(主要成分为三氧化二)中若含有的铁元素的质量112克,则此铁矿石中三氧化二铁的质量分数是
快 兰烬1年前1
兰烬1年前1 -
 8911 共回答了23个问题
8911 共回答了23个问题 |采纳率87%含有的铁元素的质量112克的Fe2O3的质量是112/(112/160)=160g
三氧化二铁的质量分数是160/200*100%=80%1年前查看全部
- 那个含铁元素的碱有哪些
 yinfeiya1年前1
yinfeiya1年前1 -
 8865138 共回答了20个问题
8865138 共回答了20个问题 |采纳率80%含有铁元素,而且是碱的只有两种:氢氧化铁,氢氧化亚铁
因为氢氧化亚铁不稳定,空气中迅速被氧化成氢氧化铁,所以能够稳定存在的只有一种.1年前查看全部
- Fe(OH)2中的铁元素会被氯水氧化吗?
 som131452111年前6
som131452111年前6 -
 栎灵 共回答了15个问题
栎灵 共回答了15个问题 |采纳率86.7%会.氯水中有HCl,HClO,HClO具有强氧化性,氧化为Fe(OH)3,对于Fe(OH)2来说,在空气中就能和水、氧气反应,生成Fe(OH)31年前查看全部
- 食物中的含有铁元素的会被氧化吗被氧化成什么?
 1394541年前3
1394541年前3 -
 曾经郁闷 共回答了13个问题
曾经郁闷 共回答了13个问题 |采纳率84.6%如果食物中的铁元素是+2价,那么遇到空气就会被氧化成+3价.苹果削皮后变色就是因为这1年前查看全部
- 某赤铁矿石样品25.6g,其中含氧化铁的质量为12.8g.求该矿石中铁元素的质量分数.(杂质中不含铁元素)
 飞行棋大战对对碰1年前1
飞行棋大战对对碰1年前1 -
 呜喵呜 共回答了25个问题
呜喵呜 共回答了25个问题 |采纳率88%解题思路:根据杂质中不含铁元素,利用氧化铁的质量来计算铁元素的质量,然后再利用矿石样品的质量来计算矿石中铁元素的质量分数.因杂质中不含铁元素,由氧化铁的质量为12.8g,
氧化铁的化学式为Fe2O3,
则铁元素的质量为12.8g×[56×2/56×2+16×3]×100%=8.96g,
则该铁矿石中铁元素的质量分数为[8.96g/25.6g]=35%,
答:该矿石中铁元素的质量分数为35%.点评:
本题考点: 物质组成的综合计算;化合物中某元素的质量计算.
考点点评: 本题考查元素质量分数的计算,学生明确只有氧化铁中含有铁元素是解答本题的关键,学生应能利用氧化铁的化学式及原子的相对原子质量来计算元素的质量分数来解答.1年前查看全部
- 由FeO、Fe2O3和Fe3O4组成的混合物,其中铁元素与氧元素的质量比为21:8,则混合物中由FeO、Fe2O3和Fe
由FeO、Fe2O3和Fe3O4组成的混合物,其中铁元素与氧元素的质量比为21:8,则混合物中由FeO、Fe2O3和Fe3O4的质量比为.这道题唯一不懂的地方就是Fe3O4中Fe和O的质量比也是21:8,为什么他不会影响到铁元素和氧元素的质量比呢
 lettly1231年前3
lettly1231年前3 -
 伊人云风 共回答了18个问题
伊人云风 共回答了18个问题 |采纳率83.3%那我举个例子好了
总男女比例是3:2,现在有一个队伍刚好男女是3:2,那麼不管这样的队伍有多少,都不会对总比例产生影响.
为什麽?假设有n个这样的队伍,那麼男生总人数为3n,女生为2n,那麼男女比例还是3:2,跟n无关
所以这道题目不管Fe3O4怎麼变,都跟它的量无关1年前查看全部
- 某赤铁矿石样品25.6g,其中含氧化铁的质量为12.8g.求该矿石中铁元素的质量分数.(杂质中不含铁元素)
 琼艾林1年前4
琼艾林1年前4 -
 无-翼 共回答了11个问题
无-翼 共回答了11个问题 |采纳率81.8%解题思路:根据杂质中不含铁元素,利用氧化铁的质量来计算铁元素的质量,然后再利用矿石样品的质量来计算矿石中铁元素的质量分数.因杂质中不含铁元素,由氧化铁的质量为12.8g,
氧化铁的化学式为Fe2O3,
则铁元素的质量为12.8g×[56×2/56×2+16×3]×100%=8.96g,
则该铁矿石中铁元素的质量分数为[8.96g/25.6g]=35%,
答:该矿石中铁元素的质量分数为35%.点评:
本题考点: 物质组成的综合计算;化合物中某元素的质量计算.
考点点评: 本题考查元素质量分数的计算,学生明确只有氧化铁中含有铁元素是解答本题的关键,学生应能利用氧化铁的化学式及原子的相对原子质量来计算元素的质量分数来解答.1年前查看全部
- FeO和Fe2O3和CaCO3的混合物.铁元素的质量的百分数是a%.求CaCO3的质量分数
 坚强地活下去1年前1
坚强地活下去1年前1 -
 lsjksmje 共回答了13个问题
lsjksmje 共回答了13个问题 |采纳率92.3%这道题目与另一种类似的题目需要区分,另一类的题目是可以把某几个原子绑定起来看.
而这道题目,解题思路是求一个范围.即求2种极端情况.说到这了.计算自己计算.
2种极端:完全是氧化铁+碳酸钙
氧化亚铁+碳酸钙1年前查看全部
- 要使三氧化二铁和四氧化三铁含有相同质量的铁元素,则三氧化二铁和四氧化三铁的质量比是( )
要使三氧化二铁和四氧化三铁含有相同质量的铁元素,则三氧化二铁和四氧化三铁的质量比是( )
A. 3:2
B. 1:1
C. 30:29
D. 29:30 honeybabyjojo1年前7
honeybabyjojo1年前7 -
 irishtomxt 共回答了18个问题
irishtomxt 共回答了18个问题 |采纳率100%解题思路:根据两物质的化学式,分别计算化合物中铁元素的质量分数,由铁元素质量等于化合物质量与元素质量分数的乘积,计算两物质的质量比.三氧化二铁和四氧化三铁含有相同质量的铁元素,设三氧化二铁的质量为X,四氧化三铁的质量为Y,可得
X×[56×2/160]×100%=Y×[56×3/232]×100%,解答 [X/Y]=[30/29]
故选C.点评:
本题考点: 有关化学式的计算和推断;元素的质量分数计算.
考点点评: 化合物中某组成元素的质量=化合物的质量×化合物中该元素的质量分数.1年前查看全部
- 钢材牌号14MN1MO的铁元素是多少?
 water20061年前1
water20061年前1 -
 brisky_wu 共回答了12个问题
brisky_wu 共回答了12个问题 |采纳率91.7%14Mn1Mo,还有问铁含量的?
0.14%的碳元素,1%的Mn,按道理,那个1是不需要的啊.1%的Mo.
其他的元素,硫,磷,硅,一般钢材都含有微量的.
不知道是不是这样的.1年前查看全部
- 按下列要求写出化学式或化学符号(1)氦气______;(2)3个二氧化硫分子______;(3)+3的铁元素+3Fe+3
按下列要求写出化学式或化学符号
(1)氦气______;(2)3个二氧化硫分子______;(3)+3的铁元素+3 Fe ;(4)氯离子______;+3 Fe
(5)某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式______. 第七度1年前1
第七度1年前1 -
 homelite 共回答了11个问题
homelite 共回答了11个问题 |采纳率81.8%解题思路:根据化学用语的意义及书写方法解答,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式.根据化学方程式推断物质的化学式的依据是质量守恒定律.(1)氦气是由氦原子构成的,其化学式为:He;
(2)3个二氧化硫分子就是在二氧化硫的化学式前面直接加3,即3SO2;
(3)元素的化合价要标在元素符号的正上方,且正负号在前,数字在后,+3的铁元素表示为:
+3
Fe;
(4)氯离子带一个单位负电荷,在元素符号右上角标出即可,1可以省略,即Cl-;
(5)根据反应前后原子的种类和数目都不变:X+3O2═2CO2+2H2O,反应后用2个C,4个H,6个O,故X中含有2个C,4个H,化学式为C2H4.
故答案为:(1)He;(2)3SO2;(3
+3
Fe;(4)Cl-;
(5)C2H4.点评:
本题考点: 化学符号及其周围数字的意义;质量守恒定律及其应用.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.1年前查看全部
- 铁元素是否能与氧气在常温下反应
 万里长城1年前4
万里长城1年前4 -
 4未来 共回答了20个问题
4未来 共回答了20个问题 |采纳率80%纯铁在干燥的空气中不易与氧发生反应.
铁在氧气中点燃生成四氧化三铁;在570摄氏度以上加热生成三氧化二铁;如果在高温(铁过量)的情况下,生成氧化铁.1年前查看全部
- 一个体重50kg的健康人含铁元素2g。这2g铁以Fe 2+ 和Fe 3+ 的形式存在。Fe 2+ 易被吸收,给贫血者补充
一个体重50kg的健康人含铁元素2g。这2g铁以Fe 2+ 和Fe 3+ 的形式存在。Fe 2+ 易被吸收,给贫血者补充铁时,应补充含Fe 2+ 的亚铁盐(如FeSO 4 ).服用维生素C可使食物中的Fe 3+ 转化成Fe 2+ ,有利于人体对铁的吸收。
(1)人体中经常进行Fe 2+ Fe 3+ 的转化,在过程A中,Fe 2+ 被___________,过程B中,Fe 2+ 是___________产物;
(2)“服用维生索C可使食物中的Fe 3+ 转化为Fe 2+” 这句话指出,维生素C在这一反应过程中做_________剂,具有_________性。 绝对不超八个字1年前1
绝对不超八个字1年前1 -
 denver9651 共回答了16个问题
denver9651 共回答了16个问题 |采纳率81.3%(1)氧化; 还原
(2)还原; 还原1年前查看全部
- 赤铁矿(主要成分是Fe2O3)是冶炼生铁的主要原料.若测得某赤铁矿石中铁元素的质量分数为56%.(假设杂质不含铁元素)请
赤铁矿(主要成分是Fe2O3)是冶炼生铁的主要原料.若测得某赤铁矿石中铁元素的质量分数为56%.(假设杂质不含铁元素)请回答下列问题:
(1)氧化铁中铁元素与氧元素的质量比______.
(2)该矿石中氧化铁的质量分数为______.
(3)冶炼生铁的化学方程式为______. 巡逻一队1年前1
巡逻一队1年前1 -
 何休 共回答了19个问题
何休 共回答了19个问题 |采纳率84.2%解题思路:(1)Fe2O3中铁元素与氧元素的质量比为:(铁的相对原子质量×铁原子个数):(氧的相对原子质量×氧原子个数);
(2)该矿石中氧化铁的质量分数为:赤铁矿石中铁元素的质量分数÷氧化铁中铁元素的质量分数;
(3)生铁冶炼采用的是高温固态还原法,即在炉温提高到1150~1300℃的条件下把铁矿石(氧化铁)还原成铁.据此写出化学方程式.(1)氧化铁中铁元素与氧元素的质量比为:(56×2):(16×3)=7:3;
(2)该矿石中氧化铁的质量分数为:56%÷[56×2/160]=80%;
(3)生铁冶炼是把铁矿石(氧化铁)还原成铁,还原剂主要是CO,反应的化学方程式为:Fe2O3+3CO
高温
.
2Fe+3CO2.
故答案为:(1)7:3;(2)80%;(3)Fe2O3+3CO
高温
.
2Fe+3CO2.点评:
本题考点: 元素质量比的计算;一氧化碳还原氧化铁.
考点点评: 本题主要考查学生运用化学式进行计算的能力.同时要知道生铁冶炼采用的是高温固态还原法.1年前查看全部
- 某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应后铁元素和铬元素完全转化为
某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应后铁元素和铬元素完全转化为沉淀.该沉淀经干燥后得到n mol FeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁的物质的量为n(2-x)mol
B. 处理废水中的Cr2O72-的物质的量为[nx/2]mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO•FeyCrxO3中,3x=y 山下1年前1
山下1年前1 -
 有的枫叶 共回答了22个问题
有的枫叶 共回答了22个问题 |采纳率100%解题思路:A、由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算;
B、反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
C、Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
D、根据失电子守恒计算.A、由铁元素守恒,消耗硫酸亚铁的物质的量为n(y+1),又由FeO•FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A错误;
B、根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为[nx/2],故B正确;
C、得到nmolFeO•FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,故C正确;
D、FeO•FeyCrxO3中,Cr为正三价,由得失电子守恒知3x-y=0,即3x=y,故D正确.
故选A.点评:
本题考点: 电解原理.
考点点评: 考查原子守恒、电子守恒,难度较大,注意在计算中守恒思想的应用,使计算简单化.1年前查看全部
- 在氧化铁、三氧化二铁、四氧化三铁三种化合物中,与等质量铁元素相结合的氧元素的质量比是多少?
 ybbifk3291年前5
ybbifk3291年前5 -
 闲棋女子 共回答了18个问题
闲棋女子 共回答了18个问题 |采纳率88.9%第一,氧化铁就是三氧化二铁,他们两个是同一种物质,还是说你一开始想说氧化亚铁?
建议用最小公倍数法,将三种铁的氧化物中的铁的质量,也就是Fe的脚标通过翻倍是他们的脚标相同.
FeO,Fe2O3,Fe3O4,三种物质铁的脚标为1,2,3,则取其最小公倍数6进行翻倍,则可得到
Fe6O6,Fe6O9,Fe6O8.此时三种化合物中若各取一个分子,则其铁的质量便相等,对应氧元素的质量比就相当于是新的三种氧化物中氧元素的脚标之比,6:9:81年前查看全部
- 磁铁吸的是铁还是铁元素简单地说磁铁可不可以吸铁的化合物,例如氧化铁等.
 lili03081年前1
lili03081年前1 -
 QDDEVIN 共回答了24个问题
QDDEVIN 共回答了24个问题 |采纳率95.8%磁铁是能吸引铁、钴、镍或铁氧体的物质 这一定义就说明了磁铁的性质就只能吸引铁、钴、镍或铁氧体
铁化合物大多不能吸引,只吸引铁.吸引的是铁1年前查看全部
- 1.硫酸铁和硫酸亚铁的混合物中,若其中铁元素的质量分数为a%,则其中硫元素的质量分数为多少,为什么
 cherio1281年前1
cherio1281年前1 -
 miai5 共回答了19个问题
miai5 共回答了19个问题 |采纳率94.7%处理一下有:Fe(SO4)1.5和FeSO4
所以可以看出剩下的(100-a)%为SO42(硫酸根)
在为SO42(硫酸根)中S占1/3,所以硫元素的质量分数为:(100-a)/3%1年前查看全部
- 铁元素用英语怎么说铁分子子用英语怎么说铁离子用英语怎么说铁原子用英语怎么说sorry,没有铁分子
 zjfbaobao1231年前1
zjfbaobao1231年前1 -
 强力中锋 共回答了14个问题
强力中锋 共回答了14个问题 |采纳率78.6%铁原子Iron atoms
铁离子Iron
铁分子Iron elements1年前查看全部
- 某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96% 的生铁63 t ,假设在炼制过
某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制生铁。若要炼制含铁96% 的生铁63 t ,假设在炼制过程中损失10% 铁元素,则理论上需要含杂质20% 的赤铁矿石的质量是 [ ]A. 120 t
B. 108 t
C. 96 t
D. 84 t HJY20021年前1
HJY20021年前1 -
 未激活276 共回答了22个问题
未激活276 共回答了22个问题 |采纳率90.9%A1年前查看全部
- 化学题x,y,z能相互转化x,y,z和铁元素有关的时候的六个方程式,x,y,z与钠元素有关的时候的六个方程式
 秋田麦浪1年前1
秋田麦浪1年前1 -
 工702 共回答了18个问题
工702 共回答了18个问题 |采纳率77.8%(1)Y为第三周期第VIA族S元素,HClO4>H2SO4(由“常温
下,Y单质是淡黄色固体,常在
附近沉
积”推得;Z 为Cl元素,同周期从左到右元素
渐强,
也渐强)
(2)W 为63-34=29号元素(
-
数=
=
),29-18=11故为第四周期第IB族Cu元素(
-最近的
元素
=元素在周期表中的列数,据此可判断:周期在18号的下一周期,族
与列数的关系判断,第11列为IB族 .
即为在18号Ar的基础上,按
4s有1个电子,其余10个在3d轨道;据题意,写出主要反应物和主要产物,由
规律确定另一产物为SO2,配平)
Ar3d104s1 2 Cu2S + 3O2 = 4Cu2O+2SO2
(3)X为
.(
3个
,第一个
为1s,必定有2个电子,故共有2*3=6个电子,即6号元素.据题意,写出主要反应物和主要产物,由
规律确定另一产物为CO2,配平后,由
,用方程式1*2-方程式2=该反应的
)
2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH = -270.0 kJ ·mol-11年前查看全部
- 填写下列空白:(1)写出表示含有8个质子、10个中子的原子的化学符号:______.(2)周期表中位于第8纵行的铁元素属
 填写下列空白:
填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:______.
(2)周期表中位于第8纵行的铁元素属于第______族.
(3)周期表中最活泼的非金属元素位于第______ 纵行.
(4)所含元素超过18种的周期是第______、______周期.
(5)A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B2-的结构示意图为 ,请回答下列问题:
,请回答下列问题:
①写出A、B、C三种元素的符号:A______,B______,C______.
②B位于周期表中______周期______族. nqgn5_21e__k6b8a1年前1
nqgn5_21e__k6b8a1年前1 -
 blue126 共回答了15个问题
blue126 共回答了15个问题 |采纳率93.3%解题思路:(1)原子符号AZX左下角Z为质子数、左上角A为质量数,X为元素符号,其中质量数=质子数+中子数;
(2)元素周期表中8、9、10三列为第Ⅷ族;
(3)同周期自左而右非金属性增强(稀有气体除外),同主族自上而下非金属性减弱,故非金属性最强的元素处于17列;
(4)第六、七周期中ⅢB族分别为镧系元素、锕系元素,含有元素超过18种;
(5)A、B、C为短周期元素,令A的电子数为x,则B、C电子数分别为x+9、x+2,A、C两种元素的原子核外电子数之和等于B原子的质子数,则x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素.(1)有8个质子、10个中子的原子,属于氧元素,原子质量数=8+10=18,故原子符号为188O,
故答案为:188O;
(2)元素周期表中8、9、10三列为第Ⅷ族,故第8纵行的铁元素属于第Ⅷ族,故答案为:Ⅷ;
(3)同周期自左而右非金属性增强(稀有气体除外),同主族自上而下非金属性减弱,故非金属性最强的元素处于17列,故答案为:17;
(4)第六、七周期中ⅢB族分别为镧系元素、锕系元素,含有元素超过18种,故答案为:六、七;
(5)A、B、C为短周期元素,令A的电子数为x,则B、C电子数分别为x+9、x+2,A、C两种元素的原子核外电子数之和等于B原子的质子数,则x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素,
①由上述分析可知,A、B、C三种元素的符号分别为N、S、F,故答案为:N;S;F;
②B为S元素,位于周期表中第三周期ⅥA族,故答案为:三、ⅥA.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查元素周期表、原子结构与位置关系,比较基础,侧重对基础知识的巩固.1年前查看全部
- 样品中含铁元素56%,求该赤铁矿中Fe2O3的质量分数
样品中含铁元素56%,求该赤铁矿中Fe2O3的质量分数
测得某赤铁矿石(主要成份是Fe2O3)样品中含铁元素56%,求该赤铁矿中Fe2O3的含量.
好象是80%
急` i803871年前1
i803871年前1 -
 太一的梦想 共回答了14个问题
太一的梦想 共回答了14个问题 |采纳率85.7%设含有X%的FE2O3
由FE2O3的化学式可知,FE在一个FE2O3中的质量分数是:
2*56/2*56+3*16=70%
那么就列出方程:
0.7*X%=0.56
解得X=80
故质量分数为80%1年前查看全部
- (2005•崇文区二模)下列化合物中,铁元素的质量分数最小的是( )
(2005•崇文区二模)下列化合物中,铁元素的质量分数最小的是( )
A.FeCl2
B.Fe2O3
C.Fe3O4
D.FeS maxiaojun11年前1
maxiaojun11年前1 -
 cara4107 共回答了17个问题
cara4107 共回答了17个问题 |采纳率82.4%解题思路:方法一:根据物质中某元素的质量分数=[该元素的相对原子质量×原子个数/该物质的相对分子质量]×100%,分别计算选项中铁元素质量分数,即可解答.
方法二:把每个化学式都变形成只含一个铁原子,与铁原子结合原子的相对原子质量的总和越大,铁元素的质量分数越小,进行解答.方法一:A、FeCl2中铁元素质量分数=[56/127]×100%=44.1%;
B、Fe2O3中铁元素质量分数=[112/160]×100%=70%;
C、Fe3O4中铁元素质量分数=[168/232]×100%=72.4%;
D、FeS中铁元素质量分数=[56/88]×100%=63.6%;
由此可知,FeCl2中铁元素质量分数最小;
故选A.
方法二:把每个化学式都变形成只含一个铁原子,与铁原子结合的氧原子的个数越少,铁原子的质量分数越大.选项中化学式变形为:FeCl2、FeO
3
2、FeO
4
3、FeS;则氯化亚铁中一个铁原子结合原子的相对原子质量总和最大,由此可知,FeCl2中铁元素质量分数最小;
故选:A.点评:
本题考点: 元素的质量分数计算.
考点点评: 掌握质量分数的计算公式以及在解题中的灵活应用的能力,难度不大.1年前查看全部
- 多少吨三氧化二铁与116t四氧化三铁的铁元素的含量相等?______.
 amiaochipi1年前3
amiaochipi1年前3 -
 蚊子乱飞 共回答了12个问题
蚊子乱飞 共回答了12个问题 |采纳率91.7%解题思路:根据三氧化二铁的化学式Fe2O3及四氧化三铁的化学式Fe3O4,要使两物质中铁元素的质量相等,两物质的粒子个数比应为3:2,即两种物质的质量满足480:464的关系.设Fe2O3的质量为x
3Fe2O3~2Fe3O4
480 464
x 116t
[480/464=
x
116t]
x=120t
故答案为:120t.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 根据物质的组成特点,分析两种物质含有等质量的某组成元素时的质量关系,此为解决本问题的简便方法.1年前查看全部
- 36克水中含H几克100千克铁矿石(含Fe2O3百分之70)中含铁元素几千克?
 zhuzhu12558211年前2
zhuzhu12558211年前2 -
 sbok 共回答了15个问题
sbok 共回答了15个问题 |采纳率86.7%(1)
2H/H2O=1/9 就是水中氢原子的质量分数
36g*(1/9)=4g 就是36克水中含H4g
(2)
100kg*70%=70kg 算出Fe2O3的质量
Fe/Fe2O3=56/160=35% 算出三氧化二铁中铁的质量分数
100Kg*35%=35kg 这个就是100千克铁矿石(含Fe2O3百分之70)中含铁元素1年前查看全部
- 在Fe2(SO4)3和FeSO4的固体混合物中,如果硫元素的质量分数为a%,则铁元素的质量分数为( )
在Fe2(SO4)3和FeSO4的固体混合物中,如果硫元素的质量分数为a%,则铁元素的质量分数为( )
A. 0.31a%
B. (100-3a)%
C. (100-4a)%
D. 2.25a% 毛胚房1年前1
毛胚房1年前1 -
 菲羊 共回答了10个问题
菲羊 共回答了10个问题 |采纳率90%解题思路:根据FeSO4和Fe2(SO4)3两物质的组成特点,可知混合物中S元素与O元素的质量比为1:2,混合物中硫元素的质量分数为22%则混合物中O元素质量分数为44%,则可计算混合物中铁元素质量分数.在FeSO4和Fe2(SO4)3组成的混合物中,硫元素与氧元素的质量比=32:(16×4)=1:2,
由于混合物中硫元素的质量分数为a%,则混合物中氧元素的质量分数=a%×2=2a%
则混合物中铁元素的质量分数=1-a%-2a%=(100-3a)%
故选B.点评:
本题考点: 元素的质量分数计算.
考点点评: 根据混合物组成中两化合物的中组成元素的特别关系,确定混合物中元素的质量分数,此类问题通过存在这种特点.1年前查看全部
- 化合物M是铁元素的+6价含氧酸钾盐,常用作净水剂与消毒剂.由铁元素的稳定氢氧化物与次氯酸钾、
化合物M是铁元素的+6价含氧酸钾盐,常用作净水剂与消毒剂.由铁元素的稳定氢氧化物与次氯酸钾、
氢氧化钾溶液反应制取化合物M,则制备M的离子方程式怎么写啊 ylcey1年前1
ylcey1年前1 -
 我的dd在杭州 共回答了21个问题
我的dd在杭州 共回答了21个问题 |采纳率95.2%离子方程式 2 Fe(OH)3 + 3 ClO- + 4 OH- = 2 FeO42- + 3 CI- + 5 H2O
化学方程式 2 Fe(OH)3 + 3 KClO + 4 KOH = 2 K2FeO4 + 3 KCI + 5 H2O
铁元素的稳定氢氧化物是Fe(OH)3,根据·化合价可知M是K2FeO4
剩下的就是配平了1年前查看全部
- 氧化铁的化学式为FEO2O3 1`求多少吨氧化铁中含有铁元素的质量为100吨2`多少吨FE2O3的含铁量与200吨四氧化
氧化铁的化学式为FEO2O3
1`求多少吨氧化铁中含有铁元素的质量为100吨
2`多少吨FE2O3的含铁量与200吨四氧化三铁的含铁量相等
(详细要公式,一步一步)
 scn80521年前1
scn80521年前1 -
 网络cc先锋 共回答了15个问题
网络cc先锋 共回答了15个问题 |采纳率93.3%1、氧化铁中铁的质量分数为112/160,用100除以质量分数得142.86t
2、200*168/232==x*112/160 x=206.9t1年前查看全部
- 推断题A-H为九种无机物 A中含有铁元素 E到F的条件是露置在空气中
 土神翁1年前1
土神翁1年前1 -
 keke豆 共回答了26个问题
keke豆 共回答了26个问题 |采纳率88.5%A:Fe B:Fe3O4 C:Fe(SO4)2 D:Fe2(SO4)3 E:Fe(OH)2 F:Fe(OH)3 G:Al2O3 H:O2 I:Al1年前查看全部
- 根据图示,回答与铁有关的问题.(1)图A为铁元素在元素周期表中的相关信息,可知铁的相对原子质量为______;(2)图B
根据图示,回答与铁有关的问题.

(1)图A为铁元素在元素周期表中的相关信息,可知铁的相对原子质量为______;
(2)图B为铁原子结构示意图,其中x的数值为______;
(3)图C为地壳中某些元素的含量(质量分数),其中含量最多的元素与铁元素组成的 化合物的化学式为______(写出一种即可). xwx10221年前1
xwx10221年前1 -
 june27 共回答了17个问题
june27 共回答了17个问题 |采纳率88.2%解题思路:(1)根据元素周期表每一方格中信息解答
(2)根据原子中质子数=核外电子数解答;
(3)根据元素化合价书写化学式.(1)根据元素周期表每一方格中的信息可知铁的相对原子质量为55.85
(2)根据原子结构示意图,铁原子的质子数为26,原子中质子数=核外电子数,故26=2+8+14+x,x=2
(3)地壳中含量最多的元素为氧元素,与铁形成氧化物的化学式为:Fe2O3或Fe3O4、FeO
故答案为:(1)55.85;(2)2; (3)Fe2O3或Fe3O4、FeO.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;化学式的书写及意义.
考点点评: 本题考查元素周期表、原子结构示意图及书写化学式的方法,属于基础知识考查.1年前查看全部
- 实验测得某磁铁矿石中四氧化三铁的质量分数为80%.利用该磁铁矿石5000吨.(假设杂质不含铁元素).炼铁厂理论上可以练出
实验测得某磁铁矿石中四氧化三铁的质量分数为80%.利用该磁铁矿石5000吨.(假设杂质不含铁元素).炼铁厂理论上可以练出含铁98%的生铁的质量是多少?
 tom02261年前1
tom02261年前1 -
 柯柯盐湖 共回答了21个问题
柯柯盐湖 共回答了21个问题 |采纳率95.2%设炼铁厂理论上可以练出含铁98%的生铁的质量为X
5000吨磁铁矿石含四氧化三铁的质量=5000吨*80%=4000吨.
4CO+ Fe3O4= 高温= 3Fe + 4CO2
232 168
4000吨 X*98%
232:168=4000吨:X*98%
解得:X=2955.7吨
答:炼铁厂理论上可以练出含铁98%的生铁的质量是2955.7吨1年前查看全部
- 在Fe 2 O 3 +3CO=Fe+3CO 2 的反应中,铁元素由+3价变为0价,碳元素由+2价变为+4价.像这类凡有元
在Fe 2 O 3 +3CO=Fe+3CO 2 的反应中,铁元素由+3价变为0价,碳元素由+2价变为+4价.像这类凡有元素化合价升降的反应都属于氧化一还原反应.据此判断下列反应属氧化一还原反应的是( )
①2Mg+O 2 ═2MgO
②2F 2 +2H 2 O═4HF+O 2
③CaCO 3 ═CaO+CO 2 ↑
④2KClO 3 ═2KCl+3O 2 ↑
⑤2NaOH+SO 2 ═Na 2 SO 3 +H 2 O.A.①②③ B.②③④ C.①②④ D.③⑤  826200001年前1
826200001年前1 -
 eqso1 共回答了10个问题
eqso1 共回答了10个问题 |采纳率100%①、反应物中,镁元素和氧元素的化合价都是0,生成物中铝元素的化合价是+2价,氧元素的化合价是-2价,属于氧化还原反应;
②、反应物中,氟元素的化合价是0价,氧元素的化合价是+2价,生成物中,氟元素的化合价是-1价,氧元素的化合价是0,属于氧化还原反应;
③、反应物和生成物中,钙元素、碳元素、氧元素的化合价都没有发生变化,不属于氧化还原反应;
④、反应物中,氧元素的化合价是-2价,生成物中,氧元素的化合价是0,属于氧化还原反应.故C错误;
⑤、在反应物和生成物中都没有元素化合价发生变化,不属于氧化还原反应.
由以上分析可知:
A、③不属于属氧化一还原反应.故A错误;
B、③不属于属氧化一还原反应.故B错误;
C、属于氧化一还原反应的是①②④.故C正确;
D、③⑤不属于属氧化一还原反应.故D错误.
故选C.1年前查看全部
- 某赤铁矿样品120克,经测定含铁元素4907克,求该赤铁矿样品中氧化铁(Fe2O3)的质量分数?
某赤铁矿样品120克,经测定含铁元素4907克,求该赤铁矿样品中氧化铁(Fe2O3)的质量分数?
是49.7克 virus0071年前1
virus0071年前1 -
 leleda 共回答了24个问题
leleda 共回答了24个问题 |采纳率91.7%相对原子质量 Fe 56 , O 16 , Fe2O3 160
由题知 Fe2O3的质量=49.7/112*160=71克
则 Fe2O3的质量分数=71/120=59.2%1年前查看全部
- 硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
A. 3.80g
B. 6.95g
C. 10g
D. 3.04g 士多啤犁1年前4
士多啤犁1年前4 -
 zongdiaodu77 共回答了23个问题
zongdiaodu77 共回答了23个问题 |采纳率95.7%解题思路:此题需要先计算硫酸亚铁的含铁质量分数,然后利用铁的质量除以铁的质量分数即可求出硫酸亚铁的质量.先计算硫酸亚铁中铁的质量分数,然后用铁的质量除以其质量分数即可.
硫酸亚铁中铁的质量分数是:[56/56+32+16×4]×100%=36.8%
需硫酸亚铁的质量是 1.12g÷36.8%=3.04g
故选D点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 此题是对化学式计算的考查,主要利用了元素的质量等于物质的质量乘以元素的质量分数的计算方法,属基础性化学计算题.1年前查看全部
- 1.Fe2O3的相对原子质量?各元素的质量比?铁元素的质量分数?
 飓风狂啸1年前1
飓风狂啸1年前1 -
 大家好我匙小叮当 共回答了17个问题
大家好我匙小叮当 共回答了17个问题 |采纳率94.1%Fe2O3的相对原子质量,应该是相对分子质量:
56*2+16*3 = 160
各元素的质量比:Fe2O3
56*2 :16*3
7 :3
铁元素的质量分数:56*2÷160 x100% = 70%1年前查看全部
- 地球一开始表面有铁元素,那土壤又是怎么来的呢.
 landd1年前1
landd1年前1 -
 georgeya 共回答了12个问题
georgeya 共回答了12个问题 |采纳率100%C Si等元素是热核反应得到的,从遥远的宇宙飘来的 金属元素也可以构成土壤1年前查看全部
- 赤铁矿的主要成分是Fe2O3,通过冶炼可以把其中的铁元素转化为铁单质.
赤铁矿的主要成分是Fe2O3,通过冶炼可以把其中的铁元素转化为铁单质.
(1)炼铁的过程属于-----(填“物理”或“化学”)变化.
(2)某地开采的赤铁矿中氧化铁的质量分数为80%(假设其它成分中不含铁元素)冶炼过程中铁元素的利用率为90%.要生产1000吨铁,需要这种铁矿石多少吨? 中场小贝隆1年前1
中场小贝隆1年前1 -
 LY-cyd 共回答了15个问题
LY-cyd 共回答了15个问题 |采纳率93.3%(1)是化学变化.
(2)需要1984.13吨.设需要x吨.则x*0.8*0.9*(56*2)/(56*2+16*3)=1000,得x=1984.131年前查看全部
- 在FeO、Fe2O3、Fe3O4三种化合物中,与等质量的铁元素相结合的氧元素的质量比______.
 音调1年前1
音调1年前1 -
 地羊 共回答了10个问题
地羊 共回答了10个问题 |采纳率90%解题思路:由三个化学式可知,铁原子的个数分别为1、2、3,求得最小公倍数为6,得到如下关系式:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁,进行解答.根据铁原子个数最小公倍数法求得:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁,由题意可知,与等质量铁元素相结合的氧元素的质量比,就是氧原子的个数比,即为6:9:8.
故答案为:6:9:8.点评:
本题考点: 元素质量比的计算.
考点点评: 两物质等质量或两物质含有等质量的某元素的相关计算选择最小公倍数法比较简便.1年前查看全部
- (12分,每空2分)(Ⅰ)一个体重50 kg的健康人含铁元 素2 g,这2 g铁元素以Fe 2+ 和Fe 3+ 的形式存
(12分,每空2分)(Ⅰ)一个体重50 kg的健康人含铁元
 素2 g,这2 g铁元素以Fe 2+ 和Fe 3+ 的形式存在。Fe 2+ 易被吸收,所以给贫血者补充铁时,应补充含Fe 2+ 的亚铁盐(如FeSO 4 )。服用维生素C可使食物中的Fe 3+ 转化成Fe 2+ ,有利于人体对铁的吸收。
素2 g,这2 g铁元素以Fe 2+ 和Fe 3+ 的形式存在。Fe 2+ 易被吸收,所以给贫血者补充铁时,应补充含Fe 2+ 的亚铁盐(如FeSO 4 )。服用维生素C可使食物中的Fe 3+ 转化成Fe 2+ ,有利于人体对铁的吸收。
⑴人体中经常进行Fe 2+ 与Fe 3+ 的转化,可表示为Fe 2+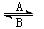 Fe 3+ 。在
Fe 3+ 。在 过程A中,Fe 2+ 作 剂,过程B中,Fe 3+ 作 剂。
过程A中,Fe 2+ 作 剂,过程B中,Fe 3+ 作 剂。
⑵“服用维生素C可使食物中的Fe 3+ 转化为Fe 2+ ”这句话指出,维生素C在这个反应中作 剂,具有 性。
(Ⅱ)有人在研究硫酸亚铁(FeSO 4 )受热分解时,作出了两种假设:
(1)假设它按KClO 3 受热分解的方式分解,反应的化学方程式为 ;
;
(2)假设它按CaCO 3 受热分解的方式分解,反应的化学方程式为 ; 热汤1年前1
热汤1年前1 -
 lsr520 共回答了12个问题
lsr520 共回答了12个问题 |采纳率83.3%1年前查看全部
- FeSO4和Fe2SO4的混合物中,硫元素质量分数为a%,求铁元素的百分含量
 不得2006不爱1年前1
不得2006不爱1年前1 -
 vivienne11 共回答了15个问题
vivienne11 共回答了15个问题 |采纳率100%解析:FeSO4, Fe2(SO4)3 从中可以看出,S和O原子之比为1:4
因为S%=a% 则有O%=4O/S *S% O%=64/32*a%=2a%
故:Fe%=1-S%-O%=1-a%-2a%=1-3a%1年前查看全部
- (2014•江宁区二模)为了测定某样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不溶于水和酸),某兴趣小组的同
(2014•江宁区二模)为了测定某样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不溶于水和酸),某兴趣小组的同学进行了如下的实验,请你参与过程分析.
【查阅资料】
1草酸(H2C2O4)在浓硫酸作用下受热分解,化学方程式为H2C2O4
CO2↑+CO↑+H2O浓硫酸 .△
2碱石灰能吸收二氧化碳和水蒸气
【实验设计及操作】用如图所示装置进行实验:
【问题讨论】
(1)装药品前应先______,实验中观察到E中现象是:固体颜色______;
(2)进入E中的气体是纯净、干燥的CO,则B、C、D中依次是______(填序号).
①浓硫酸、石灰水、氢氧化钠溶液 ②石灰水、氢氧化钠溶液、浓硫酸
③氢氧化钠溶液、石灰水、浓硫酸
(3)G的作用是______;E中反应的化学方程式是3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3;
2Fe+3CO2高温 .
(4)当E中固体完全反应后,先熄灭______灯(A、E);
(5)实验装置有一明显缺陷是:______.
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量F装置增重4.4g.则样品中氧化铁质量分数为______.
【实验反思】当观察到E中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数______(填“偏大”,“偏小”,“无影响”). 神奇之神1年前1
神奇之神1年前1 -
 鹿惊 共回答了22个问题
鹿惊 共回答了22个问题 |采纳率100%解题思路:【问题讨论】
(1)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
氧化铁是红色的,和一氧化碳反应能生成黑色的铁粉和二氧化碳;
(2)氢氧化钠溶液能够吸收二氧化碳气体,二氧化碳能使澄清石灰水变浑浊,浓硫酸具有吸水性,可以用来干燥一氧化碳;
(3)G的作用是防止空气中的二氧化碳和水蒸气干扰实验;
一氧化碳和氧化铁在高温条件下反应能生成铁和二氧化碳;
(4)当E中固体完全反应后,为了防止液体倒吸入A装置,应该先熄灭E处的酒精灯;
(5)一氧化碳有毒,扩散到空气中会污染环境;
【数据处理】
F装置增重的部分即为生成二氧化碳的质量,根据二氧化碳的质量可以计算氧化铁的质量,进一步可以计算样品中氧化铁的质量分数;
【实验反思】
当观察到E中固体全部变黑后,若立即停止通CO,则反应生成的二氧化碳不能被F装置完全吸收.【问题讨论】
(1)装药品前应先检查装置气密性,实验中观察到E中现象是:固体颜色由红色变成黑色.
故填:检查装置气密性;由红色变成黑色.
(2)进入E中的气体是纯净、干燥的CO,则B、C、D中依次是氢氧化钠溶液、石灰水、浓硫酸.
故填:③.
(3)G的作用是防止空气中的二氧化碳和水蒸气进入F;E中反应的化学方程式是3CO+Fe2O3
高温
.
2Fe+3CO2.
故填:防止空气中的二氧化碳和水蒸气进入F;3CO+Fe2O3
高温
.
2Fe+3CO2.
(4)当E中固体完全反应后,先熄灭E处的酒精灯.
故填:E.
(5)实验装置明显缺陷是没有处理尾气.
故填:没有处理尾气.
【数据处理】
设氧化铁的质量为x,
3CO+Fe2O3
高温
.
2Fe+3CO2,
160 132
x 4.4g
[160/x]=[132/4.4g],
x=5.3g,
则样品中氧化铁质量分数为:[5.3g/8.0g]×100%=66.7%,
故填:66.7%.
【实验反思】
当观察到E中固体全部变黑后,若立即停止通CO,会导致生成的二氧化碳不能被F装置完全吸收,则测得的样品中氧化铁的质量分数会偏小.
故填:偏小.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;一氧化碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.1年前查看全部
- 铁元素在化合价中有两种化合价(+2和+3),请写出两种价态铁元素组成的碱:化学式———名称——;化学式——名称——
 ed453c9214077c631年前3
ed453c9214077c631年前3 -
 雨夜郎 共回答了23个问题
雨夜郎 共回答了23个问题 |采纳率87%Fe(OH)3:氢氧化铁
Fe(OH)2:氢氧化亚铁1年前查看全部
- 一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收.所以给贫血者补充
一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收.所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.请回答下列问题:
(1)维生素C可使食物中的Fe3+转化成Fe2+,在此过程中______是氧化剂,说明维生素C具有______性.
(2)已知下列反应:①H2O2+2Fe3+═2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+═2Fe3++2H2O.反应①中生成1mol O2转移电子的物质的量为______,反应①、②的总反应方程式为______,在该反应中Fe3+的作用为______. 花花朵朵在人间1年前1
花花朵朵在人间1年前1 -
 油离配合 共回答了16个问题
油离配合 共回答了16个问题 |采纳率87.5%解题思路:(1)根据氧化还原反应中化合价变化判断:氧化剂化合价降低,具有氧化性;还原剂化合价升高,具有还原性;
(2)根据方程式中化合价的变化判断;催化剂在反应前后质量不变,性质不变.(1)维生素C可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+ 是氧化剂,维生素C是还原剂,则维生素C具有还原性,故答案为:Fe3+;还原;(2)H2O2+2Fe3+═2Fe2++O2↑+2H+,氧元素从-1价升高到0价,...
点评:
本题考点: 铁盐和亚铁盐的相互转变;氧化还原反应.
考点点评: 本题考查了氧化还原反应中氧化剂和还原剂概念的辨析,氧化还原反应中转移电子数的求算,催化剂的判断,会运用题目所给予的信息解决问题,即会用知识迁移的方法解决问题,题目难度不大.1年前查看全部
- 在Fe2O3+3CO 高温 . 2Fe+3CO2 的反应中,铁元素由+3价变为0
在Fe2O3+3CO
2Fe+3CO2 的反应中,铁元素由+3价变为0价,碳元素由+2价变为+4价.像这类凡有元素化合价升降的反应都属于氧化还原反应,判断下列反应一定不属于氧化还原反应的是( )高温 .
A.4Al+3O2
2Al2O3点燃 .
B.C+2CuO
2Cu+CO2↑高温 .
C.2H2O
2H2↑+O2↑通电 .
D.NaOH+HCl═NaCl+H2O jianshuairumian1年前1
jianshuairumian1年前1 -
 世界真蓝 共回答了16个问题
世界真蓝 共回答了16个问题 |采纳率93.8%解题思路:在单质中,元素化合价是0;在化合物中,元素化合价的代数和是0,可以根据这一原则求出化合物中各种元素的化合价.然后进行判断是否是氧化还原反应.A、反应物中,铝元素和氧元素的化合价都是0,生成物中铝元素的化合价是+3价,氧元素的化合价是-2价,属于氧化还原反应.故A错误;
B、反应物中,碳元素的化合价是0价,铜元素的化合价是+2价,生成物中,碳元素的化合价是+4价,铜元素的化合价是0,属于氧化还原反应.故B错误;
C、反应物中,氢元素的化合价是+1价,氧元素的化合价是-2价,生成物中,氢元素的化合价是0价,氧元素的化合价是0,属于氧化还原反应.故C错误;
D、反应物和生成物中,钠元素、氯元素、氧元素、氢元素的化合价都没有发生变化,不属于氧化还原反应.故D正确.
故选D.点评:
本题考点: 氧化反应;还原反应.
考点点评: 可以根据具体的化学方程式中各种物质所含有的元素化合价方面进行分析、判断,从而得出正确的结论.1年前查看全部
- →用化学符号和数字表示:三个水分子,两个硫原子,两个铜离子,三个硫酸根离子,四个亚铁离子,四个铁原子,铁元素的化合价为+
→用化学符号和数字表示:三个水分子,两个硫原子,两个铜离子,三个硫酸根离子,四个亚铁离子,四个铁原子,铁元素的化合价为+3,3个二氧化硫分子,钙离子,+5价的磷元素.
 西门停电1年前1
西门停电1年前1 -
 sqli1506 共回答了16个问题
sqli1506 共回答了16个问题 |采纳率87.5%3H2O;2S;2Cu2+;3SO4(右上角标2-);4Fe2+;4Fe;Fe(正上方标+3);3SO2;Ca2+;P((正上方标+5)1年前查看全部
- 判断氧化剂与还原剂?氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可
判断氧化剂与还原剂?
氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可以做还原剂? onlyhanyan1年前5
onlyhanyan1年前5 -
 雪rr嫩 共回答了14个问题
雪rr嫩 共回答了14个问题 |采纳率85.7%氧化剂和还原剂的判断一般是在具体的化学反应中来说的,在化学反应中,只要有升价此物质即为还原剂,有降价即为氧化剂.(如H2+O2).
如果单从物质判断,那么就要判断此元素是否还可以升价(还原性)或降价(氧化性)
如Cl元素,最高价为+7 ,最低位-1价,当Cl处于+1,+3,+5价时(2价Fe也是),均具有氧化性和还原性,因为均可再升或再降.当元素处于最低或最高价时,没有氧化性(不能再降)和还原性(不能再升).1年前查看全部
- 赤铁矿中含三氧化二铁的质量分数为80%,求铁矿石中含铁元素的质量分数(铁矿石中所含杂质不含铁元素)
 噗噗可1年前1
噗噗可1年前1 -
 带暗兮后群惊 共回答了14个问题
带暗兮后群惊 共回答了14个问题 |采纳率85.7%铁元素=56×2÷(56×2+16×3)×80%=56%1年前查看全部
- 检验铁脱氧剂使用后固体中含有+3价铁元素的化学方法?
 760456901年前1
760456901年前1 -
 思顽 共回答了20个问题
思顽 共回答了20个问题 |采纳率80%溶解,加KSCN,变红,说明有三价铁离子1年前查看全部
大家在问
- 1高中英语单选练习什么好
- 2一条直线l1与曲线y=(x-1)(x-2)(x-3)(x-4)(x-5)相切于(1,0)则直线l的方程为?
- 3作者说戏中有戏的意思是什么 永远的雷雨
- 4求一道逻辑题解答已知命题:若一个数的平方是1,则这个数是1.求此命题的否定命题,并判断原命题和否定命题的真假.再写出否定
- 5如果m-(5+2n)=15,那么2m-4n等于
- 6What are your academic strengths?
- 7英语翻译在我的实习期间,我一直都是大胆的说英语,经常和同事以及老人沟通聊天,所以口语能力每天都在进步.我们每个员工还要认
- 8中译英 2句1,他没有报名参加这次面试,这使他失去一份薪水丰厚的工作 ( which sign up for)2,一开始
- 9写信告诉你的朋友怎么到你家 (英语)要求在图片里了 语法什么的一定要对的啊 看的好的会加分的
- 10材料一:2010年10月18日,中共十七届五中全会审议通过了《中共中央关于制定国民经济和社会发展第十二个五年规划的建议》
- 11空气是一种重要的自然资源,下列关于空气的说法正确的是( ) A.空气是由多种气体组成的混合物 B.空气中大部分的气体是
- 12西夏文语法使用方法
- 13a few 、a little、a bit 、a bit of等那些后面加可数名词。哪些加不可数名词?求大神详解!
- 14一次数学测验中,某小组一共有八人,他们的平均分是82.5分,考卷发下来,王丽发现老师批错了一题,这样王丽的成绩上升4分,
- 15请教一道题,高手老师进三棱锥Pabc的顶点P在底面ABC上的射影是底面Rt△ABC斜边AC的中点O.若PA=PB=1,B