配平时,能否改动化学式中右下角的数字
 ----天马行空2022-10-04 11:39:545条回答
----天马行空2022-10-04 11:39:545条回答
已提交,审核后显示!提交回复
共5条回复
 绿荳蔸 共回答了17个问题
绿荳蔸 共回答了17个问题 |采纳率100%- 不可以,化学式是按照规定用元素符号来表示物质及物质组成的式子,配平时只能改变化学式前方的系数,如:H2O→H2+O2(箭头上标通电),将这个反应式变成方程式:2H2O=2H2↑+O2↑(等号上标通电)也就是说,如果改变了下脚标,就等于改变了物质,表达就不正确了.
- 1年前
 杨过vs 共回答了5个问题
杨过vs 共回答了5个问题 |采纳率- 不能,因为生成物或反应物是定的
- 1年前
 冰上枫叶 共回答了3个问题
冰上枫叶 共回答了3个问题 |采纳率- 不能,因为要遵循客观事实,生成物是什么就是什么,如果改变了就会改变这个物质本身了
- 1年前
 夕颜girl 共回答了234个问题
夕颜girl 共回答了234个问题 |采纳率- 当然不可以,化学式右下角的数字代表原子的个数,物质的化学式是确定的,配平改变的是化学式前的化学计量数
- 1年前
 wwbbdd521 共回答了430个问题
wwbbdd521 共回答了430个问题 |采纳率- 当然不能了
- 1年前
相关推荐
- 这个化学方程式为什么不用配平?这个化学方程式中原子数量最多的原子是O.为什么不用最小公倍数法配平?
这个化学方程式为什么不用配平?

这个化学方程式中原子数量最多的原子是O.为什么不用最小公倍数法配平?
 hewentian1年前2
hewentian1年前2 -
 fsdf454 共回答了17个问题
fsdf454 共回答了17个问题 |采纳率76.5%化学方程式的配平是根据质量守恒定律,在化学式前面配上适当的化学计量数,使式子左、右两边的每一种元素的原子数目相等.
这个化学方程式左右两边的原子种类与数目已经相等了,所以,不用配了1年前查看全部
- 氧化铝与氢氧化钠反应如何配平
 工8391年前1
工8391年前1 -
 酸辣米豆腐 共回答了15个问题
酸辣米豆腐 共回答了15个问题 |采纳率100%反应实质是氧化铝和水有微弱的反应生成氢氧化铝,氢氧化铝和氢氧化钠反使平衡正移.写的时候可以先AL2O3+3H2O=2AL(OH)3 2AL(OH)3+2NaOH=2NaAlO2+2H20 相加即可1年前查看全部
- 将下列化学反应文字表达式用化学方程式写出来并配平.写的好再加100分
将下列化学反应文字表达式用化学方程式写出来并配平.写的好再加100分
一定要用化学方程式写,一定要配平
1.镁+氧气—(点燃)—>氧化镁
2.碳+氧气—(点燃)—>二氧化碳
3.红磷+氧气—(点燃)—>五氧化二磷
4.硫+氧气—(点燃)—>二氧化硫
5.铁+氧气—(点燃)—>四氧化三铁
6.过氧化氢—(二氧化锰)—>水+氧气
7.氯酸钾—(二氧化锰 加热)—>氯化钾+氧气
8.高锰酸钾—(加热)—>锰酸钾+二氧化锰+氧气
9.水—(通电)—>氢气+氧气
10.铁+硫酸铜——>铜+硫酸亚铁
11.碳酸钠+盐酸——>氯化钠+二氧化碳+水
12.石蜡+氧气—(点燃)—>二氧化碳+水
写的好的话再加你100分,谢谢各位大哥大姐
如果可以的话把配平的过程写写,,,,如果方程式有过程的话也可以写写... 可爱的小仔儿1年前12
可爱的小仔儿1年前12 -
 Yoki1978 共回答了22个问题
Yoki1978 共回答了22个问题 |采纳率90.9%1 二个镁原子和一个氧气分子在点燃的条件下反应 生成两个氧化镁分子
2Mg + O2 =点燃= 2MgO
2 一个碳原子和一个氧分子在点燃的条件下反应 生成一个二氧化碳分子
C + O2 =点燃= CO2
3 四个磷原子和五个氧分子在点燃的条件下反应 生成两个五氧化二磷分子
4P + 5O2 = 2P2O5
4 一个硫原子和一个氧分子在点燃的条件下反应 生成一个二氧化硫分子
S + O2 =点燃= SO2
5 三个铁原子和两个氧分子在点燃的条件下反应 生成一个四氧化三铁分子
3Fe + 2O2 =点燃= Fe3O4
6 两个过氧化氢分子在二氧化锰催化的条件下反应 生成两个水分子和一个氧分子 2H2O2 =MnO2= 2H2O + O2↑
7 两个氯酸钾分子在二氧化锰催化和加热条件下反应 生成两个氯化钾分子和三个氧分子 2KClO3 =MnO2加热= 2KCl + 3O2↑
8 两个高锰酸钾分子在加热条件下反应 生成一个锰酸钾分子 一个二氧化锰分子和一个氧分子 2KMnO4 =加热= K2MnO4 + MnO2 + O2↑
9 两个水分子在通电的条件下反应 生成两个氢分子和一个氧分子
2H2O =通电= 2H2↑ + O2↑
10 一个铁原子和一个硫酸铜分子反应 生成一个铜原子和一个硫酸亚铁分子
Fe + CuSO4 = Cu + FeSO4
11 一个碳酸钠分子和两个氯化氢分子反应 生成两个氯化钠分子 一个二氧化碳分子和一个水分子 Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
12 石蜡和氧气在点燃的条件下反应 生成二氧化碳和水
(石蜡是混合物 无分子式 无化学方程式)
累啊!1年前查看全部
- 铁与硫酸生成硫酸亚铁和氢气 求解这反应物中没氢元素啊 配平
 雨桐12191年前5
雨桐12191年前5 -
 庶吉士 共回答了17个问题
庶吉士 共回答了17个问题 |采纳率94.1%Fe+H2SO4=FeSO4+H2
氢气来源于硫酸中的氢离子1年前查看全部
- 化学方程式中的配平是怎样配的?最好举例子说明一下
化学方程式中的配平是怎样配的?最好举例子说明一下
老师教我的我都听不懂啊 毛毛的tt1年前1
毛毛的tt1年前1 -
 哆啦-A梦 共回答了25个问题
哆啦-A梦 共回答了25个问题 |采纳率92%化学方程式的配平有多种方法:
1、观察法:这种方法对一些简单的方程式往往凑效.事实上就是有目的地凑数进行配平,也往往有奇偶法等的因素存在.这种方法对任何种类的方程式都可能用得着.
2、电荷平衡法:这种方法对离子方程式最有用.在离子方程式中,除了难溶物质、气体、水外,其它的都写成离子形式,首先让方程两端的电荷相等,再用观察法去配平水、气体等.这种方法一般不失手.但对氧化还原方程式却太好用.
3、氧化还原法:这种方法是针对氧化还原方程式来说的.在这里记住:“化合价升高失去氧化还原剂”.与之对应的是“化合价降低得到还原氧化剂”.具体用法是:
(1)在元素的化合价的变化的元素上部标出它的化合价,分清谁的升高,谁的降低.
(2)相同元素之间用线连起,找出并标上升高的电荷数或降低的电荷数.
(3)找最小公倍数,并分别乘在升高或降低的电荷数后.
(4)配平:把各自相乘的最小公倍数写在各自的化学式前(即系数).并注意这些化合价变化的元素在化学变化前后是否相等,一般来说,如果不相等,是整倍数地差.
(5)配合观察法,将其它的确良如水、生成的不溶物等配平.
化学方程式的配平方法:
化学变化过程中,必然遵循质量守恒定律,即反应前后元素种类与原子个数相等.
常用的配平化学方程式的方法有:
(1)最小公倍数法:
在配平化学方程式时,观察反应前后出现”个数”较复杂的元素,先进行配平.先计算出反应前后该元素原子的最小公倍数,用填化学式前面化学计量数的方法,对该原子进行配平,然后观察配平其他元素的原子个数,致使化学反应中反应物与生成物的元素种类与原子个数都相等.
例如:教材介绍的配平方法,就是最小公倍数法.在P+O2――P2O5反应中先配氧:最小公倍数为10,得化学计量数为5与2,P+5O2――2P2O5;再配平磷原子,4P+5O2==2P2O5.
(2)观察法:
通过对某物质的化学式分析来判断配平时化学计量数的方法.
例如:配平Fe2O3+CO――Fe+CO2.在反应中,每一个CO结合一个氧原子生成CO2分子,而Fe2O3则一次性提供三个氧原子,因而必须由三个CO分子来接受这三个氧原子,生成三个CO2分子即Fe2O3+3CO――Fe+3CO2,最后配平方程式Fe2O3+3CO==2Fe+3CO2,这种配平方法是通过观察分析Fe2O3化学式中的氧原子个数来决定CO的化学计量数的,故称为观察法.
(3)奇数变偶数法:
选择反应前后化学式中原子个数为一奇一偶的元素作配平起点,将奇数变成偶数,然后再配平其他元素原子的方法称为奇数变偶数法.
例如:甲烷(CH4)燃烧方程式的配平,就可以采用奇数变偶数法:CH4+O2――H2O+CO2,反应前O2中氧原子为偶数,而反应后H2O中氧原子个数为奇数,先将H2O前配以2将氧原子个数由奇数变为偶数:CH4+O2――2H2O+CO2,再配平其他元素的原子:CH4+2O2==2H2O+CO2.
(4)归一法:
找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.
例如:甲醇(CH3OH)燃烧化学方程式配平可采用此法:CH3OH+O2――H2O+CO2,显然决定生成H2O与CO2的多少的关键是甲醇的组成,因而定其计量数为1,这样可得其燃烧后生成H2O与CO2的分子个数:CH3OH+O2――2H2O+CO2.然后配平氧原子:CH3OH+3/2O2===2H2O+CO2,将各计量数同乘以2化分为整数:2CH3OH+3O2==4H2O+2CO2.
需要注意的是,不论用何种方法配平化学方程式,只能改动化学式前面的化学计量数,而决不能改动化学式中元素右下角的数字.因为改动元素符号右下角的数字即意味着改动反应物与生成物的组成,就可能出现根本不存在的物质或改变了原有化学变化的反应物或生成物,出现根本不存在的化学变化.1年前查看全部
- 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平): KMnO 4 + FeSO 4 + H
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平): KMnO 4 + FeSO 4 + H高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
KMnO 4 + FeSO 4 + H 2 SO 4 = K 2 SO 4 + MnSO 4 + Fe 2 (SO 4 ) 3 + H 2 O
下列说法正确的是A.MnO 4 - 是氧化剂,Fe 3+ 是还原产物 B.Fe 2+ 的还原性强于Mn 2+ C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成 D.生成1mol水时,转移2.5mol电子
 网名太长不好记11年前1
网名太长不好记11年前1 -
 deicai 共回答了16个问题
deicai 共回答了16个问题 |采纳率87.5%B
试题分析:A、MnO 4 - 是氧化剂,Fe 3+ 是氧化产物,错误;B、还原剂还原性强于还原产物,正确;C、KSCN溶液与Fe 3+ 反应生成配离子溶液,不是沉淀,错误;
D、 2 KMnO 4 + 10 FeSO 4 + 8 H 2 SO 4 = 1 K 2 SO 4 + 2 MnSO 4 + 5 Fe 2 (SO 4 ) 3 + 8 H 2 O(反应有10个电子转移)计算生成1mol水时,转移10÷8=1.25mol电子,错误。1年前查看全部
- 磷酸一氢盐或磷酸盐和氢离子反应生成磷酸二氢盐 Ca(HPO4)2+H+ 如何反应配平
 夏天的味道a1年前1
夏天的味道a1年前1 -
 13608584173 共回答了15个问题
13608584173 共回答了15个问题 |采纳率93.3%2CaHPO4 + 2H+ = Ca(H2PO4)2 + Ca2+1年前查看全部
- ( )Al+( )Fe2O3(高温)=( )Al2O3+( )Fe 配平
 Google测试员30321年前3
Google测试员30321年前3 -
 bj1e 共回答了22个问题
bj1e 共回答了22个问题 |采纳率90.9%(2 )Al+(1 )Fe2O3(高温)=( 1)Al2O3+(2 )Fe
1不用写出来
2Al+Fe2O3(高温)=Al2O3+2 Fe1年前查看全部
- 亚硫酸钠使溴水褪色的化学方程式(要配平和注明反应条件)?
 tlzhang1年前1
tlzhang1年前1 -
 糊涂看天下 共回答了12个问题
糊涂看天下 共回答了12个问题 |采纳率91.7%Na2SO3+Br2+H2O→Na2SO4+2HBr(无反应条件)1年前查看全部
- 配平 Zn+HNO3---Zn(NO3)2+NH4NO3+H2O 用化合价升降法
 htmm1年前2
htmm1年前2 -
 ljh770617 共回答了18个问题
ljh770617 共回答了18个问题 |采纳率94.4%化学方程式为:4Zn+10HNO3---4Zn(NO3)2+1NH4NO3+3H2O
锌升2价,氮(转化为铵根)降8价
4Zn+HNO3---Zn(NO3)2+1NH4NO3+H2O
把锌配平
4Zn+HNO3---4Zn(NO3)2+1NH4NO3+H2O
把氮配平
4Zn+10HNO3---4Zn(NO3)2+1NH4NO3+H2O
最后全部配平
4Zn+10HNO3---4Zn(NO3)2+NH4NO3+3H2O
不懂在想我追问.
多谢!1年前查看全部
- 配平;Cu2S+HNO3_Cu(NO3)2+H2SO4+NO+H2O.请写出祥细过程和结果,谢谢了
 斜阳春愁1年前2
斜阳春愁1年前2 -
 davidleelei 共回答了23个问题
davidleelei 共回答了23个问题 |采纳率91.3%3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO+8H2O
Cu2S中的2个Cu由+1价升高到+2价,失去2个电子,1个S由-2价升高到+6价,失去8个电子,还原剂共失去2+8=10个电子;HNO3中的N由+5价降低到+2价,得到3个电子,氧化剂共得到3个电子.
所以Cu2S前面填3,HNO3前面填10
然后看等号后面:Cu(NO3)2前面应该是3*2=6;H2SO前面是3,NO前面是10.
由于6Cu(NO3)2中有6*2=12个未参加氧化还原的NO3-,所以前面HNO3的系数为10+12=22.
最后配平H和O就可以了.1年前查看全部
- H2S与H2SO4反应 方程式 配平
 tjnju1年前1
tjnju1年前1 -
 hu21h 共回答了14个问题
hu21h 共回答了14个问题 |采纳率92.9%H2S + 3 H2SO4(浓) ==加热== 4 SO2(气体) + 4 H2O
不加热的话:H2S + H2SO4(浓) ==== S(沉淀) + SO2(气体) + 2 H2O
3 H2S+H2SO4=4 S+4 H2O
如果H2SO4过量那么2 H2SO4+S=3 SO2+2 H2O,总反应就是3 H2S+9 H2SO4=12 SO2+12 H2O
也就是说,H2S过量则生成S,3 H2S+H2SO4=4 S+4H2O
H2SO4过量则生成SO2,3 H2S+9 H2SO4=12 SO2+12 H2O
PS这里都是浓硫酸1年前查看全部
- (9)C2H2+02 ———→C02+H20的配平
 中年张三丰1年前1
中年张三丰1年前1 -
 mmptede 共回答了13个问题
mmptede 共回答了13个问题 |采纳率100%2,5,4,21年前查看全部
- Ca(OH)2+CO2→CaCO3+H2O配平
 lago174791年前3
lago174791年前3 -
 fabiozhe 共回答了19个问题
fabiozhe 共回答了19个问题 |采纳率100%Ca(OH)2+CO2==CaCO3↓+H2O
平的1年前查看全部
- 现有一未配平的氧化还原反应:KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X(1)该反应的还原剂是__
现有一未配平的氧化还原反应:
KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X
(1)该反应的还原剂是______.
(2)已知0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式是______.
(3)根据上述反应可推知______(填写序号).
A.氧化性:KClO3>H3PO4
B.氧化性:H3PO4>KClO3
C.还原性:PH3>X
D.还原性:X>PH3. 什么名字可以用1年前1
什么名字可以用1年前1 -
 乐乐的心情 共回答了14个问题
乐乐的心情 共回答了14个问题 |采纳率100%解题思路:(1)P元素的化合价由-3价升高为+5价,含元素化合价升高的物质为还原剂;
(2)设X中Cl的化合价为x,利用化合价的变化计算转移电子数;
(3)氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性.(1)P元素的化合价由-3价升高为+5价,含元素化合价升高的物质为还原剂,则PH3为还原剂,故答案为:PH3;
(2)设X中Cl的化合价为x,则0.2mol×(5-x)=1mol,解得x=0,则X的化学式是Cl2,故答案为:Cl2;
(3)氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,Cl元素的化合价降低,P元素的化合价升高,则KClO3为氧化剂,Cl2为还原产物,还原剂为PH3,氧化产物为H3PO4,则氧化性为KClO3>H3PO4,还原性为PH3>X,故答案为:AC.点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及规律性知识的考查,题目难度不大.1年前查看全部
- 化学方程式方法,归一式的解答四)归一法 找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平
化学方程式方法,归一式的解答
四)归一法 找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.选择化学方程式中组成最复杂的化学式,设它的系数为1,再依次推断.
第一步:设NH3的系数为1 1NH3+O2——NO+H2O 第二步:反应中的N原子和H原子分别转移到NO和H2O中,由此可得1NH3+O2——NO+3/2 H2O 第三步:由右端氧原子总数推O2系数1NH3+5/4O2——NO+3/2 H2O
第四步:取最小公倍数相乘 4NH3+5O2===4NO+6H2O.中第三步为何氧原子相加是5/4,而不是5/2?
奇偶配平法
这种方法适用于化学方程式两边某一元素多次出现,并且两边的该元素原子总数有一奇一偶,例如:C2H2+O2→CO2+H2O,此方程式配平先从出现次数最多的氧原子配起.O2内有2个氧原子,无论化学式前系数为几,氧原子总数应为偶数.故右边H2O的系数应配2(若推出其它的分子系数出现分数则可配4),由此推知C2H2前2,式子变为:2C2H2+O2→CO2+2H2O,由此可知CO2前系数应为4,最后配单质O2为5,把短线改为等号,写明条件即可:
2C2H2+5O2==4CO2+2H2O
用简单的语言概括一下,并举几个例子.我是刚学化学方程式的.很多不懂,请大大有空多教教Q:337698177 shalifei27271年前1
shalifei27271年前1 -
 冬眠的 共回答了23个问题
冬眠的 共回答了23个问题 |采纳率95.7%右边的氧原子一共是3/2(来自H2O)+1(NO)=5/2个
左边的反应物是O2分子,所以要除以2,是5/4个1年前查看全部
- (1)配平下列反应方程式:__NaIO 3 +___NaHSO 3 →___I 2 +Na 2 SO 4 +___H 2
(1)配平下列反应方程式:
__NaIO 3 +___NaHSO 3 →___I 2 +Na 2 SO 4 +___H 2 SO 4 +_____H 2 O
废旧金属的回收再利用是保护自然资源的有力措施。一批成分不详的合金废料,为了确定其成分和再利用途径,探究性学习小组拟定以下方案进行实验分析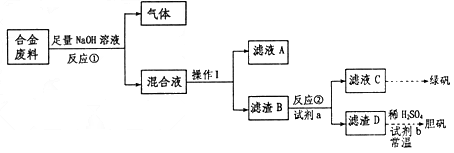
请回答下列问题:
(2)从上述信息知,该合金中可确定的成分有__________________;(填化学式)
(3)滤渣D中加入稀硫酸和试剂b,常温下可制得胆矾,是一种绿色化学工艺,则试剂b是______________;写出总反应方程式__________________________;
(4)甲、乙两同学都验证了反应①生成气体是氢气,甲同学推断滤液A应是NaAlO 2 ;乙同学查阅资料得知硅与NaOH溶液反应也有H 2 放出,因此持不同意见,请你设计一最佳方案,帮助他们作一确证:(写出选用试剂、实验判断现象及得出结论) ________________________________________________________________________
(5)取质量均为m g的滤渣B四份,分别加入同浓度,不同体积的稀HNO 3 充分反应,在标准状况生成NO(设还原产物只有一种)体积与剩余固体金属的质量如下表
①实验1溶解的金属是________;质量为____________g;
②写出实验4中金属恰好溶解后,发生反应的离子方程式:______________________。实验4中V的数值为________. 心中暖暖1年前1
心中暖暖1年前1 -
 dingding2003 共回答了20个问题
dingding2003 共回答了20个问题 |采纳率90%(1)4102732
(2)Fe、Cu
(3)H 2 O 2 ;Cu+H 2 O 2 +H 2 SO 4 ==CuSO 4 +2H 2 O
(4)取少量混合液A于试管中,逐滴滴加稀盐酸至过量。先生成白色沉淀,过量,若沉淀完全溶解,则只有Al;若沉淀部分溶解,则Al、Si都有;若沉淀始终不溶,则只有Si
(5)①Fe;4.2;②3Fe 2+ +NO 3 - +4H + ==3Fe 3+ +NO↑+2H 2 O;4.481年前查看全部
- 过氧化氢生成水和氧气怎样配平MnO2 H2O2 -----→H2O + O2 ↑这个怎样配平?教教我,我才刚刚升初三!
 rainfieldstone1年前1
rainfieldstone1年前1 -
 常悠悠 共回答了21个问题
常悠悠 共回答了21个问题 |采纳率71.4%MnO2
2H2O2==2H2O+O2
二氧化锰是催化剂.1年前查看全部
- 配平和完成下列化学方程式:(1) P+ FeO P2O5+ Fe(2) Fe(红热)+ H2O(气)—— Fe3O4+
配平和完成下列化学方程式:
(1) P+
P+ FeO
FeO
 P2O5+
P2O5+ Fe
Fe
(2) Fe(红热)+
Fe(红热)+  H2O(气)——
H2O(气)—— Fe3O4+
Fe3O4+ H2
H2
(3) N2+
N2+ H2——
H2—— NH3
NH3
(4) Al+
Al+ Fe3O4——
Fe3O4—— Fe+
Fe+ Al2O3
Al2O3 leileiqiu1年前1
leileiqiu1年前1 -
 川林竹叶 共回答了14个问题
川林竹叶 共回答了14个问题 |采纳率85.7%1年前查看全部
- PbO2+Mn(NO3)2+ ( ) = Pb(NO3)2+ HMnO4+H2O的配平
 紫vv回忆1年前1
紫vv回忆1年前1 -
 那条美丽的小河 共回答了18个问题
那条美丽的小河 共回答了18个问题 |采纳率88.9%5PbO2+2Mn(NO3)2+ 6HN03 = 5Pb(NO3)2+ 2HMnO4+2H2O
先用化合价升降法确定铅和锰的系数,再用待定系数法确定其他系数,至于为什么与硝酸反应,因为最终结果是生成水.1年前查看全部
- 用待定系数法 配平(顺便帮着解下方程)
用待定系数法 配平(顺便帮着解下方程)
小弟 先请教一个问题 2a=c
2a=2d
2b=2c+d 这个 方程组该怎样解 (小弟需要详细的步骤与解析.)
帮小弟用待定系数法配一个方程式
FE+CUCL2=CU+FECL2
(小弟需要配平的步骤) 可能我的需要有些多,但我想好心的大哥大姐们会帮助小弟的 谢谢了! rainbow_sz1年前1
rainbow_sz1年前1 -
 深圳蔚蓝海岸 共回答了19个问题
深圳蔚蓝海岸 共回答了19个问题 |采纳率84.2%例:a Fe+b H2O + c O2=d Fe(OH)3
1、先在每个反应物及生成物前面写上待定的系统,根据质量守恒定律由各元素的原子总数反应前后总数不变,列出方程组:
a=d (1) 此式是由Fe守恒得到的
2b=3d (2) 此式是由H守恒得到的
b+2c=3d (3) 此式是由O守恒得到的
2、方程组中待定系数的求
先假设一个未知数为1,如a=1,由将a代入(1)式得d=1,将d代入(2)式得b=3/2,将b和d代入(3)式得c=3/4.因为b和c的分母的最小公倍数为4,一般方程式系数不宜用分数形式表示,因此再将各系统乘以4得到a=4、b=6、c=3、d=4,最终方程式如下:4 Fe+6 H2O + 3 O2=4 Fe(OH)3
例:a Fe+b CuCl2=c Cu+d FeCl2
a=d (1) 此式是由Fe守恒得到的
b=c (2) 此式是由Cu守恒得到的
2b=2d (3) 此式是由Cl守恒得到的
待定系数法求
先假设一个未知数为1,如a=1,由将a代入(1)式得d=1,将d代入(3)式得b=1,将b代入(2)式得c=1.最后所得方程式为:Fe+ CuCl2= Cu+ FeCl21年前查看全部
- Fe2+ +Na2O2 +H2O=Fe(OH)3 +O2 +Na+这个化学方程式如何根据电子守恒来配平?
 徐祖琴1年前3
徐祖琴1年前3 -
 believe2008 共回答了17个问题
believe2008 共回答了17个问题 |采纳率94.1%Fe2+ +Na2O2 +3/2H2O=Fe(OH)3 +1/4O2 +2Na+
再两边同乘以4去分母得
4Fe2+ +4Na2O2 +6H2O=4Fe(OH)3 +O2 +8Na+1年前查看全部
- 高中化学 FE(NO3)3受热分解的化学方程式怎么写及配平方法
 七20051年前4
七20051年前4 -
 罗钦文 共回答了16个问题
罗钦文 共回答了16个问题 |采纳率81.3%先搞清楚产物,生成氧化铁,NO2,O2。
Fe(NO3)3=△=Fe2O3+NO2↑+O2↑
这个方程中,各个元素的化合价都比较容易确定,所以不需要用特殊方法配平。就用常规的得失电子守恒来配就好了。
铁元素为变价。N元素从硝酸根中+5价得1e变为NO2,O元素从硝酸根中的-2价失2e。
欲使得失电子守恒,则NO2:O2=4:1这个是配平的核心。 ...1年前查看全部
- 请帮我把这道化学方程式配平:CH4+O2--------CO2+H20
 syj_sol1年前1
syj_sol1年前1 -
 纸上韶华 共回答了21个问题
纸上韶华 共回答了21个问题 |采纳率76.2%根据元素守恒CH4+2O2=CO2+2H2O1年前查看全部
- 铝与稀硫酸和稀盐酸反应化学式分别是什么?要配平哦
 中文和数字1年前1
中文和数字1年前1 -
 南方茶网 共回答了19个问题
南方茶网 共回答了19个问题 |采纳率89.5%2Al+3H2SO4=Al2(SO4)3+3H2
2Al+6HCl=2AlCl3+3H21年前查看全部
- 教教我吧我是个初中生 要化学竞赛了 可是我不会配平酸式盐与碱式盐.教教我吧比如碱式碳酸铜cu2(oh)2co3 是怎么配
教教我吧
我是个初中生 要化学竞赛了 可是我不会配平酸式盐与碱式盐.教教我吧
比如碱式碳酸铜cu2(oh)2co3 是怎么配平的.那两个2怎么来的
我还是不懂嘞! du7e1年前2
du7e1年前2 -
 达令 共回答了26个问题
达令 共回答了26个问题 |采纳率84.6%这是在写化学式,不是配平
铜是正二价,氢氧根是负一价,碳酸根是负二价
如果直接是碳酸铜的话就是CuCO3,但加上了氢氧根,因为氢氧根和碳酸根的化合价都是负的,所以不会再加上碳酸根,所以铜的数量会增加,一个铜正好对两个氢氧根,所以再加一个铜和两个氢氧根,所以是Cu2(OH)2CO3.就是这么来的.1年前查看全部
- 谁能帮我配平这几个化学反应方程式
谁能帮我配平这几个化学反应方程式
C2H4O2+K2Cr2O7+H2SO4----K2SO4+Cr2(SO4)3+CO2+H2O
K2Cr2O7+KI+H2SO4----K2SO4+Cr2(SO4)3+I2+H2O
As2S3+HNO3+H2O----H3AsO4+H2SO4+NO
Fe3O4+KMnO4+H2SO4----Fe2(SO4)3+MnSO4+K2SO4+H2O
CuSO4+FeS2+H2O----Cu2S+FeSO4+H2SO4 爱上你是猪的错1年前1
爱上你是猪的错1年前1 -
 东东宁 共回答了17个问题
东东宁 共回答了17个问题 |采纳率94.1%3C2H4O2+4K2Cr2O7+16H2SO4====4K2SO4+4Cr2(SO4)3+6CO2+22H2O
K2Cr2O7+6KI+7H2SO4====4K2SO4+Cr2(SO4)3+3I2+7H2O
3As2S3+28HNO3+4H2O====6H3AsO4+9H2SO4+28NO
10Fe3O4+2KMnO4+48H2SO4====15Fe2(SO4)3+2MnSO4+K2SO4+48H2O
14CuSO4+5FeS2+12H2O====7Cu2S+5FeSO4+12H2SO41年前查看全部
- 配平与完成下列化学反应方程式.(1)KMnO4-K2MnO4+MnO2+O2(2)NH4HCO3-NH3+CO2+H2O
配平与完成下列化学反应方程式.
(1)KMnO4-K2MnO4+MnO2+O2
(2)NH4HCO3-NH3+CO2+H2O
(3)C2H6+O2-CO2+H2O
(4)SO2+NaOH-Na2SO3+H2O trinitong1年前1
trinitong1年前1 -
 敏娃子 共回答了28个问题
敏娃子 共回答了28个问题 |采纳率96.4%解题思路:因为反应前后元素种类不变,各种元素的原子个数相等,所以根据质量守恒定律,配平化学方程式.(1)利用奇数配偶法或观察法,配平各原子个数.故:2KMnO4═K2MnO4+MnO2+O2↑
(2)利用定一法,把NH4HCO3的计量数定为1.故:NH4HCO3═NH3+CO2↑+H2O
(3)先配有机物,把有机物的计量数定为1,且配平顺序为C-H-O,最后配单质氧气.故:2C2H6+7 O2═4CO2+6H2O
(4)利用观察法,配平各原子的个数,原则:先复杂,后简单.故:SO2+2NaOH═Na2SO3+H2O点评:
本题考点: 化学方程式的配平.
考点点评: 灵活运用“根据质量守恒定律,配平化学方程式.”1年前查看全部
- 初中化学方程式计算不懂的化学式摆出来要怎么算,而且科学考试的计算题也不会。教教我!不要配平这些啊,教些实际点的
 handsonecool1年前4
handsonecool1年前4 -
 tao1441tao 共回答了20个问题
tao1441tao 共回答了20个问题 |采纳率85%对于一些常见的很容易配平。但一些数字比较大比较偏的,怎么配?如下化学方程式的配平
在化学方程式各化学式的前面配上适当的系数,使式子左、右两边每一种元素的原子总数相等。这个过程叫做化学方程式配平。
配平的化学方程式符合质量守恒定律,正确表现反应物和生成物各物质之间的质量比,为化学计算提供准确的关系式、关系量。配平方法有多种:
(1)观察法观察反应物及生成物的化学式,找出...1年前查看全部
- 为什么一个化学方程式有多种配平方法?
为什么一个化学方程式有多种配平方法?
偶是说每种配平后系数不相同,但是都是对的.
栗子很多,比如什么高锰酸钾重铬酸钾氧化什么什么生成氧气啊什么什么的.自己找去
还有,并不是配错了.注意,对的永远不止一个. 阳台上的花1年前1
阳台上的花1年前1 -
 高压气流 共回答了15个问题
高压气流 共回答了15个问题 |采纳率100%在复杂的化学反应中是存在的.
譬如复杂的氧化还原反应,参加氧化还原的元素较多,造成多种方法使得失电子相同.
偶上次就看到一个~A元素升2价,B元素升6价,C元素降5价.(记不清了,就先用ABC代替吧)
由电子得失平衡,可以是 2A+B=2C 后来我同学得出一个 A+3B=4C
把整个方程式配平发现都可以.
要用数学来讲,有点像是多元不定方程有多个解一样.
至于其他的反应类型我就不知道怎么解释了.1年前查看全部
- 按要求完成下列化学方程式:(1)配平化学方程式Fe2O3+CO 点燃 . Fe+CO2 (2)写一个化学反应现象很剧烈
按要求完成下列化学方程式:
(1)配平化学方程式Fe2O3+CO
Fe+CO2点燃 .
(2)写一个化学反应现象很剧烈的反应3Fe+2O2
Fe3O4点燃 .3Fe+2O2.
Fe3O4点燃 .
(3)写一个反应条件加热的分解反应2KMnO4
K2MnO4+MnO2+O2↑(合理即可)△ .2KMnO4.
K2MnO4+MnO2+O2↑(合理即可)△ . xsjhh1年前1
xsjhh1年前1 -
 木清名 共回答了15个问题
木清名 共回答了15个问题 |采纳率80%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)本题可从得失氧的角度配平,一个CO分子反应中获得一个氧原子变为二氧化碳分子,由于一个Fe2O3分子中氧原子的数目为3个,所以CO与CO2前面的化学计量数都为3,最后配平其它元素的原子,Fe2O3、Fe前面的化学计量数分别为1、2.
(2)铁在氧气中燃烧剧烈燃烧,火星四射,反应的化学方程式为:3Fe+2O2
点燃
.
Fe3O4(合理即可).
(3)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,授予分解反应,反应的化学方程式是2KMnO4
△
.
K2MnO4+MnO2+O2↑(合理即可).
故答案为:(1)Fe2O3+3CO
高温
.
2Fe+3CO2;(2)3Fe+2O2
点燃
.
Fe3O4;(3)2KMnO4
△
.
K2MnO4+MnO2+O2↑(合理即可).点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 化学反应式配平cl2+ca(oh)2热---ca(clo)2+cacl2cl2+ca(oh)2冷---ca(clo)2+
化学反应式配平
cl2+ca(oh)2热---ca(clo)2+cacl2
cl2+ca(oh)2冷---ca(clo)2+cacl2 引凤招蝶1年前4
引凤招蝶1年前4 -
 gxfuq 共回答了20个问题
gxfuq 共回答了20个问题 |采纳率95%氯气和热的氢氧化钙生成的是氯酸钙:6CL2+6Ca(OH)2=Ca(CLO3)2+5CaCL2+6H2O
2CL2+2Ca(OH)2=Ca(CLO)2+CaCL2+2H2O1年前查看全部
- CXHYOZ+O2=CO2+H2O 配平 要详细的过程.谢谢
 bdboy_sky1年前2
bdboy_sky1年前2 -
 驼背模糊 共回答了18个问题
驼背模糊 共回答了18个问题 |采纳率77.8%可以设CXHYOZ系数为1即CO2系数为X而H2O系数Y/2
右边O数量为2X+Y/2
左边O数量为Z+2?
即O2的系数为(2X+Y/2-Z)/2
可乘以系数变为整数1年前查看全部
- 九年级的16个化学方程式配平九年级的16个化学方程式如何配平?现在要用!
 dalao9111年前1
dalao9111年前1 -
 TY倦客 共回答了11个问题
TY倦客 共回答了11个问题 |采纳率100%16个?..那么多..
不知道你要的是哪16个..
我就把我们总结的16个给你打上来吧..
点燃
4P+5O2Cu+H2O1年前查看全部
- 氧化还原反应方程式如何配平?求教配平方法,像复杂一点的P+CuSO4+H2O---Cu3P(Cu为+1价)+H3PO4+
氧化还原反应方程式如何配平?
求教配平方法,
像复杂一点的P+CuSO4+H2O---Cu3P(Cu为+1价)+H3PO4+H2SO4怎样来配?
能教一下方程式配平的一些重要方法吗,除了观察法.一些复杂的方程式该用什么方法来配? yongling32351年前1
yongling32351年前1 -
 良震 共回答了17个问题
良震 共回答了17个问题 |采纳率94.1%一、配平原则
由于在氧化还原反应里存在着电子的转移,因此元素的化合价必然有升有降,我们把化合价能升高的元素或含该元素的物质称还原剂;反之称为氧化剂.由氧化还原反应的知识我们不难得出配平原则:还原剂失电子总数=氧化剂的电子总数,即还原剂(元素)化合价升高的总价数=氧化剂(元素)化合价降低的总价数.
二、氧化还原反应方程式配平的一般方法与步骤
1、一般方法:从左向右配.
2、步骤:标变价、找变化、求总数、配系数.即
⑴ 标出变化元素化合价的始态和终态;
⑵ 始态 终态 变化的总价数 = 变化 × 系数
注:假设以上变化均以正价表示,其中(b-a)×(d-c) 为最小公倍数.
⑶ 将 上的系数,分别填在还原剂和氧化剂化学式的前面作为系数;
⑷ 用观察法配平其它元素;
⑸ 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看是否符合电荷守恒)
例1、 C + HNO3(浓)- NO2 + CO2 + H2O
分析:⑴标变价
C(0) + HN(+5)O3(浓)- N(+4)O2 + C(+4)O2 + H2O
⑵ 找变化
始态 终态 变化的总价数 = 变化 × 系数
⑶ 求总数
1 × 4 = 4
⑷ 配系数
C 的系数为 1 HNO3的系数为 4 ,用观察法将其它系数配平
后,经检查满足质量守恒定律.配平后的化学方程式为:
C + 4 HNO3(浓)= 4 NO2 + CO2 + 2 H2O
三、氧化还原反应配平的特殊技巧.
1、从右向左配平法
例2、Cu + HNO3(浓)- Cu(NO3)2 + NO2 + H2O
分析:由于HNO3在反应中有两个作用即酸性和氧化性,因此如按照一般的方法从左向右配的话比较麻烦,但如采用从右向左配平法的方法,这个问题显得很简单.
不同之处:配系数时只需将 中的系数先写在对应产物化学式之前,其它步骤相同.
始态 终态 变化的总价数 = 变化 × 系数
Cu + 4 HNO3(浓)= Cu(NO3)2 +2 NO2 + 2H2O
总结使用范围:此法最适用于某些物质(如硝酸、浓硫酸的反应)部分参加氧化还原反应的类型.
2、整体总价法(零价法)
适用范围:在氧化还原反应中,一种反应物中有两种或两种以上的元素化合价发生变化或几种不同物质中的元素化合价经变化后同存在于一种产物中.
技巧:把该物质当成一个“整体”来考虑.
例3、FeS2 + O2 — Fe2O3 + SO2
分析:在FeS2 中Fe的化合价由+2变到+3,S的化合价由-1变到+4,即同一种物质中有两种元素的化合价同时在改变,我们可以用整体总价法,把FeS2当成一个“整体”来考虑.
故 4FeS2 +11 O2 =2 Fe2O3 +8 SO2
3、歧化归一法
适用范围:同种元素之间的歧化反应或归一反应.
技巧:第三种价态元素之前的系数等于另两种元素价态的差值与该价态原子数目的比值.
例4、Cl2 + KOH — KCl + KClO + H2O
分析:在氧化还原反应中,电子转移只发生在氯元素之间,属于歧化反应.
0 -1 +5
Cl2 + KOH — KCl + KClO3 + H2O
Cl2 的系数为6/2=3 KCl的系数为5 KClO3的系数为1
故 3Cl2 + 6KOH = 5KCl + KClO3 +3 H2O
4、判断未知物
顾名思义,在一个氧化还原反应中缺少反应物或生成物.
技巧:一般是把反应物和生成物中的所有原子进行比较,通过观察增加或减少了哪种元素:
①若增加的元素是除H、O以外的非金属,未知物一般是相应的酸;
②若增加的元素是金属,未知物一般是相应的碱;
③若反应前后经部分配平后发现两边氢、氧原子不平衡,则未知物是水.
例5、KMnO4 + KNO2 + — MnSO4 + K2SO4 + KNO3 + H2O
分析:经比较发现,生成物中增加了S元素,则未知物是H2SO4 ,其它步骤同上略.
2KMnO4 + 5KNO2 + 3 H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O
5、单质后配法
适用范围:反应物或生成物中有单质参加或单质生成,如有机物的燃烧
都可用此法.
技巧:把游离态的那种元素放在最后来配.
例6、FeS2 + O2 — Fe2O3 + SO2
分析:反应物中有单质O2 ,我们可以把O元素放在最后来配.首先假定
Fe2O3的系数为1,则FeS2 的系数为2,那么SO2的系数为4,因此O2的系数为11/2,然后把每种物质前的系数都扩大2倍,即可配平.
4FeS2 +11 O2 =2 Fe2O3 +8 SO2
6、待定系数法
技巧:将各种物质的系数分别设为不同的未知数,然后根据质量守恒定律列方程求解最后配平.
7、加合法
技巧:把某个复杂的反应看成是某几个反应的叠加而成.
例7、Na2O2 + H2O — NaOH + O2
分析:我们可把这个反应看成是以下两个反应的叠加:
Na2O2 + 2H2O = 2NaOH + H2O2 ①
2H2O2 = 2H2O + O2 ②
把①× 2+ ② ,最后我们得到:2Na2O2 +2 H2O = 4NaOH + O2
总结:从以上示例我们发现,对于同一氧化还原反应,有时可采用不同的方法来配平,也有时用几种方法综合应用.总之,只要我们能掌握以上技巧,配平氧化还原反应方程式会易如反掌.
P+CuSO4+H2O---Cu3P+H3PO4+H2SO4
P 化合价变化:0----〉-1(Cu3P中)
0---〉+5
Cu2+变化 :+2----〉+1
化合价升高的是P 0---〉+5
降低的:P与Cu
可见: 生成一个Cu3P 总共降低 6价
生成一个H3PO4升高 5 价
可知Cu3P 与H3PO4系数比应该是5:6
初步得到: P+CuSO4+H2O==5Cu3P+6H3PO4+H2SO4
再由观察法配出: 9P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO41年前查看全部
- 配平下列化学方程式:KMnO4 [△/ ] K2MnO4+MnO2+O2↑2KMnO4 △ . K2MnO4+MnO
配平下列化学方程式:
KMnO4 [△/ ] K2MnO4+MnO2+O2↑2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4
K2MnO4+MnO2+O2↑△ .
Al+CuSO4-Al2(SO4)3+Cu
______
Zn+HCl-ZnCl2+H2↑
______
Al2O3+H2SO4-Al2(SO4)3+H2O
______
Fe2(SO4)3+NaOH-Na2SO4+Fe(OH)3↓
______. 转身爱已成过去1年前1
转身爱已成过去1年前1 -
 漫漫游人 共回答了22个问题
漫漫游人 共回答了22个问题 |采纳率95.5%解题思路:根据质量守恒定律:反应前后各原子的数目不变,选择相应的配平方法进行配平即可.根据化学方程式配平的标志:反应前后各原子的数目相等,可将上述方程式配平.
利用最小公倍数法进行配平,以钾原子作为配平的起点,KMnO4前面的化学计量数为:2,最后调整MnO2和O2前面的化学计量数为1.配平后的化学方程式为:2KMnO4
△
.
K2MnO4+MnO2+O2↑;
利用最小公倍数法进行配平,以硫酸根作为配平的起点,CuSO4前面的化学计量数为:3,最后调整Cu前面的化学计量数为3.Al前面的化学计量数为2,配平后的化学方程式为:2Al+3CuSO4=Al2(SO4)3+3Cu;
利用最小公倍数法进行配平,以氯原子作为配平的起点,HCl前面的化学计量数为:2,最后调整Zn、H2前面的化学计量数分别为1、1.配平后的化学方程式为:Zn+2HCl=ZnCl2+H2↑;
本题可利用“定一法”进行配平,把Al2(SO4)3前面的化学计量数定为1,则Al2O3、H2SO4、H2O前面的化学计量数分别为:1、3、3.配平后的化学方程式为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
本题可利用“定一法”进行配平,把Fe2(SO4)3前面的化学计量数定为1,则NaOH、Na2SO4、Fe(OH)3前面的化学计量数分别为:6、3、2.配平后的化学方程式为:Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3↓;
故答案为:2KMnO4
△
.
K2MnO4+MnO2+O2↑;2Al+3CuSO4=Al2(SO4)3+3Cu;Zn+2HCl=ZnCl2+H2↑;Al2O3+3H2SO4=Al2(SO4)3+3H2O;Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3↓;点评:
本题考点: 化学方程式的配平.
考点点评: 本题难度不大,掌握反应前后各原子的数目不变、化学方程式的配平方法等是正确解答本题的关键.1年前查看全部
- 像2x^2-5X+3=0这样的一元二次方程怎样用十字相乘法配平
像2x^2-5X+3=0这样的一元二次方程怎样用十字相乘法配平
也就是说,当2次项的系数不是1的时候怎样用十字相乘法配平?写成(x±a)(x±b)这样的形式时二次项的系数放哪里?(我就是不知道该把二次项的系数怎么办) laokai-90691年前2
laokai-90691年前2 -
 赤道上的春天 共回答了17个问题
赤道上的春天 共回答了17个问题 |采纳率88.2%把2x^拆成2x -1
X -3
十字相乘,-2X加负3X等于-5X
那么(2x-1)(X-3)等于01年前查看全部
- 铁:求图中转化方程式,可以不配平,最好写在纸上发、谢谢
 nexklee1年前0
nexklee1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 求大神给配平NaOH+SO2——Na2SO4+H2ONaOH+SO3——Na2SO4+H2O
 等待猫人1年前1
等待猫人1年前1 -
 xlfran 共回答了15个问题
xlfran 共回答了15个问题 |采纳率93.3%第一题二氧化硫在没有氧化剂的条件下怎么变成硫酸根离子?应该无法配平吧,除非加氧气之类的氧化剂.
第二题:2NaOH+SO3——Na2SO4+H2O1年前查看全部
- 化学中方程式配平“只相遇不相交”这是什么原则,请举例,具体说明,
 7891201年前2
7891201年前2 -
 jinfer 共回答了13个问题
jinfer 共回答了13个问题 |采纳率92.3%是指同一物质化合价升降不能到达彼此反应物的化合价.建议看下归中和歧化反应
6HCl+KClO3=KCl+3Cl2↑+3H2O,产物中的KCl和部分Cl2是来自HCl 而KClO3只生成Cl2,而不是KCl,KClO3中Cl是+5价不能到达HCl的-1价.1年前查看全部
- 化学方程式的配平习题
 职业懦夫1年前1
职业懦夫1年前1 -
 tsinehua 共回答了22个问题
tsinehua 共回答了22个问题 |采纳率95.5%1、P +Cl2 — PCl3
2、Cu + HNO3(稀)- Cu(NO3)2 + NO + H2O
3、Cu2S + HNO3 — Cu(NO3)2 +NO +H2SO4 + H2O
4、KI + KIO3 + H2SO4 — I2 + K2SO4+ H2O
5、H2O2+Cr2(SO4)3 + — K2SO4+ H2O+ K2CrO4
6、AgNO3 — Ag + NO2 +O2
7、FeSO4 + H2O + O2 — Fe2(SO4)3 + Fe(OH)3
8、NO2 + O2 + H2O — HNO3
参考答案
1、2,3,2
2、3,8,3,2,4
3、3,22,6,10,3,8
4、5,1,3,3,3,3
5、5,1,10KOH,3,2,8
6、2,2,2,1
7、12,6,3,4,4
8、4,1,2,4
(高中的题)1年前查看全部
- Feo+O2+H20—Fe(OH)2怎么配平?急用啊
 niq56471年前7
niq56471年前7 -
 jinger99 共回答了18个问题
jinger99 共回答了18个问题 |采纳率100%你式子错了有O2后面应生成+3价的Fe(OH)3系数从压到右分别为 4 1 6 41年前查看全部
- 怎样进化学方程式配平
 寒夜静思1年前3
寒夜静思1年前3 -
 nhzzx 共回答了19个问题
nhzzx 共回答了19个问题 |采纳率84.2%(1)最小公倍数法:在配平化学方程式时,观察反应前后出现”个数”较复杂的元素,先进行配平.先计算出反应前后该元素原子的最小公倍数,用填化学式前面化学计量数的方法,对该原子进行配平,然后观察配平其他元素的原子个数,致使化学反应中反应物与生成物的元素种类与原子个数都相等.例如:教材介绍的配平方法,就是最小公倍数法.在P+O2――P2O5反应中先配氧:最小公倍数为10,得化学计量数为5与2,P+5O2――2P2O5;再配平磷原子,4P+5O2==2P2O5.(2)观察法:通过对某物质的化学式分析来判断配平时化学计量数的方法.例如:配平Fe2O3+CO――Fe+CO2.在反应中,每一个CO结合一个氧原子生成CO2分子,而Fe2O3则一次性提供三个氧原子,因而必须由三个CO分子来接受这三个氧原子,生成三个CO2分子即Fe2O3+3CO――Fe+3CO2,最后配平方程式Fe2O3+3CO==2Fe+3CO2,这种配平方法是通过观察分析Fe2O3化学式中的氧原子个数来决定CO的化学计量数的,故称为观察法.(3)奇数变偶数法:选择反应前后化学式中原子个数为一奇一偶的元素作配平起点,将奇数变成偶数,然后再配平其他元素原子的方法称为奇数变偶数法.例如:甲烷(CH4)燃烧方程式的配平,就可以采用奇数变偶数法:CH4+O2――H2O+CO2,反应前O2中氧原子为偶数,而反应后H2O中氧原子个数为奇数,先将H2O前配以2将氧原子个数由奇数变为偶数:CH4+O2――2H2O+CO2,再配平其他元素的原子:CH4+2O2==2H2O+CO2.(4)归一法:找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.例如:甲醇(CH3OH)燃烧化学方程式配平可采用此法:CH3OH+O2――H2O+CO2,显然决定生成H2O与CO2的多少的关键是甲醇的组成,因而定其计量数为1,这样可得其燃烧后生成H2O与CO2的分子个数:CH3OH+O2――2H2O+CO2.然后配平氧原子:CH3OH+3/2O2===2H2O+CO2,将各计量数同乘以2化分为整数:2CH3OH+3O2==4H2O+2CO2.需要注意的是,不论用何种方法配平化学方程式,只能改动化学式前面的化学计量数,而决不能改动化学式中元素右下角的数字.因为改动元素符号右下角的数字即意味着改动反应物与生成物的组成,就可能出现根本不存在的物质或改变了原有化学变化的反应物或生成物,出现根本不存在的化学变化.(5)化合价法:这种方法是针对氧化还原方程式来说的.在这里记住:“化合价升高失去氧化还原剂”.与之对应的是“化合价降低得到还原氧化剂”.具体用法是:(1)在元素的化合价的变化的元素上部标出它的化合价,分清谁的升高,谁的降低.(2)相同元素之间用线连起,找出并标上升高的电荷数或降低的电荷数.(3)找最小公倍数,并分别乘在升高或降低的电荷数后.(4)配平:把各自相乘的最小公倍数写在各自的化学式前(即系数).并注意这些化合价变化的元素在化学变化前后是否相等,一般来说,如果不相等,是整倍数地差.(5)配合观察法,将其它的如水、生成的不溶物等配平.1年前查看全部
- 镁和硝酸反应配平!( )Mg+( )HNO3==( )Mg(NO3)2+( )NH4NO3+( )H2O
 任未来1年前2
任未来1年前2 -
 小笑世上士 共回答了20个问题
小笑世上士 共回答了20个问题 |采纳率95%4 10 4 1 31年前查看全部
- 高中化学反应方程式的配平我希望知道方法,例如NH3与O2反应生成NO和H2O的老师说从转换电子数目和电荷守恒等入手
 asd123f1年前1
asd123f1年前1 -
 rainmaizi 共回答了18个问题
rainmaizi 共回答了18个问题 |采纳率83.3%这是一常规的氧化还原反应配平的问题
1看化合价变化,N从-3到+2,上升5;O从0到-2,下降2,但是有两个O原子在下降,共下降4;
取4和5的最小公倍数20
所以NH3配4,O2配5,根据N元素守恒,NO配4,H元素守恒,H2O配6,检查O平不平
4NH3+5O2===4NO+6H2O
O平,方程式正确1年前查看全部
- 问问一道化学方程式:NaOH+NH4NO3==生成什么?还有配平
 恋上发呆1年前12
恋上发呆1年前12 -
 小妖眯眯 共回答了17个问题
小妖眯眯 共回答了17个问题 |采纳率100%NaOH+NH4NO3==NaNO3+NH3↑+H2O1年前查看全部
- 高三复习了,求化学“离子反应”的做题方法,如化学式配平的方法,离子共存问题离子方程式咋判断对错
高三复习了,求化学“离子反应”的做题方法,如化学式配平的方法,离子共存问题离子方程式咋判断对错
还有“物质分析”,“条件不同,相同反应物间的反应不同”的问题 容rong1年前1
容rong1年前1 -
 yibing1021 共回答了14个问题
yibing1021 共回答了14个问题 |采纳率85.7%不管离子反应还是方程式配平,都必须满足“两大守恒”,即 电荷(电子)守恒; 物料(元素)守恒;其次还要看是否符合常规逻辑!离子共存问题主要看这些离子间能否相互反映生成“三大类物质”,即 挥发性物质(气体),难溶物(沉淀),弱电解质(水)!其次还要注意前提条件:看清是碱性环境还是酸性环境,碱性时在离子中加HO- ,酸性加H+ 有些常见的共存性问题建议你直接背下来,遇见时直接就可以判定了...
学过的时间久了,好多都记不起了,希望对你有用1年前查看全部
- 已知双氯芬酸钠C14H10Cl2NNaO2燃烧产生水、二氧化碳、氯化氢、二氧化氮、氧化钠,请问配平后的方程式?
已知双氯芬酸钠C14H10Cl2NNaO2燃烧产生水、二氧化碳、氯化氢、二氧化氮、氧化钠,请问配平后的方程式?
C14H10Cl2NNaO2+O2==点燃==H2O+CO2+HCl+NO2+Na2O 花云1年前2
花云1年前2 -
 yeguozi5 共回答了22个问题
yeguozi5 共回答了22个问题 |采纳率77.3%4C14H10Cl2NNaO2+65O2==点燃==16H2O+56CO2+8HCl+4NO2+2Na2O1年前查看全部
- 亚铁氰化钾检验三价铁离子?有蓝色普鲁士蓝沉淀,化学式是KFe[Fe(CN)6]·6H2O.可以提供下吗?(方程要配平呀!
亚铁氰化钾检验三价铁离子?
有蓝色普鲁士蓝沉淀,化学式是KFe[Fe(CN)6]·6H2O.
可以提供下吗?(方程要配平呀!) gzh_lee1年前1
gzh_lee1年前1 -
 快乐星球 共回答了17个问题
快乐星球 共回答了17个问题 |采纳率94.1%普鲁士蓝沉淀的化学式应该是Fe4[Fe(CN)6]3
3[Fe(CN)6](2-)+4Fe3+ KFe[Fe(CN)6]·6H2O1年前查看全部
大家在问
- 1观察下列等式(式中的“!”是一种数学预算符号)1!=1,=1×2,=1×2×3,=1×2×3×4,.
- 2融资融券保证金比例调整是什么意思
- 3请帮忙翻译成英文!谢谢!急用啊!
- 4惊蛰和春分这两个节气哪个更暖和一些?
- 5英语单选和翻译There is a saying that the material possessions you o
- 6中草药,水晶泥,藏药用英语怎么说
- 7These silk shirts-----very soft 怎么填
- 8you have a valid medical certificate which excuses you from
- 9求2x1+2x2+2x3+.+2x(n-1)的和
- 10X1+X2+X3的标准差为根号3,则2X1+2X2+2X3的标准差为多少,2X1+2+2X2+2+2X3+2的标准差为多
- 11公式法有口诀吗?
- 12为了保持体温的恒定,就要消耗体内的能量物质来维持,应该怎样修改
- 13pH试纸晾干后颜色还准吗?
- 14秋季的星空中,()和()隔银河相对,()在银河中心,飞马座和仙女座组成“秋季四边形”.
- 15铁管竖直立在水中会受到水的压力吗?(铁管另一头在水外)