D-构型的糖在溶液中具有右旋光性,L-构型的糖在溶液中则发生左旋 选项:1、 错 2、 对
 小羊咩咩5312022-10-04 11:39:541条回答
小羊咩咩5312022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 honh288 共回答了12个问题
honh288 共回答了12个问题 |采纳率83.3%- 这个说法是错误的!这也是我发现学生们最容易犯错的问题之一.D/L是与甘油醛做比较的相对构型标记法,与物质的本身的旋光特性没有必然的联系.R/S标记法也是如此.物质的具体的旋光性需要由实验测定.(旋光仪)
- 1年前
相关推荐
- 常见的正四面体构型的气态分子有哪些?
 wula11331年前1
wula11331年前1 -
 薄荷久娘 共回答了18个问题
薄荷久娘 共回答了18个问题 |采纳率88.9%气态的话估计没有比甲烷更常见的了.不过液态的话就有四氯化碳,离子有铵根,固体有白磷P4,其他像CF4 SiF4 SiH4就不大常见了.1年前查看全部
- 用价层电子对互斥理论预言下列分子和原子的几何构型 CS2,NO2-,ClO2-,I3-,N
用价层电子对互斥理论预言下列分子和原子的几何构型 CS2,NO2-,ClO2-,I3-,N
用价层电子对互斥理论预言下列分子和原子的几何构型
CS2,NO2-,ClO2-,I3-,NO3-,BrF3 ,PCl4+,BrF4-,PF5,BrF5,[AlF6]3- 彩多少1年前1
彩多少1年前1 -
 yangfy01 共回答了19个问题
yangfy01 共回答了19个问题 |采纳率94.7%举几个例子给你吧.例如CS2 中心原子C的价电子数为4那么就用4/2那么中心原子的价电子层的电子对数就是2 也就是有两根键 正好有两个s那么也就没有孤对电子是直线行1年前查看全部
- 元素周期表的价层电子构型表记,如"氟--2s^2 2p^5",是如何表示实际构型的?
 joke_qin1年前2
joke_qin1年前2 -
 phyzju 共回答了16个问题
phyzju 共回答了16个问题 |采纳率93.8%这是电子亚层,说起来比较复杂
一般简单将比较电子能量大小,2s层电子能量低于2p层,2s层电子稳定,出现在外层的几率要小1年前查看全部
- 反-1-甲氧基-3-溴环丁烷 手性碳的构型?
反-1-甲氧基-3-溴环丁烷 手性碳的构型?
(就像这样对称位置有取代基的二取代环丁烷或二取代环己烷,手性碳怎样命名?)就是怎样比较手性碳的四个键的大小!
1
CH2—CH—CH3
∣ ∣
CH —CH2
∣3
Br
C1位连接的是甲基,不是甲氧基! 506663771年前1
506663771年前1 -
 521mm521 共回答了18个问题
521mm521 共回答了18个问题 |采纳率94.4%首先按原子序数,序数越小,原子团越小.其次看C链长度,越长的原子团越大.1年前查看全部
- 当出现5g电子后,成单电子最多的元素可能的价电子构型为
 12011379112ii11年前1
12011379112ii11年前1 -
 yc8333 共回答了21个问题
yc8333 共回答了21个问题 |采纳率76.2%1S2 2S2 2P6 3S2 3P6 4S2 3D10 4P6 5S2 4D10 5P6 6S2 4F14 5D10 6P6 7S2 5F14 6D10 7P6 8S2 5G7 价电子的话就是 8S2 5G71年前查看全部
- 环烯烃和环炔烃的空间构型是什么样的(含最少c原子的)为什么是这样的.
 economy321年前2
economy321年前2 -
 tiaoyasb 共回答了17个问题
tiaoyasb 共回答了17个问题 |采纳率82.4%按课本来应该是四个,当现实中三个已经被制造出来了1年前查看全部
- FeCI3中各原子的杂化方式及空间构型
 kk额会更好1年前2
kk额会更好1年前2 -
 高春宁 共回答了18个问题
高春宁 共回答了18个问题 |采纳率83.3%sp3d21年前查看全部
- 纯液态IF5...纯液态IF5的导电性比预计的要强的多.式指出在该体系中存在的物种为1.2.3.;所对应的几何构型为1.
纯液态IF5...
纯液态IF5的导电性比预计的要强的多.式指出在该体系中存在的物种为1.2.3.;所对应的几何构型为1.2.3. accacqa1年前1
accacqa1年前1 -
 我爱F1-F2004 共回答了15个问题
我爱F1-F2004 共回答了15个问题 |采纳率100%我才把无机学完 这个 还是等我大三在给你说嘛 等我哟1年前查看全部
- 下列分子或离子的洞见构型不是三角锥形的是?..
下列分子或离子的洞见构型不是三角锥形的是?..
A NF3 B CH3- C CO2 D H3O- xei6e1年前1
xei6e1年前1 -
 lfguozy 共回答了17个问题
lfguozy 共回答了17个问题 |采纳率82.4%选择A
氨的分子结是三角锥的
甲烷的分子是正四面体,甲基的结构就是去掉一个氢~
二氧化碳是直线分子
水合氢离子也不是1年前查看全部
- 求元素符号,Xw4的空间构型,杂化轨道类型,W2Y的空间结构
求元素符号,Xw4的空间构型,杂化轨道类型,W2Y的空间结构
W,X,Y,Z四种元素依次增大,其中Y原子的L电子层中,成对电子和未成对电子占据轨道数相同,无空轨道,X原子的L电子层中未成对电子数与Y相同,还有空轨道,WZ的原子序数相差10,Z原子的第一电离能在同周起中最低 小-鸟-依-人1年前2
小-鸟-依-人1年前2 -
 小洁的窝 共回答了15个问题
小洁的窝 共回答了15个问题 |采纳率100%Y,既然L层有成对电子说明2s已经填满.假设只有1对成对电子,那麼未成对电子就是1个,所以是2s22p1的B.也有可能是2对成对电子,那麼就占据了2个轨道,剩下两个单电子占据另外两个轨道,是2s22px22py12pz1的O.又因为题目说屋空轨道所以把B排除,Y=O.
O只有2个成单电子,而X的成单电子和Y相同,所以X也是2个.而X原子序数比O小,且有空轨道,那麼只有C.
Z的第一电离能在同周期中最低,那麼只有可能是碱金属,所以Z=Na,W就是H.
XW4=CH4,sp3杂化.
H2O是V形分子.1年前查看全部
- ⅤA族元素的价电子构型是?卤素按氟、氯、溴、碘的顺序排列,其结构或性质的变化规律是( ) A.原子半径依次增大 B.原子
ⅤA族元素的价电子构型是?
卤素按氟、氯、溴、碘的顺序排列,其结构或性质的变化规律是( )
A.原子半径依次增大 B.原子最外层电子数递增
C.各单质的化学活泼性依次增强 D.各单质与水反应的剧烈程度递增
E.各单质的颜色逐渐变浅。
17、能使碘化钾淀粉溶液变蓝的是( )
A.NaCl B.NaBr C.KF D.NaI E.氯水
18、下列卤化物中最稳定的是( )
A.NaF B.NaCl C.NaBr D.NaI E.KBr
19、下列各组溶液中不能发生化学反应的是( )
A.氯水和溴化钠 B.氯水和碘化钾
C.溴水和氯化钠 D.溴水和碘化钾
E.溴水和碘化钠
20、在含有溴化钾和碘化钾的混合液中通入过量氯气,然后将溶液蒸干,并将剩余残渣灼热最后留下的物质是( )
A.KCl B.KBr C.KI D.KBr和 KI E.碘 shenxiaomin1年前2
shenxiaomin1年前2 -
 DuFake 共回答了22个问题
DuFake 共回答了22个问题 |采纳率86.4%ⅤA族元素的价电子构型是ns2np3
1.A
B原子最外层电子数不变
C.各单质的化学活泼性依次减弱
D.各单质与水反应的剧烈程度依次减弱
E.各单质的颜色逐渐变深
2.E Cl2+2KI=2KCl+I2
3.A
4.C F Cl Br I
5.A 溴可气化、碘可升华1年前查看全部
- 74号元素的价电子构型为什么是5d4 6s2,而不是5d5 6s1呢
 坚持ff1年前1
坚持ff1年前1 -
 种子416讨力 共回答了15个问题
种子416讨力 共回答了15个问题 |采纳率93.3%一个电子轨道上能装2个电子,在同一亚轨道上的电子旋转方向相反,能量较低.一般在电子充足的情况下,电子将低能量轨道填充满才会填充下一个轨道.所以大部分情况下低层亚轨道都是满的,即2电子,74号元素如果是5d5 6s1在d层轨道的单电子能量太高,不如5d4 6s2稳定1年前查看全部
- 看看是什么立体构型?大学有机化学环己烷怎么判断横键还是竖键?例如,反1.4-二甲基环己烷为什么不能有AE构像?却只有AA
看看是什么立体构型?
大学有机化学环己烷怎么判断横键还是竖键?例如,反1.4-二甲基环己烷为什么不能有AE构像?却只有AA构象和EE构象? sinabenyor1年前1
sinabenyor1年前1 -
 dellu520 共回答了20个问题
dellu520 共回答了20个问题 |采纳率95%竖的是A键,横的是E键,由于E键较稳定,所以判断2取代时先把体积大的取代基放在E键上,然后在看取代位置和顺式或反式.简言之,1,2取代顺式EA,反式EE;1,3取代顺式EE,反式EA;1,4取代,顺式EA,反式EE.至于反1.4-二甲基环己烷...1年前查看全部
- 基态Be价层电子构型为2s2,表面看是不能形成共价键的.但杂化后可形成BeCl2.请教下为什么说表面看不成键
 mgo1391年前1
mgo1391年前1 -
 eaglesu 共回答了18个问题
eaglesu 共回答了18个问题 |采纳率72.2%Be的最外层有2个电子 一般这样结构的比较容易完全失去2个电子 形成离子键.
所以表面上看不能形成共价键,不是不能成键.1年前查看全部
- XeOF4中心原子采取什么杂化方式呢?其分子空间构型是什么样的呢?(07.3.2.3)
XeOF4中心原子采取什么杂化方式呢?其分子空间构型是什么样的呢?(07.3.2.3)
莫非是
↑ ↑↑↑ ↑↑(↑↓)?
为什么不是sp3d3呢? 再龙吟细细1年前1
再龙吟细细1年前1 -
 蓝色静脉 共回答了26个问题
蓝色静脉 共回答了26个问题 |采纳率88.5%应该是sp3d2杂化,是四方锥形1年前查看全部
- 能否用价键理论和杂化轨道理论解释BrF5的空间构型?
 寒笑天下5201年前1
寒笑天下5201年前1 -
 大漠之北 共回答了14个问题
大漠之北 共回答了14个问题 |采纳率78.6%可以,按如下流程:
1、确定中心原子的价电子结构,Br的价电子构型为4s2 4p5 4d0;
2、使中心原子的成单电子数与成键数相等;Br只有1个成单电子,而BrF5中要形成5个共价键,因此必须有5个成单电子,所以Br将通过激发并拆分最高能量轨道(4p)上的电子,并使形成有5个成单电子,即形成4s2 4p3 4d2,此时有5个成单电子;
3、确定杂化方式,根据杂化轨道理论,同一能级组或同一电子层轨道在成键前必须杂化,以提高成键能力,此时杂化方式就是sp3d2,杂化轨道结构是正八面体;
4、确定分子结构,BrF5中会形成5个Br-F键和1对孤电子,分子结构是四方锥.1年前查看全部
- 如何用VSEPR来预测分子构型比如说预测so3的结构和NH3,BF3,P4中哪个结构相似,是不是只需计算SO3和这三个中
如何用VSEPR来预测分子构型
比如说预测so3的结构和NH3,BF3,P4中哪个结构相似,是不是只需计算SO3和这三个中的哪个分子的价层电子对数相同就可?
说错了,是只需计算SO3和这三个中的哪个分子的孤电子对数相同就可? taizilongxl1年前2
taizilongxl1年前2 -
 sqszg 共回答了17个问题
sqszg 共回答了17个问题 |采纳率88.2%so3这个东西比较特殊 它有一个大π键 共用电子
需要特殊记忆的 平面三角形1年前查看全部
- 用价层电子对互斥理论预言下列分子和离子的几何构型
用价层电子对互斥理论预言下列分子和离子的几何构型
CS2,NO2-,ClO2-,I3-,NO3-,BrF3,PCl4+,BrF4-,PF5,BrF5,[AlF6]-
这是大学化学........ 澜枫1年前2
澜枫1年前2 -
 gqf5678 共回答了17个问题
gqf5678 共回答了17个问题 |采纳率82.4%cs2直线型;no2v型;clo2v型;no3三角锥型;brf3平面三角型;pcl4四面体型;pf5五边形;brf5四面体;alf6四面体1年前查看全部
- 下列分子的空间构型可用sp 2 杂化轨道来解释的是______(填序号)①CH 4 ②CH 2 =CH 2 ③C 6
下列分子的空间构型可用sp 2 杂化轨道来解释的是______(填序号)①CH 4 ②CH 2 =CH 2 ③C 6 H 6 ④CH≡CH⑤NH 3 ⑥BF 3 .  hbxfcyj1年前1
hbxfcyj1年前1 -
 树叶飘过的秋 共回答了18个问题
树叶飘过的秋 共回答了18个问题 |采纳率94.4%①CH 4 分子中碳原子杂化轨道数为4,所以采取sp 3 杂化,故错误;
②CH 2 =CH 2 分子中每个碳原子杂化轨道数为3,所以采取sp 2 杂化,故正确;
③C 6 H 6 分子中碳原子杂化轨道数为3,所以采取sp 2 杂化,故正确;
④CH≡CH分子中每个碳原子杂化轨道数为2,所以采取sp杂化,故错误;
⑤NH 3 分子中氮原子杂化轨道数为4,所以采取sp 3 杂化,故错误;
⑥BF 3 分子中硼原子杂化轨道数为3,所以采取sp 2 杂化,故正确.1年前查看全部
- 苯乙烯分子的空间构型是什么样的?
 如梦如刀1年前1
如梦如刀1年前1 -
 20062117 共回答了12个问题
20062117 共回答了12个问题 |采纳率83.3%总的来说一句话,平面的两种分子,总提来说会有不同的分子面来产生作用,就向笨载一面在加上乙烯是一个共面单元原子在空间的不同排列出现旋光异构...则称为无规立构分子的立体构型不同对材料的性能会带来影响,1年前查看全部
- SP3杂化形成的AB4型分子的空间构型 A平面四方形 B四面体 C四角锥形 D平面三角形
 破了洞的口袋1年前2
破了洞的口袋1年前2 -
 ehstar 共回答了16个问题
ehstar 共回答了16个问题 |采纳率100%sp杂化形成的AB型分子的空间构型是直线型;sp2杂化形成的AB3型分子的空间构型是平面三角形;sp3杂化形成的AB4型分子的空间构型是四面体型.1年前查看全部
- 简单说明多聚糖淀粉和纤维素的单糖结构单位、结构单位之间的糖苷键构型.
简单说明多聚糖淀粉和纤维素的单糖结构单位、结构单位之间的糖苷键构型.
RT,DANK hh16881年前1
hh16881年前1 -
 roger1226 共回答了15个问题
roger1226 共回答了15个问题 |采纳率100%直链淀粉的葡萄糖以α-D-1.4-糖苷键结合的链状化合物,相对分子质量为(20~200)×104.支链淀粉中各葡萄糖单元的连接方式除α-D-1,4-糖苷键外,还存在α-D-1,6-糖苷键,相对分子质量为(100~400)×106.
纤维素是葡萄糖通过β-1,4-糖苷键连接,分子量更大,不溶于水,不能直接被人和动物消化1年前查看全部
- 英语翻译3种氨基酸的基本结构CF1、CF2和CF3作为基础,作出缬氨酸的9种分子构型图,缬氨酸电子亲和势的计算用密度泛函
英语翻译
3种氨基酸的基本结构CF1、CF2和CF3作为基础,作出缬氨酸的9种分子构型图,缬氨酸电子亲和势的计算用密度泛函理论的3种方法B3LYP、B3P86和B3PW91,分别讨论分析同种基组6-311++G**不同方法和同一方法B3LYP不同基组的相对能量、绝热电子亲和势和垂直电子亲和势大小、最稳定和最不稳定的结构以及B3LYP中6-311++G**基组的CF31结构的键长、二面角在由中性状态下到优化负离子改变度的分析.
As the foundation of 3 kinds of amino acids in the basic structure of CF1 ,CF2 and CF3,make nine kinds of molecular configuration of valine .Valine electron affinity calculations using density functional theory 3 kinds of methods of B3LYP,B3P86 and B3PW91 .Discusses the analysis of radical group 6-311++G**different methods and the same method of B3LYP different basics sets the relative energy,the most stable and the most unstable structure and the radical group of B3LYP by the method 6-311++G**basis set CF31 structure of bond length,dihedral in the neutral state to optimize the negative ion change degree analysis.
这是百度在线翻译的 hz王vv强1年前1
hz王vv强1年前1 -
 FRSD 共回答了24个问题
FRSD 共回答了24个问题 |采纳率79.2%The basic structure of three kinds of amino acids CF1, CF2 and CF3 as the base, and make valine 9 kinds of molecular configuration diagram, valine affinity with the calculation of potential electronic density functional theory of the three methods B3LYP, B3P86 and B3PW91, respectively discussing analysis, the same group 6-311 + + G * * different methods and the same method B3LYP different base of the relative energy and heat insulation of electronic and potential and vertical electronic affinity potential size, the most stable and the most unstable structure and in B3LYP 6-311 + + G * * and the structure of the key CF31 group long, in neutral state by planes to optimize the analysis of the negative ion change degrees.
qiankecc希望帮助你更多.1年前查看全部
- 试用杂化轨道理论说明硫酸根离子的空间构型.硫酸盐的结晶水数目经常是5或7,其中4或6被认为是阳离子结晶水,它们以配位键与
试用杂化轨道理论说明硫酸根离子的空间构型.硫酸盐的结晶水数目经常是5或7,其中4或6被认为是阳离子结晶水,它们以配位键与阳离子结合,另外一个结晶水被认为是阴离子结晶水,它与硫酸根离子以氢键相结合.试画出阴离子结晶水与硫酸根离子结合的示意图.
 稻草茂1年前1
稻草茂1年前1 -
 王金宝 共回答了23个问题
王金宝 共回答了23个问题 |采纳率91.3%SO42-的中心原子S外层有6个电子,4个O按照VSEPR理论是不提供电子的,因此共有(6+2)/2=4个电子对,为sp3杂化,正四面体构型.
O^^^O…H
^^/^^^^
^^S^^^^^^O
^/^^^^^/
O^^^O…H1年前查看全部
- PtCl2(NH3)2的分子构型
PtCl2(NH3)2的分子构型
请问-NH3怎么解释? protoplast1年前1
protoplast1年前1 -
 crazyplayer 共回答了17个问题
crazyplayer 共回答了17个问题 |采纳率94.1%PtCl2(NH3)2有两种构型,即顺式和反式.Pt在正中,边上4根键-Cl,-Cl,-NH3,-NH3形成一个平面正方形.既然是平面正方形,就有了两种构型:当两个CL相邻时称为顺式,当两个CL相对时称为反式.(顺式PtCl2(NH3)2为一种抗癌药物!)1年前查看全部
- 无极分子空间构型的对称性是否决定分子构型的稳定性,就是说在无法确定简单多原子分子的空间构型情况下的各种情况中是否具有对称
无极分子空间构型的对称性是否决定分子构型的稳定性,就是说在无法确定简单多原子分子的空间构型情况下的各种情况中是否具有对称轴的构型是稳定的构型,有没有空间构型不对称却稳定的构型
 daer5v7111年前2
daer5v7111年前2 -
 Eric_xu 共回答了17个问题
Eric_xu 共回答了17个问题 |采纳率94.1%首先,没有不对称的分子.所有的分子都具有对称性,只有分子的对称性有高低不同罢了.
对称性跟分子的稳定性无关.但是对称性对分子的反应性至关紧要.1年前查看全部
- 原子轨道构型图 看不懂大学课本中关于spdf等轨道的示意图看不懂
 jilejive1年前1
jilejive1年前1 -
 白马过客 共回答了19个问题
白马过客 共回答了19个问题 |采纳率94.7%一般这是波函数的几率表示.你想知道什么?“轨道”这个概念在这里是不合适的.spdf对应角动量量子数,0,1,2,3.1年前查看全部
- 这道化学题关于有机物分子的空间构型
这道化学题关于有机物分子的空间构型
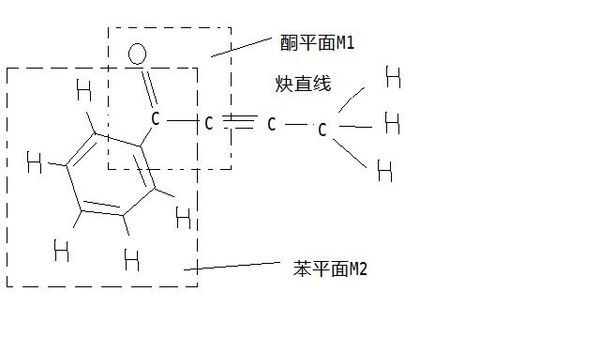
一定在同一平面上的原子最多有﹏个,答案为12,解释一下谢谢
 恋饰界1年前3
恋饰界1年前3 -
 v97v 共回答了21个问题
v97v 共回答了21个问题 |采纳率90.5%苯上有7个C,有5个H,苯上的原子一定在同一个平面,所以为12个1年前查看全部
- 写出价电子构型为[Ar]4s1的元素在周期表中的位置(周期、族、区)、元素符号,所形成硫酸盐的主要键型、该盐在水中溶解度
写出价电子构型为[Ar]4s1的元素在周期表中的位置(周期、族、区)、元素符号,所形成硫酸盐的主要键型、该盐在水中溶解度大小和水化离子的颜色.
 liangzaihome1年前2
liangzaihome1年前2 -
 唐广宁 共回答了19个问题
唐广宁 共回答了19个问题 |采纳率84.2%最外层是第四层,且是1个电子,就是第四周期第一个主族的s区钾元素;
硫酸钾主要是离子键,溶解度较大,水化离子无色;
有问题请追问!1年前查看全部
- 写出价电子构型为[Ar]3d104s2的元素在周期表中的位置(周期,族,区),元素符号,指
写出价电子构型为[Ar]3d104s2的元素在周期表中的位置(周期,族,区),元素符号,指
写出价电子构型为[Ar]3d104s2的元素在周期表中的位置(周期、族、区)、元素符号,指出该元素所形成氧化物的键型,在水中溶解度大小, zhouhuanhai1年前3
zhouhuanhai1年前3 -
 Fangfang81 共回答了29个问题
Fangfang81 共回答了29个问题 |采纳率93.1%第四周期,第2副族,ds区,Zn;氧化物离子键,溶解度极小;1年前查看全部
- 二氧化碳微粒的空间构型是什么?如题
 取个名真难呀1年前1
取个名真难呀1年前1 -
 multitv 共回答了18个问题
multitv 共回答了18个问题 |采纳率94.4%直线型1年前查看全部
- 用价层电子对互斥理论判断HgCl2的空间构型
 c7011年前1
c7011年前1 -
 hd1506 共回答了14个问题
hd1506 共回答了14个问题 |采纳率71.4%Hg是第二副族,价电子数是2,Cl是1,所以VPN=(2+2)/2=2,孤对电子数n=(2-2)/2=0,所以是直线型1年前查看全部
- 离子的电子构型分为?
 lankow1年前1
lankow1年前1 -
 breezywind 共回答了16个问题
breezywind 共回答了16个问题 |采纳率93.8%要看状态
Cu2+的电子排布:1S2 2S2 2P6 3S2 3P6 3d9
Cu+的电子排布 :1S2 2S2 2P6 3S2 3P6 3d10
看电子排布是Cu+比Cu2+稳定,其实确实是这样的,在干燥环境或者是固体、配离子中,Cu+确实比较稳定,但是在水溶液中,Cu2+能形成配离子而更加稳定,是因为Cu2+的水合能比较大,弥补了电离2个电子消耗的能量.1年前查看全部
- 苷键构型可分为几种?如何表示?
 H胡子1年前1
H胡子1年前1 -
 玺郁 共回答了11个问题
玺郁 共回答了11个问题 |采纳率100%单糖环状半缩醛结构中的半缩醛羟基与另一分子醇或羟基作用时,脱去一分子水而生成缩醛.糖的这种缩醛称为糖苷.例如α-和β-D-吡喃葡萄糖的混合物,在氯化氢催化下同甲醇反应,脱去一分子水,生成α-和β-D-甲基吡喃葡萄糖苷的混合物.
α-和β-D-吡喃葡萄混合液 β-D-甲基吡喃葡萄糖苷 α-D-甲基吡喃葡萄糖苷,苷由糖和非糖部分组成.非糖部分称为糖苷配基或苷元.糖和糖苷配基脱水后通过过“氧桥”连接,这种键称为苷键.由于单糖的环式结构有α-和β-两种构型,所以可生成α-和β-两种没构型的苷.天然苷多为β-构型.苷的名称是按其组成成分而命名的,并指出苷键和糖的构型.天然苷常按其来源而用俗名.
糖苷结构中已没有半缩醛羟基,在溶液中不能再转变成开链的醛式结构,所以糖工苷无还原性,也没有变旋现象.糖苷在中性或碱性环境中较稳定,但在酸性溶液中或在酶的作用下,则水解生成糖和非糖部分.
糖苷是中草药的有效成分之一,多为无色、无臭、有苦涩味的固体,但黄酮苷和蒽醌苷为黄色.
苷中含有糖部分,所以在水中有一定的溶解性.苷类都有旋光性,天然苷多为左旋体1年前查看全部
- 价层电子对互斥理论推测NO2构型
价层电子对互斥理论推测NO2构型
中心原子价电子对数的计算:中心原子的价电子数+单键共用对方原子的电子数 总和除2
中心原子的价在正规的共价键中:
氧原子和硫原子作为配位原子时,可认为不提供共用电子
那么N有5个价电子.O不提供,则结果是2.5
希望有人解释一下,顺便把公式的具体注意事项说明一下,谢谢
 shuiji811181年前1
shuiji811181年前1 -
 sunvar 共回答了13个问题
sunvar 共回答了13个问题 |采纳率92.3%价层电子对互斥理论
应用该理论可预测一些非过渡元素,ABm型简单分子或离子的空间构型.
理论要点:
(1)价层电子对尽可能远离使相互间斥力最小.常采取下列排布方式.
价层电子对数
2
3
4
5
6
空间构型
直线形
等边三角形
正四面体
三角双键
正八面体
(2)根据中心原子(A)的价层电子对数确定电子对的空间排布,再根据中心原子的孤对电子数及其所在位置推出ABm分子的空间构型.
(3)电子对之间斥力大小顺序是:
孤对-孤对>孤对-成键>成键-成键
在考虑价层电子对排布时需选择最少数目的90度角的孤对-孤对排布.
计算价层电子对数和孤对电子对数的方法:
价层电子对数= (A原子的价层电子数+ B原子提供的形成共价单键的
电子数±离子的电荷数)
(规定B原子为氧族元素时不提供电子)
孤对电子对数=价层电子对数―成键电子对数
http://202.114.128.246/shenbao/wjhx/%CE%DE%BB%FA%BB%AF%D1%A7%B8%A8%B5%BC/%B7%D6%D7%D3%BD%E1%B9%B9/%B7%D6%D7%D3%BD%E1%B9%B9%BB%F9%B1%BE%D2%AA%C7%F3%D3%EB%D2%AA%B5%E3.htm1年前查看全部
- 关于各类烷烃的RS构型参照基团的疑问~
关于各类烷烃的RS构型参照基团的疑问~
日前正在学习邢大本,有个RS构型,如何才能确定一个完整的基团,想了好久..... 就像第一个图,7号位上的碳在环上与俩CH2直接相连,但那个C是手性碳所以连俩CH2是无法判定RS的,那继续看下去,那个手性碳在环上到底是和哪些基团相连?

 ramonan1年前1
ramonan1年前1 -
 什么时候发ee 共回答了21个问题
什么时候发ee 共回答了21个问题 |采纳率85.7%这个环应该是可以判定RS的吧 一步一步拆分
上面那个把双键看做连接两个甲基及后面的一系列基团
三键可以看做连接三个甲基后后面的基团 而这个图 上下两个方向走 上面的双键比下面的三键更近 所以上面那个C的基团比下面那个C的基团大
所以这个结构式是S型1年前查看全部
- 价电子构型怎么写?特别是主量子数n不同时,如4d105s2.怎么写?怎样区分是最外层与内层电子?
 碧落溪纱1年前1
碧落溪纱1年前1 -
 cfhygjt 共回答了26个问题
cfhygjt 共回答了26个问题 |采纳率69.2%先填低能量再填高能量 利用两个原理(泡利原理和鸿特规则)
怎样区分是最外层与内层电子 5s2就是最外层 4d10是内层电子
就是依据低能量排满才轮到高能量级1年前查看全部
- 分子 几何构型有哪些,怎样判断?
 微冷山头斜1年前1
微冷山头斜1年前1 -
 阳台漏雨 共回答了16个问题
阳台漏雨 共回答了16个问题 |采纳率93.8%常见的分子的空间构型有四面体型(CH4、CCl4、P4等)、三角锥型(NH3、PH3等)、直线型(CO2、C2H2等)、平面型(C2H4、BF3、C6H6等)
1、确定中心原子价层电子数.它可由下式计算得到:价层电子对数=(中心原子价电子数 + 配位原子提供电子数 - 离子代数值)/2
式中配位原子提供电子数的计算方法是:氢和卤素原子均提供1个价电子;氧和硫原子提供电子为零.因为氧和硫价电子数为6,它与中心原子成键时,往往从中心原子接受2个电子而达到稳定的八隅体结构.
2、根据中心原子的价电子对数,找出电子对间斥力最小的电子排布方式.从面找出相应的电子对排布.
静电斥力最小的电子对排布
电子对 2 3 4 5 6
电子对的排布 直线 平面三角 四面体 三角双锥 八面体
3、把配位原子按相应的几何构型排布在中心原子周围,每一对电子连接一个配位原子,剩下的未与配位原子结合的电子对便是孤对电子.含有孤电子对的分子几何构型不同于价电子的排布,孤电子对所处的位置不同,分子空间构型也不同,但孤电子对总是处于斥力最小的位置,除去孤电子对占据的位置后,便是分子的几何构型.1年前查看全部
- 旋光性物质A(C5H10O3)与NaHCO3作用放出CO2,A加热脱水生成B.B存在两种构型,但无光学活性.B用KMnO
旋光性物质A(C5H10O3)与NaHCO3作用放出CO2,A加热脱水生成B.B存在两种构型,但无光学活性.B用KMnO4/H+
 牛皮癣治老ee1年前2
牛皮癣治老ee1年前2 -
 usol 共回答了18个问题
usol 共回答了18个问题 |采纳率94.4%具有旋光性,意味着具有4种不同的基团,已知含有COOH,那么剩下的肯定有(CH2)2OH,H,CH3,A加热脱水,可能有2种反应,酯化,或者脱羧,
饿.LZ的题目没写完吧?1年前查看全部
- 可不可以详细的解释元素周期表的每一项内容?主要是电子构型
 xiaolu10111年前1
xiaolu10111年前1 -
 啊啊哦哦 共回答了21个问题
啊啊哦哦 共回答了21个问题 |采纳率90.5%编辑本段元素周期表中元素及其化合物的递变性规律
1 原子半径
(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;
(2)同一族的元素从上到下,随电子层数增多,原子半径增大.
2 元素化合价
(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);
(2)同一主族的元素的最高正价、负价均相同
3 单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增
4 元素的金属性与非金属性
(1)同一周期的元素从左到右金属性递减,非金属性递增;
(2)同一主族元素从上到下金属性递增,非金属性递减.
5 最高价氧化物和水化物的酸碱性
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强.
6 非金属气态氢化物
元素非金属性越强,气态氢化物越稳定.同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱.
7 单质的氧化性、还原性
一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱.
编辑本段推断元素位置的规律
判断元素在周期表中位置应牢记的规律:
(1)元素周期数等于核外电子层数;
(2)主族元素的序数等于最外层电子数.
阴阳离子的半径大小辨别规律
由于阴离子是电子最外层得到了电子 而阳离子是失去了电子
所以,总的说来
(1) 阳离子半径原子半径
(3) 阴离子半径>阳离子半径
或者说,电子越多半径越大.
以上不适合用于稀有气体!1年前查看全部
- ClO2的分子构型如何判断
 D_alessandro1年前2
D_alessandro1年前2 -
 nationist1988 共回答了22个问题
nationist1988 共回答了22个问题 |采纳率86.4%不要被人误导
ClO2与NO一样是奇电子化合物,直接用VSEPR或八隅体规则是没有办法判断出来的,ClO2的结构是靠实验测定出来的.
其中CL是SP2杂化,两个氧的2P轨道先重排空出一个2P轨道分别接受CL的SP2一对电子(也就是CL作为配体与氧形成配位键) 未杂化的3P轨道(单电子)与两个O有孤对电子的2P轨道形成π51年前查看全部
- S8的分子构型是什么样的?32gS8含多少个S-S见
 霹雳浪子1年前1
霹雳浪子1年前1 -
 李有才 共回答了18个问题
李有才 共回答了18个问题 |采纳率94.4%去年江苏卷有一道高考题涉及S8,是皇冠形,上面4个硫,下面4个硫,依次连成键,一个S8分子中含8个S-S键.所以32gS8含6.02×10^23个S-S键.1年前查看全部
- 三氯化磷,三氯化硼用杂化轨道理论解释其空间构型.
 吃葡萄吐西瓜皮1年前1
吃葡萄吐西瓜皮1年前1 -
 hh人观hh事 共回答了15个问题
hh人观hh事 共回答了15个问题 |采纳率86.7%三氯化磷,价层对数为4,有一对孤对电子,不等性sp3杂化,四面体结构,和氨分子类似.
三氯化硼,价层对数为3,没有孤对电子,平面三角结构,sp2杂化1年前查看全部
- 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述错误的是(
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述错误的是( )
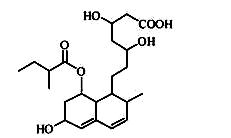
A.分子式为C 23 H 36 O 7 B.能使酸性KMnO 4 溶液褪色 C.能发生加成,取代,水解,聚合,氧化反应 D.1 mol 该物质最多可与1 mol NaOH 反应  aaronzjc1年前1
aaronzjc1年前1 -
 luziyi 共回答了14个问题
luziyi 共回答了14个问题 |采纳率85.7%D
1年前查看全部
- 铬的价电子构型为3d54s1,而不是3d44s2,这主要决定与( )
铬的价电子构型为3d54s1,而不是3d44s2,这主要决定与( )
a、洪特规则
b、能量最低理论
c、泡利不相容原理 alic_80131年前1
alic_80131年前1 -
 天空之乘 共回答了20个问题
天空之乘 共回答了20个问题 |采纳率95%a 价电子在充满和半充满的时候更稳定.3d是10个,4s是2个 5个 1个 更稳定1年前查看全部
- 化40.下列分子和离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是 A.NH4+
 zhengrong03101年前1
zhengrong03101年前1 -
 xinyanqiu 共回答了20个问题
xinyanqiu 共回答了20个问题 |采纳率100%ABCD都是正四面体的构型,但是要使得分子构型为V,就必须保证只有3个原子(最典型的就是H2O)
所以只有D满足题意.1年前查看全部
- 为什么ClO-,ClO2-,ClO3-,ClO4-四种离子的空间构型相同?
为什么ClO-,ClO2-,ClO3-,ClO4-四种离子的空间构型相同?
它们中氯原子的杂化类型相同?
上面说错了,空间构型不同, 乖乖舞娘1年前0
乖乖舞娘1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- CO2,NF3,SF4,I3-,H3O+电子对的空间构型
 ww紫衣明珠1年前2
ww紫衣明珠1年前2 -
 dikao 共回答了23个问题
dikao 共回答了23个问题 |采纳率91.3%CO2:直线
NF3:四面体
SF4:三棱双锥
I3-:三棱双锥
H3O+:四面体1年前查看全部
- spdf怎么书写11.18号元素价电子构型?写在纸上.是写成spdf形式
 cywb1年前0
cywb1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1形容女子美好的字或词给人耳目一新的感觉,越多越好,如:姝靓姣 妍之类的
- 224点数学游戏 3,4,10,负6.只能用加减乘除
- 3向量合力做功问题f1=i+2j+3k,f2=-2i+3j-k,f3=3i-4j+5k,若f1f2f3共同作用在一个物体上
- 4用nervous look up from sth turn extra写段
- 5五的立方表示5*5*5的结果,用3m表示m个3相乘的结果.如果3m与3n的结果的个位数字相同,m大于n,且m.n都是
- 6有哪些写月亮的名句啊
- 7求圆柱面z^2+y^2=2z被锥面x^2=y^2+z^2所截下部分的面积
- 8阅读理解. Mr.Knott[not] was a teacher.H
- 9“中国东西部相当不一样”用英语怎么说?
- 10对温度与反应方向的关系,下列判断不正确的是 [ ] A.△H<0,△S>
- 11有关天然气的说法错误的是 [ ] A.天然气是当今世界最重要的气体矿物燃
- 12高中英语Mr. Write was seen ( )the palace museum. A.enter B.to en
- 13运用比喻,拟人,排比修辞手法描绘你所喜爱的一种植物,表达出你的喜爱之情
- 14雪花有几种形状?雪花很漂亮形状也很多有哪几种呢为什么形状都不相同呢?
- 15粮店运来一批大米,第一天卖了26吨,还剩这批大米的12分之5这批大米原来有多少吨?
