SDS-PAGE凝胶电泳的缓冲液
 soursoul2022-10-04 11:39:541条回答
soursoul2022-10-04 11:39:541条回答
SDS-PAGE凝胶电泳的缓冲液
30%的PAGE胶所用的缓冲液原来正常用的是0.5*的,这次我不小心用的是1*的,请问有影响吗?
30%的PAGE胶所用的缓冲液原来正常用的是0.5*的,这次我不小心用的是1*的,请问有影响吗?

已提交,审核后显示!提交回复
共1条回复
 悬崖爱 共回答了17个问题
悬崖爱 共回答了17个问题 |采纳率88.2%- 浓度是会影响分辨率和跑电泳的速度.
没什么大的影响的. - 1年前
相关推荐
- PCR 后酶切,凝胶电泳,EB染色,做的胶是一块胶上左右两个半块,每次右边半块不显色或者特别浅
PCR 后酶切,凝胶电泳,EB染色,做的胶是一块胶上左右两个半块,每次右边半块不显色或者特别浅
就是我做的胶是一块胶上最左边以及胶的中间各插了一个梳子,酶切后同时点样同时跑胶,为什么每次都是左边的那块显色很清楚,右边的那块就不清楚,甚至都没法判断条带是否分开了,有人说可能是因为EB跟DNA跑的方向相反,左边的那块上面跑完后EB更多一些,让我们跑完后泡EB溶液,还是没用.因为要加快速度,所以一定是要两边一起跑,请问有无高手知道什么原因怎么解决啊?我只有5个财富,都给了吧. ghgghg11年前3
ghgghg11年前3 -
 jasshe 共回答了13个问题
jasshe 共回答了13个问题 |采纳率100%看看胶是否水平,电泳是否水平.我怀疑你胶总是左边高,右边矮.
还有,你的电压太高,跑的时间过长,导致胶过热也是原因之一.不要超过100V,一般1%缓冲液跑15-20分钟足够了.
还有一种情况就是,右边的样本都跑出胶了,你看到的是左边的样本跑到右边的胶里面了,最好每跑5-10分钟看一下,以防跑过的可能1年前查看全部
- 有关DNA凝胶电泳的问题网上说“DNA分子越大在胶中的摩擦阻力就越大,泳动也越慢,迁移速率与线状DNA分子质量的对数值成
有关DNA凝胶电泳的问题
网上说“DNA分子越大在胶中的摩擦阻力就越大,泳动也越慢,迁移速率与线状DNA分子质量的对数值成反比.”
但是DNA分子越大,它所带电荷也越大呀,按说应该抵消一部分,泳动速度应该较上述说法快一些,而不是完全的反比吧? junlai_8881年前1
junlai_8881年前1 -
 一点隐私 共回答了22个问题
一点隐私 共回答了22个问题 |采纳率95.5%“DNA分子越大在胶中的摩擦阻力就越大,泳动也越慢,迁移速率与线状DNA分子质量的对数值成反比.”这个说法是对的.
DNA分子大,其带的电荷也大,分子质量也大.DNA荷质比基本恒定,在相同的电场下,若不考虑泳动阻力(也就是在溶液中而不是在凝胶内),不同大小的DNA分子的泳动速率相同.但在凝胶中,越大的DNA分子泳动时受到的阻力越大(就象老鼠和大象比赛跑步,假定两者在平地上跑动速度一样,在密林中,肯定是老鼠快),所以,造成了泳动速率的差别.1年前查看全部
- DNA提取物,凝胶电泳检测的结果如图所示,能帮我分析一下吗?谢谢!
DNA提取物,凝胶电泳检测的结果如图所示,能帮我分析一下吗?谢谢!

为什么会有拖带,而且孔里会发亮,刚学这个东西,望各位帮忙.
 Badass1年前1
Badass1年前1 -
 luguian8 共回答了13个问题
luguian8 共回答了13个问题 |采纳率84.6%拖带可能是质粒降解
也有可能是盐浓度过高
发亮多半是因为有杂蛋白没有去干净,样品没有加热变性处理?
上游做的不多,供参考1年前查看全部
- 凝胶电泳图像的处理与打印这是我们做的DNA电泳图,写实验报告时要求打印出来,但是打印效果很差,我们小组是左数第三条,一片
凝胶电泳图像的处理与打印

这是我们做的DNA电泳图,写实验报告时要求打印出来,但是打印效果很差,我们小组是左数第三条,一片漆黑.图片能够修改吗?如果可以的话怎么修? 135123589451年前1
135123589451年前1 -
 judechou 共回答了18个问题
judechou 共回答了18个问题 |采纳率88.9%修饰很简单啊,在Word里面调整图片的亮度和明暗对比度,然后改为黑白模式,在旁边用文本框加上Marke大小标注,彩打黑白随意.提醒下,marker一般在左边,你不是点样点反了,就是拍照时胶放反了……1年前查看全部
- 凝胶电泳“这种情况可以将第一次电泳分开的斑点通过支持介质间的接触印记转移到第二个支持介质上,旋转90°,进行第二次电泳”
凝胶电泳
“这种情况可以将第一次电泳分开的斑点通过支持介质间的接触印记转移到第二个支持介质上,旋转90°,进行第二次电泳”
问下,这句话中“支持介质间的接触印记转移到第二个支持介质上”和“旋转90°”怎么理解,..
好厉害,最后一个问题:双向是不是第一次电泳时形成了一条带,然后第二次沿这条带的垂直方向再电泳一次,使他集中成一点?是不是 何处他乡1年前1
何处他乡1年前1 -
 gene_new 共回答了19个问题
gene_new 共回答了19个问题 |采纳率84.2%接触印记转移到第二个支持介质上,就是用另一种对目标物质亲和力更好的介质,把目标分子转移过去(就是贴在下面,然后吸过去);旋转90度,就是双向电泳的意思,第一次电泳把想要分离的物质集中在某一条带上,第二次电泳再进行分离,这样提高了点用的分辨率.1年前查看全部
- 降解的DNA能做PCR吗?我用酚-氯仿抽提的DNA,经凝胶电泳后发现DNA存在降解的情况,请问这样的标本做PCR的话对结
降解的DNA能做PCR吗?
我用酚-氯仿抽提的DNA,经凝胶电泳后发现DNA存在降解的情况,请问这样的标本做PCR的话对结果会有什么影响呢? yoyo_荣梦海1年前5
yoyo_荣梦海1年前5 -
 穗汐 共回答了17个问题
穗汐 共回答了17个问题 |采纳率94.1%PCR扩增原则上对你模板要求不高,因此单纯降解对PCR结果影响不大,除非你做长PCR,或者进行多态分析(如RAPD).但是你单纯用酚-氯仿抽提,可能会造成DNA里面蛋白、酚、氯仿和其他杂质较多,因此会影响PCR结果.因此建议你进行260/280,230/260分光光度计测定.如果比值异常,建议你对DNA进行纯化,纯化可以采用酒精沉淀方法进行.
目前大多数实验室已经很少用酚-氯仿抽提来进行DNA提取,除非实在是想节约经费.如果经费允许,可以使用试剂盒进行提取,目前国产试剂盒一个样品2-3元,进口约10-15元,效果很好.提取DNA进行PCR没有问题.1年前查看全部
- DNA凝胶电泳实验中EB的作用?EB即溴化乙锭,DNA诱变剂,作用机理是什么?
 清蒸猫1年前1
清蒸猫1年前1 -
 荣达岂不伟 共回答了20个问题
荣达岂不伟 共回答了20个问题 |采纳率95%1溴化乙锭是一种高度灵敏的荧光染色剂,用于观察琼脂糖和聚丙烯酰胺凝胶中的DNA.
2溴化乙锭可以嵌入碱基分子中,导致错配.许多人认为溴化乙锭是强诱变剂,具有高致癌性.
溴化乙锭用标准302nm 紫外光透射仪激发并放射出橙红色信号,可用Polaroid 底片或带CCD 成像头的凝胶成像处理系统拍摄.
溴化乙锭含有一个可以嵌入DNA堆积碱基之间的一个三环平面基团.它与DNA的结合几乎没有碱基序列特异性.在高离子强度的饱和溶液中,大约每2.5个碱基插入一个溴化乙锭分子.当染料分子插入后,其平面基团与螺旋的轴线垂直并通过范德华力与上下碱基相互作用.这个基团的固定位置及其与碱基的密切接近,导致与DNA结合的染料呈现荧光,其荧光产率比游离溶液中染料有所增加.DNA吸收254nm处的紫外辐射并传递给染料,而被结合的染料本身吸收302nm和366nm的光辐射.这两种情况下,被吸收的能量在可见光谱红橙区的590nm处重新发射出来.由于溴化乙锭-DNA复合物的荧光产率比没有结合DNA的染料高出20-30倍,所以当凝胶中含有游离的溴化乙锭(0.5ug/ml)时,可以检测到少至10ng的DNA条带.1年前查看全部
- SDS-PAGE凝胶电泳图谱为何纯化后还有多个条带,如何才能达到更好的纯化效果?
 dsfhnmdfhg1年前2
dsfhnmdfhg1年前2 -
 love-yanhuo 共回答了21个问题
love-yanhuo 共回答了21个问题 |采纳率90.5%蛋白质吗?
可能是没纯化好,或者实验过程中,蛋白质被氧化了
SDS使寡聚体蛋白解聚,实际测定出来的相对分子质量,只是代表寡聚体蛋白的亚基分子质量.如血红蛋白有两条带……血红蛋白是由两个α-亚基和两个β-亚基组成的一种四聚体.1年前查看全部
- 老师要求我们用手画DNA凝胶电泳的图,囧.有会画的么,求指教
 tomboy8101年前1
tomboy8101年前1 -
 流花伏影 共回答了21个问题
流花伏影 共回答了21个问题 |采纳率95.2%你做了实验的话就照着画,没做的话根据你DNA分子量情况以及纯度数量选择泳段和宽度,不知道图样的话,搜索DNA marker 看看就知道了,我觉得画图不是目的,老师是想知道你是否知道你实验中的DNA会在哪个分子量的区段出现,以及纯度,数量.1年前查看全部
- PCR产物凝胶电泳不理想是怎么回事?
PCR产物凝胶电泳不理想是怎么回事?
师姐在二月做了一次,我在五月重复了很多次都不理想,许多条带跑不出来.问一下是不是多次冻融模板DNA降解了.

 _一叶飘雪1年前3
_一叶飘雪1年前3 -
 紧张的可怜人 共回答了20个问题
紧张的可怜人 共回答了20个问题 |采纳率90%建议与marker一起跑电泳,如果marker跑出的带是完整的,而模板DNA有拖尾、弥散等,就基本可以确定模板DNA降解了;如果marker跑出的带也是弥散的,那可能是琼脂糖质量不好,或者是电泳Buffer不好,建议换琼脂糖、重配Buffer.1年前查看全部
- 凝胶过滤层析中和凝胶电泳中的分子筛效应有什么不同,请尽量全面
 Blando1年前3
Blando1年前3 -
 sxt901212 共回答了27个问题
sxt901212 共回答了27个问题 |采纳率88.9%凝胶过滤层析是根据分子大小不同从而实现分离,所以它的分子筛效应是大分子进不去先出去,小分子后出去.而凝胶电泳是根据带电分子在电场中受力不同以致移动速度不同从而实现分离,所以它的分子大小适中都可以进进入层析柱中的空隙.1年前查看全部
- 凝胶过滤层析中和凝胶电泳中的分子筛效应有什么不同
 明月笑我痴1年前1
明月笑我痴1年前1 -
 0318L 共回答了17个问题
0318L 共回答了17个问题 |采纳率88.2%凝胶过滤层析也称分子筛层析、排阻层析.是利用具有网状结构的凝胶的分子筛作用,根据被分离物质的分子大小不同来进行分离.层析柱中的填料是某些惰性的多孔网状结构物质,多是交联的聚糖(如葡聚糖或琼脂糖)类物质,小分子物质能进入其内部,流下时路程较长,而大分子物质却被排除在外部,下来的路程短,当一混合溶液通过凝胶过滤层析柱时,溶液中的物质就按不同分子量筛分开了.
而在聚丙烯酰胺凝胶电泳(PAGE)中,蛋白质的迁移率取决于它所带净电荷以及分子的大小和形状等因素.进入分离胶后,由于聚丙烯酰胺的分子筛作用,小分子的蛋白质可以容易的通过凝胶孔径,阻力小,迁移速度快;大分子蛋白质则受到较大的阻力而被滞后,这样蛋白质在电泳过程中就会根据其各自分子量的大小而被分离.整块胶板相当于一个分子筛.1年前查看全部
- 怎样通过凝胶电泳图谱检测DNA的纯度和浓度
 laweyes1年前1
laweyes1年前1 -
 cchanghui 共回答了19个问题
cchanghui 共回答了19个问题 |采纳率73.7%这个应该用分光光度计检测啊,浓度看OD260,纯度看OD260/OD280以及OD260/OD230.
要是非用电泳检测,纯度就看看点样孔是否发亮,发亮的话是有蛋白质,浓度的话可以在旁边加一个已知浓度的marker.1年前查看全部
- 凝胶过滤层析中和凝胶电泳中的分子筛效应有什么不同?为什么?
凝胶过滤层析中和凝胶电泳中的分子筛效应有什么不同?为什么?
要求比较标准的答案,这是王镜岩版生物化学的一道课后习题. yoyo_yy1年前2
yoyo_yy1年前2 -
 凌芸RIO 共回答了18个问题
凌芸RIO 共回答了18个问题 |采纳率88.9%凝胶过滤层析中每一个凝胶珠相当于一个分子筛,故小分子所经过的路径长,落在大分子后面;而凝胶电泳中整块胶板相当于一个分子筛,故大分子受到的阻力大而迁移慢,落在小分子后面.1年前查看全部
- 有谁知道进行蛋白电泳时温度升高对电泳结果有影响吗?是SDS-PAGE 凝胶电泳.
 123456ellen1年前3
123456ellen1年前3 -
 古道西风菊花 共回答了16个问题
古道西风菊花 共回答了16个问题 |采纳率93.8%有一定影响,但影响不大.因为样品已经是变性的了.电泳时温度升高会使胶的密度产生变化,影响样品 的形状.也容易产生热扩散.要是害怕,可以在冰盒上进行电泳.1年前查看全部
- (2008•广东模拟)一对等位基因经某种限制性内切酶切割后形成的DNA片段长度存在差异,凝胶电泳分离酶切后的DNA片段,
(2008•广东模拟)一对等位基因经某种限制性内切酶切割后形成的DNA片段长度存在差异,凝胶电泳分离酶切后的DNA片段,与探针杂交后可显示出不同的带谱.根据该特性,就能将它作为标记定位在基因组的某一位置上.现有一对夫妇生了四个儿女,其中1号性状特殊(如图),由此可推知这四个儿女的基因型(用D、d 表示)正确的是( )
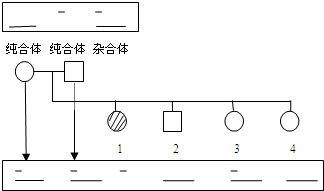
A.1号为XdXd
B.2号为XDY
C.3号为Dd
D.4号为DD maoren1071年前1
maoren1071年前1 -
 Titanic128 共回答了24个问题
Titanic128 共回答了24个问题 |采纳率95.8%解题思路:分析系谱图:父母均正常,但1号女儿却有特殊的性状,即“无中生有为隐性,隐性看女病,女病男正非伴性”,说明该性状属于常染色体隐性遗传,父亲均为杂合子(Dd),1号为隐性纯合体(dd),2号和4号都是显性纯合体(DD),3号为杂合体(Dd).A、1号为隐性纯合体dd,A错误;
B、2号是显性纯合体DD,B错误;
C、3号是杂合体Dd,C正确;
D、4号是显性纯合体DD,D正确.
故选:CD.点评:
本题考点: 基因的分离规律的实质及应用.
考点点评: 本题结合系谱图和凝胶电泳结果图,考查基因的分离规律的实质及应用、人类遗传病,首先要求考生根据系谱图,采用口诀正确判断该性状的遗传方式;其次根据图中信息及电泳结果准确判断各个个体的基因型,属于考纲理解层次的考查.1年前查看全部
- 什么是电泳,电泳的概念是什么?只是单纯的电泳的概念,不是纸电泳或者凝胶电泳?
 RIYADH1年前1
RIYADH1年前1 -
 ap0507515 共回答了18个问题
ap0507515 共回答了18个问题 |采纳率88.9%在确定的条件下,带电粒子在单位电场强度作用下,单位时间内移动的距离(即迁移率)为常数,是该带电粒子的物化特征性常数[1].不同带电粒子因所带电荷不同,或虽所带电荷相同但荷质比不同,在同一电场中电泳,经一定时间后,由于移动距离不同而相互分离.分开的距离与外加电场的电压与电泳时间成正比.在外加直流电源的作用下,胶体微粒在分散介质里向阴极或阳极作定向移动,这种现象叫做电泳.利用电泳现象使物质分离,这种技术也叫做电泳.胶体有电泳现象,证明胶体的微粒带有电荷.各种胶体微粒的本质不同,它们吸附的离子不同,所以带有不同的电荷.1年前查看全部
- dna凝胶电泳带不直是什么原因?
 jiaofu_no1年前2
jiaofu_no1年前2 -
 clare_wu 共回答了14个问题
clare_wu 共回答了14个问题 |采纳率100%如果你能确定样品没问题,(没有跑半路自动降解等问题),那么可能是下列情况:
1.胶没配好,不均匀,所以浓度高的地方跑的慢,低的跑得快,所以就是不平的.解决办法,配的时候小心点.
2.电泳槽出毛病了,电压不均匀.解决办法,换个试试
3.上样的时候混了
4.拔梳子的时候从一边拔把下面弄弯了1年前查看全部
- 求二维凝胶电泳中用到的试剂和配方,
求二维凝胶电泳中用到的试剂和配方,
请问一下你们有谁做过二维凝胶电泳实验的,麻烦您把所做的二维电泳的完整操作步骤及所用到的试剂还有实验心得告诉在下, May8281年前1
May8281年前1 -
 98块7毛9分45厘 共回答了15个问题
98块7毛9分45厘 共回答了15个问题 |采纳率93.3%操作步骤
(一)第一向等电聚焦(用自制的电泳上样缓冲液,17cm的胶条,pH 4-7)
1. 从冰箱中取-20℃冷冻保存的水化上样缓冲液(I)(不含DTT,不含Bio-Lyte)一小管(1ml/管),置室温溶解.
2. 在小管中加入0.01g DTT, Bio-Lyte 4-6、5-7各2.5μl,充分混匀.
3. 从小管中取出400μl水化上样缓冲液,加入100μl样品,充分混匀.
4. 从冰箱取-20℃冷冻保存的IPG预制胶条(17cm pH 4-7),于室温放置10分钟.
5. 沿着聚焦盘或水化盘中槽的边缘至左而右线性加入样品.在槽两端各1cm左右不要加样,中间的样品液一定要连贯.注意:不要产生气泡.否则影响到胶条中蛋白质的分布.
6. 当所有的蛋白质样品都已经加入到聚焦盘或水化盘中后,用镊子轻轻的去除预制IPG胶条上的保护层.
7. 分清胶条的正负极,轻轻地将IPG胶条胶面朝下置于聚焦盘或水化盘中样品溶液上,使得胶条的正极(标有+)对应于聚焦盘的正极.确保胶条与电极紧密接触.不要使样品溶液弄到胶条背面的塑料支撑膜上,因为这些溶液不会被胶条吸收.同样还要注意不使胶条下面的溶液
16
产生气泡.如果已经产生气泡,用镊子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶到胶条以外.
8. 在每根胶条上覆盖2-3ml矿物油,防止胶条水化过程中液体的蒸发.需缓慢的加入矿物油,沿着胶条,使矿物油一滴一滴慢慢加在塑料支撑膜上.
9. 对好正、负极,盖上盖子.设置等电聚焦程序.
10.聚焦结束的胶条.立即进行平衡、第二向SDS-PAGE电泳,否则将胶条置于样品水化盘中,-20℃冰箱保存.
(二)第二向SDS-PAGE电泳
1. 配制10%的丙烯酰胺凝胶两块.配80ml凝胶溶液,每块凝胶40ml,将溶液分别注入玻璃板夹层中,上部留1cm的空间,用MilliQ水、乙醇或水饱和正丁醇封面,保持胶面平整.聚合30分钟.一般凝胶与上方液体分层后,表明凝胶已基本聚合.
2. 待凝胶凝固后,倒去分离胶表面的MilliQ水、乙醇或水饱和正丁醇,用MilliQ水冲洗.
3. 从-20℃冰箱中取出的胶条,先于室温放置10分钟,使其溶解.
4. 配制胶条平衡缓冲液I.……参考网址on http://www.***.com/experiment/electrophoresis/286159.html1年前查看全部
- 关于PCR和凝胶电泳~(为什么老吞我的提问啊?)因为有图,俺做的东西其实不难,就是提取个DNA,然后做下PCR,再跑下胶
关于PCR和凝胶电泳~
(为什么老吞我的提问啊?)
因为有图,
俺做的东西其实不难,就是提取个DNA,然后做下PCR,再跑下胶,几乎不用动脑子。
但是现在又个严重的问题是,撇开DNA提取不说。每次新的试剂盒到时都要做个验证实验,
就是用纯DNA稀释液,做个梯度实验,一个浓度的稀释液点2管,并列的。但是跑完胶以后
两管显示的信号就是不一样,总是有强弱。明明是同一管稀释液的样品啊。
是不是移液枪操作有什么问题,有什么改正方法?
(不能贴链接,杯具...) yoyo期待1年前1
yoyo期待1年前1 -
 小宝的gg 共回答了19个问题
小宝的gg 共回答了19个问题 |采纳率84.2%用胶去做DNA定量本身就不是很精确的
此外稀释的时候是否混匀
点样的时候是否精确
胶的质地是否均匀
EB染色条件是否一致
显色的条件是否统一
影响因素蛮多的
不知道你具体是怎么做的
随便提点建议,你仔细考虑一下吧1年前查看全部
- 琼脂糖浆凝胶电泳中载样缓冲液的作用
琼脂糖浆凝胶电泳中载样缓冲液的作用
就是做重组DNA酶切分析时点样前加在样品中的缓冲液:6X载样缓冲液 osegjkljkljkl1年前2
osegjkljkljkl1年前2 -
 阳光与水 共回答了15个问题
阳光与水 共回答了15个问题 |采纳率93.3%第一:其中含有的甘油可以使待电泳样品沉在点样孔底部,避免样品漂浮:第二,其中含有的溴酚蓝(某些还含有二甲苯青)可以作为电泳进度的指示分子,溴酚蓝的迁移位置大约相当于200 bp左右的线性DNA分子的迁移位置.1年前查看全部
- 怎样分析凝胶电泳图像的条带?PCR扩增的目的是什么?
怎样分析凝胶电泳图像的条带?PCR扩增的目的是什么?
带有Marker的电泳图像怎么分析,怎么确定电泳条带中DNA的大小?另外,我们为什么要对少量的DNA进行PCR扩增?以Marker为参照,DNA扩增前后,DNA相对于Marker的位置是同样的吗?
 23zt1年前4
23zt1年前4 -
 公园5 共回答了13个问题
公园5 共回答了13个问题 |采纳率92.3%你用的应该是DL2000Marker 每一条带都代表一个分子量 看一下目的条带靠近哪条带能估算出分子量
PCR扩增是为了得到目的带 扩大浓度进行后续试验
DNA扩增前后的位置取决于你扩增的目的片段的长度 以及PCR体系是否合理1年前查看全部
- sds凝胶电泳的蛋白质分子量 maker是什么
 ericleung8001年前2
ericleung8001年前2 -
 小小岛屿 共回答了23个问题
小小岛屿 共回答了23个问题 |采纳率91.3%maker是一系列已知分子量的蛋白混合物,通过maker中蛋白迁移的距离,绘制标准曲线可以算出需要测定的蛋白分子量大小.1年前查看全部
- 应用PCR扩增来鉴定细菌是为什么要进行凝胶电泳?
 小南20031年前4
小南20031年前4 -
 风雨飘零_ 共回答了26个问题
风雨飘零_ 共回答了26个问题 |采纳率100%电泳后的迁移距离对照参照marker可以用来确定片段长度,以此来进行鉴定1年前查看全部
- 英语翻译凝胶电泳是分析复杂蛋白质混合物、分析某一蛋白质或者多肽相对含量的一种常用方法,是一种检测蛋白质纯度、评估蛋白质分
英语翻译
凝胶电泳是分析复杂蛋白质混合物、分析某一蛋白质或者多肽相对含量的一种常用方法,是一种检测蛋白质纯度、评估蛋白质分子量的强有力的生化分析方法.蛋白质电泳后聚丙烯酰胺凝胶的染色是非常重要的步骤,考马斯亮蓝染色可以说是目前使用最为广泛的一种方法.考马斯亮蓝染色具有以下优点:一是实验成本低且不需配备昂贵的扫描设备;二是实验方案很多,可以根据自己的需要在操作简便与高灵敏度之间进行选择;三是与质谱的兼容性好.因此,此次主要试验几种适用于DNA结合蛋白电泳的考马斯亮蓝染色方法的比较.
1楼那位童鞋.这个是你自己翻译的么 还是? yzlming1年前1
yzlming1年前1 -
 青叶虫虫 共回答了14个问题
青叶虫虫 共回答了14个问题 |采纳率92.9%正好看到,匆匆翻译了一下.要是有疏漏,提醒一下,呵呵.
Gel electrophoresis is a popular method to analyze protein mixture, measure the relative amount of protein or peptide species. It is also a powerful biochemical analysis tool to detect protein purity and its molecular weight. PAGE gel staining after electrophoresis is a critical step. Coomassie stain is one of the most popular methods. It has the following advantages: First of all, low cost for the reagents and also does not require expensive scanning equipment. Secondly, many protocols can be chosen from to fit the experimental requirement to balance between simplicity and sensitivity. Last but not the least, it is also well compatible with the mass spectrometry. The current experiment compared several Coomassie stain protocols that used in DNA binding protein electrophoresis assay.1年前查看全部
- PCR扩增一个500bp大小的DNA片段,若用凝胶电泳检测,用多大浓度的琼脂糖凝胶
 only1061年前1
only1061年前1 -
 aiwenrong 共回答了18个问题
aiwenrong 共回答了18个问题 |采纳率88.9%1%的琼脂糖凝胶即可,还要选好DNA marke1年前查看全部
- 高中生物题求详解现有一长度为3000碱基对(bp)的线性DNA分子,用限制性核酸内切酶酶切后,进行凝胶电泳,使降解产物分
高中生物题求详解
现有一长度为3000碱基对(bp)的线性DNA分子,用限制性核酸内切酶酶切后,进行凝胶电泳,使降解产物分开.用酶H单独酶切,结果如图1.用酶B单独酶切,结果如图2.用酶H和酶B同时酶切,结果如图3.该DNA分子的结构及其酶切图谱是

我主要不明白的是怎么看碱基片段.图三为什么是两个600一个1400一个400..看着像一个200一个800和一个2000
 halfme1年前1
halfme1年前1 -
 amywongxm 共回答了27个问题
amywongxm 共回答了27个问题 |采纳率77.8%稍等,发个图给你.1年前查看全部
大家在问
- 1下图为“北京时间16点,太阳直射A点时的光照图”,A点的是纬度20°N。读图回答下列问题。
- 2come back from work的汉语是什么
- 3前一阶段,我重视了文化学习,因此忽视了体育锻炼.修改病句
- 4下列情况中的运动物体,不能被看成质点的是( )
- 5一张来自纽约的明信片译成英语是什么?
- 6关于"罗"字的繁体字左下角是四点还是3点?整个下部分可以看作"维"吗?另外这个繁体字的来历是怎样的?查过字典词典啦,只有
- 7以“石头与山头”为话题写一篇作文,要新!
- 8she did this to your hair翻译
- 9你们一家如何庆祝中秋节?我们欢聚一堂,吃顿丰盛的晚宴、品尝月饼然后赏满月.用英文怎么写?
- 10(1)给下列词语选择正确的的读音.
- 11半坡人、河姆渡人、大汶口人的相同之处
- 12已知函数f(x)=2x-12x+1,则下列判断中正确的是( )
- 13“雪姬”用英文怎么说(这是人名。)
- 14英语诗歌格律分析Mark the rhythm of the stanzas below and comment on
- 15He borrowed a book the other day,the author(of which)is a wo
