C2H4(g)+3O2(g)=2CO2(g)+2H2O 在绝热、恒压和不作非体积功的条件下,下反应过程的Q( );W(
 jinjin1234562022-10-04 11:39:541条回答
jinjin1234562022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 阿得外思 共回答了24个问题
阿得外思 共回答了24个问题 |采纳率79.2%- Q=0,W=0,U=0
- 1年前
相关推荐
- 绝热下,气体体积增大,对外做功,内能减小,但分子势能增大,内能增大,岂不矛盾
绝热下,气体体积增大,对外做功,内能减小,但分子势能增大,内能增大,岂不矛盾
内能由温度和体积决定,绝热下温度不变,
分子势能增大体积必增大,内能不就变大了吗? Kindleslie1年前1
Kindleslie1年前1 -
 ainimeibu 共回答了23个问题
ainimeibu 共回答了23个问题 |采纳率100%首先,分子势能基本只在液体和固体中才有.气体间距离非常大,气体分子间的相互作用力几乎可以忽略不计,分子势能可以忽略.理想气体的内能就是温度的函数,实际气体温度对内能的影响也远大于体积的影响.第二,注意是绝热而...1年前查看全部
- 绝热过程的熵变,向真空膨胀的熵变,向真空蒸发的熵变,绝热真空膨胀熵变的计算及原理
 易水寒居士1年前1
易水寒居士1年前1 -
 逝花影落 共回答了18个问题
逝花影落 共回答了18个问题 |采纳率88.9%熵是一个宏观的状态函数,绝热可逆过程熵变为零.
一般来讲,光考虑气体分子热运动的话(不考虑化学反应等等作弊行为),那么准静态的气体绝热过程是可逆的,也就是熵变为零.
这里有个前提就是准静态.指一个系统任何时刻都可以用pressure,volume,temperature等等物理量来描述,也就是说,内部是达到了热运动平衡的.气体向真空的膨胀过程中,不是平衡态.这种膨胀是不可逆的,熵变大于零.具体计算,可以设计一个准静态过程达到膨胀后的状态,因为熵是状态函数,和过程无关.
偷懒的直接用玻尔兹曼公式的推论计算膨胀后的熵减去膨胀前的熵就是了.
某个P,V,T状态下的理想气体的熵可以用S=nu C_V lnT + nu R lnV +S_0 来表示,nu是摩尔数,C_V是定容热容,S_0是个基准常数,表示除分子热运动外的其他熵,另外还有校准单位的作用,不用理会.1年前查看全部
- 一绝热容器被隔板隔开,左边有稀薄气体,右边真空.抽开隔板达平衡为什么温度不变?分子平均动能减小了啊
 hqbd8azf1年前1
hqbd8azf1年前1 -
 圣诞老人2004 共回答了18个问题
圣诞老人2004 共回答了18个问题 |采纳率83.3%绝热容器说明没热量交换,右边真空,左边气体到达右边时没阻力,即没有外力做功,气体内能不变,当然温度不变啊.1年前查看全部
- 绝热环境下5kg 100度的水加入20kg 0度的水中 最后平衡时是多少度?
 fhm231年前2
fhm231年前2 -
 情谢 共回答了15个问题
情谢 共回答了15个问题 |采纳率93.3%口算比例公式 (5*100+20*0)/(5+20)=20度1年前查看全部
- 如图所示,绝热的容器内密闭一定质量的气体(不考虑分子间的作用力),用电阻丝对其加热时,绝热活塞无摩擦地上升,下列说正确的
如图所示,绝热的容器内密闭一定质量的气体(不考虑分子间的作用力),用电阻丝对其加热时,绝热活塞无摩擦地上升,下列说正确的是( )
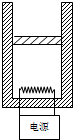 A. 活塞上升,气体对外做功,其内能减少
A. 活塞上升,气体对外做功,其内能减少
B. 电流对气体做功,气体对外做功,气体内能可能减少
C. 电流对气体做功,气体又对外做功,其内能可能不变
D. 电流对气体做功一定大于气体对外做功 carrieloo1年前2
carrieloo1年前2 -
 valentine1982 共回答了13个问题
valentine1982 共回答了13个问题 |采纳率92.3%解题思路:由题意可知气体为理想气体,分析活塞可知气体为等压变化;由等压变化规律可知气体体积及温度的变化;由热力学第一定律可知气体内能的变化.A、因活塞可无摩擦滑动,外界大气压强不变,故气体为等压变化;活塞上升的过程中气体体积增大,由理想气体状态方程知温度一定升高,内能增加,ABC错误;
D、因内能增大,由热力学第一定律可知,气体吸热一定大于对外做功,故D正确;
故选D.点评:
本题考点: 热力学第一定律.
考点点评: 热力学第一定律为热学中的重点内容,在学习中要注意重点把握.1年前查看全部
- 绝热的容器内密闭一定质量的气体(不考虑分子间的作用力),对气体缓慢加热时,绝热活塞无摩擦地上升
绝热的容器内密闭一定质量的气体(不考虑分子间的作用力),对气体缓慢加热时,绝热活塞无摩擦地上升
为什么活塞上升过程是等压变化?如果活塞能上升不是应该容器内的压强大于外界压强吗? 王智君1年前1
王智君1年前1 -
 shellings 共回答了17个问题
shellings 共回答了17个问题 |采纳率76.5%绝热的容器表明气体可以视为理想气体,可以运用盖吕萨克定律(压强相同,体积与温度的关系):一定质量的气体,在压强不变的情况下,它的体积跟热力学温度成正比.所以活塞上升,是等压变化.
你这题里没有提及外界压强.但如果不考虑活塞重量,那么容器内是与外界压强相同的.1年前查看全部
- 一个绝热密封容器,压缩体积温度会增加吗?压强会增加吗?为什么?
 海上游龙1年前4
海上游龙1年前4 -
 小炜1688 共回答了19个问题
小炜1688 共回答了19个问题 |采纳率84.2%理想气体状态方程pV=nRT,可知n,R是不变的,V减小,则单位面积上气体分子对器壁撞击次数增多,则P增强,由公式并不知道T是增大还是减小,很可能不变.1年前查看全部
- 范德华气体经绝热自由膨胀后,气体温度如何变化?
范德华气体经绝热自由膨胀后,气体温度如何变化?
这个问题用数学表达式怎么表达?
绝热自由膨胀和节流膨胀有什么区别? 么她1年前2
么她1年前2 -
 笨qq活该 共回答了14个问题
笨qq活该 共回答了14个问题 |采纳率85.7%绝热自由膨胀dQ、dW都等于零,但这是个不可逆过程,有熵变,dQ、dW是与过程有关的,一般计算要用可逆过程才好用微积分,还好dU = 0.所以这个问题数学表达为:(偏T比偏V)下标是U(式子不好打,见谅)这个问题汪志诚的热力学与统计物理上有 1.7节有一点 然后就用热力学第一定律微分式啊 麦氏关系啊 雅克比行列式啊推吧
节流过程是等焓的,可逆的.1年前查看全部
- 气体温度平衡变化直立绝热的圆桶容器,中间用隔板分成体积相同的两部分,上部充有密度较小的气体,下部有密度较大的气体,两部分
气体温度平衡变化
直立绝热的圆桶容器,中间用隔板分成体积相同的两部分,上部充有密度较小的气体,下部有密度较大的气体,两部分气体的初温相同,且不发生化学反应,设法抽去隔板,经过足够长时间后,则气体温度将怎么变化? lemon_mina1年前3
lemon_mina1年前3 -
 ayarlsj 共回答了22个问题
ayarlsj 共回答了22个问题 |采纳率77.3%平衡后气体重心上升,在中线,重力势能增大,所以内能减小,温度降低1年前查看全部
- 在绝热情况下向两份0.1mol/L的醋酸钠溶液中分别加入少量KNO3固体,为什么 c(Ac-)/c(Na+)会增大!
在绝热情况下向两份0.1mol/L的醋酸钠溶液中分别加入少量KNO3固体,为什么 c(Ac-)/c(Na+)会增大!
RT b4b_11181年前1
b4b_11181年前1 -
 痛打落水狗3377 共回答了17个问题
痛打落水狗3377 共回答了17个问题 |采纳率82.4%加入的少量硝酸钾,电离后发生盐效应使醋酸的表观离解度增大
更多的醋酸分子电离,Ac-浓度增大
故 c(Ac-)/c(Na+)会增大!1年前查看全部
- 理想气体绝热自由膨胀为何不可逆?
理想气体绝热自由膨胀为何不可逆?
既然dQ=0,熵变也应为0? 刀切馒头1年前3
刀切馒头1年前3 -
 云恋纱_aa 共回答了20个问题
云恋纱_aa 共回答了20个问题 |采纳率85%自由膨胀不是准静态过程.所以不能通过过程来计算熵变.
因为初末态的温度相等,可以设计一个等温膨胀过程来计算其熵变.可以发现熵变是增大的.1年前查看全部
- 2mol某单原子理想气体其始态为100000pa,273k,经过一绝热压缩过程至终态400000pa,546k,求:熵变
2mol某单原子理想气体其始态为100000pa,273k,经过一绝热压缩过程至终态400000pa,546k,求:熵变.
 franklin1191年前2
franklin1191年前2 -
 wozhaoyi 共回答了17个问题
wozhaoyi 共回答了17个问题 |采纳率88.2%DS=NCpmLnT2/T1+nRLnP1/P2=5.761年前查看全部
- 如图所示,一定质量的气体被绝热活塞封闭在绝热的气缸中,气缸固定,活塞通过细绳绕过定滑轮后与一沙桶连接.现不停地向沙桶中加
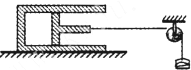 如图所示,一定质量的气体被绝热活塞封闭在绝热的气缸中,气缸固定,活塞通过细绳绕过定滑轮后与一沙桶连接.现不停地向沙桶中加沙子,使活塞缓慢地向右移动(活塞始终未被拉出气缸),则在活塞移动的过程中,下列说法正确的是( )
如图所示,一定质量的气体被绝热活塞封闭在绝热的气缸中,气缸固定,活塞通过细绳绕过定滑轮后与一沙桶连接.现不停地向沙桶中加沙子,使活塞缓慢地向右移动(活塞始终未被拉出气缸),则在活塞移动的过程中,下列说法正确的是( )
A.气体内能不断减小
B.外界对气体做功,气体内能不断增大
C.气体温度可能不变
D.气体分子单位时间单位面积撞击活塞的次数一定减少 弱痴儿童快乐多1年前1
弱痴儿童快乐多1年前1 -
 风行1979 共回答了23个问题
风行1979 共回答了23个问题 |采纳率82.6%解题思路:气缸和活塞绝热,因此不能和外界进行热交换,即Q=0;气体体积增大,对外做功,根据热力学第一定律得出其内能变化,进一步可求出其温度的变化情况;根据活塞处于平衡状态可求出气体压强的变化情况.在沙筒中加入沙子,使活塞缓慢右移,内部气体的体积增大,气体膨胀做负功,绝热汽缸没有热传递,根据热力学第一定律可知气体的内能减小,气体的内能与温度有关,内能减小温度一定减小,故A正确,BC错误;
根据活塞的平衡条件:PS+F=P0S,可得气体的压强P必然减小,故D正确.
故选:AD.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题考查了热力学第一定律与气态方程的相结合,对于这类问题的突破点往往是根据气体体积变化情况,根据热力学第一定律判断其内能的变化,进一步判断其它状态参量的变化情况.1年前查看全部
- 用隔板将一绝热容器隔成A和B两部分,A中盛有一定质量的理想气体,B为真空(如图①)。现把隔板抽去,A中的气体自动充满整个
用隔板将一绝热容器隔成A和B两部分,A中盛有一定质量的理想气体,B为真空(如图①)。现把隔板抽去,A中的气体自动充满整个容器(如图②),这个过程称为气体的自由膨胀。下列说法正确的是  [ ]
[ ]A.自由膨胀过程中,气体分子只作定向运动
B.自由膨胀前后,气体的压强不变
C.自由膨胀前后,气体的温度不变
D.容器中的气体在足够长的时间内,能全部自动回到A部分 tanya5205311年前1
tanya5205311年前1 -
 三瘋子 共回答了14个问题
三瘋子 共回答了14个问题 |采纳率92.9%C1年前查看全部
- 请问绝热的刚性容器中,发生2H2(g)+ O2(g) —2H2O(g)反应的焓变小于零么?
请问绝热的刚性容器中,发生2H2(g)+ O2(g) —2H2O(g)反应的焓变小于零么?
一般我们认为放热反应焓变都小于零,但那是对反应本身而言的,而且应该是在恒压条下。对该系统而言,△H=△U+△(PV),由于△U=0,所以△H= △(PV)=V△P,又由于该反应放热,系统的压力会升高,于是△H>0 ? 对于有化学反应发生的体系,可以这样算么?
烦请各位高人指点……谢谢
 电电101年前1
电电101年前1 -
 我是于楠 共回答了14个问题
我是于楠 共回答了14个问题 |采纳率92.9%不行 气体分子数减少压力减小 温度升高压力增大 总的效果无法判断~1年前查看全部
- 在298K时,1mol单原子理想气体从p0绝热不可逆等压压缩到终态压力为4p0.已知在298K、p0时,1mol单原子理
在298K时,1mol单原子理想气体从p0绝热不可逆等压压缩到终态压力为4p0.已知在298K、p0时,1mol单原子理想气体的规定熵为191.5 J.K-1mol-1.求该过程的Q、W 、△U、△H、△G、△S.
 xieb10011年前1
xieb10011年前1 -
 hh企老板 共回答了17个问题
hh企老板 共回答了17个问题 |采纳率94.1%这完全是热力学与统计物理啊1年前查看全部
- ██████████████我们知道“气体绝热自由膨胀”过程,系统内熵是增加的.而“气体绝热膨胀做功”过程,气体内部的熵
██████████████
我们知道“气体绝热自由膨胀”过程,系统内熵是增加的.
而“气体绝热膨胀做功”过程,气体内部的熵怎么变化呢呢?目前我看到的书上答案都是“气体绝热膨胀做功”,气体内部的熵不变.原因是对外做功无热传导,所以熵不变.
首先我们要弄清楚:缓慢膨胀和快速膨胀是不一样的,气体绝热缓慢膨胀做功,可以看成是可逆过程;而气体绝热快速膨胀做功,是不可逆过程.
我们来研究“气体绝热快速膨胀做功”这个过程.如果我们把活塞、气体、以及被做功物(比如发电机)看成一个系统整体.我们知道,孤立系统进行不可逆过程,熵是增加的.那么问题来了,这个过程中,受功者电动机是机械能转化为电能.机械能和电能都是零熵的.所以受功者电动机的熵是不变的.而系统整体的熵要增加.那么只有气体内的熵增加了.但是现在所有书上讲“气体绝热快速膨胀做功”都说气体的熵不变.这不是矛盾了吗?
我们知道卡诺循环里面气体绝热膨胀压缩是可逆过程.既然可逆,证明卡诺循环里面气体绝热膨胀压缩都是缓慢进行的.
而我们实际中的压缩机是个典型的“气体绝热快速压缩”的例子.但是不管是物理书还是制冷书上都说压缩机压缩气体时,气体的熵是不变的.
这个怎么回事? 1034691年前1
1034691年前1 -
 永无休止1 共回答了16个问题
永无休止1 共回答了16个问题 |采纳率100%1、应该是书上说得不准确,快速绝热做功膨胀确实是不可逆过程,熵应该增大.也有可能是前面还有准静态或者类似的词楼主没看清楚吧.
2、制冷机压缩气体的过程都视为理想过程,所以熵不变.1年前查看全部
- 双原子gas,初始P,V. 等温压缩到原来V的24.5%,压强为P1.绝热压缩到原来V的24.5%,压强P2.求P1/P
双原子gas,初始P,V. 等温压缩到原来V的24.5%,压强为P1.绝热压缩到原来V的24.5%,压强P2.求P1/P2.
 另外换别的1年前1
另外换别的1年前1 -
 yyy002005 共回答了15个问题
yyy002005 共回答了15个问题 |采纳率86.7%第一步等温压缩就是基本的PV/T公式
1.等温压缩,开始结束温度都是T, 等温压缩方程 PV=P1*(V*24.5%)
2..绝热压缩 ,
(P2/P1)*(V2/V1) ^ s = 1
这里 s=[(a+1)/a], a = 1/(r-1), 对双原子, r=7/5, 所以 a = 5/2, s = 7/5
开始时压强是 P1, 体积是 V1=V*24.5%, 结束时, 体积为 V*24.5%
(你是不是看错题了,如果这一步压缩完,体积不变,还是 V*25%, 那么因为没有热量进入,P1*V1/T=P2*V1/T2, P1/P2 = T/T2, 因为V1不变--没有做功,绝热--没有热量进入,物质不变,所以能量不变,唯一的物理解是T=T2, P1 = P2)
如果第二次绝热压缩后体积是第一次压缩后的24.5% 即 V2=V1*24.5%
P2/P1 *(24.5%)^1.4=1
P1/P2 = 0.141年前查看全部
- 高手来分析████████假设一个密闭的绝热容器(注意是绝热)这个密闭容器用隔板隔成A、B两个室.假设A室相对很小很小,
高手来分析████████
假设一个密闭的绝热容器(注意是绝热)
这个密闭容器用隔板隔成A、B两个室.假设A室相对很小很小,而B室相对很大很大.
现在在A室中装有30摄氏度的,压力为0.75Mpa的液态R12制冷剂.(R12在压力为0.75M时,沸点为30摄氏度,所以这时为饱和液体)
B室初始状态为绝对真空.
隔板用外力固定.
在B室中理想的假设悬空装一个数字温度感应器.(假设感应不到温度时,无显示)
然后我们迅速的拿掉隔板.
那么问题如下:
(1)因为我们假设这个温度感应器感应不到温度时没有显示,那么初始状态这个温度感应探头应该没有显示.因为B室是真空,而真空是不能传播热量的,所以温度感应探头无显示.——这个说法正确吗?
(2)当我们迅速拿开隔板后,A室里面原来的液体会出现什么变化的过程
(3)B室里面的温度感应探头降出现什么样的变化?
楼下1楼的答案不对.
(1)我们已经假设了是绝热容器,并且隔板也是绝热的.B室又是真空.所以对流、传导、辐射都无法影响B室的温度感应探头
(2)我们已经说了A室是饱和液体,所以拿开隔板后,液体因为压力降低、沸点降低所以会汽化. 南纬37度21年前1
南纬37度21年前1 -
 王家某虫 共回答了14个问题
王家某虫 共回答了14个问题 |采纳率100%1)你的问题应该是温度计感应不到“温度变化”吧!什么是感应不到“温度”啊?到处都有温度.我想你既然说容器是绝热的,那就应该不会有变化.答案是对的.
不过你没有说初始时B与A的温度是不是一样为30度,因为隔板如果不是绝热的(你没说隔板是绝热的),同时初始温度不一样,A是会向B进行热能辐射的.
(2)会先沸腾后停止.有两个过程:1、因为当拿掉隔板,气体体积膨胀,故而压力降低,气压降低会导致液体沸点降低,因此30度正好高于该液体沸点,液体沸腾.2、液体沸腾时汽化并吸收热量,因此会使室内温度降低,同时气压相对升高,使温度回升,最后停止沸腾,部分气体还是会恢复成液体状态,直到饱和状态.
(3)温度感应探头先降低后又恢复 30度1年前查看全部
- 一道华约热学题的疑问由于自行车撒气,气压下降1/4,求漏掉气体站原来气体的比例漏气过程绝热,PV^r=C可用一种答案是:
一道华约热学题的疑问
由于自行车撒气,气压下降1/4,求漏掉气体站原来气体的比例
漏气过程绝热,PV^r=C可用
一种答案是:
P0*V0^r=3/4 P0*Vt^r (1) 解出Vt,则比例K=(Vt-Vo)/Vt
为什么这样用?(1)式中研究的对象是什么?所有气体?剩余气体?漏出气体?为什么K可以这样得出? 我爱啦啦1年前0
我爱啦啦1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 两块质量相同的铜和铁,铜温度t1高于铁的温度t2,它们在绝热环境中互相接触,则热平衡时,它们之间
两块质量相同的铜和铁,铜温度t1高于铁的温度t2,它们在绝热环境中互相接触,则热平衡时,它们之间
A温度相同,都等于(t1+t2)÷2
B内能变化大小相等
C分子平均速率相等
D内能相等 dwhzw5221年前3
dwhzw5221年前3 -
 不章不段 共回答了17个问题
不章不段 共回答了17个问题 |采纳率88.2%A温度相同,都等于(t1+t2)÷2 错!
c1m(t1-t)= c2m(t-t2)
解上式,得t
B内能变化大小相等 错!
温度是内能的外在表象和量度.而t1-t不等于t-t2
C分子平均速率相等 错!
最后温度相同.而温度是分子平均动能的的外在表象和量度
D内能相等 对
温度相同就是内能相同.温度是内能的外在表象和量度1年前查看全部
- 系统经历绝热过程时一定可以认为是孤立系统,这句话对不对?
 Inigo1年前1
Inigo1年前1 -
 于地形眭地要楞这 共回答了27个问题
于地形眭地要楞这 共回答了27个问题 |采纳率88.9%定义
孤立系统:与外界无物质交换和热量交换
与外界无热量交换1年前查看全部
- 如图,两只完全相同的金属球A和B,A悬挂在不计热膨胀的绝热细线下,B放在不计热膨胀的绝热桌面上,当A、B两球升高相同的温
如图,两只完全相同的金属球A和B,A悬挂在不计热膨胀的绝热细线下,B放在不计热膨胀的绝热桌面上,当A、B两球升高相同的温度后,结合能的转化和守恒定律,可以判断A、B所吸收的热量( )
A. QA=QB
B. QA>QB
C. QA<QB
D. 不能确定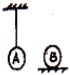
 小木屋里的温暖1年前2
小木屋里的温暖1年前2 -
 铅笔 共回答了16个问题
铅笔 共回答了16个问题 |采纳率100%解题思路:金属球受热后体积膨胀,A球重心下降重力做正功、B球重心上升重力做负功,结合热力学第一定律求解由于A、B两球升高相同的温度,故两球的内能的增量相同,由金属球受热后体积膨胀,A球重心下降重力做正功、B球重心上升重力做负功,由热力学第一定律得:
△U=Q+W,故Q=△U-W,因此QA<QB,
故选:C点评:
本题考点: 热力学第一定律.
考点点评: 注意分析金属球受热后体积膨胀后的重力做功情况,应用热力学第一定律时注意Q和W的正负1年前查看全部
- 20、如图,两个完全相同的球A和B,A是悬挂在不计热膨胀的绝缘细线下,B放在不计热膨胀的绝热桌面上,当A、B两球升高相同
20、如图,两个完全相同的球A和B,A是悬挂在不计热膨胀的绝缘细线下,B放在不计热膨胀的绝热桌面上,当A、B两球升高相同的温度后,所吸收的热量为( )
A、QA=QB B、 QA>QB
C、 QA Narcissns1年前2
Narcissns1年前2 -
 牛牛牛牛牛 共回答了14个问题
牛牛牛牛牛 共回答了14个问题 |采纳率85.7%您好!
选C.因为B的重心升高,重力势能增加,而A的重心下降,重力势能减少,吸收的热量=内能增加量+重力势能变化量,因此B吸收的热量多.1年前查看全部
- (2007•江苏)如图所示,绝热气缸中间用固定栓将可无摩擦移动的导热隔板固定,隔板质量不计,左右两室分别充有一定量的氢气
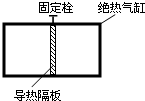 (2007•江苏)如图所示,绝热气缸中间用固定栓将可无摩擦移动的导热隔板固定,隔板质量不计,左右两室分别充有一定量的氢气和氧气(视为理想气体).初始时,两室气体的温度相等,氢气的压强大于氧气的压强,松开固定栓直至系统重新达到平衡,下列说法中正确的是( )
(2007•江苏)如图所示,绝热气缸中间用固定栓将可无摩擦移动的导热隔板固定,隔板质量不计,左右两室分别充有一定量的氢气和氧气(视为理想气体).初始时,两室气体的温度相等,氢气的压强大于氧气的压强,松开固定栓直至系统重新达到平衡,下列说法中正确的是( )
A.初始时氢分子的平均动能大于氧分子的平均动能
B.系统重新达到平衡时,氢气的内能比初始时的小
C.松开固定栓直至系统重新达到平衡的过程中有热量从氧气传递到氢气
D.松开固定栓直至系统重新达到平衡的过程中,氧气的内能先增大后减小 鱼过冬1年前1
鱼过冬1年前1 -
 飘落的栀子花 共回答了22个问题
飘落的栀子花 共回答了22个问题 |采纳率90.9%解题思路:理想气体的内能只与温度有关,则由温度的变化可知内能的变化;由热力学第一定律可知两部分气体间热量的传递方向.温度是分子平均动能的标志,温度相同,分子的平均动能相同,与分子质量无关,两部分气体温度相同,故分子的平均动能相同,故A错误;
松开固定栓至系统达到平衡过程中,先是氢气对氧气做功,内能减少,氧气内能增加,温度升高.由于存在温度差,发生热传递,最后两者温度相同,故氧气内能又减小,等于初始值,所以两种气体的内能与初始时相同.故B错误,CD正确;
故选CD点评:
本题考点: 热力学第一定律;温度是分子平均动能的标志;改变内能的两种方式;理想气体.
考点点评: 本题要注意理想气体分子间距离较大,故不计分子势能,分子内能只与温度有关,温度相同,则内能及分子的平均动能均相同.1年前查看全部
- 请问为什么在理想气体的绝热可逆过程中有公式:U的改变=最大体积功=等容摩尔热容乘以温度的改变量?
请问为什么在理想气体的绝热可逆过程中有公式:U的改变=最大体积功=等容摩尔热容乘以温度的改变量?
温度的改变量取的是高温减去低温,求得的内能变化一定是正值了吗?还是等容摩尔热容也可能是负的? 石雨198112121年前1
石雨198112121年前1 -
 是我蓝色雨 共回答了26个问题
是我蓝色雨 共回答了26个问题 |采纳率100%理想气体内能只由温度决定,定容过程只有吸热没有做功.所以内能变化由吸热决定
ΔU=nCvΔT
这个式子对理想气体任何过程都成立,因为揭示了内能与温度的关联.
绝热过程只有靠外界做功W改变内能.所以有
ΔU=nCvΔT=W
最大体积功我不明白你说的什么.
ΔT为正则ΔU为正,理想气体等容摩尔热容怎可能是负的.1年前查看全部
- H2(g)和O2(g)以 2:1 的比例在绝热刚性密闭容器中完全反应,下面错误的是 A.W = 0 B.Q = 0 C.
H2(g)和O2(g)以 2:1 的比例在绝热刚性密闭容器中完全反应,下面错误的是 A.W = 0 B.Q = 0 C.DU = 0 D.DT= 0
 xywsh1年前1
xywsh1年前1 -
 amugou 共回答了11个问题
amugou 共回答了11个问题 |采纳率90.9%d 放热 升温1年前查看全部
- 1.氢气和氧气在绝热钢瓶中生成水 为什么ΔS>0 2.H= U+PV P是体系压强还是环境压强
 tanhui661年前1
tanhui661年前1 -
 秦__风 共回答了15个问题
秦__风 共回答了15个问题 |采纳率86.7%1,熵增加原理可以说明。
绝热体系可以使用熵判据,因为发生了反应生成水,说明熵增加。
2,体系压强,因为系统的H or U都是对系统而言的,不需要考虑环境。1年前查看全部
- 绝热状态理想气体对外做功 温度是否一定下降
绝热状态理想气体对外做功 温度是否一定下降
对外做功内能减少 ,而理想气体又没有分子势能,一定放出热量 云泥尘寰1年前1
云泥尘寰1年前1 -
 肆意漂泊 共回答了18个问题
肆意漂泊 共回答了18个问题 |采纳率88.9%答案是对的,但是LZ的想法错了.
温度取决于内能没错,所以内能减少,温度当然下降.
接下来是关键
物体的内能取决于吸热放热和对内对外做功
公式是W=△+T
W是做功,△是吸放热,T是气体的温度
由于绝热,△不变,又对外做功,那么温度T怎么变不用我再讲了吧.1年前查看全部
- PT/V=C的公式和热力学中绝热过程做功引起的温度变化有何联系
PT/V=C的公式和热力学中绝热过程做功引起的温度变化有何联系
我是看到一道题目说 给车胎打气,引起车胎温度上升的原因是外界对车胎内气体做功而不是等容时压强变大引起的 屏开雀选1年前1
屏开雀选1年前1 -
 露水轻扬 共回答了17个问题
露水轻扬 共回答了17个问题 |采纳率94.1%这个式子前提条件是对于等量的气体(书上肯定有).注意PT/V=C中的C和气体的量有关,你在打气的时候,C是在变的(气体的量越来越多),所以不能说P大了,V不变,T就小了,不对的1年前查看全部
- 下列现象不可能发生的是( )A.在一与外界绝热的房间内,将一台正在工作的电冰箱的门打开,能使该房间降温B.蒸汽机把蒸汽
下列现象不可能发生的是( )
A.在一与外界绝热的房间内,将一台正在工作的电冰箱的门打开,能使该房间降温
B.蒸汽机把蒸汽的内能全部转化为机械能
C.一个在粗糙的水平地面上运动的物体最终要停下来,物体的动能全部转化为内能
D.在热传导中,热量可以自发的从高温物体传向低温物体 lfmouse1年前1
lfmouse1年前1 -
 GreatsJY 共回答了18个问题
GreatsJY 共回答了18个问题 |采纳率83.3%解题思路:根据能量守恒定律知,将一台正在工作的电冰箱的门打开,该房间温度升高,机械能可以全部转化为内能,内能不能全部转化为机械能,热量可以自发的从高温物体传向低温物体.A、根据能量守恒定律知,将一台正在工作的电冰箱的门打开,该房间温度升高,A错误;
B、机械能可以全部转化为内能,内能不能全部转化为机械能,B错误;
C、在粗糙的水平地面上运动的物体最终要停下来,物体的动能全部克服摩擦力做功转化为内能,C正确;
D、在热传导中,热量可以自发的从高温物体传向低温物体,D正确;
本题选不可能的,故选:AB点评:
本题考点: 热力学第二定律;热力学第一定律.
考点点评: 本题考查了机械能和内能间的相互转化,知道机械能可以全部转化为内能,内能不能全部转化为机械能.1年前查看全部
- 1mol理想气体经绝热自由膨胀使其体积增大为原体积的10倍,则系统的熵变为:
1mol理想气体经绝热自由膨胀使其体积增大为原体积的10倍,则系统的熵变为:
① ΔS=0
② ΔS=19.1J·K-1
③ ΔS>19.1J·K-1
④ ΔS<19.1J·K-1 SSDD2441年前1
SSDD2441年前1 -
 我是年年 共回答了21个问题
我是年年 共回答了21个问题 |采纳率81%答案选第二个,△s=Rln10=8.31*2.3=19.1J*K-11年前查看全部
- 如图所示,用一根与绝热活塞相连的细线将绝热气缸悬挂在某一高度静止不动,气缸开口向上,内封闭一定质量的气体,缸内活塞可以无
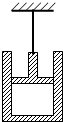 如图所示,用一根与绝热活塞相连的细线将绝热气缸悬挂在某一高度静止不动,气缸开口向上,内封闭一定质量的气体,缸内活塞可以无摩擦移动且不漏气,现将细线剪断,让气缸自由下落,下列说法正确的是( )
如图所示,用一根与绝热活塞相连的细线将绝热气缸悬挂在某一高度静止不动,气缸开口向上,内封闭一定质量的气体,缸内活塞可以无摩擦移动且不漏气,现将细线剪断,让气缸自由下落,下列说法正确的是( )
A.气体压强减小,气体对外界做功
B.气体压强增大,外界对气体做功
C.气体体积增大,气体内能减小
D.气体体积减小,气体内能增大 修依果1年前1
修依果1年前1 -
 飞花的日子 共回答了15个问题
飞花的日子 共回答了15个问题 |采纳率86.7%解题思路:对气缸进行受力分析,求出气缸内气体的压强,剪断绳子后,气缸做自由落体运动,分析缸内气体压强如何变化,然后分析答题.设大气压为P0,气缸质量为M,横截面积为S,则气缸内气体压强P=P0-[Mg/s]
剪断细线后,气缸自由下落,处于完全失重状态,气缸内气体压强P=P0,
缸内气体压强变大,所以气体体积减小,外界对气体做功,气体内能增大,所以BD正确.
故选BD.点评:
本题考点: 理想气体的状态方程.
考点点评: 气缸自由下落时,活塞对气体就没有压力了,此时气体的压强和大气压强相同,分析出气体压强即可解决本题.1年前查看全部
- 用隔板将一绝热容器隔成A和B两部分,A中盛有一定质量的理想气体,B为真空(如图①),现把隔板抽去,A中的气体自动充满整个
用隔板将一绝热容器隔成A和B两部分,A中盛有一定质量的理想气体,B为真空(如图①),现把隔板抽去,A中的气体自动充满整个容器(如图②),这个过程称为气体的自由膨胀,下列说法正确的是( )
 A. 自由膨胀过程中,气体分子只做定向运动
A. 自由膨胀过程中,气体分子只做定向运动
B. 自由膨胀前后,气体的压强不变
C. 自由膨胀前后,气体的温度不变
D. 容器中的气体在足够长的时间内,还能全部自动回到A部分 偷吃大米的小老鼠1年前1
偷吃大米的小老鼠1年前1 -
 你烦恼暖 共回答了15个问题
你烦恼暖 共回答了15个问题 |采纳率93.3%解题思路:正确解答本题要掌握:气体分子做无规则热运动,不可能只做定向运动;气体自由膨胀过程中不受阻力,因此不做功;自然界中的宏观过程具有方向性,是不可逆的,注意热力学第二定律的应用.A、分子时刻在做无规则的热运动,故A错误;
B、自由膨胀后,温度不变,体积变大,由气态方程可知,压强变小,故B错误;
C、自由膨胀过程中由于不受阻力作用,因此气体不做功,由于容器绝热,因此Q=0,由△U=W+Q可知,气体内能不变,因此温度也不变,故C正确;
D、根据热力学第二定律可知,气体向真空的自由膨胀是不可逆的,故D错误.
故选C.点评:
本题考点: 热力学第二定律;气体的体积、温度、压强之间的关系.
考点点评: 正确利用热力学第二定律解释一些物理现象,在利用热力学第一定律△U=W+Q时注意公式中各个物理量的含义,尤其注意各个物理量的正负问题.1年前查看全部
- 一个绝热气缸中有一块挡板,可以自由移动,两边有一定量气体,忽略一切摩擦,在挡板一侧的空间内有一个外接电源的电阻丝,闭合开
一个绝热气缸中有一块挡板,可以自由移动,两边有一定量气体,忽略一切摩擦,在挡板一侧的空间内有一个外接电源的电阻丝,闭合开关,使该部分的温度升高,挡板导热性良好,那最后温度会回到原温度吗?它吸热,也做了功,PV=nRT可以证明温度升高,但还有别的解释方法吗?
如果是绝热情况,那是哪侧温度高,为什么? loveviviso1年前1
loveviviso1年前1 -
 ywx1719 共回答了19个问题
ywx1719 共回答了19个问题 |采纳率100%这个问题用第一定律解就可以了: 绝热气缸中间的挡板既导热又可自由移动,故可把它看成一个系统,此时电阻丝通电后对系统做功W,而它本身不能对外放热(Q=0),据第一定律有ΔU=W+Q,它的内能增加,温度升高.在这个绝热系...1年前查看全部
- 一定质量的理想气体封闭在绝热的汽缸中,当用活塞压缩气体时,下列说法错误的是 A.气体分子的平均动能
一定质量的理想气体封闭在绝热的汽缸中,当用活塞压缩气体时,下列说法错误的是 A.气体分子的平均动能
一定增大B.气体分子的密度一定增大C.气体分子的势能一定增大D.气体的内能一定增大.重点讲一下C选项吧 红酥手pk1年前1
红酥手pk1年前1 -
 panpan1111 共回答了19个问题
panpan1111 共回答了19个问题 |采纳率100%活塞压缩做体积功,气体获得热量温度升高,内能增大,同时温度升高,热运动增强,故分子平均动能也增大;由于是理想气体,分子势能定义为分子间由于存在相互的作用力,从而具有与其相对位置有关的能,理想气体分子之间作用力忽略,故没有分子势能.所以势能是不变的.1年前查看全部
- 两根直径不同的蒸汽管道,外表面敷设厚度相同,材料相同的绝热层,若管子外表面和绝热层外表面温度相同,试问两跟管子每米长热损
两根直径不同的蒸汽管道,外表面敷设厚度相同,材料相同的绝热层,若管子外表面和绝热层外表面温度相同,试问两跟管子每米长热损失是否相同,为什么?
传热学求解答 纯净海1年前1
纯净海1年前1 -
 妙红 共回答了9个问题
妙红 共回答了9个问题 |采纳率66.7%当然不同,因为外表面积不同,相当于散热面积不同,热损失也相应不同,面积越大损失越多.
从理论上讲,你说的这种情况,可以保证绝热层外表面温度相同.1年前查看全部
- 25度,200KPa的5Mol理想气体,绝热膨胀到-28.57度100KPa V=101.68立方分米,为什么不能用W=
25度,200KPa的5Mol理想气体,绝热膨胀到-28.57度100KPa V=101.68立方分米,为什么不能用W=P2V2-P1V1求W?
一直对求功不是很理解,功的公式是W=-PdV,如果自由膨胀,就是用末态PV-出态PV吗?什么情况下W=NRT来求?如果始态末态P和V都变化怎么求? xhrrrrr36791年前1
xhrrrrr36791年前1 -
 无奈者我 共回答了16个问题
无奈者我 共回答了16个问题 |采纳率81.3%自由膨胀没有做功对象 所以W=0 U的变化量就是Q1年前查看全部
- 物理化学 为什么始态相同 达到相同的终态体积,等温可逆过程所作的功大于绝热可逆过程所作的功
物理化学 为什么始态相同 达到相同的终态体积,等温可逆过程所作的功大于绝热可逆过程所作的功
为什么 同样从A点出发,达到相同的终态体积,等温可逆过程所作的功(AB线下面积)大于绝热可逆过程所作的功(AC线下面积). 这是解释 “因为绝热过程靠消耗热力学能作功,要达到相同终态体积,温度和压力必定比B点低 ” 但我不太明白 生猛催花汉1年前1
生猛催花汉1年前1 -
 冷冷恋 共回答了11个问题
冷冷恋 共回答了11个问题 |采纳率81.8%我们就拿理想气体考虑,其热力学能仅仅是温度的函数
因为可逆过程对外做最大功,等温可逆过程,温度不变,我们可以认为其热力学能不变.
绝热可逆过程,Q=0,对外做了最大功,会导致热力学能降低,所以温度会降低.
这样从相同始态出发,达到相同的体积,必然会有绝热可逆过程的温度低于等温可逆过程.1年前查看全部
- 对于理想气体的绝热过程 有PV^r=常量,r=Cp/Cv
对于理想气体的绝热过程 有PV^r=常量,r=Cp/Cv
似乎P、T和V、T之间也应有相似关系 就是几次幂的乘积是个常数 那么是什么样的呢?
和Cv Cp无关吗?
二楼的可不可以帮我粘贴过来?太乱了 我没有找到啊 love_ly13141年前2
love_ly13141年前2 -
 xuyongyan1 共回答了21个问题
xuyongyan1 共回答了21个问题 |采纳率81%v^(r-1)t=c
p^(r-1)t^(-r)=c
其中C为恒量
Cv与Cp在其中都是恒量1年前查看全部
- 如图所示为圆柱形气缸,气缸壁绝热,气缸的右端有一小孔与大气相通,大气的压强为P0.用一热容量可忽略的导热隔板N和一绝热活
 如图所示为圆柱形气缸,气缸壁绝热,气缸的右端有一小孔与大气相通,大气的压强为P0.用一热容量可忽略的导热隔板N和一绝热活塞M将气缸分为A、B、C三室,隔板与气缸固连,活塞相对气缸可以无摩擦地移动但不漏气.气缸的左端A室中有一电加热器Ω.已知在A、B室中均盛有1摩尔同种理想气体,电加热器加热前,系统处于平衡状态,A、B两室中气体的温度均为T0,A、B、C三室的体积均为V0.现通过电加热器对A室中气体缓慢加热,若提供的总热量为Q0,试求B室中气体的末态体积和A室中气体的末态温度.(设A、B两室中气体1摩尔的内能为U=[5/2]RT,式中R为普适气体常量,T为绝对温度)
如图所示为圆柱形气缸,气缸壁绝热,气缸的右端有一小孔与大气相通,大气的压强为P0.用一热容量可忽略的导热隔板N和一绝热活塞M将气缸分为A、B、C三室,隔板与气缸固连,活塞相对气缸可以无摩擦地移动但不漏气.气缸的左端A室中有一电加热器Ω.已知在A、B室中均盛有1摩尔同种理想气体,电加热器加热前,系统处于平衡状态,A、B两室中气体的温度均为T0,A、B、C三室的体积均为V0.现通过电加热器对A室中气体缓慢加热,若提供的总热量为Q0,试求B室中气体的末态体积和A室中气体的末态温度.(设A、B两室中气体1摩尔的内能为U=[5/2]RT,式中R为普适气体常量,T为绝对温度)  一张破帆1年前1
一张破帆1年前1 -
 静子_dd 共回答了19个问题
静子_dd 共回答了19个问题 |采纳率89.5%解题思路:在电加热器对A室中气体加热的过程中,由于隔板N是导热的,B室中气体的温度要升高,活塞M将向右移动.当加热停止时,活塞M有可能刚移动气缸右端,也可能尚未移动右端,当然也可能活塞已经到右端,但加热过程还未停止.本题需要分情况讨论.1.设加热恰好能使活塞M移动到气缸最右端,则B室气体末态体积
VB=2V0 (1)
根据题意,活塞M向右移动过程中,B中气体压强不变,用TB表示B室中气体末态的温度,有
V0
T0=
VB
TB(2)
解(1)(2)两式可得
TB=2T0 (3);
由于隔板N是导热的,故A室中气体末态的温度
TA=2T0 (4);
在加热过程中,A室中气体经历的是等容过程,根据热力学第一定律,气体吸收的热量等于其内能的增加量,即
QA=
5
2R(TA−T0) (5);
由(4)(5)两式得
QA=
5
2RT0 (6);
B室中气体经历的是等压过程,在过程中B室气体对外做功为
WB=p0(VB-V0) (7);
由(1)(7)式及理想气体状态方程得
WB=RT0 (8);
内能改变为
△U=
5
2R(TB−T0) (9);
由(4)(9)两式得
△UB=
5
2RT0 (10);
根据热力学第一定律和(8)(10)两式,B室内气体吸收的热量为
QB=△UB+WB=
7
2RT0 (11);
由(6)(11)两式可知电加热器提供的热量为
Qm=QA+QB=6RT0 (12);
若Q0=Qm,B室中气体末态体积为2V0,A室中气体的末态温度2T0.
2.若Q0>Qm,则当加热器供应的热量达到Qm时,活塞刚好到达气缸最右端,但这时加热尚未停止,只是在以后的加热过程中气体的体积不做功,根据热力学第一定律,若A室中气体末态的温度为T'A,有
Q0−Qm=
5
2R(TA′−2T0′)+
5
2R(TA′−2T0) (13);
由(12)(13)两式可求得
TA′=
Q0
5R+
4
5T0 (14);
B中气体的末态的体积
VB'=2V0 (15)
3.若Q0<Qm,则隔板尚未移到气缸最右端,加热停止,故B室中气体末态的体积VB''小于2V0.设AB两室中气体末态温度为TA'',根据热力学第一定律,注意到A室中气体经历的是等容过程,其吸收的热量
QA=
5
2R(TA″−T0) (16)
B室中气体经历的是等压过程,吸收热量
QB=
5
2R(TA″−T0)+p0(VB″−V0) (17)
利用气体状态方程,上式变为
QB=
7
2R(T′′A−T0) (18)
由上可知
Q0=QA+QB=6R(T''A-T0) (19)
所以A室中气体的末态温度
T″A=
Q0
6R+T0 (20)
B室中气体的末态体积
V″B=
V0
T0T′′A=(
Q0
6RT0+1)V0(21)
答:1.若加热停止时,活塞M有刚移动气缸右端,则B室中气体末态体积为2V0,A室中气体的末态温度2T0
2.若活塞刚好到达气缸最右端,但这时加热尚未停止,则B室中气体末态体积为2V0,A室中气体的末态温度TA′=
Q0
5R+
4
5T0;
3.若隔板尚未移到气缸最右端,加热停止,则B室中气体的末态体积V″B=
V0
T0T′′A=(
Q0
6RT0+1)V0,A室中气体的末态温度T″A=
Q0
6R+T0.点评:
本题考点: 理想气体的状态方程.
考点点评: 本题为气体的综合应用题,题中涉及内能的相关知识,难度极大,过程复杂,是极少见的气体模型中的难题中难题.1年前查看全部
- 一定量的He气从0℃,5×105 Pa,10 dm3的始态,分别经过(1) 绝热可逆过程和(2)绝热等外压(105 Pa
一定量的He气从0℃,5×105 Pa,10 dm3的始态,分别经过(1) 绝热可逆过程和(2)绝热等外压(105 Pa)过程膨胀到105 Pa.试计算两个过程的终态温度T2以及Q、W、△U和△H.(假设He为理想气体)
这里面的△H怎么求? d13131年前1
d13131年前1 -
 ly3246033 共回答了19个问题
ly3246033 共回答了19个问题 |采纳率94.7%△H=nCp,m△T △U=nCv,m△T ,你运用公式求出T2,其他的就迎刃而解了.1年前查看全部
- 一绝热容器内封闭着一定质量的气体,假设此气体可以看成理想气体,若让容器从某高度自由下落(不计空气阻力),则( )
一绝热容器内封闭着一定质量的气体,假设此气体可以看成理想气体,若让容器从某高度自由下落(不计空气阻力),则( )
A因为气体处于完全失重状态,故气体对容器的压强为零
B因为重力对气体做功,故气体内能增加
C气体的温度和压强都不变
D气体分子热运动的平均动能将增大 irlyhbc1年前3
irlyhbc1年前3 -
 寂静的燃烧 共回答了25个问题
寂静的燃烧 共回答了25个问题 |采纳率84%A错误,无论是否失重,气体对容器都有压力
B错误,气体增加的是动能,不是内能.
C正确,气体和容器所构成的系统没有做功,温度和压强均不变
D错误,气体温度不变,热运动动能将保持不变1年前查看全部
- 常温常压下一定质量的气体被绝热压缩后气体分子的平均动能一定增加么?
常温常压下一定质量的气体被绝热压缩后气体分子的平均动能一定增加么?
如题 XIAOYANER19791年前1
XIAOYANER19791年前1 -
 爱情小木屋 共回答了16个问题
爱情小木屋 共回答了16个问题 |采纳率81.3%绝热压缩则一定有外力对气体做正功且无热传导,气体温度上升,气体分子的平均动能一定增加1年前查看全部
- 如图所示,绝热气缸封住一定质量的理想气体,竖直倒放于水平地面,活塞质量不可忽略,不计摩擦.现把气缸稍微倾斜一点重新达到平
如图所示,绝热气缸封住一定质量的理想气体,竖直倒放于水平地面,活塞质量不可忽略,不计摩擦.现把气缸稍微倾斜一点重新达到平衡,则( )
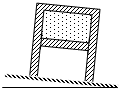 A. 气体的内能变大
A. 气体的内能变大
B. 气体的密度不变
C. 气体的压强增大
D. 气体的压强减小 wjsh32981年前1
wjsh32981年前1 -
 jcxrabbit 共回答了16个问题
jcxrabbit 共回答了16个问题 |采纳率87.5%解题思路:对活塞进行受力分析,前后两个过程活塞均处于受力平衡状态,可以判断气缸内气体压强的变化,然后根据理想气体状态方程得到气体体积的变化,得到密度变化情况.C、D、当气缸竖直放置时,对活塞受力分析如图,

所以,P0S=G+PS ①
即外界大气压力等于重力与内部气体产生的压力之和.
当气缸倾斜时活塞受力如图,
此时:Gcosθ+P1S=P0S ②
由①②可知,P1>P,即末状态压强大于初状态,故C正确,D错误.
A、B、整个过程是绝热变化,由PV=C可知,压强增大时,体积减小,故密度变大,外界对气体做功,根据热力学第一定律知内能增大,故A正确,B错误.
故选:AC.点评:
本题考点: 热力学第一定律;封闭气体压强.
考点点评: 此题把受力平衡与理想气体状态方程相结合,所以在解题过程中思维不要仅局限在理想气体状态方程和热力学第一定律上.1年前查看全部
- 有关化学平衡移动问题.容器导热/不导热.容器绝热/不绝热.分别对于平衡有何影响?以H2 N2生成NH3为例
 新龙华11年前1
新龙华11年前1 -
 wbwgz 共回答了17个问题
wbwgz 共回答了17个问题 |采纳率82.4%H2 N2生成NH3的反应为放热反应,如果容器导热就会有部分热量流失,会使反应向放热的方向(正向)移动;反之,若容器绝热(即不导热),随着容器内温度的升高,平衡逆向移动.
(纯属个人分析,如果有错误请指出)1年前查看全部
- 以下说法中正确的是( )A.墒增加原理说明一切自然过程总是向着分子热运动的无序性减少的方向进行B.在绝热条件下压缩气体
以下说法中正确的是( )
A.墒增加原理说明一切自然过程总是向着分子热运动的无序性减少的方向进行
B.在绝热条件下压缩气体,气体的内能一定增加
C.液晶既有液体的流动性,又具有单晶体的各向异性
D.由于液体表面分子间距离大于液体内部分子间的距离,液面分子间表现为引力,所以液体表面具有收缩的趋势 花落花开自有时1年前1
花落花开自有时1年前1 -
 无牙-飞天猪 共回答了22个问题
无牙-飞天猪 共回答了22个问题 |采纳率81.8%解题思路:根据热力学第二定律分析A,根据热力学第一定律分析B,根据液晶的特点分析C,根据表面张力的性质分析D,根据压强的意义分析E.A、墒增加原理说明一切自然过程总是向着分子热运动的无序性增大的方向进行.故A错误;
B、在绝热条件下压缩气体,外界对气体做功,同时Q=0,所以气体的内能一定增加.故B正确;
C、液晶是一类特殊的物质存在的状态,液晶既有液体的流动性,又具有单晶体的各向异性.故C正确;
D、表面张力产生的原因:由于液体表面分子间距离大于液体内部分子间的距离,液面分子间表现为引力,所以液体表面具有收缩的趋势.故D正确;
E、气体的压强是大量的气体分子持续撞击器壁产生的,封闭气体的密度变小,单位时间内打到器壁单位面积上的分子数减少;分子动能增加,单个分子的平均撞击力增大,气体的压强可能不变.故E正确.
故选:BCDE点评:
本题考点: * 晶体和非晶体;封闭气体压强.
考点点评: 该题考查到热力学第二定律,热力学第一定律、液晶的特点、表面张力的产生以及压强的微观意义,都是记忆性的知识点,在平时的学习过程中多加积累即可.1年前查看全部
- 如图所示,一个内壁光滑、绝热的气缸固定在地面上,绝热的活塞下方封闭着空气,若用竖直向上的力F将活塞向缓慢上拉一些距离.
如图所示,一个内壁光滑、绝热的气缸固定在地面上,绝热的活塞下方封闭着空气,若用竖直向上的力F将活塞向缓慢上拉一些距离. 则缸内封闭着的气体()
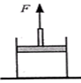
A.分子平均动能不变 B.单位时间内缸壁单位面积上受到的气体分子碰撞的次数减少 C.每个分子对缸壁的冲力都会减小 D.若活塞重力不计,拉力F对活塞做的功等于缸内气体内能的改变量  wanxueshuang1年前1
wanxueshuang1年前1 -
 守望my猪猪 共回答了12个问题
守望my猪猪 共回答了12个问题 |采纳率100%解题思路:向上拉活塞时,气体体积变大,气体对外做功,
W<0 ,由于气缸与活塞是绝热的,在此过程中气体既不吸热,也不放热,则Q=0 ,由热力学第一定律可知,△U=W+Q<0 ,气体内能减小,温度降低,分子平均动能变小,但并不是每一个分子动能都减小,每个分子对缸壁的冲力都会减小,故AC 错误;气体物质的量不变,气体体积变大,分子数密度变小,单位时间内缸壁单位面积上受到气体分子碰撞的次数减少,B 正确;若活塞重力不计,则活塞质量不计,向上拉活塞时,活塞动能与重力势能均为零,拉力F 与大气压力对活塞做的总功等于缸内气体的内能改变量,D 错误。B
1年前查看全部
- 不可逆绝热稳定流动过程系统 系统的熵不变 又因为是不可逆过程 熵一定增加 那么增加的熵到哪里去了
 新泪珠儿1年前1
新泪珠儿1年前1 -
 qjp318 共回答了20个问题
qjp318 共回答了20个问题 |采纳率90%你的题设错了,不可逆绝热稳定流动过程系统就是熵增的.不可能熵不变.1年前查看全部
大家在问
- 1比赛采取单败淘汰制,1、总共进行了73场比赛,问选手有多少人?2、如果选手有93人,应进行几场比赛?
- 2楞次定律“阻碍” 口诀“增反减同,来拒去留”?
- 3在平直轨道上匀速行驶的列车的窗口落下一物体,关于这个物体的运动,下列说法中正确的是(不计空气阻力)
- 4已知二次函数y=x2+kx+6的图象与x轴的正半轴交于A,B两点,且A,B两点间的距离为2,求k的值.
- 5用线条简单的画出事物的轮廓是什么成语
- 6美国加州一号公路哪段最美
- 7弱酸中氢离子的浓度和弱酸本身的浓度是否存在关系,还是说弱酸部分电离出的氢离子浓度与自身浓度存在关系
- 8下列溶液中微粒的物质的量浓度关系正确的是( )
- 9难忘的一件事作文300-320字
- 10fig.18.1(a)用英语怎么读
- 11NaAlSi2O6中硅元素的化合价
- 12在三角形ABC中,abc分别是角ABC对边的长,且满足cosB/cosC=-b/(2a+c).
- 13麻烦老师解答:下面是2月下旬参观博
- 14连词成句1.are we bowling ten playing o'clock at (.)2.don't the I
- 15Have you any small change?能不能改成do you have any samll change?
