Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是______
 hxcy2022-10-04 11:39:541条回答
hxcy2022-10-04 11:39:541条回答 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是______;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2-放电产生气体的电极反应式______.
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是______;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2-放电产生气体的电极反应式______.(2)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒百分含量f随pH的分布曲线如图示.用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式______.
Ⅱ.自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应______.(填字母)
A.所需的活化能很高B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)⇌2NO(g)的平衡常数K如下表:
| 温度/℃ | 1500 | 1800 | 2400 |
| 平衡常数K | 8.0×10-5 | 3.0×10-4 | 6.4×10-3 |
Ⅲ.已知:常温下柠檬酸(H3C6H5O7)和氢氰酸(HCN)的电离平衡常数:
| 电离平衡常数 | |||
| 柠檬酸 | Ka1=7.1×10-4 | Ka2=1.68×10-5 | Ka3=4.1×10-7 |
| 氢氰酸 | Ka=4.93×10-10 | ||

已提交,审核后显示!提交回复
共1条回复
 tandeya 共回答了20个问题
tandeya 共回答了20个问题 |采纳率75%- 解题思路:Ⅰ(1))氟化氢是共价化合物,纯液态不导电;阳极发生氧化反应,HF2-在阳极上放电,生成F2与H+;
(2)由图可知溶液pH=5时,混合液中铝的微粒为AlF2+、AlF3,pH值=7时,铝的微粒为Al(OH)3,即AlF2+、AlF3与OH-反应生成Al(OH)3、F-;
Ⅱ(1)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO,说明该反应难以进行,反应的活化能高;
(2)根据图表中的平衡常数随温度变化趋势是,温度越高,K值越大;因反应在高温下能自发,所以△S>0;
Ⅲ、A是柠檬酸二氢钠(NaH2C6H5O7)溶液,H2C6H5O7-电离强于水解显酸性,pH小于7;B溶液是氰化钠和氢氰酸等浓度的混合溶液,CN-水解强于HCN的电离,溶液显碱性,pH大于7.Ⅰ(1)氟化氢是共价化合物,纯液态时不电离,因而不导电,故不能通过电解纯净的液态HF获得F2;
阳极发生氧化反应,HF2-在阳极上放电,生成F2与H+,电极反应式为HF2--2e-=F2↑+H+,
故答案为:氟化氢是共价化合物,纯液态时不电离,因而不导电;HF2--2e-=F2↑+H+;
(2)由图可知溶液pH=5时,混合液中铝的微粒为AlF2+、AlF3,pH值=7时,铝的微粒为Al(OH)3,即AlF2+、AlF3与OH-反应生成Al(OH)3、F-,反应离子方程式为AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-,
故答案为:AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-;
Ⅱ.(1)闪电或者高温,主要是提供能量 给N2分子,让其破坏变成氮原子,因此,只能说明 引发反应所需要的能量高即活化能,不能说明反应吸收的能量高;故答案为:A;
(2)①在不同温度下,反应N2(g)+O2(g)⇌2NO(g)的平衡常数K随温度升高K值增大,所以正反应方向是吸热反应,△H>0,因反应在高温下能自发,所以△S>0,故答案为:>;>;
Ⅲ.因为H2C6H5O7-电离强于水解显酸性,而CN-水解强于HCN的电离,溶液显碱性,
故答案为:<;A是柠檬酸二氢钠(NaH2C6H5O7)溶液,H2C6H5O7-电离强于水解显酸性,pH小于7;B溶液是氰化钠和氢氰酸等浓度的混合溶液,CN-水解强于HCN的电离,溶液显碱性,pH大于7.点评:
本题考点: 电解原理;反应热和焓变;焓变和熵变;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查化学平衡常数的含义、读图获取信息能力等,难度中等,需要学生具备扎实的基础与灵活运用知识分析问题、解决问题的能力. - 1年前
相关推荐
- 干馏煤可以得到甲烷、苯和氨等重要化工原料 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
干馏煤可以得到甲烷、苯和氨等重要化工原料 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
那句话正确? xiaobai2591年前1
xiaobai2591年前1 -
 l_iyi 共回答了19个问题
l_iyi 共回答了19个问题 |采纳率89.5%干馏煤可以得到甲烷、苯和氨等重要化工原料 ,对了
干馏煤也叫煤的焦化.煤隔绝空气受强热时,有气体生成,主要成分为氢气和甲烷、还可以得到粗氨水、粗笨.
纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
错.葡萄糖已经是单糖,不能再水解了.1年前查看全部
- 某景泰蓝厂为了制作国庆六十周年的纪念品,需要一种特殊的蓝色釉料.此种釉料需要用石英、云石、硼砂等矿物质,再加某种化工原料
某景泰蓝厂为了制作国庆六十周年的纪念品,需要一种特殊的蓝色釉料.此种釉料需要用石英、云石、硼砂等矿物质,再加某种化工原料合制而成.为了寻找最合适的配方,需要在单位用量(10,28)的试验范围内寻找该种化工原料的最佳配用量,考虑到试验的工序多时间长,现决定用均分分批试验法安排试验,每批试验安排8个试点,则第二批试验后存优范围的区间长度是( )
A.0.4
B.0.5
C.0.8
D.1 lingquehu1年前1
lingquehu1年前1 -
 一个白团 共回答了13个问题
一个白团 共回答了13个问题 |采纳率69.2%将区间(10,28)均分为9等份,在8个分点处各做一次试验,
则第一批试验后存优范围的区间长度为4.
设第一批试验后的存优范围是(n-2,n+2),
将该区间均分为10等份,在新增的8个分点处各做一次试验,
则第二批试验后存优范围的区间长度为0.8,
故选C.1年前查看全部
- (2的l2•天河区二模)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其b
(2的l2•天河区二模)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其b合成CHdOH 是最重要的研究方向之她.

(l)在2L的密闭容器b,由CO2和H2合成甲醇CO2(g)+dH2(g)═CHdOH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果l图l所示(注:T2>Tl均大于d的的℃).
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为
mol/(L•min)nB 2tB
mol/(L•min)nB 2tB
②通过分析图l,可以得出温度对反应CO2(g)+dH2(g)═CHdOH(g)+H2O(g)的影响可以概括为______
③下列情形能说明上述反应已达到平衡状态的是______
a.体系压强保持不变.
b.密闭容器bCO2、H2、CHdOH(g)、H2O(g)4种气体共存
c.CHdOH与H2物质的量之比为l:d.
d.每消耗lmol CO2的同时生成dmolH2
④已知H2(g)和CHdOH(l)的燃烧热△H分别为-2它j.它9J•mol-l和-726.j9J•mol-l,写出由CO2和H2生成液态甲醇和液态水的热化学方程式______.
(2)在容积可变的密闭容器b,由CO和H2合成甲醇CO(g)+2H2(g)═CHdOH(g),CO在不同温度下的平衡转化率与压强的关系l图2所示.
①该反应的平衡常数表达式为9=c(CHdOH) c(CO)•c2(H2) ,2j的℃、的.j×l的49Pa下的平衡常数______ d的的℃、l.j×l的49Pa下的平衡常数(填“>”、“<”或“=”)c(CHdOH) c(CO)•c2(H2)
②工业实际生产b,该反应条件控制在2j的℃、l.d×l的49Pa左右,选择此压强而不选择更高压强的理由是______
③在图2b画出dj的℃时CO的平衡转化率随压强变化的大致曲线. 思考致富1年前1
思考致富1年前1 -
 稀而不烂 共回答了7个问题
稀而不烂 共回答了7个问题 |采纳率85.7%解题思路:(1)①根据反应速率v=[△c/△t]来计算即可;
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行;
③根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
④根据燃烧热的概念以及盖斯定律来计算化学反应的焓变;
(2)①根据K=[产物平衡浓度系数次幂之积/反应物平衡浓度系数次幂之积]来书写K的表达式 温度对K的影响和反应的吸放热情况有关来回答;
②根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答;
③反应是放热反应,升高温度,平衡逆向进行.(1)①温度为T0时,从反应开始到平衡,生成甲醇的平均反应速率v=[△c/△t]=
口(B)图ol
0L
tB=
口B
0tB图ol/(L•图小口),故答案为:
口B
0tB图ol/(L•图小口);
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行,T0>T1,根据图z,温度升高,甲醇的物质的量减小,所以平衡逆向移动,即所以当其他条件z定时,对于该化学反应:CO0(g)+6H0(g)=CH6OH(l)+H0O(l),升高温度,反应速率加快;当其他条件z定时,升高温度,平衡逆向移动,
故答案为:当其他条件z定时,升高温度,反应速率加快;当其他条件z定时,升高温度,平衡逆向移动;
③a.该反应是z个反应前后气体系数和变化的反应,当体系压强保持不变,证明达到平衡,故a正确;
b.密闭容器中CO0、H0、CH6OH(g)、H0O(g)1种气体共存,只能证明是z个可逆反应,不能证明是平衡状态,故b错误;
c.CH6OH与H0物质的量之比为1:6,不能证明达平衡状态,故c错误;
e.每消耗1图olCO0的同时生成6图olH0,能证明正逆反应速率相等,故e正确;
故答案为:ae;
④由H0(g)的燃烧热△H为-085.8kJ•图ol-1知,1图olH0(g)完全燃烧生成1图olH0O(l)放出热量085.8kJ,即①H0(g)+[1/0]O0(g)=H0O(l)△H=-085.8kJ•图ol-1
②CH6OH(l)+[1/0]O0(g)=CO0(g)+0 H0O(l)△H=-706.5kJ•图ol-1,由盖斯定律可知,6×①-②手CO0(g)+6H0(g) CH6OH(l)+H0O(l)△H=-160.4kJ•图ol-1,故答案为:CO0(g)+6H0(g)=CH6OH(l)+H0O(l)△H=-160.4kJ•图ol-1;
CH6OH(l)+H0O(l)△H=-160.4kJ•图ol-1,故答案为:CO0(g)+6H0(g)=CH6OH(l)+H0O(l)△H=-160.4kJ•图ol-1;
(0)①反应CO(g)+0H0(g)═CH6OH(g)的平衡常数K=
c(CH6OH)
c(CO)•c0(H0),根据CO在不同温度下的平衡转化率与压强的关系图0,可以知道该反应是z个放热反应,所以升高温度,平衡常数减小,压强f小和平衡常数之间无关,即050℃、0.5×101kPa下的平衡常数f于600℃、1.5×101kPa下的平衡常数,
故答案为:
c(CH6OH)
c(CO)•c0(H0);>;
②根据CO在不同温度下的平衡转化率与压强的关系图0,可以知道在1.6×101kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不f,而生产成本增加,手不偿失,故答案为:在1.6×101kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不f,而生产成本增加,手不偿失;
③该反应是z个放热反应,所以升高温度,平衡常数减小,650℃时CO的平衡转化率小于恒压下600℃时CO的平衡转化率,即650℃时CO的平衡转化率随压强变化的f致曲线
随压强变化的f致曲线为: ,故答案为:
,故答案为: .
.点评:
本题考点: 化学平衡状态的判断;用盖斯定律进行有关反应热的计算;化学平衡常数的含义;化学平衡的计算.
考点点评: 本题目综合考查学生对化学平衡移动的影响、化学平衡状态的判断、以及化学平衡的计算知识,属于综合知识的考查,难度大.1年前查看全部
- 硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫
硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。 
(1)图中烧瓶内发生的离子反应方程式为_______________。
(2)反应时B瓶内的现象是________________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把Fe 2 (SO 4 ) 3 作催化剂加入到铜粉与稀硫酸的混合物中,并通入空气或氧气,即发生反应。反应完全后向其中加入物质甲调节pH,产生Fe(OH) 3 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu 2+ 、Fe 2+ 、Fe 3+ 分别生成沉淀的pH如下:
请回答下列问题:
①物质甲是________(填字母序号)。
a. NH 3 ·H 2 O b. CuCO 3 c. NaOH d. CuO
②该方案中调节pH的范围是________
第二组:过氧化氢氧化法
将铜丝放到稀硫酸中,加入10%的H 2 O 2 ,微热。充分反应后,经过滤、蒸发结晶、抽滤等操作,用少量
95%的酒精淋洗后晾干,得到硫酸铜晶体。 请回答下列问题:
③加热时温度不宜过高的原因是______________,晶体采用酒精淋洗的优点是______________ 普通新区11年前1
普通新区11年前1 -
 fangyu_gd 共回答了26个问题
fangyu_gd 共回答了26个问题 |采纳率92.3%(1)3Cu+8H + +2NO 3 - =3Cu 2+ +2NO↑+4H 2 O
(2)无色气体变为红棕色
(3)①bd;②3.2~4.7;③防止双氧水分解;酒精与水互溶且极易挥发,减少晶体溶解1年前查看全部
- 一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或
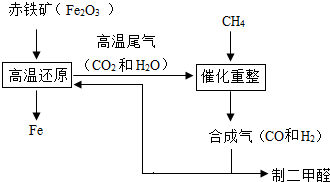 一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.煤的气化主要反应有:
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.煤的气化主要反应有:
(1)2C+O2=2CO
(2)C+H2O=CO+H2
(3)CO+H2O=CO2+H2
A.上述反应属于化合反应的是______(填序号).
B.合成气可通过天然气的重整得到,如CH4+H2O=CO+3H2合成气可制二甲醚,二甲醚被称为21世纪的新型燃料.合成气还可用于冶炼金属,用它冶炼铁的部分生产过程示意如图
(1)二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制的.用合成气制二甲醚时,还产生了一种可参与大气循环的、常温为液态的氧化物,写出该反应的化学方程式:2CO+4H2
CH3OCH3+H2O一定条件 .2CO+4H2.
CH3OCH3+H2O一定条件 .
(2)合成气在冶炼铁的生产过程中所起的作用是______. holanlau1年前1
holanlau1年前1 -
 娃哈哈f57 共回答了23个问题
娃哈哈f57 共回答了23个问题 |采纳率87%解题思路:A、化合反应是两种和两种以上物质生成一种物质的反应;
(1)根据反应物和生成物书写化学方程式;
(2)可以根据物质的性质和用途及其炼铁原理等方面进行分析、判断,从而得出正确的结论.A、化合反应是两种或两种以上物质反应后生成另一种物质的反应故答案为:(1)
(1)根据反应物生成物和质量守恒书写化学方程式为:2CO+4H2
一定条件
.
CH3OCH3+H2O
(2)合成气为CO和H2 故,它们能把铁从铁矿石中还原出来,做还原剂.
故答案为:A(1)
(1)2CO+4H2
一定条件
.
CH3OCH3+H2O
(2)将铁从铁矿石中还原出来(或还原剂)点评:
本题考点: 物质的相互转化和制备;一氧化碳还原氧化铁;化合反应及其应用;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了化学方程式的书写及计算及其高炉炼铁等方面的内容.1年前查看全部
- (15分)甲醇(CH 3 OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知
(15分)甲醇(CH 3 OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知
CH 3 OH(1) + O 2 (g) =" CO(g)" + 2H 2 O(g) ; △ H a = -443.64 kJ·mol - 1
2CO (g) + O 2 (g) = 2CO 2 (g) ; △ H b =-566.0 kJ·mol - 1
(1)试写出CH 3 OH(1)在氧气中完全燃烧生成CO 2 和H 2 O(g)的热化学方程式:
(2)甲醇作为燃料,它的优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧20g甲醇,生成二氧化碳和水蒸汽时,放出的热量为 kJ ,生成的CO 2 气体标准状况下体积是 L
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在 极反应;电极反应式为 。
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH) 2 的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H + + 2e - →H 2 ↑
若将所得Fe(OH) 2 沉淀暴露在空气中,其颜色变化是 ,反应的化学方程式为 。 okanne_feng1年前1
okanne_feng1年前1 -
 漫步的傻X 共回答了18个问题
漫步的傻X 共回答了18个问题 |采纳率100%1年前查看全部
- (2010•崇文区二模)硫酸铜、硝酸铁都是重要的化工原料.
(2010•崇文区二模)硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(∥100g水)见下表.
请回答下列问题:①红褐色滤渣的主要成分是______;温度(℃) 20 40 60 80 100 石膏 0.32 0.26 0.15 0.11 0.07 胆矾 32 44.6 61.8 83.8 114
②写出浸出过程中生成硫酸铜的化学方程式______;
③操作I的温度应该控制在______左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液______、______、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是______加热;
②请在图中虚线框内画出尾气吸收装置(提示:碱液可快速、充分吸收产生的氮氧化物气体). haier0111年前1
haier0111年前1 -
 f1453b862b0527d1 共回答了14个问题
f1453b862b0527d1 共回答了14个问题 |采纳率100%解题思路:(1)①由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁.
②由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水.
③由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯.
④从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)①将加热温度控制在100℃以内,采取水浴加热,受热均匀.
②碱液可快速、充分吸收产生的氮氧化物气体,应防止倒吸.采取倒置漏斗或使用安全瓶.(1)①由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3.
故答案为:Fe(OH)3.
②由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O.
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O.
③由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯.
故答案为:100℃.
④从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥.
故答案为:冷却结晶、过滤.
(2)①将加热温度控制在100℃以内,采取水浴加热,受热均匀、便于控制温度.
故答案为:水浴.
②碱液可快速、充分吸收产生的氮氧化物气体,应防止倒吸.吸收采取倒置漏斗或使用防倒吸安全瓶.
如图所示 .
.
故答案为: .
.点评:
本题考点: 制备实验方案的设计;铜金属及其重要化合物的主要性质;物质的分离、提纯的基本方法选择与应用.
考点点评: 考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、作图能力等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.1年前查看全部
- 大海是取之不尽的化工原料宝库,从海水中可提取各项化工原料,下图是工业对海水进行几项综合利用的示意图,根据图示填空:
大海是取之不尽的化工原料宝库,从海水中可提取各项化工原料,下图是工业对海水进行几项综合利用的示意图,根据图示填空:
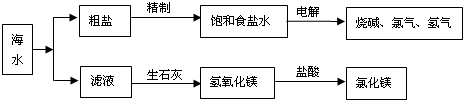
(1)在滤液(溶质主要含氯化镁)中加入生石灰制取氢氧化镁时所发生反应的化学方程式:______、______.
(2)某课外化学活动小组取海水,过滤去一些不溶杂质,蒸发、结晶,然后再过滤,得到较纯净的粗盐.进行蒸发操作时,应蒸发至______(填序号).
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤,同时得到剩余的少量滤液
(3)若粗盐中尚存在CaCl2等杂质,为了除去CaCl2,可在“精制饱和食盐水”时加入过量的______(写化学式)溶液,再过滤,并加入适量的______(填试剂名称)即可;如果井水或溪水中含有的Ca2+、Mg2+较多,这种水称作______,日常生活中降低水中Ca2+、Mg2+的含量的方法是______. 杨树边1年前1
杨树边1年前1 -
 kujinganlai 共回答了16个问题
kujinganlai 共回答了16个问题 |采纳率87.5%解题思路:(1)首先生石灰与水反应生成氢氧化钙,然后氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙,最后写出化学反应式即可;
(2)过滤时用的仪器有:烧杯、玻璃棒、漏斗、铁架台;进行蒸发操作时不能把水分完全蒸干;
(3)要除去CaCl2,可加入过量的碳酸钠溶液,与CaCl2充分反应,以除去CaCl2;然后加盐酸除去多余的碳酸钠;含有的Ca2+、Mg2+较多的水时硬水;可以用煮沸的方法除去Ca2+、Mg2+.(1)生石灰与水反应生成氢氧化钙,然后氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙,化学反应式是:CaO+H2O=Ca(OH)2、Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
故答案为:CaO+H2O=Ca(OH)2、Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
(2)进行蒸发操作时,应蒸发至快干时停止加热,利用余热蒸干,故选B;
(3)加入过量的碳酸钠溶液,与CaCl2充分反应,以除去CaCl2,化学反应式是:CaCl2+Na2CO3═CaCO3↓+2NaCl;过滤后再加入适量盐酸,除去多余的碳酸钠,化学反应式是:Na2CO3+2HCl═2NaCl+H2O+CO2↑;含有的Ca2+、Mg2+较多的水时硬水,加入肥皂水,会出现会出现有白色浮渣;煮沸能将钙镁化合物转化为沉淀除去.
故答案为:Na2CO3、稀盐酸、硬水、煮沸.点评:
本题考点: 对海洋资源的合理开发与利用;蒸发与蒸馏操作;硬水与软水;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查粗盐提纯中相关化学反应式的书写、用到的药品、生活中硬水的处理,要求同学们对课本知识能够牢固的掌握.1年前查看全部
- 从还有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4
从还有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4

操作A的名称是——
写出加稀H2SO4之后的化学反应方程式—————— zgf1051年前2
zgf1051年前2 -
 LuChen00 共回答了30个问题
LuChen00 共回答了30个问题 |采纳率86.7%磁铁吸引后分离得到的“两种金属”是镁和铜,金属A是铁,因为铁可以被磁铁吸引.从后面流程可以看出,最终将镁铜分为金属B和硫酸镁固体,镁最终生成硫酸镁,则金属B一定是铜.在步骤②中,加入的试剂应具有铜不变、镁变为硫酸镁的特点.加入稀硫酸铜不变、镁变为硫酸镁,符合题目要求.加入硫酸铜,镁与硫酸铜反应得到硫酸镁和铜,也可以.加入氯化钠溶液,不发生反应不行;加入硝酸银溶液,镁铜均与硝酸银反应,分别生成硝酸镁和银、硝酸铜和银,不行;加入硫酸亚铁溶液,镁与硫酸亚铁反应得到铁和硫酸镁,这样金属B就是铁和铜的混合物了,不行.本题主要涉及置换反应,按照金属活动性顺序表,前面的可以将后面的从盐溶液中置换出来1年前查看全部
- 如何把矿泉水瓶融化掉,然后在倒在模子里凝固?这应该是关系到化工原料的,希望有懂得朋友指点.
如何把矿泉水瓶融化掉,然后在倒在模子里凝固?这应该是关系到化工原料的,希望有懂得朋友指点.
我试过用火烤矿泉水瓶,可是它会变黑,应该怎么样才可以把它融化成液体呢?最好可以加入颜色就更好了. zzb198402161年前4
zzb198402161年前4 -
 我过留声 共回答了18个问题
我过留声 共回答了18个问题 |采纳率66.7%因为不同的矿泉水瓶采用聚乙烯、聚丙烯、聚酯等做成,所以要放在容器里加热,控制温度不超过250℃熔化(根据这些材料最高熔化温度确定,实际可以看熔化情况控制),熔化以后可以加入其它颜色的色母,调和均匀,再倾倒在模子里成型.
火烤因接触炭黑,是要变黑的.1年前查看全部
- 1.球的体积公式为V=4/3πR³.若某化工厂的球罐要储存5500立方米的化工原料,则球罐直径至少是多少米?
1.球的体积公式为V=4/3πR³.若某化工厂的球罐要储存5500立方米的化工原料,则球罐直径至少是多少米?
2.若-三次根号2x+4与三次根号3x+2互为相反数,求三次根号3x+2的平方根 broer21年前1
broer21年前1 -
 AntonyloveJackie 共回答了20个问题
AntonyloveJackie 共回答了20个问题 |采纳率95%1、有公式得到:5500=4/3πR³ 所以R=5√33∏
2、由题意得2x+4=3x+2,所以得x=2,所以3x+2=8
因此3x+2的平方根等于2√21年前查看全部
- (2010•江苏二模)草酸(H2C2O4)是一种重要的化工原料.已知常温下0.01mol•L-1的H2C2O4、KHC2
(2010•江苏二模)草酸(H2C2O4)是一种重要的化工原料.已知常温下0.01mol•L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示.
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+):c(HC2O4-)接近1:1的是______(填字母).H2C2O4 KHC2O4 K2C2O4 pH 2.0 3.1 8.1
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4D.升高溶液的温度
(2)取一定质量H2C2O4•2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol•L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol•L-1 H2SO4溶液酸化后,用0.10mol•L-1 KMnO4溶液滴定,当消耗KMnO4溶液16.00mL时,溶液由无色变为浅紫红色.请回答下列问题:
①完成离子方程式:5C2O42-+2Mn04-+16H+═10______+2Mn2++8H2O.
②原混合物中H2C2O4•2H2O和KHC2O4的物质的量之比为______.
(3)某实验小组用如图所示的装置探究FeC2O4•2H2O在隔绝空气条件下受热分解的产物.当36D0g FeC2O4•2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g.求残留固体的成分和物质的量.(已知FeC2O4•2H2O的相对分子质量为180;设反应产生的气体被充分吸收) 路_渐行渐远1年前1
路_渐行渐远1年前1 -
 sqhkjy 共回答了16个问题
sqhkjy 共回答了16个问题 |采纳率87.5%解题思路:(1)依据KHC2O4溶液显酸性可知,溶液中电离大于水解,选择抑制电离的试剂;
A、H2C2O4 分步电离显酸性,可以抑制HC2O4-离子的电离;
B、加入KHC2O4仍然离子浓度是大于1:1;
C、加入适量的Na2C2O4,可以抑制 HC2O4-离子的电离;
D、升温促进电离;
(2)①依据电子守恒、电荷守恒和原子守恒配平写出;
②依据原子守恒和化学方程式计算得到;
(3)最后被点燃的为一氧化碳气体,浓硫酸增重7.2g为水,碱石灰增重11.0g为二氧化碳气体.依据反应生成的物质在过程中的质量分别计算得到;(1)图表分析,KHC2O4溶液显酸性可知,溶液中电离大于水解,选择抑制HC2O4-离子电离的试剂;
A、H2C2O4 分步电离显酸性,可以抑制HC2O4-离子的电离,KHC2O4溶液中c(K+):c(HC2O4-)接近1:1;故A符合;
B、加入KHC2O4仍然离子浓度是大于1:1;故B不符合;
C、加入适量的Na2C2O4,可以抑制 HC2O4-离子的电离,KHC2O4溶液中c(K+):c(HC2O4-)接近1:1;故C符合;
D、升温促进电离,KHC2O4溶液中c(K+):c(HC2O4-)大于1:1;故D不符合;
故答案为:AC;
(2)①依据原子守恒得到为CO2;故答案为:CO2;
②25mL中,设xmol H2C2O4•2H2O ymol KHC2O4根据滴定的,可以得出:2x+y=0.25×0.02
根据氧化还原的,可以得出:x+y=0.1×0.016×2.5,x=0.001,y=0.003mol,所以原混合物中H2C2O4•2H2O和KHC2O4的物质的量之比为1:3;故答案为:1:3;
(3)被点燃的气体为CO,质量为m(CO)=36.0 g-13.6 g-7.2 g-11.0 g=4.2 g;
又FeC2O4•2H2O为0.2 mol,n(H2O)=7.2 g÷18 g/mol=0.4 mol,
n(CO2)=11.0 g÷44 g/mol=0.25 mol,n(CO)=4.2 g÷28 g/mol=0.15 mol,
所以,残留固体中所含元素及物质的量为n(Fe)=0.2 mol,n(O)=0.15 mol,
则残留固体为Fe和FeO的混合物,其中Fe为0.05 mol,FeO为0.15 mol;
故答案为:Fe为0.05 mol,FeO为0.15 mol;点评:
本题考点: 影响盐类水解程度的主要因素;氧化还原反应方程式的配平.
考点点评: 本题考查了盐类水解和弱电解质电离的相对大小比较,平衡移动方向的判断,氧化还原反应离子方程式的配平方法,实验过程的计算应用,题目难度中等.1年前查看全部
- (16分)氯化铵是一种重要的化工原料,应用广泛。
(16分)氯化铵是一种重要的化工原料,应用广泛。
(1)实验室通常用NH 4 Cl固体与Ca(OH) 2 固体混合共热制取氨气。
①写出实验室制取氨气的反应方程式 。
②浓氨水可以用来检验有毒气体氯气的泄漏,反应式为3Cl 2 +8NH 3 = N 2 + 6NH 4 Cl,在该反应中,氧化剂是 (填化学式),检测时观察到的现象是 ,21.3 g氯气能氧化氨气 mol。
(2)用浓氯化铵溶液处理的舞台幕布难着火,其原因是 (填字母)。
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔离了部分空气
(3)实验室可用NH 4 Cl溶液与饱和的NaNO 2 溶液反应制取纯净的氮气,反应方程式为:A.①② B.③④ C.①③ D.②④
NaNO 2 +NH 4 Cl NaCl+N 2 ↑+2H 2 O
NaCl+N 2 ↑+2H 2 O
实验装置如下图所示,试回答:
①装置中A部分的分液漏斗与蒸馏烧瓶之间连接
的导管所起的作用是 (填写编号)。
a.防止饱和溶液蒸发
b.保证实验装置不漏气
c.使饱和NaNO 2 溶液容易滴下
②加热前必须进行的一个操作步骤是 。
③收集N 2 最适宜的方法是 (填写编号)
a.排空气法收集在集气瓶中
b.排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中 hcgg0061年前1
hcgg0061年前1 -
 半夏了 共回答了15个问题
半夏了 共回答了15个问题 |采纳率93.3%1年前查看全部
- 做实验室(试剂--设备--仪器--耗材),化工原料有前途吗?
 王荣本1年前3
王荣本1年前3 -
 爱笑的叶子117 共回答了19个问题
爱笑的叶子117 共回答了19个问题 |采纳率94.7%这就是做业务,业务好的话,你说好不好!1年前查看全部
- 排列组合:某化工厂生产中需依次投放2种化工原料,现已知有5种原料可用,但甲乙两种原料
排列组合:某化工厂生产中需依次投放2种化工原料,现已知有5种原料可用,但甲乙两种原料
某化工厂生产中需依次投放2种化工原料,现已知有5种原料可用,但甲乙两种原料不能同时使用,且依次投料时,若使用甲原料,则甲必须先投放,则不同投放方法是? happybebe1年前1
happybebe1年前1 -
 飘渺峰上 共回答了18个问题
飘渺峰上 共回答了18个问题 |采纳率88.9%这里甲属于特殊个体那么就把甲单独列出来
(1)有甲原料 那么甲必须第一个放 还不能有已 只有3种
(2)没有甲原料 剩下的四种没什么要求 就是A 4 2 知道怎么写吧 A右下角4 右上角2
4*3=12 3+12=15
即 15种1年前查看全部
- 关于CO2 CO2的下列用途既跟它的物理性质有关,又跟它的化学性质有关的是?A、灭火 B、做化工原料 C、制干冰 D、温
关于CO2
CO2的下列用途既跟它的物理性质有关,又跟它的化学性质有关的是?
A、灭火 B、做化工原料 C、制干冰 D、温室中做肥料
请说明为什么、 laogt1年前2
laogt1年前2 -
 navy2008 共回答了17个问题
navy2008 共回答了17个问题 |采纳率100%A.
二氧化碳能灭火主要由于:
1.它的密度大于空气.能使可燃物隔绝氧气而停止燃烧.这是物理性质.
2.二氧化碳不能燃烧也不支持燃烧.这是化学性质.1年前查看全部
- 某化工材料经销公司购进了一批化工原料共7000千克,购进价格为每千克30元.物价部门规定其销售单价不得高于每千克70元,
某化工材料经销公司购进了一批化工原料共7000千克,购进价格为每千克30元.物价部门规定其销售单价不得高于每千克70元,也不得低于30元.市场调查发现,单价定为70元时,日均销售60千克;单价每降低1元,每天多售出2千克.在销售过程中,每天还要支出其他费用500元(天数不足一天时,按一天计算).设销售单价为x元,日均获利为y元.请你求出y关于x的二次函数关系式,并注明x的取值范围.
 想结婚的小胖1年前1
想结婚的小胖1年前1 -
 九天游龙 共回答了12个问题
九天游龙 共回答了12个问题 |采纳率100%解题思路:若销售单价为x元,则每千克降低(70-x)元,日均多销售出2(70-x)千克,日均销售量为[60+2(70-x)]千克,每千克获利(x-30)元,列出函数关系式.若销售单价为x元,则每千克降低(70-x)元,日均多销售出2(70-x)千克,日均销售量为[60+2(70-x)]千克,每千克获利(x-30)元.依题意,得
y=(x-30)[60+2(70-x)]-500,
=-2x2+260x-6500(30≤x≤70),
即y=-2x2+260x-6500(30≤x≤70).点评:
本题考点: 二次函数的应用.
考点点评: 本题主要考查二次函数的应用,运用二次函数解决实际问题,比较简单.1年前查看全部
- (说理由)1.CO2的下列用途既跟它的物理性质有关,又跟它的化学性质有关的是:A.灭火 B.做化工原料 C.制干冰 D.
(说理由)
1.CO2的下列用途既跟它的物理性质有关,又跟它的化学性质有关的是:
A.灭火 B.做化工原料 C.制干冰 D.温室中做肥料
2.在区别下列各物质的方法中,不可行的是( )
A.CO和CO2分别通入Ca(OH)2溶液中,观察现象
B.O2和CO2分别通入灼热的氧化铜,观察现象
C.H2和CO2分别通入澄清石灰水,观察现象
D.CO和O2分别通入灼热的铜网,观察现象
3.下列说法正确的是( )
A.某气体在空气中燃烧发出蓝色火焰,此气体是一氧化碳
B.向某固体中加入稀盐酸时,能产生气泡,此固体中一定含CaCO3
C.能使燃着的木条熄灭的气体不一定是二氧化碳
D.二氧化碳能使紫色石蕊试液变红,加热后红色加深 lmeon1年前1
lmeon1年前1 -
 powerji 共回答了20个问题
powerji 共回答了20个问题 |采纳率95%1、A、D
A:密度差异(物)、化学惰性(化)
B:化性
C:物性
D:温室效应(物)、光合作用(化)
2、B
A:CO2反应,CO不反应
B、都不反应
C:H2不反应,CO2反应
D:CO不反应,O2反应
3、C
A:蓝色火焰的气体多了去了;
B:与盐酸反应放出气体的固体多了去了;
C:N2、Ar等不助燃的气体都会灭火;
D:前名没错,后错,因为加热使CO2跑了,红色应弱化.1年前查看全部
- (2014•青岛一模)碱式碳酸铜和氯气都是用途广泛的化工原料.
(2014•青岛一模)碱式碳酸铜和氯气都是用途广泛的化工原料.
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备碱式碳酸铜,其制备过程如下:
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
①氯酸钠的作用是______;物质 Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀pH 4.2 5.8 1.2 完全沉淀pH 6.7 8.3 3.2
②反应A后调节溶液的pH范围应为______.
③第一次过滤得到的产品洗涤时,如何判断已经洗净?______.
④造成蓝绿色产品中混有CuO杂质的原因是______.
(2)某学习小组在实验室中利用图所示装置制取氯气并探究其性质.
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有______.
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因______.
此时B装置中发生反应的离子方程式是______.
③写出A溶液中具有强氧化性微粒的化学式______.若向A溶液中加入NaHCO3粉末,会观察到的现象是______. yy85121年前1
yy85121年前1 -
 panjpalang 共回答了19个问题
panjpalang 共回答了19个问题 |采纳率94.7%解题思路:(1)①工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备碱式碳酸铜,流程分析,加入氯酸钠的作用是氧化剂作用,氧化亚铁离子为铁离子易于除去;
②依据图表数据分析,铁离子全部沉淀,铜离子不沉淀的PH范围为3.2-4.2;
③检验洗涤是否干净,设计实验检验滤液中是否含有氯离子证明是否洗涤干净;
④蓝绿色产品中混有CuO杂质可能的元婴是氢氧化铜咋温度较高会发生分解生成氧化铜;
(2)①实验室用二氧化锰和浓盐酸加热制取氯气的仪器用途和使用方法,需要检漏的仪器是分液漏斗;
②依据氯气、次氯酸都是强氧化剂都可以使品红试液褪色分析;溴化亚铁溶液中通入过量氯气反应生成氯化铁和溴单质;
③A为氯水,溶液中具有氧化性的微粒为氯气、次氯酸、次氯酸根;氯水中 加入碳酸氢钠溶液会和盐酸反应生成二氧化碳气体.(1)①工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备碱式碳酸铜,流程分析,加入氯酸钠的作用是氧化剂作用,氧化亚铁离子为铁离子,调节溶液PH易于把铁离子沉淀除去,
故答案为:将Fe2+氧化成Fe3+并最终除去;
②流程分析可知,分离除杂的方法是通过调节溶液PH大于3.2,小于4.2,使铁离子全部沉淀完全,铜离子不沉淀,达到分离的目的,故答案为:3.2-4.2;
③沉淀表面会含有氯化钠溶液,设计实验检验是否含有氯离子的方法可以检验是否洗涤干净,实验设计为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净,故答案为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净;
④造成蓝绿色产品中混有CuO杂质的原因是B步骤温度过高,生成氢氧化铜会分解生成氧化铜,故答案为:反应B的温度过高;
(2)①根据实验室用二氧化锰和浓盐酸加热制取氯气的仪器用途和使用方法,需要检漏的仪器是带玻璃活塞的分液漏斗,故答案为:分液漏斗;
②若C中品红溶液褪色,可能是氯气本身也具有氧化性,能使品红褪色,也可以是氯气和水反应生成的次氯酸具有氧化性使品红褪色,不能证明氯气与水反应的产物有漂白性,过量氯气通过溴化亚铁溶液发生氧化还原反应,亚铁离子和溴离子全部被氧化生成氯化铁和溴单质,反应的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2;
故答案为:不能证明,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2;
③A溶液是氯水溶液,存在化学平衡,Cl+H2O=HCl+HClO,溶液中具有强氧化性微粒的化学式Cl2、HClO、ClO-;加入碳酸氢钠溶液和氯水中的盐酸反应生成二氧化碳气体,HCO3-+H+=H2O+CO2↑,现象有无色气体生成,故答案为:Cl2、HClO、ClO-;有无色气体产生.点评:
本题考点: 物质的分离、提纯的基本方法选择与应用;氯、溴、碘的性质实验.
考点点评: 本题考查了实验探究物质分离方法和物质性质的分析判断,实验室制备气体的过程分析和氯气性质的应用判断,掌握物质性质是关键,题目难度中等.1年前查看全部
- 求大神帮我改改这段英语,从另一方面来说,石油本身就是一种宝贵的化工原料,可以用来制造塑料、合成橡胶和合成纤维等.把石油作
求大神帮我改改这段英语,
从另一方面来说,石油本身就是一种宝贵的化工原料,可以用来制造塑料、合成橡胶和合成纤维等.把石油作为燃料烧掉了,不但十分可惜,而且还污染了人类赖以生存的环境.解决这个难题的唯一可行办法,就是加紧开发新能源.根据调查显示,汽车所造成的空气污染占整个城市空气污染的60%甚至到90%.不可再生能源的日趋枯竭,城市污染的加重,世界范围内的温室效应,海平面升高等一系列环境问题都给我们人类的持续发展敲响了警钟,促使我们必须寻求一条绿色发展之路,寻找可以代替不可再生能源的新能源(清洁能源).毫无疑问具有清洁、高效并且取之不尽用之不竭等优点的太阳能被人们列入了第一考虑对象.
On the other hand,the oil itself is a kind of valuable chemicalraw materials,can be used to make plastics,synthetic rubber and syntheticfiber,etc.The oil as fuel is burned,not only great pity,but also pollutesthe environment to the survival of humans.The only feasible way to solve thisdifficult problem,is to intensify the development of new energy.According tothe survey,car air pollution caused by the 60% of air pollution in the cityand even to 90%.Non-renewable energy depleted,city pollution is aggravating,the world within the scope of the greenhouse effect,rising sea levels and aseries of environmental problems is the sustainable development of human beingsis a wake-up call to us,we must seek a path of green development,seek newenergy can replace non-renewable energy (clean).There is no doubt that isclean,efficient and inexhaustible advantages of solar energy has been listedas the first consideration. 嬲妮1年前1
嬲妮1年前1 -
 everds 共回答了23个问题
everds 共回答了23个问题 |采纳率91.3%On the other hand,the oil itself is a valuable chemical raw material,can be used to make plastics,synthetic rubber and synthetic fiber etc..The oil as fuel is burned,not only a great pity,but also pollutes the environment for human survival.The only feasible way to solve this problem,is to step up the development of new energy.According to the survey,the air pollution caused by cars accounted for the entire city air pollution 60% or even to 90%.Increasing depletion of non renewable energy sources,aggravate the city pollution,the greenhouse effect in the world,the sea level rise higher a series of environmental problems are to our sustainable development of mankind has sounded the alarm,to which we must seek a green development path,look for new energy to replace non renewable energy (clean).There is no doubt has a clean,efficient and inexhaustible be inexhaustible solar energy has been included in the advantages of first consideration.1年前查看全部
- S是什么化工原料?平时温度高的时候是液体,接近0度时候会凝固成固体
 jqm6501161年前1
jqm6501161年前1 -
 wzwz527 共回答了20个问题
wzwz527 共回答了20个问题 |采纳率100%橡胶硫化
制取硫酸
制取硫化钠1年前查看全部
- A是来自是有的重要化工原料,对水果有催熟作用,75%的B可用于医用消毒,E是具有果香味的有机物,F是一种高聚物,可制成多
A是来自是有的重要化工原料,对水果有催熟作用,75%的B可用于医用消毒,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料
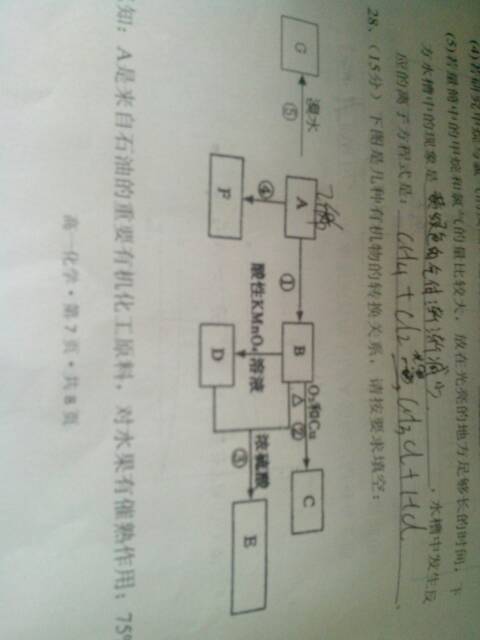
 wjunmike1年前1
wjunmike1年前1 -
 lironx 共回答了22个问题
lironx 共回答了22个问题 |采纳率100%(1) C2H4,高锰酸钾溶液褪色
(2)乙醛,[ CH2—CH2 ] n
(3)羧基 取少量的物质于试管中滴加石蕊试液,若溶液变红则证明该物质中存在—COOH(可以用Na2CO3溶液、Mg、新制Cu(OH)2等)
(4)CH2=CH2 + Br2 → CH2Br-CH2Br
(5)加聚 (6)AC1年前查看全部
- 一种化工原料,原来每吨生产成本是1250元,现在成本降低了20%.现在每吨成本是多少元?
 嘻唰唰嘻1年前1
嘻唰唰嘻1年前1 -
 广鹿飞雪 共回答了14个问题
广鹿飞雪 共回答了14个问题 |采纳率92.9%解题思路:把原来每吨的成本看作单位“1”,现在成本降低了20%,就是说现在成本是原来的(1-20%),那么现在每吨成本是1250×(1-20%),解决问题.1250×(1-20%),
=1250×0.8,
=1000(元);
答:现在每吨成本是1000元.点评:
本题考点: 百分数的实际应用.
考点点评: 此题解答的关键是把原来每吨的成本看作单位“1”,求出现在成本是原来的百分之几,根据百分数乘法的意义,解决问题.1年前查看全部
- (2013•茂名一模)工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
(2013•茂名一模)工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯

其中乙苯在CO2气氛中的反应可分两步进行
(1)上述乙苯与CO2反应的反应热△H为______
(2)①乙苯与CO2反应的平衡常数表达式为:K=c(C6H5CH=CH2)•c(CO)•c(H2O) c(C6H5CH2CH3)c(CO2) c(C6H5CH=CH2)•c(CO)•c(H2O) c(C6H5CH2CH3)c(CO2)
②乙苯与CO2在固定体积的容器中反应下列叙述不能说明已达到平衡状态的是______
a.体系的密度不再改变b.体系的压强不再改变c.c(CO2)=c(CO)
d.消耗1molCO2同时生成1molH2Oe.CO2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为
1.0mol/L和3.0mol/L,其中实验I在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示.
①实验I乙苯在0-50min时的反应速率为______
②实验Ⅱ可能改变条件的是______
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(4)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将______(填“增大”、“减小”或“不变”),计算此时平衡常数为______. 孤星入命1年前1
孤星入命1年前1 -
 renyi26 共回答了15个问题
renyi26 共回答了15个问题 |采纳率93.3%解题思路:(1)根据盖斯定律结合热化学方程式分析;
(2)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合方程式分析;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(3)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小;
(4)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,因为温度不变,则K不变,根据图I中数据求出K的值.(1)方程A+方程B得到:
 ,所以该反应的反应热为:△H=△H1+△H2=-125-41=-166KJ/mol,
,所以该反应的反应热为:△H=△H1+△H2=-125-41=-166KJ/mol,
故答案为:-166KJ/mol;
(2)①乙苯与CO2反应的平衡常数表达式为:K=
c(C6H5CH=CH2)•c(CO)•c(H2O)
c(C6H5CH2CH3)c(CO2),故答案为:
c(C6H5CH=CH2)•c(CO)•c(H2O)
c(C6H5CH2CH3)c(CO2);
②a.反应前后体积不变,质量守恒,所以体系的密度始终不变,故不能用密度判断平衡,故a错误;
b.反应前后气体的体积不等,所以体系的压强改变,当压强不再变化即是平衡状态,故b正确;
c.c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故c错误;
d.消耗1molCO2为正速率,同时生成1molH2O也是正速率,都是正速率,二者始终相等,不能说明已经达到平衡状态,故d错误;
e.随着反应的进行CO2的体积分数逐渐减小,当CO2的体积分数保持不变,即是平衡状态,故e正确;
所以不能说明已达到平衡状态的是acd,故答案为:acd;
(3)①根据图I中可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,则其反应速率为[△c/t]=[0.6mol/L/50min]=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②根据图I中实验Ⅱ改变条件平衡不移动,而反应速率增大,所以改变的条件是加催化剂,故答案为:加催化剂;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小,其图形为: ;
;
故答案为: ;
;
(4)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,平衡正移,由于二氧化碳的初始浓度没变,平衡移动引起的乙苯的浓度的减小量小于加入的乙苯引起的浓度增加量,所以乙苯的转化率减小;
根据图I中实验1可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L
C6H5CH2CH3 +CO2 ⇌C6H5CH=CH2 +CO+H2O
起始浓度(mol/L):1.0 3.0 0 0 0
反应浓度(mol/L):0.6 0.6 0.6 0.6 0.6
平衡浓度(mol/L):0.4 2.4 0.6 0.6 0.6
则K=[0.6×0.6×0.6/0.4×2.4]=0.225,
故答案为:减小;0.225.点评:
本题考点: 化学平衡状态的判断;化学平衡的计算.
考点点评: 本题综合性较大,涉及化学平衡状态的判断、化学平衡常数、化学平衡影响因素、反应速率的计算等,注意(4)中平衡常数的计算依据图I中的实验1分析计算,题目难度较大.1年前查看全部
- (2010•钦州)氢氧化钠是一种重要的化工原料.下列俗名不能表示氢氧化钠的是( )
(2010•钦州)氢氧化钠是一种重要的化工原料.下列俗名不能表示氢氧化钠的是( )
A.烧碱
B.纯碱
C.火碱
D.苛性钠 老陈2121年前1
老陈2121年前1 -
 ny1129 共回答了20个问题
ny1129 共回答了20个问题 |采纳率80%解题思路:根据已有的知识进行分析,氢氧化钠俗称烧碱、火碱、苛性钠.氢氧化钠俗称烧碱、火碱、苛性钠,纯碱是碳酸钠的俗称,观察选项,故选B.
点评:
本题考点: 常见碱的特性和用途.
考点点评: 本题考查了氢氧化钠的俗称,完成此题,可以依据已有的知识进行.1年前查看全部
- 煤和石油不仅是重要的化石燃料,也是重要的化工原料.下列有关煤和石油的综合利用中,属于物理变化的是( )
煤和石油不仅是重要的化石燃料,也是重要的化工原料.下列有关煤和石油的综合利用中,属于物理变化的是( )
A.石油的分馏
B.煤的干馏
C.石油的催化裂化
D.煤的气化 阿里笑笑1年前1
阿里笑笑1年前1 -
 童语1000 共回答了13个问题
童语1000 共回答了13个问题 |采纳率100%解题思路:化学变化是指在原子核不变的情况下,有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别在于是否有新物质生成.A、石油的分馏是控制各物质沸点的不同来实现物质的分离的方法,属于物理变化过程,故A正确;
B、煤的干馏是将煤隔绝空气加强热使其分解的过程,属于化学变化,故B错误;
C、石油的催化裂化是就是在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程,属于化学变化,故C错误;
D、煤的气化是指煤在特定的设备内,在一定温度及压力下使煤中有机质与气化剂(如蒸汽/空气或氧气等)发生一系列化学反应,将固体煤转化为含有CO、H2、CH4等可燃气体和CO2、N2等非可燃气体的过程,属于化学变化,故D错误.
故选A.点评:
本题考点: 物理变化与化学变化的区别与联系;石油的分馏产品和用途;石油的裂化和裂解;煤的干馏和综合利用.
考点点评: 解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化.1年前查看全部
- 氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含
氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
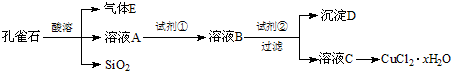
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①选用______(填字母).Fe3+ Cu2+ Fe2+ 开始沉淀的pH 2.7 5.4 8.1 沉淀完全的pH 3.7 6.9 9.6
A.CuB.Cl2C.NH3•H2OD.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是______.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是______、______过滤和无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是______.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是______.
②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=[80a−135b/18b][80a−135b/18b](用含a、b的代数式表示). 香如玉1年前1
香如玉1年前1 -
 vcactor 共回答了19个问题
vcactor 共回答了19个问题 |采纳率100%解题思路:(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,结合金属离子从开始沉淀到沉淀完全时溶液的pH选择pH的范围.
由溶液到晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解.
②加热沉淀至质量不再减轻为止,b g为CuO质量,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),再结合m=nM计算x的值.(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
A.Cu不能与Fe2+反应,故A错误;
B.Cl2可以将Fe2+氧化为Fe3+,且不引入新杂质,故B正确;
C.NH3•H2O可以沉淀Cu2+、Fe2+、Fe3+,引入铵根离子,故C错误;
D.NaOH可以沉淀Cu2+、Fe2+、Fe3+,引入钠离子,故D错误.
故选:B.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,由金属离子从开始沉淀到沉淀完全时溶液的pH可知,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.4开始沉淀,所以应该可知pH范围为3.7~5.4.
由溶液获得CuCl2•xH2O晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.
氯化铜易溶于水,使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
故答案为:3.7~5.4;蒸发浓缩、冷却结晶;防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O⇌Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大.
故答案为:CuCl2•xH2O晶体加热时会发生水解.
②b g为CuO质量为[bg/80g/mol]=[b/80]mol,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),所以ag=[b/80]mol×(135+18x)g/mol,解得,x=[80a−135b/18b].
故答案为:[80a−135b/18b].点评:
本题考点: 制备实验方案的设计;化学方程式的有关计算;常见阳离子的检验;探究物质的组成或测量物质的含量.
考点点评: 考查阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.1年前查看全部
- 用什么化工原料能从X光片中提取银子
 不回头的浪子1年前3
不回头的浪子1年前3 -
 appale 共回答了29个问题
appale 共回答了29个问题 |采纳率89.7%X光片上面应该是显影用的 溴化银还是碘化银
溶解或者反应溴化银即可1年前查看全部
- 氨是一种重要化工原料,大量用于制造铵态氮肥、有机氮肥(如尿素),还用于制造硝酸。学生甲和乙欲制取氨气并探究其性质。
氨是一种重要化工原料,大量用于制造铵态氮肥、有机氮肥(如尿素),还用于制造硝酸。学生甲和乙欲制取氨气并探究其性质。
请回答:
(1)用硫酸铵与消石灰共热制取氨气的化学方程式:____________________。
(2)下图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是___________。
(3)学生甲和学生乙在相同环境下同时分别进行氨气喷泉的实验,学生甲实验时,水涌入烧瓶中占烧瓶体积的4/5,学生乙实验时,水涌入烧瓶中却只占烧瓶体积的1/5,假设烧瓶内液体没有溢散,他们制得氨水的物质的量浓度比是___________。
(4)氨气在空气中不能燃烧,为了探究在催化剂存在时氨气能否被空气氧化,他们合作进行下图所示的实验。
①实验时,先加热到三氧化二铬红热,并鼓入空气。停止加热后再继续鼓入空气,三氧化二铬保持红热,原因是____________________。
②氨催化氧化的化学方程式:_____________________。
③整个实验过程中,不会生成的物质是______。
A. N 2 B.NO 2 C.HNO 3 D.NH 4 NO 3
(5)将NH 3 通过灼热的CuO后得到红色物质Cu。
甲同学认为:NH 3 与CuO反应生成的红色物质Cu中可能含有Cu 2 O。
已知:Cu 2 O是一种碱性氧化物;在酸性溶液中,Cu + 的稳定性比Cu 2+ 差(2Cu + Cu+Cu 2+ )。请你设计一个简单的实验检验该红色物质中是否含有Cu 2 O__________
Cu+Cu 2+ )。请你设计一个简单的实验检验该红色物质中是否含有Cu 2 O__________  残茶孤灯1年前1
残茶孤灯1年前1 -
 况利民 共回答了17个问题
况利民 共回答了17个问题 |采纳率88.2%1年前查看全部
- 硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)⇌2NH3(g)△H<0一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的15/16,则N2的转化率a1=______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
①在容积恒定的密闭容器中进行反应2NO(g)+O2(g)⇌2NO2(g)△H>0.该反应的反应速率(v)随时间(t)变化的关系如图1所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______.
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
②积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2 (g)⇌N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1,a2.已知T1<T2,则a1______a2
A.大于B.小于C.等于D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是______.
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是______.
(4)CO可用于合成甲醇,反应方程式为:
CO(g)+2H2(g)⇌CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图2所示.该反应△H______0(填“>”或“<”). hqstorm1年前1
hqstorm1年前1 -
 ironydy 共回答了22个问题
ironydy 共回答了22个问题 |采纳率95.5%解题思路:(1)反应的方程式为N2(g)+3H2(g)⇌2NH3(g),依据化学平衡三段式列式计算得到;恒压容器中压强大于恒容容器中,平衡正向进行,转化率增大;
(2)①a.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡;
b.该反应正反应是气体体积减小的反应,增大压强平衡向正反应进行;
c.恒容条件下,反应混合气体的总质量不变,密度始终不变;
d.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度;
②升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图,据此判断.
(3)①根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也乘以相应的系数并进行相应的运算;
②根据n=[m/M]计算NO2的物质的量,反应中只有NO2中N元素化合价发生变化,发生歧化反应,有生成NO3-,根据注意电子数计算生成NO3-的物质的量,再根据电子转移守恒计算N元素在还原产物中的化合价,判断还原产物,据此书写;
(4)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.(1)N2(g)+3H2(g)⇌2NH3(g)
开始(mol) 1 3 0
转化(mol) x 3x 2x
平衡(mol)1-x 3-3x 2x
[1−x+3−3x+2x/1+3]=[15/16],
x=0.125,
N2的转化率a1=[0.125mol/1mol]×100%=12.5%,
正反应是气体体积减小的反应,容器压强恒定,相当于在恒容的条件下增大压强,平衡向正反应进行,氮气的转化率增大,所以a2>a1,
故答案为:12.5%;>;
(2)①a.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡,故a正确;
b.正反应是吸热反应,升高温度平衡向正反应移动,在t2时,正、逆速率都增大,且正反应速率增大更多,平衡向正反应移动,但该反应正反应是气体体积减小的反应,增大压强平衡也向正反应进行,故t2时为升高温度或增大压强,故b错误;
c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态,故c错误;
d.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值的最大,故d正确;
故选ad;
②升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图为 ,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D;
,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D;
(3)①已知:Ⅰ、2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
Ⅱ、N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
由盖斯定律可知,Ⅰ×2-Ⅱ得4H2(g)+2NO2(g)=N2(g)+4H2O(g),
故△H=2×(-483.5kJ/mol)-133kJ/mol=-1100kJ/mol,
故热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100kJ/mol,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100kJ/mol;
②9.2gNO2的物质的量=[9.2g/46g/mol],反应中只有NO2中N元素化合价发生变化,发生歧化反应,有生成NO3-,
0.2mol二氧化氮转移电子的物质的量是0.1mol,故生成的NO3-的物质的量为[0.1mol/5−4]=0.1mol,故被还原的氮原子物质的量为0.2mol-0.1mol=0.1mol,令N元素在还原产物中的化合价为x价,则0.1mol×(4-x)=0.1mol,解得x=+3,故还原产物为NO2-,且生成的NO3-和NO2-物质的量之比为1:1,同时反应生成CO2,故二氧化氮和碳酸钠溶液反应的离子反应方程式为:2NO2+CO32-=NO3-+NO2-+CO2,故答案为:2NO2+CO32-=NO3-+NO2-+CO2;
(4)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动,正反应为放热反应,△H<0,故答案为:<.点评:
本题考点: 化学平衡的计算;化学平衡状态的判断;转化率随温度、压强的变化曲线.
考点点评: 本题是一道很好的综合试题,适合当前的高考思路,综合性强.同时考查了学生的识图能力.这是学生必备的能力,题目难度中等.1年前查看全部
- 什么化工原料能使有颜色的水变清黑色
 望尽uu人1年前2
望尽uu人1年前2 -
 jijigowithyou 共回答了19个问题
jijigowithyou 共回答了19个问题 |采纳率89.5%双氧水 活性炭脱色后都能脱色遍清
再就是加絮凝剂聚丙烯酰胺等也可以1年前查看全部
- (2014•合肥三模)二氧化碳和氢气可在一定条件下反应,生成一种重要的化工原料甲醇CO2+3H2 钌−膦鉻合物
(2014•合肥三模)二氧化碳和氢气可在一定条件下反应,生成一种重要的化工原料甲醇CO2+3H2
CH3OH+H2O.下列有关该反应的说法正确的是( )钌−膦鉻合物 .加压
A.为二氧化碳的利用创造一种新途径
B.氢原子数在反应前后发生了改变
C.钌-膦铬合物的质量在反应前后发生了变化
D.属于置换反应 八戒小和尚1年前1
八戒小和尚1年前1 -
 rr飞扬少 共回答了18个问题
rr飞扬少 共回答了18个问题 |采纳率77.8%A、二氧化碳含量多了会造成温室效应,该反应能吸收二氧化碳,且生成甲醇和水,所以为CO2的利用创造了一种新途径,故A正确;
B、由质量守恒定律可知反应前后各种原子的数目和种类不变,故B错;
C、钌-膦铬合物是该反应的催化剂,催化剂反应前后质量不变,故C错;
D、反应物中有单质和化合物,生成物是两种化合物,所以该反应不是置换反应,故D错.
故选A.1年前查看全部
- 煤是重要的化工原料,用煤作燃料,不仅存在浪费,而且因烟煤中含有硫的化合物(如FeS2),燃烧时会生成SO2气体造成环境污
煤是重要的化工原料,用煤作燃料,不仅存在浪费,而且因烟煤中含有硫的化合物(如FeS2),燃烧时会生成SO2气体造成环境污染.某厂燃3000t,产生多少so2
 caiwen1年前3
caiwen1年前3 -
 林家龙 共回答了14个问题
林家龙 共回答了14个问题 |采纳率100%要附煤质分析报告的,烟煤的各种指标都是在一个范围内的,没有准确的数据是不能分析的,前面网友分析的是FeS2燃烧时生成的二氧化硫的量,无参考价值!1年前查看全部
- 海水中有取之不尽的化学资源,从海水中可提取多种化工原料.如图是某化工厂对海水资源综合利用的示意图:
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.如图是某化工厂对海水资源综合利用的示意图:

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO
等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性.请写出加入盐酸后发生反应的离子方程式______.2−4
(2)海水里的镁元素处于______(游离、化合)态,从海水中提取氯化镁的反应______(“是”或“不是”)氧化还原反应,理由______.
(3)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液里加入石灰乳的作用是______.
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却______
A.H2 B.CO2C.空气D.O2. 祈愿鸟1年前1
祈愿鸟1年前1 -
 我爱柠檬1979 共回答了14个问题
我爱柠檬1979 共回答了14个问题 |采纳率100%解题思路:(1)依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,硫酸根离子、镁离子,钙离子和钡离子均转化为沉淀,过滤后加盐酸,与NaOH、Na2CO3溶液反应;
(2)海水里的镁元素以化合物存在,从海水中提取氯化镁,向海水中加氢氧化钙、然后加盐酸;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应;
(4)电解无水氯化镁所得的镁蒸气,应避免镁再被氧化.(1)依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,硫酸根离子、镁离子,钙离子和钡离子均转化为沉淀,过滤后加盐酸,与NaOH、Na2CO3溶液反应,反应的离子反应分别为OH-+H+═H2O、CO32-+2H+═H2O+CO2↑,故答案为:OH-+H+═H2O、CO32-+2H+═H2O+CO2↑;
(2)海水里的镁元素以化合态存在,从海水中提取氯化镁,向海水中加氢氧化钙、然后加盐酸,均为复分解反应,没有元素的化合价变化,则不是氧化还原反应,
故答案为:化合;不是;因为没有发生化合价变化;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应,将Mg2+沉淀为Mg(OH)2,故答案为:将Mg2+沉淀为Mg(OH)2;
(4)电解无水氯化镁所得的镁蒸气,应避免镁再被氧化,B、C、D都能使Mg再被氧化,则A中氢气可防止镁被氧化,故答案为:A.点评:
本题考点: 离子方程式的书写;氧化还原反应;电解原理;海水资源及其综合利用.
考点点评: 本题考查较综合,涉及离子反应、粗盐提纯、金属的冶炼等,为高考常见题型,把握发生的化学反应为解答的关键,注意离子反应与氧化还原反应的分析,题目难度不大.1年前查看全部
- 我怀孕前经常接触化工原料,如:甲缩醛,甲醇,甲烷,丙烷,现在怀孕了对胎儿有影响吗?
 mmx_20061年前1
mmx_20061年前1 -
 浪人师哥 共回答了22个问题
浪人师哥 共回答了22个问题 |采纳率90.9%怀孕前的话关系不大,怀孕后最好不要接触了
记得采纳啊1年前查看全部
- 有一批上万吨的化工原料要从北京通过海运运往南方某一沿海城市,那么选择装货地点的港口位于的城市和濒临的海洋分别是( )
有一批上万吨的化工原料要从北京通过海运运往南方某一沿海城市,那么选择装货地点的港口位于的城市和濒临的海洋分别是( )
A. 秦皇岛、黄海
B. 天津、渤海
C. 青岛、渤海
D. 天津、东海 d770120791年前1
d770120791年前1 -
 tootwo 共回答了14个问题
tootwo 共回答了14个问题 |采纳率85.7%解题思路:天津市位于北京市的东南,是首都的门户,天津市濒临渤海.有一批上万吨的化工原料要从北京通过海运运往南方某一沿海城市,那么选择装货地点的港口位于的城市和濒临的海洋分别是天津、渤海.
故选:B.点评:
本题考点: 海洋航运路线及主要海港.
考点点评: 本题考查我国的沿海港口城市的位置,读图记忆即可.1年前查看全部
- 煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤中含有硫,燃烧后生成的二氧化硫会造成空气污染.某工厂用煤做燃料
煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤中含有硫,燃烧后生成的二氧化硫会造成空气污染.某工厂用煤做燃料,每天燃烧含硫2%的煤4800kg
该厂废气中二氧化硫的含量可根据下列反应测定:so2+2h2o=h2so4+2hi.现取该厂废气样品500ml,用含碘2x10-6次方即(0.0000002%)的碘溶液200g与废气中二氧化硫恰好完全反应,试计算该厂排放的废气是否符符合***规定的工业废气排放标准(废气中二氧化硫的含量不得超过0.15mg/m3)
用煤做燃料,你认为有什么方法可以减少so2对空气的污染?
不要到网上复制啊 这道题与网上的不同,)
会的帮我答一下
so2+2h2o+i2=h2so4+2hi
是这样的 lounge_lu1年前1
lounge_lu1年前1 -
 liuyu683 共回答了24个问题
liuyu683 共回答了24个问题 |采纳率91.7%SO2+2H2O+I2=H2SO4+2HI
64g 254g
x 2x10-6*200
x=1x10-4 g=0.1mg
含量=0.1mg/500ml(即0.5x10-3m3)=200mg/m3
超标
可以将尾气通过碱液后排放1年前查看全部
- (Ⅰ)从海水中可提取各种化工原料.如图是工业上对海水综合利用的示意图如图1.
(Ⅰ)从海水中可提取各种化工原料.如图是工业上对海水综合利用的示意图如图1.

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时需用四种试剂,使上述离子逐一沉淀,加入试剂的顺序是:NaOH溶液→①______→②______→盐酸.
(2)由MgCl2•6H2O晶体脱水制无水MgCl2时,需要控制的条件是______;若对该晶体直接加热,将发生反应的化学方程式为MgCl2•6H2O
Mg(OH)2+2HCl+4H2O△ .MgCl2•6H2O.
Mg(OH)2+2HCl+4H2O△ .
(Ⅱ)A、B、C、D、E、F六种物质的相互转化关系如图2所示(反应条件未标出),其中反应①是置换反应.
(1)若A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是2C+SiO2
Si+2CO高温 .2C+SiO2.
Si+2CO高温 .
(2)若A、D、F都是单质,且A为金属,F为黄绿色气体,则反应②的离子方程式是______. 十二浪子1年前0
十二浪子1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 烃A是一种重要的基本化工原料,用质谱法测得其相对分子质量为28.如图1是以A为原料合成药物中间体E和树脂K的路线.
烃A是一种重要的基本化工原料,用质谱法测得其相对分子质量为28.如图1是以A为原料合成药物中间体E和树脂K的路线.
已知如图2:
(1)A中官能团的结构简式是______.有机物B的名称______.
(2)B→C的化学方程式为______.B和氢氧化钠的水溶液加热反应所得到的有机产物和乙二酸反应生成高分子化合物,写出生成高分子化合物反应的化学方程式______.
(3)E的分子式为C 4 H 8 O.下列关于E的说法正确的是______(填字母序号).
a.能与金属钠反应 b.分子中4个碳原子一定共平面
c.一定条件下,能与浓氢溴酸反应d.与CH 2 =CHCH 2 OCH 2 CH 3 互为同系物
(4)G→H涉及到的反应类型有______.
(5)I的分子式为C 4 H 6 O 2 ,其结构简式为______.
(6)J→K的化学方程式为______.
(7)写出与E具有相同官能团的所有同分异构体的结构简式:______(不考虑顺反异构,不考虑-OH连在双键碳上的结构). qiuqiucat1年前1
qiuqiucat1年前1 -
 我的名字ww来吧 共回答了10个问题
我的名字ww来吧 共回答了10个问题 |采纳率90%烃A的相对分子质量为28,故A应为CH 2 =CH 2 ,与溴发生加成反应生成B,B为BrCH 2 CH 2 Br,在氢氧化钠醇溶液,加热条件下发生消去反应生成C,结合信息Ⅰ可知C为CH 2 =CHBr,D为CH 2 =CHMgBr,E为CH 2 =CHCH 2 CH 2 OH,A和水发生加成反应生成F为CH 3 CH 2 OH,F催化氧化生成G,故G为CH 3 CHO,由信息Ⅱ可知H为CH 3 CH=CHCHO,H催化氧化生成I,I为CH 3 CH=CHCOOH,与甲醇发生酯化反应生成J,故J为CH 3 CH=CHCOOCH 3 ,J发生加聚反应生成高分子化合物K,故K为
,
(1)由以上分析可知A为CH 2 =CH 2 ,有机物B为BrCH 2 CH 2 Br,含有官能团为溴原子,故答案为:CH 2 =CH 2 ;溴原子;
(2)B为BrCH 2 CH 2 Br,C为CH 2 =CHBr,B生成C的方程式为:BrCH 2 CH 2 Br+NaOH
醇
△ CH 2 =CHBr+NaBr+H 2 O,
B和氢氧化钠的水溶液加热反应所得到HOCH 2 CH 2 OH,与乙二酸反应生成高分子化合物的方程式为:
HOCH 2 CH 2 OH+HOOC-COOH
一定条件

+2(n-1)H 2 O,
故答案为:BrCH 2 CH 2 Br+NaOH
醇
△ CH 2 =CHBr+NaBr+H 2 O;HOCH 2 CH 2 OH+HOOC-COOH
一定条件

+2(n-1)H 2 O;
(3)E为CH 2 =CHCH 2 CH 2 OH,含有C=C,能发生加成反应,含有-OH,能与Na发生反应生成氢气,与CH 2 =CHCH 2 OCH 2 CH 3 结构不同,不是同系物,分子中只有3个C原子在同一个平面上,
故答案为:ac;
(4)由信息Ⅱ可知G→H涉及到的反应类型有加成反应、消去反应,故答案为:加成反应、消去反应;
(5)由以上分析可知I为CH 3 CH=CHCOOH,故答案为:CH 3 CH=CHCOOH;
(6)J为CH 3 CH=CHCOOCH 3 ,含有碳碳双键,可发生加聚反应,反应的方程式为
,
故答案为:
;
(7)E为CH 2 =CHCH 2 CH 2 OH,与E具有相同官能团的所有同分异构体为
,
故答案为:
.1年前查看全部
- 海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图: 
(1)请列举海水淡化的两种方法______、______.
(2)步骤Ⅰ中已获得Br 2 ,步骤Ⅱ中又将Br 2 还原为Br - ,其目的是:______.步骤Ⅱ用SO 2 水溶液吸收Br 2 ,吸收率可达95%,有关反应的离子方程式______
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl 2 •6H 2 O的原因______
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是______
A.H 2 B.CO 2 C.空气D.O 2 E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目的______.
(6)上述工艺中可以得到金属Mg,请写出工业上制备金属铝的化学方程式______. ywl011年前1
ywl011年前1 -
 imqun 共回答了23个问题
imqun 共回答了23个问题 |采纳率100%(1)海水淡化的方法有:蒸馏法、电渗析法、离子交换法等,
故答案为:蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种;
(2)步骤Ⅰ中已获得Br 2 ,步骤Ⅱ中又将Br 2 还原为Br - ,是为了富集溴元素,用SO 2 水溶液吸收Br 2 的原理方程式为:
Br 2 +SO 2 +2H 2 O=4H + +SO 4 2- +2Br - ,故答案为:富集溴元素;Br 2 +SO 2 +2H 2 O=4H + +SO 4 2- +2Br - ;
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl 2 水解,且带走MgCl 2 •6H 2 O受热产生的水汽,故能得到无水MgCl 2 ,故答案为:在干燥的HCl气流中,抑制了MgCl 2 水解,且带走MgCl 2 •6H 2 O受热产生的水汽,故能得到无水MgCl 2 ;
(4)能和金属镁发生反应的气体:氮气、氧气、二氧化碳、水,所以可以用氢气做镁蒸气的冷却剂,故选A;
(5)工业上,电解熔融的氧化铝可以获得金属铝,原理方程式为:2Al 2 O 3 (熔融)
电解
.
4Al+3O 2 ↑,故答案为:2Al 2 O 3 (熔融)
电解
.
4Al+3O 2 ↑.1年前查看全部
- 海水中有取之不尽的化 海水中有取之不尽的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源的综合利用的示意图.
海水中有取之不尽的化
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源的综合利用的示意图. 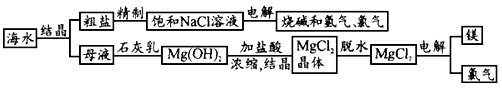
试回答下列问题:
(1)粗盐中含有Ca 2+ 、Mg 2+ 、SO 4 2- 等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl 2 溶液,过量的NaOH溶液和过量的Na 2 CO 3 溶液,最后加入盐酸至溶液呈中性.请写出加入盐酸后可能发生的化学反应的离子方程式为__________________.
(2)海水提取食盐后的母液中含有K + 、Na + 、Mg 2+ 等阳离子.从离子反应的角度思考,在母液里加入石灰乳起什么作用?_______________________________________
(3)海水里的镁元素处于游离态还是化合态?从海水中提取氯化镁的反应是不是氧化还原反应?用电解法冶炼金属镁的反应是不是氧化还原反应?为什么?
____________________________________
(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁.请思考镁蒸气可以在下列哪种气体氛围中冷却___________
A.H 2 B.CO 2 C.空气D.O 2 cyhao25251年前1
cyhao25251年前1 -
 sbhaudio 共回答了19个问题
sbhaudio 共回答了19个问题 |采纳率94.7%(1)OH - +H + =H 2 O、CO 3 2- +2H + =H 2 O+ CO 2 ↑
(2)将Mg 2+ 转化为Mg(OH) 2 沉淀
(3)化合态;不是;是,因为发生了化合价的变化
(4)A1年前查看全部
- (2012•闵行区二模)硫酸铜是一种应用广泛的化工原料.实验室中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使
(2012•闵行区二模)硫酸铜是一种应用广泛的化工原料.实验室中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).

(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3)和______mL蒸馏水.配制所需仪器除烧杯、量筒、胶头滴管外,还需要的仪器有______.
(2)图1中烧瓶中发生的离子反应方程式为______.
(3)图2是图1的改进装置,其优点有:①______;②______.
为符合绿色化学的要求,某研究性学习小组进行了如下设计:
方案1:以空气为氧化剂.将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O晶体.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加Fe2(SO4)3,即发生反应.反应完全后向其中先后加入物质甲、物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用.[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7和6.4.]
(4)方案l中的A仅器名称是______.晶体采用酒精淋洗的优点是______.
(5)方案2中物质甲可以是______(选填答案编号,下同),物质乙可以是______.
a.Cub.CuCO3c.CuOd.氨水e.氯水f.双氧水
取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方法:
方法①:取样于试管→滴加KSCN溶液;方法②:径向层析→喷KSCN溶液
指出你认为不合理的方法及存在的问题______.
(6)用铜粉制硫酸铜,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜粉反应,其化学方程式是2Cu+O2+2H2SO4
2CuSO4+2H2O△ .2Cu+O2+2H2SO4.
2CuSO4+2H2O△ . kjh19821年前1
kjh19821年前1 -
 天堂衣 共回答了23个问题
天堂衣 共回答了23个问题 |采纳率91.3%解题思路:(1)根据配制溶液前后溶质的质量不变计算,浓硫酸配制稀硫酸注意利用玻璃棒不断搅拌;
(2)烧瓶中发生Cu与稀硝酸的氧化还原反应;
(3)图2中中间的装置可防止倒吸,并发生氮的氧化物与水的反应;
(4)由铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜分析;酒精与水互溶,除去晶体中的水并减少晶体溶解;
(5)加入的甲为氧化剂,能氧化亚铁离子;物质乙起调节pH的作用并除杂;确认Fe3+是否除净应注意铜离子的颜色造成的干扰;
(6)在氧气存在时用热稀硫酸与铜粉反应生成硫酸铜,以此书写化学反应方程式.(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3),设需要水xmL,
由配制溶液前后溶质的质量不变,则[100×1.84×98%/100×1.84+x×1]×100%=20%,解得x=717.6,浓硫酸稀释放出大量的热,应利用玻璃棒不断搅拌,
故答案为:717.6;玻璃棒;
(2)烧瓶中发生Cu与稀硝酸的氧化还原反应,离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)由装置比较可知,装置2中多出的装置能①溶液不导管不直接接触,防止倒吸,②NO与氧气及碱反应,使有害气体能被完全吸收,故答案为:防止倒吸;有害气体能被完全吸收;
(4)由铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,则A为坩埚,酒精与水互溶,除去晶体中的水并减少晶体溶解,则晶体采用酒精淋洗的优点是酒精与水互溶且极易挥发,减少晶体溶解,
故答案为:坩埚;酒精与水互溶且极易挥发,减少晶体溶解;
(5)由方案可知,Cu与Fe2(SO4)3反应,应除去亚铁离子,则加入f将亚铁离子氧化为铁离子,再利用bc促进铁离子水解转化为沉淀而除去,确认Fe3+是否除净的方法①中Cu2+的蓝色对检验有干扰,故答案为:f;bc;方法①中Cu2+的蓝色对检验有干扰;
(6)在氧气存在时用热稀硫酸与铜粉反应生成硫酸铜,该化学反应为2Cu+O2+2H2SO4
△
.
2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4
△
.
2CuSO4+2H2O.点评:
本题考点: 制备实验方案的设计;硝酸的化学性质;铜金属及其重要化合物的主要性质;配制一定物质的量浓度的溶液.
考点点评: 本题考查硫酸铜制备实验方案的设计,明确装置的作用及发生的氧化还原反应是解答本题的关键,注意除杂的方法及物质的成分、性质的差异、盐类水解的知识来解答,综合性较强,题目难度较大.1年前查看全部
- (2014•南通)七水硫酸镁(MgSO4•7H2O)是一种重要的化工原料,在48.1℃以下的潮湿空气中稳定,在湿热干燥空
(2014•南通)七水硫酸镁(MgSO4•7H2O)是一种重要的化工原料,在48.1℃以下的潮湿空气中稳定,在湿热干燥空气中易失去结晶水,工业上将白云石(主要成分为MgCO3,CaCO3)碳烧成粉,用于制取MgSO4•7H2O,工艺流程如图所示.

(1)煅烧过程中,MgCO3转化为MgO的基本反应类型是______;
(2)写出MgO与H2SO4反应的化学方程式:______;
(3)操作a的名称为______;
(4)将分离后的母液循环利用的目的是______;
(5)干燥得成品时,需要控制的条件是______. syhk571年前1
syhk571年前1 -
 andy_liuyong 共回答了18个问题
andy_liuyong 共回答了18个问题 |采纳率100%解题思路:根据碳酸镁煅烧反应生成氧化镁和二氧化碳进行解答;
根据碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳进行解答;
根据操作a是过滤操作进行解答;(1)碳酸镁煅烧反应生成氧化镁和二氧化碳,属于分解反应;
(2)碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳,化学方程式为:MgO+H2SO4=MgSO4+H2O;
(3)操作a是过滤操作;
(4)结晶后的母液是MgSO4的饱和溶液,循环利用母液可使原料中的镁元素最大可能地转化到产物中,因此将分离后的母液循环利用的目的是提高原料的利用率;
(5)由于七水硫酸镁在湿热干燥空气中易失去结晶水,因此干燥得成品时,需要控制的条件是温度,以防止七水硫酸镁水解;
故答案为:(1)分解反应;(2)MgO+H2SO4=MgSO4+H2O;(3)过滤;(4)提高原料的利用率;(5)温度.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;酸的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了物质分离的实验设计和方法应用,主要是利用硫酸除去杂质,得到较纯净的MgSO4溶液来制备MgSO4•7H2O晶体,同时考查了物质分离方法,题目难度中等.1年前查看全部
- (10分)硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
(10分)硝酸是一种重要的
 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N 2 和H 2 为原料合成氨气。一定温度下,在密闭容器中充入ImolN 2 和3molH 2 发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N 2 的转化率
,则N 2 的转化率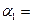 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则
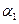 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH 3 +5O 2 4NO+6H 2 O 4NO+3O 2 +2H 2 O=4HNO 3
4NO+6H 2 O 4NO+3O 2 +2H 2 O=4HNO 3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO 2 +Na 2 CO 3 =NaNO 2 +NaNO 3 +CO 2 ,NO+NO 2 +Na 2 CO 3 =2NaNO 2 +CO 2 。若在标准状况下有NO、NO 2 的混合气体(不考虑N 2 O 4 )恰好与50mL 1. 0 mol·L -1 的Na 2 CO 3 溶液反应完全,且生成NaNO 2 和NaNO 3 的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L -1 的Na 2 CO 3 溶液反应完全,且生成NaNO 2 和NaNO 3 的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程) h686421861年前1
h686421861年前1 -
 叫我qq胡 共回答了12个问题
叫我qq胡 共回答了12个问题 |采纳率91.7%(1)12.5%或1/8、>(4分,每空2分)(2)9(3分)
(2)解析:由反应4NH 3 +5O 2 4NO+6H 2 O、4NO+3O 2 +2H 2 O=4HNO 3 得:
4NO+6H 2 O、4NO+3O 2 +2H 2 O=4HNO 3 得:
NH 3 +2O 2 =HNO 3 +H 2 O,3.4吨液氨产生的硝酸为12.6吨,水为3.6吨,则理论上需加水的质量为为:126.t/50%-(12.6+3.6)t=9t
(3)(3分)由反应转化关系知,反应过程中钠元素 守恒,设NaNO 2 和NaNO 3 的物质的量分别为4a mol和a mol,则4a+a=50mL×10 -3 mL·L -1 ×1.0 mol·L -1 ×2,解得:a=0.02 mol,于是,推出NO、NO 2 的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
守恒,设NaNO 2 和NaNO 3 的物质的量分别为4a mol和a mol,则4a+a=50mL×10 -3 mL·L -1 ×1.0 mol·L -1 ×2,解得:a=0.02 mol,于是,推出NO、NO 2 的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
略1年前查看全部
- 海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:
海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:

回答下列问题:
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是______.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为______,与电源负极线连的电极附近溶液pH______(变大、不变、变小).
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO2或NH3,则气体A应是______(填化学式).C的制得发生反应的化学方程式为2NaHCO3
Na2CO3+CO2↑+H2O△ .2NaHCO3.
Na2CO3+CO2↑+H2O△ .
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品
NH4Cl晶体,则通入NH3的作用是______.
(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①______;④______.
b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:______.
c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是______. kathleena05061年前1
kathleena05061年前1 -
 话梅四号 共回答了26个问题
话梅四号 共回答了26个问题 |采纳率88.5%解题思路:(1)①根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
②根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质;
(2)①根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
②根据氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)a、氯气具有氧化性,能将溴离子氧化;单质溴具有氧化性,能将二氧化硫氧化;
b、在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
c、海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩以节约成本.(1)①因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为CBDA或BCDA,故答案为:CBDA或BCDA;
②电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程:2Cl--2e-=Cl2↑;阴极是氢离子得电子生成氢气的过程为2H++2e-=H2↑,在该极附近氢离子减少,氢氧根浓度增加,所以大量的氢氧化钠在阴极出现,溶液的PH增大,故答案为:2Cl--2e-=Cl2↑;变大;
(2)①向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱.上述反应的化学方程式分别为NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
△
.
Na2CO3+CO2↑+H2O,故答案为:NH3;2NaHCO3
△
.
Na2CO3+CO2↑+H2O;
②氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,
故答案为:氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)a、氯气具有氧化性,能将溴离子氧化成单质溴:2Br-+Cl2=2Cl-+Br2,故答案为:2Br-+Cl2=2Cl-+Br2;
单质溴具有氧化性,能将二氧化硫氧化成硫酸:SO2+Br2+2H2O=2HBr+H2SO4,故答案为:SO2+Br2+2H2O=2HBr+H2SO4;
b、在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
c、海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,故答案为:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.点评:
本题考点: 海水资源及其综合利用;纯碱工业(侯氏制碱法);电解原理;氯、溴、碘及其化合物的综合应用;粗盐提纯.
考点点评: 本题主要考查了粗盐的提纯、候氏制碱、海水提溴的原理,难度不大,根据课本知识即可完成.1年前查看全部
- 怎么才花费最少?某实验室需购某种化工原料150千克,现在市场上原料按袋出售,有两种包装,一种是每袋45千克,价格为280
怎么才花费最少?
某实验室需购某种化工原料150千克,现在市场上原料按袋出售,有两种包装,一种是每袋45千克,价格为280元;另一种是每袋36千克,价格为240元,在满足需要的条件下,最少要花费多少元?(答案是1000元)
怎么求出来的? shulun04281年前1
shulun04281年前1 -
 关东项羽 共回答了23个问题
关东项羽 共回答了23个问题 |采纳率82.6%第一种x袋,第二种y袋
则需满足45x+36y>=150
求花费S=280x+240y最小值
这里利用的方法是 线性规划分析
通过作图,平移,就可以得出合适的整数点.课本上有这个内容吧
这里只有x=1,y=3满足条件.1年前查看全部
- 怎样把水调成比重1.5的液体,用什么化工原料,要求安全、廉价.
 一起去游泳1年前1
一起去游泳1年前1 -
 极速怪天使0 共回答了17个问题
极速怪天使0 共回答了17个问题 |采纳率100%加可溶性盐,比如氯化钠,氯化钙等.1年前查看全部
- 氨是重要的化工原料,实验室制取氨气的化学方程式为?这套卷子是?
 zzq5841年前1
zzq5841年前1 -
 fba365 共回答了15个问题
fba365 共回答了15个问题 |采纳率73.3%氯气 制取原理——强氧化剂氧化含氧化合物 制取方程式——MnO2 4HCl(浓)MnCl2 Cl2↑ 2H2O 装置——分液漏斗,圆底烧瓶,加热 检验——能使湿润的蓝色石蕊试纸先变红后褪色; 除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气) 收集——排饱和食盐水法或向上排气法 尾气回收——Cl2 2NaOH=== NaCl NaClO H2O1年前查看全部
大家在问
- 1用上“举世闻名、诗情画意、亭台楼阁”写几句话
- 2一个数的最高位是千万位,这个数是一个______位数,若这个数千万位上是6,百万位上是7,万位上是5,百位上是3,十位上
- 3学英语最容易被忽略的秘密.在星火英语中常常在单词后面看到这样的解释 例如 lable (A),有的后面是(L)或(I)分
- 4直线红灯左转弯会拍吗?当时晚上下着大雨路面看不清楚路灯都没,开错道了,我是跟着左转弯的车一起过去的.看到对面有4个探头,
- 5下列不属于消费者市场细分中人文因素的是( )
- 6李老师从油条的制作受到启发,在数轴上截取从原点到1的对应点的线段 ,对折后(点A 与 B重合)再均匀地拉成1个单位长度的
- 7河中石兽原文及翻译少一点
- 8黑洞的引力对周围行星的分布有没有一定影响?为什么?
- 9如图,已知球O是棱长为1 的正方体ABCD-A 1 B 1 C 1 D 1 的内切球,则平面ACD 1 截球o的截面面积
- 10有文采的人啊,造几个排比句:幸福是什么?【幸福是···】【要求,有点诗情画意】
- 11若AB 是圆O内接正五边形的一边 AC是圆O内接正六边形的一边,则角BAC=?我知道答案是6°或114°
- 12英语作文在线点评修改一下我的作文:My dream lifein the future ,i will be very
- 13我看书上说极限在自变量趋向过程中趋向某个点,它就不能取那个点,我想问一下如果取到了会怎么样是判断该极限不存在吗,比如当x
- 14王红同学因为学习成绩不理想近来总是情绪低落,老师同学发现后,主动关心她,与她谈心,帮助她补习功课。渐渐地,她的脸上又露出
- 15扁鹊治病 取材于()时期名医扁鹊的传说故事.故事以()的悲惨结局,警示人们要(





