sp,sp2,sp3杂化轨道,谁夹角最大?
 haozittt2022-10-04 11:39:541条回答
haozittt2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 luwarrior 共回答了14个问题
luwarrior 共回答了14个问题 |采纳率78.6%- sp,sp2,sp3杂化轨道中sp键脚最大180 度
sp2为120度
sp3为108度多少分 - 1年前
相关推荐
- 下列叙述不正确的是( )A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构B.分子中中心原子通过s
下列叙述不正确的是( )
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形
C.杂化轨道理论与价层电子互斥理论都可以分析分子的空间构型
D.四面体型结构的分子一定是非极性分子 澄澈的蓝1年前1
澄澈的蓝1年前1 -
 dony_fan 共回答了18个问题
dony_fan 共回答了18个问题 |采纳率94.4%解题思路:A、若中心原子存在孤电子对时,该分子就不是正四面体;
B、若中心原子存在孤电子对时,该分子就不是平面三角形;
C、杂化轨道理论与价层电子互斥理论均用于分析判断分子的空间构型,且两种理论相互补充;
D、正四面体构型的对称型分子属于非极性分子,偏四面体性的分子为极性分子.A、分子中中心原子通过sp3杂化轨道成键时,说明中心原子的价层电子对数为4,若中心原子存在孤电子对,该分子就不是正四面体,如氨气分子、水分子等,故A正确;
B、分子中中心原子通过sp2杂化轨道成键时,说明中心原子的价层电子对数为3,若中心原子存在孤电子对,该分子就不是平面三角形,如SO2等,故B正确;
C、杂化轨道理论与价层电子互斥理论均用于分析判断分子的空间构型,且两种理论相互补充,故C正确;
D、正四面体构型的对称型分子属于非极性分子,偏四面体性的分子为极性分子,如一氯甲烷等,故D错误;
故选:D.点评:
本题考点: 原子轨道杂化方式及杂化类型判断;极性分子和非极性分子.
考点点评: 本题考查价层电子对互斥理论和杂化轨道理论,难度不大,两种理论均用于分析分子的空间构型,掌握两种理论的精髓和特殊例子是解题的关键.1年前查看全部
- 怎么判断SP几杂化?SiO2为什么SP3杂化?
 蓝海欣琳1年前2
蓝海欣琳1年前2 -
 竹隐林音 共回答了17个问题
竹隐林音 共回答了17个问题 |采纳率82.4%二氧化硅是空间立体结构,是由硅原子和氧原子间隔构成的立方体,每个硅原子实际是连接四个氧原子,但由于空间结构,化简后为一个硅原子对应两个氧原子.正四面体结构的杂化为sp3杂化.
sp杂化:直线形 如:CO2、CS2
sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3、
sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl41年前查看全部
- 无机化学中sp3杂化是什么?有那些物质?
 早晨的雨水1年前3
早晨的雨水1年前3 -
 静静的等你回来 共回答了16个问题
静静的等你回来 共回答了16个问题 |采纳率100%一个s轨道和三个p轨道杂化成四个sp3杂化轨道.以甲烷为例:基态C原子中已配对的2s电子拆开,其中1个电子跑到能量稍高的2p轨道中(Pz空轨道)去,这一过程叫电子跃迁;接着进行杂化,一个2S轨道和3个2P轨道杂化,生成4个能量相等的sp3杂化轨道.因为是平均混合,每个sp3杂化轨道含有1/4s和3/4的p轨道的成份,其中各有1个成单电子.最后这4个电子再与4个H原子中的1s电子配对成σ(西格玛)键,从而形成CH4.
sp3杂化例子
CH4 CCl4、(正四面体)、NH4+.NH3(三角锥型)、H2O(V型)等也是sp3杂化,只不过是sp3不等形杂化.1年前查看全部
- 在等性sp3杂化轨道中s成分占
 角落的风铃1年前2
角落的风铃1年前2 -
 chaooliver 共回答了14个问题
chaooliver 共回答了14个问题 |采纳率92.9%一共四条轨道参与杂化,其中一条当然占四分之一了1年前查看全部
- H2O2为什么O原子采取sp3杂化,
 左三1年前1
左三1年前1 -
 yeyu7200 共回答了21个问题
yeyu7200 共回答了21个问题 |采纳率85.7%原子杂化轨道数=δ键数+孤对电子对数=2+2=4
所以是sp3杂化1年前查看全部
- 氮杂化轨道问题问题一:NH3分子中,据说N是SP3杂化,那么我有问题了既然是sp3杂化,那么势必就会有4个sp杂化轨道,
氮杂化轨道问题
问题一:NH3分子中,据说N是SP3杂化,那么我有问题了既然是sp3杂化,那么势必就会有4个sp杂化轨道,和1个P轨道,其中有三个sp轨道电子与氢原子形成sita键,难道余下的一个sp轨道电子莫名其妙地就与p轨道的电子在一起,形成了成对的电子?
问题二:HCN中C是sp杂化,那么势必会有两个p轨道电子要形成两个π键,按此推理来N也要有两个p轨道的电子,那么难道N是sp2杂化?其中一个杂化轨道电子与C形成sita键,难道剩下的两个个杂化轨道电子又莫名其妙地在一起了?
求解释!追加分 淡月黄昏1年前2
淡月黄昏1年前2 -
 vitaminlu 共回答了21个问题
vitaminlu 共回答了21个问题 |采纳率81%1)1个s + 3个p=四个sp3杂化轨道.已经是sp3杂化了,三个p轨道都被用于杂化了,哪儿还有一个P轨道呀?NH3分子中,N是SP3杂化.其中三个sp3杂化轨道形成三个N-H键,还有一个sp3杂化轨道含孤对电子.
2) 在多原子分子中,杂化轨道的概念是用来描述非过渡金属元素中心原子的电子对(成sigma键电子对和孤对电子对)分布的几何形状.sp:线性;sp2:平面三角;sp3:正四面体;sp3d(dsp3):三角双锥;sp3d2(d2sp3):正八面体.
所以,没有必要将杂化的概念用于外围原子.HCN中C是sp杂化,线性分子.外围原子氮,除与C形成sigma键,还与其形成两个相互垂直的pi键.三个共价键用掉了N的三个电子.剩下的一对电子为N上的孤对电子.1年前查看全部
- 原子轨道杂化后,各杂化轨道的形状咋样?比如SP3杂化等
 接罩1年前1
接罩1年前1 -
 叶好龙公 共回答了18个问题
叶好龙公 共回答了18个问题 |采纳率88.9%s轨道杂化是头碰头,p轨道杂化是肩并肩.一般说分子空间构型是直线型,该物质中心原子sp杂化;平面型,sp2杂化;四面体型,sp3杂化.其实蛮简单的,高考的时候考的很少,知道常见几个就可以.H2O、NH3,sp3杂化.1年前查看全部
- sp3与sp3杂化方式的中心原子间为什么不可能形成π键呢?
 蓝色纸轩1年前3
蓝色纸轩1年前3 -
 陈书贤620 共回答了17个问题
陈书贤620 共回答了17个问题 |采纳率82.4%以碳为例,sp3杂化是最高的杂化类型,没有剩余的p轨道和p电子去形成兀键.
(A)中有两对p轨道,因此可以形成两套相互垂直的兀键,(B)中可以形成一对兀键.
上面的“兀”表示派键,因为电脑上打不出来,而他的字形比较相像.
希望对你有所帮助!1年前查看全部
- 在任何情况下,每一个sp3杂化轨道所含的sp 成分都相同吗
 vivienkotomi1年前1
vivienkotomi1年前1 -
 米米猪19850318 共回答了27个问题
米米猪19850318 共回答了27个问题 |采纳率88.9%亲,要看中心原子或离子的独对电子数;按照这个电子对数取:s p d的轨道,轨道数=电子对数.希望我的回答对你有所帮助,1年前查看全部
- 下列说法正确的是( )A.凡是中心原子采取sp3杂化的分子,其立体构形都是正四面体B.CH4分子中的sp3杂化轨道是由
下列说法正确的是( )
A.凡是中心原子采取sp3杂化的分子,其立体构形都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 fimmy1年前1
fimmy1年前1 -
 珊月儿 共回答了21个问题
珊月儿 共回答了21个问题 |采纳率81%解题思路:A、如果中心原子无孤电子对采取sp3杂化的分子,其立体构形都是正四面体;
B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的sp3杂化轨道形成4个σ键;
C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对;
D、凡AB3型的共价化合物,其中心原子周围有一对孤电子对A均采用sp3杂化轨道成键.A、如果中心原子无孤电子对采取sp3杂化的分子,其立体构形都是正四面体,故A错误;
B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的sp3杂化轨道形成4个σ键,故B错误;
C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对,故C正确;
D、凡AB3型的共价化合物,其中心原子周围有一对孤电子对A均采用sp3杂化轨道成键,故D错误;
故选C.点评:
本题考点: 原子轨道杂化方式及杂化类型判断;判断简单分子或离子的构型.
考点点评: 本题考查了原子杂化类型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数=[1/2](a-xb)中各个字母的含义,难度中等.1年前查看全部
- 配合物中,中心离子的杂化轨道类型属内轨型是sp3杂化吗
 地瓜呀地瓜1年前2
地瓜呀地瓜1年前2 -
 kejun2006 共回答了25个问题
kejun2006 共回答了25个问题 |采纳率84%内轨型杂化参与的轨道除了外层轨道外还有内层轨道,所以称为内轨型杂化,如d2sp3杂化(其中s、p的主量子数是n,d的主量子数是n-1).
外轨型杂化参与的都是外层轨道,内层轨道不参与,如sp3、sp3d2等.
所以sp3杂化不是内轨型的杂化.1年前查看全部
- 下列说法中正确的是( )A.在PCl5分子中,磷分子满足最外层8电子结构B.凡中心原子采取sp3杂化的分子中,其分子几
下列说法中正确的是( )
A.在PCl5分子中,磷分子满足最外层8电子结构
B.凡中心原子采取sp3杂化的分子中,其分子几何构型都是四面体
C.在NaCl晶体中,每个Na+的周围有6个Cl-
D.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道. 辣蛤蜊1年前1
辣蛤蜊1年前1 -
 残留馨香 共回答了17个问题
残留馨香 共回答了17个问题 |采纳率100%解题思路:A.对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构;
B.中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但分子构型不一定是正四面体;
C.根据晶胞确定氯化钠的配位数;
D.sp3杂化是指一个原子同一电子层内由一个ns轨道和三个np轨道发生杂化的过程.A.PCl5中P元素化合价为+5价,P原子最外层电子数是5+5=10,则P原子不满足8电子结构,故A错误;
B.中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但分子构型不一定是正四面体,如水和氨气分子中心原子都采取sp3杂化,但H2O是V形,NH3是三角锥型,故B错误;
C.晶体中每个Na+同时吸引着 6个Cl-,每个Cl-同时吸引着6个Na+,故C正确;
D.sp3杂化轨道是由同一电子层内的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道,故D错误;
故选C.点评:
本题考点: 原子核外电子排布;原子轨道杂化方式及杂化类型判断;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题主要考查了8电子结构的判断、杂化类型与分子构型的关系、晶胞的结构以及杂化轨道的定义,难度不大,注意知识的运用.1年前查看全部
- 怎样计算SP3杂化时的键角?咋算出109.
 醋点灯000121年前2
醋点灯000121年前2 -
 西罗 共回答了22个问题
西罗 共回答了22个问题 |采纳率90.9%这个记住就好了,不用了解计算过程.计算是立体几何问题,挺复杂,可以用向量求解,考虑用球坐标系可能会比较方便.问问你们数学老师更好1年前查看全部
- 关于H2O分子轨道杂化问题.书上写把CH4,NH3,H2O一起在sp3杂化那一起说明.CH4sp3杂化的原因我能理解,但
关于H2O分子轨道杂化问题.
书上写把CH4,NH3,H2O一起在sp3杂化那一起说明.CH4sp3杂化的原因我能理解,但是NH3,H2O理解不来 氧原子不是有两个含单电子的2p轨道吗,为什么不能直接和两个氢离子行成共价键,而是要先sp3杂化呢?还有关于大Л键,谁能以CO2为例,要不只回答第一个问题也行 灌uu1年前2
灌uu1年前2 -
 如风蝶 共回答了13个问题
如风蝶 共回答了13个问题 |采纳率92.3%因为NH3,N外有5个电子,3个与H的电子各自配对,剩下的2个自成一对,所以需要4个轨道,所以SP3杂化 同理H2O,O外有6个电子,2个与H的电子各自配对,剩下的4个分别配成两对,所以需要4个轨道,所以SP3杂化 SP3杂化原因是原子核外电子的斥力,由于产生共价键后,O外有4对电子,每对电子共占一个轨道 且能量相当,而原有的SP3轨道是S轨道能量比P轨道能量少,要形成4个能量相当的轨道,就将4个轨道揉在一起形成SP3杂化,由于电子都带负电,相互排斥,所以形成了轨道是4面体型,但具体电子对有的是跟H公用的,有的是孤电子对,所以能量也有点差别,所以形成的四面体不是正四面体 关于π键,是因为C跟每个O都共用2对电子,就是说形成双键,而双键是一个σ键一个π键,σ键就相当于与孤电子对能量相当的单键,所以与C剩下的2对没公用的电子轨道揉成了SP2杂化的3个轨道,剩下的1个P轨道就形成肩并肩式的π键,因为S能量比P要低,所以杂化之后SP2杂化轨道能量比P轨道能量低,所以σ键比π键更稳定1年前查看全部
- h2o sp3杂化后2p轨道还存在吗?原有的一对2p轨道上的成对电子和未与h原...
h2o sp3杂化后2p轨道还存在吗?原有的一对2p轨道上的成对电子和未与h原...
h2o sp3杂化后2p轨道还存在吗?
原有的一对2p轨道上的成对电子和未与h原子成键的2p电子是否是在sp3杂化轨道上运动? 娃哈哈mbs1年前1
娃哈哈mbs1年前1 -
 两只小乌龟走了 共回答了22个问题
两只小乌龟走了 共回答了22个问题 |采纳率95.5%O的2S2P轨道都参与杂化,所以不存在2P轨道,只有sp3杂化轨道了,但是四个杂化后的轨道能量并不相同,因为有两个轨道是单电子,两个轨道是成对电子,两个轨道的单电子与2个氢原子的单电子分别形成西格玛键.未成键的2P电子仍然在sp3轨道上运动,但是电子云伸展方向和原来有所不同.1年前查看全部
- 稀有气体最外层电子的排布是SP3杂化吗
 3058911年前3
3058911年前3 -
 roohi 共回答了11个问题
roohi 共回答了11个问题 |采纳率90.9%除了和氧化合的可能是sp3外,其它一般都不是sp3
比如 XeO3 中Xe sp3
XeF2 sp3d XeF4 sp3d2 XeF6 sp3d31年前查看全部
- 高中化学中有哪些常见的分子轨道是sp、sp2、sp3杂化?请列举出来
 蜀鸟吴花残照里1年前1
蜀鸟吴花残照里1年前1 -
 bye04 共回答了13个问题
bye04 共回答了13个问题 |采纳率84.6%sp杂化: CO2, BeCl2 , CH三CH,sp2, SO2, BF3 , CH2=CH2 , C6H6 (苯), sp3杂化 : CH4,CF4,CCl4 SiF4 , NH3 ,H2O , H2S, PH3,1年前查看全部
- 碳原子的sp3杂化与甲烷的空间结构是什么?
碳原子的sp3杂化与甲烷的空间结构是什么?
sp3杂化轨道是什么样子的? 擎天柱vs威震天1年前1
擎天柱vs威震天1年前1 -
 寇老西儿 共回答了26个问题
寇老西儿 共回答了26个问题 |采纳率84.6%sp3杂化轨道是 正四面体,四个角度完全相同.
甲烷的空间结构是 正四面体1年前查看全部
- 下列说法中正确的是( )A. 乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键B. sp3杂化轨道是由任意的1个
下列说法中正确的是( )
A. 乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键
B. sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C. 凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形
D. 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 lililove1年前1
lililove1年前1 -
 fpfpjr209 共回答了12个问题
fpfpjr209 共回答了12个问题 |采纳率100%解题思路:A.碳碳三键中含有一个σ键和两个π键,每个碳原子含有2个σ键且不含孤电子对,每个碳原子都有两个未杂化的2p轨道肩并肩重叠形成两个π键;
B.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道为杂化轨道;
C.根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数,n=3,sp2杂化,不含孤电子对其分子构型都是平面三角形,否则不是;
D.根据价层电子对互斥理论确定其杂化方式,如果价层电子对为2,则中心原子以sp杂化轨道成键,AB2型的共价化合物,其中心原子A不一定采用sp杂化轨道成键;A.乙炔分子的结构式H-C≡C-H,中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+[1/2]×(4-2×2)=2,采取sp杂化,每个碳原子都有两个未杂化的2p轨道形成π键,故A正确;
B.sp3杂化轨道是指同一电子层内,1个s轨道和3个p轨道杂化,形成能量相等的四个sp3杂化轨道,故B错误;
C.中心原子采取sp2杂化的分子,n=3,sp2杂化,不含孤电子对其分子构型都是平面三角形,否则不是,如二氧化硫分子中,价层电子对数=2+
1
2×(6-2×2)=3,所以采取sp2杂化,含有一对孤电子对,所以立体构型为V型,故C错误;
D.AB2型的共价化合物,其中心原子A价层电子对为2,则中心原子以sp杂化轨道成键,如氯化铍分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,AB2型的共价化合物,也有不采用sp杂化轨道成键,如二氧化硫分子中,价层电子对数=2+
1
2×(6-2×2)=3,所以采取sp2杂化,故D错误;
故选A.点评:
本题考点: 原子轨道杂化方式及杂化类型判断;判断简单分子或离子的构型.
考点点评: 本题考查了杂化轨道、分子空间结构等,题目难度中等,注意把握杂化轨道理论的应用,注意判断中心原子的价层电子对以及孤对电子数的判断.1年前查看全部
- 分子中中心原子通过sp3杂化轨道成键时 该分子不一定是四面体结构 这句话是对的吗 老师说是对的 可是我觉得该分子不一定是
分子中中心原子通过sp3杂化轨道成键时 该分子不一定是四面体结构 这句话是对的吗 老师说是对的 可是我觉得该分子不一定是正四面体结构 但一定是四面体结构啊
 王逸铃1年前1
王逸铃1年前1 -
 adidas810022 共回答了21个问题
adidas810022 共回答了21个问题 |采纳率85.7%老师说的对.
也不一定是四面体,比如水,是SP3杂化,但它只有三个原子,只能形成一个角度.
NH3也是sp3杂化,但它是一个三角锥形
根据杂化判定结构,需要知道它是否是等性杂化以及原子个数等1年前查看全部
- 为什么他们具有芳香性呢? 第一个pi电子是8个.不符合4n+2 第二个明显右面是sp3杂化呀.?求
为什么他们具有芳香性呢? 第一个pi电子是8个.不符合4n+2 第二个明显右面是sp3杂化呀.?求
为什么他们具有芳香性呢?
第一个pi电子是8个.不符合4n+2
第二个明显右面是sp3杂化呀.?求大神解答
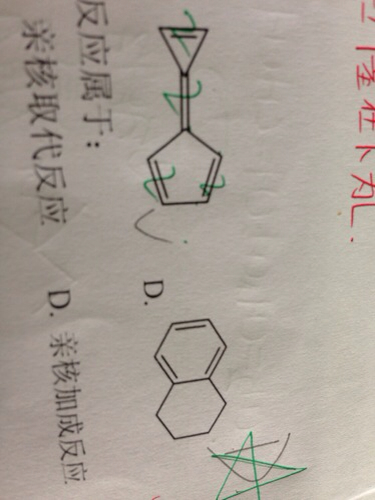
 starcfar5201年前1
starcfar5201年前1 -
 掰开 共回答了16个问题
掰开 共回答了16个问题 |采纳率87.5%休克尔规则是对单环而言的,对于多环类化合物,要一个单环一个单环来看,一个体系只要有一个部分有芳香性,这个分子就有方向性.1年前查看全部
- CHCl3分子中碳原子是不是以不等性sp3杂化的?
 cara42981年前1
cara42981年前1 -
 tctga 共回答了14个问题
tctga 共回答了14个问题 |采纳率85.7%原则上,只要形成的化学键不一样,就是不等性杂化.
所以氯仿中的C可以看成不等性杂化.1年前查看全部
- 高手请用电子轨道排布的角度解释一下硫酸根离子的SP3杂化...3Q
高手请用电子轨道排布的角度解释一下硫酸根离子的SP3杂化...3Q
RT 波索夫乙1年前1
波索夫乙1年前1 -
 月辉银洒 共回答了11个问题
月辉银洒 共回答了11个问题 |采纳率90.9%硫的四个孤电子与氧分别形成两个单键和两个双键,双键中包含一个单键,故有四个单键,需要sp3杂化成四个相同的化学键
记得采纳啊1年前查看全部
- 为什么在硝基正离子进攻苯环生成中间体碳正离子sp2杂化会变为sp3杂化
为什么在硝基正离子进攻苯环生成中间体碳正离子sp2杂化会变为sp3杂化
有机化学硝化反应 Rern1年前1
Rern1年前1 -
 彳亍孑孓 共回答了17个问题
彳亍孑孓 共回答了17个问题 |采纳率94.1%碳原子上连接4个基团:苯环上两个相邻的碳,H,NO2+,所以是sp3杂化.1年前查看全部
- SOCl2中S原子的轨道即使SP3杂化以后.S的电子构型也不允许它接三个原子啊!好奇怪啊!
 icq_wyq1年前2
icq_wyq1年前2 -
 momojeff 共回答了20个问题
momojeff 共回答了20个问题 |采纳率80%氯化亚砜分子可认为是亚硫酸分子中两个羟基被氯原子取代,中心硫原子上还有一孤电子对,是sp3杂化,由于有两种σ键和孤电子对,因此是不等性的杂化,去掉孤电子对看分子构型是三角锥形的.
sp3杂化
S原子sp3杂化有三种情况:
(1) 生成2个σ键,2对孤电子对,分子构型为V形.S的氧化数为+2或-2.例如H2S、SCl2.
(2) 生成3个σ键,1个π键,1对孤电子对,分子构型为三角锥形,S的氧化数为+4,例如SOCl2.
在氯化亚硫酰SOCl2分子中,S的1对p成对电子拆开,跃迁到3d轨道中去,S与2个Cl、1个O,除生成3个σ键外,跃迁到3d轨道上去的这个电子与O的1个成单电子形成π键,所以S=O键之间是双键.
(3) 生成4个σ键,2个π键,分子构型为四面体形,S的氧化数为+6,例如SO42-、SO2Cl2.1年前查看全部
- H2O是进行SP3杂化,应该是四面体形状的,怎么水分子是V的?
 figodai1年前3
figodai1年前3 -
 kuanglian8 共回答了27个问题
kuanglian8 共回答了27个问题 |采纳率85.2%这是因为4个sp3杂化轨道只有2个sp3轨道形成了键,其它两个轨道是孤电子对,没有成键,因此分子就是 V字型的,总共3原子 要么直线,要么V字型不可能是四面体,四面体要5个原子.(其中一个中心原子)1年前查看全部
- 为什么在H2o分子中o原子采用sp3杂化
 yumaoning1年前1
yumaoning1年前1 -
 乌鸦酒店 共回答了22个问题
乌鸦酒店 共回答了22个问题 |采纳率81.8%根据价层电子对互斥理论,四对电子相互排斥成四面体结构,可见四个轨道都参与了杂化,所以是sp3杂化1年前查看全部
- p元素的成键问题p的价电子层有5个电子,其中2s上的两个已经配对,怎么sp3杂化时会出现4个σ键(PH4+),而且没有孤
p元素的成键问题
p的价电子层有5个电子,其中2s上的两个已经配对,怎么sp3杂化时会出现4个σ键(PH4+),而且没有孤对电子,孤对电子哪去了? qqfull1年前2
qqfull1年前2 -
 和鱼在一起 共回答了11个问题
和鱼在一起 共回答了11个问题 |采纳率90.9%一对孤对电子就是P与H+离子之间公用,就是配位键.1年前查看全部
- 水的sp3杂化氧为什么要sp3杂化再和氢结合 不杂化为什么不能结合 氧的两个2p轨道不是正缺两电子吗 干吗非得激发
 乐天tx1年前2
乐天tx1年前2 -
 小乖乖爱大乖乖 共回答了17个问题
小乖乖爱大乖乖 共回答了17个问题 |采纳率82.4%很多理论是为了解释客观事实.
水的结构中,角度是104度30分,而不是90度,说明用于成键的O原子的p轨道不是原来的p轨道,发了变化.
s轨道是球形的,p轨道是纺锤形的,s与p杂化后的轨道形状介于两者之间,一头大,一头小,成键时用大头去发生电子云重叠,也便于电子云的更大程度的重叠,形成更稳定的化学键.
总之,杂化后的轨道,能量介于原来之间,形状介于原来之间,但都是为了更大程度去发生电子云重叠,形成更稳定的共价键.1年前查看全部
- 过氧化氢中 氧不是sp3杂化么 为何连接氢的地方是离子键?
 风爆1年前1
风爆1年前1 -
 wuwelxiang 共回答了23个问题
wuwelxiang 共回答了23个问题 |采纳率100%过氧化氢是共价化合物,没有离子键1年前查看全部
- 为什么吡啶比苯胺碱性要强?这两个N上都是给电子共轭,我知道吡啶上的N是SP2 杂化,而苯胺上的N是SP3杂化,可是,为什
为什么吡啶比苯胺碱性要强?
这两个N上都是给电子共轭,我知道吡啶上的N是SP2 杂化,而苯胺上的N是SP3杂化,可是,为什么SP3杂化的苯胺比SP2杂化的吡啶碱性要弱呢? dnvdx1年前1
dnvdx1年前1 -
 玩波的波都打爆你 共回答了23个问题
玩波的波都打爆你 共回答了23个问题 |采纳率82.6%大概是因为sp2杂化的吡啶里N原子留下的未成键电子多吧,路易斯碱就是给电子的能力强,吡啶的N可能给一个电子的能力不如苯胺,但是它能给出3个,苯胺只剩1个未成键电子可给出.不知这样回答您懂没1年前查看全部
- 碳原子没有参加反应 单个碳原子有sp3杂化轨道吗
 rain98761年前1
rain98761年前1 -
 morsommao 共回答了17个问题
morsommao 共回答了17个问题 |采纳率88.2%单个碳原子没有sp3杂化轨道,只有在形成化合物时,才有SP3杂化轨道参与成键.1年前查看全部
- 举例说明B原子用SP3杂化轨道形成三个西伽马键和一个配位键,并对结构...
举例说明B原子用SP3杂化轨道形成三个西伽马键和一个配位键,并对结构...
举例说明B原子用SP3杂化轨道形成三个西伽马键和一个配位键,并对结构式给予说明? 尘烟2000001年前2
尘烟2000001年前2 -
 吴嘉淇 共回答了20个问题
吴嘉淇 共回答了20个问题 |采纳率90%比如氟硼酸HBF4,其酸根离子就是采取sp3杂化.BF3为缺电子化合物,B最外层有3个价电子,跟3个F连接采取sp2杂化,剩馀一个空的P轨道可以接受F-提供的电子对而变成sp3杂化.其中有3个B-F键是原来的Σ键,第四个为F→B配位键.1年前查看全部
- 怎么判断分子杂化轨道类型就是怎么看它是sp还是sp2或者sp3杂化
 最后一个末班车1年前3
最后一个末班车1年前3 -
 流泪的树枝 共回答了15个问题
流泪的树枝 共回答了15个问题 |采纳率100%1.杂化 杂化轨道
杂化是指在形成分子时,由于原子的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道.这种轨道重新组合的过程叫杂化,所形成的新轨道就称为杂化轨道.
2.
杂化轨道理论认为在形成分子时,通常存在激发、杂化和轨道重叠等过程.如CH4分子的形成过程:碳原子2s轨道中1个电子吸收能量跃迁到2p空轨道上,这个过程称为激发,但此时各个轨道的能量并不完全相同,于是1个2s轨道和3个2p轨道“混合”起来,形成能量相等、成分相同的4个sp3杂化轨道.然后4个sp3杂化轨道上的电子间相互排斥,使四个杂化轨道指向空间距离最远的正四面体的四个顶点,碳原子的4个sp3杂化轨道分别与4个H原子的1s轨道形成4个相同的σ键,从而形成CH4分子.由于四个C-H键完全相同,所以形成的CH4分子为正四面体,键角10928'.
3.杂化轨道的类型
⑴sp杂化 sp杂化轨道是由一个ns轨道和一个np轨道组合而成的.sp杂化轨道间的夹角使180,呈直线形.例如,气态的BeCl2分子的结构.Be原子的电子层结构是1s22s2,从表面上看Be原子似乎不能形成共价键,但是激发状态下,Be的一个2s电子可以进入2p轨道,经过杂化形成两个sp杂化轨道,与氯原子的3p轨道重叠形成两个sp-pσ键.由于杂化轨道间的夹角为180,所以形成的BeCl2分子的空间构型是直线形的.
⑵sp2杂化 sp2杂化是由一个ns轨道和两个np轨道组合而成的.sp2杂化轨道间的夹角使120,呈平面三角形.例如BF3分子的结构.B原子的电子层结构是1s22s22px1,当硼原子与氟原子反应时,硼原子的一个2s电子激发到一个空的2p轨道中,使B原子的电子层结构是1s22s22px12py1.硼原子的2s轨道和两个2p轨道杂化组合成三个sp2杂化轨道,硼原子的三个sp2杂化轨道分别与三个氟原子的各一个2p轨道重叠形成三个sp2-p的σ键,由于三个sp2杂化轨道在同一个平面而且杂化轨道间的夹角为120,所以BF3分子具有平面三角形结构.
⑶sp3杂化 sp3杂化是由一个ns轨道和三个np轨道组合而成的.Sp3杂化轨道间的夹角是10928',呈正四面体结构.例如CH4分子的结构.C原子的电子层结构是1s22s22px12py1.碳原子的一个2s电子激发到一个空的2p轨道中,使碳原子的电子层结构是1s22s22px12py12pz1.碳原子的2s轨道和三个2p轨道杂化组合成四个sp3杂化轨道,碳原子的四个sp3杂化轨道分别与4个H原子的1s轨道形成4个相同的σ键,从而形成CH4分子.所以形成的CH4分子为正四面体,键角10928'.答案补充 杂化后的轨道如果能量相同、成分和形状完全相同,仅空间方位不同,这样的杂化方式是等性杂化.反之为不等性杂化.判断是否为等性杂化基本上可以简单地根据杂化后的轨道与其他原子的连接情况确定.例如NH4+中的N原子采取sp3杂化轨道,连接4个H原子,完全相同,为等性杂化,每个轨道所含有的sp成分相同.H3O+中有孤队电子占据一个空轨道,所以其杂化方式为不等性的sp3杂化.1年前查看全部
- NH3分子中,据说N是SP3杂化,那么我有问题了既然是sp3杂化,那么势必就会有4个sp杂化轨道,和1个P轨道,其中有三
NH3分子中,据说N是SP3杂化,那么我有问题了既然是sp3杂化,那么势必就会有4个sp杂化轨道,和1个P轨道,其中有三个sp轨道电子与氢原子形成sita键,难道余下的一个sp轨道电子莫名其妙地就与p轨道的电子在一起,形成了成对的电子?
HCN中C是sp杂化,那么势必会有两个p轨道电子要形成两个π键,按此推理来N也要有两个p轨道的电子,那么难道N是sp2杂化?其中一个杂化轨道电子与C形成sita键,难道剩下的两个个杂化轨道电子又莫名其妙地在一起了?
上面说错了 不是sita键 是sigma键 树上的石头1年前4
树上的石头1年前4 -
 凤凰东南飞 共回答了13个问题
凤凰东南飞 共回答了13个问题 |采纳率100%问题1:N原子的最外层轨道电子分布是2s22p3(即2s轨道上两个电子,2p轨道上3个电子),我们知道N有3个2p轨道,加上2s轨道共四个外层轨道.这四个轨道杂化形成四个sp3杂化轨道并被N的外层5个电子占据,即其中3个轨道上有一个电子,1个轨道上有一对电子.3个轨道上的单个电子分别与三个H原子形成sigma单键,那一对电子就是孤对电子了.
问题2:同上分析,2s和其中的2px轨道杂化形成两个sp杂化轨道,这时的N原子的轨道为2个sp,2个p轨道,5个外层电子分布在这四个轨道上分别为sp 1个和2个,p轨道各一个;由于C原子也是sp杂化,即2个sp,2个p,但碳原子外层只有四个电子,所以每个轨道上一个.然后N的但电子sp和C的其中一个但电子sp形成sigma键,N的2个单电子2p分别与C的2个单电子2p生成两个π键.N原子剩下的sp上的两个电子为孤对电子,C剩下的但电子sp轨道和H的s轨道上的单电子生成sigma键.这样就得到了HCN.1年前查看全部
- 价电子对数为2,3,4就一定是sp,sp2,sp3杂化吗?
价电子对数为2,3,4就一定是sp,sp2,sp3杂化吗?
如有特例,请举例说明哦、、 hvfjf1年前1
hvfjf1年前1 -
 zzy7478 共回答了16个问题
zzy7478 共回答了16个问题 |采纳率100%价层电子对数为2,3,4时就一定是sp,sp2,sp3杂化,没有特例.1年前查看全部
- HF为什么不是sp3杂化结构?如果因为不用杂化理论,那H2O为什么又要用杂...
HF为什么不是sp3杂化结构?如果因为不用杂化理论,那H2O为什么又要用杂...
HF为什么不是sp3杂化结构?如果因为不用杂化理论,那H2O为什么又要用杂化理论?他们不是都能相加得8吗?
如何判断谁是中心原子? 苏苏这只熊1年前3
苏苏这只熊1年前3 -
 好好看哦 共回答了15个问题
好好看哦 共回答了15个问题 |采纳率80%我认为一定用杂化的话,是一个sp不等杂化,一个sp与H成健了!有三对孤电子!杂化论是解释不了一些物质才发展起来的,能用简单的方法解释最好,比如co用分子轨道解释,复杂且最终找不到配位健,用价健理论最好解释,不过用在配合物中,分习轨道论非常清楚的解释很多问题,具体问题具体分析!1年前查看全部
- 乙烯干吗不是SP3杂化C的2S和2个2P杂化成3个SP轨道位于一个平面,剩下一个电子填到2P(2Pz)上去,这样不是有3
乙烯干吗不是SP3杂化
C的2S和2个2P杂化成3个SP轨道位于一个平面,剩下一个电子填到2P(2Pz)上去,这样不是有3个SP轨道参与杂化吗?干吗还是SP2而不是SP3?
上面打错了,我是问有3个P轨道参与(2个与S杂化,1个填电子),怎么不是SP3 nn宪兵1年前3
nn宪兵1年前3 -
 老牛不老 共回答了13个问题
老牛不老 共回答了13个问题 |采纳率92.3%如果一个分子是SP3杂化,那么它的空间构型为四面体,SP2杂化为平面三角形 ,而乙烯分子的碳原子和两个氢原子 不可能形成四面体结构.这是原因一.
第二,碳原子的2S轨道是一个原子轨道,加上2个2P轨道,一共是3个原子轨道,而SP2就是需要3个原子轨道的杂化,因此也不能形成SP3这样的4个原子轨道的杂化方式.
中1年前查看全部
- SP3杂化形成的AB4型分子的空间构型 A平面四方形 B四面体 C四角锥形 D平面三角形
 破了洞的口袋1年前2
破了洞的口袋1年前2 -
 ehstar 共回答了16个问题
ehstar 共回答了16个问题 |采纳率100%sp杂化形成的AB型分子的空间构型是直线型;sp2杂化形成的AB3型分子的空间构型是平面三角形;sp3杂化形成的AB4型分子的空间构型是四面体型.1年前查看全部
- 二氧化硫的电子式怎么写?大派键怎么看?为什么不是SP3杂化?碳硅钠氧四种元素熔点的高低怎么比较?
 llzzqq1年前0
llzzqq1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 化学SP3杂化解释下SP3杂化最好形象点看书上有点太抽象了还有SP3杂化有什么用比如说是用来判断什么的我知道4对电子是S
化学SP3杂化
解释下SP3杂化
最好形象点
看书上有点太抽象了
还有SP3杂化有什么用
比如说是用来判断什么的
我知道4对电子是SP3 3对是SP2 为什么
还是就是这么制定的?
如果一个分子是SP3杂化
那能说明什么(它有什么性质)
比如说CH4
但我不喜欢复制的
如果是那样的话我可以去看书
希望朋友们自己回答下这个问题
我之所以问这个问题
就是因为我看书的时候
老出现"SP3杂化"
我想书上说这个是分子是SP3杂化
肯定要说明什么
就像说它是弱碱性
这说明它能电离出OH-
等等 深夜无语amw1年前5
深夜无语amw1年前5 -
 xinyue128 共回答了20个问题
xinyue128 共回答了20个问题 |采纳率90%杂化轨道的原因就是能量相近的几个轨道结合在一起形成一种新的轨道以增强成键能力,SP3就是一个S轨道和3个P轨道结合形成的,主要是用来解释诸如CH4之类的四根键是等同的等问题
如果一个分子是SP3杂化,那么它的空间构型为四面体,SP2杂化为平面三角形1年前查看全部
- 下列说法中正确的是( )A.乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键B.sp3杂化轨道是由任意的1个s轨
下列说法中正确的是( )
A.乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C.凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形
D.凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 zhgao13301年前1
zhgao13301年前1 -
 小小灵芝 共回答了13个问题
小小灵芝 共回答了13个问题 |采纳率92.3%解题思路:A.碳碳三键中含有一个σ键和两个π键,每个碳原子含有2个σ键且不含孤电子对,每个碳原子都有两个未杂化的2p轨道肩并肩重叠形成两个π键;
B.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道为杂化轨道;
C.根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数,n=3,sp2杂化,不含孤电子对其分子构型都是平面三角形,否则不是;
D.根据价层电子对互斥理论确定其杂化方式,如果价层电子对为2,则中心原子以sp杂化轨道成键,AB2型的共价化合物,其中心原子A不一定采用sp杂化轨道成键;A.乙炔分子的结构式H-C≡C-H,中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+[1/2]×(4-2×2)=2,采取sp杂化,每个碳原子都有两个未杂化的2p轨道形成π键,故A正确;
B.sp3杂化轨道是指同一电子层内,1个s轨道和3个p轨道杂化,形成能量相等的四个sp3杂化轨道,故B错误;
C.中心原子采取sp2杂化的分子,n=3,sp2杂化,不含孤电子对其分子构型都是平面三角形,否则不是,如二氧化硫分子中,价层电子对数=2+
1
2×(6-2×2)=3,所以采取sp2杂化,含有一对孤电子对,所以立体构型为V型,故C错误;
D.AB2型的共价化合物,其中心原子A价层电子对为2,则中心原子以sp杂化轨道成键,如氯化铍分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,AB2型的共价化合物,也有不采用sp杂化轨道成键,如二氧化硫分子中,价层电子对数=2+
1
2×(6-2×2)=3,所以采取sp2杂化,故D错误;
故选A.点评:
本题考点: 原子轨道杂化方式及杂化类型判断;判断简单分子或离子的构型.
考点点评: 本题考查了杂化轨道、分子空间结构等,题目难度中等,注意把握杂化轨道理论的应用,注意判断中心原子的价层电子对以及孤对电子数的判断.1年前查看全部
- 我发现当氮原子不参与大π键的形成时,氮原子为sp3杂化,而参与了的就变成了sp2了,如二氧化氮.
我发现当氮原子不参与大π键的形成时,氮原子为sp3杂化,而参与了的就变成了sp2了,如二氧化氮.
请告诉我这个结论合不合理,只要适合大多数情况即可 xiangandfish1年前2
xiangandfish1年前2 -
 lllkkk0151 共回答了14个问题
lllkkk0151 共回答了14个问题 |采纳率92.9%基本没问题,我帮你改一下:“当氮原子不参与π键的形成时,氮原子为sp3杂化,而参与了的就变成了sp2了或者sp1”,你可以放心地把“大π键”的“大”字去掉1年前查看全部
- SP3不等性杂化的解释在分子结构中:SP3杂化有两种,一种是等性杂化,一种是不等性杂化,请说明一下不等性杂化
 神经习习1年前1
神经习习1年前1 -
 梦想飘飞 共回答了17个问题
梦想飘飞 共回答了17个问题 |采纳率94.1%等性与不等性的差别在于杂化轨道是否都是成键的电子轨道
CH4属于等性杂化,NH3属于不等性杂化.CH4四个轨道都用来成键,而NH3中有三个轨道用来成键,还有一个被一对孤对电子占据,四个轨道作用不同,所以称不等性杂化1年前查看全部
- B2H6为什么是SP3杂化
 塔罗隐者1年前2
塔罗隐者1年前2 -
 里性 共回答了22个问题
里性 共回答了22个问题 |采纳率100%看中心原子.当它的孤电子对数+结合原子数=4时,就是sp3杂化了.
由图可知每个硼原子均为sp3杂化,2个硼原子与4个氢原子形成普通的西格玛键.
这四个西格玛键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的氢桥键.也称为三中心两电子键.
价电子分布:两个硼原子+六个氢原子,共12个价电子.
四个普通的西格玛键,用掉8个价电子.
每个氢桥键两个电子,两个氢桥键用掉4个电子.1年前查看全部
- 书上说N经SP3杂化后,其中1个杂化轨道由一孤对电子占据,这句话是不是指N经SP3后形成的化合物中N上的SP3轨道总有一
书上说N经SP3杂化后,其中1个杂化轨道由一孤对电子占据,这句话是不是指N经SP3后形成的化合物中N上的SP3轨道总有一个要被孤对电子占据呢?氧也一样吗?
 快乐伙伴1年前2
快乐伙伴1年前2 -
 不要太夸张 共回答了16个问题
不要太夸张 共回答了16个问题 |采纳率100%不是的,要看情况
比如 NH4+ 这个离子中N是sp3 杂化,但是没有N没有孤对电子
而NH3 这个分子中 N也是 sp3杂化,N有一对孤对电子.
O一般是形成2个键 ,因此O为中心原子的时候,O通常有2 对孤对电子,比如 H2O中 O为 sp3杂化,O就有2对孤对电子
凡是sp3杂化的原子要是形成4个键了,比如和4个原子相连,那么它就没有孤对电子了,反之就有孤对电子.1年前查看全部
- 请问苯酚中的氧原子是否为SP3杂化,如果是为什么它还会有单独的P轨道和苯基形成共轭效应?
 jimmyni861年前2
jimmyni861年前2 -
 fsg121068437 共回答了15个问题
fsg121068437 共回答了15个问题 |采纳率86.7%正三角形sp2杂化,
主要因为每个C多了一个电子,形成了一个大 派(符号) 键1年前查看全部
- 请问比如c的sp杂化和sp3杂化有什么规律吗?怎么知道?是不是都要满足最外层共有8电子结构
请问比如c的sp杂化和sp3杂化有什么规律吗?怎么知道?是不是都要满足最外层共有8电子结构
pcl5就不是8电子结构,感觉好困惑,到底成键杂化什么的,还有空间结构,有什么规律啊 清风晨流1年前3
清风晨流1年前3 -
 旋转羽毛 共回答了14个问题
旋转羽毛 共回答了14个问题 |采纳率92.9%高中而言,判断AmBn型化合物是什么杂化可以通过一个式子,(配位原子的最外层电子数+中心原子的最外层电子数)/2,其中结果为2,3,4,对应着中心原子的杂化方式为sp,sp2,sp3(配位原子中卤素算1,O与F算0)
空间结构要通过价层电子互斥理论,SP3——2,3,4个原子——V型,三角锥型,四面体
SP2——2,3个原子——V型,平面三角形
SP——都是直线型1年前查看全部
- H2O2 sp3杂化原理,要不然我看不懂
 captain_z971年前0
captain_z971年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1已知奇函数y=f(x)是R上的减函数,对任意x∈R恒有f(kx)+f(-x^2+x-1)>0,求k的取值范围
- 2皮肤变差 和 我不想活了 的英语翻译?
- 3正方形上给定8个点,以这些点为顶点,能构成多少个等腰三角形
- 4【选择】夏至日,北半球().夏至日,北半球().A,昼长夜短;B,昼短夜长;C,越往北昼越长;D,正处于冬季我怎么看A和
- 5萃取操作时,选择有机萃取剂,则溶质在萃取剂中的密度需要比水大吗?
- 6自由水的作用知道细胞中的水分为结合水和自由水,但问题是为什么自由水含量多能使生命活动旺盛,却适应不良环境的能力会差些?
- 7自由水在细胞中所占比例 结合水在细胞中所占比例
- 8i wear my new blue dress ,and i want to wear my white shoes
- 9人们常用浮筒法打捞海底沉船,将充满回水 的浮筒沉入水底,绑在沉船两侧,用高压气体将浮筒中的水排除,浮筒既产生向上的举力,
- 10判断轨道杂化方式具体方法,全
- 11设函数f(x)=x的立方-3ax+b(a不等于0) 若曲线y=f(x)在点(2,f(2))处与直线y=8相切,求a,b
- 12硫化物的溶解性为什么硫化铁溶于稀酸,硫化铜不溶于稀酸?哪些硫化物易水解?为什么?
- 1354平方米=多少平方分米?
- 14在直角坐标系中,双曲线y=x/3,绕着坐标原点旋转90度后的对应双曲线的表达式是
- 15纯水的导电性很弱.还有玻璃都是无色的.这2句话是属于化学性质还是物理性质
