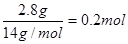与阿伏加德罗常数有关的一个问题盛有二氧化硫的密闭容器中含有NA个氧原子,则二氧化硫的物质的量为0.5摩尔.请问这句话为什
 小逍遥2022-10-04 11:39:541条回答
小逍遥2022-10-04 11:39:541条回答盛有二氧化硫的密闭容器中含有NA个氧原子,则二氧化硫的物质的量为0.5摩尔.
请问这句话为什么正确?是怎么判断的?

已提交,审核后显示!提交回复
共1条回复
 小蜘蛛蛛 共回答了15个问题
小蜘蛛蛛 共回答了15个问题 |采纳率93.3%- 一个二氧化硫分子有两个氧原子,相对而言也可以说是1 mol的二氧化硫有了2 mol 的氧原子
那么反过来某二氧化硫样品有1 mol 的氧原子,那么该二氧化硫物质的量就是0.5 mol
1 mol 刚好是一个阿伏伽德罗常数 所以这句话是对的! - 1年前
相关推荐
- 用NA表示阿伏加德罗常数的值,下列说法正确的是( )
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22.4 L 氢气中含有氢分子数目为NA
B.0.5mol Na2CO3中含有的Na+数目为 0.5 NA
C.常温常压下,14 g 氮气含有的原子数目为 NA
D.0.5 mol/L Fe2(SO4)3溶液中,S
的数目为1.5NAO 2−4 Nicy媛1年前1
Nicy媛1年前1 -
 oldflyknife 共回答了18个问题
oldflyknife 共回答了18个问题 |采纳率77.8%解题思路:A、不知道气体摩尔体积的大小,无法计算氢分子数目;
B、0.5mol Na2CO3中含有的Na+数目为2×0.5 NA;
C、14g氮气的物质的量为0.5mol,氮气分子数为0.5NA,氮原子数目为2×0.5NA=NA;
D、缺少溶液的体积,无法计算其物质的量、微粒的数目.A、不知道气体摩尔体积的大小,无法计算氢分子数目,故A错误;
B、0.5mol Na2CO3中含有的Na+数目为2×0.5mol×NA mol-1=2×0.5 NA=NA,故B错误;
C、14g氮气的物质的量为0.5mol,氮气分子数为0.5NA,氮原子数目为2×0.5NA=NA,故C正确;
D、缺少溶液的体积,无法计算其物质的量、微粒的数目,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的有关计算,难度不大,注意气体摩尔体积、物质的量浓度计算公式的使用范围和条件.1年前查看全部
- (Ⅰ)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol-1.若阿伏加德罗常数用NA
(Ⅰ)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol-1.若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为[m/M][m/M]mol.
(2)该气体在标准状况下的体积为[22.4m/M][22.4m/M]L
(3)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为[m/MV][m/MV]mol/L
(Ⅱ)49gH2SO4含有分子______mol,含有O原子______个,含有S原子______g.完全溶于水,配成2L溶液,则所得溶液中H+的物质的量浓度为______. 七曜念林一百年1年前1
七曜念林一百年1年前1 -
 以后不可以看 共回答了18个问题
以后不可以看 共回答了18个问题 |采纳率94.4%解题思路:(Ⅰ)(1)根据物质的量与摩尔质量的关系计算出该气体的物质的量;
(2)根据标况下的气体摩尔体积计算出该气体在标况下的体积;
(3)根据物质的量浓度的表达式计算出所得溶液的物质的量浓度;
(Ⅱ)根据n=[m/M]计算出硫酸的物质的量,然后根据硫酸的化学式计算出含有的氧原子、S原子的物质的量、数目及质量;根据物质的量浓度表达式计算出氢原子氢离子的浓度.(Ⅰ)(1)该气体的物质的量为:n=[mg/Mg/mol]=[m/M]mol,
故答案为:[m/M];
(2)[m/M]mol该气体在标况下的体积为:22.4L/mol×[m/M]mol=[22.4m/M]L,
故答案为:[22.4m/M];
(3)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为:c=[n/V]=
m
M
Vmol/L=[m/MV]mol/L,
故答案为:[m/MV];
(Ⅱ)49g硫酸的物质的量为:[49g/98g/mol]=0.5mol;0.5mol硫酸中含有O原子的物质的量为:0.5mol×4=2mol,含有氧原子的数目为:2NA;0.5mol硫酸中含有0.5mol硫原子,含有S的质量为:32g/mol×0.5mol=16g;完全溶于水,配成2L溶液,则所得溶液中H+的物质的量浓度为:c=[0.5mol×2/2L]=0.5mol/L,
故答案为:0.5;2NA;16;0.5mol/L.点评:
本题考点: 物质的量浓度的相关计算;阿伏加德罗常数.
考点点评: 本题考查了有关物质的量的简单计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、物质的量浓度、摩尔质量等物理量之间的转化关系,明确物质的量浓度的概念及计算方法.1年前查看全部
- (2010•南开区二模)用NA表示阿伏加德罗常数的值,下列说法正确的是( )
(2010•南开区二模)用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.室温下,30 g乙烷含有共价键数为8 NA
B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
C.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
D.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA aotong1年前1
aotong1年前1 -
 yuri22 共回答了17个问题
yuri22 共回答了17个问题 |采纳率100%解题思路:A、依据n=[m/M]计算物质的量结合乙烷分子结构计算共价键;
B、取代基结构计算电子数进行比较;
C、依据PH计算,结合离子积常数计算得到氢氧根离子数;
D、氯气和碱反应发生的是自身氧化还原反应,氯元素化合价从0价变化为-1价和+1价.A、室温下,30 g乙烷物质的量为1mol,乙烷分子结构CH3-CH3可知,含有共价键数为7 NA,故A错误;
B、等物质的量的甲基(-CH3)与羟基(-OH)是取代基,所含电子数为9,电子数相等,故B正确;
C、25℃时,pH=13的1.0 L Ba(OH)2溶液中c(H+)=10-13mol/L,c(OH-)=0.1mol/L,含有的OH-数目为0.1 NA,故C错误;
D、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,氯气和碱反应发生的是自身氧化还原反应,氯元素化合价从0价变化为-1价和+1价,转移的电子总数为0.1NA,故D错误;
故选B.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的应用,主要是质量换算物质的量计算微粒数,取代基结构特征应用,溶液离子积和pH的计算应用,氧化还原反应电子转移计算方法,题目难度中等.1年前查看全部
- (2009•湖北模拟)阿伏加德罗常数值是NA,标准状况下,若某氧气和氮气的混合气体mg含有b个分子,则ng该混合气体在标
(2009•湖北模拟)阿伏加德罗常数值是NA,标准状况下,若某氧气和氮气的混合气体mg含有b个分子,则ng该混合气体在标准状况下的体积是( )
A.[22.4nbmNA  九月观潮1年前1
九月观潮1年前1 -
 z93147 共回答了18个问题
z93147 共回答了18个问题 |采纳率88.9%解题思路:正确理解气体摩尔体积,阿伏加德罗常数,先求出ng该混合气体含有的分子数,再求出其物质的量,最后根据气体体积公式求出体积.根据其组分及其含量相同,所以其质量与分子数成正比,设ng该混合气体含有的分子数为:x个,质量与分子数的比列式为:mg:b个=ng:x个,
x=[ng ×b个/mg]=[nb/m]个;
ng该混合气体含有的物质的量为:n=
N
NA=
nb
mNAmol
其体积为:V=n×Vm =
nb
mNAmol×Vm =
22.4nb
mNAL
故选:A点评:
本题考点: 阿伏加德罗常数;气体摩尔体积.
考点点评: 本题考查的是物质的量、质量、气体摩尔体积之间的关系,灵活运用公式是解题的关键,这种类型的题在高考选择题中经常出现.1年前查看全部
- N A 表示阿伏加德罗常数,下列叙述正确的是 A.1molC 2 H 6 中共价键数为8N A B.3.2 g O 2
N A 表示阿伏加德罗常数,下列叙述正确的是
A.1molC 2 H 6 中共价键数为8N A B.3.2 g O 2 和O 3 的混合气中氧原子数为0.2N A C.1L 0.1mol·L -1 Al 2 (SO 4 ) 3 溶液中Al 3+ 数为0.2N A D.标准状况下,22.4 L甲醇的分子数为N A  xas160481年前1
xas160481年前1 -
 pengyanting318 共回答了16个问题
pengyanting318 共回答了16个问题 |采纳率93.8%B
1年前查看全部
- (2013•珠海一模)设NA为阿伏加德罗常数,下列说法正确的是( )
(2013•珠海一模)设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,224mL水含有的电子数为0.1NA
B.1L 0.1mol/L硅酸钠溶液中含有0.1NA个SiO2-3
C.标准状况下,11.2L CO2和SO2混合气体中含NA个氧原子
D.足量的铁粉与1mol Cl2加热条件下充分反应,转移的电子数为3NA 天马行网1年前1
天马行网1年前1 -
 kalanka 共回答了18个问题
kalanka 共回答了18个问题 |采纳率100%解题思路:A.标准状况下,水为液体,不能使用气体摩尔体积;
B.溶液中SiO32-水解,其离子浓度小于1mol/L,根据n=cV、N=nNA进行判断;
C.根据n=
计算11.2 LCO2和SO2混合气体的物质的量,二者每个分子都含2个氧原子,氧原子物质的量为混合气体的2倍,再根据N=nNA计算氧原子数目;V Vm
D.铁与氯气反应生成氯化铁,反应中氯气起氧化剂作用,根据氯气的物质的量计算转移电子数目.A.标准状况下,水为液体,不能使用气体摩尔体积,224 mL水的物质的量远大于0.01mol,故A错误;
B.溶液中SiO32-水解,其离子浓度小于1mol/L,SiO32-的物质的量小于1mol/L×1L=1mol,故SiO32-数目小于1mol×NAmol-1=NA,故B错误;
C.标况下,11.2 LCO2和SO2混合气体的物质的量为[11.2L/22.4L/mol]=0.5mol,二者每个分子都含2个氧原子,氧原子物质的量为0.5mol×2=1mol,故含有氧原子数目为1mol×NAmol-1=NA,故C正确;
D.铁与氯气反应生成氯化铁,反应中氯气起氧化剂作用,氯元素化合价由0价降低为-1价,故转移电子数目为1mol×2×NAmol-1=2NA,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查常用化学计量,难度不大,注意气体摩尔体积的使用体积与对象,D选项中铁过量与否都生成氯化铁.1年前查看全部
- 下列说法不正确的是( )A.1mol任何粒子的粒子数叫阿伏加德罗常数,12g 12C含有阿伏加德罗常数个碳原子B.1m
下列说法不正确的是( )
A.1mol任何粒子的粒子数叫阿伏加德罗常数,12g 12C含有阿伏加德罗常数个碳原子
B.1mol硫酸在水溶液中电离出的离子数约为2NA
C.硫酸根离子的摩尔质量是96 g•mol-1
D.同温同压下,相同体积的任何气体含有相同数目的分子 我爱111年前1
我爱111年前1 -
 别人的背影 共回答了22个问题
别人的背影 共回答了22个问题 |采纳率95.5%解题思路:A.1mol任何粒子的粒子数叫阿伏加德罗常数,粒子包含分子、原子、离子或电子等;
B.硫酸在水溶液里完全电离,每个硫酸分子电离出2个氢离子和1个硫酸根离子;
C.摩尔质量是g/mol,在数值上等于其相对分子质量;
D.同温同压下,相同体积的任何气体物质的量相等,其分子数相等.A.1mol任何粒子的粒子数叫阿伏加德罗常数,粒子包含分子、原子、离子或电子等,12g 12C的物质的量是1mol,含有阿伏加德罗常数个碳原子,故A正确;
B.硫酸在水溶液里完全电离,每个硫酸分子电离出2个氢离子和1个硫酸根离子,所以1mol硫酸在水溶液中电离出的离子数约为3NA,故B错误;
C.硫酸根离子的摩尔质量是96g/mol,在数值上等于其相对分子质量,故C正确;
D.同温同压下,相同体积的任何气体物质的量相等,其分子数相等,所以同温同压下,相同体积的任何气体含有相同数目的分子,故D正确;
故选B.点评:
本题考点: 物质的量与其浓度和气体摩尔体积的综合应用;摩尔质量.
考点点评: 本题考查电解质的电离、摩尔质量、物质的量等知识点,注意阿伏伽德罗常数的概念,知道阿伏伽德罗常数与6.02×1023关系,题目难度不大.1年前查看全部
- 设N A 代表阿伏加德罗常数的值,下列有关叙述正确的是 A.标准状况下,44.8L NO与22.4L O 2 混合气体中
设N A 代表阿伏加德罗常数的值,下列有关叙述正确的是
A.标准状况下,44.8L NO与22.4L O 2 混合气体中分子总数等于3N A B.Al 2 (SO 4 ) 3 溶液中还可以大量存在Na + 、K + 、CO 2 — 3 、NO — 3 C.将SO 2 通入Ca(ClO) 2 溶液中:Ca 2+ +2ClO — +SO 2 +H 2 O=CaSO 3 +2HClO D.2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1N A  bl1v1年前1
bl1v1年前1 -
 wanggang0520211 共回答了12个问题
wanggang0520211 共回答了12个问题 |采纳率100%D
1年前查看全部
- (2009•徐州三模)用NA表示阿伏加德罗常数的值.下列说法正确的是( )
(2009•徐州三模)用NA表示阿伏加德罗常数的值.下列说法正确的是( )
A.1 mol/LCuCl2溶液中含有Cl-的个数为2NA
B.14 g CnH2n中含有的共用电子对数为NA
C.电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为NA
D.标准状况下11.2 L NH3溶于1 L水中,溶液中含N原子的微粒总数为0.5NA 恕我直言1年前1
恕我直言1年前1 -
 铕丨丶訫痛 共回答了17个问题
铕丨丶訫痛 共回答了17个问题 |采纳率82.4%解题思路:A、溶液中离子数目与离子浓度、溶液体积有关.
B、根据原子最外层电子数计算每个CnH2n分子中含有共用电子对数为[4×n+2n/2]=3n对,根据n=[m/M]计算14gCnH2n的物质的量,再根据N=nNA计算共用电子对数.
C、电解精炼铜时,阳极放电物质除铜外还有其它物质.
D、根据n=
计算氨气的物质的量,根据氮原子守恒可知,溶液中氮原子数目等于11.2LNH3含有的氮原子数目.V Vm A、1 mol/LCuCl2溶液中氯离子浓度为2mol/L,液中离子数目与离子浓度、溶液体积有关,溶液体积为告诉,无法计算离子浓度,故A错误;
B、14gCnH2n的物质的量为[14g/14ng/mol]=[1/n]mol,每个CnH2n分子中含有共用电子对为3n对,所以,14gCnH2n中含有的共用电子对数为3NA,故B错误;
C、电解精炼铜时,若只有铜放电每转移2mol电子阳极上溶解的铜原子数为NA,阳极放电物质除铜外还有其它物质,所以溶解的铜原子数小于NA,故C错误;
D、标准状况下11.2LNH3的物质的量为0.5mol,根据氮原子守恒可知,溶液中氮原子数目等于11.2LNH3含有的氮原子数目为0.5NA,故D正确.
故选:D.点评:
本题考点: 阿伏加德罗常数.
考点点评: 考查常用化学计量有关计算,难度中等,注意B选项中共用电子对数目的计算.1年前查看全部
- (2009•湛江一模)阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是( )
(2009•湛江一模)阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是( )
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.标准状况下,a L甲烷和乙烷混合气体中的分子数约为[a/22.4]×6.02×1023 粉发1年前1
粉发1年前1 -
 ruralister 共回答了13个问题
ruralister 共回答了13个问题 |采纳率92.3%解题思路:A、依据n=[m/M]计算物质的量.结合重水分子中的电子数计算判断;
B、乙烯和丙烯最简式相同,只需要计算42.0gCH2中的碳原子数;
C、标准状况甲苯不是气体;
D、依据气体摩尔体积计算气体物质的量得到分子数;A、常温常压下,18.0 g重水(D2O)物质的量=[18.0g/20g/mol],所含的电子数=[18.0g/20g/mol]×10×6.02×1023,故A错误;
B、室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数,乙烯和丙烯最简式相同,只需要计算42.0gCH2中的碳原子数=[42.0g/14g/mol]×6.02×1023=3×6.02×1023;故B正确;
C、标准状况甲苯不是气体,22.4 L甲苯不是1mol,故C错误;
D、标准状况下,a L甲烷和乙烷混合气体物质的量[aL/22.4L/mol],气体中的分子数约为[a/22.4]×6.02×1023,故D正确;
故选:BD.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的应用,主要是气体摩尔体积的条件应用,质量换算物质的量计算微粒数,题目难度中等.1年前查看全部
- 设N A 代表阿伏加德罗常数的数值,下列说法中正确的是 [ ] ①常温常
设N A 代表阿伏加德罗常数的数值,下列说法中正确的是 [ ]
①常温常压下,17 g甲基(- 14 CH 3 )所含的中子数为9N A
②常温常压下,22.4 L NO气体的分子数小于N A
③64 g的铜发生氧化还原反应,一定失去2N A 个电子
④常温常压下,100 mL 0.5 mol·L -1 的乙酸溶液中,乙酸的分 子数目小于0.05N A
⑤标准状况时,22.4 L二氯甲烷所含有的分子数为N A
⑥常温常压下,1 mol氦气含有的核外电子数为2N A
A、①④⑤
B、②③④
C、②④⑥
D、②⑤⑥ songjw19691年前1
songjw19691年前1 -
 toty0801 共回答了16个问题
toty0801 共回答了16个问题 |采纳率87.5%C1年前查看全部
- 水的分子量18,水的密度为103kg/m3,阿伏加德罗常数为NA=6.0×1023个/mol,则:
水的分子量18,水的密度为103kg/m3,阿伏加德罗常数为NA=6.0×1023个/mol,则:
(1)水的摩尔质量M
(2)水的摩尔体积V
(3)一个水分子的质量m0
(4)一个水分子的体积V0. 5309748931年前1
5309748931年前1 -
 协月累了 共回答了13个问题
协月累了 共回答了13个问题 |采纳率92.3%解题思路:水的摩尔质量等于分子量的大小,根据摩尔质量和密度求出水的摩尔体积,根据摩尔质量和阿伏伽德罗常数求出一个分子的质量,根据摩尔体积和阿伏伽德罗常数求出一个水分子的体积.(1)水的分子量为18,知水的摩尔质量为:M=18g/mol.
(2)水的摩尔体积为:V=
M
ρ=
18×10−3
103m3/mol=1.8×10−5m3/mol.
(3)一个水分子的质量为:m0=
M
NA=
18×10−3
6×1023=3×10−26kg.
(4)一个水分子的体积为:V0=
V
NA=
1.8×10−5
6×1023=3×10−29m3.
答:(1)水的摩尔质量M为18g/mol.
(2)水的摩尔体积V为1.8×10-5m3/mol.
(3)一个水分子的质量为3×10-26kg.
(4)一个水分子的体积为3×10-29m3.点评:
本题考点: 阿伏加德罗常数.
考点点评: 解决本题的关键知道质量、体积、摩尔质量、摩尔体积、密度、分子质量、分子体积、阿伏伽德罗常数之间的关系,知道阿伏伽德罗常数是联系宏观物理量和微观物理量的桥梁.1年前查看全部
- 摩尔和阿伏加德罗常数有什么区别?什么时候用摩尔,什么时候用阿伏加德罗常数?
 西没m1年前3
西没m1年前3 -
 澜cc 共回答了16个问题
澜cc 共回答了16个问题 |采纳率100%物质的量(n) 的单位表示就是 摩尔(mol),阿弗加德罗常数NA是规定的,固定不变的,约为6.02*10的23次方.用来计算物质的量可以用到.公式为物质的量(n)=粒子数(N)/阿弗加德罗常数(NA),例如:有·6.02*10的23次方个氢原子,求有多少mol氢原子?分析:(6.02*10的23次方个氢原子)表示粒子数,(多少mol氢原子)就是求物质的量,将这些数带入以上公式得出1摩尔氢原子,字母表示1mol(H).摩尔就是物质的量的单位,阿弗加德罗常数是规定的粒子个数,也是不变的粒子个数,就是6.02*10的23次方.根据以上公式可以计算出物质的量有多少mol.(我是高一新生,这是我刚学的内容,说的不清楚的地方请多多包涵)1年前查看全部
- 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子.则该硫酸盐
在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子.则该硫酸盐的物质的量浓度为( )
A. 2 mol•L-1
B. 2.5 mol•L-1
C. 5 mol•L-1
D. 7.5 mol•L-1 tb881615221年前1
tb881615221年前1 -
 zhouhexifan 共回答了22个问题
zhouhexifan 共回答了22个问题 |采纳率95.5%解题思路:1.5NA个硫酸根离子的物质的量为1.5mol,NA个金属阳离子的物质的量为1mol,根据电荷守恒可知,金属阳离子为+3价,所以该硫酸盐可以表示为M2(SO4)3,根据硫酸根守恒可知,硫酸盐为0.5mol,再利用c=[n/V]计算.1.5NA个硫酸根离子的物质的量为1.5mol,NA个金属阳离子的物质的量为1mol,令金属离子的化合价为x,根据电荷守恒可知,x=1.5×2=3,故金属阳离子为+3价,所以该硫酸盐可以表示为M2(SO4)3,根据硫酸根守恒可知,硫酸盐为0.5mol,所以该硫酸盐的物质的量浓度为[0.5mol/0.2L]=2.5mol/L.
故选:B.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 考查物质的量浓度计算,难度中等,判断金属离子的化合价是解题关键,注意守恒思想的运用.1年前查看全部
- (2013•泸州一模)用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
(2013•泸州一模)用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A.1mol过氧化钡(BaO2)晶体中所含有的阴离子数目为2NA
B.标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA
C.将Imol FeCl3转化为氢氧化铁胶体,得到的氢氧化铁胶体粒子数小于NA
D.常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA 肥洋1年前1
肥洋1年前1 -
 起阿起阿 共回答了14个问题
起阿起阿 共回答了14个问题 |采纳率100%解题思路:A、过氧化钡是钡离子和过氧根离子构成;
B、标准状况,四氯化碳不是气体;
C、氢氧化铁胶体粒子是氢氧化铁微粒的集合体;
D、氯气体积在常温常压33.6L氯气物质的量不是1.5mol.A、过氧化钡是钡离子和过氧根离子构成,1mol过氧化钡(BaO2)晶体中所含有的阴离子数目为NA,故A错误;
B、标准状况,四氯化碳不是气体,22.4L四氯化碳物质的量不是1mol,故B错误;
C、将1mol FeCl3转化为氢氧化铁胶体,氢氧化铁胶体粒子是氢氧化铁微粒的集合体,得到的氢氧化铁胶体粒子数小于NA,故C正确;
D、常温常压下,33.6L氯气物质的量不是1.5mol,与56g铁充分反应,转移的电子数不是3NA,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的应用,主要是物质构成分析判断,胶体微粒判断气体摩尔体积的条件应用,题目难度中等.1年前查看全部
- 设N A 为阿伏加德罗常数,下列关于0.2mol•L -1 硝酸钡溶液的说法不正确的是( ) A.1L溶液中所含阴阳离
设N A 为阿伏加德罗常数,下列关于0.2mol•L -1 硝酸钡溶液的说法不正确的是( ) A.1L溶液中所含阴阳离子总数是0.6N A B.1L溶液中含有0.2N A 个NO 3 - C.500mL溶液中含有0.2N A 个NO 3 - D.500mL溶液中Ba 2+ 浓度为0.2mol•L -1  lala_ss3331年前1
lala_ss3331年前1 -
 w363685798 共回答了18个问题
w363685798 共回答了18个问题 |采纳率94.4%A、1L0.2mol•L -1 硝酸钡溶液含0.2molBa(NO 3 ) 2 ,一个Ba(NO 3 ) 2 中阴阳离子总数为3,0.2molBa(NO 3 ) 2 中所含阴阳离子总数是0.6N A ,故A正确;
B、一个Ba(NO 3 ) 2 中有2个NO 3 - ,1L0.2mol•L -1 硝酸钡溶液含0.4N A 个NO 3 - ,故B错误;
C、一个Ba(NO 3 ) 2 中有2个NO 3 - ,500mL0.2mol•L -1 Ba(NO 3 ) 2 含有0.2N A 个NO 3 - ,故C正确;
D、500mL0.2mol•L -1 硝酸钡溶液中Ba 2+ 浓度仍为0.2mol•L -1 ,与体积无关,故D正确;
故选:B.1年前查看全部
- NA为阿伏加德罗常数,且已知C2H2(g)+[5/2]O2(g)=2CO2(g)+H2O (l)△H=-130
NA为阿伏加德罗常数,且已知C2H2(g)+[5/2]O2(g)=2CO2(g)+H2O (l)△H=-1300kJ•mol-1,则下列说法正确的是( )
A.当有20NA个电子转移时,放出1300kJ 热量
B.当有4NA个碳氧共用电子对生成时,放出1300kJ热量
C.若生成NA个水蒸气分子焓变为△H′,则△H′<△H
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量 yuz**0071年前1
yuz**0071年前1 -
 yuan0425 共回答了19个问题
yuan0425 共回答了19个问题 |采纳率94.7%解题思路:A、当有20NA个电子转移时,转移电子物质的量为20mol,反应中氧元素化合价由0价降低为-2价,故参加反应的氧气的物质的量为[20mol/4]=5mol,结合热化学方程式中的反应热计算;
B、1个CO2分子中含有4个碳氧共用电子对,有4NA个碳氧共用电子对,说明有1molCO2生成,结合热化学方程式中的反应热计算;
C、气态水的能量比液态水的能量高,故生成气态水放出的热量少,反应热△H′偏大;
D、1个CO2分子中含有4个碳氧共用电子对,有8NA个碳氧共用电子对,说明有2molCO2生成,结合热化学方程式中的反应热计算.A、当有20NA个电子转移时,转移电子物质的量为20mol,反应中氧元素化合价由0价降低为-2价,故参加反应的氧气的物质的量为[20mol/4]=5mol,根据热化学方程式中[5/2]mol氧气参加反应放热1300kJ,所以5mol氧气反应放热2600KJ,故A错误;
B、1个CO2分子中含有4个碳氧共用电子对,有4NA个碳氧共用电子对,说明有1molCO2生成,根据热化学方程式中2mol二氧化碳参加反应放热1300kJ,所以1mol二氧化碳反应放热650KJ,故B错误;
C、气态水的能量比液态水的能量高,故生成气态水放出的热量少,但是△H为负值,所以反应热△H′偏大,所以△H′>△H,故C错误;
D、1个CO2分子中含有4个碳氧共用电子对,有8NA个碳氧共用电子对,说明有2molCO2生成,据热化学方程式中2mol二氧化碳参加反应放热1300kJ,所以2mol二氧化碳反应放热1300KJ,故D正确;
故选D.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查反应热的有关计算,难度中等,正确从微观结构判断参加反应物质的物质的量是做本题的关键,注意C选项中比较△H大小时要考虑符号.1年前查看全部
- 设N A 表示阿伏加德罗常数的值,下列说法不正确的是 A.T 0 C时,1 L pH=6的纯水中,含有的OH - 数目为
设N A 表示阿伏加德罗常数的值,下列说法不正确的是
A.T 0 C时,1 L pH=6的纯水中,含有的OH - 数目为1×10 -6 N A B.12.0 g NaHSO 4 固体中含有的阳离子数目为0.1 N A C.50 g 98%的浓硫酸中,所含的氧原子数目为2N A D.1 molNa 2 O 2 与足量CO 2 充分反应转移的电子数目为N A  陈锐君1年前1
陈锐君1年前1 -
 lin589589 共回答了27个问题
lin589589 共回答了27个问题 |采纳率85.2%C
1年前查看全部
- N A 表示阿伏加德罗常数的值,下列说法正确的是( ) A.1L1mol•L -1 Na 2 S溶液中含有的S 2-
N A 表示阿伏加德罗常数的值,下列说法正确的是( ) A.1L1mol•L -1 Na 2 S溶液中含有的S 2- 的个数为N A B.常温常压下,1mol甲基所含电子数为10N A C.常温常压下,活泼金属从盐酸中置换出1gH 2 ,发生转移的电子数为N A D.标准状况下,0.5N A 个SO 3 所占的体积约为11.2L  luckytz111年前1
luckytz111年前1 -
 莜航 共回答了16个问题
莜航 共回答了16个问题 |采纳率81.3%A、由于硫离子水解,所以1L1mol•L -1 Na 2 S溶液中含有的S 2- 的个数小于N A ,故A错误;
B、1mol甲基所含电子数=1mol×(6+3)×N A =9N A ;故B错误;
C、活泼金属从盐酸中置换出1gH 2 ,根据金属失电子和氢离子得到电子生成氢气守恒计算,所以发生转移的电子数为N A ,故C正确;
D、三氧化硫标准状况下不是气体,0.5N A 个SO 3 所占的体积小于11.2L,故D错误;
故选C.1年前查看全部
- (2014•山东模拟)NA表示阿伏加德罗常数的值,下列说法正确的是( )
(2014•山东模拟)NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.100mL 2 mol•L-1碳酸钠溶液中,CO32-离子数为0.2NA
B.将10mL 1mol•L-1FeCl3溶液滴入沸水中,所得氢氧化铁胶粒数为0.01NA
C.1 mol Na2O2固体中含离子总数为3NA
D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g 怡红公子20461年前1
怡红公子20461年前1 -
 wfjbcb 共回答了16个问题
wfjbcb 共回答了16个问题 |采纳率81.3%A、由于碳酸根离子发生了水解,数量减少,离子数小于0.2NA,故A错误;
B、氢氧化铁胶体的胶粒是氢氧化铁的集合体,胶粒数小于0.01NA,故B错误;
C、由于1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,含离子总数为3NA,故C正确;
D、电解时阳极氧化、阴极还原,应该是阴极析出铜,故D错误;
故选C.1年前查看全部
- 在标准状况下,1LN2中含m个氮分子,则阿伏加德罗常数可表示为( )
在标准状况下,1LN2中含m个氮分子,则阿伏加德罗常数可表示为( )
A. [1/28]m/mol
B. [1/22.4]m/mol
C. 22.4m
D. 22.4m/mol workdayout1年前1
workdayout1年前1 -
 hayeshe 共回答了14个问题
hayeshe 共回答了14个问题 |采纳率100%解题思路:根据标况下气体摩尔体积与氮气的体积计算出氮气分子的物质的量,再根据N=nNA计算出阿伏伽德罗常数即可.在标准状况下,1LN2的物质的量为:[1L/22.4L/mol]=[1/22.4]mol,
根据N=nNA可得:NA=[N/n]=[m
1/22.4mol]=22.4m/mol,
故选D.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算,难度中等,注意明确阿伏伽德罗常数的概念及计算方法,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.1年前查看全部
- 设N A 表示阿伏加德罗常数的值,下列叙述正确的是 [ ] A.常温下,
设N A 表示阿伏加德罗常数的值,下列叙述正确的是 [ ]A.常温下,1 L 0.1 mol/L的NH 4 NO 3 溶液中,NH 4 + 和NO 3 - 的总数为0.2N A
B.标准状况下,4.48 L重水(D 2 O)中含有的中子数为2N A
C.在反应KIO 3 +6HI=KI+3I 2 +3H 2 O中,每生成3 mol I 2 转移的电子数为5N A
D.标准状况下,22.4 L NO和11.2 L O 2 充分反应,所得气体中NO 2 的分子数为N A 1年前1
1年前1 -
 lijiayang1 共回答了22个问题
lijiayang1 共回答了22个问题 |采纳率90.9%C1年前查看全部
- 若NA表示阿伏加德罗常数的值,下列说法错误的是( )
若NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.NA个氧气分子与NA个氖气分子的质量比是8:5
B.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
C.标准状况下,22.4 L H2和Cl2的混合气体中含有的分子数为2NA
D.标准状况下,11.2 L CO2与常温常压下8.5 g NH3所含分子数相等 yiyi乙乙1年前1
yiyi乙乙1年前1 -
 leois2005 共回答了24个问题
leois2005 共回答了24个问题 |采纳率91.7%解题思路:A、根据n=
计算出氧气和氖气的物质的量,再计算出二者质量之比,注意稀有气体为单原子分子;N NA
B、根据n=
计算出混合气体的物质的量,再根据二氧化氮和二氧化碳的分子组成计算出氧原子数目;N NA
C、根据标况下的气体摩尔体积计算出混合气体的物质的量及含有的分子数;
D、先计算出二氧化碳和氨气的物质的量,二者物质的量相等,含有的分子数一定相同.A、NA个氧气分子的物质的量为1mol,质量为32g;NA个氖气分子的物质的量为1mol,质量为20g,二者质量比是:32g:20g=8:5,故A正确;B、分子总数为NA的NO2和CO2混合气体的物质的量为1mol,1mol混合气体含有2mol氧原子...
点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,既要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
- 阿伏伽德罗常数一道选择题下列关于阿伏加德罗常数(NA)的说法正确的是( )A.1mol37(37为质量数)Cl中含有20
阿伏伽德罗常数一道选择题
下列关于阿伏加德罗常数(NA)的说法正确的是( )
A.1mol37(37为质量数)Cl中含有20NA个质子
B.20g2(质量数)H216(质量数)O中含有10NA个电子
C.26g26(质量数)Mg2+中含有26NA个中子
D.18(质量数)O中含有10NA个中子
为什么答案是B? 0p1361年前1
0p1361年前1 -
 xieshiye9980 共回答了13个问题
xieshiye9980 共回答了13个问题 |采纳率76.9%下列关于阿伏加德罗常数(NA)的说法正确的是( ) A.1mol37(37为质量数)Cl中含有20NA个质子 B.20g2(质量数)H216(质量数)O中含有10NA个电子 C.26g26(质量数)Mg2+中含有26NA个中子 D.18(质量数)O中含有10NA个中子 为...1年前查看全部
- (2013•常德模拟)用NA表示阿伏加德罗常数,则下列说法正确的是( )
(2013•常德模拟)用NA表示阿伏加德罗常数,则下列说法正确的是( )
A.1mol/L Na2SO4溶液中有2NA个Na+
B.18gD2O含有的电子数为10NA
C.0.3molO2与4.48LO3所含的氧原子数一定相等
D.标准状况下11.2 L氮气和氧气的混合气体所含原子数为NA 江山101年前1
江山101年前1 -
 herjoe 共回答了14个问题
herjoe 共回答了14个问题 |采纳率85.7%解题思路:A、硫酸钠溶液的体积不知,无法计算硫酸钠中钠离子的数目;
B、重水中含有10个电子,18g重水的物质的量为0.9mol;
C、没有告诉是标准状况下,不能使用标况下的气体摩尔体积计算臭氧的物质的量;
D、氮气和氧气都是双原子分子,根据标况下的气体摩尔体积计算出11.2L氮气和氧气的物质的量.A、没有告诉1mol/L Na2SO4溶液的体积,无法计算硫酸钠的物质的量及钠离子的数目,故A错误;
B、18g重水的物质的量为0.9mol,0.9mol重水中含有9mol电子,含有的电子数为9NA,故B错误;
C、没有告诉是标况下,题中条件无法计算臭氧的物质的量,故C错误;
D、标况下11.2L氮气和氧气的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,所含原子数为NA,故D正确;
故选D.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件;注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,也要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
- 1.设NA表示阿伏加德罗常数,下列说法中错误的是 A.常温常压下,22.4L氮气所含分子数小于NA个
1.设NA表示阿伏加德罗常数,下列说法中错误的是 A.常温常压下,22.4L氮气所含分子数小于NA个
1.设NA表示阿伏加德罗常数,下列说法中错误的是 A.常温常压下,22.4L氮气所含分子数小于NA个 B.1molCl2通入足量水中电子转移数为NA个 C.1molSiO2中含有4 molSi-O键 D.12g金刚石含有NA个碳原子
2..A与B在溶液中进行反应,无论A与B的物质的量之比如何,都可以用所示的离子方程式表示的是
A.碘化钾与氯气:5I-+3Cl2-+3H2O → IO3-+ 6Cl- + 6H+ B.KAl(SO4)2与Ba(OH)2:2Ba2+ + 4OH– + Al3+ + 2SO42–→2BaSO4↓+ AlO2– + 2H2O C.氨水与SO2:NH3·H2O + SO2 → HSO3- + NH4+ D.NaAlO2与AlCl3:Al3+ + 3AlO2- +6H2O→ 4Al (OH)3↓ hwwq30001年前1
hwwq30001年前1 -
 dxmjxs 共回答了14个问题
dxmjxs 共回答了14个问题 |采纳率92.9%1.A.常温常压下,22.4L氮气所含分子数小于NA个,这个到底是小于大于还是等于都是可能的,由PV=nRT,V/n=RT/P是变大还是变小是不确定的,因为在标准状况下,V/n=22.4的,常温常压下22.4L氮气所含分子数是大于小于还是等于NA个不确定
B.1molCl2通入足量水中电子转移数为NA个,H2O+Cl2=HCl+HClO 1molCl2只转移了1mol电子,正确
C.1molSiO2中含有4 molSi-O键,SiO2中Si都是以Si—O单键结合的,每个Si都形成了4个Si—O单键,1molSiO2中含有4 molSi-O键正确
D.12g金刚石含有NA个碳原子,12g金刚石就是1mol,含NA个碳原子正确
选A
2.A.碘化钾与氯气:5I-+3Cl2-+3H2O → IO3-+ 6Cl- + 6H+,这个碘离子的氧化产物有多种,比如氧化产物是I2,与Cl2用量有关,所以不能始终用这个方程式表示,
KAl(SO4)2与Ba(OH)2:2Ba2+ + 4OH– + Al3+ + 2SO42–→2BaSO4↓+ AlO2– + 2H2O,Ba(OH)2足量用这个表示,少量Ba(OH)2是不会生成AlO2–而是Al(OH)3,所以不合题意
C.氨水与SO2:NH3·H2O + SO2 → HSO3- + NH4+,SO2足量用这个,SO2少量只能生成
SO3 2—,所以不合题意
D.NaAlO2与AlCl3:Al3+ + 3AlO2- +6H2O→ 4Al (OH)3↓这个是不用哪个多少都是这样反应的,不能发生其它的反应,符合题意
选D1年前查看全部
- 什么叫做“把含有阿伏加德罗常数个微粒的集合体计量为1mol"
什么叫做“把含有阿伏加德罗常数个微粒的集合体计量为1mol"
怎么推导出这个,还是课本规定的?怎么理解这句话,举些例子. 宇宙351年前1
宇宙351年前1 -
 桃花一朵朵 共回答了22个问题
桃花一朵朵 共回答了22个问题 |采纳率95.5%没分,采纳也行.阿伏加德罗常数定义:一摩尔某种物质所含有微粒数,大小为6.02乘以10的23次方每摩尔.如一摩尔氧气含有6.02乘以10的23次方个氧分子(O2),1年前查看全部
- 阿伏加德罗常数约为6.02×10 23 mol - 1 ,下列叙述正确的是 A.2.24 L CO 2 中含有的原子数为
阿伏加德罗常数约为6.02×10 23 mol - 1 ,下列叙述正确的是
A.2.24 L CO 2 中含有的原子数为0.3×6.02×10 23 B.0.1 L 3 mol·L - 1 的NH 4 NO 3 溶液中含有的NH 4 + 数目为0.3×6.02×10 23 C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×10 23 D.4.5 g SiO 2 晶体中含有的硅氧键数目为0.3×6.02×10 23  utadaye1年前1
utadaye1年前1 -
 ff1979129 共回答了19个问题
ff1979129 共回答了19个问题 |采纳率89.5%D,所以
A不正确,因为不一定是在标准状况下。硝酸铵水解,所以0.1 L 3 mol·L - 1 的NH 4 NO 3 溶液中含有的NH 4 + 数目小于0.3×6.02×10 23 ,B不正确。C不正确,如果铁过量,则失去2个电子。SiO 2 晶体中每个硅原子形成4个硅氧键,4.5g二氧化硅是0.075mol,所以D正确,答案选D。1年前查看全部
- 下列说法不正确的是( )A.6.02×1023就是阿伏加德罗常数B.0.012 kg 12C含有的碳原子数就是阿伏加德
下列说法不正确的是( )
A.6.02×1023就是阿伏加德罗常数
B.0.012 kg 12C含有的碳原子数就是阿伏加德罗常数的值
C.含有阿伏加德罗常数个粒子的物质的量是1 mol
D.1 mol NH3所含原子数约是2.408×1024 270fever1年前1
270fever1年前1 -
 WODUNIKING 共回答了20个问题
WODUNIKING 共回答了20个问题 |采纳率75%解题思路:A.根据阿伏伽德罗常数的近似值来判断;
B.根据0.012kg12C含有的碳原子数判断;
C.含有阿伏伽德罗常数个微粒的物质的量就是1mol;
D.根据N=nNA结合氨气分子的构成计算.A.阿伏伽德罗常数的近似值为6.02×1023,但6.02×1023不是阿伏伽德罗常数,故A错误;
B.0.012kg12C的物质的量是1mol,所以0.012kg12C含有的碳原子数就是阿伏加德罗常数,故B正确;
C.含有阿伏伽德罗常数个微粒的物质的量就是1mol,故C正确;
D.N=nNA=1mol×NA/mol=NA,一个氨气分子中含有4个原子,所以1molNH3所含原子数约是2.408×1024,故D正确.
故选A.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的有关知识,难度不大,注意:阿伏伽德罗常数与6.02×1023关系为解答中的易错点.1年前查看全部
- 下列叙述正确的是( ) A.6.02×10 23 叫做阿伏加德罗常数 B.摩尔(mol)是国际单位制中七个基本单位之一
下列叙述正确的是( ) A.6.02×10 23 叫做阿伏加德罗常数 B.摩尔(mol)是国际单位制中七个基本单位之一 C.H 2 SO 4 的摩尔质量(M)是98 D.气体摩尔体积(V m )是指1 mol任何气体所占的体积都约为22.4 L  juniper0001年前1
juniper0001年前1 -
 还是不够坚强 共回答了17个问题
还是不够坚强 共回答了17个问题 |采纳率82.4%A、单位物质的量的物质含有的粒子数叫阿伏加德罗常数阿伏伽德罗常数,故A错误;
B、物质的量是国际单位制中七个基本物理量之一,摩尔是物质的量的单位,故B正确;
C、硫酸的摩尔质量是98g/mol,故C错误;
D、标准状况下,1 mol任何气体所占的体积都约为22.4 L,气体摩尔体积是指单位物质的量的物质所占有的体积,故D错误.
故选B.1年前查看全部
- 用 N A 表示阿伏加德罗常数,下列说法正确的是( ) A.22.4L O 2 的分子数约为 N A B.标准状况下
用 N A 表示阿伏加德罗常数,下列说法正确的是()
A.22.4L O 2 的分子数约为 N A B.标准状况下,11.2L H 2 O的分子数约为0.5 N A C.1 L 1mol/L的NaOH溶液中Na + 的数目为 N A D.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1 N A  沧海飘飘1年前1
沧海飘飘1年前1 -
 macdull 共回答了19个问题
macdull 共回答了19个问题 |采纳率84.2%C
A中没有指明状态,不正确。B中水不是气体,不正确。铁和盐酸反应,转移电子是2个,D不正确,答案选C。1年前查看全部
- 用 N A 表示阿伏加德罗常数的值,下列说法中正确的是 A.1 mol O 3 所含有的原子数为3 N A B.18克H
用 N A 表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol O 3 所含有的原子数为3 N A B.18克H 2 O中,原子数为2N A C.22.4 L氯化氢所含的原子数为2 N A D.N A 个 CH 4 分子的质量为16g/mol  kangzhuang20061年前1
kangzhuang20061年前1 -
 哇来了 共回答了17个问题
哇来了 共回答了17个问题 |采纳率94.1%A
18克H 2 O中,原子数为3N A ,22.4 L氯化氢不是标准状态,不是1 mol,N A 个 CH 4 分子的质量为16g1年前查看全部
- (2012•闸北区二模)NA表示阿伏加德罗常数,下列叙述中正确的是( )
(2012•闸北区二模)NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下2.24L三氯甲烷含有分子数目为0.1NA
B.标准状况下1.8 g H2O含有分子数目为0.1NA
C.3.2 g硫与铜充分反应,电子转移总数为0.1NA
D.常温下,100mL lmol/L的Na2CO3溶液中的阴离子数目大于0.1NA 8xzd01年前0
8xzd01年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- N A 为阿伏加德罗常数,下列说法正确的是 ( ) A.标准状况下,11.2
N A 为阿伏加德罗常数,下列说法正确的是 ()
A.标准状况下,11.2 L的己烷所含的分子数为0.5 N A B.28 g乙烯所含共用电子对数目为4 N A C.0.1molC n H 2n+2 中含有的C-C键数为0.1n N A D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 N A  兰香默默1年前1
兰香默默1年前1 -
 小贝丢丢 共回答了11个问题
小贝丢丢 共回答了11个问题 |采纳率90.9%1年前查看全部
- 1mol物质微粒的质量=原子真实质量*阿伏加德罗常数
 mm饿鬼1年前3
mm饿鬼1年前3 -
 tongtong_2004 共回答了12个问题
tongtong_2004 共回答了12个问题 |采纳率91.7%1mol的物质微粒的个数等于阿伏伽德罗常数,每个微粒的真实质量乘以总数量就等于总质量.1年前查看全部
- 标准状况下22.4L水所含的分子数为什么不能表示阿伏加德罗常数数值?
 xx天才预言家1年前5
xx天才预言家1年前5 -
 zsw2381376 共回答了9个问题
zsw2381376 共回答了9个问题 |采纳率88.9%因为标况下是指(273K、101kpa)下,也就是0摄氏度,一个标准大气压下,此时水的状态有三种情况:固态,液态,固液共存态.但都不是气态.而气体摩尔体积仅用于气态物质,所以喽.1年前查看全部
- 设阿伏加德罗常数为NA,下列说法正确的是( )
设阿伏加德罗常数为NA,下列说法正确的是( )
A.2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA
B.常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA
C.常温常压下,22.4L的氧气中含氧原子数为2NA
D.18g H2O含有的电子数8NA Deborah_dong1年前1
Deborah_dong1年前1 -
 534504685 共回答了17个问题
534504685 共回答了17个问题 |采纳率94.1%解题思路:A.镁为2价金属,0.1mol镁完全反应失去0.2mol电子;
B.根据n=cV计算出氯化镁的物质的量,0.2mol氯化镁中含有0.4mol氯离子;
C.常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算氧气的物质的量;
D.水分子中含有10个电子,18g水的物质的量为1mol,含有10mol电子.A.2.4g镁的物质的量为0.1mol,0.1mol镁与足量盐酸反应生成0.1mol氢气,失去0.2mol电子,反应失去电子数为0.2NA,故A正确;B.1L 0.2mol/L MgCl2溶液中含有0.2mol氯化镁,0.2mol氯化镁中含有0.4mol氯离子,含Cl...
点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意氯化镁的化学式组成情况.1年前查看全部
- 设N A 为阿伏加德罗常数,下列说法正确的是( ) A.23g钠在氧气中完全燃烧失去电子数为N A B.1L2mol/
设N A 为阿伏加德罗常数,下列说法正确的是( ) A.23g钠在氧气中完全燃烧失去电子数为N A B.1L2mol/L的MgCl 2 溶液中含Mg 2+ 数为2N A C.标准状况下,11.2LH 2 O所含分子数为0.5N A D.分子数为N A 的CO气体质量为28g  ggq11051年前1
ggq11051年前1 -
 wuhao929 共回答了25个问题
wuhao929 共回答了25个问题 |采纳率88%A、23g钠的物质的量为n(Na)=
23g
23g/mol =1mol,失去电子的数目为1×1mol× N A mol -1 =N A ,故A正确;
B、1L2mol/L的MgCl 2 溶液溶质的物质的量为n(MgCl 2 )=1L×2mol/L=2mol,假定Mg 2+ 不水解,溶液中Mg 2+ 的数目为N(Mg 2+ )=2mol× N A mol -1 =2N A ,由于Mg 2+ 离子水解,溶液中Mg 2+ 离子数目小于2N A ,故B错误;
C、标准状况下,H 2 O是液体,不能使用气体摩尔体积v m =22.4L/mol,11.2LH 2 O的物质的量不是0.5mol,含有的分子数不是0.5N A ,故C错误;
D、分子数为N A 的CO气体的物质的量为n(CO)=
N A
N A mol -1 =1mol,其质量为m(CO)=1mol×28g/mol=28g,故D正确.
故选AD.1年前查看全部
- NA 表示阿伏加德罗常数,下列说法中正确的是 ( )
NA 表示阿伏加德罗常数,下列说法中正确的是 ( )
用 NA 表示阿伏加德罗常数,下列说法中正确的是 ( )
A.标准状况下,22.4L H2O 含水分子数约为 6.02*10^23
B.32 g 氧气中所含氧原子数为 NA
C.500 mL 0.5 mol·L-1 Al2(SO4)3溶液中,SO4(2-)的浓度为 1.5 mol·L-1
D.1.7 g 氨气所含的电子数为 10 NA
B和D错在哪?正确的应该是怎样算的?用什么公式?
C 怎么判断?用什么公式?步骤是怎样的..
希望有人帮忙,短时间里一定采纳, ff的脚底板1年前4
ff的脚底板1年前4 -
 douloveljy 共回答了22个问题
douloveljy 共回答了22个问题 |采纳率90.9%A. 标准状况下, 只有22.4L 气体 含分子数约为 6.02*10^23
B 氧气结构为O2,故32g 氧气含氧原子数为2NA,氧分子为NA个
D 1.7 g 氨气为0.1 mol,1 mol氨气含有10 NA个电子,所以1.7 g 氨气所含的电子数为1 NA
C SO4(2-)的浓度是Al2(SO4)3的浓度的3倍
故SO4(2-)的浓度=0.5*3=1.5 mol·L-11年前查看全部
- 1.阿伏加德罗常数(NA)与物质的量(n)的关系.
1.阿伏加德罗常数(NA)与物质的量(n)的关系.
2.n=N/NA=V/Vm n=m/M n=V/Vm这几个公式到底什么意思?有何联系?说得简单易懂些
3.等质量的SO2和SO3物质的量之比?
4.等体积的O2和O3物质的量之比?别只给个答案.
..我好困苦.呃 sail151年前1
sail151年前1 -
 bluebabyvivian 共回答了12个问题
bluebabyvivian 共回答了12个问题 |采纳率83.3%1.NA表示一摩尔物质所含的微粒数
比如2molFe 中含有2N=2*6.02*10^23个铁原子
2.N表示粒子总数,所以物质的量=粒子总数/一摩尔物质所含的粒子数
即n=N/NA
物质的量=物质实际质/物质的摩尔质量(就是一摩尔该物质的质量) 即n=m/M
3.设质量为m
SO2的摩尔质量为64g/mol SO3的摩尔质量为80g/mol
所以相同质量下
n(SO2)=m/64 n(SO3)=m/80
n(SO2)/n(SO3)=5/4
4.在相同状态下1mol气体的体积是一样的 无论气体种类
所以等体积的O2和O3的物质的量是一样的1年前查看全部
- (2014•四川模拟)设NA为阿伏加德罗常数的值.下列叙述正确的是( )
(2014•四川模拟)设NA为阿伏加德罗常数的值.下列叙述正确的是( )
A.在标况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA
B.常温常压下,16g O3所含的电子数为8NA
C.0.1mol Na2O2晶体中含有0.4NA个离子
D.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA 撒旦的哥哥1年前1
撒旦的哥哥1年前1 -
 小豌豆莉莉 共回答了20个问题
小豌豆莉莉 共回答了20个问题 |采纳率90%解题思路:A.二氧化氮与四氧化二氮存在转化平衡,导致气体的分子数减小;
B.16g臭氧中含有16g氧原子,含有1mol氧原子,1mol氧原子含有8mol电子;
C.过氧化钠中的离子为钠离子和过氧根离子,0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,总共含有0.3mol离子;
D.生成1mol氢气需要转移2mol电子.A.标况下,11.2L气体的物质的量为0.5mol,0.5mol一氧化氮消耗0.25mol氧气生成0.5mol二氧化氮,氧气剩余0.25mol,由于部分二氧化氮转化成四氧化二氮,所以反应后的气体的物质的量小于0.75mol,所含分子数小于0.75NA,故A错误;
B.16g臭氧中含有16g氧原子,含有氧原子的物质的量为1mol,含有8mol电子,所含的电子数为8NA,故B正确;
C.0.1mol过氧化钠中含有0.2mol钠离子和0.1mol过氧根离子,总共含有阴阳离子总物质的量为0.3mol,含有0.3NA个离子,故C错误;
D.生成1mol氢气,得到了2mol电子,根据电子守恒,转移了2mol电子,转移的电子数为2NA,故D错误;
故选B.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项A为易错点,注意二氧化氮与四氧化二氮之间存在转化平衡.1年前查看全部
- (2014•德庆县一模)设NA为阿伏加德罗常数的值.下列说法正确的是(C-12 H-1 N-14 O-16)( )
(2014•德庆县一模)设NA为阿伏加德罗常数的值.下列说法正确的是(C-12 H-1 N-14 O-16)( )
A.1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA
B.12g碳含有的电子数为4NA
C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA viki0081年前1
viki0081年前1 -
 -宫- 共回答了16个问题
-宫- 共回答了16个问题 |采纳率81.3%解题思路:A.次氯酸钠溶液中,次氯酸根离子部分水解,溶液中次氯酸根离子减少;
B.12gC的物质的量为1mol,1molC原子中含有6mol电子;
C.氮气和一氧化碳的摩尔质量都是28g/mol,14g二者的混合物的物质的量为0.5mol,含有1mol原子;
D.标况下6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸,转移了0.2mol电子.A.次氯酸钠溶液中,次氯酸根离子发生水解,无法计算溶液中次氯酸根离子的物质的量及数目,故A错误;
B.12gC的物质的量为1mol,含有6mol碳原子,含有的电子数为6NA,故B错误;
C.14gN2与CO组成的混合气体的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,含有的原子数目为NA,故C正确;
D.标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,转移了0.2mol电子,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
- 阿伏加德罗常数约为6.02×10 23 mol ,下列说法中正确的是 A.1 mol Cl 2 与足量铁反应转移的电子数
阿伏加德罗常数约为6.02×10 23 mol
 ,下列说法中正确的是
,下列说法中正确的是A.1 mol Cl 2 与足量铁反应转移的电子数是3×6.02×10 23 B.常温、常压下,6.02×10 23 个甲醛分子所占的体积大于22.4L C.3.4g H 2 O 2 中共价键数为0.1×6.02×10 23 D.1 mol氧单质含有的原子数是l mol氖气含有的原子数的两倍  龙云剑飞1年前1
龙云剑飞1年前1 -
 doreenly 共回答了16个问题
doreenly 共回答了16个问题 |采纳率100%B
1molCl 2 与足量铁反应转移的电子数是2×6.02×10 23 ,A错;常温、常压与标准状况相比,压强基本相同,温度较高,所以此时1摩尔气体所占体积比标准状况大,B正确;一个H 2 O 2 分子中有3个共价键,所以0.1molH 2 O 2 中含有的共价键数为0.3×6.02×10 23 ,C错;氧单质有O 2 与O 3 ,所以1摩尔氧单质中氧原子数不可确定,D错。1年前查看全部
- 1g氮气含有n个分子,则阿伏加德罗常数是多少
1g氮气含有n个分子,则阿伏加德罗常数是多少
我要懂的 希望笔笔快乐1年前1
希望笔笔快乐1年前1 -
 异乡之恋 共回答了14个问题
异乡之恋 共回答了14个问题 |采纳率85.7%1NA个氮气分子是28g,所以NA/28=n.NA=28n1年前查看全部
- (2009•宿迁二模)设阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
(2009•宿迁二模)设阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
A.常温下,4.4gCO2和N2O混合物中所含有的原子数约为0.3×6.02×1023
B.足量的锌与一定量的浓硫酸充分反应,放出 2.24L气体时,转移电子数约为0.2×6.02×1023
C.标准状况下,2.24L乙烷中含有的非极性键数约为0.7×6.02×1023
D.含1mol硅原子的SiO2晶体中Si-O键的个数约为2×6.02×1023 kfc天河城1年前1
kfc天河城1年前1 -
 lwm858 共回答了10个问题
lwm858 共回答了10个问题 |采纳率80%解题思路:A、4.4gCO2和N2O摩尔质量都为44g/mol,依据n=[m/M]计算物质的量结合分子式计算原子数;
B、锌和浓硫酸反应生成二氧化硫气体,随反应进行浓硫酸变为稀硫酸和锌反应生成气体为氢气,气体温度压强未知,气体体积不能计算物质的量;
C、依据n=[m/M]计算物质的量结合乙烷分子结构计算非极性键 数;
D、依据二氧化硅结构分析判断;A、CO2和N2O摩尔质量都为44g/mol,4gCO2和N2O物质的量0.1mol,混合物中所含有的原子数约为0.3×6.02×1023,故A正确;
B、足量的锌与一定量的浓硫酸充分反应,放出 2.24L气体时,温度压强不知,转移电子数不是0.2×6.02×1023,故B错误;
C、标准状况下,2.24L乙烷物质的量为0,1mol.分子中含有的非极性键数约为0.1×6.02×1023,故C错误;
D、含1mol硅原子的SiO2晶体中Si-O键的个数约为4×6.02×1023,故D错误;
故选A.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的分析判断,主要是质量换算物质的量计算微粒数的方法,气体摩尔体积的条件应用,二氧化硅结构分析,题目难度中等.1年前查看全部
- 设N A 为阿伏加德罗常数的值,下列关于0.2 mol/L Ba( NO 3 ) 2 溶液的说法中不正确的是 [
设N A 为阿伏加德罗常数的值,下列关于0.2 mol/L Ba( NO 3 ) 2 溶液的说法中不正确的是 [ ]
A.2 L溶液中阴、阳离子的总数为1.2N A
B.500 mL溶液中NO 3 - 的浓度为0.2 mol/L
C.500 mL溶液中Ba 2+ 的浓度为0.2 mol/L
D.500 mL溶液中NO 3 - 的总数为0.2N A muma42851年前1
muma42851年前1 -
 艺术手法 共回答了15个问题
艺术手法 共回答了15个问题 |采纳率93.3%B1年前查看全部
- 若某氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
若某氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
A. 氖元素的相对原子质量一定是12a/b
B. 该氖原子的摩尔质量是aNAg
C. Wg该氖原子的物质的量一定是[WaNA  jmslw1年前3
jmslw1年前3 -
 863120219 共回答了11个问题
863120219 共回答了11个问题 |采纳率81.8%解题思路:A、根据元素的相对原子质量含义计算;
B、依据摩尔质量概念分析计算;
C、根据物质的量的概念计算;
D、质量换算为物质的量进而计算质子数;A、氖原子的相对原子质量=
一个原子的质量/碳原子质量的1/12]=[12a/b],氖元素存在同位素,氖元素的相对原子质量是同位素所占体积分数的平均值,故A错误;
B、氖原子的摩尔质量是1mol原子的质量即aNAg•mol-1,故B错误;
C、Wg该氖原子的物质的量=[质量/摩尔质量]=[W/aNA]mol,故C正确;
D、Wg该氖原子所含质子数=1mol氖原子所含质子数×物质的量×NA=10×[W/aNA]×NA=[10w/a],故D正确;
故选CD.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了原子相对原子质量、元素相对原子质量、摩尔质量、物质的量等概念的理解与应用.1年前查看全部
- 阿伏加德罗常数是n的单位么?它们之间的关系是怎样的?
 绿豆叉烧粽1年前2
绿豆叉烧粽1年前2 -
 虾米97 共回答了19个问题
虾米97 共回答了19个问题 |采纳率78.9%阿伏伽德罗常数(符号:NA)是物理学和化学中的一个重要常量.它的数值为:一般计算时取6.02×10^23或6.022×10^23.它的正式的定义是0.012千克碳12中包含的碳12的原子的数量.n指的是物质的量.
它们之间的关系为:n=N(微粒个数)/NA(阿弗加德罗常数)1年前查看全部
- 设NA表示阿伏加德罗常数,下列叙述中正确的是
设NA表示阿伏加德罗常数,下列叙述中正确的是
A 常温常压下,11.2L氧气所含的原子数为NA
B 1.8g的NH4+离子中含有的电子数为10NA
C 含有NA个氦原子的氦气在标准状态下的体积约为22.4,
D 2.4g金属镁变为镁离子时失去的电子数为0.1NA lancome12281年前5
lancome12281年前5 -
 aszz3 共回答了20个问题
aszz3 共回答了20个问题 |采纳率85%A、错.标态是0摄氏度1大气压
B、错.0.1molNH4+中含有1mol电子,数量为Na
C、正确.He为单原子分子
D、错.一个Mg原子变为Mg2+时失去2个电子,0.1mol失去0.2mol电子,数量0.2Na1年前查看全部
大家在问
- 1用厚度为1厘米的玻璃做一个无盖的长方体容器,测得长32厘米,宽22厘米,高60厘米,这个容器可以装多少毫升
- 2500g冰,加热溶化成水,体积减少一半,质量会怎么改变.
- 3白绵羊与白绵羊交配,后代出现了白绵羊和黑绵羊,产生这种现象的根本原因是( )
- 450克等于多少斤?
- 5汉译英你过去的书是红色的吗?能不能用助动词提问?
- 6【急求】在什么情况下疑问句中要用助动词do?
- 7哈雷彗星的轨道与太阳系中那么多行星轨道相交,为什么不会撞到他们?
- 8We provided food for the hungry children
- 9the nature reserve provides a shelter for wildlife .是什么结构?主谓
- 10Many poor people have no food to eat.(同义句) Many poor people
- 11描写原野的成语急
- 12描写田野的成语
- 13根据极限定义证明:函数f(x)当x→Xo时极限存在的充分必要条件是左极限、右极限各自存在并且相等.
- 14古文中“以前”怎么说?古文中“以前”怎么表示,就是说我以前不怎么怎么样,之后怎么怎么样了.就是古文里有时候有之前怎么怎么
- 15平抛运动中求位移?的方法.