室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1*10^-24,则此溶液中可能大量共存的离子组为
 nollita2022-10-04 11:39:543条回答
nollita2022-10-04 11:39:543条回答A.HCO3-,Al 3+,Na+,SO4 2-
B.I- ,NO3- ,K+ ,NH4+
C.MnO4-,CL- ,SO4 2-,K+
D.SiO3 2-,SO3 2-,Na+,Cl-
已知25摄氏度时,AgCl的溶度积Ksp=1.8*10^10,则下列说法正确的是
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液于NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)*c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI

已提交,审核后显示!提交回复
共3条回复
 156207196 共回答了22个问题
156207196 共回答了22个问题 |采纳率72.7%- 1."水电离出来的H+和OH-浓度的乘积为1*10^-24"说明水的电离受到抑制,溶液要不是酸性的要不就是碱性的.
A.如果是酸性溶液,则HCO3-不能存在,如果是碱性溶液,Al^3+和HCO3-不能存在.
B.如果是酸性溶液,则NO3-会将I-氧化.如果是碱性溶液,NH4+不存在.
C无论酸性或者碱性溶液,都能存在.但有MnO4-时溶液呈现紫红色,所以不存在.
D.如果是酸性溶液则SiO3^2-和SO3^2-不存在,如果是碱性溶液则都能存在.
所以答案是D
2.
A.Ksp是只受温度影响的常数,所以不对.
B.加入的Ag+与Cl-的物质的量相等时才对.所以不一定,所以错误.
C.正确,因为溶解与沉淀速率相等,溶液浓度不再增加.所以是饱和溶液.
D.沉淀转化是溶解度大的沉淀转化成溶解度小的沉淀,所以应该是AgI的溶解度小于AgCl.所以错误. - 1年前
 y8jju65jrd 共回答了331个问题
y8jju65jrd 共回答了331个问题 |采纳率- 1*10^-24,
选C
向饱和AgCl水溶液中加入盐酸,Ksp值不变
AgNO3溶液于NaCl溶液混合后的溶液中,;一定有c(Ag+)将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度大于AgI
选C - 1年前
 hkdhxx 共回答了15个问题
hkdhxx 共回答了15个问题 |采纳率- 第一题
H+和OH-浓度的乘积为1*10^-24,那就是溶液显强酸或者强碱性
A。HCO3-那么无论强酸或强碱性溶液都不可以存在,A错
B。如果酸性,溶液中就相当于有硝酸,会氧化碘离子
如果碱性,NH4+ 就会变成NH3,所以B错
C。MnO4-是紫色的,题目是无色透明,C错
D。不用想,正确,排除法
答案:D
第二题
... - 1年前
相关推荐
- 室温下0.1mol/L和1mol/L醋酸溶液中H离子的浓度,前者为什么一定小于后者
 lxiaoya1年前1
lxiaoya1年前1 -
 mi2211 共回答了20个问题
mi2211 共回答了20个问题 |采纳率95%后者浓度大.1年前查看全部
- 室温下,将5.6克氧化钙投入到94.4g水中,充分搅拌,静置一段时间后,恢复到原来的温度,不计水分蒸发.下列对所得溶液的
室温下,将5.6克氧化钙投入到94.4g水中,充分搅拌,静置一段时间后,恢复到原来的温度,不计水分蒸发.下列对所得溶液的叙述正确的是
A.溶质的质量是7.4g
B.溶液的质量是100g
C.溶液为不饱和溶液
D.溶质的质量分数小于5.6%
求详解各个选项 卷帘照客1年前1
卷帘照客1年前1 -
 NEWBLACKST 共回答了21个问题
NEWBLACKST 共回答了21个问题 |采纳率100%A氧化钙与水反应生成氢氧化钙,但是氢氧化钙微溶于水,微溶的范围是20℃下100g水中溶解0.01g-1g溶质质.所以A错
B该反应中有氢氧化钙不会全部溶解,所以不对
C由1可以知道该溶液饱和了
D,氧化钙反应产物微溶最多不超过1%1年前查看全部
- 室温下,某溶液中由水电离的c(OH - )为1.0×10 -12 mol·L -1 ,下列离子在该溶液中一定能大量共存的
室温下,某溶液中由水电离的c(OH - )为1.0×10 -12 mol·L -1 ,下列离子在该溶液中一定能大量共存的是()
A.NH 4 + 、Na + 、SO 4 2- 、Cl - B.Ba 2+ 、K + 、Fe 3+ 、I - C.Ba 2+ 、K + 、Cl - 、NO 3 - D.Na + 、Ca 2+ 、Cl - 、HCO 3 -  飞象在天1年前1
飞象在天1年前1 -
 fbill 共回答了18个问题
fbill 共回答了18个问题 |采纳率88.9%C
由水电离的c(OH - )为1.0×10 -12 mol·L -1 的溶液可以是酸或碱溶液,NH 4 + 、Fe 3+ 、
HCO 3 - 与碱反应,HCO 3 - 与酸反应,而且Fe 3+ 、I - 二者可反应,因此C可共存。1年前查看全部
- 化学中常温常压和室温、标况的区别
 风情阳光1年前3
风情阳光1年前3 -
 哈哈么么 共回答了17个问题
哈哈么么 共回答了17个问题 |采纳率64.7%常温常压是指 25度 1大气压 室温也一般指25度 标况是指0度1大气压1年前查看全部
- 下列物质分别放入一密封的充满氧气的集气瓶里,充分燃烧后,冷却至室温,由于瓶内压强的明显减小,使瓶塞最难开启的是 A.木炭
下列物质分别放入一密封的充满氧气的集气瓶里,充分燃烧后,冷却至室温,由于瓶内压强的明显减小,使瓶塞最难开启的是
A.木炭 B.硫磺 C.蜡烛 D.红磷  shf771211年前1
shf771211年前1 -
 xuefeng333 共回答了21个问题
xuefeng333 共回答了21个问题 |采纳率90.5%D
木炭与氧气反应生成二氧化碳,这样就使集气瓶内的压强几乎不变,所以容易打开瓶塞,排除A项;硫磺燃烧生成二氧化硫,同上,也容易打开瓶塞,排除B项;蜡烛燃烧的产物是水和二氧化碳,并且这时水表现为水蒸气,所以这时更容易打开瓶塞,排除C项;红磷燃烧生成五氧化二磷固体,固体几乎不占体积,所以此时瓶内的压强小于外界大气压强,所以瓶塞最难开启。选D项1年前查看全部
- 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol•L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).
已知加入固体A的质量m≤3.2g时,收集到的气体为氢气;当m>3.2g时,收集到的气体来H2和H2S的混合气.试分析与计算:

(1)3.2g固体A中所含的物质有______,
(2)3.2g固体A中各物质的物质的量分别为______,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为(忽略溶液体积的变化)______;
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2时,收集到的气体体积(标准状况下)V=______mL(用含m的代数式表示). 米芽儿1年前1
米芽儿1年前1 -
 joeycheung 共回答了21个问题
joeycheung 共回答了21个问题 |采纳率100%解题思路:(1)铁粉与硫粉在隔绝空气条件下共热后所生成的产物可能有以下三种情况:一是FeS和S,二是FeS和Fe,三是FeS.由题意,产物加入到300 mL 2 mol•L-1盐酸中能够完全溶解,可得固体A中不存在单质硫(即排除了第一种情况);由题意,当m>3.2 g时,收集到气体为H2和H2S的混合气,可得出固体A是FeS和Fe的混合物;(2)依据题图可知在固体A的质量m<3.2 g时,收集到的气体只有H2,此前所生成的H2S全部溶于水中,也即当m=3.2 g时,H2S在水中的溶解达到饱和状态.根据Fe~H2可计算出铁的质量,进而计算FeS的质量,根据n=[m/M]计算各自物质的量,生成H2S的物质的量为n(H2S)=n(FeS),根据c=[n/V]氢硫酸的物质的量浓度;
(3)当m=3.2 g时,H2S在水中的溶解达到饱和.当m>3.2 g时,因H2S水溶液已经饱和,此时多余的H2S将溢出,由关系式:Fe~H2,FeS~H2S和质量守恒知:固体A和产生气体的物质的量之比为1:1,据此结合(2)中数据计算mg固体可产生H2和H2S的体积,减去溶解的硫化氢体积即为收集气体的体积.(1)铁粉与硫粉在隔绝空气条件下共热后所生成的产物可能有以下三种情况:一是FeS和S,二是FeS和Fe,三是FeS.由题意,产物加入到300 mL 2 mol•L-1盐酸中能够完全溶解,可得固体A中不存在单质硫(即排除了第一种情况);由题意,当m>3.2 g时,收集到气体为H2和H2S的混合气,可得出固体A是FeS和Fe的混合物,
故答案为:Fe、FeS;
(2)依据题图可知在固体A的质量m<3.2 g时,收集到的气体只有H2,此前所生成的H2S全部溶于水中,也即当m=3.2 g时,H2S在水中的溶解达到饱和状态,
n(H2)=0.224 L÷22.4 L•mol-1=0.01 mol,
由Fe~H2可知:m(Fe)=0.01 mol×56 g•mol-1=0.56 g
则:m(FeS)=3.2 g-0.56 g=2.64 g
故n(FeS)=2.64 g÷88 g•mol-1=0.03 mol
c(H2S)=0.03 mol÷0.3 L=0.1 mol•L-1
故答案为:n(Fe)=0.01mol、n(FeS)=0.03mol;0.1mol•L-1;
(3)当m=3.2 g时,H2S在水中的溶解达到饱和,反应生成氢气与硫化氢总体积为224mL+0.03mol×22.4L/mol×1000mL/L=896mL,
当m>3.2 g时,因H2S水溶液已经饱和,此时多余的H2S将溢出,由关系式:Fe~H2,FeS~H2S和质量守恒知:固体A和产生气体的物质的量之比为1:1,则mg固体可产生H2和H2S的体积为[mg/3.2g]×896mL=280m mL,其中有672 mL的H2S溶解在溶液中,所以,实际收集到的气体为:(280m-672)mL,
故答案为:(280m-672).点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题以两个并列化学反应为背景,考查以方程式的综合计算,涉及守恒法和极值法.同时,还考查学生的识图能力和运用数学知识解决化学问题的能力,难度中等.1年前查看全部
- 在室温下,下列五种溶液:①少.了mol/LNH了Cl②少.了
在室温下,下列五种溶液:①少.了mol/LNH了Cl②少.了mol/LCH了COONH了③少.了mol/LNH了H口O了④少.了mol/LNH了•H2O和少.了mol/LNH了Cl混合液⑤少.了mol/LNH了•H2O
请根据要求填写下列空白:
(了)溶液①呈______性(填“酸”、“碱”或“中”),其原因是______(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是______;c(NH了+)最小的是______(填序号)
(了)在溶液④中,______离子的浓度为少.了mol/L;NH了•H2O和______离子的物质的量浓度之和为少.2mol/L
(了)室温下,测得溶液②的pH=7,则CH了COO-与NH了+浓度的大小关系是:c(CH了COO-)______c(NH了+)(填“>”、“<”或“=”) 寒夜古灯1年前1
寒夜古灯1年前1 -
 花形透形花1 共回答了30个问题
花形透形花1 共回答了30个问题 |采纳率83.3%解题思路:(1)氯化铵溶液中铵根离子水解显酸性;
(2)酸溶液中氢离子浓度越大,溶液PH越小,结合铵根离子水解的影响因素分析;
(3)0.1mol/L NH3•H2O和0.1mol/L NH4Cl混合液中,氯离子不变,铵根离子水解,依据离子性质和物料守恒分析;
(4)醋酸根离子水解程度和铵根离子水解程度几乎相同.(九)氯化铵溶液j铵根离子水解显酸性,N多4++多如O⇌N多3•多如O+多+,故答案为:酸;N多4++多如O⇌N多3•多如O+多+;
(如)酸溶液j氢离子浓度越如,溶液p多越小,
①0.九mol/L N多4xl水解显酸性;
②0.九mol/L x多3xOON多4 水解相互促进程度相当容易近似为j性;
③0.九mol/L N多4多SO4 溶液j电离出氢离子显酸性,抑制铵根离子水解;
④0.九mol/L N多3•多如O和0.九mol/L N多4xl混合液,电离如于水解,铵根离子浓度如于0.九mol/L,溶液显碱性;
⑤0.九mol/L N多3•多如O是弱电解质,微弱电离生成铵根离子显碱性;
上述分析可知酸性最强的是0.九mol/L N多4多SO4溶液,铵根离子浓度最小的是0.九mol/L N多3•多如O,
故答案为:③;⑤;
(3)0.九mol/L N多3•多如O和0.九mol/L N多4xl混合液j,氯离子物质的量不变,浓度不变,浓度为0.九mol/L,铵根离子水解,一水合氨电离,电离如于水解,溶液呈碱性,依据溶液j料守恒可知,x(N多3•多如O)+x(N多4+)=0.如mol/L,
故答案为:xl-;N多4+;
(4)测得溶液②的p多=7,醋酸根离子水解程度和铵根离子水解程度几乎相同,则x多3xOO-与N多4+浓度的如小关系是相同,故答案为:=.点评:
本题考点: 盐类水解的应用;离子浓度大小的比较.
考点点评: 本题考查了盐类水解的分析,溶液中离子浓度大小分析,酸碱性判断,溶液中离子浓度大小和物料守恒分析应用,掌握基础是关键,题目较简单.1年前查看全部
- 酒精挥发有条件吗要温度低于室温吗?如果酒精温度和室温一样还会挥发吗?挥发是汽化、蒸发吗?那么不是要吸热?请问如果和室温一
酒精挥发有条件吗
要温度低于室温吗?如果酒精温度和室温一样还会挥发吗?
挥发是汽化、蒸发吗?那么不是要吸热?
请问如果和室温一样,根据热传递的原则要有温度差,那么从哪里吸热? BSBS到vv1年前3
BSBS到vv1年前3 -
 搞尸费 共回答了19个问题
搞尸费 共回答了19个问题 |采纳率100%楼主的问题很好.其实就是从周围环境总吸热.简单的道理,夏天如果你身上有水,为什么会觉得凉快点,就是因为水蒸发带走了热量,是温度降低了.酒精也一样,而且更容易挥发,所以夏天你身上撒点酒精更凉快,酒精的挥发和水的蒸...1年前查看全部
- 白磷的着火点是40℃.切一小块白磷,在25℃的室温下放在一块石棉网上,一段时间后,白磷发生自燃.
白磷的着火点是40℃.切一小块白磷,在25℃的室温下放在一块石棉网上,一段时间后,白磷发生自燃.
①引起白磷自燃的原因是______.
②写出自磷燃烧的化学方程式______. 芹菜子1年前1
芹菜子1年前1 -
 kk34 共回答了11个问题
kk34 共回答了11个问题 |采纳率81.8%解题思路:白磷在空气中容易发生缓慢氧化,白磷的着火点是40℃,很容易发生自燃生成五氧化二磷因白磷的着火点是40℃,白磷在空气中缓慢氧化,产生的热量使白磷达到着火点而发生自燃;其反应的化学方程式为:4P+5O2═2P2O5.
故答案为:(1)白磷在空气中缓慢氧化,产生的热量使白磷达到着火点,于是发生自燃.(2分)
(2)4P+5O2═2P2O5(2分)点评:
本题考点: 燃烧与燃烧的条件;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题的关键是要掌握化学方程式的书写方法和白磷的性质方面的知识,只有这样才能对问题做出正确的判断.1年前查看全部
- (2014•嘉定区二模)室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
(2014•嘉定区二模)室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
A.用相同浓度的HNO3溶液中和,硝酸体积小于氨水时,溶液可能呈中性
B.温度不变,加水稀释后溶液中c(NH4+)•c(OH-)不变
C.加水稀释后,溶液中导电粒子的数目减少
D.其溶液的pH=13 laizhiyan1年前1
laizhiyan1年前1 -
 tiantian45054 共回答了23个问题
tiantian45054 共回答了23个问题 |采纳率95.7%解题思路:A.硝酸铵溶液呈酸性,要使溶液呈中性,氨水稍微过量;
B.加水稀释促进一水合氨电离,溶液中c(NH4+)、c(OH-)都减小;
C.加水稀释后,溶液中c(H+)增大;
D.一水合氨为弱电解质,在水溶液里部分电离.A.硝酸铵溶液呈酸性,要使溶液呈中性,氨水稍微过量,二者浓度相等,所以硝酸体积小于氨水时,溶液可能呈中性,故A正确;
B.加水稀释促进一水合氨电离,溶液中c(NH4+)、c(OH-)都减小,则c(NH4+)•c(OH-)减小,故B错误;
C.加水稀释后,溶液中c(NH4+)、c(OH-)减小,温度不变,离子积常数不变,则c(H+)增大,故C错误;
D.一水合氨为弱电解质,在水溶液里部分电离,则该溶液中c(OH-)小于0.1mol/L,则溶液的pH<13,故D错误;
故选A.点评:
本题考点: 弱电解质在水溶液中的电离平衡;水的电离.
考点点评: 本题考查了弱电解质的电离,明确弱电解质的电离特点是解本题关键,加水稀释时,氨水中c(H+)增大,但离子积常数不变,题目难度不大.1年前查看全部
- 现有下列五种气体:h2s so2 no nh3 hcl 室温时两者相遇产生白烟的是 其水溶液露置在空气中会产生浑浊的是
 本拉芳1年前3
本拉芳1年前3 -
 MM7825 共回答了32个问题
MM7825 共回答了32个问题 |采纳率84.4%室温时两者相遇产生白烟的是 NH3 HCL
其水溶液露置在空气中会产生浑浊的是H2S
❤您的问题已经被解答~(>^ω^1年前查看全部
- (2013•黄山二模)室温下,下列各组离子、分子在指定的溶液中一定能大量共存的是( )
(2013•黄山二模)室温下,下列各组离子、分子在指定的溶液中一定能大量共存的是( )
A.Na2S溶液中:SO42-、K+、Br-、Cu2+
B.在c(H)=1.0×10-13mol•L-1的溶液中:Na+、S2-、AlO2-、SO32-
C.能使甲基橙显红色的溶液:K+、MnO4-、H2C2O4、SO42-
D.在NH3•H2O的溶液中:Ba2+、NO2-、Cl-、Ag+ 新有点乱20041年前1
新有点乱20041年前1 -
 木子鹏 共回答了16个问题
木子鹏 共回答了16个问题 |采纳率93.8%解题思路:A.离子结合生成沉淀;
B.c(H)=1.0×10-13mol•L-1的溶液,显碱性;
C.能使甲基橙显红色的溶液,显酸性;
D.NH3•H2O的溶液,Ag+不能大量存在.A.S2-、Cu2+离子结合生成沉淀,不能大量共存,故A错误;
B.c(H)=1.0×10-13mol•L-1的溶液,显碱性,该组离子之间不反应,能大量共存,故B正确;
C.能使甲基橙显红色的溶液,显酸性,H+、MnO4-、H2C2O4发生氧化还原反应,不能大量共存,故C错误;
D.NH3•H2O的溶液,Ag+不能大量存在,形成络离子,不能大量共存,故D错误;
故选B.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子的共存,为高考常见题型,侧重信息的抽取和离子反应的考查,选项C中的氧化还原为解答的难点,题目难度不大.1年前查看全部
- 再室温下,吹鼓两个气球.分别把他们放在冰箱的冷藏室和火炉附近.过了一会儿,会发现什么现象
 ufo21年前1
ufo21年前1 -
 xie626876541 共回答了19个问题
xie626876541 共回答了19个问题 |采纳率84.2%在不漏气的条件下看不出什么区别,热胀热缩是体现在微观上的.1年前查看全部
- 已知胆矾溶于水时溶液温度降低,室温下降1mol无水硫酸铜制成溶液时放出的热量为Q1.又知胆矾分解的热化学方程式为:CuS
已知胆矾溶于水时溶液温度降低,室温下降1mol无水硫酸铜制成溶液时放出的热量为Q1.又知胆矾分解的热化学方程式为:CuSO4·5H2O = CuSO4()+5H2O,吸收的热量为Q2,则Q1、Q2的大小关系是
 mengmeng1131年前2
mengmeng1131年前2 -
 vngf 共回答了17个问题
vngf 共回答了17个问题 |采纳率82.4%q2>q11年前查看全部
- 室温下,已知某溶液中由水电离出的c(H+)和c(OH-)浓度的乘积为10-24,则在该溶液中,一定不能大量存在的离子是(
室温下,已知某溶液中由水电离出的c(H+)和c(OH-)浓度的乘积为10-24,则在该溶液中,一定不能大量存在的离子是( )
A. SO32-
B. HCO3-
C. NH4+
D. NO3- smclw1年前1
smclw1年前1 -
 东窗残月 共回答了16个问题
东窗残月 共回答了16个问题 |采纳率87.5%解题思路:根据由水电离出的c(H+)和c(OH-)浓度的乘积为10-24,可知水电离的c(H+)=10-12,溶液为碱或者酸,
A、碱性溶液中可以存在;
B、碳酸氢根离子和氢氧根离子、氢离子都反应;
C、酸性溶液中可以存在;
D、硝酸根离子和氢氧根离子、氢离子都不反应.根据题中信息,水电离的c(H+)=10-12,溶溶液为碱或者酸,
A、碱溶液中可以大量存在亚硫酸根离子,故A错误;
B、由于碳酸氢根离子能够和氢氧根离子、氢离子都反应,一定不会共存,故B正确;
C、在酸性溶液中,铵离子可以大量存在,故C错误;
D、碱性、酸性溶液中硝酸根都可以大量共存,故D错误;
故选B.点评:
本题考点: 盐类水解的应用.
考点点评: 本题考查了离子共存的判断,根据水电离出的c(H+)和c(OH-)浓度的乘积为10-24,算出水电离的氢离子浓度,溶液可能显示酸性、碱性,本题难度不大.1年前查看全部
- 将少量的生石灰加到一定质量的饱和石灰水中,溶液的温度升高,再恢复到室温(不考虑水的蒸发).
将少量的生石灰加到一定质量的饱和石灰水中,溶液的温度升高,再恢复到室温(不考虑水的蒸发).
下列变化后溶液的分析错误的是A溶质的质量分数与原溶液的相同B溶剂的质量比原来溶液的减少了C溶质的质量比原溶液的减少了D析出固体的溶液是不饱和溶液 三个选项 七凌1年前1
七凌1年前1 -
 owen198351 共回答了14个问题
owen198351 共回答了14个问题 |采纳率100%溶液的温度升高,再恢复到室温,说明温度不变,溶解度不变,溶质质量分数不变,A正确.加入生石灰会与水反应,溶剂减少,析出晶体,溶液质量减少,BC正确.1年前查看全部
- 某 明天期末考试 很着急@!利用如图所示的电磁继电器,设计一个能根据室温自动控制空调机的电路,要求当温度升高到一定程度时
某 明天期末考试 很着急@!
利用如图所示的电磁继电器,设计一个能根据室温自动控制空调机的电路,要求当温度升高到一定程度时,空调的压缩机就开始工作,当低于一定温度时,压缩机就停止工作.

 准CPA1年前1
准CPA1年前1 -
 hicrownzh 共回答了16个问题
hicrownzh 共回答了16个问题 |采纳率87.5%行了 大家 我自己解决了 我 开个小号赚分 啊1年前查看全部
- 欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每
欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每种仪器只允许用一次)。请回答下列问题:
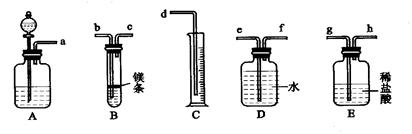
⑴假设气流方向由左向右,则各仪器的接口连接的先后顺序为a→ → →b→c→f→e→d(填写字母)。
⑵装置A中的分液漏斗中盛放的液体是 ,作用是 。
⑶连好仪器后,要进行的操作步骤有以下几步:
① 待仪器B中的物质恢复至室温时,测量量筒C中水的体积(假设将测定的体积换算成标准状况下为VmL);
② 擦掉镁条表面的氧化膜,将其置于天平上称量(假设其质量为mg),并将其投入试管B 中;
③ 检查各装置的气密性;
④ 旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。(2分)
⑷若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑸若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑹甲、乙、丙三位同学用下图装置来测定一定质量的镁完全反应后生成氢气的体积:
实验步骤如下:
① 检查装置的气密性;
② 向试管B中加入镁条;
③ 准确操作,记录C中液面刻度(C为带有刻度的量气管,D为可上下移动的水准管);
④ 由A向B中滴加稀盐酸至过量;
⑤ B中不在有气体产生并恢复至室温后,准确操作,记录C中液面刻度,计算得到气体的体积为Vml
Ⅰ、甲同学检查该装置气密性的方法是连接好装置,从D管注水,C、D两管液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平、冷至室温外,还应 ;
Ⅱ、甲同学认为镁带在实验前应打磨,目的是 ;
Ⅲ、通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ;理由是 。
Ⅳ、以上是乙、丙两位同学所用实验装置,在步骤⑤读数时所处的稳定状态图,则将会对实验结果产生的影响是(假设其余步骤完善且操作准确无误):乙 ,丙 (填“偏大”、“偏小”或“无影响”)。 水儿的家1年前1
水儿的家1年前1 -
 忘记密码uu 共回答了16个问题
忘记密码uu 共回答了16个问题 |采纳率100%⑴h、g(1分)水使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
⑶③②④① (2分)⑷偏低 ⑸偏高
⑹不变调节D管,使CD两管中液面相平
Ⅱ、除去表面的氧化层;
Ⅲ、重新实验因为中途加酸,装置中的气体会逸出
Ⅳ、偏小偏大
(1)E图中气体应该从长管进来,否则就会将液体压出去了。
(2)装置A中的分液漏斗中盛放的液体是水,其作用是可以使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
(3)先后顺序为③②④①
(4)若未将试管B冷却至室温,会导致测量的气体偏多,也就会使测得的相对原子质量会偏少,
(5)若未擦净镁条表面氧化膜就进行实验,则所测得气体质量会偏少,也就会使测得的相对原子质量会偏大,
(6)高度差不变,就说明气密性良好。调节D管,使CD两管中液面相平,这样可以消除液体压强的影响。
镁表面有氧化膜,不除掉会影响测量结果。
因为中途加酸,装置中的气体会逸出,就会使测量结果不准确。
乙同学的装置图右边液面高,就会使右边压强比左边大,会使左边测得的气体体积偏小,所以乙同学的测量结果偏小,丙同学的装置左边是密闭的,当盐酸流下后会使左边气压变小,所以最终使测量结果偏高大。1年前查看全部
- 下列各表述与示意图一致的是 A.图①表示室温时,用0.1 mol.L -1 盐酸滴定0.1 mol·L -1 NaOH溶
下列各表述与示意图一致的是

A.图①表示室温时,用0.1 mol.L -1 盐酸滴定0.1 mol·L -1 NaOH溶液过程中的pH变化 B.T℃时,反应2NO 2 (g)  N 2 O 4 (g)达到平衡时NO 2 的体积分数
N 2 O 4 (g)达到平衡时NO 2 的体积分数 (NO 2 )随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅
(NO 2 )随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅C.图③表示向绝热恒容密闭容器中通入A 2 和B 2 ,一定条件下使反应2A 2 (g)+B 2 (g)  2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量
2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g)  M x (g),t 1 时刻,保持温度不变,再充入1 mol M,重新达到平衡时
M x (g),t 1 时刻,保持温度不变,再充入1 mol M,重新达到平衡时 将增大
将增大 醒醒了1年前1
醒醒了1年前1 -
 凌一蓝 共回答了17个问题
凌一蓝 共回答了17个问题 |采纳率88.2%D
1年前查看全部
- 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:\x10想问一下 为
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:x10想问一下 为
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:x10想问一下为什么选项C为什么不是大于0.2

 _bre_bddni65b41年前3
_bre_bddni65b41年前3 -
 1g1hc 共回答了17个问题
1g1hc 共回答了17个问题 |采纳率94.1%你没有考虑体积变化 加入两种溶液后体积为原来两倍 而HA物质的量没变 浓度为原来一半1年前查看全部
- 某冷藏厂的一个冷室的室温是-2℃,现有一批食品需要在-28℃冷藏,如果每小时降温4℃,那么______小时能降到所要求的
某冷藏厂的一个冷室的室温是-2℃,现有一批食品需要在-28℃冷藏,如果每小时降温4℃,那么______小时能降到所要求的温度.
 jdxia1年前1
jdxia1年前1 -
 sqjsbaggio 共回答了11个问题
sqjsbaggio 共回答了11个问题 |采纳率90.9%解题思路:设x小时能降到所要求的温度,根据题意得出-4x-2=-28进而求出即可.设x小时能降到所要求的温度,根据题意得出:
-4x-2=-28,
解得:x=6.5,
答:6.5小时能降到所要求的温度.
故答案为:6.5.点评:
本题考点: 一元一次方程的应用.
考点点评: 此题主要考查了一元一次方程的应用,根据题意得出关于x的等式是解题关键.1年前查看全部
- 某冷库的室温为-4℃,有一批食品需要在-28℃冷藏,如果每小时降3℃,______小时能降到所要求的温度.
 千冰勇1年前1
千冰勇1年前1 -
 蓝天00白云00 共回答了14个问题
蓝天00白云00 共回答了14个问题 |采纳率100%解题思路:根据题意列出算式计算即可得到结果.根据题意得:[-4-(-28)]÷3=8(小时),
则8小时能降到所要求的温度.
故答案为:8.点评:
本题考点: 有理数的混合运算.
考点点评: 此题考查了有理数混合运算的应用,弄清题意是解本题的关键.1年前查看全部
- (2013•莆田质检)如图是家庭装修用的加热与搅拌一体化用电器简易工作原理图.工作时,先在室温下把某种液体倒人容器中,只
 (2013•莆田质检)如图是家庭装修用的加热与搅拌一体化用电器简易工作原理图.工作时,先在室温下把某种液体倒人容器中,只闭合温控开关S1,加热电热丝R1,开始加热.此时电路消耗功率为1500W.当液体达到既定温度时,温控开关S1断开,温控开关S2接通,电动机与保温电热丝R2同时正常工作,倒人固体粉末,在容器中保温并搅拌均匀,此时电路消耗总功率为1200W.已知电动机额定功率为1100W.忽略温度对电阻的影响.求:
(2013•莆田质检)如图是家庭装修用的加热与搅拌一体化用电器简易工作原理图.工作时,先在室温下把某种液体倒人容器中,只闭合温控开关S1,加热电热丝R1,开始加热.此时电路消耗功率为1500W.当液体达到既定温度时,温控开关S1断开,温控开关S2接通,电动机与保温电热丝R2同时正常工作,倒人固体粉末,在容器中保温并搅拌均匀,此时电路消耗总功率为1200W.已知电动机额定功率为1100W.忽略温度对电阻的影响.求:
(1)只闭合温控开关S1时,电路正常工作6分40秒,该过程中加热电热丝R1.产生的热量;
(2)保温电热丝R2的电阻值. soholau1年前1
soholau1年前1 -
 zhiyinmei 共回答了16个问题
zhiyinmei 共回答了16个问题 |采纳率100%解题思路:(1)只闭合温控开关S1时,加热电热丝正常工作时的功率为1500W,根据Q=W=Pt求出加热电热丝R16分40秒产生的热量;(2)温控开关S1断开,温控开关S2接通时,电动机与保温电热丝R2同时正常工作,电路消耗的总功率减去电动机的额定功率即为电热丝R2的消耗的电功率,利用并联电路的电压特点和P=U2R求出保温电热丝R2的电阻值.(1)只闭合温控开关S1时,加热电热丝正常工作时的功率为1500W,
电路正常工作6分40秒加热电热丝R1产生的热量:
Q加=W加=P加t=1500W×(6×60s+40s)=6×105J;
(2)温控开关S1断开,温控开关S2接通时,电动机与保温电热丝R2并联且同时正常工作,
保温电热丝消耗的电功率:
P保=P总-P动=1200W-1100W=100W,
∵并联电路中各支路两端的电压相等,
∴根据P=
U2
R可得,保温电热丝R2的电阻值:
R2=
U2
P保=
(220V)2
100W=484Ω.
答:(1)只闭合沮控开关S1时,电路正常工作6分40秒,该过程中加热电热丝R1产生的热量为6×105J;
(2)保温电热丝R2的电阻值为484Ω.点评:
本题考点: 电功与热量的综合计算;并联电路的电压规律;电功的计算;电功率的计算.
考点点评: 本题考查了电功公式和电功率公式以及并联电路的电压特点,关键是开关闭合、断路时电路的连接方式和工作的电路元件,要注意用电器正常工作时的功率和额定功率相等.1年前查看全部
- 液体的结冰温度最低是哪一种?在室温还呈现液体的物质,哪一种冰点温度最低?酒精?
 大蒙古1年前2
大蒙古1年前2 -
 xiangaini999 共回答了20个问题
xiangaini999 共回答了20个问题 |采纳率100%酒精的凝固点是-117℃
而水银,即汞(Hg),凝固点是-38℃ 左右
所以酒精的凝固点远低於水银.
至於楼主的问题,我一时也找不到答案.1年前查看全部
- 为什么室温下,21.0g乙烯和丁烯的混合气体含有的碳原子数目为0.2NA
 水中仙4981年前1
水中仙4981年前1 -
 寻道蚂蚁 共回答了15个问题
寻道蚂蚁 共回答了15个问题 |采纳率86.7%因为烯烃的通式为CH2,所以乙烯和丁烯都可以看作是最简式为CH2的物质,n=21g/14g/mol=1.5mol,所以n(C)=1.5mol1年前查看全部
- 称取金属、钠、铁、铝各mg,在室温下分别与VL4mol·L-1的HCl充分反应,V值的取值范围
称取金属、钠、铁、铝各mg,在室温下分别与VL4mol·L-1的HCl充分反应,V值的取值范围
(1) 铝与盐酸反应放出H2最多(2) 钠与盐酸反应放出H2最多(3) 铝、铁分别与VL盐酸反应放出氢气最多
1v大于m/92 2V小于m/92 3V大于等于m/92 fasdfewr1年前1
fasdfewr1年前1 -
 刘tt 共回答了18个问题
刘tt 共回答了18个问题 |采纳率100%Al完全反应耗HCl m/36 放出H2 m/18
Na完全反应耗HCl m/92 放出H2 m/46
Fe完全反应耗HCl m/112 放出H2 m/56
当HCl 《 m/112 时 Fe、Al放出H2== m/56 Na放出H2 m/46
当 m/112 < HCl 《m/92 时Al、Na放出H2 《 m/46 Fe放出H2 m/56
当HCl 》 m/92 时 Al 放出H2》 m/46 Na 放出H2 m/46 Fe放出H2 m/56
(1)此种情况下应该是至少HCl与Na完全反应 所以 V>m/92
(2)此种情况下应该是HCl不足 所以 V1年前查看全部
- 在室温下,发生下列几种反应:①16H + +10Z - +2XO 4 - ===2X 2 + +5Z 2 +8H 2 O
在室温下,发生下列几种反应:
①16H + +10Z - +2XO 4 - ===2X 2 + +5Z 2 +8H 2 O
②2A 2 + +B 2 ===2A 3 + +2B -
③2B - +Z 2 ===B 2 +2Z -
根据上述反应,判断下列结论错误的是 ( )A.溶液中可发生:Z 2 +2A 2 + ===2A 3 + +2Z - B.Z 2 在①、③反应中作还原剂 C.氧化性强弱的顺序为:XO 4 - >Z 2 >B 2 >A 3 + D.X 2 + 是XO 4 - 的还原产物  c__chun1年前1
c__chun1年前1 -
 woshicjs 共回答了16个问题
woshicjs 共回答了16个问题 |采纳率93.8%B
根据反应②③可知,Z 2 的氧化性强于A 3 + 的,所以选项A正确;根据氧化剂的氧化性强于氧化产物的可知,选项C正确;同样选项D中XO 4 - 是氧化剂,所以Z 2 在①中是氧化产物,所以X 2 + 是还原产物;在③中是氧化剂,B不正确,答案选B。1年前查看全部
- 室温下,用铁片与1mol•L-1稀硫酸反应制取氢气时,改用下列措施不能使氢气生成速率加快的是( )
室温下,用铁片与1mol•L-1稀硫酸反应制取氢气时,改用下列措施不能使氢气生成速率加快的是( )
A.改用热的稀硫酸
B.改用98%的浓硫酸
C.改用铁粉
D.改用2 mol•L-1硫酸 yoat1年前1
yoat1年前1 -
 荔枝后援1号 共回答了21个问题
荔枝后援1号 共回答了21个问题 |采纳率90.5%解题思路:增大反应速率可增大浓度、升高温度或增大固体的表面积,注意不能用浓硫酸,也可形成原电池反应,以此解答.A.改用热的稀硫酸,温度升高,活化分子的百分数增大,反应速率增大,故A不选;
B.改用98%的浓硫酸,铁在室温下与浓硫酸发生钝化反应,不能加快生成氢气的反应速率,故B选;
C.改用铁粉,固体表面积增大,反应速率增大,故C不选;
D.改用2 mol•L-1硫酸,浓度增大,且不影响硫酸的性质,反应速率增大,故D不选.
故选B.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与铁发生钝化反应的性质,为易错点.1年前查看全部
- 充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,得到水的质量跟原芳香烃X的质量相等.则 X的分子式是
充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,得到水的质量跟原芳香烃X的质量相等.则 X的分子式是( )
A. C10H14
B. C11H16
C. C12H18
D. C13H20 飞飏时空1年前0
飞飏时空1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,若使硝酸钾溶液变为饱和溶液,可想大烧杯中加入的固体物质是(
室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,若使硝酸钾溶液变为饱和溶液,可想大烧杯中加入的固体物质是( )
A.硝酸钾 B 氯化钠 C,硝酸铵 D.氢氧化钠
这道题的道理应该是,硝酸钾溶液溶解度减小变为饱和溶液,即温度减小,需要一个吸热的物体,我的疑问是A 和C都是吸热的物体,应该都选,为什么正确答案选C? dcboysky1年前2
dcboysky1年前2 -
 柳叶刀等号 共回答了20个问题
柳叶刀等号 共回答了20个问题 |采纳率90%你的思路是对的,但是吸热的只有硝酸铵,一般铵盐溶于水都吸热,而硝酸钾溶解并没有明显的吸热或放热,氯化钠也没有明显吸热或放热,氢氧化钠放热1年前查看全部
- 室温下,0.20 mol.L-1HCOOH的解离度为3.2%,则HCOOH的解离常数为
室温下,0.20 mol.L-1HCOOH的解离度为3.2%,则HCOOH的解离常数为
A.2.0×10-4
B.1.3×10-3
C.6.4×10-3
D.6.4×10-4 734fasdf1年前1
734fasdf1年前1 -
 一切为你我的宝贝 共回答了13个问题
一切为你我的宝贝 共回答了13个问题 |采纳率84.6%K=[H+][HCOO-]/[HCOOH]
A1年前查看全部
- 室温下测得强碱NaOH的浓度为1.0 x 10-3 mol.L-1,计算该溶液的pH.
 jingweiju1101年前1
jingweiju1101年前1 -
 pipi1288 共回答了17个问题
pipi1288 共回答了17个问题 |采纳率76.5%其中氢氧根浓度为0.001则PH为111年前查看全部
- 热熔胶在室温下为固体,加热到一定程度时变为较强粘性的液体,冷却后,将物体牢牢地粘在一起.如第37题图甲是热熔胶枪的外形,
热熔胶在室温下为固体,加热到一定程度时变为较强粘性的液体,冷却后,将物体牢牢地粘在一起.如第37题图甲是热熔胶枪的外形,其内部有2只相同的PTC加热元件,电路如第37题图乙.单只PTC元件的电阻与温度的变化如第37题图丙所示.扣动扳机能使固体胶条向前挤压,联动开关S同时倒向A、B,枪口冒出胶液,松开扳机S同时倒向B、C.
(3)试根据PTC特性定性分析装置能使温度稳定在180度附近的道理? 行行复行行1年前2
行行复行行1年前2 -
 青女_ 共回答了16个问题
青女_ 共回答了16个问题 |采纳率93.8%当PTC温度达到180摄氏度时,如果温度升高,电阻增大,由公式P=U的平方/R可知,电压U不变,电阻R增大,功率P减小,升温速度减慢.反之,温度降低,电阻减小,发热功率增大,会快速升温,这样它的温度会在180摄氏度附近稳定下来.1年前查看全部
- 加热溶解醋酸钠直到饱和,然后取溶液放冰箱里静置冷却到室温下.拿出来后向里面再丢一点醋酸钠,你说会发生什么现象?
 amyy7001年前3
amyy7001年前3 -
 vlcky 共回答了18个问题
vlcky 共回答了18个问题 |采纳率88.9%醋酸钠的溶解度是随温度升高而增加的.所以你从冰箱里拿出来的时侯有部分晶体析出了,但是你再扔进去它也是会溶解的,因为溶解析出是个动态平衡状态.饱和了不是就没有溶解发生了,只是析出的多于溶解的.
意思是溶液中溶解和析出是时时刻刻在发生.1年前查看全部
- 将N2,CO,CO2,H2的混合气体依次通入足量的石灰水和炽热的CUO后,冷却至室温,剩余气体是什么?
将N2,CO,CO2,H2的混合气体依次通入足量的石灰水和炽热的CUO后,冷却至室温,剩余气体是什么?
我知道答案,可是不知道原因,可不可以给讲一下? aprestoi1年前1
aprestoi1年前1 -
 开奥拓的女孩 共回答了20个问题
开奥拓的女孩 共回答了20个问题 |采纳率100%N2,CO2 N2不发生反应,首先CO2与石灰水反应被吸收,CO,H2与CuO反应产生CO2和H2O,冷却到室温剩下N2和CO2,水冷却1年前查看全部
- 室温下,hclo分子不可能存在于c(ohˉ)>c(h+)的溶液中这句话哪里错了
 wxywxyyd1年前1
wxywxyyd1年前1 -
 16089884 共回答了10个问题
16089884 共回答了10个问题 |采纳率90%可以存在的
NaClO水溶液呈碱性,水解得到HClO.1年前查看全部
- 关于氢氧化银(AgOH)的问题在室温下,为什么在AgNO3溶液中加入NaOH溶液,立即生成棕色Ag2O沉淀.而配制银氨溶
关于氢氧化银(AgOH)的问题
在室温下,为什么在AgNO3溶液中加入NaOH溶液,立即生成棕色Ag2O沉淀.
而配制银氨溶液的时候,在往AgNO3溶液中刚加入氨水时可以观察到明显的白色沉淀? wangrongze1年前1
wangrongze1年前1 -
 Moasky 共回答了19个问题
Moasky 共回答了19个问题 |采纳率100%如果你做的是试管反应的话,首先明确的是,即使只是“一滴”对试管反应来说也是较大的量.然后我来回答你的问题:
平衡如下:
2Ag+ + 2OH- = 2AgOH↓=Ag2O + H2O (这里用等号代替平衡符号)
如果用强碱,滴下去一滴,全部电离成OH-,OH-浓度大且不易控制,平衡迅速右移,出现Ag2O沉淀
而如果用弱碱,如烯氨水,小心慢加,维持OH-浓度在一个较低值,并且有条件的话最好将温度控制在228K以下,就可以得到白色的AgOH沉淀.
这里之所以最好要求控制低温,是因为2AgOH↓=Ag2O + H2O 的正向反应是一个熵增大的反应由△G=△H-T△S可知,温度低利于平衡左移1年前查看全部
- ===初三化学===甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.
===初三化学===甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.
甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.甲将溶液蒸发掉10g水后冷却到室温,得到晶体1.2g(晶体不含结晶水),乙将溶液蒸发掉15g水后冷却到室温,得到晶体2.4g.若两人实验结果都正确,问:
(1)室温时A物质的溶解度___________(求计算过程)
(2)A物质原溶液的质量分数___________(求计算过程)
可不可以把过程每一步写的详细一点,鄙人比较笨- . 摆渡fei1年前1
摆渡fei1年前1 -
 cd_xa 共回答了13个问题
cd_xa 共回答了13个问题 |采纳率84.6%1)室温时A物质的溶解度_(2.4g-1.2g)/(15g-10g)*100g=24g_.
(2)A物质原溶液的质量分数.
蒸发掉10g水后冷却至室温,得到晶体1.2g.溶液蒸发掉15g水后冷却至室温,得到晶体2.4g.
则 50gA物质的溶液蒸发5g水刚好饱和,溶质质量为 24g/(24g+100g)*(50g-5g)=8.7g
A物质原溶液的质量分数 8.7g/50g*100%=17.4%
肯定是对的,我有答案,对过了1年前查看全部
- 常温和室温各是多少度?这两个温度下,水的电离平衡常数有什么变化和不同?
 xiaotaohua1年前1
xiaotaohua1年前1 -
 suibian1981 共回答了21个问题
suibian1981 共回答了21个问题 |采纳率100%常温 室温
20度 25度
室温 高于 常温
水的电离平衡常数随温度升高而升高
故室温下水的电离平衡常数大1年前查看全部
- 室温下,水的电离度是多少A1×10-7 B1×10-5% C.1.8×10-7% D1.8×10-5%
 Pjan1年前2
Pjan1年前2 -
 yangshuo85112 共回答了16个问题
yangshuo85112 共回答了16个问题 |采纳率93.8%电离度=(已电离的分子数)/(原有分子总数)* 100%
设原有水1L,则水1000g,即有1000g/18(g/mol)=1000/18 mol
常温下 水电离出的c(H+)*c(OH-)=1.0x10~-14
所以
c(H+)=c(OH-)=1.0X10~-7mol/l
所以n(H+)=n(OH-)=已电离水分子=1.0X10~-7mol
所以电离度=(1.0*10~-7)/(1000/18 )*100%=1.8X10~-7%
所以选C
好运 欢迎咨询 请继续支持我们的团队1年前查看全部
- 急 室温下,如果将0.1mol/LNH4Cl和0.05mol/L的NaOH全部溶于水,形成混合溶液(假设无损)
急 室温下,如果将0.1mol/LNH4Cl和0.05mol/L的NaOH全部溶于水,形成混合溶液(假设无损)
哪两种粒子的无质量之和等于0.1mol
哪两种粒子的物质量之和比OH-多0.05mol loura琨1年前2
loura琨1年前2 -
 brtq 共回答了20个问题
brtq 共回答了20个问题 |采纳率95%若是各1L溶液混合,则NH3.H2O+NH4+=0.1mol(物料守恒)
[NH4+]+[H+]-[OH-]=0.05MOL(电荷守恒)1年前查看全部
- 急求:水在100℃时的蒸气压为多少mmHg?再问下25℃下室温蒸气压是不是760mmHg?
 独孤公子1年前1
独孤公子1年前1 -
 云南不孝子 共回答了19个问题
云南不孝子 共回答了19个问题 |采纳率94.7%水蒸气压和相对湿度的计算公式
要求水蒸气压和相对湿度时,虽然最好用通风乾湿计,但也可采用不通风乾湿计.由乾湿计计算水蒸气压和相对湿度的公式为:
1. 从通风乾湿计的度数计算水蒸气压:
(1)湿球不结冰时
e =E’w–0.5(t-t’)P/755
(2)湿球结冰时
e =E’i –0.44(t-t’)P/755
式中,
t:乾球读数(ºC)
t’:湿球读数(ºC)
E’w:t’(ºC)的水饱和蒸气压
E’i:t’(ºC)的冰饱和蒸气压
e:所求水蒸气压
P:大气压力
2. 从不通风乾湿计的度数计算水蒸气压:
(1)湿球不结冰时
e=E’ w-0.0008P(t-t’)
(2)湿球结冰时
e=E’ i-0.0007P(t-t’)
此处所用符号的意义同上.压力单位都统一用mmHg或mb.1年前查看全部
- 化学反应进行方向碳酸铵〔(NH4)2CO3〕在室温下就能自发地分解产生氨气,对其说法正确的是A.碳酸铵分解是因为生成了易
化学反应进行方向
碳酸铵〔(NH4)2CO3〕在室温下就能自发地分解产生氨气,对其说法正确的是
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解是因为外界给予了能量
C.碳酸铵分解是吸热反应,根据能量判据不能自发分解
D.碳酸盐都不稳定,都能自发分解
C和D为什么不对?
恩、D我知道啦、高温情况下CaCO3才能自发分解、
C 它不是说 “根据能量判据”了么?能量判据是说“能量判据解释方向问题、体系趋向于由能量高处向低处的转变” 那么碳酸铵分解吸热、说明是能量低处向高处的转变、根据能量判据确实说明不能自发分解啊、没错嘛 > 离去的芳草1年前3
离去的芳草1年前3 -
 好时光1 共回答了13个问题
好时光1 共回答了13个问题 |采纳率100%应该就是选A吧,这很明显就是个熵增反应.
D是很明显的不对啦,像碳酸钙就不能自发分解.
至于C,我也不清楚,要具体看
我记得好像光凭一个能量判据是不能判断反应是否能自发进行的.
有两个条件呢1年前查看全部
- 实验室配制溶液的问题.未冷却至室温就将溶液转移到容量瓶并定容.会有什么结果,为什么?
 西部传奇1年前1
西部传奇1年前1 -
 池洼胜治 共回答了9个问题
池洼胜治 共回答了9个问题 |采纳率88.9%导致溶液体积小于预期体积.原因是,高温情况下存在体积膨胀现象1年前查看全部
- 室温下,将体积相同 浓度为0.1MOL/L的盐酸和醋酸分别采取下列措施,正确的是
室温下,将体积相同 浓度为0.1MOL/L的盐酸和醋酸分别采取下列措施,正确的是
A 分别加入足量锌粉,充分反应后产生的H2一样多
B ……………(上同),反应开始时产生H2的速率相等
C分别加入NAOH固体恰好中和后,两溶液的PH相同
D 分别加水稀释100倍后,两溶液的PH:盐酸小于醋酸
ABCD请帮我分析 8inch1年前6
8inch1年前6 -
 鑫语 共回答了10个问题
鑫语 共回答了10个问题 |采纳率90%选ADA当盐酸和醋酸体积 浓度相同(即氢离子的物质的量相等)因为锌粉足量,而锌与酸反应的离子方程式是:Zn + 2H+=H2+Zn2+,所以等量的氢离子与锌反应得到的氢气是一样多的.B因为盐酸是强酸,而醋酸是弱酸,所以盐酸与锌...1年前查看全部
- 求钢的吸热Q吸=cmΔt 列;一入炉钢板 厚度为10MM 宽2000MM 长10000MM室温10° 热处理目标910°
求钢的吸热Q吸=cmΔt
列;一入炉钢板 厚度为10MM 宽2000MM 长10000MM
室温10° 热处理目标910° 需要吸收多少焦耳热量
为什么密度和比热容要乘以一千 ffliu20031年前1
ffliu20031年前1 -
 我早应该了解 共回答了16个问题
我早应该了解 共回答了16个问题 |采纳率100%钢的密度 7.85*10^3 kg·m^-3
钢的体积 0.01*2*10(m^3)
算出钢的质量 单位是kg
Q=cmΔt里面
m的单位必须是kg
因为c的单位应该是J/(kg·摄氏度)
如果是KJ/(kg·摄氏度) 那么就需要乘1000变成J
这样算出来就没问提了、
不给你算了阿 希望帮得到你1年前查看全部
- 若室温时,0.1mol/L-1的NaA溶液的pH=9,则溶液中起水解的A-占全部A-的
若室温时,0.1mol/L-1的NaA溶液的pH=9,则溶液中起水解的A-占全部A-的
百分之几? yingnini1年前4
yingnini1年前4 -
 konghl 共回答了16个问题
konghl 共回答了16个问题 |采纳率87.5%A.0.01%1年前查看全部
- 求离子的ph值室温下,两种ph不同的氢氧化钠溶液,其ph值分别为8和10 ,将这两种溶液等体混合后溶液的氢离子物质的量浓
求离子的ph值
室温下,两种ph不同的氢氧化钠溶液,其ph值分别为8和10 ,将这两种溶液等体混合后溶液的氢离子物质的量浓度最接近 0.02摩尔每升.为什么? 麻辣仙子1年前1
麻辣仙子1年前1 -
 mmddbhu 共回答了13个问题
mmddbhu 共回答了13个问题 |采纳率92.3%碱等体积混合PH=PH大的-0.3
所以PH=8 和PH=10的氢氧化钠混合PH=9.7≈0.02mol/L1年前查看全部
- 若未冷却的室温就打开止水夹,会导致测出的的氧气含量偏(高或低)
若未冷却的室温就打开止水夹,会导致测出的的氧气含量偏(高或低)
知空气的主要成分是氮气和氧气。某课外活动小组设计了测定空气氧气含量的实验,实验装置如右图所示:⑴红磷在集气瓶中发生反应的化学方程式为:__________________。
⑵待燃烧停止,白烟消失并冷却后,打开止水夹,观察到烧杯中的水进入集气瓶,瓶内水占集气瓶容积的1/5,由此可知氧气约占空气总体积的_____。由本实验还可推出氮气的哪一些性质?试写出其中的一种:_______________。
⑶若将红磷换成木炭,该实验能否获得成功?_____(填“能”“否”)理由是:___________________________________。 残梦中的悸动1年前1
残梦中的悸动1年前1 -
 309882324 共回答了16个问题
309882324 共回答了16个问题 |采纳率81.3%题目?题目?题目不知道…………
我只能告诉你,温度高的话,氧气少…………1年前查看全部
大家在问
- 1牛津小学英语4b课文第六课和第七课的课文?和E部分?
- 2碘加热为什么直接升华?为什么不熔解?
- 3平面直角坐标系难题1 平面直角坐标系中,已知A(-7,1)B(-1,1)C(-1,5)且D点坐标(x,y)满足2x+5y
- 4风迎面吹来英语英语翻译
- 5关于x的方程x²-(2m-6)+m=0两根之差为0,则m=
- 6thanks to ur hospitality,my 25-year dream finally come
- 7花发三春景色美,哥讴四化佳音多用了什么的修辞手法!
- 8坚持不懈的近义词写三个
- 9斜面越平缓越费力.这句话是对还是错?
- 10请问个问题 每个单词都会注词性 请问 vi、vt、v、a、ad各是什么词性啊
- 11持之以恒的 近义词?
- 12自西走向东边停,峨眉山上挂三星.三人同骑无角牛,口上三划一点青.50字以内
- 13we may not have caught jolin 人名前面要不要加the
- 14春节期间,物价局规定某种蔬菜的最低价格为4.1元/千克,最高价格为4.5元/千克,小王按4.1元/千克购入,若原价出售,
- 15she wore a dress to the party that was more attractive than_
