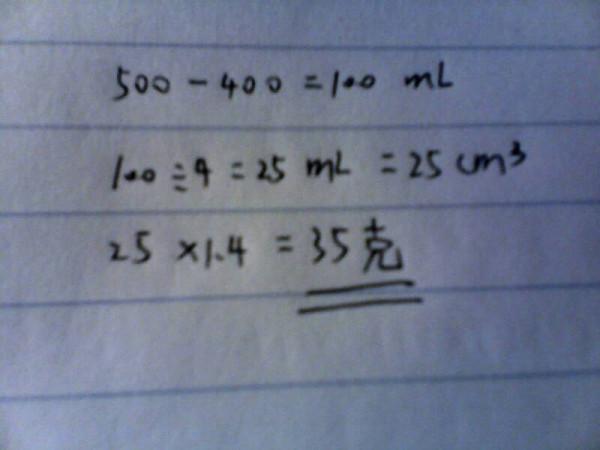含1.4克某碱金属及其氧化物的混合物跟水反应后蒸发溶液得不含结晶水固体1.7克,则混合物中碱金属质量分数
 灵光儿2022-10-04 11:39:541条回答
灵光儿2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 guxinglengyue 共回答了18个问题
guxinglengyue 共回答了18个问题 |采纳率100%- 1.7÷1.4=1.2143 所以,该碱金属是钾
【以上方法是经过不少麻烦的方法计算得到的.结果可以这样记忆:Cs 1.0 -1.1;Rb 1.1-1.2; K 1.2-1.3 ;Na 1.4-1.6;Li 1.7-3.4 常用的是钠钾】
设其中含金属钾xmol,氧化钾ymol:
39x + 94y = 1.4 56(x+2y)=1.7
以下就会了吧.
此题的问题表意不清,究竟是碱金属单质的质量分数还是碱金属元素质量分数? - 1年前
相关推荐
- 硫酸亚铁可用于治疗缺铁性贫血.(1)硫酸亚铁中铁元素的质量分数少?(2)某贫血患者共需补充1.4克铁元素,服用的药物中相
硫酸亚铁可用于治疗缺铁性贫血.
(1)硫酸亚铁中铁元素的质量分数少?
(2)某贫血患者共需补充1.4克铁元素,服用的药物中相当于硫酸亚铁多少克? mgg_19821年前1
mgg_19821年前1 -
 lianren518 共回答了21个问题
lianren518 共回答了21个问题 |采纳率100%解题思路:(1)分析题意可得要求硫酸亚铁中铁元素的质量分数即为用铁元素的质量比上硫酸亚铁的质量.
(2)已知铁元素的质量再根据铁元素的质量分数求出硫酸亚铁的质量.(1))硫酸亚铁中铁元素的质量分数=[56×1/56×1+32×1+16×4]×100%=36.8%.
答:硫酸亚铁中铁元素的质量分数为36.8%.
(2)硫酸亚铁的质量=1.4g÷36.8%=3.8g.
答:硫酸亚铁的质量为3.8g.点评:
本题考点: 元素的质量分数计算;化合物中某元素的质量计算.
考点点评: 本题主要考查元素的质量分数计算以及化合物中某元素的质量计算.1年前查看全部
- 百分比为30%的氢氧化钠溶液100公斤,其密度为1.4克每毫升,问其物质的摩尔浓度是多少?
 爱在咖啡1年前2
爱在咖啡1年前2 -
 xiapbaobao 共回答了15个问题
xiapbaobao 共回答了15个问题 |采纳率93.3%物质的摩尔浓度=物质的量/物质的体积.
NaOH溶液中所含NaOH物质的量=100*30%*1000/40=750mol(NaoH的M为40),
NaOH溶液的体积=100/1.4 L
NaOH溶液NaOH摩尔浓度=M/V=750*1.4/100=10.5mol/L1年前查看全部
- 在标准状况下,将1.4克的氮气,1.6克的氧气和4克的氩气混合,该混合气体为多少升?
在标准状况下,将1.4克的氮气,1.6克的氧气和4克的氩气混合,该混合气体为多少升?
该混合气体的平均分子量为多少? 寒江雪3691年前1
寒江雪3691年前1 -
 qq509088 共回答了19个问题
qq509088 共回答了19个问题 |采纳率100%根据理想气体状态方程PV=nRT 所以PV=P1V1+P2V2+P3V3
因为都在标况下,故总体积等于各气体体积之和1年前查看全部
- 1 氧气计算题人每天呼吸要消耗氧气360升,(设常温时密度喂1.4克每升的负一次幂)每炼10吨钢,需消耗氧气1吨,每发射
1 氧气计算题
人每天呼吸要消耗氧气360升,(设常温时密度喂1.4克每升的负一次幂)每炼10吨钢,需消耗氧气1吨,每发射一次宇宙火箭需消耗氧气约2000吨,
每发射一次宇宙火箭,耗氧量相当于-------人每天呼吸的耗氧量,每炼1吨钢的耗氧量相当于-----人每日天呼吸的耗氧量 anson_zhi1年前4
anson_zhi1年前4 -
 dontwakeup 共回答了31个问题
dontwakeup 共回答了31个问题 |采纳率87.1%都化为统一的质量上作比较就行啦.2L的回答也有问题.他的小数点保留出了大问题.
一个人一天呼吸的氧气质量是:1.4g/L* 360L=504g
然后是单位转化 : 0.1T=100kg =100000g
炼钢的换算成 人的比例 =1000000g/504g=198.413 ,去尾法,因为人头都是整数,不足就是不足,小数点即使是0.5以上,都算 不足一人,最后是198个人
因为除不尽,万万不能将小数点随便约去,因为你约去的是人啊,2000吨=2*10^9 g
除以504g=3968253.97,不足一人,同样也不能进位,因为不足就是不足,进位后反而足了.明显不对,火箭人数应该为3968253人.1年前查看全部
- 在20℃时,某物质的不饱和溶液100克,平均分成两等分.一份中加入1.4克该物质,另一份蒸发掉10克水,结果两份溶液都达
在20℃时,某物质的不饱和溶液100克,平均分成两等分.一份中加入1.4克该物质,另一份蒸发掉10克水,结果两份溶液都达到饱和,那么20℃时该物质的溶解度为( )
A,14克 B ,35克 C,70克 D,无法计算 且回答选出的答案是为什么
假设50g溶液中有xg溶质
xg+1.4g x
————==—
51.4g 40g
x=4.9g
4.9g÷40g×100=12.3
怎么没答案的..我错了?
下面的方程是我的解题 它什么地方错了?按10g水恰好能溶解1.4g该物质算1.4÷11.4×100=12.2貌似也不是A吧 我给gg咬1年前3
我给gg咬1年前3 -
 tt民航gg 共回答了16个问题
tt民航gg 共回答了16个问题 |采纳率100%最大的错误在于溶解度的计算,应该是:溶质除以溶剂再乘以100.这样,你仍然依照你的方法做X=5O分之7 50分之7再除以40减50分之7的差 最后乘100 答案选A(最后建议你做理科题目的时候中途不要约分,不仅影响答案,而且容易被扣分)希望对你有帮助,好好学习哦~1年前查看全部
- 500毫升质量分数为60%的硫酸(密度为1.4克/厘米³)中韩溶质及溶剂各多少克
500毫升质量分数为60%的硫酸(密度为1.4克/厘米³)中韩溶质及溶剂各多少克
(2)在t℃时,某物值饱和溶液中,溶质质量分数是18%,此温度下,该物质的溶解度是多少?
(3)某温度是,蒸干35克氯化钾溶液,得到10克氯化钾,求该溶液中溶质的质量分数?
(4)20℃时,50克溶质的质量分数为22%的A物质溶液,蒸发14克水后,降温至20℃,析出1克晶体,求20℃时A的溶解度? sguihyui1年前1
sguihyui1年前1 -
 怡乔 共回答了18个问题
怡乔 共回答了18个问题 |采纳率83.3%溶液质量m=ρ*v=1.4g/cm3 * 500cm3 =700g
硫酸质量m1=m*60%=700*0.6=420g
溶剂质量m2=m-m1=700-420=280g1年前查看全部
- 1 在标准状况下,将2克氦气,1.4克氮气和1.6克氧气混合,该混合气体的体积是(&
1 在标准状况下,将2克氦气,1.4克氮气和1.6克氧气混合,该混合气体的体积是( )
2 由二氧化炭,氢气,和一氧化碳组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中的二氧化碳,氢气,和一氧化碳的体积比为( ) ctcp1年前1
ctcp1年前1 -
 魑魅洛洛 共回答了13个问题
魑魅洛洛 共回答了13个问题 |采纳率100%1mol气体体积是22.4L
自己自算下吧
假设有1mol氮气,X44+2y+28z=28
X+Y+Z=1mol1年前查看全部
- 一个量筒,陈有四百毫升的水,放入四颗半径相等的玻璃珠好,水面上升到刻度是五百毫升的地方,如果一立方厘米的玻璃珠重1.4克
一个量筒,陈有四百毫升的水,放入四颗半径相等的玻璃珠好,水面上升到刻度是五百毫升的地方,如果一立方厘米的玻璃珠重1.4克,那么一颗玻璃珠的质量是多少克?
 春春001年前0
春春001年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1 在标况下,多少克硫化氢气体与1.4克的氮气所占体积相同?
1 在标况下,多少克硫化氢气体与1.4克的氮气所占体积相同?
2在标况下 多少克二氧化硫与2.8升的二氧化碳所含分子数相同? 头一次1年前4
头一次1年前4 -
 ytking1984 共回答了22个问题
ytking1984 共回答了22个问题 |采纳率77.3%1. N2的物质的量n=m/M=1.4/28=0.05mol
所以硫化氢的质量m=n×M=0.05×34=1.7g
2.CO2的物质的量n=2.8/22.4=0.125mol
所以二氧化硫的质量m=n×M=0.125×64=8g1年前查看全部
- 已知A+3B=2C+2D中,A和B的相对粒子质量之比为7:8,已知1.4克AB与一定质量的B完全反应,生成1.8克D,则
 飘0渺0峰1年前2
飘0渺0峰1年前2 -
 孔孔吼吼 共回答了18个问题
孔孔吼吼 共回答了18个问题 |采纳率88.9%A +3B= 2C+ 2D
7 3×8
1.4g 4.8g 1.8g
C的质量=1.4g+4.8g-1.8g=4.4g1年前查看全部
- 配制200ml50%(密度=1.4克/立方cm)的硫酸溶液,求需要98%的浓硫酸(密度为1.84克/cm立方)和水各多少
配制200ml50%(密度=1.4克/立方cm)的硫酸溶液,求需要98%的浓硫酸(密度为1.84克/cm立方)和水各多少克?
 easy00121年前2
easy00121年前2 -
 ID封了998 共回答了14个问题
ID封了998 共回答了14个问题 |采纳率100%需要98%的浓硫酸 x 克
200X1.4X50%=98%x
x=142.9 g
需加水:200X1.4-142.9=137.1 g1年前查看全部
- 一个量筒,盛有400毫升的水,放入4颗半径相等的玻璃球后,水面上升到500毫升的地方,如果1立方厘米的玻璃珠重1.4克,
一个量筒,盛有400毫升的水,放入4颗半径相等的玻璃球后,水面上升到500毫升的地方,如果1立方厘米的玻璃珠重1.4克,那么一颗玻璃珠的质量是多少克?
 戒不了叶子的毒1年前2
戒不了叶子的毒1年前2 -
 娜样风情 共回答了1个问题
娜样风情 共回答了1个问题 |采纳率100%1年前查看全部
- 在273K和101KPa的条件下,将2克氮气,1.4克氧气混合,该气体的体积是()
在273K和101KPa的条件下,将2克氮气,1.4克氧气混合,该气体的体积是()
A.6.72L B.7.84L C.10.08L D.13.44L pppman1年前5
pppman1年前5 -
 dd5292001 共回答了24个问题
dd5292001 共回答了24个问题 |采纳率87.5%2gN2 是0.07142 mol,1.4gO2是0.04375mol.两者之和为0.1152mol.
1mol是22.4,所以0.1152mol.是 2.58L.完毕.
要么是你的题目问题要么是你的答案问题1年前查看全部
- 配制250毫升1摩尔每升的硝酸,需要百分之63的硝酸(密度1.4克每毫升)几毫升
 爱打呼噜的熊1年前1
爱打呼噜的熊1年前1 -
 easy1900 共回答了18个问题
easy1900 共回答了18个问题 |采纳率88.9%17.85ml1年前查看全部
- 标准状况下由1.4克一氧化碳和4.4克二氧化碳组成的混合气体密度是多少?
 磋人1年前3
磋人1年前3 -
 beatles19 共回答了15个问题
beatles19 共回答了15个问题 |采纳率100%1.4克一氧化碳和4.4克二氧化碳的物质的量=1.4/28+4.4/44=0.15mol,体积是0.15*22.4=3.36L
混合气体密度是(1.4+4.4)/3.36=1.73克/升1年前查看全部
- 标准状况下将1.4克氮气,1.6克氧气4.0氩气充分混合,体积为?
 944108271年前1
944108271年前1 -
 mingren444 共回答了18个问题
mingren444 共回答了18个问题 |采纳率94.4%氮气氧气双分子,1.4g氮气和1.6g氧气都是0.1mol
氩气是稀有气体单分子,4.0g氩气也是0.1mol
不考虑分子间隙,混合后0.3mol
标准状况体积V=0.3mol乘以22.4L/mol=6.72L1年前查看全部
- 1.4克铁溶于盐酸中,加入NaOH溶液得到红褐色沉淀,过滤后给红褐色沉淀物加热,得红色物质,其质量为()
1.4克铁溶于盐酸中,加入NaOH溶液得到红褐色沉淀,过滤后给红褐色沉淀物加热,得红色物质,其质量为()
A、1克 B、1.5克 C、3克 D、2克 花牵手1年前1
花牵手1年前1 -
 何守关中 共回答了17个问题
何守关中 共回答了17个问题 |采纳率82.4%选D,最终得到的是Fe2O3.
铁的物质的量n(Fe)=m/M=1.4/56=0.025mol
n(Fe)=1/2n(Fe2O3)=1/2*0.025=0.0125mol
Fe2O3的质量m=nM=0.0125*160=2g1年前查看全部
- 若将15.8克高锰酸钾放在试管里加热,一段时间后生成氧气的质量为1.4克,试分析试管
 yuansujj1年前2
yuansujj1年前2 -
 恒星-走廊 共回答了13个问题
恒星-走廊 共回答了13个问题 |采纳率84.6%2KMnO4=加热=K2MnO4 + MnO2 + O2↑
316 197 87 32
x y z 1.4g
316/x=197/y=87/z=32/1.4g
x=13.8g y=8.6g z=3.8g
试管里剩余高锰酸钾的质量=15.8 g-13.8=2g
生成的 锰酸钾为8.6g、二氧化锰为3.8g1年前查看全部
- 与1.4克一氧化碳所含氧原子的数目相等的二氧化碳的体积是多少【标况】
 acgcn1年前1
acgcn1年前1 -
 闲庭信步的MM 共回答了19个问题
闲庭信步的MM 共回答了19个问题 |采纳率94.7%nCO=1.4/28=0.05mol
nCO2=1/2nCO=0.025mol
VCO2=0.025*22.4=0.56L1年前查看全部
- 帮忙解一道初三化学题取3.0克偏二甲肼在氧气中充分燃烧后生成4.4克CO2、3.6克H2O和1.4克N2三种物质,由此可
帮忙解一道初三化学题
取3.0克偏二甲肼在氧气中充分燃烧后生成4.4克CO2、3.6克H2O和1.4克N2三种物质,由此可知偏二甲肼由( )种元素组成,其中碳元素的质量分数为( ) 3.0克偏二甲肼中,碳原子有( )mol,氢原子有( )mol,氮原子有( )mol
最好有解题过程,谢谢
 雨不亭1年前1
雨不亭1年前1 -
 寒冰ZJK 共回答了24个问题
寒冰ZJK 共回答了24个问题 |采纳率91.7%4.4g CO2中含有4.4/44 * 12 = 1.2g C元素
3.6g H2O中含有3.6/18 * 2 = 0.4g H元素
1.4g N2中含有1.4g N元素
因为1.2 + 0.4 + 1.4 = 3g
说明偏二甲肼中只含有C/H/N三种元素
所以偏二甲肼由 3 种元素组成,其中碳元素的质量分数 = 1.2/3 = 40%
碳原子有1.2/12 = 0.1mol,
氢原子有0.4/1 = 0.4mol,
氮原子有1.4/14 = 0.1mol1年前查看全部
- 百分比为30%的氢氧化钠溶液100公斤,其密度为1.4克每毫升,问其物质的摩尔浓度是多少?
 kejutozh1年前2
kejutozh1年前2 -
 龟的方式 共回答了11个问题
龟的方式 共回答了11个问题 |采纳率81.8%100公斤30%氢氧化钠溶液中含有氢氧化钠30kg,折合750mol;
100公斤密度为1.4g/ml的溶液,其体积为71.43升;
摩尔浓度则为750÷71.43=10.5mol/L1年前查看全部
- 一箱苹果每只平均重85.6克,若再加一个94克重的苹果,则平均每只增重1.4克,这箱苹果共有多少只?
 dingo1年前1
dingo1年前1 -
 不知oo 共回答了20个问题
不知oo 共回答了20个问题 |采纳率90%方程 设原有X只苹果
X*85.6+94=(X+1)(85.6+1.4)
85.6X+94=87X+87
1.4X=7
X=5
原来有苹果5只
算式方法 (94-85.6-1.4)/1.4=51年前查看全部
- 小丽买了一箱苹果,每只苹果平均重量为85.6克,若再加一个94克重的苹果,则平均重量每只将增加重1.4克,这箱苹果共有几
小丽买了一箱苹果,每只苹果平均重量为85.6克,若再加一个94克重的苹果,则平均重量每只将增加重1.4克,这箱苹果共有几只? 急啊!
 mlitn1年前1
mlitn1年前1 -
 yaxuewang 共回答了23个问题
yaxuewang 共回答了23个问题 |采纳率91.3%(94-85.6-1.4)/1.4=51年前查看全部
- 取表面被氧化成氧化镁的镁片1.4克,跟53.9克10%的硫酸溶液恰好完全反应,在标准状况下生成1.12升氢气(已知氢气密
取表面被氧化成氧化镁的镁片1.4克,跟53.9克10%的硫酸溶液恰好完全反应,在标准状况下生成1.12升氢气(已知氢气密度是0.09克/升),求:
(1)镁片上有氧化镁多少克?
(2)反应后溶液的溶质质量分数是多少? 笨笨0011041年前1
笨笨0011041年前1 -
 521哼哼 共回答了18个问题
521哼哼 共回答了18个问题 |采纳率94.4%解题思路:(1)根据氢气的质量利用化学方程式计算出镁的质量,进而求出氧化镁的质量;
(2)反应后溶液中的溶质为镁与氧化镁分别于硫酸反应生成的硫酸镁之和,据此解答氢气的质量为:1.12升×0.09克/升≈0.1g,
(1)设镁的质量为x,生成硫酸镁的质量为y
Mg+H2SO4=MgSO4+H2↑
24842
xy 0.1g
[24/2=
x
0.1g],[84/2=
y
0.1g]
x=1.2g,y=4.2g
氧化镁的质量为:1.4g-1.2g=0.2g;
(2)设氧化美与硫酸反应生成的硫酸镁的质量为z
MgO+H2SO4=MgSO4+H2O
40 84
0.2g z
[40/84=
0.2g
z]
z=0.42g
反应后所得溶液的质量为:1.4g+53.9g-0.1g=55.2g
反应后溶液的溶质质量分数是:
4.2g+0.42g
55.2g×100%=8.4%
答:(1)镁片上有氧化镁0.2g;
(2)反应后溶液的溶质质量分数是8.4%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.1年前查看全部
- 将1.4克纯铁粉放入80ml 1mol/L的稀HON3中,反应停止后生成的硝酸盐成分是什么?质量是多少克
将1.4克纯铁粉放入80ml 1mol/L的稀HON3中,反应停止后生成的硝酸盐成分是什么?质量是多少克
铁不是过量的吗?那铁会跟硝酸铁再反应吗 2432209241年前4
2432209241年前4 -
 西北阿郎 共回答了15个问题
西北阿郎 共回答了15个问题 |采纳率80%Fe+4HNO3--->Fe(NO3)3+NO↑+2H20
过量的铁 会 和 铁离子 反应生成 亚铁离子1年前查看全部
- 在标准状况下,将2克氦气,1.4克氮气和1.6克氧气混合,求混合气体的体积?
在标准状况下,将2克氦气,1.4克氮气和1.6克氧气混合,求混合气体的体积?
我算出氦气的物质的量是0.5mol,氮气和氧气都是0.05mol,再向下是分别把每个物质的体积算起来加在一起呢(这样做好像不太对,因为是气体,混合在一起体积减小)还是怎么做呢?
雨落 气体怎么会有0.6mol呢?加在一起应该是1.5mol亚 想去ff看大海1年前3
想去ff看大海1年前3 -
 zmmsdx 共回答了17个问题
zmmsdx 共回答了17个问题 |采纳率100%气体总共有0.6mol
体积是0.6mol×22.4l/mol
你的做法应该是正确地1年前查看全部
- 将1.4克纯铁粉放入的80mL1mol/L稀硝酸中,反应停止后生成的硝酸盐是什么?有多少克?
 aaaaal1年前3
aaaaal1年前3 -
 方式不如姿势 共回答了22个问题
方式不如姿势 共回答了22个问题 |采纳率95.5%铁过量,生成硝酸铁和硝酸亚铁
Fe+4HNO3=====Fe(NO3)3+NO↑+2H2O
0.02 0.08mol 0.02
剩余铁=1.4/56-0.02=0.005mol1年前查看全部
- 在科技节中我们了解到了,燃烧7克塑料会 产生21克的二氧化碳,照这样计算燃烧1.4克塑料会产生多少克的 二氧化碳 燃烧多
在科技节中我们了解到了,燃烧7克塑料会 产生21克的二氧化碳,照这样计算燃烧1.4克塑料会产生多少克的 二氧化碳 燃烧多少克塑料会产生31.5克的二氧化碳?
 5270021年前1
5270021年前1 -
 叶好龙公 共回答了18个问题
叶好龙公 共回答了18个问题 |采纳率88.9%燃烧1克塑料可以产生的二氧化碳是21÷7=3克
燃烧1.4克可以产生的是1.4*3=4.2克
那么再产生31.5克二氧化碳就需要燃烧31.5÷3=10.5克塑料1年前查看全部
大家在问
- 1关于艺术品作文的题材,例如一幅画啦之类的,最好靠近小学生活.
- 2NIHONG GO是啥意思?I DO NOT KNOW NIHONG GO!啥意思
- 3hardly 前什么时候加be如I am hardly do cooking 还是I hardly do cooking
- 4在CU2(OH)2CO3一个分子中含有几个原子
- 5by coincidence是什么意思?
- 6联系贝壳的主题,说说作者对贝壳外形作了细腻的描绘,目的是什么?
- 7一元一次方程的甲乙两人练习赛跑,如果甲让乙先跑10米,那么甲跑5秒钟就可以追上乙
- 8生活处处有物理,留心观察皆学问.对以下现象解释正确的是( )
- 9如果人民币一年定期储蓄的年利率是X,一年到期后,银行将本金和利息自动按一年定期储蓄转存,到期支取时
- 10cosπ/9cos2π/9cos23π/9
- 11去年今日此门中,人面桃花相映.人面不知何处去,桃花依旧笑春风.这首诗题和诗意是什么?
- 12给出下列命题.其中真命题的个数是?
- 13急求英语500字论文一篇,you have sufficient money and time,what kind of
- 14如何做一个有道德的人作文
- 15在我上大学以前,我都是与父母住在一起。(标准的英语)用英文翻译一下!!