在CU2(OH)2CO3一个分子中含有几个原子
 kittyjoies2022-10-04 11:39:543条回答
kittyjoies2022-10-04 11:39:543条回答有XYZW四种元素,X元素原子的核外电子为1个.Y元素得到2个电子,Z元素失去3个电子,他们的核外电子排布都和氖原子相同.W元素的第三电子层上电子数和第一层上的电子数相同,写出四种元素
X是
Y是
Z是
W是

已提交,审核后显示!提交回复
共3条回复
 fanfan0893 共回答了18个问题
fanfan0893 共回答了18个问题 |采纳率88.9%- X==H,只有氢原子的核外电子为1个
因为氖原子核外电子排布是28,Y元素得到2个电子,Z元素失去3个电子后和氖原子相同,说明Y==O,Z==Al
W元素的第三电子层上电子数和第一层上的电子数相同,第一层一般为2个电子,所以W==Mg - 1年前
 pingbai 共回答了1个问题
pingbai 共回答了1个问题 |采纳率- CU2(OH)2CO3一个分子中含有10个原子
X是Na
Y是Mg
Z是P
W是Ca - 1年前
 jh479 共回答了5个问题
jh479 共回答了5个问题 |采纳率- 1. 10 个原子
2.
X: H
Y: O
Z: Al
W: Mg - 1年前
相关推荐
- (2010•济南)Cu2(OH)2CO3的式量为______.
 西湖天下闻1年前1
西湖天下闻1年前1 -
 conquerorscn 共回答了20个问题
conquerorscn 共回答了20个问题 |采纳率90%解题思路:相对分子质量是化学式中各原子的相对原子质量的总和.由相对分子质量的计算方法进行计算即可.Cu2(OH)2CO3的式量(即相对分子质量)为63.5×2+(16+1)×2+12+16×3=221.
故答案为:221.点评:
本题考点: 相对分子质量的概念及其计算.
考点点评: 本题很简单,掌握相对分子质量的计算方法是解答此类题的关键.1年前查看全部
- (2006•岳阳)已知:H2CO3═H2O+CO2↑;Cu2(OH)2CO3 加热 . &
(2006•岳阳)已知:H2CO3═H2O+CO2↑;Cu2(OH)2CO3
2CuO+H2O+CO2↑.加热 .
(1)观察上述两个反应,他们有许多相似之处.请任写两条:
①______;
②______.
(2)请写出一个符合上面相似之处之一的化学方程式:______. yimujun1年前1
yimujun1年前1 -
 烟雨剑法 共回答了20个问题
烟雨剑法 共回答了20个问题 |采纳率90%解题思路:首先根据题目给出的两个化学反应方程式,可以仔细观察发现它们的不同点和相同点.主要从不同角度进行观察:比如方程式左右两边(反应物和生成物组成);化学反应类型件等不同的方面来比较它们的异同.答案也不是固定,只要符合题意即可.(1)从生成物的种类发现,它们相似之处均含有水和二氧化碳,然后再写出一个含有水和二氧化碳生成的方程式即可.或者是从生成物的物质的分类看相似点,均是氧化物,然后写出一个有氧化物生成的方程式即可;或者从反应类型来看,他们均为分解反应,然后补充一个分解反应类型的方程式即可.
故答案为:(1)①生成物中都含有水和二氧化碳; ②它们都是分解反应(2)CaCO3+2HCl=CaCl2+CO2↑+H2O( 或CaCO3
高温
.
CaO+CO2↑等);点评:
本题考点: 分解反应及其应用;从组成上识别氧化物;书写化学方程式、文字表达式、电离方程式.
考点点评: 找几个反应的共同点时一般要从:反应物、生成物、反应条件、反应类型、反应物和生成物种类这几个方面考虑,属基础性知识考查题.1年前查看全部
- (2011•海珠区一模)铜器长期暴露在空气中,表面会生成铜绿[其成分可表示为Cu2(OH)2CO3],从其组成分析,预测
(2011•海珠区一模)铜器长期暴露在空气中,表面会生成铜绿[其成分可表示为Cu2(OH)2CO3],从其组成分析,预测铜绿能与______(任举一例)反应.
 白云飞彩霞1年前1
白云飞彩霞1年前1 -
 的确良16 共回答了15个问题
的确良16 共回答了15个问题 |采纳率80%解题思路:根据铜绿的组成,猜测其化学性质;铜绿[Cu2(OH)2CO3]中含有碳酸根和氢氧根,则铜绿能与酸反应,且生成水和放出气体二氧化碳;
故答案为:HCl(或H2SO4、HNO3);点评:
本题考点: 金属锈蚀的条件及其防护;质量守恒定律及其应用.
考点点评: 碳酸盐都能与酸反应生成气体二氧化碳,与酸反应生成二氧化碳的一定含有碳酸根.1年前查看全部
- 小林同学发现铜制眼睛框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称铜绿,主要成分是Cu2(OH)2CO3.
小林同学发现铜制眼睛框表面出现了绿色物质,通过化学学习知道该物质为铜锈,俗称铜绿,主要成分是Cu2(OH)2CO3.
[提出问题]铜在什么条件下锈蚀的?
[猜想]根据铜锈的化学式,猜想铜生锈可能是铜和水、______、______共同作用的结果.
[设计与实验]借鉴“铁钉锈蚀条件的探究”实验,小林设计了“铜片锈蚀条件的探究”实验如图所示.
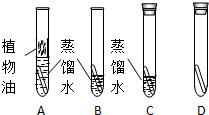
(1)实验较长时间后,发现______试管中的光亮铜片最先生锈(填字母编号).
(2)从优化实验的角度考虑,A实验是多余的,它只考虑了水这个单一条件.C试管中除光亮铜片、蒸馏水外,还有的另外一种物质为______.
(3)D试管中除光亮的铜片外,还有的另外两种物质为______、______;从D试管的实验中,获得的结论是______.
[评价与改进]我认为小林设计的“铜片锈蚀条件的探究”实验不够完善,要得出正确结论,还要补充的一个实验是(可图示)______. xusq20051年前4
xusq20051年前4 -
 baihua2884 共回答了14个问题
baihua2884 共回答了14个问题 |采纳率92.9%解题思路:由铜绿的化学式Cu2(OH)2CO3,得知铜绿由Cu、C、H、O四种元素组成,在此认识基础上对铜生锈的条件进行合理地、大胆地猜测,然后依据猜测,结合“铁钉锈蚀条件的探究”获得的技能,对“铜片锈蚀条件的探究”的设计方案进行评价与改进.本题涉及方案的设计、评价与改进,题目难度较大.[猜想]由组成铜绿的四种元素,依据质量守恒的思想,其中C元素来自空气中的二氧化碳气体、H元素来自水,而O元素则可能来自二氧化碳、水或者占空气体积分数21%的氧气.故答:氧气、二氧化碳.
(1)图A中上层的油层隔离了空气,其中的铜片也就只与水接触,远远不能满足铜锈蚀条件,因此放置时间再长也不会出现锈蚀;故不选A试管.
图B,试管中有水且敞口放置,其中铜片与水、二氧化碳、氧气都接触,应该是四只试管中最能满足锈蚀条件的,因此应该最先生锈;故选B.
图C,试管内有水和空气,但因管口塞住,不能与外界空气产生气体交换,就会因二氧化碳量不足很难甚至不能出现生锈;故不选C.
图D,试管内因缺少水,不满足铜片锈蚀条件,不会出现生锈现象;故不选D.
(2)C管内是铜、水、少量空气,空气中二氧化碳气体含量很少可忽略其存在,因此可认为铜片只和水、氧气接触;故答:氧气.
(3)猜想铜片生锈应与水、氧气、二氧化碳相关,在探究实验中每只管内只控制一种物质,而D管中明显没有水,因此应设计为充满氧气和二氧化碳的混合气体.故答:氧气、二氧化碳.
[评介与改进]题图所提供的四只试管,A管因只有水而被去除,B管内为二氧化碳、氧气和水,C管内为氧气和水,D管内为二氧化碳和氧气,综合起来就能发现缺少一组对比:铜片与水和二氧化碳接触而无氧气的影响.故设计如图: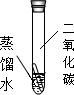
点评:
本题考点: 探究金属锈蚀的条件;猜想与事实验证;科学探究的基本方法;科学探究的基本环节;化学实验方案设计与评价;元素在化学变化过程中的特点;质量守恒定律及其应用.
考点点评: 本题的需控变量(水、二氧化碳和氧气)较多,方案设计就更为复杂,所以,把“铁钉锈蚀条件的探究”进行技能移植显得尤其重要.知识的迁移能力在此得到突出展示.1年前查看全部
- (2010•日照)碱式碳酸铜[Cu2(OH)2CO3],俗称孔雀石、铜绿,是铜与空气中的氧气、二氧化碳和水反应产生的物质
(2010•日照)碱式碳酸铜[Cu2(OH)2CO3],俗称孔雀石、铜绿,是铜与空气中的氧气、二氧化碳和水反应产生的物质.碱式碳酸铜受热发生分解,生成三种氧化物.宋老师为了让同学们探究碱式碳酸铜受热完全分解后的产物,给同学们准备了下列仪器和药品(胶皮管若干,已略),并告知碱石灰的主要成分是氧化钙和氢氧化钠.请完成下列实验:

(1)实验前,检验A中反应容器气密性的操作是______.
(2)为了验证产物中的气体,如将产生的气体通过装置______(填装置序号,下同),现象是______,则证明产物中有二氧化碳;如产物中的气体使______装置中的物质变蓝色,则证明产物中有______.
(3)若一次性完成上述两项证明,且使实验更科学合理,应在(2)中所选的两套装置中间增加______装置,目的是______.
(4)验证产物中的黑色固体,应选择______装置进行实验,还需要一种固体反应物是______(写名称).
(5)碱式碳酸铜受热分解的化学方程式Cu2(OH)2CO3
2CuO+CO2↑+H2O△ .Cu2(OH)2CO3-.该反应的类型是______.
2CuO+CO2↑+H2O△ . ot2b21年前1
ot2b21年前1 -
 Jenny_z 共回答了19个问题
Jenny_z 共回答了19个问题 |采纳率100%解题思路:(1)根据气密性检查原理由于形成压强差而出现现象分析解答;
(2)检验二氧化碳用澄清石灰水,检验水用无水硫酸铜;
(3)根据每次检验一种气体的思路解答.
(4)根据氧化铜能与碳发生还原反应解答.
(5)根据反应物和生成物及书写化学方程式的原则解答,分解反应是一变多.(1)该装置气密性检查方法为将导管没入水中,用手紧握试管外壁,观察导管口产生气泡,冷却后,导管中上升一段水柱,说明气密性良好.
(2)检验二氧化碳用澄清石灰水,二氧化碳使澄清石灰水变浑浊,无水硫酸铜遇水变蓝,;
(3)先通过E装置证明水的存在,然后通过B装置除去剩余的水,再将剩余气体通过C澄清石灰水验证二氧化碳;
(4)黑色固体氧化铜能与木炭粉反应生成红色的铜和能使澄清石灰水变浑浊的气体二氧化碳.给固体加热应选用A装置.
(5)碱式碳酸铜分解生成氧化铜、水和二氧化碳,化学方程式为:Cu2(OH)2CO3
△
.
2CuO+CO2↑+H2O,反应物是一种,生成物是三种,一变多,属于分解反应.
故答案为:(1)将导管没入水中,用手紧握试管外壁,观察导管口产生气泡,冷却后,导管中上升一段水柱,说明气密性良好.(2)C;石灰水变浑浊;E;水
(3)B 吸收气体中的水
(4)A;木炭粉
(5)Cu2(OH)2CO3
△
.
2CuO+CO2↑+H2O;分解反应点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法.
考点点评: 要同时检验二氧化碳和水,需要先检验水再检验二氧化碳,检验水用无水硫酸铜.1年前查看全部
- 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
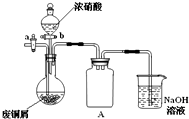 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
Ⅰ.废铜屑制硝酸铜
如图(夹持仪器已省略),将浓硝酸缓慢加到废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
Ⅱ.碱式碳酸铜的制备
①向大试管中加入碳酸钠溶液和硝酸铜溶液
②水浴加热至70℃左右
③用0.4mol/L的NaOH 溶液调节pH至8.5,振荡、静置、过滤
④用热水洗涤,烘干,得到碱式碳酸铜产品
回答:
(1)浓硝酸与铜反应的离子方程式______.
(2)装置A的作用是______.
(3)已知:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO3+NaNO2+H2O,NO不能单独与NaOH溶液反应,实验结束时,如何操作才能使装置中的有毒气体被NaOH溶液充分吸收?______.
(4)步骤④中洗涤的目的是______.
(5)步骤③过滤后的滤液中可能含有CO32-,检验CO32- 的方法是______.
(6)若实验得到2.36g 样品(只含CuO 杂质),取此样品加热至分解完全后,得到1.74g 固体,此样品中碱式碳酸铜的质量分数是______. hjq07501年前1
hjq07501年前1 -
 zappa1981 共回答了27个问题
zappa1981 共回答了27个问题 |采纳率88.9%解题思路:(1)浓硝酸与铜反应生成硝酸铜、二氧化氮气体和水,离子方程式中浓硝酸写成离子形式;
(2)铜与浓硝酸反应中,圆底烧瓶中压强会迅速减小,将氢氧化钠溶液倒吸入反应装置,有了A装置就可以防止倒吸;
(3)关闭活塞b,打开活塞a,通入一段时间空气,将装置中的有毒气体导入氢氧化钠溶液中,让氢氧化钠溶液充分吸收;
(4)洗涤可除去碱式碳酸铜表面的吸附的硝酸钠;
(5)加入稀盐酸,检验是否有二氧化碳气体生成来检验滤液中是否含有碳酸根离子;
(6)设碱式碳酸铜的质量分数为x,根据反应Cu2(OH)2CO3
2CuO+H2O+CO2↑,利用称量法计算出列式计算出碱式碳酸铜的质量分数.△ .(1)浓硝酸与铜反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)由于铜与浓硝酸反应中,圆底烧瓶中压强会迅速减小,将氢氧化钠溶液倒吸入反应装置,有了A装置就可以防止倒吸,
故答案为:防止倒吸;
(3)通过关闭活塞b,打开活塞a,通入一段时间空气操作,可以将装置中的有毒气体导入氢氧化钠溶液中,让氢氧化钠溶液充分吸收,
故答案为:关闭活塞b,打开活塞a,通入一段时间空气;
(4)通过洗涤可除去碱式碳酸铜表面的吸附的硝酸钠,故答案为:洗去碱式碳酸铜表面吸附的Na+和NO3-;
(5)步骤③过滤后的滤液中可能含有CO32-,检验CO32-的方法为:取少量滤液于试管中,加入稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明有CO32-,
故答案为:取少量滤液于试管中,加入稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明有CO32-;
(6)碱式碳酸铜完全分解得到CuO,设样品中碱式碳酸铜的质量分数为x,
依据碱式碳酸铜的方程式,Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑ 质量差△m
222 1844(18+44)=62
2.36x (2.36g-1.74g)
可得[222/62=
2.36x
(2.36−1.74)],
解得x=0.94,
故答案为:0.94或94%.点评:
本题考点: 制备实验方案的设计;有关混合物反应的计算.
考点点评: 本题借助制取碱式碳酸铜制法考查了离子方程式书写、质量分数计算等知识,充分考查了学生的分析、理解、计算能力,是一道不错的题目,本题难度中等.1年前查看全部
- 碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2
碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2(OH)2CO3
2CuO+H2O+CO2↑.现将一定量的碱式碳酸铜和铜的粉末放在容器里,在空气中用酒精灯充分加热后冷却,称量,发现加热前后固体的质量相等.据此计算原混合粉末中Cu2(OH)2CO3的质量.△ . dfasd234d31年前1
dfasd234d31年前1 -
 mms123 共回答了14个问题
mms123 共回答了14个问题 |采纳率78.6%解题思路:根据题意,可知:铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等.铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等;
设原混合物质量为100g,其中碱式碳酸铜的质量为x,则铜的质量为100g-x,生成的水蒸汽和二氧化碳的质量为y;
则根据题意有:
①Cu2(OH)2CO3
△
.
CuO+H2O+CO2↑
222 18+44=62
x y
则[222/x=
62
y],解得y=[62x/222]
②2Cu+O2
△
.
2CuO
12832
100g-xy
[128/100g−x=
32
y],解得y=
32(100g−x)
128
所以得[62x/222]=
32(100g−x)
128,解得x≈47.2g,故
47.2g
100g×100%=47.2%
答:原混合粉末中Cu2(OH)2CO3的质量分数约为47.2%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是对利用化学方程式计算的考查题,解题的关键是对反应前后质量变化的分析,属于基础性知识考查题.1年前查看全部
- (2012•桂平市三模)向铜锈 Cu2(OH)2CO3中加入过量的稀硫酸,固体逐渐溶解,得到蓝色溶液,从蓝色溶液中回收铜
(2012•桂平市三模)向铜锈 Cu2(OH)2CO3中加入过量的稀硫酸,固体逐渐溶解,得到蓝色溶液,从蓝色溶液中回收铜的过程如下:

(1)操作a的名称是______;
(2)证明B过量的方法是______;
(3)蓝色溶液加入过量铁粉反应的化学方程式是______. 两手空空闯江湖1年前1
两手空空闯江湖1年前1 -
 布丁演唱 共回答了18个问题
布丁演唱 共回答了18个问题 |采纳率100%解题思路:向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色溶液,由从蓝色溶液中回收铜的过程可知:
(1)得到蓝色溶液为硫酸铜和稀硫酸的混合液,加过量的铁粉时反应后所得为固体与溶液的混合物,故可知操作a的名称.
(2)依据B属于稀酸的实际,所以证明B过量方法是取滤液少量于试管中,向试管中加入少量锌粒,观察现象.
(3)蓝色溶液加入过量铁粉发生反应的化学方程式为:铁与硫酸和硫酸铜分别反应.(1)得到蓝色溶液为硫酸铜和稀硫酸的混合液,加入过量的铁粉,则铁能与稀硫酸反应,同时铁能置换出硫酸铜中的铜,所以反应后为铜铁的固体和硫酸亚铁的溶液,而操作a是分离固体与溶液的过程,所以是过滤.
(2)固体M是铜与铁的混合物,分离两者时应加入稀硫酸或稀盐酸,所以证明B过量方法是:取滤液少量于试管中,向试管中加入少量锌粒,有气体产生,则证明B过量.
(3)蓝色溶液是硫酸铜与稀硫酸的混合物,所以加入过量铁粉发生反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑与Fe+CuSO4═FeSO4+Cu.
故答案为:(1)过滤;(2)取滤液少量于试管中,向试管中加入少量锌粒,有气体产生,则证明B过量.
(3)Fe+H2SO4═FeSO4+H2↑ Fe+CuSO4═FeSO4+Cu.点评:
本题考点: 酸的化学性质;过滤的原理、方法及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了常见金属的知识,熟练掌握有关铁、铜的知识,会分析、应用、解决一些具体问题是解题的关键.1年前查看全部
- (2004•防城港)铜被锈蚀会产生铜绿,其主要成份是:Cu2(OH)2CO3.请在分析铜绿的化学式的基础上,借鉴“铁钉锈
(2004•防城港)铜被锈蚀会产生铜绿,其主要成份是:Cu2(OH)2CO3.请在分析铜绿的化学式的基础上,借鉴“铁钉锈蚀条件的探究”实验,自主设计“铜锈蚀条件的探究”实验,把你的猜想和验证方法填写在下表中.
你的猜想 铜生锈可能是铜与 H2O、O2、CO2共同作用的结果. 实验验证方法
(可用文字表达,也可用实验设计图表示)取A、B、C、D四支干燥试管,分别放入相同的光亮的铜片,A中注入蒸馏水,让铜片一半浸入水中;B、C都注入刚煮沸的蒸馏水,并分别让铜片一半浸入水中,B中水上层充满O2,C中水上层充满CO2,都分别用胶塞塞紧试管口;D中充入干燥的CO2和O2的混合气体,也用胶塞塞紧试管口.放置一段时间,观察结果.  genius_zqq1年前0
genius_zqq1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•孝感)研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入
(2010•孝感)研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),消耗73g盐酸,称得烧杯中剩余物质的质量为85.8g.
试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数.(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O) 写在你睡以后1年前1
写在你睡以后1年前1 -
 香雪海9333 共回答了27个问题
香雪海9333 共回答了27个问题 |采纳率88.9%解题思路:(1)先算出二氧化碳气体的质量,然后写出化学方程式并代入二氧化碳气体的质量计算出碱式碳酸铜的质量,最后计算铜矿中碱式碳酸铜的质量分数.
(2)根据化学方程式计算出氯化铜的质量,然后计算出反应后溶液的质量,最后计算出溶液中溶质的质量分数.(1)依题意,CO2的质量=73克+15克-85.8克=2.2克.设铜矿中碱式碳酸铜的质量为X,生成氯化铜质量为Y.
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 27044
X Y 2.2克
[222/44]═[X/2.2克]
得:X=11.1克
[270/44]═[Y/2.2克]
得:Y=13.5克
∴铜矿中碱式碳酸铜的质量分数为=[11.1g/15g]×100%=74%.
(2)根据(1)的计算可知,反应后溶液的质量=85.8克-(15克-11.1克)=81.9克.
∴所得溶液中溶质的质量分数=[13.5克/81.9克]×100%═16.5%.
答:铜矿中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 掌握化学方程式的计算格式和规范性,本题的易错点:反应后溶液的质量要减去矿石的杂质.1年前查看全部
- 铜绿的主要成分是碱式碳酸铜〔Cu2(OH)2CO3〕,它能跟酸反应生成铜盐、水和二氧化碳.某同学用小刀把家中旧铜器上的铜
铜绿的主要成分是碱式碳酸铜〔Cu2(OH)2CO3〕,它能跟酸反应生成铜盐、水和二氧化碳.某同学用小刀把家中旧铜器上的铜绿刮下,用来依次制取较纯净的硫酸铜、氧化铜和铜(为避免掺入固体杂质,他没有采用金属或碳置换化合物中的铜的方法).制取步骤分为四步.
铜绿+A→硫酸铜+B→氢氧化铜+C→氧化铜+D→铜.则ABCD是? 好奇11年前1
好奇11年前1 -
 mummyreturns 共回答了16个问题
mummyreturns 共回答了16个问题 |采纳率93.8%Cu2(OH)2CO3 + 2H2SO4 == 2CuSO4 + CO2↑ + 3H2O
A
CuSO4 + 2NaOH == Cu(OH)2↓ + Na2SO4
B
Cu(OH)2 =△= CuO + H2O 这一步什么都不用加,直接加热就行了
CuO + H2 =△= Cu + H2O
D1年前查看全部
- (2014•松北区一模)加热一定质量碱式碳酸铜[Cu2(OH)2CO3]固体一段时间后,测得剩余固体中铜元素与碳元素的质
(2014•松北区一模)加热一定质量碱式碳酸铜[Cu2(OH)2CO3]固体一段时间后,测得剩余固体中铜元素与碳元素的质量比为64:3.则已分解的碱式碳酸铜占原碱式碳酸铜的质量分数为( )
A.40%
B.60%
C.30%
D.50% Limonada1年前1
Limonada1年前1 -
 小强老秃 共回答了13个问题
小强老秃 共回答了13个问题 |采纳率84.6%解题思路:碱式碳酸铜中,铜元素和碳元素的质量比为:(64×2):12=64:6,碱式碳酸铜分解时,剩余固体中铜元素的质量不变,由于生成二氧化碳,所以剩余固体中碳元素的质量在减少,根据剩余固体中铜元素与碳元素的质量比可以判断已分解的碱式碳酸铜占原碱式碳酸铜的质量分数.碱式碳酸铜中,铜元素和碳元素的质量比为:(64×2):12=64:6,当剩余固体中铜元素与碳元素的质量比为64:3时,说明有一半碱式碳酸铜已经分解,则已分解的碱式碳酸铜占原碱式碳酸铜的质量分数为50%;
故选:D.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答本题的关键是分析出铜元素和碳元素的质量比及其变化关系,如果通过设未知数,再根据化学方程式进行计算,是比较繁杂的,要注意理解掌握这种简单的计算方法.1年前查看全部
- 一道化学方程式题,1配平下列化学方程式题,( )CU2(OH)2CO3点燃( )CUO+( )CO2↑+( )H2O(
一道化学方程式题,
1配平下列化学方程式题,
( )CU2(OH)2CO3点燃( )CUO+( )CO2↑+( )H2O
( )C+( )Fe2O3点燃( )Fe+( )CO2
( )Mg+( )CO2点燃MgO+( )C
( )Na2CO3+Ca(OH)2=( )CaCO3↓+( )NaOH 藍天1年前1
藍天1年前1 -
 heart_free 共回答了12个问题
heart_free 共回答了12个问题 |采纳率75%第一题1221(条件应该是加热)第二题3243第三题2121第四题11121年前查看全部
- 写出孔雀石Cu2(OH)2CO3加热分解的化学方程式
 joytwan1年前1
joytwan1年前1 -
 日翻南昌航院 共回答了20个问题
日翻南昌航院 共回答了20个问题 |采纳率85%分解成氧化铜,水,和二氧化铜1年前查看全部
- 长的化学式怎么读?比如,Cu2(OH)2CO3 为什么读碱式碳酸铜而不读酸式氢氧化铜?Rb2TeO4,CH2O,C2H2
长的化学式怎么读?比如,Cu2(OH)2CO3 为什么读碱式碳酸铜而不读酸式氢氧化铜?Rb2TeO4,CH2O,C2H2,C2H4,C2H6,C4H10,C4H9SH,KO2,C2O3,Mg(HCO3)2,CO(NH2)2,Ca(HCO3)2又该怎么读?为什么CH3COOH读乙酸?这些都有什么规律吗?就如看见什么读碱式,酸式,甲乙丙丁,过氧化某,次什么酸的?
 清清哟1年前1
清清哟1年前1 -
 每天清醒的睡 共回答了14个问题
每天清醒的睡 共回答了14个问题 |采纳率92.9%Cu2(OH)2CO3 是铜锈,属于盐;
CH2O:甲醛
C2H2,C2H4,C2H6,C4H10分别为乙炔、乙烯、乙烷、丁烷
C4H9SH 丁硫醇
KO2超氧化钾
三氧化二碳(C2O3)
Mg(HCO3)2,碳酸氢镁
CO(NH2)2,尿素
Ca(HCO3)2碳酸氢钙1年前查看全部
- (2013•黄石)小红同学在实验室发现了一块绿色的孔雀石样品,他查阅资料知道其成分为Cu2(OH)2CO3.小红以孔雀石
(2013•黄石)小红同学在实验室发现了一块绿色的孔雀石样品,他查阅资料知道其成分为Cu2(OH)2CO3.小红以孔雀石(不考虑其中的杂质参与反应)为原料设计了两种途径制取铜,其制备流程如图所示(部分生成物略去),请回答下列问题:
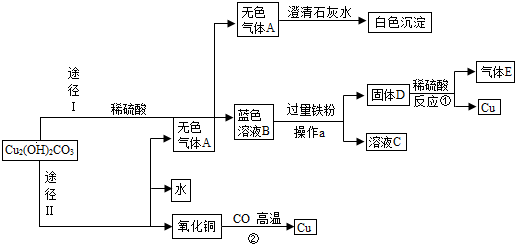
(1)无色气体A是______(填化学式),固体D的成分为______(用符号表示).
(2)写出下列反应的化学方程式:反应①______;反应②:CuO+CO
Cu+CO2高温 .CuO+CO.
Cu+CO2高温 .
(3)操作a的名称是______;
(4)小红同学设计的两种途径中,你认为途径______更合理(填“Ⅰ”或“Ⅱ”),其理由是______. 游戏币借支1年前1
游戏币借支1年前1 -
 我的密码 共回答了22个问题
我的密码 共回答了22个问题 |采纳率86.4%解题思路:(1)依据碱式碳酸铜加热后的产物或与硫酸反应的产物分析解答;
(2)依据过量的铁与硫酸铜反应后的固体情况找到反应的情况;
(3)依据该操作后会得到固体和液体分析解答;
(4)依据两种途径的过程中的有关问题分析解答;(1)由于碱式碳酸铜加热会生成氧化铜、水和二氧化碳,与硫酸反应会生成水、硫酸铜和二氧化碳,所以A是二氧化碳,B是蓝色的硫酸铜,硫酸铜能与铁反应生成硫酸亚铁和铜,而由于铁过量,所以固体是铁和铜;
(2)由于硫酸不能铜与反应但能与铁反应生成硫酸亚铁和氢气,所以①的反应方程式为Fe+H2SO4=FeSO4+H2↑;反应②是氧化铜和一氧化碳的反应,方程式为CuO+CO
△
.
Cu+CO2;
(3)操作a分离的是固体和液体,所以该过程是过滤操作;
(4)小红同学设计的两种途径中途径I更合理,因为途径Ⅱ需要加热,消耗较多的能量;
故答案为:(1)CO2;Fe、Cu;(2)Fe+H2SO4=FeSO4+H2↑;CuO+CO
△
.
Cu+CO2;(3)过滤;(4)Ⅰ;途径Ⅱ需要加热,消耗较多的能量;点评:
本题考点: 物质的鉴别、推断;常见气体的检验与除杂方法;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了利用碱式碳酸铜制备铜,完成此题,可以依据物质的性质进行.1年前查看全部
- (2003•宿迁)某学生在报刊上看到:孔雀石(主要成份为Cu2(OH)2CO3,假设其它成份不参加反应)在熊熊燃烧的木碳
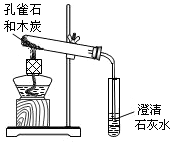 (2003•宿迁)某学生在报刊上看到:孔雀石(主要成份为Cu2(OH)2CO3,假设其它成份不参加反应)在熊熊燃烧的木碳上灼烧后,灰烬中有红色固体生成.他想在实验室利用右图装置来验证此现象,将少量孔雀石和木碳粉放入试管,然后加热.试回答下列问题
(2003•宿迁)某学生在报刊上看到:孔雀石(主要成份为Cu2(OH)2CO3,假设其它成份不参加反应)在熊熊燃烧的木碳上灼烧后,灰烬中有红色固体生成.他想在实验室利用右图装置来验证此现象,将少量孔雀石和木碳粉放入试管,然后加热.试回答下列问题
①写出试管内可能发生的化学反应方程式(最少写两个)Cu2(OH)2CO3
2CuO+H2O+CO2↑△ .Cu2(OH)2CO3;
2CuO+H2O+CO2↑△ .2CuO+C
2Cu+CO2↑△ .2CuO+C.
2Cu+CO2↑△ .
②实验结束取出导气管后,空气往往会进入试管使红色物质又被氧化.为防止空气进入,对此装置可以改进的措施为______
③请你猜想一下导出的气体中可能含有的有害气体是______,为防止它污染环境一般用______方法进行处理. herodayu1年前1
herodayu1年前1 -
 爱的好痛苦 共回答了15个问题
爱的好痛苦 共回答了15个问题 |采纳率100%解题思路:①根据碱式碳酸铜受热分解成氧化铜、水、二氧化碳,碳再与氧化铜发生反应;②在导管上接上橡皮管,放上止水夹,再考虑;①碱式碳酸铜受热分解生成氧化铜、水、二氧化碳,用观察法配平,二氧化碳后面标上上升符号,反应条件是加热,所以方程式是Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;碳与氧化铜反应生成铜和二氧化碳,用观察法配平,二氧化碳后面标上上升符号,反应条件是加热,所以方程式是:2CuO+C
△
.
2Cu+CO2↑;
②在导管上接上橡皮管,放上止水夹,先将导管从石灰水中取出,然后用弹簧夹夹紧胶皮管,让产物自然冷却;
③碳与氧化铜反应生成铜和二氧化碳,碳再与二氧化碳反应生成一氧化碳,所以导出的气体中可能含有的有害气体是一氧化碳;为防止它污染环境一般用点燃的方法,将一氧化碳转化为二氧化碳,所以防止它污染环境一般用点燃的方法进行处理.
故答案为:①Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;2CuO+C
△
.
2Cu+CO2↑;②在导管上接上橡皮管,放上止水夹,先将导管从石灰水中取出,然后用弹簧夹夹紧胶皮管,让产物自然冷却;③一氧化碳;点燃.点评:
本题考点: 盐的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题考查了碱式碳酸铜加热分解产物水与二氧化碳、氧化铜,碳和氧化铜黑色混合物成分反应的生成物,还需要熟悉化学方程式的书写注意事项.1年前查看全部
- 铜器在潮湿的空气中,表面会慢慢地生成一层铜锈[Cu2(OH)2CO3].该反应的化学方程式为:______.
 阆苑胜事可断肠1年前1
阆苑胜事可断肠1年前1 -
 pigu911 共回答了17个问题
pigu911 共回答了17个问题 |采纳率94.1%解题思路:根据所学知识结合质量守恒定律,来判断反应物和生成物,并正确地书写化学方程式.在潮湿的空气中,铜可以和水、氧气、二氧化碳等物质反应生成碱式碳酸铜,反应的化学方程式为:2Cu+H2O+CO2+O2═Cu2(OH)2CO3.
故答案为:2Cu+H2O+CO2+O2═Cu2(OH)2CO3.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要正确的书写反应物和生成物的化学式,同时书写化学方程式时要遵循质量守恒定律,注意化学方程式的配平.1年前查看全部
- 绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.孔雀石主要含Cu2(OH)2CO3,还含有Fe、Si的化合物
绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.孔雀石主要含Cu2(OH)2CO3,还含有Fe、Si的化合物(含硅物质不溶于酸).某工厂设计以孔雀石、废铁屑、稀硫酸等为原料制备CuSO4•5H2O与FeSO4•7H2O,流程如图所示.请回答下列问题:
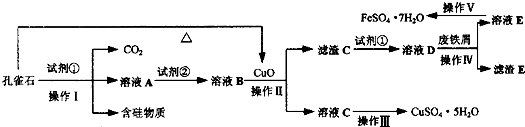
(1)试剂①为______,孔雀石与试剂①反应的主要化学方程式为______.
(2)溶液A中的金属阳离子除Cu2+外,还可能含有Fe2+和Fe3+中的一种或两种,检验Fe3+存在的最佳试剂为______.为了确定溶液A中是否含有Fe2+并测定其浓度大小,设计以下实验方案:
①配制溶液.取A溶液10mL,配成250mL,配制溶液所需的仪器除了量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是______.
②滴定检测.取25mL所配溶液于锥形瓶中,滴加a mol•L-1酸性KMnO4溶液V ml时,溶液恰好变为淡紫色且半分钟内不变色.
③分析计算.A溶液中是否含有Fe2+?______(填“含有”或“不含有”,若填“不含有”,则下列空白不用填写),则A溶液中C(Fe2+)为______.
(3)从以下试剂中选择:试剂②为______(填序号),选择原因是______.
a.KMnO4
b.(NH4)2S
c.H2O2
d.Cl2
(4)已知滤渣C为Fe(OH)3,试解释向溶液B中加入CuO的作用:______.
(5)由溶液C获得CuSO4•5H2O,需要经过加热蒸发、______、过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是______.
(6)操作V得到的绿矾晶体用少量液体洗涤,该液体可以是______(填序号).
A.冰水
B.蒸馏水
C.80%酒精溶液
D.CCl4. adslwlqq1年前1
adslwlqq1年前1 -
 sdrg2 共回答了19个问题
sdrg2 共回答了19个问题 |采纳率89.5%解题思路:(1)根据反应物、生成物以及反应原理书写反应方程式;
(2)检验Fe3+存在的最佳试剂为KSCN溶液;
①配250mL溶液还需要250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;
(3)能将Fe2+氧化而又不引入新杂质;
(4)加入试剂和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流;
(6)洗涤晶体表面的杂质离子时,既不能使主要物质减少,又能把杂质离子洗去.(1)制备的产物为硫酸盐,碱式碳酸铜又不溶于水,试剂①为稀硫酸,反应方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,
故答案为:稀硫酸;Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
(2)检验Fe3+选择KSCN溶液,Fe3+遇KSCN溶液变血红色,故答案为:KSCN溶液;
①一般用量筒量取溶液,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、胶头滴管.
故答案为:250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;由关系式:5Fe2+~MnO4-,可得A溶液中C(Fe2+)为=5aVmol/L,故答案为:含有;5aVmol/L;
(3)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2,故答案为:C;既能将Fe2+氧化而又不引入新杂质;
(4)氧化铜和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质,故答案为:除去多余的稀硫酸,调节溶液的PH;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流,故答案为:冷却结晶;引流;
(6)冰水和蒸馏水均使晶体损耗较多,四氯化碳不能洗去杂质,故选80%酒精溶液,故答案为:C.点评:
本题考点: 铜金属及其重要化合物的主要性质;硫酸亚铁的制备.
考点点评: 本题考查金属及其重要化合物的主要性质,题目难度中等,注意(4)中沉淀铁离子时不能引入新的杂质.1年前查看全部
- 探究铜生锈的条件:铜锈的主要成分是铜绿[Cu2(OH)2CO3],某同学为探究铜在空气中生锈的条件,利用图1所示的装置进
探究铜生锈的条件:铜锈的主要成分是铜绿[Cu2(OH)2CO3],某同学为探究铜在空气中生锈的条件,利用图1所示的装置进行实验,经过一个月的观察,该同学发现B中铜丝生锈,而A、C中铜丝无明显变化,该同学由此得出结论:铜生锈的主要原因是铜与空气中的氧气和水相互作用的结果.
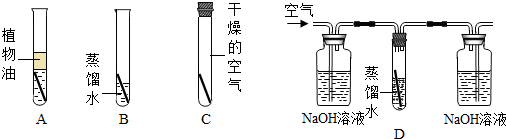
(1)该同学得出的结论正确吗?不正确不正确.
(2)你猜测一下参与铜生锈的物质还可能有二氧化碳二氧化碳.
(3)为验证你的判断,可用图2所示装置进行实验,其中NaOH溶液的作用是除去空气中的二氧化碳除去空气中的二氧化碳,经过近一个月的观察,D中的铜丝基本无变化,由此可认为:铜在有氧气和水的条件下难以生锈,参与铜生锈反应的物质有氧气、水、二氧化碳氧气、水、二氧化碳. 纯真心1年前1
纯真心1年前1 -
 用户名并不重要 共回答了22个问题
用户名并不重要 共回答了22个问题 |采纳率90.9%(1)不正确.铜绿中含有碳元素,根据质量守恒定律可知,反应物中应该有含有碳元素的物质.故填:不正确.
(2)空气中含有二氧化碳,二氧化碳参加了铜生锈的反应.故填:二氧化碳.
(3)NaOH溶液的作用是除去空气中的二氧化碳,这样做的目的是分析在没有二氧化碳的条件下铜是否能够生锈.故填:除去空气中的二氧化碳.
由实验可知,铜在有氧气和水的条件下难以生锈,所以参与铜生锈反应的物质有氧气、水、二氧化碳.故填:氧气、水、二氧化碳.1年前查看全部
- 铜锈的主要成分是碱式碳酸铜,它的化学式为Cu2(OH)2CO3,据此计算:
铜锈的主要成分是碱式碳酸铜,它的化学式为Cu2(OH)2CO3,据此计算:
(1)碱式碳酸铜的相对分子质量______;
(2)111g该物质中氧元素质量与多少克水所含氧元素质量相同? 英语简历1年前1
英语简历1年前1 -
 家家家qq 共回答了18个问题
家家家qq 共回答了18个问题 |采纳率88.9%解题思路:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)碱式碳酸铜的相对分子质量是64×2+(16+1)×2+12+16×3=222.
(2)设需要水的质量为x,则111g×
16×5
222×100%=x×
16
1×2+16×100% x=45g.
故答案为:(1)222;(2)45.点评:
本题考点: 相对分子质量的概念及其计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 小明、小强和小红三位同学在一起对碱式碳酸铜[Cu2(OH)2CO3,相对分子质量为222]受热完全分解后黑色固体产物的成
小明、小强和小红三位同学在一起对碱式碳酸铜[Cu2(OH)2CO3,相对分子质量为222]受热完全分解后黑色固体产物的成分进行探究.他们称取5.0g碱式碳酸铜在试管中加热使之完全分解,冷却至室温,称量黑色固体产物质量为3.6g.
他们根据碱式碳酸铜的化学式对黑色固体产物做出了以下猜想:①可能是氧化铜;②可能是炭粉;③可能是氧化铜和炭粉的混合物.他们做出以上猜想的依据是:______.
(1)小明设计的实验方案是:向盛有少量该黑色固体的试管中加入足量的稀硫酸,充分振荡,静置后观察现象.
如果猜想①正确,现象应是______;
如果猜想③正确,现象应是______.
(2)小强进一步思考后,根据碳的化学性质,认为猜想③可以排除.他的理由是:______.
(3)小红通过对得到的实验数据进行计算,排除了②.她的理由是:______.
(4)科学探究的方法和途径有多种.若证明某黑色粉末确由氧化铜和炭粉组成,你还可用什么方法:______. singopeng1年前1
singopeng1年前1 -
 wzxxhg 共回答了15个问题
wzxxhg 共回答了15个问题 |采纳率73.3%解题思路:探究性题目的做法是大胆推测,但要有合理的依据,不能凭空猜想;根据质量守恒定律可知,碱式碳酸铜[Cu2(OH)2CO3]的产物是有Cu、O、H、C中的一种或多种元素组合而成;根据题目信息(黑色粉末)可知,黑色物质可以是题目所说的三种情况.
(1)根据氧化铜、碳和硫酸的性质及其产物的颜色即可.
(2)碳和氧化铜在高温情况下会发生反应可知.
(3)有质量守恒定律可知.
(4)碳和氧化铜在高温情况下会发生反应的产物性质可知.根据质量守恒定律可知,反应前后元素的种类不变;碱式碳酸铜[Cu2(OH)2CO3]的产物是有Cu、O、H、C中的一种或多种元素组合而成;结合题目信息(黑色粉末)可知,氧化铜和碳都是黑色固体;所以黑色物质可以是题目所说的三种情况;故答案为:化学变化过程中元素不变,且氧化铜和炭粉都是黑色固体.
(1)
①氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜的水溶液的颜色是蓝色的,故答案为:试管中溶液变成蓝色,黑色固体消失(或没有黑色固体剩余).
②氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜的水溶液的颜色是蓝色的;但是碳不会和硫酸反应;故答案为:试管中溶液变成蓝色,仍有黑色固体剩余.
(2)氧化铜和碳在高温条件下发生反应生成铜和二氧化碳,所以在高温条件下,氧化铜和碳不会同时存在,故答案为:在加热的条件下,氧化铜和单质碳能发生反应.
(3)根据质量守恒定律可知,反应前后元素的种类、质量均不发生改变;反应前的碳的质量是:
5.0×([12/222]×100%)═0.27g,但是黑色粉末的质量是3.6g,因此排除②,故答案为:5.0g碱式碳酸铜中含有C:[12/222]×5.0g=0.27g<3.6g.
(4)假如是氧化铜和碳的混合物,它们在高温条件下反应生成铜和二氧化碳,二氧化碳的性质非常特殊,那就是通入澄清石灰水会使石灰水变浑浊.故答案为:将混合物在大试管中加热,并将生成的气体通入澄清的石灰水中,观察现象.点评:
本题考点: 实验探究物质的组成成分以及含量;质量守恒定律及其应用;根据化学反应方程式的计算.
考点点评: 做这类题目要有充足的知识和大胆的推测,这就要求学生平时多记一些物质的性质和特点(颜色,状态).1年前查看全部
- 已知铜绿[Cu2(OH)2CO3]在加热时分解生成A、B、C三种常见的氧化物,已知B是氧化铜,F是一氧化碳.下面是有关物
已知铜绿[Cu2(OH)2CO3]在加热时分解生成A、B、C三种常见的氧化物,已知B是氧化铜,F是一氧化碳.下面是有关物质之间的转化关系图示.
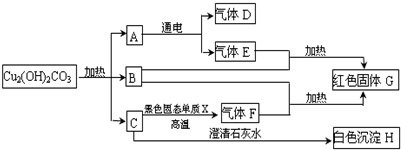
(1)试通过分析推断,确定下列物质:(写化学式)
D.______,E.______,G.______,X.______.
(2)写出A→D和E化学方程式:2H2O
O2↑+2H2 ↑通电 .2H2O.
O2↑+2H2 ↑通电 . longhushui1年前1
longhushui1年前1 -
 妖精带着妖姬走 共回答了16个问题
妖精带着妖姬走 共回答了16个问题 |采纳率81.3%解题思路:根据A在通电的条件下反应生成D和E,则A为水,D和E为氢气和氧气;B-氧化铜和E在加热条件下能生成红色固体G,则G为铜,E为氢气,D为氧气;碱式碳酸铜受热分解能生成氧化铜、水和二氧化碳;所以C为二氧化碳,C和黑色单质X反应生成气体F-一氧化碳,所以X为碳单质,而H为碳酸钙,至此各物质鉴定完毕,可以据此答题.A在通电的条件下反应生成D和E,则A为水,D和E为氢气和氧气;B-氧化铜和E在加热条件下能生成红色固体G,则G为铜,E为氢气,D为氧气;碱式碳酸铜受热分解能生成氧化铜、水和二氧化碳;所以C为二氧化碳,C和黑色单质X反应生成气体F-一氧化碳,所以X为碳单质,而H是二氧化碳和石灰水反应产生的碳酸钙,因此:
(1)D为氧气,E为氢气,G为铜,X为碳,故化学式分别为:O2;H2 ;CO;C;
(2)水通电得到氢气和氧气,故反应的方程式为:2H2O
通电
.
O2↑+2H2 ↑.点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题属于常见的框图式推断题,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.1年前查看全部
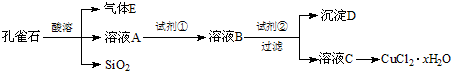
- 氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含
氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如图:
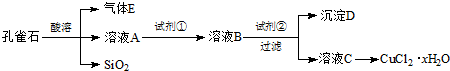
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①可选用______(填字母).Fe3+ Cu2+ Fe2+ 开始沉淀的pH 2.7 5.4 8.1 沉淀完全的pH 3.7 6.9 9.6
A.Ca(ClO)2B.H2O2C.HNO3D.KMnO4
反应的离子方程式为______.
(2)加入试剂②的目的是调节pH至a,a的范围是______.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是______、过滤、用无水乙醇洗涤和风干等操作,使用无水乙醇代替水进行洗涤的主要原因是______.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下实验方案:称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是______. kimikojun1年前1
kimikojun1年前1 -
 xphxc 共回答了18个问题
xphxc 共回答了18个问题 |采纳率88.9%解题思路:(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质;(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,结合金属离子从开始沉淀到沉淀完全时溶液的pH选择pH的范围.由溶液到晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失;(3)CuCl2•xH2O晶体加热时会发生水解.(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质,都是氧化剂,但是只有双氧水是绿色氧化剂,不会引进杂质离子,其余三个都会引进杂质离子,双氧水和亚铁离子之间的反应为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:B;2Fe2++2H++H2O2=2Fe3++2H2O;
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,由金属离子从开始沉淀到沉淀完全时溶液的pH可知,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.4开始沉淀,所以应该可知pH范围为3.7~5.4.由溶液获得CuCl2•xH2O晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.氯化铜易溶于水,使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
故答案为:3.7~5.4;蒸发浓缩、冷却结晶;防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O⇌Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大.
故答案为:CuCl2•xH2O晶体加热时会发生水解.点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查学生阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.1年前查看全部
- 铜绿的主要成分是碱式碳酸铜〔Cu2(OH)2CO3〕,它能跟酸反应生成铜盐、水和二氧化碳.某同学用小刀把家中旧铜器上的铜
铜绿的主要成分是碱式碳酸铜〔Cu2(OH)2CO3〕,它能跟酸反应生成铜盐、水和二氧化碳.某同学用小刀把家中旧铜器上的铜绿刮下,用来依次制取较纯净的硫酸铜、氧化铜和铜(为避免掺入固体杂质,他没有采用金属或碳置换化合物中的铜的方法).制取步骤分为四步:
(1)填写下面表示制取步骤和方法的方框图(方框内填写所制取物质的化学式,方框前的横线上填写所加入的试剂及简要操作).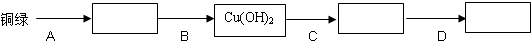
(2)根据上面的操作步骤,在下列所示仪器中选择实验所需用的仪器编号和名称______.
(3)写出A、C操作过程中涉及的反应的化学方程式______、Cu(OH)2
CuO+H2O△ .Cu(OH)2.
CuO+H2O△ .
(4)如果实验装置及生成铜以前的操作都正确,但最后没有生成铜,这是因为______. 八班精英1年前1
八班精英1年前1 -
 1231232007 共回答了26个问题
1231232007 共回答了26个问题 |采纳率92.3%解题思路:利用题设信息“铜绿的主要成分是碱式碳酸铜,它能跟酸反应生成铜盐、水和二氧化碳”,可推断为得到硫酸铜应使碱式碳酸铜与硫酸反应,然后利用硫酸铜与氢氧化钠反应得到氢氧化铜的沉淀,再对不溶性的碱氢氧化铜进行加热分解产生氧化铜,最后利用具有还原性的氢气在加热条件下还原氧化铜,从而避免掺入固体杂质得到较为纯净的铜.(1)把铜绿与稀硫酸混合充分反应后过滤得到硫酸铜溶液,向所得硫酸铜溶液中滴加氢氧化钠溶液至沉淀不再产生时过滤,把过滤得到的氢氧化铜沉淀进行加热分解得到氧化铜,最后利用氢气在加热条件下还原氧化铜即可达到获得不含固体杂质铜的制取目的;
(2)取铜绿于烧杯中,加入适量稀硫酸用玻璃棒搅拌,充分反应后过滤,向过滤所的硫酸铜溶液中加入氢氧化钠溶液并不断搅拌;完成以上操作需要使用漏斗、烧杯、玻璃棒、滴管、铁架参(带铁圈)等仪器;把过滤得到的氢氧化铜沉淀放在试管中加热,全部全黑色,通入氢气进行还原直到全部变为光亮的红色的铜;完成以上操作需要使用酒精灯、试管、氢氢气的玻璃导管、铁架台(带铁夹)等仪器.因此完成该实验需要使用的仪器为:(1)试管、(3)烧杯、(4)酒精灯、(5)通氢气的玻璃导管、(6)漏斗、(7)滴管、(9)铁架台(带铁圈和铁夹)、⑽玻璃棒;
(3)操作A加入稀硫酸,硫酸与碱式碳酸铜反应可生成硫酸铜、水和二氧化碳,反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;操作C为对氢氧化铜加热,氢氧化铜受热分解生成氧化铜和水,反应的化学方程式为Cu(OH)2
△
.
CuO+H2O;
(4)由于铜在高温下能与氧气发生反应生成氧化铜,因此在铜未冷却便停止通氢气,则会导致还原出的铜又被氧化成氧化铜,出现实验装置及生成铜以前的操作都正确,但最后没有生成铜的意外结果.
故答案为:
(1)铜绿
稀硫酸
搅拌过滤CuSO4
NaOH溶液
搅拌过滤Cu(OH)2
△
CuO
H2
△Cu;
(2)选出的仪器:(1)试管、(3)烧杯、(4)酒精灯、(5)通氢气的玻璃导管、(6)漏斗、(7)滴管、(9)铁架台(带铁圈和铁夹)、⑽玻璃棒;
(3)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;Cu(OH)2
△
.
CuO+H2O;
(4)铜未冷却便停止通氢气,结果铜又被氧化成氧化铜.点评:
本题考点: 物质的相互转化和制备;常用仪器的名称和选用;书写化学方程式、文字表达式、电离方程式.
考点点评: 利用所涉及物质的性质、变化规律及实验的具体要求,分析制取流程以理解所设计的实验过程,从而解答实验中所涉及的相关问题.1年前查看全部
- 碱式碳酸铜(Cu2(OH)2CO3)受热分解成二氧化碳、水和氧化铜.
 kvla1年前1
kvla1年前1 -
 舒恩儿 共回答了11个问题
舒恩儿 共回答了11个问题 |采纳率100%解题思路:碱式碳酸铜(Cu2(OH)2CO3)受热分解成二氧化碳、水和氧化铜,写出反应的化学方程式即可.碱式碳酸铜(Cu2(OH)2CO3)受热分解成二氧化碳、水和氧化铜,反应的化学方程式为:Cu2(OH)2CO3
△
.
H2O+2CuO+CO2↑.
故答案为:Cu2(OH)2CO3
△
.
H2O+2CuO+CO2↑.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL 9mol/L的硝酸中,充分反应后,
将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL 9mol/L的硝酸中,充分反应后,固体全部溶解,硝酸只被还原成NO2和NO(假设生成气体全部逸出),反应后溶液中H+ 为0.16mol(不考虑Cu2+ 的水解).往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体.求:
(1)铜片中单质铜的质量分数(保留2位小数).
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前溶液的体积不变).
(3)生成NO2和NO气体的体积比.
(4)已知2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O.现将反应后生成的气体用过量NaOH溶液吸收,为使氮氧化物充分吸收,还需通入一定量氧气.
①最少应通入氧气的体积(标准状况).
②参加反应的NaOH的物质的量. honje20001年前1
honje20001年前1 -
 雷鸣 共回答了14个问题
雷鸣 共回答了14个问题 |采纳率100%解题思路:干燥后得到29.4g蓝色固体为Cu(OH)2,n[Cu(OH)2]=[29.4g/98g/mol]=0.3mol,
(1)根据铜元素守恒n(Cu)=n[Cu(OH)2],设单质铜为xmol,Cu2(OH)2CO3为ymol,根据二者质量之和及铜原子的物质的量之和列方程计算,根据m=nM计算Cu单质的质量,根据质量分数定义计算;
(2)由题意可知,反应后硝酸有剩余,溶液中溶质为硝酸铜、硝酸,根据硝酸根守恒可知,溶液中n(NO3-)=n(HNO3)+2n[Cu(NO3)2],根据铜原子守恒n[Cu(NO3)2]=n(Cu),再根据c=[n/V]计算;
(3)设NO2和NO的物质的量分别为xmol、ymol,根据氮元素守恒可知,二者物质的量之和等于原硝酸溶液中硝酸的物质的量减去反应后溶液中硝酸根的物质的量,再根据电子转移守恒列方程,据此解答;
(4)①当NO:NO2=1:1时需要氧气最少,计算通入氧气后NO:NO2的物质的量,根据反应的NO计算最少应通入n(O2),再根据V=nVm计算;
②由化学式NaNO3、NaNO2可知,氮原子与钠原子物质的量之比为1:1,故n(NaOH)=n(N),放出的气体中含有二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠,由钠离子守恒可知n(NaOH)=2n(Na2CO3),根据碳原子守恒计算n(Na2CO3),上述两部分氢氧化钠之和为消耗的氢氧化钠,据此解答.干燥后得到29.4g蓝色固体为Cu(OH)2,n[Cu(OH)2]=[29.4g/98g/mol]=0.3mol,
(1)根据铜元素守恒n(Cu)=n[Cu(OH)2]=0.3mol,
设单质铜为xmol,Cu2(OH)2CO3为ymol,则:
x+2y=0.3
64x+222y=23.9,解得x=0.2,y=0.05,
m(Cu单质)=0.2mol×64g/mol=12.8g,
故铜单质的质量分数=[12.8g/23.9g]×100%=53.56%
答:铜片中单质铜的质量分数为53.56%;
(2)由题意可知,反应后硝酸有剩余,溶液中溶质为硝酸铜、硝酸,根据硝酸根守恒可知,溶液中n(NO3-)=n(HNO3)+2n[Cu(NO3)2]=0.16mol+2×0.3mol=0.76mol,
故溶液中NO3-的物质的量浓度=[0.76mol/0.1L]=7.6mol/L,
答:溶液中NO3-的物质的量浓度为7.6mol/L.
(3)设NO2和NO的物质的量分别为xmol、ymol,根据氮元素守恒可知,二者物质的量之和等于原硝酸溶液中硝酸的物质的量减去反应后溶液中硝酸根的物质的量,则:x+y=0.1×9-0.76,
再根据电子转移守恒有:x+3y=0.2×2,
联立方程,解得x=0.01,y=0.13
故生成NO2和NO气体的体积比=0.01mol:0.13mol=1:13,
答:生成NO2和NO气体的体积比为1:13,
(4)①当NO:NO2=1:1时需要氧气最少,则加入氧气后NO的物质的量=[1/2]×(0.01mol+0.13mol)=0.07mol,故与氧气反应转化为二氧化氮的NO的物质的量为:0.13mol-0.07mol=0.06mol,2NO+O2=2NO2可知,需要氧气最少为[1/2]×0.06mol=0.03mol,体积为0.03mol×22.4L/mol=0.672L,
答:最少应通入氧气的体积为0.672L.
②由化学式NaNO3、NaNO2可知,氮原子与钠原子物质的量之比为1:1,故n(NaOH)=n(N)=0.01mol+0.13mol=0.14mol,
放出的气体中含有二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠,根据碳原子守恒计算n(Na2CO3)=n[Cu2(OH)2CO3]=0.05mol,由钠离子守恒可知n(NaOH)=2n(Na2CO3)=0.1mol,
故消耗的氢氧化钠的物质的量=0.14mol+0.1mol=0.24mol,
答:参加反应的NaOH的物质的量为0.24mol.点评:
本题考点: 有关混合物反应的计算;硝酸的化学性质;铜金属及其重要化合物的主要性质.
考点点评: 本题考查混合物的有关计算,难度较大,注意根据守恒进行的计算,清楚反应过程是解题的关键,(4)②为易错点,学生容易忽略气体中二氧化碳与氢氧化钠反应.1年前查看全部
- 孔雀石的主要成分是碱式碳酸铜 化学式为Cu2(OH)2CO3,碱式碳酸铜受热会分解生成二氧化碳等三种氧化物,
孔雀石的主要成分是碱式碳酸铜 化学式为Cu2(OH)2CO3,碱式碳酸铜受热会分解生成二氧化碳等三种氧化物,
(1)写出该反应的化学方程式Cu2(OH)2CO3
2CuO+H2O+CO2↑△ .Cu2(OH)2CO3
2CuO+H2O+CO2↑△ .
(2)某同学为测定一种孔雀石中铜元素的质量分数,称取20g样品充分加热后,生成 1.1gCO2(假设样品中杂质加热不分解,不溶于水也不与酸反应).请你帮助计算该样品中铜元素的质量分数.(请写出计算过程)
(3)该同学向上述剩余固体混合物中加入一定质量分数的稀硫酸,恰好完全反应时,共用去稀硫酸96g,试计算反应后所得溶液中溶质的质量分数,(请写出计算过程) yinjifu1年前1
yinjifu1年前1 -
 aa咻咻 共回答了19个问题
aa咻咻 共回答了19个问题 |采纳率89.5%解题思路:(1)氧化物为一种元素与氧元素组成的只含两种元素且含氧元素的化合物,根据碱式碳酸铜的组成元素,判断分解所生成的氧化物,写出反应的化学方程式;
(2)根据反应的化学方程式,可由生成二氧化碳的质量计算出反应生成氧化铜的质量,再利用该化合物中铜元素的质量分数,计算样品中铜元素质量,从而求得样品中铜元素的质量分数;
(3)碱式碳酸铜完全分解后的固体为氧化铜,氧化铜能与硫酸反应生成硫酸铜,利用氧化铜的质量计算恰好完全反应所生成硫酸铜的质量,并利用质量守恒定律求得反应后所得溶液的质量,即可解得反应后所得溶液中溶质的质量分数.(1)根据碱式碳酸铜受热会分解生成二氧化碳等三种氧化物,可知分解生成氧化铜、水、二氧化碳,该反应的化学方程式为Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;
故答案为:Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;
(2)设反应生成的CuO的质量为x
Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑
160 44
x1.1g
[160/x=
44
1.1g]
x=4g
4g×[64/64+16]×100%=3.2g
样品中铜元素的质量分数=[3.2g/20g]×100%=16%
(3)设反应生成的CuSO4的质量为y
CuO+H2SO4═CuSO4+H2O
80160
4gy
[80/4g=
160
y]
y=8g
所得溶液的溶质质量分数=[8g/4g+96g]×100%=8%
答:(2)样品中铜元素的质量分数为16%;(3)所得溶液的溶质质量分数为8%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 由于样品中杂质加热不分解,不溶于水也不与酸反应,因此根据质量守恒定律,与硫酸反应后所得溶液质量=参加反应氧化铜的质量+所加稀硫酸的质量.1年前查看全部
- 铜器在潮湿的空气中,表面会慢慢地生成一层铜锈[Cu2(OH)2CO3].该反应的化学方程式为:______.
 雨夜留香1年前2
雨夜留香1年前2 -
 可漂小熊猪猫猫 共回答了25个问题
可漂小熊猪猫猫 共回答了25个问题 |采纳率92%解题思路:根据所学知识结合质量守恒定律,来判断反应物和生成物,并正确地书写化学方程式.在潮湿的空气中,铜可以和水、氧气、二氧化碳等物质反应生成碱式碳酸铜,反应的化学方程式为:2Cu+H2O+CO2+O2═Cu2(OH)2CO3.
故答案为:2Cu+H2O+CO2+O2═Cu2(OH)2CO3.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要正确的书写反应物和生成物的化学式,同时书写化学方程式时要遵循质量守恒定律,注意化学方程式的配平.1年前查看全部
- 碱式碳酸铜的化学式为Cu2(OH)2CO3.试计算:
碱式碳酸铜的化学式为Cu2(OH)2CO3.试计算:
(1)碱式碳酸铜中的铜、氧、氢、碳四种元素的质量比是m(Cu):m(O):m(H):m(C)=______
(2)碱式碳酸铜中氧元素质量分数为多少?
(3)多少克的碱式碳酸铜含有的氧元素质量与88g二氧化碳中的氧元素质量相等. 阳光蜜糖1年前0
阳光蜜糖1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 潮湿的空气中,铜能跟氧气及空气中的另外两种物质生成铜绿[(Cu2(OH)2CO3)].出土的青铜制品失去了昔日的光彩,其
潮湿的空气中,铜能跟氧气及空气中的另外两种物质生成铜绿[(Cu2(OH)2CO3)].出土的青铜制品失去了昔日的光彩,其变化的原因用化学方程式表示为______;变色眼镜的玻璃片中含溴化银(AgBr),溴化银见光分解为银和单质溴(Br2),眼镜片自动变暗.光线弱时,单质溴与银又化合生成溴化银,眼镜片变亮.试写出避光时的化学方程式:______.
 卖呆的人1年前1
卖呆的人1年前1 -
 liang1018 共回答了16个问题
liang1018 共回答了16个问题 |采纳率81.3%解题思路:根据质量守恒定律,在化学反应前后,元素的种类不变,原子的种类和数目不变,原子的质量不变.根据题意,溴化银见光分解为银和单质溴(Br2),光线弱时,单质溴与银又化合生成溴化银,写出反应的化学方程式即可.Cu2(OH)2CO3中含有碳元素和氢元素,所以空气中的另外两种物质是水和二氧化碳.化学方程式为:2Cu+O2+H2O+CO2═Cu2(OH)2CO3
光线弱时,单质溴与银又化合生成溴化银,反应的化学方程式为:2Ag+Br2═2AgBr.
故答案为:2Cu+O2+H2O+CO2═Cu2(OH)2CO3;2Ag+Br2═2AgB点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- (2012•上海)碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如
 (2012•上海)碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
(2012•上海)碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品.
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式______.
(2)上图装置中NaOH溶液的作用是______.反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有______(填写化学式).
(3)步骤二中,水浴加热所需仪器有______、______(加热、夹持仪器、石棉网除外);洗涤的目的是______.
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法______.
(5)影响产品产量的主要因素有______、______.
(6)若实验得到2.42g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80g固体,此样品中碱式碳酸铜的质量分数是______. eqcheng20061年前1
eqcheng20061年前1 -
 笑笑就忘 共回答了22个问题
笑笑就忘 共回答了22个问题 |采纳率95.5%解题思路:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染,由NO2+NaOH→NaNO2+NaNO3+H2O,可知反应结束后,除剩余的NaOH外,还有新生成的NaNO2、NaNO3;
(3)反应器为大试管,水浴加热用烧杯盛放水,由于控制温度,用温度计测定水温;碱式碳酸铜表面附着的硝酸钠,需要洗涤除去;
(4)利用碳酸根与酸反应生成气体,将生成的气体通过澄清的石灰水进行检验;
(5)由步骤二可知,实验成功的关键是控制反应温度与溶液的pH值;
(6)碱式碳酸铜完全分解得到CuO,令样品中碱式碳酸铜的质量分数为x,则碱式碳酸铜的质量为2.42x g,根据碱式碳酸铜分解方程式,利用差量法列方程计算.(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染,由NO2+NaOH→NaNO2+NaNO3+H2O,可知反应结束后,除剩余的NaOH外,还有新生成的NaNO2、NaNO3,
故答案为:吸收氮的氧化物;NaNO2、NaNO3;
(3)反应器为大试管,水浴加热用烧杯盛放水,由于控制温度,用温度计测定水温;洗涤除去碱式碳酸铜表面附着的硝酸钠,
故答案为:烧杯、温度计;洗涤除去碱式碳酸铜表面附着的硝酸钠;
(4)检验碳酸根的方法为:取样,加入盐酸,将生成的气体通入澄清的石灰水,溶液变浑浊,说明含有CO32-,
故答案为:取样,加入盐酸,将生成的气体通入澄清的石灰水,溶液变浑浊,说明含有CO32-;
(5)由步骤二可知,实验成功的关键是控制反应温度与溶液的pH值,故影响产品产量的主要因素有:反应温度、溶液pH值,
故答案为:反应温度;溶液pH值;
(6)令样品中碱式碳酸铜的质量分数为x,碱式碳酸铜的质量为2.42x g,则:
Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑ 质量减少
222 62
2.42x g 2.42g-1.8g=0.62g
所以,222:62=2.42x g:0.62g
解得x=0.92
故答案为:0.92.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查物质制备实验,综合考查学生的实验能力,需要学生具备扎实的基础,难度中等.1年前查看全部
- (2004•河北)小明、小强和小红三位同学在一起对碱式碳酸铜[Cu2(OH)2CO3,相对分子质量为222]受热完全分解
(2004•河北)小明、小强和小红三位同学在一起对碱式碳酸铜[Cu2(OH)2CO3,相对分子质量为222]受热完全分解后黑色固体产物的成分进行探究.他们称取5.0g碱式碳酸铜在试管中加热使之完全分解,冷却至室温,称量黑色固体产物质量为3.6g.
他们根据碱式碳酸铜的化学式对黑色固体产物做出了以下猜想:①可能是氧化铜;②可能是炭粉;③可能是氧化铜和炭粉的混合物.他们做出以上猜想的依据是:______.
(1)小明设计的实验方案是:向盛有少量该黑色固体的试管中加入足量的稀硫酸,充分振荡,静置后观察现象.
如果猜想①正确,现象应是______;
如果猜想③正确,现象应是______.
(2)小强进一步思考后,根据碳的化学性质,认为猜想③可以排除.他的理由是:______.
(3)小红通过对得到的实验数据进行计算,排除了②.她的理由是:5.0g碱式碳酸铜中含有C:[12/222]×5.0g=0.27g<3.6g5.0g碱式碳酸铜中含有C:[12/222]×5.0g=0.27g<3.6g.
(4)科学探究的方法和途径有多种.若证明某黑色粉末确由氧化铜和炭粉组成,你还可用什么方法:______. 许无一1年前1
许无一1年前1 -
 我就爱uu 共回答了18个问题
我就爱uu 共回答了18个问题 |采纳率77.8%解题思路:探究性题目的做法是大胆推测,但要有合理的依据,不能凭空猜想;根据质量守恒定律可知,碱式碳酸铜[Cu2(OH)2CO3]的产物是有Cu、O、H、C中的一种或多种元素组合而成;根据题目信息(黑色粉末)可知,黑色物质可以是题目所说的三种情况.
(1)根据氧化铜、碳和硫酸的性质及其产物的颜色即可.
(2)碳和氧化铜在高温情况下会发生反应可知.
(3)有质量守恒定律可知.
(4)碳和氧化铜在高温情况下会发生反应的产物性质可知.根据质量守恒定律可知,反应前后元素的种类不变;碱式碳酸铜[Cu2(OH)2CO3]的产物是有Cu、O、H、C中的一种或多种元素组合而成;结合题目信息(黑色粉末)可知,氧化铜和碳都是黑色固体;所以黑色物质可以是题目所说的三种情况;故答案为:化学变化过程中元素不变,且氧化铜和炭粉都是黑色固体.
(1)
①氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜的水溶液的颜色是蓝色的,故答案为:试管中溶液变成蓝色,黑色固体消失(或没有黑色固体剩余).
②氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜的水溶液的颜色是蓝色的;但是碳不会和硫酸反应;故答案为:试管中溶液变成蓝色,仍有黑色固体剩余.
(2)氧化铜和碳在高温条件下发生反应生成铜和二氧化碳,所以在高温条件下,氧化铜和碳不会同时存在,故答案为:在加热的条件下,氧化铜和单质碳能发生反应.
(3)根据质量守恒定律可知,反应前后元素的种类、质量均不发生改变;反应前的碳的质量是:
5.0×([12/222]×100%)═0.27g,但是黑色粉末的质量是3.6g,因此排除②,故答案为:5.0g碱式碳酸铜中含有C:[12/222]×5.0g=0.27g<3.6g.
(4)假如是氧化铜和碳的混合物,它们在高温条件下反应生成铜和二氧化碳,二氧化碳的性质非常特殊,那就是通入澄清石灰水会使石灰水变浑浊.故答案为:将混合物在大试管中加热,并将生成的气体通入澄清的石灰水中,观察现象.点评:
本题考点: 实验探究物质的组成成分以及含量;质量守恒定律及其应用;根据化学反应方程式的计算.
考点点评: 做这类题目要有充足的知识和大胆的推测,这就要求学生平时多记一些物质的性质和特点(颜色,状态).1年前查看全部
- (2010•潍坊)已知碱式碳酸铜[Cu2(OH)2CO3]受热易分解、能与酸反应.孔雀石主要含Cu2(OH)2CO3,还
(2010•潍坊)已知碱式碳酸铜[Cu2(OH)2CO3]受热易分解、能与酸反应.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.某学校化学研究小组以孔雀石为原料制备CuSO4•5H2O的流程如下:
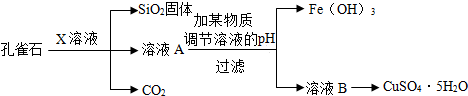
请回答下列问题:
(1)流程中,X的化学式是______;由溶液B获得CuSO4•5H2O,需要经过加热蒸发、______、过滤等操作.
(2)若通过置换反应由溶液B制备金属铜,反应的化学方程式是______.
若选用下列物质与氧化铜反应制备铜,写出反应的化学方程式:
①选用非金属单质2CuO+C
2Cu+CO2↑或CuO+H2高温 .
Cu+H2O△ .2CuO+C:
2Cu+CO2↑或CuO+H2高温 .
Cu+H2O△ .
②选用氧化物CuO+CO
Cu+CO2△ .CuO+CO.
Cu+CO2△ .
(3)工业上用焦炭在高温电炉中还原SiO:可得到含有少量杂质的Si和CO,反应的化学方程式是SiO2+2C
Si+2CO↑高温 .SiO2+2C,该反应类型为______.
Si+2CO↑高温 . seaman8209131年前1
seaman8209131年前1 -
 小小豆芽菜 共回答了18个问题
小小豆芽菜 共回答了18个问题 |采纳率77.8%解题思路:本题属于一道综合性的解答题,包括的知识点比较多,由孔雀石制备五水硫酸铜的原理不难知道X为稀硫酸,因为需要利用重结晶技术对制备的五水硫酸铜进行提纯,所以离不开冷却结晶.根据金属活性顺序及氧化-还原反应和置换反应原理不难解决金属铜的制备和还原氧化硅的问题.(1)①孔雀石的主要成分是Cu2(OH)2CO3,其主要杂质为Fe、Si等,是以铁盐或者铁的氧化物形式存在,而S是以二氧化硅的形式存在,二氧化硅不溶解于酸.所以用稀硫酸浸取孔雀石粉,其中铜、铁以硫酸盐的形式进入溶液,SiO2作为不溶物而分离出来.故X的化学式为:H2SO4;
②溶液中残留的少量Fe3+及其它可溶性杂质则可利用CuSO4•5H2O的溶解度随温度升高而增大的性质,通过重结晶的方法除去.重结晶后,杂质留在母液中,从而达到纯化CuSO4•5H2O的目的.故答案为:冷却结晶或结晶.
(2)在金属活动顺序中,金属的位置越靠前它的活动性就越强;排在氢前面的金属能与酸反应放出氢气,而且位置在前的金属可以把位于其后的金属从他们的盐溶液中置换出来.故答案为:Zn+CuSO4═ZnSO4+Cu(其他合理答案也可).
利用非金属单质碳或氢气及一氧化碳与氧化铜反应制铜,利用的是它们的还原性质,在这一反应中,氧化铜中的氧被夺去,铜被还原出来,所以答案为:
①2CuO+C
高温
.
2Cu+CO2↑或CuO+H2
△
.
Cu+H2O
②CuO+CO
△
.
Cu+CO2
(3)SiO2与C在高温下的反应原理和氧化铜与碳的反应原理相同,是还原反应.因为SiO2是氧化物,但同时它又是化合物的一种,所以他们之间的反应又是置换反应.故答案为:SiO2+2C
高温
.
Si+2CO↑,置换反应.点评:
本题考点: 探究金属铜的冶炼原理;金属活动性顺序及其应用;碳、一氧化碳、氢气还原氧化铜实验;酸的化学性质;化学式的书写及意义;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题属于一道制备物质的综合性解答题,解此类问题关键要抓住主要知识点.比如本题,一要清楚由孔雀石制备五水硫酸铜的原理和过程,二要牢牢掌握金属活性顺序,此外还要明白还原反应和置换反应的原理.总之,同学们在学习中要善于综合运用所学知识,理清知识之间的联系和区别.1年前查看全部
- (2007•海淀区二模)孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最
 (2007•海淀区二模)孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.
(2007•海淀区二模)孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.
冶炼铜的反应原理为:Cu(OH)2CO3
2CuO+CO2↑+H2O△ .
2CuO+C
2Cu+CO2↑高温 .
某校课外小组同学在实验室验证上述反应.
(1)加热分解碱式碳酸铜,生成氧化铜.装置如下图所示.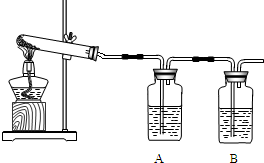
①瓶A中盛有的试剂是______,用来吸收水,证明碱式碳酸铜加热分解的产物中有水.
②瓶B中盛有的试剂是澄清石灰水,用来______,反应的化学方程式为______.
③反应结束,熄灭酒精灯前,应______.
(2)木炭和氧化铜反应,生成铜.
将木炭粉末和氧化铜粉末混合均匀,放进试管,加热充分反应.将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余.该小组同学设计方案验证黑色粉末的成分.
查阅资料:部分内容如下:木炭和氧化铜都是黑色粉末.氧化铜与稀硫酸反应生成硫酸铜,木炭与稀硫酸不反应.
猜想与验证:操作和药品 现象 分析和结论 方案Ⅰ 取少量剩余黑色粉末,充分灼烧 ①______________
________________原剩余黑色粉末是
氧化铜方案Ⅱ ②_______________
__________________③_____________
_________________原剩余黑色粉末是
氧化铜
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比.设计方案如下:
上述设计方案的主要研究方法是______.配方1 配方2 配方3 配方4 木炭质量(g) 0.4 0.5 0.6 0.7 氧化铜质量(g) 8 8 8 8  匠心之心1年前1
匠心之心1年前1 -
 诃郎 共回答了28个问题
诃郎 共回答了28个问题 |采纳率85.7%解题思路:(1)①吸收水的液体一般是浓硫酸②检验有二氧化碳存在一般是澄清石灰水
(2)证明黑色固体是氧化铜而不是碳可以从碳和氧化铜两方面考虑
(3)找到最佳质量比可通过一种物质的量不变,而改变另一种物质进行探究(1)A装置是吸收水分的装置因其为液体,故是浓硫酸;而检验二氧化碳的存在一般用到的是澄清石灰水.
故应填:①浓硫酸②碱式碳酸铜加热分解的产物中有二氧化碳,Ca(OH)2+CO2=CaCO3↓+H2O
(2)此实验分别是从两方面入手的①是给固体加热固体无变化说明没有碳,因为碳在加热时会生成二氧化碳;而加入稀硫酸全部反应,说明无碳,因为碳不与硫酸反应,氧化铜与硫酸反应生成硫酸铜的溶液.
故应填①黑色粉末没有变化(黑色粉末灼烧前后质量没有变化等) ②取少量剩余黑色粉末,加入足量稀硫酸,充分反应
③黑色粉末消失,生成蓝色溶液
(3)找到最佳质量比可通过一种物质的量不变,而改变另一种物质进行探究.故可填:具有控制变量的意识(使用控制变量法等)点评:
本题考点: 探究金属铜的冶炼原理;实验探究物质的组成成分以及含量;实验步骤的探究;二氧化碳的检验和验满;碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题考查了碱式碳酸铜加热分解产物水与二氧化碳的鉴定,并进行了黑色固体混合物成分的鉴定,碳和氧化铜黑色混合物成分的鉴定可采用加热或加入酸的方式进行,还进行了反应物最佳质量比的鉴定.1年前查看全部
- 将一严重锈蚀而部分变成铜绿Cu2(OH)2CO3的铜块研磨成粉末,在空气中中分灼烧成CuO,固体质量的变化情况可能是?
将一严重锈蚀而部分变成铜绿Cu2(OH)2CO3的铜块研磨成粉末,在空气中中分灼烧成CuO,固体质量的变化情况可能是?
可为什么我这里答案是增重10%和不变啊? gmm5301年前1
gmm5301年前1 -
 Jobseekers 共回答了18个问题
Jobseekers 共回答了18个问题 |采纳率94.4%这是一化学竞赛题
而单质铜与铜绿的含量不清楚
方法是:极端假设法
如果全部是铜
2Cu+O2==2CuO
128 32 160
增加%=32/160=20%
如果全部是铜绿
Cu2(OH)2CO3==2CuO+H2O+CO2
128+34+60 160 18+44
=222 =62
减少%=62/222=27.9%
最多增加20%,最多减少27.9%
由于是铜和铜绿的混合物,增多10%,当然是可能的了,
铜与氧气反应生成氧化铜增加的质量,和铜绿分解减少的质量相等,质量不变也是可能的1年前查看全部
- 锡青铜里 锡保护铜 为什么铜还被腐蚀成Cu2(OH)2CO3呢?如果锡保护铜 那么锡被氧化成什么了?
 hanmu771年前1
hanmu771年前1 -
 渔途想民 共回答了18个问题
渔途想民 共回答了18个问题 |采纳率94.4%锡青铜中,锡与铜形成合金,说是前者保护后者,是因为原电池作用:金属性锡强于铜,所以前者为负极,后者正极,正极材料不被腐蚀.但只是理论,实际由于各种原因不一定真的完全保护,很有可能某部分锡完全反应后只剩铜,所以被腐蚀.而且该合金中明显铜居多,过多的铜不可能被少量的锡完全保护,会有部分直接与空气接触而反应1年前查看全部
- 铜在空气中易生锈,生成一种叫“铜绿”的物质,其化学式为Cu2(OH)2CO3,它由碳、氢、氧、铜四种元素组成.小明设计了
铜在空气中易生锈,生成一种叫“铜绿”的物质,其化学式为Cu2(OH)2CO3,它由碳、氢、氧、铜四种元素组成.小明设计了一个实验,证明铜生锈仅是由铜、氧气和水共同作用的结果.
(1)你认为小明的结论正确吗?为什么?
(2)你猜测铜生锈还可能有什么物质参加反应?______.
(3)怎样防止铜生锈?______. xyz906521年前1
xyz906521年前1 -
 sgreatlight 共回答了21个问题
sgreatlight 共回答了21个问题 |采纳率100%解题思路:化学反应前后,元素的种类不变,原子的种类、个数不变;
根据铜生锈的条件可以判断防止铜生锈的方法.(1)不正确;因为铜、氧气和水中含有铜、氧、氢等三种元素,而铜绿中含有碳、氢、氧、铜等四种元素,不遵循质量守恒定律,应该有含有碳元素的物质参加反应.
(2)因为铜是在空气中生锈,空气中的二氧化碳含有碳元素,所以二氧化碳应该参加了反应.
故填:二氧化碳.
(3)把铜放在干燥的环境中,或给铜镀一层金属,或给铜涂一层油漆等方法都可以防止铜生锈,因为在干燥的环境中缺少水,铜不容易生锈,镀一层金属或涂一层油漆,能使铜与水、氧气和二氧化碳隔绝,不容易生锈.
故填:把铜放在干燥的环境中,或给铜镀一层金属,或给铜涂一层油漆.点评:
本题考点: 金属锈蚀的条件及其防护.
考点点评: 铜生锈需要与水、氧气和二氧化碳同时接触,只要破坏铜生锈的条件,就可以达到防止铜生锈的目的.1年前查看全部
- (2013•福建)根据质量守恒定律可知,碱式碳酸铜〔Cu2(OH)2CO3〕受热分解,不可能得到的物质是( )
(2013•福建)根据质量守恒定律可知,碱式碳酸铜〔Cu2(OH)2CO3〕受热分解,不可能得到的物质是( )
A.CuO
B.H2O
C.CO2
D.HCl mdcgmhh1681年前1
mdcgmhh1681年前1 -
 liyang110 共回答了16个问题
liyang110 共回答了16个问题 |采纳率93.8%解题思路:根据质量守恒定律进行分析,化学反应前后元素的种类不变.根据碱式碳酸铜的化学式可以看出,碱式碳酸铜含有铜、氢、碳、氧四种元素,根据质量守恒定律可知生成物中也只含有这四种元素,因此氧化铜、水和二氧化碳可能是生成物,而氯化氢中含有氯元素,不可能是生成物.
故选:D.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 根据题目提供的信息,对问题做出正确的判断,培养学生提取正确有用信息的能力.1年前查看全部
- 碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2
碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2(OH)2CO3
2CuO+H2O+CO2↑.现将一定量的碱式碳酸铜和铜的粉末放在容器里,在空气中用酒精灯充分加热后冷却,称量,发现加热前后固体的质量相等.据此计算原混合粉末中Cu2(OH)2CO3的质量.△ . 顽固的笑话1年前1
顽固的笑话1年前1 -
 打假派 共回答了23个问题
打假派 共回答了23个问题 |采纳率87%解题思路:根据题意,可知:铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等.铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等;
设原混合物质量为100g,其中碱式碳酸铜的质量为x,则铜的质量为100g-x,生成的水蒸汽和二氧化碳的质量为y;
则根据题意有:
①Cu2(OH)2CO3
△
.
CuO+H2O+CO2↑
222 18+44=62
xy
则[222/x=
62
y],解得y=[62x/222]
②2Cu+O2
△
.
2CuO
12832
100g-xy
[128/100g−x=
32
y],解得y=
32(100g−x)
128
所以得[62x/222]=
32(100g−x)
128,解得x≈47.2g,故
47.2g
100g×100%=47.2%
答:原混合粉末中Cu2(OH)2CO3的质量分数约为47.2%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是对利用化学方程式计算的考查题,解题的关键是对反应前后质量变化的分析,属于基础性知识考查题.1年前查看全部
- 求下列元素的质量分数 H2S中的S为—?CuSO4中Cu的为—?CuO中Cu的为—?Cu2(OH)2CO3中Cu为—?
 fabiongff1年前1
fabiongff1年前1 -
 wangtelry 共回答了17个问题
wangtelry 共回答了17个问题 |采纳率100%第一问为百分之八十八点九,第二问为百分比之四十,第三问为百分之八十,第四问为百分之五十七点七1年前查看全部
- 碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2
碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2(OH)2CO3
2CuO+H2O+CO2↑.现将一定量的碱式碳酸铜和铜的粉末放在容器里,在空气中用酒精灯充分加热后冷却,称量,发现加热前后固体的质量相等.据此计算原混合粉末中Cu2(OH)2CO3的质量.△ . 飘翎叶1年前1
飘翎叶1年前1 -
 潘恬恬 共回答了18个问题
潘恬恬 共回答了18个问题 |采纳率94.4%解题思路:根据题意,可知:铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等.铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等;
设原混合物质量为100g,其中碱式碳酸铜的质量为x,则铜的质量为100g-x,生成的水蒸汽和二氧化碳的质量为y;
则根据题意有:
①Cu2(OH)2CO3
△
.
CuO+H2O+CO2↑
222 18+44=62
xy
则[222/x=
62
y],解得y=[62x/222]
②2Cu+O2
△
.
2CuO
12832
100g-xy
[128/100g−x=
32
y],解得y=
32(100g−x)
128
所以得[62x/222]=
32(100g−x)
128,解得x≈47.2g,故
47.2g
100g×100%=47.2%
答:原混合粉末中Cu2(OH)2CO3的质量分数约为47.2%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是对利用化学方程式计算的考查题,解题的关键是对反应前后质量变化的分析,属于基础性知识考查题.1年前查看全部
- 研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入
研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),消耗73g盐酸,称得烧杯中剩余物质的质量为85.8g.
试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数.(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O) 圣斗士-一辉1年前1
圣斗士-一辉1年前1 -
 garylineker 共回答了14个问题
garylineker 共回答了14个问题 |采纳率92.9%解题思路:(1)先算出二氧化碳气体的质量,然后写出化学方程式并代入二氧化碳气体的质量计算出碱式碳酸铜的质量,最后计算铜矿中碱式碳酸铜的质量分数.
(2)根据化学方程式计算出氯化铜的质量,然后计算出反应后溶液的质量,最后计算出溶液中溶质的质量分数.(1)依题意,CO2的质量=73克+15克-85.8克=2.2克.设铜矿中碱式碳酸铜的质量为X,生成氯化铜质量为Y.
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 27044
XY 2.2克
[222/44]═[X/2.2克]
得:X=11.1克
[270/44]═[Y/2.2克]
得:Y=13.5克
∴铜矿中碱式碳酸铜的质量分数为=[11.1g/15g]×100%=74%.
(2)根据(1)的计算可知,反应后溶液的质量=85.8克-(15克-11.1克)=81.9克.
∴所得溶液中溶质的质量分数=[13.5克/81.9克]×100%═16.5%.
答:铜矿中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 掌握化学方程式的计算格式和规范性,本题的易错点:反应后溶液的质量要减去矿石的杂质.1年前查看全部
- 我们的祖先很早就掌握了炼铜的工艺,他们将孔雀石,主要成分Cu2(OH)2CO3和木炭一起加热就可得到红色的金属铜.请你写
我们的祖先很早就掌握了炼铜的工艺,他们将孔雀石,主要成分Cu2(OH)2CO3和木炭一起加热就可得到红色的金属铜.请你写出化学反应原理.提示:孔雀石受热易分解,得到氧化铜、二氧化碳和水,加热时,用木炭作还原剂就能把氧化铜中的铜还原出来.
 见谁抽谁1年前2
见谁抽谁1年前2 -
 232345 共回答了15个问题
232345 共回答了15个问题 |采纳率93.3%解题思路:充分运用提示的信息,分析出反应物生成物和反应条件,从而写出正确的化学方程式.由提示知:孔雀石加热时分解,生成氧化铜、二氧化碳和水,故方程式为:Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;加热时,用木炭作还原剂把氧化铜中的铜还原出来,根据反应物的组成,还应生成二氧化碳,但条件应是加热,故方程式为:C+2CuO
高温
.
2Cu+CO2↑.
故选Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;C+2CuO
高温
.
2Cu+CO2↑.点评:
本题考点: 探究金属铜的冶炼原理;金属的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解题时要充分利用信息,不能对不熟悉的反应无所适从,同时掌握基础知识,提高知识的衍生能力.1年前查看全部
- 碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2
碱式碳酸铜(Cu2(OH)2CO3)俗称铜绿,受热易分解,生成黑色固体氧化铜、水蒸汽和二氧化碳.反应的化学方程式为Cu2(OH)2CO3
2CuO+H2O+CO2↑.现将一定量的碱式碳酸铜和铜的粉末放在容器里,在空气中用酒精灯充分加热后冷却,称量,发现加热前后固体的质量相等.据此计算原混合粉末中Cu2(OH)2CO3的质量.△ . dolphin24281年前1
dolphin24281年前1 -
 海底琥珀 共回答了16个问题
海底琥珀 共回答了16个问题 |采纳率93.8%解题思路:根据题意,可知:铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等.铜绿受热易分解,生成黑色固体氧化铜,水蒸汽和二氧化碳,水蒸汽和二氧化碳跑到空气中了,铜粉与氧气反应生成CuO,因为加热前后固体的质量相等,所以跑掉的水蒸汽和二氧化碳的质量与铜反应的氧气的质量相等;
设原混合物质量为100g,其中碱式碳酸铜的质量为x,则铜的质量为100g-x,生成的水蒸汽和二氧化碳的质量为y;
则根据题意有:
①Cu2(OH)2CO3
△
.
CuO+H2O+CO2↑
222 18+44=62
xy
则[222/x=
62
y],解得y=[62x/222]
②2Cu+O2
△
.
2CuO
12832
100g-xy
[128/100g−x=
32
y],解得y=
32(100g−x)
128
所以得[62x/222]=
32(100g−x)
128,解得x≈47.2g,故
47.2g
100g×100%=47.2%
答:原混合粉末中Cu2(OH)2CO3的质量分数约为47.2%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是对利用化学方程式计算的考查题,解题的关键是对反应前后质量变化的分析,属于基础性知识考查题.1年前查看全部
- 火烧孔雀石【Cu2(OH)2CO3】也属还原法 这句话对吗?
 彼岸野花1年前2
彼岸野花1年前2 -
 wangxh0798 共回答了18个问题
wangxh0798 共回答了18个问题 |采纳率77.8%这句话是对的.燃烧法制取铜使价态降低,属于还原反应,所以可以认为是还原法.
Cu2(OH)2CO3 ══2CuO + CO2↑+ H2O (加热)
CuO + CO ══Cu + CO2 (加热)
整体是还原法1年前查看全部
- 氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含
氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等.用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①选用______(填字母).Fe3+ Cu2+ Fe2+ 开始沉淀的pH 2.7 5.4 8.1 沉淀完全的pH 3.7 6.9 9.6
A.CuB.Cl2C.NH3•H2OD.NaOH
(2)加入试剂②的目的是调节pH至a,a的范围是______.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是______、______过滤和无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是______.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是______.
②称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为b g.则x=[80a−135b/18b][80a−135b/18b](用含a、b的代数式表示). 香如玉1年前1
香如玉1年前1 -
 vcactor 共回答了19个问题
vcactor 共回答了19个问题 |采纳率100%解题思路:(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,结合金属离子从开始沉淀到沉淀完全时溶液的pH选择pH的范围.
由溶液到晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解.
②加热沉淀至质量不再减轻为止,b g为CuO质量,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),再结合m=nM计算x的值.(1)由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
A.Cu不能与Fe2+反应,故A错误;
B.Cl2可以将Fe2+氧化为Fe3+,且不引入新杂质,故B正确;
C.NH3•H2O可以沉淀Cu2+、Fe2+、Fe3+,引入铵根离子,故C错误;
D.NaOH可以沉淀Cu2+、Fe2+、Fe3+,引入钠离子,故D错误.
故选:B.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,不能沉淀Cu2+,由金属离子从开始沉淀到沉淀完全时溶液的pH可知,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.4开始沉淀,所以应该可知pH范围为3.7~5.4.
由溶液获得CuCl2•xH2O晶体需要蒸发浓缩、冷却结晶、过滤、洗涤等.
氯化铜易溶于水,使用无水乙醇代替水进行洗涤,防止CuCl2•xH2O晶体溶解损失.
故答案为:3.7~5.4;蒸发浓缩、冷却结晶;防止CuCl2•xH2O晶体溶解损失.
(3)①CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O⇌Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大.
故答案为:CuCl2•xH2O晶体加热时会发生水解.
②b g为CuO质量为[bg/80g/mol]=[b/80]mol,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),所以ag=[b/80]mol×(135+18x)g/mol,解得,x=[80a−135b/18b].
故答案为:[80a−135b/18b].点评:
本题考点: 制备实验方案的设计;化学方程式的有关计算;常见阳离子的检验;探究物质的组成或测量物质的含量.
考点点评: 考查阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.1年前查看全部
- 孔雀石的主要成分为碱式碳酸铜[Cu2 (OH)2CO3],化学小组的同学利用 Cu2 (OH)2CO3+4HCl=2Cu
孔雀石的主要成分为碱式碳酸铜[Cu2 (OH)2CO3],化学小组的同学利用 Cu2 (OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O,测定某孔雀石中碱式碳酸铜的质量分数.称取该铜矿样品30g于烧杯中,逐滴加入溶质质量分数为10%的稀盐酸至恰好完全反应,共用去稀盐酸146g(假设铜矿中的其他成分不与稀盐酸反应,也不溶于水).则该孔雀石样品中碱式碳酸铜的质量分数是多少?反应后所得溶液中溶质的质量分数是多少?
 不爱理你1年前1
不爱理你1年前1 -
 歪脑袋 共回答了19个问题
歪脑袋 共回答了19个问题 |采纳率100%解题思路:根据碱式碳酸铜与稀酸反应的方程式,由稀盐酸溶液质量和溶质质量分数求出碱式碳酸铜的质量,再除以孔雀石样品的质量即可得出碱式碳酸铜的质量分数,根据碱式碳酸铜与稀盐酸反应的方程式可知,反应后所得溶液中溶质是氯化铜,根据质量守恒定律反应后溶液的质量等于盐酸溶液的质量加上参加反应的碱式碳酸铜的质量减去生成的二氧化碳的质量,根据氯化铜和溶液的质量就可求出反应后所得溶液中溶质的质量分数.设孔雀石样品中碱式碳酸铜的质量为x,生成的二氧化碳的质量为y
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 14627044
X146g×10%y
[222/146=
x
146g×10%] X=22.2g
[146/44=
146g×10%
y] Y=27g
该孔雀石样品中碱式碳酸铜的质量分数是:[22.2/30]×100%=74%
反应后所得溶液中溶质的质量分数是[27/146+22.2−4.4]×100%=16.5%
答:孔雀石样品中碱式碳酸铜的质量分数是74%,反应后所得溶液中溶质的质量分数是16.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查了根据化学方程式的计算,解题的关键是会根据质量守恒定律由参加反应的碱式碳酸铜和稀盐酸的质量以及生成的二氧化碳的质量求出反应后生成的溶液的质量.1年前查看全部
- 将一严重锈蚀而部分变成铜绿[Cu2(OH)2CO3]的铜块研磨成粉末,在空气中充分灼烧成CuO,固体质量的变化情况可能是
将一严重锈蚀而部分变成铜绿[Cu2(OH)2CO3]的铜块研磨成粉末,在空气中充分灼烧成CuO,固体质量的变化情况可能是( )
A. 增重30%
B. 增重10%
C. 不变
D. 减轻30% duckie44881年前1
duckie44881年前1 -
 fcpop 共回答了21个问题
fcpop 共回答了21个问题 |采纳率95.2%解题思路:根据题意可知其中存在铜单质(部分变质),且有铜绿(有变质的部分).固体最多增重Cu→CuO,固体最多减轻Cu2(OH)2CO3→CuO,故可根据极值法求出增重最多的和减轻最少的进行判断.因为固体最多增重Cu→CuO,固体最多减轻Cu2(OH)2CO3→CuO,
①假设全部为铜:则加热变为氧化铜,会增重氧元素的质量,相当于铜元素质量的[16/64],即25%;
②假设全部为铜绿:则加热后只余氧化铜,那么减轻的质量应为Cu2(OH)2CO3中保留CuO部分外的质量,即
(222−160)
222=27.9%;
综上,由于是两种情况的混合物,所以真正的变化情况应是处于两者之间,也就是在增重25%与减轻27.9%之间的,
故选BC.点评:
本题考点: 常见化学反应中的质量关系.
考点点评: 本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.1年前查看全部
大家在问
- 1by coincidence是什么意思?
- 2联系贝壳的主题,说说作者对贝壳外形作了细腻的描绘,目的是什么?
- 3一元一次方程的甲乙两人练习赛跑,如果甲让乙先跑10米,那么甲跑5秒钟就可以追上乙
- 4英语翻译大理崇圣寺三塔,澄江抚仙湖或普者黑,陆良彩色沙林的英语导游词.能讲十分钟左右就可以.口语为主,能讲十分钟左右就行
- 5请问是it was not until 1990s还是It was not until the 1990s
- 6实验室制备乙酸乙酯为什么不是乙酸过量?
- 7作文,怎样过中秋节500字
- 8hardly 前什么时候加be如I am hardly do cooking 还是I hardly do cooking
- 9NIHONG GO是啥意思?I DO NOT KNOW NIHONG GO!啥意思
- 10关于艺术品作文的题材,例如一幅画啦之类的,最好靠近小学生活.
- 11含1.4克某碱金属及其氧化物的混合物跟水反应后蒸发溶液得不含结晶水固体1.7克,则混合物中碱金属质量分数
- 12生活处处有物理,留心观察皆学问.对以下现象解释正确的是( )
- 13如果人民币一年定期储蓄的年利率是X,一年到期后,银行将本金和利息自动按一年定期储蓄转存,到期支取时
- 14cosπ/9cos2π/9cos23π/9
- 15去年今日此门中,人面桃花相映.人面不知何处去,桃花依旧笑春风.这首诗题和诗意是什么?
