化学家闵恩泽院士获2007年度国家最高科学技术奖,近年来闵院士开始开发化纤单体己内酰胺的制造技术,己内酰胺分子式为C 6
 辣嘴辣椒_cc2022-10-04 11:39:541条回答
辣嘴辣椒_cc2022-10-04 11:39:541条回答| 化学家闵恩泽院士获2007年度国家最高科学技术奖,近年来闵院士开始开发化纤单体己内酰胺的制造技术,己内酰胺分子式为C 6 H 11 NO,下列说法不正确的是( ) A.己内酰胺相对分子质量为113 B.各元素质量比依次为72:11:14:16 C.分子中原子个数比依次为6:11:1:1 D.在空气中完全燃烧的产物是二氧化碳和水 |

已提交,审核后显示!提交回复
共1条回复
 落花听音 共回答了17个问题
落花听音 共回答了17个问题 |采纳率100%- A、己内酰胺分子式为C 6 H 11 NO,因此己内酰胺的相对分子质量是12×6+1×11+14+16=113,故说法正确;
B、己内酰胺分子式为C 6 H 11 NO,因此碳、氢、氮、氧四种元素质量比为(12×6):(1×11):14:16=72:11:14:16,故说法正确;
C、己内酰胺分子式为C 6 H 11 NO,因此分子中碳原子、氢原子、氮原子、氧原子个数比为6:11:1:1,故说法正确;
D、己内酰胺分子式为C 6 H 11 NO,根据质量守恒定律可知己内酰胺在空气中完全燃烧的产物中有含氮元素的物质,故说法错误;
故选D. - 1年前
相关推荐
- 沃森 克里克 就是一开始将AA和TT相对排列,有化学家提出违反化学规律,究竟是什么规律呢?
 心惊胆战的小可怜1年前2
心惊胆战的小可怜1年前2 -
 落幕收场 共回答了19个问题
落幕收场 共回答了19个问题 |采纳率89.5%形成氢键有问题.1年前查看全部
- 远古时期,人类就用硅的氧化物和硅酸盐来制作陶瓷.而硅单质直到18世纪才被化学家制备出来.
远古时期,人类就用硅的氧化物和硅酸盐来制作陶瓷.而硅单质直到18世纪才被化学家制备出来.
为什么硅单质这么晚才出现在人类生活呢? zechuan1年前1
zechuan1年前1 -
 koubunzui 共回答了23个问题
koubunzui 共回答了23个问题 |采纳率78.3%因为原始条件下,二氧化硅、硅酸盐这类稳定的化合物,无法实现硅的化合物的分解,得到单晶硅.直到近代,电的发现才使得硅单质的出现成为可能.1年前查看全部
- 化学家能对化学世界探索,正在利用__技术制造具有特定功能的产品,使化学在__`__`__和__等研究上发挥了作用
 nintendo701年前1
nintendo701年前1 -
 冰皓 共回答了20个问题
冰皓 共回答了20个问题 |采纳率95%现在,化学家们已经能利用各种先进的仪器和分析技术对化学世界进行微观的探索,并正在探索利用纳米技术制造出具有特定功能的产品,使化学在材料、能源、环境和生命科学等研究上发挥越来越重要的作用.1年前查看全部
- 诺贝尔是一位怎样的化学家?
 uhead1年前1
uhead1年前1 -
 哈别一个 共回答了16个问题
哈别一个 共回答了16个问题 |采纳率93.8%伟大1年前查看全部
- 1806年,英国化学家戴维用电解法从苏打(碳酸钠)中得到一种金属.他对这种新金属作了如下实验:取一块金属
 yanfv5131年前1
yanfv5131年前1 -
 kingkyoking 共回答了21个问题
kingkyoking 共回答了21个问题 |采纳率85.7%物理性质:
1.密度小(浮在水上)
2.熔点低(熔成小球)
3.硬度低(用到可以切割)
4.是银白色固体(颜色和状态)
化学性质:能与水反应(也可以说和水反应产生气体,因为在水上急速运动,说明有气体推动)1年前查看全部
- 绿色化学又称为-------,它给化学家提出了一项新的挑战,其核心就是-------.
 liancaiyan1年前1
liancaiyan1年前1 -
 ivanxxb 共回答了15个问题
ivanxxb 共回答了15个问题 |采纳率86.7%绿色化学又称环境无害化学,反应过程和化工生产中,尽量减少或彻底消除使用和生产有害物质.1年前查看全部
- 19世纪中叶,俄国化学家门捷列夫对化学这一学科的巨大贡献是( )
19世纪中叶,俄国化学家门捷列夫对化学这一学科的巨大贡献是( )
A. 提出了原子学说
B. 发现了元素周期律
C. 提出了分子学说
D. 发现了新的元素 sg_wyl1年前4
sg_wyl1年前4 -
 atonomy 共回答了20个问题
atonomy 共回答了20个问题 |采纳率85%解题思路:1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循.A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.俄国化学家门捷列对已发现的元素进行研究,未发现了新的元素,故D错误.
故选B.点评:
本题考点: 化学史.
考点点评: 本题主要考查了化学史,难度不大.了解化学的发展史,有利于激发学生学习化学的兴趣,培养社会责任感.1年前查看全部
- 英国的道尔顿是最早提出原子理论的化学家 对道尔顿的观点作何评论
 godspeedyy1年前1
godspeedyy1年前1 -
 ljllk 共回答了17个问题
ljllk 共回答了17个问题 |采纳率94.1%那是 人类大胆的猜想
因为在那时原子是看不见的
当然了在当时人类是无法理解的1年前查看全部
- 最早提出定量分析的化学家
 cythia04091年前2
cythia04091年前2 -
 yy33547 共回答了17个问题
yy33547 共回答了17个问题 |采纳率76.5%有机物元素定量分析最早由德国人李比希提成1年前查看全部
- 我国著名化学家张青莲教授测定的锑元素的相对原子质量为121.760,早在1993年已被国际相对原子质量委员会确认为锑的国
我国著名化学家张青莲教授测定的锑元素的相对原子质量为121.760,早在1993年已被国际相对原子质量委员会确认为锑的国际标准相对原子质量.已知锑有质量数为121、质子数为51的Sb和质量数为123、质子数51的Sb两种天然同位素.下列说法中正确的是( ).
A.121.760是一个锑原子的质量与一个12C原子质量的1/12的比值.
B.121.760是按锑的两种天然同位素的质量数与它们的原子百分比计算出来的平均值.
C.天然存在的锑元素中(质量数为121、质子数为51)
Sb与(质量数为123、质子数为51)Sb的原子个数比为
31:19.
D.(质量数为123、质子数为51)Sb的原子质量与12C的原子质量的比值是123:1.
A为何错了 allfreesky1年前1
allfreesky1年前1 -
 守海人 共回答了19个问题
守海人 共回答了19个问题 |采纳率100%不应该是一个锑原子的质量,应该是平均的,因为有2种同位素1年前查看全部
- 我国著名化学家候德榜写的《_》一书,揭开了制碱秘密.
 cqbbjgym1年前1
cqbbjgym1年前1 -
 laoyoung 共回答了12个问题
laoyoung 共回答了12个问题 |采纳率83.3%他把制碱法的全部技术和自己的实践经验写成专著《纯碱制造》,于1933年在纽约列入美国化学会丛书出版,揭开了制碱秘密!1年前查看全部
- 揭开碱奥秘的我国著名的化学家是谁
 7408281年前4
7408281年前4 -
 红富士 共回答了19个问题
红富士 共回答了19个问题 |采纳率94.7%侯德榜1年前查看全部
- 我国著名化学家张青莲教授测定的锑元素的相对原子质量为121.760,早在1993年已被国际相对原子质量委员会确认为锑的国
我国著名化学家张青莲教授测定的锑元素的相对原子质量为121.760,早在1993年已被国际相对原子质量委员会确认为锑的国际标准相对原子质量.已知锑有质量数为121、质子数为51的Sb和质量数为123、质子数51的Sb两种天然同位素.下列说法中正确的是( ).
A.121.760是一个锑原子的质量与一个12C原子质量的1/12的比值.
B.121.760是按锑的两种天然同位素的质量数与它们的原子百分比计算出来的平均值.
C.天然存在的锑元素中(质量数为121、质子数为51)
Sb与(质量数为123、质子数为51)Sb的原子个数比为
31:19.
D.(质量数为123、质子数为51)Sb的原子质量与12C的原子质量的比值是123:1
这个题的答案是C,想知道ABD哪里错了. nana_9711年前3
nana_9711年前3 -
 cwchaker 共回答了23个问题
cwchaker 共回答了23个问题 |采纳率82.6%A 元素原子量是各种同位素的加权值 A错
B 是加权值不是平均值
C
D 是123:12 不是 123:1
设有121的Sb和123的Sb分为 x 和y
则 元素原子量==(121x+123y)/(x+y)==121.76
x:y==31:19
选C1年前查看全部
- 3、化学领域内的大多数研究成果都是通过实验来获得的.下面是早期英国化学家普里斯特利研究空气成分所做的实验:用一个玻璃钟罩
3、化学领域内的大多数研究成果都是通过实验来获得的.下面是早期英国化学家普里斯特利研究空气成分所做的实验:用一个玻璃钟罩将一支燃着的蜡烛和一只小老鼠一同扣上,过一段时间后,蜡烛逐渐熄灭,小老鼠也开始抽搐,直至死亡.普里斯特利被这种现象所困扰,老鼠是不是死于被污染的空气?但是当他用处理后的洁净的空气重复上述实验时,另一只老鼠同样也死去了.到底是什么气体导致了老鼠的死亡呢?若用植物代替老鼠,其是否也死亡呢?实验结果是:蜡烛依旧渐渐熄灭,而植物不但没有死亡,反而第二天长出新芽,从普里斯特利的上述实验中,我们可以得出什么结论?
 blackeyescug1年前3
blackeyescug1年前3 -
 Khephri 共回答了24个问题
Khephri 共回答了24个问题 |采纳率83.3%植物可以更新因蜡烛燃烧或小鼠呼吸而变得污浊的空气
用现在的解释就是蜡烛燃烧和小鼠呼吸会消耗氧气,最终小鼠缺氧而死
而植物通过光合作用可以产生氧气供小鼠呼吸
这其实是一个生物题目啊.1年前查看全部
- 1.具有真正意义的元素周期表是由那位化学家发现的是
 failurer1年前6
failurer1年前6 -
 dodger醉客 共回答了25个问题
dodger醉客 共回答了25个问题 |采纳率92%化学元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形.在周期表中,元素是以元素的原子序排列,最小的排行最先.表中一横行称为一个周期,一列称为一个族.1年前查看全部
- 19世纪,化学家对氧化锆的化学式有争议.经测定,锆的相对原子质量为91,其氯化物的相对分子质量是233.若氧化锆中锆的化
19世纪,化学家对氧化锆的化学式有争议.经测定,锆的相对原子质量为91,其氯化物的相对分子质量是233.若氧化锆中锆的化合价与氯化物中的相同,氧化锆的化学式为( )
A. ZrO2
B. Zr2O
C. Zr2O3
D. ZrO luoyuILFD1年前1
luoyuILFD1年前1 -
 myQQQ 共回答了21个问题
myQQQ 共回答了21个问题 |采纳率85.7%解题思路:根据锆、氯的相对原子质量,由氯化物的相对分子质量为233,可以算出锆元素的化合价,最后写出氧化物的化学式.设锆元素的化合价为+X,由氯的化合价为-1价,则氯化物的化学式为:ZrClx
∵锆的氯化物的相对分子质量为233.
∴91+35.5X=233 得:X=4
∵在锆的氧化物中锆的化合价是+4价,氧元素的化合价是-2价.
∴氧化物的化学式为:ZrO2,
故选A.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 根据化合价原则,学会根据化学式求化合价,由化合价书写物质的化学式.1年前查看全部
- 2007年诺贝尔化学奖授予德国化学家GerhardErtl,以表彰他对固体表面化学过程研究的重大发现.使CO、NOx等在
2007年诺贝尔化学奖授予德国化学家GerhardErtl,以表彰他对固体表面化学过程研究的重大发现.使CO、NOx等在铂表面发生化学反应转变成两种无毒气体(其中一种是空气中最多的气体),以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一.下列有关说法不正确的是( )
 A. CO、NOx在铂表面生成CO2和N2
A. CO、NOx在铂表面生成CO2和N2
B. 铂在反应中应该起催化剂的作用
C. 该反应属于置换反应
D. 化学方面的成就为人类提高生活质量提供了方便 evvnne1年前1
evvnne1年前1 -
 winsor在线 共回答了14个问题
winsor在线 共回答了14个问题 |采纳率92.9%解题思路:A、根据信息“使CO、NOx等在铂表面发生化学反应转变成两种无毒气体”判断.
B、根据催化剂的作用判断.
C、根据置换反应的定义判断.
D、根据化学的用途判断.A、根据信息“使CO、NOx等在铂表面发生化学反应转变成两种无毒气体”,可以得出CO、NOx是在铂表面生成CO2和N2,所以正确.
B、在该反应中铂是催化剂,起催化作用,所以正确.
C、置换反应是一种单质与一种化合物反应,生成另外的一种单质和化合物的反应,在该反应的反应物中无单质,不是置换反应,所以错误.
D、利用化学可以合成药物、生产化肥和农药、开发新能源和新材料、综合利用自然资源和保护环境,故为人类提高生活质量提供了方便,所以正确.
故选C.点评:
本题考点: 防治空气污染的措施;催化剂的特点与催化作用;反应类型的判定.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,思维跨度大,强调了学生课本知识的运用能力.1年前查看全部
- 2007年诺贝尔化学奖授予德国化学家格哈德•埃特尔,他的贡献有助于人们理解铁的锈蚀机理、如何防锈等问题.下列做法不能有效
2007年诺贝尔化学奖授予德国化学家格哈德•埃特尔,他的贡献有助于人们理解铁的锈蚀机理、如何防锈等问题.下列做法不能有效防止铁制品锈蚀的是( ) A.在铁制面盆表面烤制搪瓷 B.制造炊具采用不锈钢材料 C.自行车经常用水冲冼 D.机器齿轮经常打油  飛狐仟年1年前1
飛狐仟年1年前1 -
 Doratony 共回答了17个问题
Doratony 共回答了17个问题 |采纳率88.2%A、在铁制面盆表面烤制搪瓷能够使铁制品与氧气和水隔绝,从而防止铁制品生锈;
B、不锈钢属于合金,耐腐蚀性强,制造的炊具不容易生锈;
C、自行车经常用水冲冼时容易生锈;
D、机器齿轮经常打油能够使机器齿轮与氧气和水隔绝,从而防止铁制品生锈.
故选C.1年前查看全部
- 历史上勤奋的化学家有那些举出具体事例
 majian1181年前1
majian1181年前1 -
 4_oooo 共回答了18个问题
4_oooo 共回答了18个问题 |采纳率88.9%最勤奋的当然是俄国化学家门捷列夫,他是元素周期表的发明者,他最勤奋,最后是因为好多天连续工作耒耜在实验台旁.1年前查看全部
- 仔细阅读下列材料。材料一:1869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片段),并在他
仔细阅读下列材料。
材料一:1869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片段),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。
材料二:1875年,法国化学家布瓦博德朗公布类铝他发现的新元素镓(元素符号Ga)X的性质;镓是银白色金属,密度4.7g/cm3,能与沸水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9g/cm3~6.0g/cm3之间。
材料三:1876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g/com3,从而验证了元素周期表的正确性。随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素。目前金属镓广泛用于制造半导体材料。镓的原子结构示意图如右,常见化合价为-3。
请回答下列问题:
(1)镓元素原子的质子数为__________________,其原子最外层电子数为_____________;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:_________________________________________-;
化学性质(请用化学方程式表示):;
用途:___________________________________________________________。
(3)氢氧化镓与氢氧化钾都具有碱的性质,则氢氧化镓与稀硫酸反应生成盐的化学式为
。 jxhsh1年前1
jxhsh1年前1 -
 goodtolove 共回答了25个问题
goodtolove 共回答了25个问题 |采纳率80%(1)31 3
(2)物理性质:银白色金属,密度为5.94g/com3
化学性质:2Ga+6H20 2Ga(OH)3+3H2↑
2Ga(OH)3+3H2↑
用途:制造半导体材料
(3)Ga2(SO4)3
分析:(1)根据在原子中,质子数=核外电子数,进行解答;
离原子核最远的是最外层,依据原子结构示意图即可解答;
(2)物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质;物质的化学性质包括可燃性、氧化性、还原性、稳定性、酸性、碱性、热解性等,通常描述的语句中有能、可以、可等字眼儿进行解答;
(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法即可写出化学式.
(1)根据在原子中,质子数=核外电子数,由原子结构示意图可知镓元素原子的质子数为:31;
最外层电子数为:3;
(2)根据物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质,从题中可知
镓的物理性质为:镓是银白色金属,密度为5.94g?cm -3 ;
根据镓能与沸水剧烈反应生成氢气和氢氧化镓反应化学方程式为:2Ga+6H 2 O 2Ga(OH) 3 +3H 2 ↑;
2Ga(OH) 3 +3H 2 ↑;
根据目前金属镓广泛用于制造半导体材料,可知镓的用途为:制造半导体材料;
故答案为:银白色金属,密度为5.94g?cm -3 ; 2Ga+6H 2 O 2Ga(OH) 3 +3H 2 ↑; 制造半导体材料;
2Ga(OH) 3 +3H 2 ↑; 制造半导体材料;
(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法写出硫酸镓的化学式为:Ga 2 (SO 4 ) 3 ;
故答案为:Ga 2 (SO 4 ) 3 .1年前查看全部
- 在线求指导:1828年,德国化学家维
在线求指导:1828年,德国化学家维
1828年,德国化学家维勒第一次用无机物氯化铵和氰酸银制成了尿素,尿素是动物体内排出的一种有机物你认为维勒的实验可以说明什么___________.  烟草味道0011年前1
烟草味道0011年前1 -
 gg0126 共回答了22个问题
gg0126 共回答了22个问题 |采纳率95.5%由无机物形成有机物的这一过程是可能的1年前查看全部
- 1909年化学家哈伯在实验室首次合成了氨2007年化学家格哈德·埃特尔在 最后一问急
 唐以洪1年前1
唐以洪1年前1 -
 jxcf 共回答了20个问题
jxcf 共回答了20个问题 |采纳率90%54123 还有楼主前面那反应是可逆反应 要用双箭头1年前查看全部
- .比利时化学家海尔蒙特曾做过这样一个实验:将一颗柳树苗载入经烘干称重的一盆泥土中,经常浇水,五年后,柳树长成大树.盆中的
.比利时化学家海尔蒙特曾做过这样一个实验:将一颗柳树苗载入经烘干称重的一盆泥土中,经常浇水,五年后,柳树长成大树.盆中的泥土经烘干称重,发现重量没有减少.下列说法正确的是
A.树木生长只需要水 B.泥土中不含树木生长所需的元素
C.树木不能从泥土中吸收生长所需元素 D.水可以为树木生长提供氢元素和氧元素 蕃茄圆子1年前3
蕃茄圆子1年前3 -
 放纵心情 共回答了18个问题
放纵心情 共回答了18个问题 |采纳率88.9%选D
最简单是用排除法:首先树木生长肯定不会只需要水分,还要从土壤中吸收无机盐,从空气中吸收二氧化碳,所以ABC肯定是错的.
至于柳树增加的重量,主要是水分和有机物,有机物的来源是由植物光合作用生成的.从二氧化碳中分离出碳元素,再和水中的氢元素、氧元素结合,生成葡萄糖.所以D是正确的
至于说泥土的重量没有减少,应该是几乎没有减少,肯定是会有少量的无机盐被吸收的.几百年前的实验,测量不可能非常精准的.1年前查看全部
- 美国化学家r.f.heck因发现如下heck反应什么的
 wangqing851年前1
wangqing851年前1 -
 yanwh1 共回答了17个问题
yanwh1 共回答了17个问题 |采纳率94.1%答案:(1)a、d
(2)(CH3)2CHCH=CH2 (3)新制Cu(OH)2悬浊液(或新制银氨溶液)1年前查看全部
- 1850年,法国化学家( )通过考察溶液旋光性的变化,给出了表示物质浓度和反应速度关系的第一个数学表达式
 目视钱方1年前2
目视钱方1年前2 -
 cw2004 共回答了14个问题
cw2004 共回答了14个问题 |采纳率92.9%威廉米 他既是化学家又是物理学家 不过是德国的 你非要找法国的只能是贝赛罗了1850年,德国物理学家威廉米 (Ludwig Ferdinand Wilhelmy,1812~1864)通过考察溶液旋光性的变化,研究了蔗糖加酸水解反应,发现在大量水存...1年前查看全部
- 一道天原杯试题4多选题:20世纪20年代,一些化学家提出的酸碱质子理论认为:凡能放出质子(H+)的分子或离子都是酸,凡能
一道天原杯试题4
多选题:20世纪20年代,一些化学家提出的酸碱质子理论认为:凡能放出质子(H+)的分子或离子都是酸,凡能结合质子的分子或离子都是碱.根据这一理论,下列物质不属于碱的是
A.HNO3 B.HCO3 C.NH4(+) D.SO4(2+) 张飞跃1年前1
张飞跃1年前1 -
 bmw宝马 共回答了16个问题
bmw宝马 共回答了16个问题 |采纳率75%AC
所谓质子论,就是能接受质子的分子或离子都是碱,质子也就是氢离子,这个你知道吧,你看哪个不能加氢离子了...
B加氢离子为碳酸
D加氢离子为硫酸氢根1年前查看全部
- 高中化学?谢谢 下列科学家中化学家是_. A.拉瓦锡 B.笛卡儿 C.李四光 D.祖冲之
 man1571571年前3
man1571571年前3 -
 汉民1116 共回答了17个问题
汉民1116 共回答了17个问题 |采纳率100%选A ,拉瓦锡(A.L.Lavoisier,1743.8.26-1794.5.8)法国著名化学家,近代化学的奠基人之一,“燃烧的氧学说”的提出者.1743年8月26日生于巴黎,因其包税官的身份在法国大革命时的1794年5月8日于巴黎被处死.拉瓦锡与他人合作制定出化学物种命名原则,创立了化学物种分类新体系.拉瓦锡根据化学实验的经验,用清晰的语言阐明了质量守恒定律和它在化学中的运用.这些工作,特别是他所提出的新观念、新理论、新思想,为近代化学的发展奠定了重要的基础,因而后人称拉瓦锡为近代化学之父.拉瓦锡之于化学,犹如牛顿之于物理学.1年前查看全部
- 甲、乙、丙住在相邻的公寓房子里,乙住中间.三人的职业分别是电台广播员、医生和化学家.当甲出差时,电台广播员就替甲照顾花木
甲、乙、丙住在相邻的公寓房子里,乙住中间.三人的职业分别是电台广播员、医生和化学家.当甲出差时,电台广播员就替甲照顾花木;当丙的立体声音乐太响时,化学家就敲丙的墙.据此可知 ( a.甲是医生 b.乙是医生 c.丙是化学家 为什么?我想了很久都没想出来.
 hjj15141年前1
hjj15141年前1 -
 khjkuy 共回答了20个问题
khjkuy 共回答了20个问题 |采纳率90%甲是医生.很简单,根据后两句,可以得知甲不是广播员、丙不是化学家,就排除c了.而甲和丙的房子中间隔着乙,所以甲不可能敲丙的房子,由此可知乙就是化学家了,于是又排除d和b了.所以正确答案是a."
更多公考资讯请查看安徽人才信息网http://www.***.com1年前查看全部
- 诺贝尔化学奖曾授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NO x 等在
诺贝尔化学奖曾授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NO x 等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是 [ ]A.CO在铂表面被氧化生成CO 2 ,铂起催化作用
B.汽车尾气中NO x 在铂表面发生反应的产物是N 2
C.CO在铂表面可能和O 2 、NO x 反应
D.NO x 、CO、CO 2 均能与人体中的血红蛋白结合而使人中毒 我是sqboy1年前1
我是sqboy1年前1 -
 marsherfu 共回答了17个问题
marsherfu 共回答了17个问题 |采纳率94.1%D1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图1
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图1,请利用下表回答相关问题.

(1)用符号表示:带两个单位负电荷且质子数为8的离子______.
(2)我发现如下规律:
①在化学反应中,第1纵行的元素比较容易______电子(除H外);第7纵行的元素比较容易______电子,可见元素的化学性质主要决定于原子的______数.
②从原子结构方面看:同一横行的元素具有相同的______数;同一纵行的元素具有相同______数.
(3)图2甲是两种元素在周期表中的信息,图2乙是氟原子的原子结构示意图.请完成下列问题:
①图2甲方框的横线上填的是______,图2乙方框横线上的数字是______;
②图2甲所示两种元素形成化合物的化学式为______. serap123451年前1
serap123451年前1 -
 当缘分不在 共回答了13个问题
当缘分不在 共回答了13个问题 |采纳率84.6%解题思路:(1)根据质子数判断元素为O,据此可写出该元素的离子;
(2)①根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;金属元素在化学反应中易失去电子,非金属元素在化学反应中易得到电子,元素的化学性质与最外层电子数有关,进行解答;②根据原子结构示意图进行分析解答本题;
(3)①根据元素名称写出元素符号即可;根据在原子中,原子序数=质子数=核外电子数,进行解答;②根据化合价利用十字交叉法写出化学式即可.(1)根据质子数判断元素为O,带两个单位负电荷,由此可知该离子为:O2-,故答案为:O2-;
(2)①根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;金属元素在化学反应中易失去电子,非金属元素在化学反应中易得到电子,元素的化学性质与最外层电子数有关;故答案为:失;得;最外层电子;
②根据原子结构示意图分析可知:同一横行的元素具有相同的电子层数;同一纵行的元素具有相同的最外层电子数;故答案为:电子层;最外层电子;
(3)①根据元素名称写出元素符号为Ca;根据在原子中,原子序数=质子数=核外电子数,乙中的最外层电子数为7;②根据化合价利用十字交叉法,两种元素形成化合物的化学式为:CaF2;故答案为:Ca;7;CaF2.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;化学式的书写及意义.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 2010年诺贝尔化学奖授予在“钯催化交叉偶联反应”领域作出突出贡献的三位化学家.下列有关钯原子( 10646P
2010年诺贝尔化学奖授予在“钯催化交叉偶联反应”领域作出突出贡献的三位化学家.下列有关钯原子(
Pd)的说法错误的是( )10646
A.
Pd是钯原子的一种核素10646
B.
Pd与10646
Pd是同位素10746
C.电子数为46
D.中子数为46 asdfgb1年前1
asdfgb1年前1 -
 sunwet 共回答了16个问题
sunwet 共回答了16个问题 |采纳率75%解题思路:A.核素是指具有一定数目质子和一定数目中子的同一种原子;
B.有相同质子数,不同中子数的原子互为同位素;
C.电子数=质子数;
D.中子数=质量数-质子数.A.
10646Pd质子数为46,中子数=质量数-质子数=106-46=60,是钯原子的一种核素,故A正确;
B.
10646Pd与
10746Pd质子数相同,中子数不同,互为同位素,故B正确;
C.
10646Pd质子数为46,电子数=质子数=46,故C正确;
D.A.
10646Pd质子数为46,中子数=质量数-质子数=106-46=60,故D错误,
故选D.点评:
本题考点: 核素.
考点点评: 本题考查同位素、核素的概念,以及微粒间的数量关系,难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.1年前查看全部
- (2008•卢湾区二模)2007年诺贝尔化学奖表彰了在表面化学有突破性研究的德国化学家格哈德•埃特尔,他主要研究一氧化碳
(2008•卢湾区二模)2007年诺贝尔化学奖表彰了在表面化学有突破性研究的德国化学家格哈德•埃特尔,他主要研究一氧化碳在铂表面催化下的氧化反应,由此实现了汽车尾气中有毒气体一氧化碳的清洁排放.下列说法中错误的( )
A.该反应为化合反应
B.铂在该反应中起催化作用
C.该反应遵守质量守恒定律
D.一氧化碳是氧化剂 只想活到70岁1年前1
只想活到70岁1年前1 -
 udc_30d2wz4_1eb 共回答了21个问题
udc_30d2wz4_1eb 共回答了21个问题 |采纳率90.5%解题思路:A、根据该反应的反应物和生成物的特点进行分析,
B、根据铂是催化剂进行分析,
C、根据该反应是化学变化进行分析,
D、根据一氧化碳在该反应中发生的是氧化反应进行分析,A、一氧化碳在铂表面催化下的氧化反应,生成了无毒的气体,肯定还氧化剂,但是不一定是氧气,所以不一定是化合反应.故A错误.
B、铂在反应中是催化剂,起的就是催化作用,故B正确,
C、只要是化学反应都遵循质量守恒定律,该反应是化学变化,也就遵循质量守恒定律,故C正确,
D、根据氧化还原反应的原理可知,氧化剂发生的是还原反应,还原剂发生的是氧化反应,一氧化碳发生的是氧化反应,应该是还原剂,故D错误,
故选AD.点评:
本题考点: 一氧化碳的化学性质.
考点点评: 做这类题,首先要根据题中的叙述提炼出对解题有用的知识,然后结合所学的知识对各个选项进行逐一的分析,在氧化还原反应中,氧化剂发生的是还原反应,还原剂发生的是氧化反应.1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表雏形,如图为元素周期表的部分元素的相关
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表雏形,如图为元素周期表的部分元素的相关信息,利用如图回答相关问题
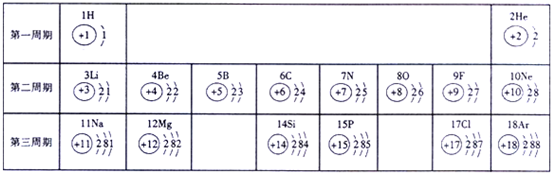
(1)16号元素的原子在化学反应中比较容易______(填“得到”或“失去”)电子变成离子;
(2)如图中11号元素与地壳中含量最多的元素组成的化合物的化学式是______
(3)如图中17号元素原子的化学性质与图中______号元素的原子化学性质相似
(4)从原子结构方面看,同一横行的元素具有相同的______,同一纵行的元素具有相同的______. fengcan11年前1
fengcan11年前1 -
 一段老哑木 共回答了18个问题
一段老哑木 共回答了18个问题 |采纳率100%解题思路:(1)根据原子结构示意图的各部分的意义分析解答;
(2)周期表中最活泼金属元素在右下角位置,地壳中含量最多的元素是氧;由化合价书写化学式;
(3)根据最外层电子数相同化学性质相似来回答;
(4)根据原子结构示意图进行分析解答本题.(1)根据原子结构示意图,16号元素的最外层有6个电子,易得到两个成为8电子稳定结构.
(2)周期表中从左到右金属的活泼性逐渐减弱,从上到下,金属的活泼性逐渐增强,所以最活泼金属元素在右下角位置,应为钠,地壳中含量最多的元素是氧,二者可以形成氧化钠;钠的化合价为+1,氧的化合价为-2,故为Na2O;
(3)根据最外层电子数相同化学性质相似,17号元素原子的最外层有7个电子与9号元素氟的化学性质相似;
(4)根据原子结构示意图分析可知:同一横行的元素具有相同的电子层数;同一纵行的元素具有相同的最外层电子数;同一周期中最外层电子数1到8依次增大等;
故答案为:(1)得到;(2)Na2O;(3)9;
(4)电子层;最外层电子.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”.已知:稀土金属
著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”.已知:稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应.(注:铈常见的化合价为+3和+4;氧化性:Ce4+>Fe3+.)下列说法正确的是( )
A.四种核素
Ce、13658
Ce、13858
Ce、14058
Ce,它们互称为同素异形体14258
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+ 童_心1年前1
童_心1年前1 -
 湖南hao123 共回答了15个问题
湖南hao123 共回答了15个问题 |采纳率80%解题思路:A、根据同素异形体和同位素概念的区别来回答;
B、根据氧化还原反应的有个关知识来回答;
C、根据电解池的工作原理来判断;
D、根据电荷守恒来判断离子方程式的正误.A、同素异形体是同种元素组成的不同单质间的互称,四种核素
13658Ce、
13858Ce、
14058Ce、
14258Ce,它们互称为同位素,故A错误;
B、Ce4+有氧化性,碘离子具有还原性,二者不能共存于一个溶液中,故B错误;
C、电解熔融状态的CeO2时,在阴极上是Ce4+得电子生成单质铈的过程,即在阴极获得铈,故C正确;
D、根据氧化性:Ce4+>Fe3+来判断反应能发生,应该为:Ce4++Fe2+═Ce3++Fe3+,故D错误.
故选C.点评:
本题考点: 电解原理;同素异形体;氧化还原反应.
考点点评: 本题是一道信息给予题,考查学生分析和解决问题的能力,难度不大.1年前查看全部
- 2013年度诺贝尔化学奖获得者的研究成果是“发展多尺度模型研究复杂化学体系”,它让化学家们得以用计算机做“帮手”来揭示化
 2013年度诺贝尔化学奖获得者的研究成果是“发展多尺度模型研究复杂化学体系”,它让化学家们得以用计算机做“帮手”来揭示化学过程.晶体硅是制造计算机必不可少的材料,右图是硅元素的部分信息.下列说法正确的是( )
2013年度诺贝尔化学奖获得者的研究成果是“发展多尺度模型研究复杂化学体系”,它让化学家们得以用计算机做“帮手”来揭示化学过程.晶体硅是制造计算机必不可少的材料,右图是硅元素的部分信息.下列说法正确的是( )
A.Si原子核外有14个电子
B.Si元素的相对原子质量为14
C.Na2SiO3是一种氧化物
D.晶体硅在空气中不稳定 82230351年前1
82230351年前1 -
 binyinu 共回答了23个问题
binyinu 共回答了23个问题 |采纳率95.7%解题思路:A.根据原子中,原子序数=质子数=核外电子数来分析;
B.根据元素周期表中的信息来分析;
C.根据氧化物的概念来分析;
D.根据硅原子最外层电子数与化学性质的关系来分析.A.在原子中,原子序数=质子数=核外电子数,硅元素的原子序数为14,则其核外有14个电子,正确;
B.由元素周期表的信息可知,硅元素的相对原子质量为28.066,错误;
C.氧化物是由两种元素组成,并且又一种元素是氧元素的化合物,故错误;
D.硅原子最外层有4个电子,既不易得电子,也不易失电子,化学性质比较稳定,故错误.
故选A.点评:
本题考点: 元素周期表的特点及其应用;从组成上识别氧化物.
考点点评: 本题难度不大,考查学生灵活运用元素周期表中元素的信息进行分析解题的能力.1年前查看全部
- (2012•庐阳区一模)“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示
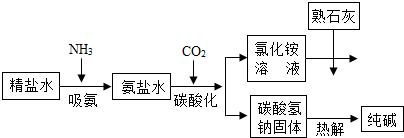 (2012•庐阳区一模)“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
(2012•庐阳区一模)“联合制碱法”是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
(1)写出流程中一种氧化物的化学式______.
(2)氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合溶液(称为氨盐水).氨盐水比食盐水更容易吸收二氧化碳,其原因是______.
(3)工业生产纯碱的流程中,碳酸化时析出碳酸氢钠而没有析出碳酸钠的原因是______.
(4)写出氯化铵溶液与熟石灰反应的化学方程式______.
(5)氯化钙常用于合成药物,青少年正处于生长发育阶段,需要摄入足够的钙,写出一个合理的补钙方法:______. ngsdfa1年前1
ngsdfa1年前1 -
 siku 共回答了24个问题
siku 共回答了24个问题 |采纳率87.5%解题思路:(1)流程中需要二氧化碳,碳酸氢钠受热分解能生成碳酸钠、水和二氧化碳,二氧化碳和水都属于氧化物;
(2)食盐水显中性,氨水显碱性,所以氨盐水显碱性,比食盐水更容易吸收二氧化碳;
(3)相同条件下,溶质的溶解度越小,越容易从溶液中析出;
(4)氯化铵溶液与熟石灰反应能生成氯化钙、水和氨气;
(5)钙元素在人体中含量较多,属于常量元素.(1)水和二氧化碳都属于氧化物,化学式分别为H2O、CO2.
故填:H2O或CO2.
(2)因为氨盐水显碱性,所以比食盐水更容易吸收二氧化碳.
故填:氨盐水显碱性.
(3)碳酸化时析出碳酸氢钠而没有析出碳酸钠的原因是相同温度下,碳酸氢钠的溶解度小于碳酸钠的溶解度.
故填:相同温度下,碳酸氢钠的溶解度小于碳酸钠的溶解度.
(4)氯化铵和熟石灰反应能生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O.
故填:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O.
(5)多吃富含钙的食物可以为人体补充需要的钙元素.
故填:多吃富含钙的食物.点评:
本题考点: 纯碱的制取;从组成上识别氧化物;书写化学方程式、文字表达式、电离方程式;人体的元素组成与元素对人体健康的重要作用.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.1年前查看全部
- 我国著名化学家侯德榜发明的联合制碱法中的碱是指?
 forestcheng1年前1
forestcheng1年前1 -
 shaoyu6666 共回答了17个问题
shaoyu6666 共回答了17个问题 |采纳率100%侯氏制碱法:向饱和食盐水里通入足量的CO2和氨气,析出NaHCO3晶体
NH3+CO2+H20+NaCl====NaHCO3↓+NH4Cl
再加热NaHCO3固体,制得纯碱 Na2CO3
2NaHCO3=====Na2CO3+CO2↑+H2O
所以碱是Na2co31年前查看全部
- 19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( ) A.提出了原子学说 B.提出了元素周期律 C.提出了分子
19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( ) A.提出了原子学说 B.提出了元素周期律 C.提出了分子学说 D.制定了科学的元素周期表  魔鬼的ll1年前1
魔鬼的ll1年前1 -
 CryingJoker 共回答了15个问题
CryingJoker 共回答了15个问题 |采纳率80%A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故D正确.
故选BD.1年前查看全部
- (2012•滨州)学习化学的目的并不在于要成为化学家,重要的是善于用化学知识去分析、解决生产生活中的问题.从化学的角度看
(2012•滨州)学习化学的目的并不在于要成为化学家,重要的是善于用化学知识去分析、解决生产生活中的问题.从化学的角度看,下列说法中正确的是( )
A.常用钢丝球擦洗铝壶可以使其光亮洁净且耐用
B.食品添加剂对人体有害,应禁止生产和使用任何食品添加剂
C.夜晚发现液化气泄漏立即开灯检查
D.日本大地震中和核泄漏事件引起人们的反思,要安全可靠地使用核能 龙在西夏1年前1
龙在西夏1年前1 -
 年轻ll 共回答了15个问题
年轻ll 共回答了15个问题 |采纳率86.7%解题思路:A、根据钢丝球擦洗铝壶的危害考虑;B、根据食品添加剂的作用考虑;C、根据液化气泄漏的处理方法考虑;D、根据核能的危害考虑.A、铝壶表面有一层致密的氧化铝保护膜,如果钢丝球擦洗铝壶将会把保护膜擦掉,容易腐蚀内部的铝,故A错;
B、有的食品添加剂对人体有害,但有的食品添加剂对人体有利,故B错;
C、夜晚发现液化气泄漏立即关闭阀门,打开门窗通风,千万不能用电,故C错;
D、日本大地震中和核泄漏事件引起人们的反思可知核能的不正确使用对人体有害,所以要安全可靠地使用核能,故D正确.
故选D.点评:
本题考点: 金属的化学性质;防范爆炸的措施;资源综合利用和新能源开发;亚硝酸钠、甲醛等化学品的性质与人体健康.
考点点评: 解答本题关键是要知道铝壶表面有一层致密的氧化铝保护膜,知道食品添加剂并不是都有害,知道液化气泄漏的处理方法和正确看待核能.1年前查看全部
- 为什么化学家就喜欢抢物理学家饭碗
为什么化学家就喜欢抢物理学家饭碗
丽莎和哈恩,舍勒和法拉第 lading0011年前1
lading0011年前1 -
 完美世界1986 共回答了14个问题
完美世界1986 共回答了14个问题 |采纳率92.9%这就要关系到另一个自然科学的领域了!生物学,种类斗争,物竞天择,适者生存,哈哈1年前查看全部
- 据报道,1995年化学家合成了一种分子式为C200H200的含多个碳碳叁键(-C≡C-)的链状烃,其分子中含碳碳叁键最多
据报道,1995年化学家合成了一种分子式为C200H200的含多个碳碳叁键(-C≡C-)的链状烃,其分子中含碳碳叁键最多可以是( )
A. 49个
B. 50个
C. 51个
D. 100个 fd_Goblin1年前2
fd_Goblin1年前2 -
 kaobue 共回答了20个问题
kaobue 共回答了20个问题 |采纳率90%解题思路:对于烃CnHm,当分子中无C=C和环时,C≡C最多,根据:
=叁键数×2解题.(2n+2)−m 2 对于烃CnHm,碳氢原子个数与分子结构的关系公式为:
(2n+2)−m
2=双键数+叁键数×2+环数,
当分子中无C=C和环时,C≡C最多,此时
(2×200+2)−200
2=叁键数×2,所以叁键数50.5.
由于叁键数不可能为0.5个,故C200H200中最多可有50个碳碳叁键.
故选B.点评:
本题考点: 有机化合物中碳的成键特征.
考点点评: 本题考查有机化合物中碳的成键特征,难度适中,注意碳氢原子个数与分子结构的关系公式为:(2n+2)−m2=双键数+叁键数×2+环数.1年前查看全部
- 2001年诺贝尔化学奖授予了美国化学家诺尔斯博士和日本化学家野佐良治教授以及美国化学家沙普利斯教授,以表彰他们对催化不对
2001年诺贝尔化学奖授予了美国化学家诺尔斯博士和日本化学家野佐良治教授以及美国化学家沙普利斯教授,以表彰他们对催化不对称合成的重大贡献.环氧化(R)丙烯醇(化学式为C 3 H 6 O 2 )是沙普利斯教授应用不对称合成技术合成的一种重要物质.该物质用于生产一种治疗心脏病的药物.计算:
(1)C 3 H 6 O 2 中的碳、氢、氧三种元素的质量比______;
(2)求3.7g该物质中氧元素的质量______ (计算结果保留1位小数). vigi20021年前1
vigi20021年前1 -
 倚阑凝眸 共回答了20个问题
倚阑凝眸 共回答了20个问题 |采纳率90%(1)C 3 H 6 O 2 中碳、氢、氧三种元素的质量比为:12×3:1×6:16×2═18:3:16;
(2)氧元素的质量为:3.7×
16×2
12×3+1×6+16×2 ×100%=1.6g
故答案为:(1)18:3:16;(2)1.6g1年前查看全部
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀
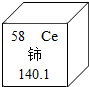 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
A.中子数是58
B.相对原子质量是140.1
C.质子数为58
D.铈元素是金属元素 人在路上tt1年前1
人在路上tt1年前1 -
 蚩蚩尤尤 共回答了14个问题
蚩蚩尤尤 共回答了14个问题 |采纳率92.9%解题思路:根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,相对原子质量及化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;进行解答.A.根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,而不是中子数,故错误;
B.根据元素周期表中一格提供的信息,相对原子质量为140.1,故正确;
C.根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,故正确;
D.根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,可知铈元素是金属元素,故错误.
故选A.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查学生根据元素周期表中一格提供的信息及辨别元素的种类的方法,进行分析解题的能力.1年前查看全部
- (2009•天津)瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,反应的化学方程式
(2009•天津)瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2X则X的化学式为______.△ . 鲁75991年前1
鲁75991年前1 -
 cjq0392131 共回答了18个问题
cjq0392131 共回答了18个问题 |采纳率83.3%解题思路:根据质量守恒定律可知,在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.根据化学方程式和质量守恒定律就可计算出生成物各元素的原子个数与反应物各元素的原子个数之差,然后除以2,就是X的化学式中含有的元素的原子个数.根据化学方程式可知,X的化学式中含有Mn的个数为:(1-1)÷2=0;含有Cl的个数为:(4-4)÷2=0;含有O的个数为:2÷2=1;含有H的个数为:4÷2=2.故X的化学式为H2O.
故答案为:H2O.点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查学生运用化学式和质量守恒定律计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两
2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。如图表示两个丙烯分子进行烯烃换位,生成两个新的烯烃分子:2—丁烯和乙烯。

现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
(1)G的结构简式:______________ ;
(2)反应②的化学方程式是___________________________________________ ;
(3)反应④中C与HCl气体在一定条件只发生加成反应,反应④和⑤不能调换的原因是___________________________________,E的结构简式:_____________ ;
(4)反应⑨的化学方程式:___________________________________________ 。 qiyiting21年前1
qiyiting21年前1 -
 大萝卜哥哥33 共回答了12个问题
大萝卜哥哥33 共回答了12个问题 |采纳率91.7%1年前查看全部
- (2分)为了减少“温室效应”带来的负面影响。法国化学家Paul Sabatier提出CO2生成甲烷的反应。该反应是使CO
(2分)
为了减少“温室效应”带来的负面影响。法国化学家Paul Sabatier提出CO2生成甲烷的反应。该反应是使CO2和H2在催化剂作用下生成CH4和H2O,试写出该反应的化学方程式: qyd1101年前0
qyd1101年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 2.空气中氮气与氧气体积比约为 ( ) A.1:4 B.5:4 C.4:1 D.5:1 3.早期化学家为了认识
 dlbingdu1年前1
dlbingdu1年前1 -
 玉指环007 共回答了15个问题
玉指环007 共回答了15个问题 |采纳率93.3%A
氮气占空气总体积的5/4
氧气占空气总体积的5/11年前查看全部
- 如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油.
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油.
资料一:石蜡是含有20- 30个碳原子的烷烃的混合物,常温下呈固态.
资料二:石油的催化裂化通常使用Al2O3做催化剂.某研究性学习小组在实验室中模拟石油的催化裂化.
装置如图:实验过程中可观察到烧杯Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻到试管Ⅱ中液体具有汽油的气味.
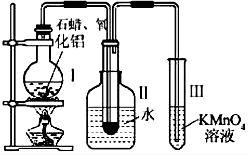
2)试管Ⅱ中少量液体凝结说明了__________________________.
(3)试管Ⅲ中溶液褪色说明了__________________________.
 jiangzhongshui1年前1
jiangzhongshui1年前1 -
 宽叶树a 共回答了23个问题
宽叶树a 共回答了23个问题 |采纳率78.3%2)试管Ⅱ中少量液体凝结说明了__石蜡分解为小分子液体________________________.
(3)试管Ⅲ中溶液褪色说明了___含有双键小分子有机物_______________________.1年前查看全部
- (2013•重庆二模)1986年,化学家Karl Christe首次用化学方法制得了F2,他提出的三步反应原理
(2013•重庆二模)1986年,化学家Karl Christe首次用化学方法制得了F2,他提出的三步反应原理如下:
①KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O
②SbCl5+HF→SbF5+HCl
③2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑.
(1)配平①并标出电子转移的方向和数目:______.
(2)若将反应③的变化改用惰性电极进行电解,则F2应当在______极附近逸出. bigrafter1年前0
bigrafter1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1右图是A、B两种物质的溶解度曲线,根据图示回答下列问题:
- 2(2010•工业园区模拟)(本题有a、b两小题,考生任选一题解答.若两题都解,则以a小题计分)
- 3石头纸都有哪些优点呢?
- 4call out one's
- 5spend sometime on watching tv为什么错
- 6根据下面一段话的内容,你能推断出A、B、C、D、E,各是方框中的哪一个数吗?
- 7地中海气候区的雨季通常在
- 8英语翻译Studies have shown that many diseases have something to
- 9负4分之3一8.25
- 10一种商店,如果先提价20%,再降价20%,那么该商店的售价和原价相比( )%
- 11Is this the factory___you worked in ten years ago?
- 12水映有缘天 却是无字书 这句是什么意思呢 谁能帮忙解答一下 谢了
- 13若不同两点P,Q的坐标分别为(a,b),(3-b,3-a),则线段PQ的垂直平分线l的斜率为______,圆(x-2)2
- 14急需类似《出塞》这样描述边塞军旅生活的古诗!
- 15Tony usually--------(have) lunch at school.



