侯氏制减法的核心原理为NH3+CO2+NaCl+H2O==NH4Cl+NaHCO3.某温度下,向溶质的质量分数为20%的
 会怒放的猪2022-10-04 11:39:541条回答
会怒放的猪2022-10-04 11:39:541条回答,47.25g中通入一定量的氨气(NH3)和二氧化碳充分反应后,将溶液中析出的碳酸氢钠晶体过滤,低温烘干,称量,质量为4.4g...计算需要通入的氨气质量(计算结果保留小数点后1位)已知:该温度下碳酸氢钠的饱和溶液中,碳酸氢钠与水的质量比额为1:9且溶液中若存在其他溶质不会影响上述比值.

已提交,审核后显示!提交回复
共1条回复
 like777777 共回答了15个问题
like777777 共回答了15个问题 |采纳率86.7%- 反应为NaCl + NH3 + CO2 + H2O = NaHCO3↓ + NH4Cl,滤液则可视为NaHCO3的饱和溶液.
饱和NaCl溶液中NaCl质量为:47.25g×20%=9.45g,溶剂H2O的质量为47.25g-9.45g=37.8g.
根据题意,滤液中NaHCO3质量为:37.8g×1/9=4.2g.
所以加上滤出的NaHCO34.4g,共生成NaHCO3:4.4g+4.2g=8.6g.
设通入NH3质量为xg:
NaCl + NH3 + CO2 + H2O = NaHCO3↓ + NH4Cl
17 84
x 8.6
解得:x=1.7. - 1年前
相关推荐
- 关于文言文 黄陶庵先生少有盛名,馆于同里侯氏,以道义相切劘②.虞山钱宗伯有一子名孙爱,甫成童,欲
关于文言文
黄陶庵先生少有盛名,馆于同里侯氏,以道义相切劘②.虞山钱宗伯有一子名孙爱,甫成童,欲延师教之,而难其人,商之程孟阳.孟阳曰:“我有故人子嘉定黄蕴生,奇士也.与同里侯氏交三世矣.未可轻致.公雅与侯善,以情告侯,公可得也.”宗伯乃具厚币,遣门下客李生,至嘉定延之.李生见侯,道宗伯指.侯力为劝驾,黄意不悦,强而后可.遂与李偕至宗伯家,宗伯待以殊礼.
居浃月,孟阳出海棠小笺示黄.黄询唱者为谁.孟阳曰:“宗伯如君柳夫人③作也.子于帖括④
之暇,试点笔焉.”陶庵变色曰:“忝居师席,可与小君酬和乎?”孟阳曰:“此何伤?我亦偕诸君子和之矣.”陶庵曰:“先生耆年硕德,与主人为老友,固可无嫌,诸君亦非下帷于此者,若淳耀则断不可.”孟阳惭退.
先是,曾馆某抚军幕府,有邑令闻先生在署,橐数百金,赂先生父,令致书,俾为之左右.先生复父书曰:“父生男之身,尤望生男之心.若行一不义,取一非有,男心先死矣,尚何以养父乎?”忠孝大节,岂临时激于意气者所能为乎!
【注释】①黄淳耀:字蕴生,号陶庵,嘉定人.崇祯十六年进士,诸进士悉授官,独淳耀不赴选.清兵入关后,被推为抗清义军***,终兵败自刭.②切劘(mó):切磨;切磋相正.③如君:旧称他人之妾为“如君”.柳夫人:指钱谦益之妾柳如是.④帖括:泛指科举应试文章.
请写明各项解释
 火星没有人1年前1
火星没有人1年前1 -
 xbr42283 共回答了20个问题
xbr42283 共回答了20个问题 |采纳率90%A可是,转折;顺承
B替,动词;是,动词
C用,介词;用,介词
D在,介词;被,介词1年前查看全部
- 侯氏联合制碱法的碱是那种化学物质,用化学名称填写
 su8881年前6
su8881年前6 -
 yaohang888 共回答了19个问题
yaohang888 共回答了19个问题 |采纳率89.5%小苏打,纯碱1年前查看全部
- 我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献。下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程。已知有
我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献。下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程。已知有关物质重要反应的化学方程式如下:2NH 4 Cl +X====2NH 3 ↑+CaCl 2 +2H 2 O NH 4 Cl ==
 ="=" NH 3 ↑+HCl↑
="=" NH 3 ↑+HCl↑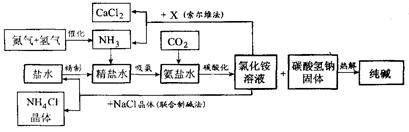
根据以上信息回答下列问题。
(1)盐水精制的过程是除去溶液中各种杂质的过程。为将盐水中含有的MgCl 2 沉淀除去,可以向其中加入过量的烧碱.此时反应的化学方程式为 ,将混合液中不溶物除去的实验方法是 ;溶液中多余烧碱可以加 ( 填试剂名称)来除去,反应的化学方程式为 。
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要“加压”的原因是:____________ 。
(3)在氨碱工业的历史上,如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”,即在氯化铵溶液中加入物质X (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化铵的 ,使氯化铵晶体单独析出得到另一种产品——氮肥。氯化钠溶液则可以循环利用。
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?
答: 。 leiming7691年前1
leiming7691年前1 -
 xbp138 共回答了24个问题
xbp138 共回答了24个问题 |采纳率95.8%(1)MgCl 2 +2NaOH ="=" Mg(OH) 2 ↓+2NaCl过滤
盐酸 NaOH + HCl ="=" NaCl + H 2 O
(2)增大二氧化碳的溶解度
(3)Ca(OH) 2 溶解度
(4)氯化铵受热易分解
(1)氢氧化钠和氯化镁生成氢氧化镁沉淀和氯化钠,分离固液混合物,要采用过滤的方法,氢氧化钠和盐酸生成氯化钠和水,(2) 气体的溶解度随着压强的增大而增大,(3)根据生成物是氨气和氯化钙可知X为Ca(OH) 2 ,氯化钠溶解溶液减少,是氯化铵的溶解度降低,(4)氯化铵受热易分解1年前查看全部
- 用“侯氏联合制碱法”制取的纯碱(Na 2 CO 3 )中常含有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠
用“侯氏联合制碱法”制取的纯碱(Na 2 CO 3 )中常含有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g。
试计算:
⑴产生二氧化碳气体的质量是_____g。
⑵该厂生产的纯碱中碳酸钠的质量分数。(计算结果精确到0.1%) 情系西北1年前1
情系西北1年前1 -
 学则思 共回答了18个问题
学则思 共回答了18个问题 |采纳率94.4%(1)4.4g
(2)设12g纯碱试样中碳酸钠的质量为x
Na 2 CO 3 +2HCl==2NaCl+H 2 O+CO 2 ↑
106 44
x 4.4g
106:44=x:4.4g
解得x=10.6g
碳酸钠的质量分数为:10.6g/12g×100%=88.3%
答:该厂生产的纯碱中碳酸钠的质量分数88.3%。1年前查看全部
- 工业上“侯氏”制碱法制得的纯碱产品中常含有少量的NaCl.为测定纯碱产品中Na 2 CO 3 的含量,取23g样品置于烧
工业上“侯氏”制碱法制得的纯碱产品中常含有少量的NaCl.为测定纯碱产品中Na 2 CO 3 的含量,取23g样品置于烧杯中,加水将其溶解,然后逐滴滴入稀盐酸,当滴入200g稀盐酸时,两者恰好完全反应,生成的气体全部逸出,共收集到8.8gCO2.
(1)所用稀盐酸中溶质的质量分数为______;23g样品中Na 2 CO 3 的质量为______g
(2)反应后烧杯中的溶液为不饱和溶液,试通过计算求出该溶液中溶质的质量. aaa19851151年前1
aaa19851151年前1 -
 鑫比天高 共回答了17个问题
鑫比天高 共回答了17个问题 |采纳率94.1%(1)设参加反应盐酸的质量为a,碳酸钠的质量为b,
Na 2 CO 3 +2HCl=2NaCl+CO 2 ↑+H 2 O
106 73 44
ab 8.8g
106
a =
44
8.8g a=21.2g
73
b =
44
8.8g b=14.6g
稀盐酸中溶质的质量分数=
14.6g
200g ×100% =7.3%
故答案为:7.3%;21.2;
(2)设反应生成氯化钠的质量为x
Na 2 CO 3 +2HCl=2NaCl+CO 2 ↑+H 2 O
117 44
x 8.8g
117
44 =
x
8.8g
x=23.4g
溶液中溶质NaCl的质量=23.4g+(23g-21.2g)=25.2g
答:该溶液中溶质的质量为25.2g.1年前查看全部
- 工业上“侯氏”制碱法制得的纯碱产品中常含有少量的NaCl。为测定纯碱产品中Na 2 CO 3 的含量,取23g样品置于烧
工业上“侯氏”制碱法制得的纯碱产品中常含有少量的NaCl。为测定纯碱产品中Na 2 CO 3 的含量,取23g样品置于烧杯中,加水将其溶解,然后逐滴滴入稀盐酸,当滴入200g稀盐酸时,两者恰好完全反应,生成的气体全部逸出,共收集到8.8gCO 2 。
(1)所用稀盐酸中溶质的质量分数为____________;23g样品中Na 2 CO 3 的质量为__________g
(2)反应后烧杯中的溶液为不饱和溶液,试通过计算求出该溶液中溶质的质量。 eee3eeee41年前0
eee3eeee41年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 侯氏联合制碱法的三个化学方程式分别是:一、向浓铵水中通入足量co2生成碳铵。二、再加入食盐细末搅拌。三、碳酸氢钠加热。
 烟台八仙过海1年前2
烟台八仙过海1年前2 -
 青出于蓝_007 共回答了18个问题
青出于蓝_007 共回答了18个问题 |采纳率77.8%1 向已经氨化的饱和食盐水中通入二氧化碳
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3(析出)
2 加热碳酸氢钠,得到碳酸钠
2NaHCO3=Na2CO3+H2O+CO2
3 利用碳酸钠通入石灰水,制得氢氧化钠
Na2CO3+Ca(OH)2=2NaOH+CaCO3
4 培烧碳酸钙,得到二氧化碳循环
CaCO3=CaO+CO2
CaO+H2O=Ca(OH)2
ps:
嗯..你说的:
一、向浓铵水中通入足量CO2生成碳铵
NH3 +H2O +CO2 = NH4HCO3
二、再加入食盐细末搅拌
NH4HCO3 +NaCl = NH4Cl +NaHCO3 (析出)
三、碳酸氢钠加热
2NaHCO3 = Na2CO3 +H2O +CO2 (气体)1年前查看全部
- 侯氏联合制碱法的碱是?
 45961年前4
45961年前4 -
 ashidu 共回答了26个问题
ashidu 共回答了26个问题 |采纳率88.5%是碳酸钠 属于盐的一种 化学式是Na2CO3 水溶液呈碱性1年前查看全部
- 侯氏制碱法制的是什么碱
 蔚蓝心境1年前1
蔚蓝心境1年前1 -
 需要遗忘 共回答了23个问题
需要遗忘 共回答了23个问题 |采纳率91.3%侯氏制碱法制的是纯碱,即碳酸钠
方程式:
①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
②2NaHCO3=加热=Na2CO3+H2O+CO2↑1年前查看全部
- 化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是 A.纯碱厂用侯氏制碱法制纯碱 B.硝酸厂用氨氧化法制
化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是
A.纯碱厂用侯氏制碱法制纯碱 B.硝酸厂用氨氧化法制硝酸 C.硫酸厂用接触法生产硫酸 D.氮肥厂用氮气和氢气合成氨气  1748400011年前1
1748400011年前1 -
 wusong2006 共回答了22个问题
wusong2006 共回答了22个问题 |采纳率95.5%A
1年前查看全部
- 下列关于工业生产说法正确的是 A.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳 B.在硫酸工业、合成氨工业
下列关于工业生产说法正确的是
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳 B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理 C.工业上用电解熔融氧化物的方法制金属镁和铝 D.氯碱工业中的阳离子交换膜阻止阳离子通过  ii_ii1年前1
ii_ii1年前1 -
 金gg小白兔 共回答了18个问题
金gg小白兔 共回答了18个问题 |采纳率88.9%A
本题考查了常见的工业制法。在侯氏制碱法中,由于二氧化碳溶解度小,故先通入过量氨气再通而二氧化碳。电解法制活泼金属时,制铝用氧化物,制镁用氯化物。氯碱工业中,阳离子交换膜不允许小分子、阴离子通过。在硫酸工业、合成氨工业、硝酸工业中,尾气往往要回收以提高原料利用率。1年前查看全部
- 下列有关酸、碱、盐的说法合理的是( ) A.“侯氏联合制碱法”制得的碱是烧碱 B.生成了盐和水的反应就是中和反应 C.
下列有关酸、碱、盐的说法合理的是( ) A.“侯氏联合制碱法”制得的碱是烧碱 B.生成了盐和水的反应就是中和反应 C.硫酸铵与熟石灰混合、研磨,能闻到刺激性的气味 D.有咸味的工业用盐可以当食盐使用  dAiyu8881年前1
dAiyu8881年前1 -
 77205496 共回答了23个问题
77205496 共回答了23个问题 |采纳率73.9%A、“侯氏联合制碱法”制得的碱是纯碱,纯碱是碳酸钠的俗称,而烧碱是氢氧化钠的俗称,故选项说法错误.
B、中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水;生成盐和水的反应不一定是中和反应,如CO 2 +2NaOH═Na 2 CO 3 +H 2 O,故选项说法错误.
C、硫酸铵属于铵态氮肥,熟石灰属于碱,硫酸铵与熟石灰混合、研磨能放出有刺激性气味的氨气,故能闻到刺激性的气味,故选项说法正确.
D、有咸味的工业用盐亚硝酸钠有毒,不能代替食盐使用,故选项说法错误.
故选C.1年前查看全部
- 文言文翻译黄陶庵先生少有盛名,馆于同里侯氏,以道义相切劘②.虞山钱宗伯有一子名孙爱,甫成童,欲延师教之,而难其人,商之程
文言文翻译
黄陶庵先生少有盛名,馆于同里侯氏,以道义相切劘②.虞山钱宗伯有一子名孙爱,甫成童,欲延师教之,而难其人,商之程孟阳.孟阳曰:“我有故人子嘉定黄蕴生,奇士也.与同里侯氏交三世矣.未可轻致.公雅与侯善,以情告侯,公可得也.”宗伯乃具厚币,遣门下客李生,至嘉定延之.李生见侯,道宗伯指.侯力为劝驾,黄意不悦,强而后可.遂与李偕至宗伯家,宗伯待以殊礼
居浃月,孟阳出海棠小笺示黄.黄询唱者为谁.孟阳曰:“宗伯如君柳夫人③作也.子于帖括④之暇,试点笔焉.”陶庵变色曰:“忝居师席,可与小君酬和乎?”孟阳曰:“此何伤?我亦偕诸君子和之矣.”陶庵曰:“先生耆年硕德,与主人为老友,固可无嫌,诸君亦非下帷于此者,若淳耀则断不可.”孟阳惭退.
先是,曾馆某抚军幕府,有邑令闻先生在署,橐数百金,赂先生父,令致书,俾为之左右.先生复父书曰:“父生男之身,尤望生男之心.若行一不义,取一非有,男心先死矣,尚何以养父乎?”忠孝大节,岂临时激于意气者所能为乎! king131年前4
king131年前4 -
 thomas-1 共回答了16个问题
thomas-1 共回答了16个问题 |采纳率87.5%黄陶庵先生年轻时就负有盛名,在同乡侯氏家里设馆教书,按道义标准为人处世.虞山钱宗伯有一个孩子名字叫孙爱,刚刚才成长儿童(特指十二三岁的样子),想要聘请老师教导他,然而因为找不到合适的人而感到为难,来和程孟阳商量.孟阳说:“我有位故人的儿子嘉定人黄蕴生,是一名有奇才的人.和同乡里的侯氏家族交往三世了.不能够随意就招得他来.公雅(可能是人名)和侯氏处得极好,将这件事告知侯氏,您就可以聘得他了.”于是宗伯就准备了丰厚的礼物,派遣门客李生,到嘉定聘请黄蕴生.李生见到侯氏,说明了宗伯的意思.侯氏使力替宗伯说好话,劝黄蕴生动身去宗伯家设馆教书,但是黄蕴生有些不愿意,再三强迫之下他才勉强同意.于是就与李生一起到宗伯家,宗伯用非常优越的礼节招待他.
过了一个月,孟阳拿出海棠小信笺给黄蕴生看.黄蕴生看了,问作这首唱词的人是谁?孟阳说;“是宗伯的夫人柳氏作的.您在帖子的间距空闲处,试着帮忙修改批注一下.”陶庵(黄蕴生)惭愧地说:“空占着老师的位置了.能和柳夫人酬和几首诗吗?”孟阳说:“这有什么呢?我也就是想和诸位一起酬和他的.”陶庵(黄蕴生)说:“先生您年高德厚,和主人又是多年的好朋友,当然可以无顾虑.其他诸位也不用来内室休息之所,像我就断然不能这样做了.(他的意思是说,其他人与柳夫人是有距离的,就算作诗酬和也可以避开嫌疑.但他在内室做教书先生,有机会有柳夫人接触,如果作诗酬和,会难免让人起疑.)孟阳听了,觉得他说得有道理,自觉自己做事考虑不周到,所以感觉到惭愧就离开了.
前面,黄蕴生曾设馆在某抚军幕府中,有个邑令听说先生在府中,拿了数百金来贿赂先生的父亲.让他父亲给他写信,请他来身边做帮手.先生回信给父亲说:“父亲生了孩儿的身体,更希望能生孩儿的心.如果做一件不义的事,获取一件不该自己拥有的东西,孩儿的心就先死了.还拿什么养父亲呢?黄蕴生的忠义气节,难道是临时被意气激起的人而表现出来忠义的气节的人所能做到的吗?1年前查看全部
- 用侯氏制碱法制得纯碱中常含有少量氯化钠.向一定质量的样品中加入足量..
用侯氏制碱法制得纯碱中常含有少量氯化钠.向一定质量的样品中加入足量..
用侯氏制碱法制得纯碱中常含有少量氯化钠.向一定质量的样品中加入足量的氢氧化钙溶液、可得到沉淀10.0克、求.
(1)样品中纯碱的质量为多少
(2)除了可求出纯碱的质量外、如需求样品中氯化纳的质量分数、还需要知道_____量.
第二小问是填空.
第一小问能不能把过程答上.
我承认我不厚道了. j_dongmei1年前1
j_dongmei1年前1 -
 winshoes56 共回答了24个问题
winshoes56 共回答了24个问题 |采纳率95.8%Na2CO3+Ca(OH)2==CaCO3+2NaOH
106 100
x 10.0g
106/x=100/10.0g
x=10.6g
(1)10.6g
(2) 样品质量1年前查看全部
- 谁能详细的为我讲解一下侯俊德的侯氏联合制碱法的流程和其对应的化学方程式?
 mrsa1年前1
mrsa1年前1 -
 豆渣 共回答了13个问题
豆渣 共回答了13个问题 |采纳率100%1)NH3+H2O+CO2=NH4HCO3(首先通入氨气,然后再通入二氧化碳)(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(NaHCO3溶解度最小,所以析出.)(3)2NaHCO3=Na2CO3+CO2↑+H2O(NaHCO3热稳定性很差,受热容易分解)1年前查看全部
- 侯氏制碱法制的的纯碱中通常含有少量的氯化钠,现有含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,向溶液中加入稀盐酸6
侯氏制碱法制的的纯碱中通常含有少量的氯化钠,现有含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,向溶液中加入稀盐酸64.4g,恰好完全反应,所得溶液的质量为121g,求
①该纯碱样品的纯度(计算精确到0.001)
②最后所得滤液中溶质的质量分数
 百年蓍草1年前1
百年蓍草1年前1 -
 天龙97 共回答了24个问题
天龙97 共回答了24个问题 |采纳率95.8%① 96.4%
② 10%1年前查看全部
- (2013•长宁区一模)氨碱法(索氏)和联合制碱法(侯氏)是两大重要的工业制碱法,
(2013•长宁区一模)氨碱法(索氏)和联合制碱法(侯氏)是两大重要的工业制碱法,
下列表达不正确的是( )氨碱法 联合制碱法 A 原料 食盐、氨气、生石灰 食盐、氨气、二氧化碳 B 可能的副产物 氯化钙 氯化铵 C 循环物质 氨气、二氧化碳 氯化钠 D 评价 原料易得;设备复杂;能耗高 原料利用率高;废弃物少
A.A
B.B
C.C
D.D joyrock1年前1
joyrock1年前1 -
 耗儿爱上猫 共回答了19个问题
耗儿爱上猫 共回答了19个问题 |采纳率78.9%解题思路:氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱.先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液.其化学反应原理是:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品:2NaHCO3
Na2CO3+CO2↑+H2O,放出的二氧化碳气体可回收循环使用.△ .
含有氯化铵的滤液与石灰乳(Ca(OH)2)混合加热,所放出的氨气可回收循环使用,CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液.
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体.由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多,所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品.此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用.
联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱.A、氨碱法原料有:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气,联合制碱法原料有:食盐、氨气、二氧化碳,故A错误;
B、氨碱法可能的副产物为氯化钙,联合制碱法可能的副产物氯化铵,故B正确;
C、氨碱法循环物质:氨气、二氧化碳,联合制碱法循环物质:氯化钠,二氧化碳,故C错误;
D、氨碱法原料(食盐和石灰石)便宜,产品纯碱的纯度高,副产品氨和二氧化碳都可以回收循环使用,制造步骤简单,适合于大规模生产,但设备复杂;能耗高,氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,故D正确;
故选AC.点评:
本题考点: 纯碱工业(侯氏制碱法).
考点点评: 本题主要考查了氨碱法(索氏)和联合制碱法(侯氏)的原理,掌握原理是解题的关键,难度中等以上.1年前查看全部
- 侯氏制“碱”法制得的纯碱中含有少量氯化钠。请根据下图所示的实验过程和提供的数据,回答下列问题:
侯氏制“碱”法制得的纯碱中含有少量氯化钠。请根据下图所示的实验过程和提供的数据,回答下列问题:
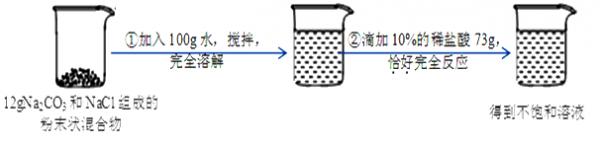
(1)在滴入稀盐酸的过程中,观察到的明显现象是 。
(2)该反应过程中生成CO2气体的质量.
(3)求最终所得溶液中溶质的质量是多少? tynk1年前1
tynk1年前1 -
 主敢 共回答了18个问题
主敢 共回答了18个问题 |采纳率88.9%(1)固体逐渐溶解,产生气泡;
(2)4.4g;
(3)最终所得溶液中溶质的质量是13.1g
1年前查看全部
- 有关侯氏制碱法候德榜发明了联合制碱法.联合制碱法中的碱属于盐,它的浓溶液与澄清石灰水反应的化学方程式为----
 snowwie1年前1
snowwie1年前1 -
 yongyuan 共回答了14个问题
yongyuan 共回答了14个问题 |采纳率92.9%联合制碱法中的碱就是碳酸钠,它的浓溶液与澄清石灰水反应的化学方程式为:
Na2CO3 + Ca(OH)2 = CaCO3(沉淀) + 2NaOH1年前查看全部
- 有关侯氏制碱法的一些问题为什么向母液中通氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
 nn19811221年前3
nn19811221年前3 -
 xhd_home 共回答了17个问题
xhd_home 共回答了17个问题 |采纳率94.1%氨气能提高溶液的碱性和铵根离子的浓度
氢氧根使碳酸氢根变成碳酸根
而按根离子的浓度增大能使氯化铵更纯1年前查看全部
- 用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,
用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g.试计算:该厂生产的纯碱中碳酸钠的质量分数.(计算结果精确到0.1%)
 Q匠1年前1
Q匠1年前1 -
 媚色无边 共回答了25个问题
媚色无边 共回答了25个问题 |采纳率92%解题思路:碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,烧杯中的物质前后减少的质量为二氧化碳的质量,根据二氧化碳的质量可求出碳酸钠的质量,再根据 [碳酸钠的质量/样品的质量]×100%,可求出纯碱样品中碳酸钠的质量分数.生成二氧化碳的质量为:12g+73g-80.6g=4.4g
设12g纯碱试样中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 4.4g
[106/x]=[44/4.4g]
解得x=10.6g
所以碳酸钠的质量分数为:[10.6g/12g]×100%≈88.3%
答:该厂生产的纯碱中碳酸钠的质量分数88.3%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 当知道反应前后物质的质量时,通常要使用质量守恒定律,二氧化碳的质量根据质量守恒定律,这是解答本题的关键,然后根据方程式计算即可,注意解题格式要规范.1年前查看全部
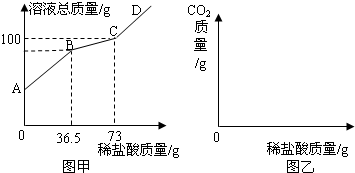
- (2007•烟台)工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠.化验员对每批刚生产出的纯碱产品都要进行检测,标
(2007•烟台)工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠.化验员对每批刚生产出的纯碱产品都要进行检测,标示出各种成分的含量后投放市场.在实验室中取22g该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为10%的稀盐酸并不断振荡,首先发生的反应是:Na2CO3+HCl=NaHCO3+NaCl,然后发生的反应是:NaHCO3+HCl=NaCl+CO2↑+H2O.在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图1所示.
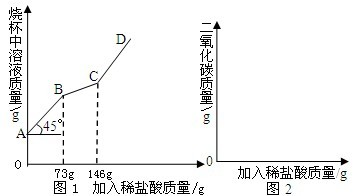
(1)请你根据图1提供的信息,在图2的坐标系中画出检测过程中产生CO2的质量随滴加盐酸质量的变化曲线(注意标明二氧化碳、盐酸质量的相应数值).
(2)计算出22g该样品中各成分的质量. lhehuang1年前1
lhehuang1年前1 -
 芜茌荏 共回答了20个问题
芜茌荏 共回答了20个问题 |采纳率95%解题思路:(1)根据图1可知,在加入盐酸达73g之前,反应中无气体产生,滴入的稀盐酸与碳酸钠反应生成碳酸氢钠;当稀盐酸滴至146g时,碳酸氢钠完全反应,之后再滴加的稀盐酸不再发生反应而无气体产生;
(2)样品中的氯化钠与稀盐酸不发生反应,而碳酸钠可与盐酸反应生成碳酸氢钠,根据反应的化学方程式,由反应消耗稀盐酸的质量可计算参加反应的碳酸钠的质量,样品中氯化钠的质量=样品质量-碳酸钠的质量. (1)开始的45°夹角,说明加入的溶液的质量等于溶液质量增加量,说明过程中无气体或者沉淀产生.当加入73g稀盐酸时,开始放出气体二氧化碳;当稀盐酸的量达146g时,放出二氧化碳气体达最大值;以后再加稀盐酸,不再放出二氧化碳气体;
(1)开始的45°夹角,说明加入的溶液的质量等于溶液质量增加量,说明过程中无气体或者沉淀产生.当加入73g稀盐酸时,开始放出气体二氧化碳;当稀盐酸的量达146g时,放出二氧化碳气体达最大值;以后再加稀盐酸,不再放出二氧化碳气体;
设碳酸氢钠与盐酸反应得到的二氧化碳的质量为x.对应的生成二氧化碳消耗的盐酸的质量为146g-73g=73g.
NaHCO3+HCl=NaCl+CO2↑+H2O
36.5 44
73g×10%=7.3g x
[36.5/44]=[7.3g/x]
x=8.8g
故答案为:变化曲线,如图,盐酸数值(73g,146g),CO2的数值(0g,8.8g).
(2)设22g样品中Na2CO3质量为x,
Na2CO3+HCl=NaCl+NaHCO3
106 36.5
x 73g×10%
[106/x=
36.5
73g×10%]
x=21.2g
22g样品中NaCl的质量为:22g-21.2g=0.8g
答:22g该样品中含碳酸钠21.2g,含氯化钠0.8g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 利用反应的化学方程式表示物质的质量关系,根据反应中某一物质的质量可计算反应中其它任何物质的质量.1年前查看全部
- (2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3
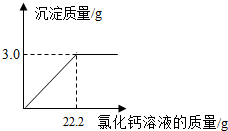 (2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(1)该纯碱样品中碳酸钠的质量分数.(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数. uu11061年前1
uu11061年前1 -
 adslb214000 共回答了21个问题
adslb214000 共回答了21个问题 |采纳率95.2%解题思路:(1)欲求该纯碱样品中碳酸钠的质量分数,须先根据化学方程式求出样品中碳酸钠的质量,再利用质量分数公式计算即可.
(2)欲求所加入氯化钙溶液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数=[溶质质量/溶液质量]×100%计算即可.设该纯碱样品中碳酸钠的质量为x,22.2g氯化钙溶液中溶质的质量为y,则Na2CO3+CaCl2=CaCO3↓+2NaCl106 111 100x y 3.0g...
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生对物质质量分数和溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.1年前查看全部
- 侯氏制碱法制的的是什么物质?
 wangqinghe1年前2
wangqinghe1年前2 -
 一口西猪 共回答了21个问题
一口西猪 共回答了21个问题 |采纳率90.5%纯碱(碳酸钠)1年前查看全部
- (2013•樊城区模拟)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱
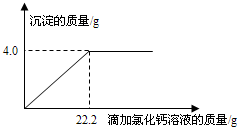 (2013•樊城区模拟)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品4.4g,充分溶解于27.4g水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(2013•樊城区模拟)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品4.4g,充分溶解于27.4g水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(1)该纯碱样品中碳酸钠的质量分数.(精确到0.1%)
(2)到恰好不再产生沉淀时为止所得溶液中溶质的质量分数. wangfan02141年前1
wangfan02141年前1 -
 荆棘无声 共回答了15个问题
荆棘无声 共回答了15个问题 |采纳率86.7%解题思路:根据图示中的数据可知碳酸钠和氯化钙反应生成的碳酸钙沉淀的质量为4.0g,然后根据化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl求出碳酸钠的质量,根据Na2CO3+CaCl2=CaCO3↓+2NaCl还可求出氯化钙和氯化钠的质量;根据质量守恒定律过滤后所得溶液的质量为4.4g+27.4g+22.2g-4.0g=50g,然后根据氯化钠溶液溶质质量分数等于氯化钠的质量比上氯化钠溶液的质量乘以100%即可解答.设原样品中含碳酸钠质量为X,到恰好不再产生沉淀时生成氯化钠质量为Y
Na2CO3+CaCl2=Ca CO3↓+2NaCl
106100117
x 4gy
[106/x=
100
4g=
117
y]
x=4.24g
y=4.68g
(1)该纯碱样品中碳酸钠的质量分数为:[4.24g/4.4g]×100%=96.4%
(2)到恰好不再产生沉淀时为止所得溶液中溶质的质量分数为
4.68g+(4.4g−4.24g)
27.4g+4.4g+22.2g−4g×100%=9.68%;
答:(1)该纯碱样品中碳酸钠的质量分数为:96.4%.
(2)到恰好不再产生沉淀时为止所得溶液中溶质的质量分数为9.68%;点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- 下列关于工业生产说法错误的是( ) A.在侯氏制碱工业中,向饱和氯化钠溶液中先通入氨气,后通入二氧化碳 B.
下列关于工业生产说法错误的是( )
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通入氨气,后通入二氧化碳 B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 D.工业上采用电解熔融氯化铝的方法制取金属铝  williamclo1年前1
williamclo1年前1 -
 smqsmqqq 共回答了15个问题
smqsmqqq 共回答了15个问题 |采纳率93.3%D
A项中先往饱和NaCl溶液中通入NH 3 ,使溶液碱化,有利于吸收CO 2 ,正确;硫酸工业未反应的SO 2 ,合成氨工业未反应的N 2 、H 2 ,硝酸工业NO 2 溶于水产生NO均可循环利用,B正确;C项中用隔膜电解槽,可避免Cl 2 与NaOH反应,C正确;D项中AlCl 3 为共价化合物易升华,无法制取铝。1年前查看全部
- (2010•东莞模拟)“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,实验步骤如下:
(2010•东莞模拟)“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,实验步骤如下:
①小明称取该纯碱样品3.3g,充分溶解于水中
②滴加氯化钙溶液产生沉淀,共用去氯化钙溶液22.2 g,经过过滤、洗涤、干燥、称量所得白色固3.0 g.
试求:
(1)实验过程中产生的不溶物是:______,它的质量为______g
(2)该纯碱样品中碳酸钠的质量分数.(精确到0.1%) 就是不想做淑女1年前1
就是不想做淑女1年前1 -
 阿速速 共回答了19个问题
阿速速 共回答了19个问题 |采纳率78.9%解题思路:(1)实验过程中产生的不溶物是碳酸钠与氯化钙反应生的碳酸钙沉淀.
(2)要求纯碱样品中碳酸钠的质量分数,必须要知道纯碱的质量和碳酸钠的质量.纯碱的质量已经知道,碳酸钠的质量不知道,但是知道碳酸钠和氯化钙反应生成的碳酸钙的质量,可根据碳酸钙的质量求出碳酸钠的质量.(1)实验过程中产生的不溶物是:CaCO3,它的质量为3g.
(2)设碳酸钠的质量为X,
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
X3g
106:X=100:3g
X=3.18g
纯碱样品中碳酸钠的质量分数=
3.18g
3.3g×100%=96.4%
答:纯碱样品中碳酸钠的质量分数为96.4%点评:
本题考点: 实验探究物质的组成成分以及含量;碳酸钠、碳酸氢钠与碳酸钙;根据化学反应方程式的计算.
考点点评: 本题是一道有关化学方程式的计算题,解第二小题这类题时要从问题着手考虑.1年前查看全部
- (2009•海门市模拟)工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠.某化学兴趣小组对某纯碱样品进行下列探究活
(2009•海门市模拟)工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠.某化学兴趣小组对某纯碱样品进行下列探究活动.称取11g样品于烧杯中,加20.4g水将其溶解,然后逐滴加入一定质量分数的稀盐酸并不断振荡,发现刚开始时并无气泡,一段时间后才有气泡产生,这引起了他们的好奇.查阅资料知道:首先发生的反应是:Na2CO3+HCl=NaHCO3+NaCl,然后发生的反应是:NaHCO3+HCl=NaCl+CO2↑+H2O.实验过程中,测得加入稀盐酸的质量和溶液总质量的关系如图甲所示.请你解决下列问题:
(1)根据上述信息,请在图乙坐标系中画出实验过程中产生CO2的质量随滴加盐酸质量的变化曲线(不必计算具体数据).
(2)计算样品中NaCl和Na2CO3的质量比.
(3)计算实验中恰好完全反应时所得溶液的溶质质量分数. fjxmtony1年前1
fjxmtony1年前1 -
 huangjj19 共回答了22个问题
huangjj19 共回答了22个问题 |采纳率90.9%解题思路:(1)盐酸首先与碳酸钠反应,没有二氧化碳产生,然后与碳酸氢钠反应,生成二氧化碳的质量随滴入盐酸质量的增加而增加,当完全反应时,气体不再生成;
(2)因为盐酸与氯化钠不反应,分析图示数据可知,AB段表示盐酸与碳酸钠反应,BC段表示盐酸与碳酸氢钠反应.根据质量守恒定律,生成二氧化碳气体的质量=反应前物质质量总和-反应后物质质量总和;根据化学方程式可知,完全反应的情况下,参与反应的碳酸钠质量与生成的碳酸氢钠质量成正比例,碳酸氢钠质量与二氧化碳质量成正比例,由此推断,碳酸钠质量与二氧化碳质量成正比例,据此计算出碳酸钠的质量;样品质量-碳酸钠质量=氯化钠质量,进而得出样品中NaCl和Na2CO3的质量比;
(3)分析题意可知,恰好完全反应时所得溶液的溶质是氯化钠(包括样品中的氯化钠、碳酸钠与盐酸反应生成的氯化钠和碳酸氢钠与盐酸反应生成的氯化钠),然后根据溶质质量分数公式计算即可.根据质量守恒定律,生成二氧化碳气体的质量=73g+11g+20.4g-100g=4.4g;(1)如右图:(2)反应的化学方程式为:Na2CO3+HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+CO2↑+H2O设样品中Na2CO3的质量为x,∴Na2CO3----CO2106 ...
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;酸的化学性质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 本题主要考查学生利用化学方程式和质量守恒定律进行计算的能力.本题所涉数据较多,学生需认真分析数量关系,找出数据之间的联系,根据质量守恒定律,得出生成二氧化碳的质量,就可以顺利答题.1年前查看全部
- 一道初三科学计算题 工业上“侯氏”制碱法制得的纯碱产品中常含有少量氯化钠.取22g样品于烧杯中加水溶解 然后逐滴加入溶质
一道初三科学计算题
工业上“侯氏”制碱法制得的纯碱产品中常含有少量氯化钠.取22g样品于烧杯中加水溶解 然后逐滴加入溶质质量分数为10%的稀盐酸并不断振荡 加入73g稀盐酸时先发生的反应是Na2CO3+HCl=NaHCO3+NaCl 再加入73g稀盐酸时然后发生的反应是NaHCO3+HCl=NaCl+CO2↑+H2O
(1)产生CO2质量(2)22g样品中各成分质量 冷眼看洋1年前1
冷眼看洋1年前1 -
 gswczx1314 共回答了20个问题
gswczx1314 共回答了20个问题 |采纳率95%(1)两化学反应式相加得
Na2CO3+2HCl=2NaCl+CO2↑+H2O
73 44
(73+73)×10% x
73x=44×(73+73)×10%
x=8.8g
(2)两化学反应式相加得
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 73
x (73+73)×10%
73x=106×(73+73)×10%
x=21.2g
22g样品中Na2CO3质量为21.2g,杂质氯化钠为22-21.2=0.8g1年前查看全部
- “NaCl + CO 2 + NH 3 + H 2 O NaHCO 3 ↓+ NH 4 Cl”是著名的“侯氏
“NaCl + CO 2 + NH 3 + H 2 O NaHCO 3 ↓+ NH 4 Cl”是著名的“侯氏制碱法”的重要反应。下面四种说法中不正确的是( )
A.NaHCO 3 是一种难溶于水的物质 B.析出固体后的溶液为NaHCO 3 的饱和溶液 C.NaHCO 3 不是纯碱 D.从该反应可以获得氮肥  归雁忆秋1年前1
归雁忆秋1年前1 -
 DoAs 共回答了13个问题
DoAs 共回答了13个问题 |采纳率100%A
A、该反应说明该条件下碳酸氢钠的溶解度较小,不能说明其是难溶于水的物质,故本选项错误;
B、析出碳酸氢钠,说明剩余的溶液为碳酸氢钠的饱和溶液,故本选项正确;
C、碳酸氢钠是小苏打,纯碱是碳酸钠,故本选项正确;
D、生成的氯化铵属于氮肥,所以从该反应可以获得氮肥,故本选项正确;
故选A.1年前查看全部
- 用“侯氏联合制碱法”制取的纯碱中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放
用“侯氏联合制碱法”制取的纯碱中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g.
试计算:
(1)产生二氧化碳气体的质量是______g.
(2)该纯碱样品中氯化钠钠的质量.
(3)此次反应所得溶液中溶质质量分数.(计算结果精确到0.1%) very_boy1年前1
very_boy1年前1 -
 顶着风干 共回答了21个问题
顶着风干 共回答了21个问题 |采纳率76.2%解题思路:(1)烧杯中的物质前后减少的质量为二氧化碳的质量.
(2)根据二氧化碳的质量可求出碳酸钠的质量,进而可求出纯碱样品中碳酸钠的质量分数.
(3)依据反应方程式可求生成的氯化钠质量,同时可依据碳酸钠的质量求出原混合物中氯化钠的质量,进而依据反应后溶液的质量求出所得溶液的溶质质量分数;(1)二氧化碳的质量=12g+73g-80.6g=4.4g
(2)设样品中Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
[106/x=
117
y=
44
4.4g]
∴x=10.6g y=11.7g
纯碱样品中NaCl的质量═12g-10.6g=1.4g
(3)溶液中NaCl的总质量═11.7g+1.4g=13.1g
反应所得溶液中溶质质量分数═[13.1g/80.6g]×100%≈16.3%
故答案为:(1)4.4;(2)该纯碱样品中氯化钠的质量是1.4g;(3)答:此次反应所得溶液中溶质质量分数是16.3%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成二氧化碳的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.1年前查看全部
- 用‘侯氏联合制碱法’制得的纯碱常常含有少量的氯化钠,为测定某纯碱样品中碳酸钠的含量,小新称取该纯碱
 xiabin3500071年前1
xiabin3500071年前1 -
 a47249954 共回答了16个问题
a47249954 共回答了16个问题 |采纳率100%加入HCI
测气体的质量(初中)或体积(高中)
之后用比例式就可以算出百分数1年前查看全部
- 侯氏联合制碱法的化学反应与过程
 清幽一族1年前1
清幽一族1年前1 -
 runkey 共回答了25个问题
runkey 共回答了25个问题 |采纳率96%1 向已经氨化的饱和食盐水中通入二氧化碳
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3(析出)
2 加热碳酸氢钠,得到碳酸钠
2NaHCO3=Na2CO3+H2O+CO2
3 利用碳酸钠通入石灰水,制得氢氧化钠
Na2CO3+Ca(OH)2=2NaOH+CaCO3
4 培烧碳酸钙,得到二氧化碳循环
CaCO3=CaO+CO2
CaO+H2O=Ca(OH)2
ps:
嗯.你说的:
一、向浓铵水中通入足量CO2生成碳铵
NH3 +H2O +CO2 = NH4HCO3
二、再加入食盐细末搅拌
NH4HCO3 +NaCl = NH4Cl +NaHCO3 (析出)
三、碳酸氢钠加热
2NaHCO3 = Na2CO3 +H2O +CO2 (气体)
参考资料:http://zhidao.baidu.com/question/18836654.html?fr=qrl31年前查看全部
- 有关侯氏制碱法的化学式
 salinna19831年前3
salinna19831年前3 -
 xiongpeng1 共回答了22个问题
xiongpeng1 共回答了22个问题 |采纳率86.4%1.NH3+H2O=NH4HCO3
2.NaCl(饱和)+NH4HCO3(饱和)=NH4Cl+NaHCO3↓
3.2NaHCO3=NaCO3+H2O+CO2↑
第一个是网上的,第二个是作业本上的,第三个是问老师的1年前查看全部
- 用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,
用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠.化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g
(1)产生CO2的质量是---
(2)该厂生产的纯碱中碳酸钠的质量分数.(计算结果精确到0.1%) 南昌的叶子1年前1
南昌的叶子1年前1 -
 shahuwan 共回答了17个问题
shahuwan 共回答了17个问题 |采纳率94.1%m(CO2)=12+73-80.6=4.4g
设Na2CO3质量为X
则: Na2CO3+HCl== NaCl+H2O+CO2↑
106 44
x 4.4g
列比例式 106/x=44/4.4g
x=10.6g
质量分数=10.6g/12g*100=88.3%1年前查看全部
- (2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3
 (2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(2010•阜新)用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示.求:
(1)该纯碱样品中碳酸钠的质量分数.(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数. 催花东子1年前1
催花东子1年前1 -
 wangxinrong 共回答了21个问题
wangxinrong 共回答了21个问题 |采纳率95.2%设该纯碱样品中碳酸钠的质量为x,22.2g氯化钙溶液中溶质的质量为y,则
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100
x y 3.0g
[106/x=
111
y=
100
3]
解之得:x=3.18g,y=3.33g
所以,该纯碱样品中碳酸钠的质量分数为:[3.18/3.3]×100%=96.4%
所加入氯化钙溶液的溶质质量分数为:[3.33/22.2]×100%=15%
答:该纯碱样品中碳酸钠的质量分数为96.4%,所加入氯化钙溶液的溶质质量分数为15%.1年前查看全部
大家在问
- 1Fank,when will the meeting begin you should come ()2:30.if y
- 2已知集合 A={x|x^2-5x+4≤0},B={x|x^2-2ax+a+2≤b} a∈R,A∪B=A,求a的取值范围
- 3怎样使用手提式灭火器
- 4已知298K时,2C(s)+O2(g)=2CO(g)△H1=-221.01kJ•mol-1;C(s)+O2(g)=CO2
- 5已知y=(4^x)-(3)*(2^x)+3,当其值域为[1,7]时,求x的取值范围.
- 618.如图所示,两个水平平行放置的金属板,上板带负电,下板带等量的正电,两板的电势差为U.一个带电粒子
- 7下列反应中氧化剂与还原剂的物质的量之比为1:2,且电子转移数为0.1mol的是( ) A.已知:Cu+2Fe 3+ =
- 8请根据字义,写出相应的由该字组成的词语,并写出正确读音.例:佛:指佛教.佛寺读作fo,和:结束战争或争执.什么读作什么
- 9一个三角形,三条边的比是3:4:5,最长的一边比其他两边的和短6厘米,求这个三角形的周长是多少厘%
- 10数学初中已知抛物线y=ax∧2 bx+c经过点(-1,2)且方程ax∧2+bx+c=0的两根分别为-3,1求抛物线的解析
- 11什么是余式定理,需要举一个例子加以说明,
- 12二元一次方程填空如果│x-y+2│+(x+y-1)²=0,那么x=______,y=______有一个两位数,
- 13某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO
- 147+7的平方+7的三次方+.7的2009次方得多少?
- 15若x1,x2是关于x的方程x2+bx+c=0的两个实数根,且|x1|+|x2|=2|k|(k是整数),则称方程x2+bx
