八面体、十二面体、二十面体各有多少顶点、面和棱
 饿馍41922022-10-04 11:39:541条回答
饿馍41922022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 秋天的色彩 共回答了20个问题
秋天的色彩 共回答了20个问题 |采纳率95%- 八面体 顶点6 面8 棱12
十二面体 顶点20 面12 棱30
二十面体 顶点12 面20 棱30 - 1年前
相关推荐
- Co(Ⅲ)的八面体配合物CoClm•nNH3,若1mol配合物与AgNO3作用生成1mol AgCl沉淀,则m
Co(Ⅲ)的八面体配合物CoClm•nNH3,若1mol配合物与AgNO3作用生成1mol AgCl沉淀,则m、n的值是( )
A. m=1,n=5
B. m=3,n=4
C. m=5,n=1
D. m=4,n=5 闲云野鹤饮马江湖1年前1
闲云野鹤饮马江湖1年前1 -
 小小OK 共回答了29个问题
小小OK 共回答了29个问题 |采纳率79.3%解题思路:由1 mol配合物生成1 mol AgCl沉淀,知道1 mol配合物电离出1 mol Cl-,即配离子显+1价,又因为外界有一个Cl-,且Co显+3价,所以[CoClm-1•nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4;1mol配合物生成1 mol AgCl沉淀,知道1 mol配合物电离出1 mol Cl-,即配离子显+1价,又因为外界有一个Cl-,且Co显+3价,所以[CoClm-1•nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4,所以m=3,n=4;
答案:B;点评:
本题考点: 配合物的成键情况.
考点点评: 本题主要考查了配合物的组成,电离时外界电离,内界不电离是解题的关键,难度中等.1年前查看全部
- 下列配体中,与过渡金属离子只能形成低自旋八面体配合物的是:A氟离子B碘离子C钛离子D锰离子
 糖糖41年前1
糖糖41年前1 -
 夏之冬语 共回答了15个问题
夏之冬语 共回答了15个问题 |采纳率80%第一个和第二个都不能,因为他们都是弱的配位场,只能形成high spin.
要看是low spin还是high spin,要看配位场的能量强弱,有一个排列顺序.
阴离子的场强顺序为
I- < Cl- < F- < OH- < H2O < NH3< en < CN-≈CO
其中H2O和NH3是中性场强,那么形成low spin还是high spin要看他们跟阳离子间的能量差,若能量差大,则生成low spin,反之则是high spin
阳离子的场强顺序为
Mn2+ < Ni2+ < Co2+ < Fe2+ < V2+ < Fe3+ < Cr3+ < V3+ < Co3+ < Mn4+ < Mo3+ < Rh3+ < Pd4+ < Ir3+ < Re4+1年前查看全部
- [Co(NH3)3(H2O)3](NO3)3中,配离子为八面体构型,则配离子的空间结构有几种?为什么?
 happy2125071年前1
happy2125071年前1 -
 cathyqq 共回答了26个问题
cathyqq 共回答了26个问题 |采纳率84.6%2种,一种面式,一种经式1年前查看全部
- 请问:“已知一个凸八面体共有8个面,且有6个顶点,它有多少条棱?
 避花休月1年前1
避花休月1年前1 -
 pxd103 共回答了22个问题
pxd103 共回答了22个问题 |采纳率86.4%根据欧拉定理,在一凸多面体中,顶点数-棱边数+面数=2,可知棱数为6+8-2=121年前查看全部
- 四面体,五面体,六面体,八面体,的顶点数和面数,棱数
四面体,五面体,六面体,八面体,的顶点数和面数,棱数
各自列出来 zgfz911年前1
zgfz911年前1 -
 liuliu1204 共回答了20个问题
liuliu1204 共回答了20个问题 |采纳率85%根据欧拉公式:顶点(v)+面(f)-棱(e)=2可以很清楚的知道答案:四面体v=4;f=4;e=6五面体v=5;f=5;e=8八面体v=8;f=8;e=141年前查看全部
- 二价锌离子和二价镁离子半径相近,但在天然矿物中,前者经常呈四面体配位,后者则呈八面体配位,为什么?
 merad1年前1
merad1年前1 -
 moooon2000 共回答了19个问题
moooon2000 共回答了19个问题 |采纳率94.7%Mg2+核电荷数少,不易吸引配体.1年前查看全部
- {急】正四面体有多少条棱正四面体有多少条棱?六面体呢?八面体呢?正十二面体呢?正二十面体呢?全部答对加10分 先到先得
 dww5201年前1
dww5201年前1 -
 308971684 共回答了20个问题
308971684 共回答了20个问题 |采纳率85%“wanweiyi456”:
正四面体有6条棱
正六面体有12条棱
正八面体有18条棱
正十面体有24条棱
正十二面体有30条棱
正二十面体有54条棱.
从四面体有6条棱开始,每增加一个面就增加三条棱.
正n面体有(n-4)×3+6 条棱
祝好,再见.
20-41年前查看全部
- 食盐的结构(大学)到底是什么?我们热学课本中,讲到固体物理的时候,说食盐有三种结构,四面体,六面体,和八面体(好像是这样
食盐的结构(大学)到底是什么?
我们热学课本中,讲到固体物理的时候,说食盐有三种结构,四面体,六面体,和八面体(好像是这样,中间那个不确定),我只是想问,那个八面体是“正八面体”吗?希望有知道的好心人回答一下,高中课本的不要, adorelaure221年前1
adorelaure221年前1 -
 罗娜尔多 共回答了17个问题
罗娜尔多 共回答了17个问题 |采纳率88.2%不是食盐的结构,是氯化钠的晶孢结构是四面体的.同意楼下说法.1年前查看全部
- 老师,帮我做一道题:数出三棱锥 ,正方体,八面体,十二面体的顶点数(v),棱数(E)和面数(F),并归纳
老师,帮我做一道题:数出三棱锥 ,正方体,八面体,十二面体的顶点数(v),棱数(E)和面数(F),并归纳
V,E,F之间的关系式 ssr3281年前1
ssr3281年前1 -
 寰岛oo 共回答了11个问题
寰岛oo 共回答了11个问题 |采纳率100%V+F-E=2
顶点数+面数-棱数=21年前查看全部
- 如何用代数式表示出四面体、六面体、八面体、十二面体的面、顶点、棱之间的关系
 shanghanqing1年前1
shanghanqing1年前1 -
 继续工作ui 共回答了13个问题
继续工作ui 共回答了13个问题 |采纳率84.6%f+v-l=2
其中f代表面数
v代表顶点数
l代表棱数
这是个著名的定理,大概叫欧拉公式1年前查看全部
- 抛掷一枚普通的八面体骰子,骰子上有两个面写着1,两个面写着2,两个面写着3,两个面写着4,求P(掷得1).
 一根筷子-1年前1
一根筷子-1年前1 -
 hh相逢萍水hh 共回答了18个问题
hh相逢萍水hh 共回答了18个问题 |采纳率94.4%解题思路:先确定共8种等可能的结果数,而上面为1的占2种,然后根据概率公式计算.共有8种等可能的结果数,其中写着1的占2种,
所以P(掷得1)=[2/8]=[1/4].点评:
本题考点: 概率公式.
考点点评: 本题考查了概率公式:随机事件A的概率P(A)=事件A可能出现的结果数除以所有可能出现的结果数.P(必然事件)=1;P(不可能事件)=0.1年前查看全部
- 已知一个凸八面体共有8个面,且有6个顶点,请问它的棱有几条
 琵琶美酒夜光杯1年前1
琵琶美酒夜光杯1年前1 -
 冰封以久 共回答了14个问题
冰封以久 共回答了14个问题 |采纳率78.6%12条1年前查看全部
- Co(Ⅲ)的八面体配合物CoClm•nNH3,若1mol配合物与AgNO3作用生成1mol AgCl沉淀,则m
Co(Ⅲ)的八面体配合物CoClm•nNH3,若1mol配合物与AgNO3作用生成1mol AgCl沉淀,则m、n的值是( )
A.m=1,n=5
B.m=3,n=4
C.m=5,n=1
D.m=4,n=5 tj_20001年前1
tj_20001年前1 -
 万王之王小老虎 共回答了21个问题
万王之王小老虎 共回答了21个问题 |采纳率85.7%解题思路:由1 mol配合物生成1 mol AgCl沉淀,知道1 mol配合物电离出1 mol Cl-,即配离子显+1价,又因为外界有一个Cl-,且Co显+3价,所以[CoClm-1•nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4;1mol配合物生成1 mol AgCl沉淀,知道1 mol配合物电离出1 mol Cl-,即配离子显+1价,又因为外界有一个Cl-,且Co显+3价,所以[CoClm-1•nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4,所以m=3,n=4;
答案:B;点评:
本题考点: 配合物的成键情况.
考点点评: 本题主要考查了配合物的组成,电离时外界电离,内界不电离是解题的关键,难度中等.1年前查看全部
- 一个立体图形是柱体,且是八面体,这个立体图形是?
 戏子罗成1年前2
戏子罗成1年前2 -
 ssq772 共回答了17个问题
ssq772 共回答了17个问题 |采纳率94.1%既然是柱体,无外乎就圆柱和棱柱,既然有8个面,就排除了圆柱.
棱柱上下各有一个面,8-2=6
所以,阁下所指的立体图形是六棱柱!1年前查看全部
- 数字右上角的小数字各代表什么!我看到一个数字右上角有个小8,我只知道有个小2是平方,有个小3是立方,8莫非是八面体啊.还
数字右上角的小数字各代表什么!
我看到一个数字右上角有个小8,我只知道有个小2是平方,有个小3是立方,8莫非是八面体啊.还有上头有小4,5,6,7,9,10都代表什么啊!答好的加30分啊
我说的是物理中啊,那上面光速公试上有8次方,我认为应该是其它单位.... 草寇张三1年前4
草寇张三1年前4 -
 煮螃蟹58622 共回答了17个问题
煮螃蟹58622 共回答了17个问题 |采纳率100%光速是吗?就是3*10的八次方啊,八个10连乘,我解释的没有错啊
物理离不开数学的,大学以前的物理上如果出现你说的情况(如8的右上角有个11),就是11个8连乘,读作8的11次方,A的右上角是B的话,就是B个A连乘,读作A的B次方.学到后面你会遇到B不是整数的情况,到时候老师会教的1年前查看全部
- 在八面体弱场中,Fe2+和Fe3+的晶体场稳定化能分别为
 4058387501年前1
4058387501年前1 -
 bird106 共回答了18个问题
bird106 共回答了18个问题 |采纳率100%在八面体弱场中,假设电子成对能为P,则:
Fe(II) d6 (t2g)4 (eg)2
CFSE = - 4* 4 Dq + 2*6 Dq + P = - 4Dq + P
Fe(III) d5 (t2g)3 (eg)2
CFSE = - 3* 4 Dq + 2*6 Dq = 0 Dq1年前查看全部
- 可否由偶极矩方法鉴别八面体配合物MA2B4的顺反异构以及MA3B3的fac-mer异构体?
 dhc4k1年前1
dhc4k1年前1 -
 你我在路上 共回答了15个问题
你我在路上 共回答了15个问题 |采纳率80%MA2B4可以,顺式有偶极,反式很小;MA3B3用不了,面式和经式都是有偶极的,而且也很难从配体推出偶极矩大小1年前查看全部
- 为何 ClF6- 为正八面体而 XeF6为畸变的八面体?
为何 ClF6- 为正八面体而 XeF6为畸变的八面体?
RT 谢谢 xgq511年前3
xgq511年前3 -
 zhonglijiasudu 共回答了16个问题
zhonglijiasudu 共回答了16个问题 |采纳率81.3%第一个是特例,原因不太清楚,第二个很明确,Xe有8个外层电子,6个成键还有一个lp,所以是畸变的八面体,纠正一下雪浪安,是ClF6-,lp=1,不是0,再次纠正,这绝对是特例,这里作为负离子,要加一,1年前查看全部
- 表面积相同的四面体,六面体,八面体和十二面体哪个体积大
 我的露颖1年前1
我的露颖1年前1 -
 danelse 共回答了20个问题
danelse 共回答了20个问题 |采纳率85%12面1年前查看全部
- 已知一个多面体有12条棱,6个顶点,那么这个多面体是( ) A五面体 B六面体 c八面体 D12面体
 是这样的么1年前2
是这样的么1年前2 -
 木木我 共回答了24个问题
木木我 共回答了24个问题 |采纳率87.5%答案是C八面体
因为:在多面体中,简单多面体的顶点数V、面数F及棱数E间有关系
V+F-E=2
这个公式叫欧拉公式.公式描述了简单多面体顶点数、面数、棱数特有的规律.1年前查看全部
- 八面体配合物的晶体场理论说明Ti(H2O)63+
 ff韵诵读878618801年前2
ff韵诵读878618801年前2 -
 ningliang 共回答了23个问题
ningliang 共回答了23个问题 |采纳率95.7%弱场配位1年前查看全部
- 立体几何一道 相当急!正八面体的每个面的边长均为a的正三角形,则边长为1的八面体的各个顶点都在同一个球面上,则此球的体积
立体几何一道 相当急!
正八面体的每个面的边长均为a的正三角形,则边长为1的八面体的各个顶点都在同一个球面上,则此球的体积为?
给个思路就行,没有图不要紧,但思路要详细,解释要清楚, 仰望华山1年前4
仰望华山1年前4 -
 小牛子0104 共回答了20个问题
小牛子0104 共回答了20个问题 |采纳率90%正八面体关于正中间的平面是对称的.
正八面体的各个顶点都在同一个球体上,考虑到正八面体的对称性,这个球体应该也关于正八面体的对称面对称,否则旋转180°以后正八面体重合而球体不重合..而这是不可能的.
所以正八面体中间的正方形所在的平面就是球体最大的球面,也就是这个平面通过球心.
则边长为1的正方形的对角线就是球体的直径.
直径就是√2.
半径是√2/2.
体积=4/3*πr^3,计算即可1年前查看全部
- 空隙,M3+一半填入八面体空隙,一半填入四面体空隙,则为反式尖晶石,试通过CFSE计算Fe3O4 M3O4是什么结构
空隙,M3+一半填入八面体空隙,一半填入四面体空隙,则为反式尖晶石,试通过CFSE计算Fe3O4 M3O4是什么结构
M3O4氧原子常以面心立方堆积,若M2+填入四面体空隙,M3+填入八面体空隙,则为常式尖晶石,若M2+填入八面体空隙,M3+一半填入八面体空隙,一半填入四面体空隙,则为反式尖晶石,试通过CFSE计算Fe3O4 Mn3O4是什么结构 土豆粉丝1年前2
土豆粉丝1年前2 -
 风YU中 共回答了22个问题
风YU中 共回答了22个问题 |采纳率90.9%Fe3O4为反式尖晶石结构
Mn3O4为常式尖晶石结构1年前查看全部
- 为什么四面体配合物中的d-d跃迁吸收带比相应的八面体配合物强?
 nunu2881年前1
nunu2881年前1 -
 20hau 共回答了9个问题
20hau 共回答了9个问题 |采纳率88.9%在中心对称的八面体配合物中d-d跃迁属于·“禁阻跃迁”-----跃迁距极小.而在非中心对称的四面体配合物中d-d跃迁属于·“可允跃迁”----跃迁距大.1年前查看全部
- 在棱长为a的正方体中,连结相邻面的中心,求以这些线段为棱的八面体的体积
在棱长为a的正方体中,连结相邻面的中心,求以这些线段为棱的八面体的体积
希望能详细说下,点下灵通,我现在还没搞清楚呢.快快的,
我还在思考呢, xiaotuzi5201年前1
xiaotuzi5201年前1 -
 周2 共回答了18个问题
周2 共回答了18个问题 |采纳率88.9%=8*1/6(1/8a~3)
沿各边的中线把正方体分成8份,8面体也被分为8分,每份都是长宽高都为1/2a的4面体1年前查看全部
- 八面体有几条棱,几个顶点?急~~~~~~~~~
 mimi48561年前1
mimi48561年前1 -
 愤怒的小彬 共回答了16个问题
愤怒的小彬 共回答了16个问题 |采纳率87.5%N面体有N个面,(N-2)×2个顶点,(N-2)*3条棱
所以八面体有18条棱,12个顶点.1年前查看全部
- 【结构化学】画出d5组态在强八面体场中的电子排布方式,并求其晶体场稳定化能(东北师范大学研究生入学试题
 坚-持1年前1
坚-持1年前1 -
 ewq321ewq 共回答了22个问题
ewq321ewq 共回答了22个问题 |采纳率72.7%d5,5个电子,强场低自旋,电子应优先排列在能量低的t2g轨道上.故电子排布为t2g5 eg0(2g,g为下角标,5,0为上角标),t2g轨道上的5个电子分布在三个轨道上,为↑↓,↑↓,↑.即两个轨道上分别有两个自旋相反的电子,一个轨道上有一个单个电子.
晶体场稳定化能的计算公式:
CFSE=-(-4n1+6n2)Dq-(m1-m2)P,式中n1为t2g轨道上的电子数,n2为eg轨道上的电子数,m1、m2分别为八面体场、球形场中的d轨道的成对电子数.
对于d5强场来说,n1=5,n2=0,m1=2,m2=0.故
CFSE=-(-4*5+6*0)Dq-(2-0)P=20Dq-2P.1年前查看全部
- 四面体、五面体、六面体和八面体的顶点数、面数和棱数
 vv榜总编1年前1
vv榜总编1年前1 -
 baddoog 共回答了16个问题
baddoog 共回答了16个问题 |采纳率93.8%4,4,6
5,5,8
6,6,10
8,8,141年前查看全部
- 已知[Co(NH3)6]3+呈正八面体结构:各NH3分子间距相等,Co3+位于正八面体的中心.若其中2个NH3分子被Cl
已知[Co(NH3)6]3+呈正八面体结构:各NH3分子间距相等,Co3+位于正八面体的中心.若其中2个NH3分子被Cl取代,所形成的[Co(NH3)4Cl2]+的同分异构体有( )
x05A.2种 B.3种 C.4种 D.5种
为什么只有两种,在四个NH3分子形成的正方形邻位和对位不是也有两种,应该是四种啊?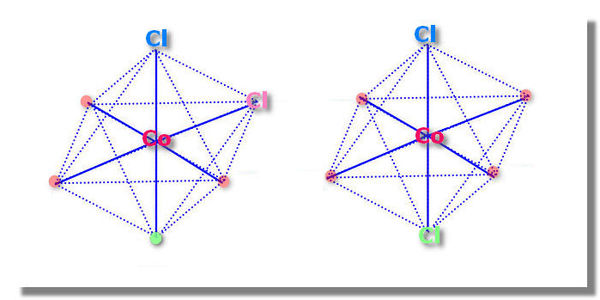
 erheworjweo1年前2
erheworjweo1年前2 -
 sowenwen 共回答了21个问题
sowenwen 共回答了21个问题 |采纳率81%CL与Cl之间的关系只有直线与直角.1年前查看全部
- 用分数坐标表示ccp晶胞中四面体空隙中心和八面体空隙中心的位置.
用分数坐标表示ccp晶胞中四面体空隙中心和八面体空隙中心的位置.
我不想要答案,我想问过程.
有八个(1/4,1/4,1/4); (1/4,1/4,3/4); (3/4,1/4,1/4); (3/4,1/4,3/4); (1/4,3/4,1/4); (1/4,3/4,3/4); (3/4,3/4,1/4); (3/4,3/4,3/4)
挑一个,讲怎么求得, lengyanren1年前1
lengyanren1年前1 -
 rita6 共回答了15个问题
rita6 共回答了15个问题 |采纳率100%ccp是立方面心最密堆积,链接一个顶点和旁边三个面心四个等径圆球的中心,即构成一个四面体空隙.
如距原点最近的空隙中心,从该点平行于b轴向a轴引垂线,与a轴相交于a轴单位长度的1/4处,故a轴坐标为1/4,同理:从该点平行于a轴向b轴引垂线,与b轴相交于b轴单位长度的1/4处,故b轴坐标也为1/4.过该点平行于ab的面,与c轴相交于c轴单位长度的1/4处,故c轴坐标为1/4.所以位置为(1/4,1/4,1/4).
其他空隙中心用同样方法可确定其分数坐标.
八面体空隙中心的位置在立方体体心和棱心位置,有四个.即:(1/2,1/2,1/2); (1/2,0,0); (0,1/2,0); (0,0,1/2);1年前查看全部
- 某矿物性状:八面体或六面体,无色透明,强金属光泽,最硬,性脆,条痕白色.是贵重宝石
某矿物性状:八面体或六面体,无色透明,强金属光泽,最硬,性脆,条痕白色.是贵重宝石
请详述 内部资料注意保存1年前2
内部资料注意保存1年前2 -
 jy03066325 共回答了15个问题
jy03066325 共回答了15个问题 |采纳率93.3%应该是钻石,也就是金刚石
钻石的晶体形态多呈八面体、菱形十二面体、四面体.纯净的钻石无色透明,强金刚光泽.硬度为10,是目前已知最硬的矿物.其脆性也相当高,用力碰撞仍会碎裂.属于贵重宝石1年前查看全部
- 下列说法中错误的是( )A.当中心原子的配位数为6时,配合单元常呈八面体空间结构B.SO3为平面正三角形结构C.已知[
下列说法中错误的是( )
A.当中心原子的配位数为6时,配合单元常呈八面体空间结构
B.SO3为平面正三角形结构
C.已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型
D.配位数为4的配合物均为正四面体结构 浅笑20001年前1
浅笑20001年前1 -
 风0513 共回答了21个问题
风0513 共回答了21个问题 |采纳率71.4%解题思路:A、当中心原子的配位数为6时,根据价层电子对互斥理论,形成的配合单元常呈八面体空间结构,这样的分布配位键间的作用力最小,物质最稳定,据此判断;
B、SO3中中心原子硫原子的价层电子对数为[6+0/2]=3,中心原子没有孤电子对,所以分子的空间构型为平面正三角形,据此判断;
C、[Cu(NH3)2]2+的中心原子采用sp杂化,形成两个杂化轨道,与两个氨分子形成两个配位键,中心原子无孤电子对,所以分子的空间构型为直线型,据此判断;
D、配位数为4的配合物可以为正四面体结构,也可以为平面四边形结构,据此判断;c、当中心原子的配位数为2时,根据价层电子对互斥理论,形成的配合单元常呈八面体空间结构,这样的分布配位键间的作用力最3,物质最稳定,故c正确;
B、SO3中中心原子硫原子的价层电子对数为[2+3/2]=3,中心原子没有孤电子对,所以分子的空间构型为平面正三角形,故B正确;
C、[Cu(NH3)2]2+的中心原子采用sp杂化,形成两个杂化轨道,与两个氨分子形成两个配位键,中心原子无孤电子对,所以分子的空间构型为直线型,故C正确;
j、配位数为4的配合物可以为正四面体结构,也可以为平面四边形结构,故j错误;
故选j.点评:
本题考点: 配合物的成键情况;原子轨道杂化方式及杂化类型判断.
考点点评: 本题主要考查配位单元及分子的空间构型,难度中等,解题关键是要注意正确运用价层电子互斥理论分析问题.1年前查看全部
- 四面体,八面体空隙在立方体中,哪几个位置是四面体空隙,哪几个是八面体空隙?描述尽量清楚点把
 神經_兮兮1年前3
神經_兮兮1年前3 -
 bakerstreet 共回答了16个问题
bakerstreet 共回答了16个问题 |采纳率93.8%面心的四面体空隙是(1/4,1/4,1/4),(3/4,1/4/1/4),(3/4,3/4,1/4),(1/4,3/4,1/4),(1/4,1/4,3/4),(3/4,1/4/3/4),(3/4,3/4,3/4),(1/4,3/4,3/4),
八面体空隙是((1/2,0,0),(1/2,1/2,0),(0,1/2,0),(1/2,1/2,1/2)
体心的情况稍微复杂点,包括12个四面体空隙,6个八面体空隙,24个三角形空隙,可以类推写出原子坐标1年前查看全部
- 某金属离子可以形成磁距分别为5.92BM和1.73BM的两种八面体配合物该离子可能是三价铁吗
 我这么拽1年前1
我这么拽1年前1 -
 萝卟丝鲫鱼汤 共回答了20个问题
萝卟丝鲫鱼汤 共回答了20个问题 |采纳率95%1、分析根据:
μ = [ n ( n + 2 )]^1/2
可求出不成对电子数n
磁矩为μ为5.92BM ,算出单电子数n为5;
1.73BM时,单电子数为1.
2、若是Fe(III)
d5类型:
强场时,单电子数为1,采取d2sp3杂化,形成八面体,如[Fe(CN)6]3-
弱场时,单电子数为5,采取sp3d2杂化,形成八面体,如[ FeF6]3-
所以可能是三价铁.1年前查看全部
- 下列说法中错误的是( )A.当中心原子的配位数为6时,物质常呈八面体空间结构B.[Ag(NH3)2]+中Ag+提供空轨
下列说法中错误的是( )
A.当中心原子的配位数为6时,物质常呈八面体空间结构
B.[Ag(NH3)2]+中Ag+提供空轨道
C.配位数为4的配合物均为正四面体结构
D.已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型 xiaoou881年前1
xiaoou881年前1 -
 疏导开 共回答了18个问题
疏导开 共回答了18个问题 |采纳率88.9%解题思路:A当中心原子的配位数为6时,将这六个配体边结起来就可以构成正八面体,所以物质结构也常呈八面体结构,据此判断;
B根据配合物的结构特点可知,[Ag(NH3)2]+中Ag+是中心离子,提供空轨道,NH3是配体提供孤电子对,形成配位键,据此答题;
C配位数为4的配合物可以为正四面体结构也可以为正四面体结构,据此答题;
D在[Cu(NH3)2]2+的中心原子采用sp杂化,而铜离子的配体是两个氨分子,所以它们的空间构型为直线型,据此答题;A、当中心原子的配位数为6时,将这六个配体边结起来就可以构成正八面体,所以物质结构也常呈八面体结构,故A正确;
B、根据配合物的结构特点可知,[Ag(NH3)2]+中Ag+是中心离子,提供空轨道,NH3是配体提供孤电子对,形成配位键,故B正确;
C、配位数为4的配合物可以为正四面体结构也可以为正四面体结构,故C错误;
D、在[Cu(NH3)2]2+的中心原子采用sp杂化,而铜离子的配体是两个氨分子,所以它们的空间构型为直线型,故D正确;
故答案选C.点评:
本题考点: 配合物的成键情况;原子轨道杂化方式及杂化类型判断.
考点点评: 本题主要考查了配合物的空间结构,难度不大,注重对配合物的基础知识的考查.1年前查看全部
- 有一个多面体由三面体和八面体连接组成的,已知有24个顶点,每个顶点有3个棱,设三面体有x个面,八面体有y
有一个多面体由三面体和八面体连接组成的,已知有24个顶点,每个顶点有3个棱,设三面体有x个面,八面体有y
很急,能快点吗?越快追加得分越高. topy781年前1
topy781年前1 -
 虚拟蔷薇 共回答了26个问题
虚拟蔷薇 共回答了26个问题 |采纳率80.8%八个正三角形,六个正八边形
已知有24个顶点,每个顶点有3个棱,设三面体有x个面,八面体有y
三角形有顶点=3x个
八边形有顶点=8y个
共有(3x+8y)/3个 因为每个顶点计算了三次
三角形有棱=3x个
八边形有棱=8y个
共有棱(3x+8y)/2 因为每条棱计算了两次
有24个顶点
所以(3x+8y)/3=24 化简得3x+8y=72 ①
所以有棱(3x+8y)/2=72/2=36
由euler公式
顶点数+面数-棱数=2
有24+x+y-36=2 化简得x+y=14 ②
由①②解得x =8 y=61年前查看全部
- 一只蚂蚁在八面体上随机的 移动 (random walk) 蚂蚁从一顶点出发到相邻的4个顶点的概率相同=1/4 求Px(
一只蚂蚁在八面体上随机的 移动 (random walk) 蚂蚁从一顶点出发到相邻的4个顶点的概率相同=1/4 求Px(X_n
一只蚂蚁在正八面体上随机的移动 (random walk) 蚂蚁从一顶点出发到相邻的4个顶点的概率相同=1/4 求Px(X_n) ) (在n步后回到起始点的概率)hint:递回式(recursion).有谁能帮我找出这样的式子啊或者其他方法也行
 fortunelin1年前1
fortunelin1年前1 -
 jinshan2000 共回答了11个问题
jinshan2000 共回答了11个问题 |采纳率90.9%Markov Chain
你用矩阵好了
起始点是1,相邻的2,3,4,5,对点6
矩阵A是:
0 0.25 0.25 0.25 0.25 0
0.25 0 0.25 0 0.25 0.25
0.25 0.25 0 0.25 0 0.25
0.25 0 0.25 0 0.25 0.25
0.25 0.25 0 0.25 0 0.25
0 0.25 0.25 0.25 0.25 0
每一项aij表示从i到j的概率
n步后回到原点概率就是A^n(矩阵相乘)a11的数
BTW,更简单一点的就是把原点,邻点,对点看成三类(1,2,3)
P(i,j)表示第j步在点i的概率
有初始P(1,0)=1;P(2,0)=0;P(3,0)=0
P(1,1)=0;P(2,1)=1;P(3,1)=0
P(1,2)=1/4;P(2,2)=1/2;P(3,2)=1/4
...
P(1,n)=P(2,n-1)*0.25
P(2,n)=P(1,n-1)*1+P(2,n-1)*0.5+P(3,n-1)*1
P(3,n)=P(2,n-1)*0.25
也就是
B=
0 0.25 0
1 0.5 1
0 0.25 0
C=(1,0,0)
C*B^n的第一项的值1年前查看全部
- 正多面体是不是分形?正三角体可以切割成若干个小的正三角体,立方体也可以.是不是所有的正多面体都可以这样干呢?(八面体,十
正多面体是不是分形?
正三角体可以切割成若干个小的正三角体,立方体也可以.是不是所有的正多面体都可以这样干呢?(八面体,十二面体,二十面体)
具体怎么说?? 青青蛇妖1年前3
青青蛇妖1年前3 -
 槽子糕 共回答了24个问题
槽子糕 共回答了24个问题 |采纳率79.2%我是LZ,我想了一下好像觉得不行.
假设把一个较小的分形塞到一个较大分形的一个角上,那么在小分形和大分形边缘就会产生一百八十减去正多面体角大小的夹角,这个夹角也要用该正多面体的角去填充.
设边之间的夹角是X,X好像要满足180-X=NX,N∈Z才行,所以X只能是60°和90°,大于90度的不行(N1年前查看全部
- 某金属配合物在八面体弱场中磁矩为4.98B.M,在八面体强场中磁矩为0,该金属为?答案是Fe2+,为什么不是Mn3+
某金属配合物在八面体弱场中磁矩为4.98B.M,在八面体强场中磁矩为0,该金属为?答案是Fe2+,为什么不是Mn3+
Fe2+是正确答案,求对Mn3+这个答案错误原因的详细分析. yueyang5281年前3
yueyang5281年前3 -
 yezidongtian 共回答了18个问题
yezidongtian 共回答了18个问题 |采纳率100%在八面体弱场中Fe2+ 和 Mn3+ 都有四个不成对电子,磁矩都为4.98B.M.但是在八面体强场中Fe2+的六个电子都成对(T2g6),磁矩为0,而Mn3+ 还有两对未成对电子(T2g4),故磁矩不为0.1年前查看全部
- 具有d8电子构型的中心离子,在形成八面体配合物时,必定以sp3d2轨道杂化,属于外轨型配合物.
 wbsaok2221年前2
wbsaok2221年前2 -
 shunshun0624 共回答了16个问题
shunshun0624 共回答了16个问题 |采纳率87.5%利用价键理论分析配合物的成键情况时的类型时是这么一个情况:
(1)杂化形成的杂化轨道均为空轨道(轨道中不排布电子).
(2)杂化轨道数与配位齿数相等,但不一定等于配位体数(有些配体为多齿配体),如八面体中,配位齿数为6,那么需要的杂化轨道数为6.
(3)当需要d轨道参与杂化形成杂化轨道时,有两种形式,当利用内层d轨道时,形成内轨型杂化轨道类型,形成内轨型配合物;当利用外层d轨道形成时,为外轨型杂化轨道,形成外轨型配合物.
需要6个杂化轨道,通常可以采取sp3d2或d2sp3两种杂化类型,但是在本题中,由于采用d2sp3,杂化时,有一个参加杂化的d轨道已经有两个电子(不提供空轨道),所以采用的可能为sp3d2杂化.但是由于杂化轨道价键理论本身并不能解决所有的问题,解释某些问题时也会出现和实际情况不相同的结果.因此,具有d8电子构型的中心离子,在形成八面体配合物时,有可能采取sp3d2杂化,也有可能采取其他的杂化类型.例如,dsp3d杂化等,如果需要具体得知是哪种杂化轨道类型的话,可以根据群论的相关知识得到解答.因此,本题中,不能说一定是外轨型配合物.只能说是有可能是sp3d2杂化.碰到具体问题得具体分析.1年前查看全部
- TiO2的红外光谱?求TiO2的红外标准谱(锐钛矿、金红石).以及Ti-O四面体、Ti-O八面体、Ti-O-Ti等键的伸
TiO2的红外光谱?
求TiO2的红外标准谱(锐钛矿、金红石).以及Ti-O四面体、Ti-O八面体、Ti-O-Ti等键的伸缩和弯曲振动的具体谱带位置.网上能见所到的都是有机物的红外谱,无机物的很少. 李许1年前1
李许1年前1 -
 jsk83 共回答了19个问题
jsk83 共回答了19个问题 |采纳率94.7%http://riodb01.ibase.a ... ?sdbsno=40172TiO2的标准IR光谱,具体谱带位置你可能得去查文献.这个日本的网站还可以查其它物质的IR、Raman、NMR等,但主要是针对有机物. 查看原帖>>
采纳哦1年前查看全部
- 怎么解释在八面体弱场中,Cu2+比Ni2+生成的配合物更稳定?
怎么解释在八面体弱场中,Cu2+比Ni2+生成的配合物更稳定?
我个人是计算了CFSE,但是结果很明显是相反的.到底该怎么解释呢,书上的习题要求解释八面体弱场中下列离子生成的配合物的稳定性 Mn2+ 留在心底1年前0
留在心底1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 求教无机化学晶体题!离子型氧化物MxOy,M离子填充在氧离子的八面体空隙中,八面体共顶角按简单立方点阵形式连接成三维骨架
求教无机化学晶体题!
离子型氧化物MxOy,M离子填充在氧离子的八面体空隙中,八面体共顶角按简单立方点阵形式连接成三维骨架,问该离子化合物的化学式.
答案是MO3 马路右边1年前0
马路右边1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 由八面体和三角形组成的立体图形,有24个顶点,每个顶点有三条棱,问他共有几个面
 熊壮1年前1
熊壮1年前1 -
 a_wsj 共回答了15个问题
a_wsj 共回答了15个问题 |采纳率73.3%直接使用初中学的欧拉公式:V+F-E=2,V是多面体的顶点个数,F是多面体的面数,E是多面体的棱的条数.V=24,E=24*3/2=36(每个棱对应两个顶点,每个顶点对应3条棱),即可求得多面体的面数F=141年前查看全部
- 已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被Cl-和H2O取代,所形成的[Co(NH3)2C
已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被Cl-和H2O取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)几种
(A)3种 (B)4种 (C)5种 (D)6种
为什么?不要复制别人的答案 luxiyuh1年前3
luxiyuh1年前3 -
 溶雪5219 共回答了21个问题
溶雪5219 共回答了21个问题 |采纳率85.7%等我发图片1年前查看全部
- 棱长为a的正方体中,连接相邻面的中心,以这些线段为棱的八面体的体积为( )
棱长为a的正方体中,连接相邻面的中心,以这些线段为棱的八面体的体积为( )
A.a3 3
B.a3 4
C.a3 6
D.a3 12  星薇1年前0
星薇1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在棱长伟a的正方体中,连接相邻面的中心,求以这些线段为棱的八面体的体积
 hefd1d1年前2
hefd1d1年前2 -
 眼睛哭舯了 共回答了16个问题
眼睛哭舯了 共回答了16个问题 |采纳率81.3%体积为:a³/6(a立方的六分之一倍)
相当于两个各棱长都相等的正四棱锥体积之和,且各棱长为√2a/2(二分之根号二倍a)1年前查看全部
- 如图,将正方体的六个面的中心连接起来,构成一个八面体,设这个八面体的体积是V 1 ,正方体体积是
如图,将正方体的六个面的中心连接起来,构成一个八面体,设这个八面体的体积是V 1 ,正方体体积是
V 2 ,则V 1 :V 2 =( )。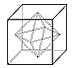
 dts1234567891年前1
dts1234567891年前1 -
 shli66 共回答了21个问题
shli66 共回答了21个问题 |采纳率100%1:61年前查看全部
- 如何区分下列单体?1)斜方双锥,四方双锥和八面体 2)斜方四面体,四方四面体,四面体
 开怀畅饮1年前1
开怀畅饮1年前1 -
 flying_to_sky 共回答了18个问题
flying_to_sky 共回答了18个问题 |采纳率94.4%四方双锥就是由八面体转化过来的,将八面体的每个面的中线提起来就是啦,斜方双锥我也不知道哦啊.后面的也在研究中1年前查看全部
大家在问
- 1下列叙述中,前者属于化学性质,后者是能表现出该项性质的化学变化的一组是( )
- 2如图,在矩形ABCD中,AB=20cm,BC=4cm,点P从A开始沿折线A-B-C-D以4cm的速度移动
- 3过去完成时的用法.例题一:她告诉我她从没去过巴黎.——She said that she had never been
- 4一、用所给动词适当形式填空:1、Let’s_____(read) the text again.2、Listen,who
- 5解方程题 x除3/7=10乘2/5 1/3除5/4除x=2/5 (21/20-1/4)除x=7/8 3/4x+一又1/2
- 6《富人之子》的理解题富人之子全文:齐有富人,家累千金.其二子甚愚,其父又不教之.艾子谓其父曰:"君之子虽美,而不通世务,
- 7压裂是返排率如何计算,例如压入地层100方压裂液,排除60方水和10方油
- 8一瓶饮料300毫升,其橙汁与水的比是1:4,小晶喝去一半后,剩下的饮料中,橙汁的含量是( )
- 9高数中讨论一个二元函数在某一点是否可微的方法有哪些?一阶偏导数连续是指极限值存在且相等吗?
- 10秋天是个收获的季节,也是播种希望,孕育新生的季节,美丽而多彩.请你在下面空格上填入,竖着填有关秋的
- 11已知A={(x,y)|x2+y2=1},B={(x,y)|[x/a+yb]=1},若集合A与集合B有且只有一个公共元素,
- 12直径8毫米的铜棒,一米有多重?如题,直径6毫米的呢?
- 13初一下科学作业本A第六节 地球表面的七巧板——板块 P60
- 14May I come in?翻译成中文
- 15根据首字母填空They were s---- at the strange noise.I was a---- at t
