AgNO3+NH4Cl=AgCl↓+NH4NO3中,NH4Cl是溶液吗?
 yuan1842022-10-04 11:39:542条回答
yuan1842022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 齐春虎 共回答了25个问题
齐春虎 共回答了25个问题 |采纳率76%- NH4Cl是溶液.
因为这个反应的本质是Ag+与Cl-结合生成AgCl沉淀,是离子反应,要在水溶液中进行. - 1年前
 lsx86 共回答了78个问题
lsx86 共回答了78个问题 |采纳率- 是的
- 1年前
相关推荐
- 某地1000kg化肥的市场价格如下:CO(NH2)2为1080元,NH4NO3为810元,NH4CO3为330元.分别用
某地1000kg化肥的市场价格如下:CO(NH2)2为1080元,NH4NO3为810元,NH4CO3为330元.分别用10000元采购上述花费,则购得化肥中氮元素最多的是哪一种?
 feneten1年前1
feneten1年前1 -
 2oxj5 共回答了17个问题
2oxj5 共回答了17个问题 |采纳率82.4%先求各物质中N的含量:CO(NH2)2含氮量为14×2/[(12+16+(14+2)×2)]=46.67%;NH4NO3含氮量为14×2/(14+4+14+16×3)=35%;NH4CO3含氮量为14/(14+4+12+16×3)=17.95%
再求10000元可买化肥质量:CO(NH2)2:10000/1080=9.26t; NH4NO3:10000/810=12.35t; NH4CO3:10000/330=30.3t
求氮总量:CO(NH2)2:9.26×46.67%=4.322t; NH4NO3:12.35×35%=4.323t; NH4CO3:30.3×17.95%=5.439t
故购买最多的是NH4CO31年前查看全部
- nh4cl nh4no3 (nh4)2so4受热分解,可制氨气吗?
nh4cl nh4no3 (nh4)2so4受热分解,可制氨气吗?
说明原因,产物,反应方程~ 寂惺1年前2
寂惺1年前2 -
 maomaold 共回答了17个问题
maomaold 共回答了17个问题 |采纳率88.2%氯化铵和硫酸铵在理论上可能,但没有什么实际价值.
理论上氯化铵热分解后形成的氨气和氯化氢气体扩散速率不一样.
(NH4)2SO4=NH3+NH4HSO4
硝酸铵受热阴阳离子间会发生氧化还原反应.
2NH4NO3=2N2+4H2O+O2 (热分解反应也会有其他产物)1年前查看全部
- 有一硝酸铵样品(NH4NO3).可能含有下列(NH4)2SO4,CO(NH2)2,NH4HCO3,NH4CL中的一种,分
有一硝酸铵样品(NH4NO3).可能含有下列(NH4)2SO4,CO(NH2)2,NH4HCO3,NH4CL中的一种,分析得知期中氮元素的质量分数是20%,该杨平中一定含有的物质是.
我一直搞不懂这种题.能不能具体分析一下?
硝酸铵中氨的质量分数是35%,35%>20%让后怎么分析? 肥猫瘦狗1年前1
肥猫瘦狗1年前1 -
 puplove 共回答了15个问题
puplove 共回答了15个问题 |采纳率93.3%NH4NO3的含氮量为35%,那证明含有的另外一种物质的含氮量肯定小于20%.这样才可以混合后取他们的中间值20%
(NH4)2SO4的含氮量为28/132=21%
CO(NH2)2的含氮量为28/60==47%
NH4HCO3的含氮量为14/79==17.7%
NH4CL的含氮量为14/53.5==26.1%
所以答案是NH4HCO3
不懂可以密我1年前查看全部
- 请教大家一道化学计算题:多少千克硝酸铵(NH4NO3)中的氮元素于100千克尿素中的氮元素质量相等?请快点告诉我,拜托大
请教大家一道化学计算题:多少千克硝酸铵(NH4NO3)中的氮元素于100千克尿素中的氮元素质量相等?请快点告诉我,拜托大家了
大家告我一下怎么列方程就行了 菲子儿1年前4
菲子儿1年前4 -
 z54247106 共回答了16个问题
z54247106 共回答了16个问题 |采纳率87.5%氮元素质量相等则含氮原子个数也相等
NH4NO3---CO(NH2)2
80 60
X 100kg
80/x=60/100kg
x=133.33kg1年前查看全部
- 、当硝酸铵(NH4NO3)和尿素[CO(NH2)2]中所含氮元素的质量相等时,它们的质量比是( )
、当硝酸铵(NH4NO3)和尿素[CO(NH2)2]中所含氮元素的质量相等时,它们的质量比是( )
这里的质量比是不是相对分子质量比 为什么 猫小妖v1年前1
猫小妖v1年前1 -
 咚咚囡囡 共回答了26个问题
咚咚囡囡 共回答了26个问题 |采纳率88.5%是
因为硝酸铵(NH4NO3)和尿素[CO(NH2)2]都是每摩尔含2摩尔氮原子
所以含的氮元素质量相等也就是他们的摩尔数相同 所以质量比就是相对分子质量之比
答案为 4:31年前查看全部
- 多少克含尿素10%的样品含有氮元素的质量与100克含有NH4NO3 20%的样品中含有氮元素的质量相等?
 camy1年前2
camy1年前2 -
 love435000 共回答了13个问题
love435000 共回答了13个问题 |采纳率76.9%尿素【CO(NH2)2】中氮元素的质量分数为:28/60×100%=46.7%
硝酸铵【NH4NO3 】中氮元素的质量分数为:28/80×100%=35%
设a克含尿素10%的样品含有氮元素的质量与100克含有NH4NO3 20%的样品中含有氮元素的质量相等
a×10%×46.7%=100×20%×35%
a=150
答:150克含尿素10%的样品含有氮元素的质量与100克含有NH4NO3 20%的样品中含有氮元素的质量相等1年前查看全部
- 科学的计算题(要过程的,氮是农作物体内蛋白质、核酸和叶绿素的重要成分.硝酸铵(化学式为:NH4NO3,)是目前农村常用的
科学的计算题(要过程的,
氮是农作物体内蛋白质、核酸和叶绿素的重要成分.硝酸铵(化学式为:NH4NO3,)是目前农村常用的一种速效氮肥,请计算,
-60g硝酸铵中还有氮元素多少克? 天边的惊虹1年前2
天边的惊虹1年前2 -
 多尼_乔巴 共回答了16个问题
多尼_乔巴 共回答了16个问题 |采纳率75%(NH4NO3查表可知,N(氮)的相对原子质量为14,H(氢)的相对原子质量为1,O(氧)的相对原子质量为16--此过程不必写出)
的相对分子质量为14+1×4+14+16×3=80
∴NH4NO3中氮的质量分数为[(14×2)/80]×100%=35%(注:书写时(14×2)/80可写为分数,不必用中括号)
∴NH4NO3中含有35%的N(氮)元素.
∴60gNH4NO3中含N质量为60g×35%=21g
答:60g硝酸铵中还有氮元素21g
(够完整吧:))1年前查看全部
- 问一个化学题某硝酸铵样品中NH4NO3的质量分数为99%(杂质不含氮),计算该化肥样品中氮元素的质量分数?最后一个:99
问一个化学题
某硝酸铵样品中NH4NO3的质量分数为99%(杂质不含氮),计算该化肥样品中氮元素的质量分数?
最后一个:99%X/(28/80)/X=99%*28/80
请写明白点,全部公式 bingmu20021年前1
bingmu20021年前1 -
 nn 共回答了18个问题
nn 共回答了18个问题 |采纳率88.9%NH4NO3的质量分数为99%,NH4NO3中N的质量分数为(14×2)/(14×2+4×1+16×3).
所以化肥中的N的质量分数为{(14×2)/(14×2+4×1+16×3)}×99%=34.65%1年前查看全部
- 160g NH4NO3中含氮元素多少G?
 尘世间11年前2
尘世间11年前2 -
 vaart23 共回答了15个问题
vaart23 共回答了15个问题 |采纳率93.3%160*(28/80)=56g1年前查看全部
- 硝酸铵(NH4NO3)中氮元素的质量分数为多少?……在线等.
硝酸铵(NH4NO3)中氮元素的质量分数为多少?……在线等.
提前预习,不过在这个问题上卡壳了,请教各位.要有详细的解题过程
 天师0071年前1
天师0071年前1 -
 风浪子123 共回答了13个问题
风浪子123 共回答了13个问题 |采纳率84.6%N:14 H:1 O:16
14X2 28
________________= — =0.35=35%
14+1X4+14+16X3 80
答:硝酸铵(NH4NO3)中氮元素的质量分数为35%1年前查看全部
- 硫酸铵(NH4)2SO4 碳酸氢铵 (NH4HCO3) 氯化铵 (NH4CL) 硝酸铵(NH4NO3) 中氮元素的含量怎
硫酸铵(NH4)2SO4 碳酸氢铵 (NH4HCO3) 氯化铵 (NH4CL) 硝酸铵(NH4NO3) 中氮元素的含量怎么求 ?
这是谢谢你们了啊...
我我 辛苦死我了.. 幸好还有一口气 .. 蓝天下飞翔1年前1
蓝天下飞翔1年前1 -
 孤堡飘雪 共回答了14个问题
孤堡飘雪 共回答了14个问题 |采纳率85.7%很简单,各氮元素原子量除以本化学式的化学式量,既氮元素的百分含量,如各物质的实际质量知道,和氮元素的百分含量一乘即是.1年前查看全部
- 一道初三化学题 ! 求解 .1吨化肥市场价格:尿素CO(NH2)2 1080元 ,硝酸铵 NH4NO3 810元 ,碳酸
一道初三化学题 ! 求解 .
1吨化肥市场价格:尿素CO(NH2)2 1080元 ,硝酸铵 NH4NO3 810元 ,碳酸氢铵 NH4HC03 330元 ,分别用1000元买化肥 ,买那种化肥含氮元素质量最多 ? ( 通过计算说明 )
有计算过程最好 。 jdzsw1年前5
jdzsw1年前5 -
 爱不懂_ff 共回答了17个问题
爱不懂_ff 共回答了17个问题 |采纳率94.1%尿素:1000/1080*(28/60)=0.432吨
硝酸铵:1000/810*(28/80)=0.324吨
碳酸氢铵1000/330*(14/79)=0.537吨1年前查看全部
- 某土地使用含杂质的氮化肥NH4NO3,已知氮元素的质量分数为38%,则含有的杂质是?
某土地使用含杂质的氮化肥NH4NO3,已知氮元素的质量分数为38%,则含有的杂质是?
A NH4HCO3 B NH4CI C CO(NH2)2 D (NH4)2SO4 永恋勇俊1年前1
永恋勇俊1年前1 -
 晚安三秒 共回答了14个问题
晚安三秒 共回答了14个问题 |采纳率92.9%NH4NO3分子量是80 含N百分数是 28/80= 35 %小于38%
现在已知氮元素的质量分数为38% 所以得出结论 如果要让混合物的含N百分数是 38% 必须满足一个大于 38% 一个小于38%
说明另一种杂质的含氮量要大于38 %
A NH4HCO3 含N量是 14/79=17.8%
B NH4CI含氮量 14/53.5 =26%
C CO(NH2)2含N量是28/58=48.3%
D (NH4)2SO4 含氮量是 28/ 132=21.2%
所以选 c1年前查看全部
- 多少克尿素【co(NH2)2】的含氮量与160g硝酸铵的含氮量相当. 硝酸铵的化学式是NH4NO3
多少克尿素【co(NH2)2】的含氮量与160g硝酸铵的含氮量相当. 硝酸铵的化学式是NH4NO3
谢谢
 onlyren1年前1
onlyren1年前1 -
 饭岛嫒 共回答了18个问题
饭岛嫒 共回答了18个问题 |采纳率94.4%可以设尿素质量为x.则
(2*14 / 60 )*x =(2*14 /80 )*160
解得,尿素的质量x= 120g1年前查看全部
- 760g尿素[CO(NH2)2]中含氮元素多少克?与多少克硝酸铵(NH4NO3)含氮元素的质量相等?
760g尿素[CO(NH2)2]中含氮元素多少克?与多少克硝酸铵(NH4NO3)含氮元素的质量相等?
急得很, 0201443241年前2
0201443241年前2 -
 辉哥在线 共回答了21个问题
辉哥在线 共回答了21个问题 |采纳率95.2%12+16+(14+2)*2=60
所以尿素相对分子质量为60
所以760/60 * 28=354.6666667g 再让这个数除以硝酸铵中氮元素的质量分数35%,就得硝酸铵的质量.1年前查看全部
- 已知化肥硝酸铵的化学式 NH4NO3 (所有数字是小写的).试求
已知化肥硝酸铵的化学式 NH4NO3 (所有数字是小写的).试求
《1》硝酸铵中N、H、O三种元素的质量比,7:1:4(我已经求出来了)
《2》为了保证某一农作物获得3.5kg氮元素,则需要硝酸铵质量为多少?(要写出过程)
《3》某硝酸铵样品中 NH4NO3 (数字小写)的纯度为90%,求此样品中氮元素的质量分数.(杂志不含氮元素)
俄..第一问 答案看错了,是7:1:12 .好心人直接答第二、三问就好 cklh_10041年前1
cklh_10041年前1 -
 他朝相忘烟水里 共回答了18个问题
他朝相忘烟水里 共回答了18个问题 |采纳率88.9%(1)质量比求错了,应该是:
14*2:1*4:16*3=7:1:12
(2)含N质量分数为:14*2/(14*2+1*4+16*3)=7/20,设需要硝酸铵x kg
x*7/20=3.5
解得x=10
(3)含N质量分数=纯度*纯物质N质量分数=90%*7/20=31.50%1年前查看全部
- 一定条件下,硝酸铵受热分解的未配平的化学方程式为NH4NO3=HNO3+N2+H2O,求被氧化与被还原的原子数之比,过程
 cwwp1年前1
cwwp1年前1 -
 mysticist 共回答了15个问题
mysticist 共回答了15个问题 |采纳率93.3%铵根离子中的N是负三价,硝酸根中的N是正五价,发生归中反应,都得到0价的N,电荷守恒,上升的总价态要等于下降的总价态,3(上升)*5(原子数)=5(下降)*3(原子数),因此被氧化与被还原的原子数之比为5:3.1年前查看全部
- 根据硝酸铵(NH4NO3)化学式计算 160千克硝酸铵中含氮元素多少千克?
 制造ss1年前2
制造ss1年前2 -
 troyaynait 共回答了17个问题
troyaynait 共回答了17个问题 |采纳率88.2%硝酸铵中氮元素的质量分数为28/80*100%=35%
160*35%=56kg
160千克硝酸铵中含氮元素56kg1年前查看全部
- 根据下列步骤鉴别氮肥(NH4)2SO4,NH4NO3,NH4HCO3
根据下列步骤鉴别氮肥(NH4)2SO4,NH4NO3,NH4HCO3
分别闻气味 有强烈气味的是 【 A 】 无强烈气味的是【B】【C】 加入 Ba(NO3)2溶液 再加稀HNO3 无沉淀的是【B】 有 白色沉淀的是【C】 问 A B C 为 上述三种 氮肥的 什么 liuxvruo1年前3
liuxvruo1年前3 -
 熊回来了 共回答了18个问题
熊回来了 共回答了18个问题 |采纳率94.4%A 碳酸氢铵 B 硝酸铵 C 硫酸铵
由于铵根粒子与碳酸氢根离子可双水解不稳定,故能闻到刺激性气味
硫酸根可与钡离子发生反应,是常识
剩下的一个用排除法即可1年前查看全部
- 某同学进行了“物质溶解的吸热或放热”的探究实验:他向盛有5mL水的试管中加入5gNH4NO3固体,振荡,得到透
某同学进行了“物质溶解的吸热或放热”的探究实验:他向盛有5mL水的试管中加入5gNH4NO3固体,振荡,得到透
明澄清的溶液,并发现试管外壁有水珠产生.《1》振荡试管的目的是什么?溶液的颜色为什么色?该溶液的溶质是什么?溶剂是什么?该溶液中溶剂的质量是多少?《水的密度为1g/cm3次方》《4》试管外壁有水珠的原因是? qwertyering1年前1
qwertyering1年前1 -
 沸点的寒冰 共回答了27个问题
沸点的寒冰 共回答了27个问题 |采纳率92.6%(1)震荡目的视为了使 NH4NO3充分溶解,溶液颜色无色的原因是 NH4+和NO3-都是无色的.
(2)该溶液溶质是 NH4NO3,溶剂是 水
(3)溶剂的质量是5g
(4)试管外壁有水珠,说明溶解过程是吸热,所以试管外空气中的水气遇冷凝结在水管外壁.1年前查看全部
- 某硝酸钠(NH4NO3)的样品中,NH4NO3的质量分数为70%,计算样品中氮元素的质量分数
 sweetrain191年前1
sweetrain191年前1 -
 sandy19 共回答了18个问题
sandy19 共回答了18个问题 |采纳率100%NH4NO3中N的质量分数为(14×2)/(14×2+4×1+16×3)
再乘70%就是了(假设杂质中不含N)1年前查看全部
- 某硝酸铵样品中NH4NO3的质量分数为90%(杂质不含氮).计算该氮肥样品中氮元素的质量分数______.
 怎么会爱上你1年前1
怎么会爱上你1年前1 -
 lctjane 共回答了17个问题
lctjane 共回答了17个问题 |采纳率100%解题思路:混合物中某元素的质量分数=纯净物中该元素的质量分数×混合物中该纯净物的纯度.解法一:样品中氮元素的质量分数为
[14×2/80]×100%×90%=31.5%.
故答案为31.5%.
解法二:设样品的质量为a,则样品中的NH4NO3的质量为90%a.
则含有的氮元素的质量为90%a×[14×2/14×2+4+16×3]×100%=0.315a.
则氮元素在样品中的质量分数为[0.315a/a]×100%=31.5%
故答案为31.5%点评:
本题考点: 物质组成的综合计算;常见化肥的种类和作用;有关化学式的计算和推断.
考点点评: 本题主要考查和混合物中某元素的质量分数的计算,难度较大.1年前查看全部
- 某硝酸铵[NH4NO3]样品中含一种杂质,经分析样品中氮元素的质量分数为36%,该样品中所含杂质可能是( )
某硝酸铵[NH4NO3]样品中含一种杂质,经分析样品中氮元素的质量分数为36%,该样品中所含杂质可能是( )
A. (NH4)2SO4
B. CO(NH2)2
C. NH4HCO3
D. NaCl 痴心绝对0051年前1
痴心绝对0051年前1 -
 piaoliang3213 共回答了13个问题
piaoliang3213 共回答了13个问题 |采纳率92.3%解题思路:首先计算纯净物硝酸铵中氮元素的质量分数,然后与样品中氮的质量分数相比,看谁的高.若样品中的高,则杂质中氮的质量分数必定高于硝酸铵中的;若样品中的低,则杂质中氮的质量分数必然低于硝酸铵中的.纯净硝酸铵[NH4NO3]中氮元素的质量分数=[28/80]×100%=35%
A、(NH4)2SO4中氮元素的质量分数=[28/132]×100%=21.2%
B、CO(NH2)2中氮元素的质量分数=[28/60]×100%=46.7%
C、NH4HCO3中氮元素的质量分数=[14/79]×100%=17.8%;
D、NaCl中不含氮元素;
样品中氮元素的质量分数为36%>35%,若样品中的高,则杂质中氮的质量分数必定高于硝酸铵中的;
故选B.点评:
本题考点: 有关化学式的计算和推断;元素的质量分数计算.
考点点评: 将质量分数的计算与生活实际相联系;计算时要理清各个量之间的关系,再结合题意进行分析解答.1年前查看全部
- 一道初三化学题(求思路)用一定量的NH4NO3和NH4H2PO4的固体混合物配置无土栽培营养液,混合物中氮元素的质量分数
一道初三化学题(求思路)
用一定量的NH4NO3和NH4H2PO4的固体混合物配置无土栽培营养液,混合物中氮元素的质量分数最有可能的是
12% 25% 35% 40%
求思路 yuandingzhehao1年前1
yuandingzhehao1年前1 -
 谭风 共回答了25个问题
谭风 共回答了25个问题 |采纳率88%NH4NO3中氮元素质量分数=N×2/NH4NO3×100%=35%
NH4H2PO4氮元素的质量分数 = 14 ÷(14+4+2+31+4×16) ×100% = 12.17%
只要是介于12.17%-35%之间的都可以.1年前查看全部
- (2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取&
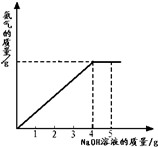 (2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
(2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
(1)样品中硝酸铵的质量分数;
(2)所得溶液中NaNO3的质量分数(保留两位小数). wwID不能取太长1年前1
wwID不能取太长1年前1 -
 纺织工人 共回答了20个问题
纺织工人 共回答了20个问题 |采纳率95%解题思路:(1)从图中可看出氢氧化钠溶液滴加到4克时硝酸铵恰好完全反应,根据参加反应的氢氧化钠的质量求出硝酸铵的质量,即可解答;
(2)根据参加反应的氢氧化钠的质量求出生成的硝酸钠的质量,用生成的硝酸钠的质量+原有的硝酸钠的质量为所得溶液中硝酸钠的质量;用样品的质量+所加氢氧化钠溶液的质量-氨气的质量(氨气的质量可根据氢氧化钠的质量求出)为所得溶液的质量;再根据溶质质量分数计算公式即可求出所得溶液中硝酸钠的质量分数.设2.0g样品中含NH4NO3的质量为ⅹ,反应生成 NaNO3的质量为 y,
反应生成的NH3的质量为z,则
NH4NO3 +NaOH=NaNO3 +NH3↑+H2O
80 40 85 17
ⅹ4g×20% yz
[80/x=
40
4g×20%],[40/4g×20%]=[85/y],[40/4g×20%=
17
z]
ⅹ=1.6g
y=1.7g
z=0.34g
(1)样品中NH4NO3的质量分数为:
1.6g
2g×100%=80%;
(2)反应后所得溶液中NaNO3的质量分数为:
1.7g+(2g−1.6g)
2g+5g−0.34g×100%=31.5%
答:(1)样品中NH4NO3的质量分数为80%;
(2)反应后所得溶液中NaNO3的质量分数为31.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 做本道题时要将4克氢氧化钠溶液和5克氢氧化钠溶液区分清,不能乱用,参加反应的氢氧化钠溶液的质量是4克,所加的氢氧化钠溶液的质量是5克.1年前查看全部
- 区别 试剂的题 会的来能把Na2SO4 NH4NO3 KCl (NH4)2SO4四瓶无色溶液加以区别的一种试剂 必要时可
区别 试剂的题 会的来
能把Na2SO4 NH4NO3 KCl (NH4)2SO4四瓶无色溶液加以区别的一种试剂 必要时可以加热
A BaCl2 B NaOH C Ba(OH)2 D AgNO3
为什么是C 其他3个为啥不行 用到哪些原理 知识点 爱你万年1年前4
爱你万年1年前4 -
 51590221 共回答了21个问题
51590221 共回答了21个问题 |采纳率81%c和Na2SO4反应只有沉淀,和 NH4NO3 反应只有气体,和KCl无明显现象,和(NH4)2SO4反应既有气体又有沉淀现象明显,所以能区分A和Na2SO4 (NH4)2SO4反应都有沉淀,无法区分B和Na2SO4 KCl反应也没有明显现象,无法区分D和Na2SO4...1年前查看全部
- HNO3+NH3=NH4NO3的离子方程式
 tryagainwu1年前1
tryagainwu1年前1 -
 真予 共回答了28个问题
真予 共回答了28个问题 |采纳率82.1%H+ + NH3 =NH4+
望采纳1年前查看全部
- 配平 Zn+HNO3---Zn(NO3)2+NH4NO3+H2O 用化合价升降法
 htmm1年前2
htmm1年前2 -
 ljh770617 共回答了18个问题
ljh770617 共回答了18个问题 |采纳率94.4%化学方程式为:4Zn+10HNO3---4Zn(NO3)2+1NH4NO3+3H2O
锌升2价,氮(转化为铵根)降8价
4Zn+HNO3---Zn(NO3)2+1NH4NO3+H2O
把锌配平
4Zn+HNO3---4Zn(NO3)2+1NH4NO3+H2O
把氮配平
4Zn+10HNO3---4Zn(NO3)2+1NH4NO3+H2O
最后全部配平
4Zn+10HNO3---4Zn(NO3)2+NH4NO3+3H2O
不懂在想我追问.
多谢!1年前查看全部
- 多少千克的NH4HCO3中所含氮元素与160千克NH4NO3中氮的质量相等
 施法者1年前1
施法者1年前1 -
 情定落日桥 共回答了22个问题
情定落日桥 共回答了22个问题 |采纳率86.4%NH4HCO3中,W(N)=
1kg NH4HCO3中,氮元素的质量=1kg×17.7%=0.177kg
NH4NO3中,W(N)=
NH4NO3的质量为:0.177kg÷35%=0.51kg1年前查看全部
- 某NH4NO3样品中氮元素的质量分数为28%(杂志不含氮),此样品中的NH4NO3的质量分数是
 最爱棉花糖1年前1
最爱棉花糖1年前1 -
 huanghaitian 共回答了22个问题
huanghaitian 共回答了22个问题 |采纳率90.9%80%
NH4NO3的质量分数=氮元素的质量分数/NH4NO3中氮元素的质量分数
28%/(28/80)=80%1年前查看全部
- 已知NH4NO3和KCl固体混合物中氮元素的质量分数为28%,则混合物中KCl的质量分数为( )
已知NH4NO3和KCl固体混合物中氮元素的质量分数为28%,则混合物中KCl的质量分数为( )
A. 20%
B. 25%
C. 85%
D. 80% dsjsgm1年前1
dsjsgm1年前1 -
 jingxiu2 共回答了14个问题
jingxiu2 共回答了14个问题 |采纳率100%解题思路:NH4NO3中含有氮元素,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,计算出固体混合物硝酸铵的质量分数、KCl的质量分数.NH4NO3中含有氮元素,已知NH4NO3和KCl固体混合物中氮元素的质量分数为28%,则混合物中硝酸铵的质量分数为28%÷(
14×2
14×2+1×4+16×3×100%)=80%.
则混合物中KCl的质量分数为1-80%=20%.
故选:A.点评:
本题考点: 元素的质量分数计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 关于某道初三化学题的疑惑已知某不纯的氮肥样品中,含有NH4NO3,经测定其中氮元素的质量分数为336%,则样品中可能含有
关于某道初三化学题的疑惑
已知某不纯的氮肥样品中,含有NH4NO3,经测定其中氮元素的质量分数为336%,则样品中可能含有的一种氮肥的含氮量为什么要大于36%呢?难道这个36%是平均值? feiycy981年前1
feiycy981年前1 -
 杨赖赖 共回答了20个问题
杨赖赖 共回答了20个问题 |采纳率75%这个36%当然是这份样品中氮含量的平均值了.硝酸铵中氮含量是35%,那么另一种氮肥的氮含量一定要大于36%才能使其平均值为36%.1年前查看全部
- 某不纯的化肥经化验的氮的含量为31.5%已知其中只有硝酸铵NH4NO3为含氮化何物,则NH4NO3的质量分数为多少?
 13000023004001年前1
13000023004001年前1 -
 fgfgffgf 共回答了18个问题
fgfgffgf 共回答了18个问题 |采纳率83.3%设化肥的质量为100g.
其中氮的质量为:100gx31.5%=31.5g
NH4NO3中氮的质量分数=(14x2)/14x2+1x4+16x3=35%
NH4NO3的质量=31.5g/35%=90g
NH4NO3的质量分数=90g/100g=90%1年前查看全部
- (2012•东城区一模)硝酸铵(NH4NO3)的外观与氯化钠很相似,均为白色固体.区别它们的一种方法是将两者分别隔绝空气
(2012•东城区一模)硝酸铵(NH4NO3)的外观与氯化钠很相似,均为白色固体.区别它们的一种方法是将两者分别隔绝空气加热,氯化钠不分解,硝酸铵能分解.硝酸铵分解得到的气体不可能是( )
A.NH3
B.SO2
C.NO2
D.N2 Lydia_t1年前1
Lydia_t1年前1 -
 uu觅者 共回答了15个问题
uu觅者 共回答了15个问题 |采纳率93.3%解题思路:根据质量守恒定律,化学反应前后,元素的种类不变进行分析.化学反应前后元素的种类不变,硝酸铵中有氮元素、氢元素、氧元素三种元素,故分解后得到的气体中只能含有这三种元素.
故选B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查了质量守恒定律,明白元素的种类在化学反应前后不变是解决本题的关键.1年前查看全部
- HNO3怎样生成NH4NO3
 jones02171年前1
jones02171年前1 -
 ofw_30 共回答了27个问题
ofw_30 共回答了27个问题 |采纳率96.3%HNO3+NH3-->NH4NO31年前查看全部
- 硝酸铵(化学式为NH4NO3)在农业与工业生产中有重要作用,下列有关硝酸铵的说法正确的是( )
硝酸铵(化学式为NH4NO3)在农业与工业生产中有重要作用,下列有关硝酸铵的说法正确的是( )
A.它属于氧化物
B.其相对分子质量是80g
C.它可用作复合肥
D.其中氮、氢元素的质量比是7:1 wuupp1年前1
wuupp1年前1 -
 思念漫溢 共回答了16个问题
思念漫溢 共回答了16个问题 |采纳率81.3%解题思路:A、根据氧化物的概念进行分析判断.
B、相对分子质量单位是“1”,不是“克”,常常省略不写.
C、根据含有氮元素的肥料称为氮肥进行分析判断.
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.A、硝酸铵(化学式为NH4NO3)由三种元素组成,不属于氧化物,故选项说法错误.
B、相对分子质量单位是“1”,不是“克”,故选项说法错误.
C、硝酸铵中含有氮元素,属于氮肥,不属于复合肥,故选项说法错误.
D、硝酸铵中氮、氢元素的质量比是(14×2):(1×4)=7:1,故选项说法正确.
故选:D.点评:
本题考点: 常见化肥的种类和作用;从组成上识别氧化物;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- NH4NO3 (NH4)2SO4
NH4NO3 (NH4)2SO4
(1)市售硝酸铵中含氮33.95%,求其中纯硝酸铵的质量分数
(2)某农民原计划买1吨这种含氮33.95%的硝酸铵,现因缺货,改买硫酸铵,
要买多少吨硫酸铵,才能使其含氮量相等? jack01251年前1
jack01251年前1 -
 丫丫妹妹1 共回答了11个问题
丫丫妹妹1 共回答了11个问题 |采纳率90.9%(1)设纯硝酸铵的质量分数为x
28/80x=33.95% x=97%
(2)设需要买y吨硫酸铵
1×33.95%=(28/132)×y
y=1.6(吨)1年前查看全部
- 60克硝酸铵(NH4NO3)中含氮元素( )
60克硝酸铵(NH4NO3)中含氮元素( )
要有计算过程或推理过程
在线等,急!!!!!!!!!!! sxpsxp1581年前2
sxpsxp1581年前2 -
 邹飞 共回答了22个问题
邹飞 共回答了22个问题 |采纳率86.4%硝酸铵相对分子质量14+4*1+14+16*3=80
内氮元素分子质量14*2=28
则60G硝酸铵中氮元素=60*(28/80)=21g1年前查看全部
- NaCl,NH4NO3,NaOH,这三种物质溶解时的温度变化是?
NaCl,NH4NO3,NaOH,这三种物质溶解时的温度变化是?
PS:放热>吸热 会使周围温度升高,还是溶液本身温度升高,如果是使周围温度升高,那溶液此刻温度是不是低于溶解前温度,烧杯壁温度呢? fymjq1年前1
fymjq1年前1 -
 风后痕迹 共回答了16个问题
风后痕迹 共回答了16个问题 |采纳率93.8%NaCl没变化.硝酸铵溶解吸热,NaOH溶解放热.
溶解放热就是指物体向环境中放出热量,所以周围温度升高,也就是说溶液温度升高,一个道理.像NaOH溶解时水可以很烫,烧杯壁与溶液是一样的温度啊
溶解吸热就是指物体从环境中吸收热量,周围温度降低.NH4NO3溶解的时候可以把水冻住1年前查看全部
- 把aL(NH4)2SO4和NH4NO3的混合溶液分成两等分
把aL(NH4)2SO4和NH4NO3的混合溶液分成两等分
将aL含(NH4)2SO4和NH4NO3的混合液平均分成两份,向一份中加入b mol烧碱,加热恰好将NH3全部赶去,向另一份中加入BaCl2溶液完全反应,消耗c mol BaCl2,则原溶液中NO3-的物质的量浓度为?
备注:我的化学基础比较差,我看了许多人的答案,都看不懂,什么叫做电荷守恒,什么铵根离子总量等于NaOH的量bmol,硫酸根的量等于BaCl2的物质的量,即cmol,由以上可知硫酸铵含有的铵根离子,则可求硝酸铵中硝酸根的物质的量及浓度.
都不知道到底是怎么一个计算过程,请高手一步步来,每步解释清楚, maple4161年前2
maple4161年前2 -
 zling999 共回答了16个问题
zling999 共回答了16个问题 |采纳率93.8%先别急嘛,我会说的让你容易懂的,
别管那些什么理论了,其实,你的备注都查不多做出来啦,只是你没组织好而已.
一步步来吧,
(1)aL分成两份就是a/2L体积.
(2)加入烧碱,和哪个反应,你知道吧.OH- + NH4+ =NH3 + H2O 一比一反应,加入的是b mol OH- 你就有b mol NH4+.这个明白吧?
(3)加入c mol BaCl2 是Ba2+ + SO42- =BaSO4一比一反应,就是有c mol SO42-,这个懂吧?
(4)由(3)可知,在a/2L里面有硫酸铵是 c mol,再结合(2)可知,含有的硝酸根量与和他结合的铵根一样的,就是b -2c,
所以,浓度就是,b-2c/a/2=2(b-2c)/a.1年前查看全部
- 下列物质:①NaCl;②I2;③C60;④Ag;5NH4NO3;⑥Ne;⑦CH4;8NaOH中,由原子构成的物质有 ;由
下列物质:①NaCl;②I2;③C60;④Ag;5NH4NO3;⑥Ne;⑦CH4;8NaOH中,由原子构成的物质有 ;由分子构成
下列物质:①NaCl;②I2;③C60;④Ag;5NH4NO3;⑥Ne;⑦CH4;8NaOH中,由原子构成的物质有 ;由分子构成的物质有 ;
由离子构成的物质有 ;属于金属单质的是 . y118385001年前2
y118385001年前2 -
 anyuan19811202 共回答了24个问题
anyuan19811202 共回答了24个问题 |采纳率91.7%由原子构成的物质有Ag Ne由分子构成的物质有I2 C60 CH4 由离子构成的物质有NaCl NH4NO3 NaOH 属于金属单质的是 Ag1年前查看全部
- 已知某种NH4NO3样品中混有不含氮元素的杂质,测得该NH4NO3样品中含氮的质量分数为24.5%,则样品中NH4NO3
已知某种NH4NO3样品中混有不含氮元素的杂质,测得该NH4NO3样品中含氮的质量分数为24.5%,则样品中NH4NO3的质量分数为( )
A. 24.5%
B. 49%
C. 70%
D. 80% 阿努夏农1年前1
阿努夏农1年前1 -
 月下刀 共回答了13个问题
月下刀 共回答了13个问题 |采纳率92.3%解题思路:欲正确解答本题,需计算出NH4NO3中氮元素的质量分数,再让NH4NO3样品中含氮的质量分数和它比较,即可计算出样品中NH4NO3的质量分数,然后从选项中选出符合的一项即可.NH4NO3中氮元素的质量分数为:
28
80×100%=35%,24.5%÷35%=70%,
故选C.点评:
本题考点: 混合物中某元素的质量计算.
考点点评: 本题主要考查学生对元素的质量分数的计算能力.1年前查看全部
- 镁和硝酸反应配平!( )Mg+( )HNO3==( )Mg(NO3)2+( )NH4NO3+( )H2O
 任未来1年前2
任未来1年前2 -
 小笑世上士 共回答了20个问题
小笑世上士 共回答了20个问题 |采纳率95%4 10 4 1 31年前查看全部
- NaOH ,NaCl ,NH4NO3是什么物质
 chit061年前1
chit061年前1 -
 reida 共回答了17个问题
reida 共回答了17个问题 |采纳率94.1%NaOH :氢氧化钠,碱,火碱;NaCl:氯化钠,盐,食盐.NH4NO3:硝酸铵,盐,是硝酸和氨的反应产物,可做化肥.1年前查看全部
- NaoH,NH4NO3,NaCl可以只用水来鉴别么?
 90307351年前1
90307351年前1 -
 今夜买醉 共回答了22个问题
今夜买醉 共回答了22个问题 |采纳率100%1.因为要除去三氧化硫,如果用亚硫酸钠的话,三氧化硫可以除去,但是因为二
氧化硫也会溶于眼硫酸钠中而且还会在二氧化硫中引入水蒸气这个新的杂质气体
,A,B就不用说了,所以要用浓硫酸,即选D项.
2.氯化银溶于过量的氨水,生成银铵溶液,但银铵溶液不稳定.
3.二氧化硫具有漂白性可以使品红褪色,但次氯酸等也具有漂白性的物质也可以
同样使品红褪色.
4.可以只用水来鉴别.分别取三支试管分别加入固体物质,加水溶解.因为氢氧
化钠遇水会放出大量的热,所以可直接鉴别出来,另两只试管变化不太大,但往
另两只试管中加入氢氧化钠固体,有刺激性气体放出的是硝酸铵,另一种就是氯
化钠.1年前查看全部
- 问问一道化学方程式:NaOH+NH4NO3==生成什么?还有配平
 恋上发呆1年前12
恋上发呆1年前12 -
 小妖眯眯 共回答了17个问题
小妖眯眯 共回答了17个问题 |采纳率100%NaOH+NH4NO3==NaNO3+NH3↑+H2O1年前查看全部
- ?请高手帮忙算一下,化学题!:为给庄稼施氮肥,须27kg尿素[CO(NH2)2],若换成硝酸铵(NH4NO3),达到..
?请高手帮忙算一下,化学题!:为给庄稼施氮肥,须27kg尿素[CO(NH2)2],若换成硝酸铵(NH4NO3),达到...
?请高手帮忙算一下,化学题!:为给庄稼施氮肥,须27kg尿素[CO(NH2)2],若换成硝酸铵(NH4NO3),达到同样效果,用多少千克 海艺hhxx1年前2
海艺hhxx1年前2 -
 Alan_love_u2000 共回答了22个问题
Alan_love_u2000 共回答了22个问题 |采纳率90.9%27kg尿素含有的氮元素质量 = 27*28/60 = 12.6kg
所以需要硝酸铵的质量 = 12.6/(28/80) = 36kg
即需要36千克硝酸铵.1年前查看全部
- 尿素[CO(NH2)2]和硝酸铵(NH4NO3)都是优质氮肥.(1)CO(NH2)2的相对分子质量为多少?(2)NH4N
尿素[CO(NH2)2]和硝酸铵(NH4NO3)都是优质氮肥.(1)CO(NH2)2的相对分子质量为多少?(2)NH4NO3中氮元素的质量分数为多少?(3)多少千克的NH4NO3与30㎏的尿素所含氮元素的质量相等?
 cckj1年前1
cckj1年前1 -
 tryinggirl 共回答了17个问题
tryinggirl 共回答了17个问题 |采纳率100%1.60
2.28÷80=35%
3.35%X=30×28/60
x=25kg1年前查看全部
- 某菜农原计划在每亩菜地施用硝酸铵(NH4NO3)16千克,
某菜农原计划在每亩菜地施用硝酸铵(NH4NO3)16千克,
现改施尿素CO(NH2)2
若要达到同样的施肥效果,则每亩菜地应施尿素多少千克 放爱飞翔1年前1
放爱飞翔1年前1 -
 foxhcl 共回答了12个问题
foxhcl 共回答了12个问题 |采纳率75%现在算氮的质量分数 NH4NO3中为 28/80
CO(NH2)2中为 28/60
设应施尿素X千克,X*28/60=16*28/80 X=16*60/80=121年前查看全部
大家在问
- 1关于独一无二的自己 的英语作文
- 2连续区间是
- 3抱歉 我的英语不好 可以讲中文吗?
- 4有一本书共120页,王华第一天读了全书的2/5,第二天读了剩下的1/3,第三天应从第( )页读起。
- 5(对不起 我忘了你是谁) 的英文怎么写
- 6读万卷书的下一句
- 7如图,AD=AE,BE=CD,角1=角2.求证:AB=AC.
- 81.座钟的摆针摆动一个来回所需的时间称为一个周期,其计算公式为T=2π根号L/g,其中T表示周期(单位:秒),L表示摆长
- 9【紫色】的英语怎么写?【白色】的英语怎么写?【粉色】的英语怎么写?
- 10My city is famous for its tea culture while many foreigners
- 11高数极限题目 lim (x+e^x)^1/x求极限,x趋于0
- 12如图是6×6的方格纸,小方格纸的面积是1平方厘米,小方格的顶点称为格点.请你在图上选8个格点,要求其中任意3个格点都不在
- 13已知在三角形ABC中,∠A=∠2B=∠3C,则这个三角形是
- 14求一篇关于校园治安的120字英语作文,要求原创,在线等
- 15甲乙两车同时从某地出发背向而行,6小时候,两车相距1200米.已知甲车每小时比乙车多行4千米,
