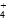PH=7的溶液一定呈中性么?那在酸性溶液中c〔H+〕越大,酸性就越强吗?
 松江无雪772022-10-04 11:39:541条回答
松江无雪772022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 dreamfly427 共回答了21个问题
dreamfly427 共回答了21个问题 |采纳率100%- 不是
因为水的电离是个放热反应
升高温度电离平衡向吸热方向进行
所以抑制了水的电离
当在25度时`
PH=7是中性
但在100度时
PH=6才是啦`
PS
PH=C(H+)的负对数
因为在酸性溶液里`
所以那在酸性溶液中c〔H+〕越大,酸性就越强 - 1年前
相关推荐
- pH=7的溶液中:Na+、A13+、Cl-、SO42-能大量共存吗?是不是要考虑铝离子的水解?
 吾芊吾挂1年前3
吾芊吾挂1年前3 -
 声亦乐 共回答了21个问题
声亦乐 共回答了21个问题 |采纳率90.5%"pH=7的溶液中"这个是题目给的背景条件.也就是在这样的条件下考虑“Na+、A13+、Cl-、SO42-”的共存问题.实现pH=7,是题目完成的,可能溶液本身有微弱的OH-或别的原因.所以只用考虑题目的4个离子的共存问题,题目的意思就是不再额外考虑水解了.
而以上的4个离子在pH=7的溶液中可以大量共存.1年前查看全部
- 下列溶液中微粒浓度关系一定正确的是( ) A.氨水与氯化铵的pH=7的混合溶液中:c(Cl - )>c(NH 4 +
下列溶液中微粒浓度关系一定正确的是( )
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl - )>c(NH 4 + ) B.新制氯水中:c(Cl - )>c(H + )>c(OH - )>c(ClO - ) C.室温下,向0.01 mol·L -1 NH 4 HSO 4 溶液中滴加等浓度等体积的NaOH溶液:c(Na + )=c(SO 4 2- )>c(NH 4 + )>c(H + )>c(OH - ) D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH - )=c(H + )  束日1年前1
束日1年前1 -
 微微自语 共回答了19个问题
微微自语 共回答了19个问题 |采纳率100%C
溶液呈中性,溶液中氢离子和氢氧根离子浓度相等,所以溶液中氯离子浓度和铵根离子浓度相等,故A错误;新制氯水溶液呈酸性,所以氢离子浓度大于氢氧根离子浓度,次氯酸电离氢离子、氯化氢电离出氢离子导致氢离子浓度大于氯离子浓度,故B错误;当酸为强酸时,溶液呈中性,氢离子浓度等于氢氧根离子浓度;当酸为弱酸时,酸的浓度大于碱的浓度,所以溶液呈酸性,氢离子浓度大于氢氧根离子浓度,故D错误。1年前查看全部
- 离子交换容量如何计算,其中PK=6.5,PH=7,交联度=8%
 linjiand1年前1
linjiand1年前1 -
 2523417 共回答了20个问题
2523417 共回答了20个问题 |采纳率95%交换容量有理论交换和实际交换,理论是树脂出厂给的,实际交换容量要按照差减法确定终始量/树脂量来确定的,实际交换容量一般小于理论交换容量1年前查看全部
- (1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体
(1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的比值关系为 。
(2)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,四种溶液中由水电离出的OH — 浓度由大到小的顺序是(填序号) 。
(3)已知100℃ K W =10 -12 ,若将此温度下pH=8的Ba(OH) 2 溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH) 2 溶液与盐酸的体积之比为 。 冰雨倩女1年前1
冰雨倩女1年前1 -
 doctorfang1984 共回答了14个问题
doctorfang1984 共回答了14个问题 |采纳率100%(1) V(酸):V(碱)=1:100 (2) ②>③=④>① (3)2:9
1年前查看全部
- (高二的内容)室温,PH=2的强酸溶液和PH=12的强碱溶液等体积混合,溶液呈中性,PH=7,求PH等于7是怎么算出来的
(高二的内容)室温,PH=2的强酸溶液和PH=12的强碱溶液等体积混合,溶液呈中性,PH=7,求PH等于7是怎么算出来的,
 nfrank1年前2
nfrank1年前2 -
 zby3486467 共回答了11个问题
zby3486467 共回答了11个问题 |采纳率90.9%其实这个说出来很简单,因为这是强酸,还是等体积.同等量的氢离子和同等量的氢氧根离子混合,正好全部生成水了,当然也就成中性了啊.
PH其实测的就是溶液中氢离子的浓度.好像是lg(c),C是氢离子浓度.1年前查看全部
- 一道关于盐类水解的题.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]
一道关于盐类水解的题.
常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
为什么c(CH3COO-)>c(CH3COOH)?
不用电离常数能不能讨论出来? jmfhf1年前1
jmfhf1年前1 -
 610515580 共回答了20个问题
610515580 共回答了20个问题 |采纳率95%这个看经验了,溶液中性,所以你可以认为加进去的醋酸没有电离,醋酸根也没有水解.但以醋酸的酸性来讲,同浓度的醋酸酸性要比醋酸钠的碱性强,所以你为了实现溶液中性,弱的那种肯定要多加,所以就c(CH3COO-)>c(CH3COOH)了.要科学地得到这个数据还真的需要用电离常数才能得出来,但是反正我就用经验了.1年前查看全部
- 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1],为什么c
常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1],为什么c(CH3COO-)>c(CH3COOH)
根据物料守恒 还有 电荷守恒 怎么去解 jamkengde011年前2
jamkengde011年前2 -
 xiaobetter2005 共回答了18个问题
xiaobetter2005 共回答了18个问题 |采纳率88.9%这个要用到缓冲溶液的pH计算公式了,目前高中阶段只能定性描述.
本来在高中阶段认为CH3COONa和CH3COOH的混合溶液中是不考虑CH3COONa的水解的,因此溶液呈酸性.但是现在呈中性就只能说明CH3COOH的浓度非常非常小.
用公式来考虑的话,缓冲溶液中:
pH=pKa+lg[CH3COO-]/lg[CH3COOH]
由於醋酸的pKa≈4.8,而pH=7因此lg[CH3COO-]/lg[CH3COOH]>1,因此lg[CH3COO-]>lg[CH3COOH],CH3COO->CH3COOH
可以算得[CH3COOH]=6.3*10-4mol/L1年前查看全部
- 将NaHS04溶液滴入Ba(OH)2溶液中至PH=7的方程式怎么写?
 shuisheng1年前4
shuisheng1年前4 -
 lei467 共回答了18个问题
lei467 共回答了18个问题 |采纳率100%因为一个NaHS04只能提供一个氢离子,而一个Ba(OH)2能提供两个氢氧根离子,所以NaHS04必为2,而Ba(OH)2为一,2NaHS04+Ba(OH)2=2H2O+Na2SO4+BaSO41年前查看全部
- 10ml0.1mol/L的NaH2PO3溶液中加入多少体积0.2mol/L Na2HPO4溶液才能使溶液pH=7(pk1
10ml0.1mol/L的NaH2PO3溶液中加入多少体积0.2mol/L Na2HPO4溶液才能使溶液pH=7(pk1=2.12 pK2=7.21 pK3=12.66)
 rkc129ahq0_6e61年前2
rkc129ahq0_6e61年前2 -
 lingjw 共回答了19个问题
lingjw 共回答了19个问题 |采纳率100%NaH2PO3溶液?
应该是10ml0.1mol/L的NaH2PO4 溶液中加入多少体积0.2mol/L Na2HPO4溶液才能使溶液pH=7
显然是缓冲溶液
因此:H2PO4-HPO42- +H+
Ka2=[H+]*[HPO42-]/[H2PO4-]
=约=[H+]*c(HPO42-)/c(H2PO4-)
==[H+]*n(HPO42-)/n(H2PO4-)
10^-7.21 =10^-7 *n(HPO42-)/ (10ml*0.1mol/L)
n(HPO42-)=0.62mmol
0.2mol/L Na2HPO4溶液的体积=0.62m mol / 0.2mol/L=3.1mL1年前查看全部
- 关于化学滴定终点的问题所有指示剂都不是ph=7变色,为何取变色为终点
 铁路ii1年前1
铁路ii1年前1 -
 化蝶飞天舞 共回答了17个问题
化蝶飞天舞 共回答了17个问题 |采纳率82.4%你要理解Ph的定义lg【H+】,PH=6或7甚至4、5,H+的浓度变化都是很小的,所以一旦变色,就认为反应终止1年前查看全部
- 醋酸和醋酸钠混合溶液ph=7 的粒子浓度比较(包括醋酸分子)
 tasking9111年前1
tasking9111年前1 -
 内河不见了 共回答了18个问题
内河不见了 共回答了18个问题 |采纳率94.4%题目没讲,默认常压,PH=7是中性溶液,c(OH-)=c(H+)=1.0×10^-7mol/L ,这个浓度很小的.
钠离子是完全电离的,浓度较大,而由于电荷守恒,所有阴离子浓度和等于阳离子浓度和,所以c(Na+)=c(CH3COOH-)>c(OH-)=c(H+).下一步就是判断醋酸分子的位置了,只有3种可能,在c(Na+)=c(CH3COOH-)>c(OH-)=c(H+)的最左边,最右边,中间>处.由于醋酸钠是弱碱性的,可以认为混合溶液是醋酸钠里滴加了几滴醋酸,所以最左边和最右边都不符合,只能插中间了.所以是c(Na+)=c(CH3COOH-)>c(CH3COOH)>c(H+)=c(OH-)1年前查看全部
- 25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶
25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为?
要使混合溶液呈中性,则氢氧根离子的物质的量等于氢离子的物质的量,设碱的体积为xL,酸的体积为yL,则10-5 mol/L×xL=10-4 mol/L×yL,所以x:y=10-4:10-5=10:1.
但硫酸是二元酸,1mol有2molH+,为什么答案不应该是20:1 asukasyo1年前2
asukasyo1年前2 -
 zhaosha5491 共回答了21个问题
zhaosha5491 共回答了21个问题 |采纳率85.7%PH根据溶液中H+浓度计算的 PH= -lgcH+
这和几元酸没关系PH=4 说cH+=10^-4molL-
中和反应 H++OH=H2O 是根据方程式计算
求硫酸的浓度是10^-4molL- /21年前查看全部
- pH=7的溶液不一定是中性溶液.为什么?
 骄傲的丫头1年前3
骄傲的丫头1年前3 -
 守望者娃娃 共回答了20个问题
守望者娃娃 共回答了20个问题 |采纳率90%如果温度升高 Kw会增加
假设Kw增加到10^-12
那么只有当H+和OH-浓度为10^-6时,溶液呈中性
此时pH=6,也就是说现在的温度pH=6是中性,pH=7就显碱性了1年前查看全部
- 常温下向20ml的0.1mol/l的盐酸中逐滴加入0.1mol/l的氢氧化钠溶液20ml时ph=7
常温下向20ml的0.1mol/l的盐酸中逐滴加入0.1mol/l的氢氧化钠溶液20ml时ph=7
问:ph=2时氢氧化钠滴加了多少ml
ph=12时氢氧化钠滴加了多少ml 雁子的天空1年前1
雁子的天空1年前1 -
 1995xx 共回答了15个问题
1995xx 共回答了15个问题 |采纳率80%设未知体积V1、V2,
则有方程:
pH=2即H+浓度为0.01:20÷1000 ×0.1-V1÷1000×0.1=0.01(20+V1) ÷1000 得V1=180/11 ml
pH=12即OH-浓度为0.01:V2÷1000×0.1-20÷1000×0.1=0.01(V2+20)÷1000 得V2=220/9 ml
欢迎追问1年前查看全部
- 醋酸,盐酸都ph=2.若将他俩混合,ph=7,则谁消耗的体积多?
 xxzksf1年前1
xxzksf1年前1 -
 weqwdaw 共回答了23个问题
weqwdaw 共回答了23个问题 |采纳率100%他们混合ph不可能是71年前查看全部
- 下列各组数据中,其比值为2∶1的是( ) A.氨水与(NH 4 ) 2 SO 4 溶液混合后pH=7的溶液中,[NH
下列各组数据中,其比值为2∶1的是( )
A.氨水与(NH 4 ) 2 SO 4 溶液混合后pH=7的溶液中,[NH 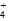 ]∶[SO
]∶[SO ]
]B.相同温度下,0.2 mol·L - 1 乙酸溶液与0.1 mol·L - 1 乙酸溶液中,[H + ]之比 C.Na 2 CO 3 溶液中,[Na + ]∶[CO 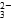 ]
]D.pH=12的Ba(OH) 2 溶液与pH=12的KOH溶液中,c[Ba(OH) 2 ]∶c(KOH)  樱木苹果1年前1
樱木苹果1年前1 -
 douhewei 共回答了14个问题
douhewei 共回答了14个问题 |采纳率85.7%1年前查看全部
- pH=x的强碱和pH=y的弱酸混合,x+y=14,混合后pH=7,它们的体积关系~
pH=x的强碱和pH=y的弱酸混合,x+y=14,混合后pH=7,它们的体积关系~
我想的是:弱酸不是不完全电离的嘛,既然要和强碱电离出来的氢氧根完全中和,应该需要更多的弱酸电离出氢离子才行啊…思路哪里不对呢? debly1年前1
debly1年前1 -
 sueke731 共回答了25个问题
sueke731 共回答了25个问题 |采纳率84%应该是x>y吧.你等等,我组织下语言.假如酸是6,碱是8,那么如果体积一样,因为酸还有很多没电离出来,它实际拥有的H离子比碱要多很多.所以要完全中和,酸应该要少点吧.还有点忘了说了,你思路错在不是强碱消耗了弱酸电离出来的氢离子后弱酸没电离的就不电离了,弱酸会继续电离,补充消耗了的氢离子.一直到强碱把弱酸的氢离子消耗得差不多的时候.这个差不多的时候要涉及到水解平衡了,就是很少很少,几乎没有.1年前查看全部
- 为什么强酸弱碱混合后PH<7等物质的量,等体积,不是应该完全反应,PH=7吗?为什么<7呢?
 重庆oo1年前4
重庆oo1年前4 -
 虫大小 共回答了9个问题
虫大小 共回答了9个问题 |采纳率100%因为弱碱阳离子的水解,结合水电离出来的氢氧根离子,事氢离子剩余下来,显酸性1年前查看全部
- 常温下,将NaOH溶液和甲酸溶液混和,所得溶液的pH=7,此溶液中离子浓度大小顺序正确的是
常温下,将NaOH溶液和甲酸溶液混和,所得溶液的pH=7,此溶液中离子浓度大小顺序正确的是
A、c(Na+)>c(HCOO-)
B、c(HCOO-)>c(Na+)
C、c(Na+)=c(HCOO-)
D、无法确定
可是答案是c额 iyswb7_cfr__37651年前1
iyswb7_cfr__37651年前1 -
 ciqpig 共回答了19个问题
ciqpig 共回答了19个问题 |采纳率94.7%离子守恒,c(Na+)+c(H+)=c(OH-)+c(HCOO-),PH=7,c(H+)=c(OH-).所以,选C1年前查看全部
- 下列关于溶液的酸碱性,说法正确的是( ) A.pH=7的溶液是中性 B.中性溶液中一定:c(H + )=1.0×10
下列关于溶液的酸碱性,说法正确的是( )
A.pH=7的溶液是中性 B.中性溶液中一定:c(H + )=1.0×10 -7 mol·L -1 C.c(H + )=c(OH - )的溶液呈中性 D.在100°C时,纯水的pH<7,因此显酸性  Travei1年前1
Travei1年前1 -
 冷血老K 共回答了10个问题
冷血老K 共回答了10个问题 |采纳率100%C
A项中运用pH判断溶液的酸碱性时,用到了水的离子积常数,与温度有关,但A项未给出温度,所以错误;在中性溶液中c(H + )和c(OH - )一定相等,但并不一定等于1.0×10 -7 mol·L -1 ,所以B项错误,C项正确;100°C的纯水中,虽然pH<7,但c(H + )=c(OH - ),还是中性,所以D项错误。1年前查看全部
- 常温下,关于下列各溶液的叙述正确的是 A.pH=7的醋酸钠和醋酸的混合溶液中:c(CH 3 COO - )>c(Na +
常温下,关于下列各溶液的叙述正确的是
A.pH=7的醋酸钠和醋酸的混合溶液中:c(CH 3 COO - )>c(Na + ) B.0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH 3 COOH)-c(CH 3 COO - )=2[c(OH - )-c(H + )] D.已知酸性HF>CH 3 COOH,pH相等的NaF溶液与CH 3 COOK溶液中:[c(Na + )-c(F - )] >[c(K + )-c(CH 3 COO - )]  skyxmj1年前1
skyxmj1年前1 -
 蟹粉伯爵 共回答了17个问题
蟹粉伯爵 共回答了17个问题 |采纳率94.1%C
1年前查看全部
- PH=10,加HCl,调节到PH=7,应该加入HCl是多少,如何计算的?前边那个我会了
 砂砂05041年前1
砂砂05041年前1 -
 weir960 共回答了17个问题
weir960 共回答了17个问题 |采纳率100%先计算PH=10的溶液中碱的量:PH=10=14-(-lg[OH-])
得[OH-]=0.0001mol
那么加入等量的[H+]即可中和1年前查看全部
- 稀氨水与稀盐酸反应至PH=7,会是怎样的过程?
稀氨水与稀盐酸反应至PH=7,会是怎样的过程?
还有什么类似的题目吗? 阿当0011年前1
阿当0011年前1 -
 wennie24 共回答了18个问题
wennie24 共回答了18个问题 |采纳率94.4%酸碱中和,皿中液体是氯化铵溶液(NH4Cl) 另:1.用两只玻璃棒分别蘸取浓氨水和浓盐酸,在空中靠近时会有白烟生成.2.纯碱溶液(Na2CO3)和稀盐酸(HCl)混合会有气泡生成.化学是一门神奇的学科.1年前查看全部
- 铝离子水解后与硫酸根反应吗?pH=7的溶液中:Na+、A13+、Cl-、SO42-又能否大量共存呢?为什么?
 hh海881年前2
hh海881年前2 -
 李zz啊 共回答了21个问题
李zz啊 共回答了21个问题 |采纳率100%铝离子水解后不与硫酸根反应
pH=7的溶液中:Na+、A13+、Cl-、SO42-不能大量共存,因为铝离子的溶液必须是酸性的,否则铝离子就会水解1年前查看全部
- 稀氨水与稀盐酸反应至PH=7,会是怎样的过程?
稀氨水与稀盐酸反应至PH=7,会是怎样的过程?
还有什么类似的题目吗? ws024001271年前1
ws024001271年前1 -
 rp7410 共回答了17个问题
rp7410 共回答了17个问题 |采纳率82.4%酸碱中和,皿中液体是氯化铵溶液(NH4Cl) 另:1.用两只玻璃棒分别蘸取浓氨水和浓盐酸,在空中靠近时会有白烟生成.2.纯碱溶液(Na2CO3)和稀盐酸(HCl)混合会有气泡生成.化学是一门神奇的学科.1年前查看全部
- 常温下,某强酸溶液ph=a,某强碱溶液ph=b,a+b=12,酸碱溶液混合后ph=7,则酸溶液体积V1和碱溶液体积V2的
常温下,某强酸溶液ph=a,某强碱溶液ph=b,a+b=12,酸碱溶液混合后ph=7,则酸溶液体积V1和碱溶液体积V2的正确关系是?
 五味果1年前1
五味果1年前1 -
 剑是依天剑 共回答了11个问题
剑是依天剑 共回答了11个问题 |采纳率90.9%混合后ph=7>6 溶液为碱性 因为是强酸强碱 所以碱多 V2>V11年前查看全部
- ph=7的醋酸和醋酸钠溶液混合液中离子浓度关系是钠离子等于醋酸根大于氢离子等于氢氧根,醋酸浓度排在哪
 booksky0011年前3
booksky0011年前3 -
 尚家gg03 共回答了29个问题
尚家gg03 共回答了29个问题 |采纳率93.1%该混合溶液中,其离子浓度的排序应该是:
[Ac-] > [Na+] > c(HAc) > [H+] = [OH-]1年前查看全部
大家在问
- 1小明每隔2天去一次动物园,小花每隔3天去一次动物园,4月一日他俩都去了动物园,请问下一次几号一起去?4月份能一起去几次?
- 2某小型水电站的电能输送示意图如图所示,发电机通过升压变压器T 1 和降压变压器T 2 向用户供电。已知输电线的总电阻为R
- 3为什么等物质的量的CxHy完全燃烧 (x+Y/4)越大,耗氧量越大
- 4Read and match. 为中文搭配出适当的英文。
- 5X^2+4X-XY-2Y+4因式分解
- 6小明从甲地出发到乙地,相距为S千米,他先用速度V走了一半路程,后一半路程他用4/5V的速度前进,问他的平均速度为( )
- 7英语翻译为人倜傥高奇,俯视一切,好饮酒,善衡文评书,议论皆发前人所未发.”“凡一切经史子集,笺疏训古,与夫释道内外诸典,
- 8已知点C与点D在直线AB上,AD=5/9DB,且CD=4cm,求AB的长(字母排列为:A,D,C,B)
- 91. 12比( )少25% 2. ( )比75多20%
- 10九年级下的数学书(新版)上P26-2和P27-9的题
- 11我要答案,和算式
- 121+2+1= 4 1+2+3+2+1 =9 根据你所发现的规律写出第1000个算式以及算出的结果.用N表示你发现的规律
- 13测两人关系的 对方的牌面是权杖8逆位和宝剑6逆位,然后代表我自己的牌面是星币五逆位,最后两个人的关系状况是审判的正位,这
- 14(2011•淮北模拟)2008年度诺贝尔化学奖获得者美籍华裔钱永健发明的荧光染剂技术,可以观察细胞内钙离子信号.根据如右
- 15物质分离提纯一般原则是什么