氯酸是一种强酸和氢键有关吗
 yanningnight2022-10-04 11:39:541条回答
yanningnight2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 好帖顶74 共回答了22个问题
好帖顶74 共回答了22个问题 |采纳率90.9%- 氯酸酸性强的主要原因在于形成2个Cl→O配位键[其结构可表示为O←Cl(OH)→O],造成Cl带较多正电荷,使得羟基上的H容易以H+的形式离去,而非氢键的原因.
- 1年前
相关推荐
- .貌似是用摩尔解..谁帮偶下实验室加热氯酸甲和而氧化锰的混合物制取氧气.如收集到标准状况下的3.36L氧气,至少需要加热
.貌似是用摩尔解..谁帮偶下
实验室加热氯酸甲和而氧化锰的混合物制取氧气.如收集到标准状况下的3.36L氧气,至少需要加热多少克氯酸甲?同时生成氯酸甲的物质的量是多少? 高天渌水1年前2
高天渌水1年前2 -
 haitao1991 共回答了17个问题
haitao1991 共回答了17个问题 |采纳率94.1%当然用物质的量一章的知识来解.
氧气的物质的量为3.36/22.4=0.15mol
物质的量之比等于方程式中的系数之比
2KClO3=2KCl+3O2
所以需要氯酸钾0.1mol,生成氯化钾0.1mol
所需氯酸钾的质量为0.1*122.5=12.25g1年前查看全部
- 现有①液氧、②过氧化氢溶液、③铁、④二氧化碳、⑤氧化镁、⑥蒸馏水、⑦加热高锰酸钾完全反应后的剩余固体、⑧液态空气、⑨氯酸
现有①液氧、②过氧化氢溶液、③铁、④二氧化碳、⑤氧化镁、⑥蒸馏水、⑦加热高锰酸钾完全反应后的剩余固体、⑧液态空气、⑨氯酸钾九种物质,其中属于混合物的是
(填序号下同);属于氧化物的是 ;属于含氧元素的化合物,但不属于氧化物的是 ;含有氧分子的是 . 小拍子1年前1
小拍子1年前1 -
 武清 共回答了18个问题
武清 共回答了18个问题 |采纳率100%②⑦⑧ ; ④⑤⑥ ; ⑨ ; ①⑧
:②30%过氧化氢溶液、⑦加热高锰酸钾完全反应后的剩余固体、⑧液态空气等组成的混合物;
④二氧化碳、⑤氧化镁、⑥水都是由两种元素组成的化合物,而且其中一种元素是氧元素,属于氧化物;
属于含氧元素的化合物,但不属于氧化物的是⑨碳酸氢铵;
含有氧分子的是①液氧、⑧液态空气.
故答案为;②⑦⑧,④⑤⑥,⑨,①⑧.1年前查看全部
- 氯气和氢氧化钠反应~生成氯酸跟和次氯酸根的比例是1;1混合液~这条方程式是什么~
 山口百惠爱春1年前6
山口百惠爱春1年前6 -
 xinllqq 共回答了12个问题
xinllqq 共回答了12个问题 |采纳率83.3%Cl2+2NaOH==NaCl+NaClO+H2O
改写成离子方程式你的问题就很明显了
Cl2+2OH-==Cl- +ClO- +H2O
生成氯酸跟和次氯酸根的比例是1:1
记得采纳哦!1年前查看全部
- 氯酸的化学方程式是什么?
 小狐狸qq1年前6
小狐狸qq1年前6 -
 baijinart 共回答了23个问题
baijinart 共回答了23个问题 |采纳率91.3%HClO31年前查看全部
- 二氧化硫与氯酸反应的化学方程式该反应可生成一种强酸和一种氧化物
 ChrisBosh1年前5
ChrisBosh1年前5 -
 四个月亮 共回答了14个问题
四个月亮 共回答了14个问题 |采纳率85.7%二氧化硫与氯酸反应的化学方程式:
HClO3+ SO2+H2O===== H2SO4 +HCl + O2
❤您的问题已经被解答~(>^ω^1年前查看全部
- 下列图像能正确反映其对应操作中各量变化关系的是 [ ] A.图①是给氯酸
下列图像能正确反映其对应操作中各量变化关系的是  [ ]
[ ]A.图①是给氯酸钾和二氧化锰的混合物加热
B.图②是向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体
C.图③是向pH=1的酸溶液中不断加水
D.图④是向一定质量的稀硫酸中加入锌粒 gougou221年前1
gougou221年前1 -
 xx和工人 共回答了16个问题
xx和工人 共回答了16个问题 |采纳率87.5%C1年前查看全部
- 5克含铁,镁,锌三种金属的混合物跟稀氯酸反应生成2.8升氯气则这三种金属的物质的量之和为
 红修天象1年前1
红修天象1年前1 -
 liuxiaomengmeng 共回答了25个问题
liuxiaomengmeng 共回答了25个问题 |采纳率96%铁,镁,锌和酸反应后都生成+2价的离子.
所以都可以写成 M+2HCl==MCl2+H2↑ 的形式
1mol金属生成1mol H2
现在生成2.8/22.4 = 1/8 mol H2
所以这三种金属的物质的量之和为 1/8 mol 即 0.125 mol1年前查看全部
- 将15.68L(标况)的氯气通入70℃、500mL氢氧化钠溶液中,发生了两个自身氧化还原反应,其氧化产物为次氯酸钠和氯酸
将15.68L(标况)的氯气通入70℃、500mL氢氧化钠溶液中,发生了两个自身氧化还原反应,其氧化产物为次氯酸钠和氯酸钠.若吸取此溶液25mL稀释到250mL.再吸取此稀释液25mL用醋酸酸化后,加入过量碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾.用浓度为0.20mol•L-1的硫代硫酸钠滴定析出的碘:I2+2S2O32-═2I-+S4O62-.消耗硫代硫酸钠溶液5.0mL恰好到终点.将滴定后的溶液用盐酸调至强酸性,此时氯酸钠亦能氧化碘化钾,析出的碘用上述硫代硫酸钠溶液再滴定到终点,还需要硫代硫酸钠溶液30.0mL
①反应后溶液中次氯酸钠和氯酸钠的物质的量之比为:______
②写出氯气和氢氧化钠在上述条件的总反应方程式______
③氢氧化钠溶液的体积在通入氯气前后的变化可忽略不计,计算通入氯气反应后c(NaClO)=______,c(NaClO3)=______,c(NaCl)=______. children19981年前1
children19981年前1 -
 十里雾中 共回答了23个问题
十里雾中 共回答了23个问题 |采纳率87%解题思路:①根据关系式ClO-~2I-~I2~2S2O32-、ClO3-~6I-~3I2 ~6S2O32-计算出次氯酸钠和氯酸钠的物质的量,据此解答;
②氯气与氢氧化钠溶液反应生成NaCl、NaClO、NaClO3与水,结合NaClO、NaClO3的物质的量关系,配平书写方程式;
③计算氯气的物质的量,根据方程式计算反应后n(NaClO)、n(NaClO3)、n(NaCl),进而计算各自的浓度.①用醋酸酸化,只有次氯酸钠氧化碘化钾,消耗Na2S2O3溶液10.00mL,根据关系式:ClO-~2I-~I2~2S2O32-,则n(NaClO)=n(I2)=[1/2]×n(S2O32-)=[1/2]×0.20mol/L×0.005L=0.0005mol;
用盐酸酸化至强酸性,氯酸钾氧化碘化钠,消耗Na2S2O3溶液30.00mL;根据关系式:ClO3-~6I-~3I2 ~6S2O32-,则n(NaClO3)=[1/6]n(S2O32-)=[1/6]×0.20mol/L×0.03L=0.001mol;
故n(NaClO):n(NaClO3)=0.0005mol:0.001=1:2;
故答案为:1:2;
②氯气与氢氧化钠溶液反应生成NaCl、NaClO、NaClO3与水,n(NaClO):n(NaClO3)=1:2,则反应总方程式为:7Cl2+14NaOH=2NaClO3+NaClO+11NaCl+7H2O,
故答案为:7Cl2+14NaOH=2NaClO3+NaClO+11NaCl+7H2O;
③15.68L(标准状况)Cl2 的物质的量是:15.68 L÷22.4 L•mol-1=0.7mol,
7 Cl2+14 NaOH=2 NaClO3+NaClO+11 NaCl+7H2O
7 2 1 11
0.7mol n(NaClO3) n(NaClO) n(NaCl)
n(NaClO3)=[0.7mol×2/7]=0.2mol
n(NaClO)=[0.7mol×1/7]=0.1mol
n(NaCl)=[0.7mol×11/7]=1.1mol
则:c(NaClO)=[0.1mol/0.5L]=0.2mol/L
c(NaClO3)=[0.2mol/0.5L]=0.4mol/L
c(NaCl)=[1.1mol/0.5L]=2.2mol/L
故答案为:0.2mol/L;0.4mol/L;2.2mol/L.点评:
本题考点: 化学方程式的有关计算;氯气的化学性质.
考点点评: 本题考查氧化还原反应滴定计算,难度中等,注意利用关系式进行计算.1年前查看全部
- 分解过氧化氢和加热氯酸甲是化学变化吗
分解过氧化氢和加热氯酸甲是化学变化吗
生成了什么物质 漂石-岁月1年前2
漂石-岁月1年前2 -
 szxjl 共回答了16个问题
szxjl 共回答了16个问题 |采纳率93.8%分解过氧化氢和加热氯酸钾是化学变化,因为有新物质生成.
过氧化氢 —二氧化锰→ 水+氧气
氯酸钾 —加热→ 氯化钾+氧气1年前查看全部
- 有关于氯酸的问题硫酸是一种强酸,浓度超过40%时就会迅速分解,放出气体,经干燥后,测得气体混合物的平均分子质量为47.6
有关于氯酸的问题
硫酸是一种强酸,浓度超过40%时就会迅速分解,放出气体,经干燥后,测得气体混合物的平均分子质量为47.6.
(1)写出氯酸分解反应的化学方程式
已知产物为高氯酸,氯气,氧气,水
(2)高氯酸前面的化学计量数为 若有8摩尔的氯酸分解,转移的电子数为 mol 亚雷克斯1年前1
亚雷克斯1年前1 -
 天使碎了翅膀 共回答了12个问题
天使碎了翅膀 共回答了12个问题 |采纳率100%(1)显然Cl2和O2比例为2:3(由气体平均分子量)
配平麻烦,可以用无脑解方程的办法:
设反应方程式为HClO3===xHClO4+2yCl2+3yO2+zH2O
显然,由原子守恒,x+2z=1,x+4y=1,4x+6y+z=3,解得x=0.5,y=0.125,z=0.25
化为最简整数比,则方程式为:
8HClO3===4HClO4+2Cl2+3O2+2H2O
(2)根据方程式,略1年前查看全部
- 用H,N,O,CL写下列物质酸--------------盐--------------并写出名称氯酸,亚氯酸,次氯酸,
用H,N,O,CL写下列物质
酸--------------
盐--------------
并写出名称
氯酸,亚氯酸,次氯酸,高氯酸各是什么化学式 浪子吉他手1年前4
浪子吉他手1年前4 -
 wailianji 共回答了20个问题
wailianji 共回答了20个问题 |采纳率95%酸 HNO3硝酸,HNO2亚硝酸,HNO4过硝酸,HCl盐酸 HClO次氯酸 HClO3 氯酸 HClO4 高氯酸
盐NH4Cl氯化铵,NH4NO3硝酸铵,NH3NO2亚硝酸铵1年前查看全部
- 通过学习,我们掌握了一些气体的制备方法,例如制取氧气的方法有:①分离空气;②加热高锰酸钾;③分解过氧化氢;④加热分解氯酸
通过学习,我们掌握了一些气体的制备方法,例如制取氧气的方法有:①分离空气;②加热高锰酸钾;③分解过氧化氢;④加热分解氯酸钾;⑤电解水等.也熟悉一些气体的制取和收集装置,如图所示:
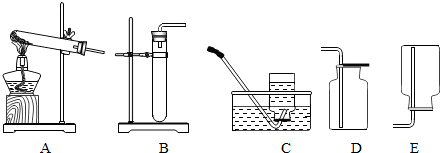
(1)以上制取氧气的方法中,属于物理方法的有______(填序号,下同),要用到催化剂的反应有______.
(2)实验室用高锰酸钾制氧气,写出该反应的文字表达式高锰酸钾
锰酸钾+二氧化锰+氧气加热 高锰酸钾.用此方法制取氧气,应选择的发生装置为______(填装置编号),收集氧气可以选用装置______,理由是______.
锰酸钾+二氧化锰+氧气加热
(3)实验室也可以用过氧化氢制取氧气,写出该反应的文字表达式过氧化氢
水+氧气二氧化锰 过氧化氢.
水+氧气二氧化锰
(4)利用如图所示气体制取和收集装置,还可以制取氨气.氨气是一种密度比空气小,极易溶于水的气体,可用加热氯化铵和熟石灰两种固体混合物方法制得,则制取氨气装置组合应为______(填装置编号). yzprf121年前1
yzprf121年前1 -
 青清轻蜻 共回答了19个问题
青清轻蜻 共回答了19个问题 |采纳率100%解题思路:(1)根据制取方法是否生成新物质判断是否是物理方法,分解过氧化氢、加热分解氯酸钾要用到二氧化锰作催化剂;
(2)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,该反应需要加热,属于固体加热型,故选发生装置A,并据氧气的密度和溶解性选择收集装置;
(3)过氧化氢在二氧化锰的催化作用下生成水和氧气,据此书写表达式;
(4)据反应物状态和反应条件选择发生装置,据气体的密度和溶解性选择收集装置.(1)制取氧气的方法中:①分离空气制取氧气,空气中本来就有氧气,所以该方法没有生成新物质,属于物理方法;②加热高锰酸钾;③分解过氧化氢;④加热分解氯酸钾;⑤电解水,均生成了新物质,属于化学方法;其中分解过氧化氢、加热分解氯酸钾要用到二氧化锰作催化剂,加快反应速率;
(2)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应的文字表达式是:高锰酸钾
加热
锰酸钾+二氧化锰+氧气;该反应需要加热,属于固体加热型,故选发生装置A,氧气的密度比空气大,可用向上排空气法收集,氧气不易溶于水,可用排水法收集;
(3)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的文字表达式是:过氧化氢
二氧化锰
水+氧气;
(4)用加热氯化铵和熟石灰两种固体混合物方法制得氨气,属于固体加热型,故选发生装置A,氨气密度比空气小,极易溶于水,所以只能用向下排空气法收集;
故答案为:(1)①;③④;
(2)高锰酸钾
加热
锰酸钾+二氧化锰+氧气;A;C(或D);氧气不易溶于水(或氧气密度比空气大);
(3)过氧化氢
二氧化锰
水+氧气;
(4)AE.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;书写化学方程式、文字表达式、电离方程式.
考点点评: 据反应物状态和反应条件选择发生装置,据气体的密度和溶解性选择收集装置,生成新物质的变化是化学变化,制取氧气的方法中分解过氧化氢、氯酸钾均须催化剂.1年前查看全部
- 次氯酸和氯酸的酸酐为什么是ClO2,
 橙红月1年前4
橙红月1年前4 -
 地狱影子 共回答了17个问题
地狱影子 共回答了17个问题 |采纳率94.1%酸酐要求和酸中该元素化合价相同,所以:
次氯酸的酸酐是:Cl2O
氯酸的酸酐是:Cl2O5
不会是ClO2啊?
要么是这样:4ClO2+2H2O= 3HClO3+ HClO
ClO2是HClO3,HClO混合酸的酸酐1年前查看全部
- (2013•长宁区一模)氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
(2013•长宁区一模)氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3→3O2+2Cl2+4HClO4+2H2O.
(1)在上述变化过程中,发生还原反应的过程是:______(填化学式).该反应的氧化产物是______(填化学式);所得混合气体的平均式量为______.
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子.反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-离子,该离子反应方程式为______.若将该反应设计成原电池,则在正极生成的离子是______(填离子名称)
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是______(填序号).
a.KMnO4>Cl2b.Cl2>O2c.HIO4>HClO3d.HIO4>Cl2. 春暖花开的宝贝1年前1
春暖花开的宝贝1年前1 -
 cc2067 共回答了20个问题
cc2067 共回答了20个问题 |采纳率95%解题思路:(1)得电子的反应物是氧化剂,氧化剂在反应中发生还原反应,失电子的反应物是还原剂,还原剂对应的产物是氧化产物,在数值上,平均式量=平均摩尔质量=
;m n(总)
(2)锰离子失电子而转化为高锰酸根离子,所以锰离子作还原剂,则得电子化合价降低的物质作氧化剂,根据元素的化合价确定氧化剂和还原产物,再结合离子方程式的书写规则书写,在原电池中,正极上得电子发生还原反应;
(3)在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.(1)8HClO3→3O2↑+2Cl2↑+4HClO4+2H2O中,氧化剂和还原剂都是HClO3,HClO3中Cl元素得电子化合价降低生成Cl2而发生还原反应,所以发生还原反应的过程是HClO3→Cl2;
O氧元素的化合价由-2价→0价,Cl元素的化合价由+5价→+7价,所以氧化产物是O2、HClO4;
平均式量=平均摩尔质量=[m
n(总)=
3×32+2×71/5]=47.6,
故答案为:HClO3→Cl2,O2、HClO4,47.6;
(2)锰离子失电子被氧化生成高锰酸根离子,所以锰离子作还原剂,氧化剂得电子化合价降低,IO3-和IO4-中碘元素的化合价分别是+5价和+7价,所以IO4-作氧化剂,还原产物是IO3-,同时水参加反应生成氢离子,所以该反应的离子方程式为:2Mn2++5IO4-+3H2O→2MnO4-+5IO3-+6H+,若将该反应设计成原电池,正极上得电子化合价降低而发生还原反应,则在正极生成的离子是碘酸根离子,
故答案为:2Mn2++5IO4-+3H2O→2MnO4-+5IO3-+6H+,碘酸根离子;
(3)a、高锰酸钾和浓盐酸反应生成氯气,所以高锰酸钾的氧化性大于氯气,故正确;
b、有能量提供情况下氯氧化性较强,一般情况下氧气略强,故错误;
c、氧化性HIO4<HClO4,氧化性HClO4<HClO3,所以氧化性HIO4<HClO3,故错误;
d、KMnO4>Cl2,HIO4>KMnO4,所以氧化性HIO4>Cl2,故正确;
故选a、d.点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较;原电池和电解池的工作原理.
考点点评: 本题考查了氧化性强弱的比较,明确氧化性、还原性强弱的判断发生即可解答,难度中等.1年前查看全部
- 氯气与碱溶液反应为什么氯气与热的碱溶液反应生成的是氯酸化物而与冷的碱溶液反应生成的是生成的氯化物?
 夜郎西1年前1
夜郎西1年前1 -
 开美瑞的佳美 共回答了23个问题
开美瑞的佳美 共回答了23个问题 |采纳率87%冷溶液中歧化成氯离子和次氯酸根 为主
热溶液歧化成氯离子和氯酸跟 为主1年前查看全部
- 次氯酸,亚氯酸,氯酸,高氯酸,它们的氧化性强度排序?(用化学式表达)
 雨之暗瞳1年前1
雨之暗瞳1年前1 -
 txlab 共回答了16个问题
txlab 共回答了16个问题 |采纳率100%次氯酸HClO
亚氯酸HClO2
氯酸HClO3
高氯酸 HClO4
理论上讲氧化性是HClO41年前查看全部
- 请完成下列化学方程式(1)______FeS2+______O2-______Fe2O3+______SO2↑(2)氯酸
请完成下列化学方程式
(1)______FeS2+______O2-______Fe2O3+______SO2↑
(2)氯酸钾(KClO3),在二氧化锰(MnO2)作催化剂并加热的条件下分解生成氯化钾和氧气2KClO3
2KCl+3O2MnO2 .△ 2KClO3
2KCl+3O2MnO2 .△
(3)铜锈的主要成分是Cu2(OH)2CO3,其在加热时分解生成氧化铜,二氧化碳和水Cu2(OH)2CO3
2CuO+CO2↑+H2O△ .Cu2(OH)2CO3
2CuO+CO2↑+H2O△ .
(4)3Cu+8HNO3=3Cu(NO3)2+2NO↑+____________. tomjordan1年前1
tomjordan1年前1 -
 冬天wgj 共回答了15个问题
冬天wgj 共回答了15个问题 |采纳率66.7%解题思路:本题考查化学方程式的配平,利用原子在化学反应前后数目不变来配平;书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据客观事实、遵守质量守恒定律.(1)根据原子在反应前后数目不变来配平化学方程式:
4FeS2+11O2=2Fe2O3+8SO2↑;
(2)氯酸钾(KClO3),在二氧化锰(MnO2)作催化剂并加热的条件下分解生成氯化钾和氧气:
2KClO3
MnO2
.
△2KCl+3O2;
(3)Cu2(OH)2CO3在加热时分解生成氧化铜,二氧化碳和水:
Cu2(OH)2CO3
△
.
2CuO+CO2↑+H2O;
(4)根据H、O原子在反应前后数目不变来完成化学方程式:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
故答案是:(1)4、11、2、8;
(2)2KClO3
MnO2
.
△2KCl+3O2;
(3)Cu2(OH)2CO3
△
.
2CuO+CO2↑+H2O;
(4)4、H2O.点评:
本题考点: 化学方程式的配平;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查化学方程式的书写和基本反应类型的判断,难度稍大.1年前查看全部
- 氯酸的受热催化分解化学反应方程式
 awqma1年前3
awqma1年前3 -
 少奶奶小uu 共回答了11个问题
少奶奶小uu 共回答了11个问题 |采纳率63.6%2HClO3=△=2HCl+3O2↑1年前查看全部
- 氯酸氢根能与氧气反应吗?自己按想法写的一离子方程式 ClO-+O2=△=ClO3-
 我给外婆绕毛线1年前1
我给外婆绕毛线1年前1 -
 ddo51058 共回答了16个问题
ddo51058 共回答了16个问题 |采纳率100%请注意,有氯酸氢根这离子吗?你写的是次氯酸根.应该不反应,次氯酸根本身是强氧化剂,一般不谈它的还原性.1年前查看全部
- 关于氯酸分解方程式配平的问题氯酸(HClO3)分解为氧气、氯气、高氯酸、水 分别有如下配平方式3→2 1 1 18→3
关于氯酸分解方程式配平的问题
氯酸(HClO3)分解为氧气、氯气、高氯酸、水 分别有如下配平方式
3→2 1 1 1
8→3 2 4 2
11→5 3 5 3
请问哪个对呢?三个都符合质量守恒和化合价规律
求详解 qq英语631年前6
qq英语631年前6 -
 rootsky 共回答了17个问题
rootsky 共回答了17个问题 |采纳率88.2%这是我竞赛培训时,化学老师给我们说的:
复杂的氧化还原反应方程式出现多组系数的原因在于方程式中有两个或多个相互独立的氧化还原反应方程式,这些氧化还原反应方程式之间没有必然的联系,将它们乘以不同的因子并加和在一起,即出现多组系数的情况.
上述反应都符合得失电子守恒、原子守恒、元素守恒,但最好满足电子转移总数最小原则,这下你应该知道那个方程式最佳了吧.
(第一个方程式)1年前查看全部
- 将31g氯酸钾和二氧化锰的混合物进行加热反应完全后得到21.4g固体求原混合物中氯酸
将31g氯酸钾和二氧化锰的混合物进行加热反应完全后得到21.4g固体求原混合物中氯酸
的质量分数,所得固体含哪些成分,各位几g
 liwulai1年前1
liwulai1年前1 -
 慎思笃行 共回答了16个问题
慎思笃行 共回答了16个问题 |采纳率93.8%生成的氧气的质量,31g-21.4g=9.6g2KClO3 =MnO2 △= 2KCl + 3O2 ↑245 149 96x y 9.6g245/x=149/y=96/9.6gx=24.5gy=14.9g原混合物中氯酸钾的质量分数 24.5g/31g*100%=79.03%剩余固体中含氯化钾 14.9g 二氧化锰 21.4g-...1年前查看全部
- (10南昌市7).分类是学习和研究物质的一种常见的方法,下列物质的分类正确的是 A.氮气中只含氮元素,属于单质 B.氯酸
(10南昌市7).分类是学习和研究物质的一种常见的方法,下列物质的分类正确的是
A.氮气中只含氮元素,属于单质 B.氯酸钾中含有氧元素,属于氧化物 C.硫酸钠中含有硫酸根离子,属于酸 D.碳酸中含有碳元素,属于有机物  pjh9991年前1
pjh9991年前1 -
 chatme6210 共回答了21个问题
chatme6210 共回答了21个问题 |采纳率90.5%A
A、氮气中只含氮元素,属于单质,物质的分类正确,故A正确;
B、掌握氧化物的概念:只由两种元素组成,一种元素是氧元素,而氯酸钾有三种元素组成,故B错误;
C、硫酸钠中含有硫酸根离子和金属离子,属于盐,所以物质的分类错误,故C错误;
D、碳酸中含有碳元素,但无有机物的特征,却具有无机物的特征,所以为无机物,故D错误.
故选A.1年前查看全部
- 为什么亚氯酸稳定性比次氯酸 氯酸 高氯酸都差?
 abc20xyz1年前1
abc20xyz1年前1 -
 bjrmdht 共回答了23个问题
bjrmdht 共回答了23个问题 |采纳率82.6%亚氯酸是目前所知唯一的亚卤酸,它也是氯的含氧酸中最不稳定的.容易分解,在几分钟之内便可生成Cl2、ClO2和H2O
估计是它有生成二氧化氯的倾向,而CIO2的水溶液常温下比较稳定,纯CIO2也不太稳定,毕竟正价的氯具有强氧化性,与氧的共价键较弱
还好氯的含氧酸里有亚酸存在,其他的卤素里就没有这个物质了,应该是这些卤素+3价态的含氧化合物(不包括盐)均难以长期存在吧1年前查看全部
- 请问氯酸和硫酸的酸性哪个强?是氯酸哦,不是高氯酸!
 ee企老总总1年前10
ee企老总总1年前10 -
 涛6113 共回答了19个问题
涛6113 共回答了19个问题 |采纳率68.4%HClO4>HI>HBr≈H2SO4>HCl>HClO3>HNO3(以上为强酸)>H2C2O4(草酸)>H2SO3>H3PO4>CH3COCOOH(丙酮酸)>HNO2(以上为中强酸)>HF>HCOOH>C3H6O3(乳酸)>C6H5COOH(苯甲酸)>CH2=CH-COOH(丙烯酸)>CH3COOH>C2H5COOH(丙酸)>C17H33COOH(油酸)>C17H35COOH(硬脂酸)>H2CO3>H2S>HClO>H3BO3>H2SiO3>C6H5OH(苯酚)1年前查看全部
- 如何配平氯酸分解的方程式?HClO3生成HClO4和O2和Cl2和H2O?
 pitto1年前4
pitto1年前4 -
 ykqie 共回答了18个问题
ykqie 共回答了18个问题 |采纳率77.8%由于:
Cl:+5→+7,每个Cl原子失去2e-
Cl:+5→0,每个Cl原子得到5e-
O:-2→0,每个O原子失去2e-
而又无法找到上述任意两个原子的个数比关系,只好将上式分为:
HClO3 — HClO4 + Cl2 + H2O
HClO3 — Cl2 + O2 + H2O
两式来配平,得:
7HClO3 = 5HClO4 + Cl2 + H2O……①
4HClO3 = 2Cl2 + 5O2 + 2H2O……②
①式乘以任意数,②式乘以任意数,然后两式相加,所得总的反应方程式都符合得失电子总数相等
所以此题应该还有其它条件,否则写成的式子就不止一个
比如①×1加上②×2:
15HClO3 = 5HClO4 + 5Cl2 + 10O2 + 5H2O
①×2加上②×1:
18HClO3 = 10HClO4 + 4Cl2 + 5O2 + 4H2O
……1年前查看全部
- 下列各组物质属于同一物质的是?A 纯碱 火碱 烧碱B 盐酸 氯酸 氢氟酸C 熟石灰 消石灰 氢氧化钙D 硫酸 氢硫酸 亚
下列各组物质属于同一物质的是?
A 纯碱 火碱 烧碱
B 盐酸 氯酸 氢氟酸
C 熟石灰 消石灰 氢氧化钙
D 硫酸 氢硫酸 亚硫酸 知是故人1年前2
知是故人1年前2 -
 xpx_vivi 共回答了14个问题
xpx_vivi 共回答了14个问题 |采纳率78.6%A 纯碱Na2CO3 火碱烧碱NaOH
B 盐酸HCl 氯酸HCl 氢氟酸HF
C 都是Ca(OH)2
D 硫酸H2SO4 氢硫酸H2S 亚硫酸H2SO31年前查看全部
- 以下化学式怎样写:碱式碳酸铜、二氯化锰、氯酸、硫酸氢铵、磷酸、磷酸氢二钠、硫磺、磷酸钠、氩气、氖气、金刚石,碱式碳酸铜加
以下化学式怎样写:
碱式碳酸铜、二氯化锰、氯酸、硫酸氢铵、磷酸、磷酸氢二钠、硫磺、磷酸钠、氩气、氖气、金刚石,碱式碳酸铜加热的化学式、三氧化硫和水反应、氧化铜和碳、氧化铜和co、碱式碳酸铜加热、碳酸氢钙溶液中滴加盐酸, 我爱喝茶HHH1年前3
我爱喝茶HHH1年前3 -
 哈雷v太空 共回答了17个问题
哈雷v太空 共回答了17个问题 |采纳率94.1%Cu2(OH)2CO3、MnCl2、HClO3、NH4HSO4、H3PO4、NaH2PO4、S、Ar
Ne
C
Cu2(OH)2CO3=(Delta)2CuO+H2O+CO2
SO3+H2O=H2SO4
2CuO+C=(Delta)CO2+2Cu(产物较复杂,可生成Cu2O或CO)
CuO+CO=CO2+Cu(也可生成Cu2O)
HCO3-+H+=H2O+CO2(离子方程式)1年前查看全部
- 次氯酸.氯酸.亚氯酸.高氯酸的酸性大小
 hongbocui1年前5
hongbocui1年前5 -
 txmwhb 共回答了13个问题
txmwhb 共回答了13个问题 |采纳率100%次氯酸是弱酸,且酸性比碳酸还弱,因此,
CO2+H2O+Ca(ClO)2=CaCO3+2HClO
这个反应说明了漂白粉在空气中久置后失效的基本反应.
亚氯酸属于中强酸,类似于磷酸.
氯酸属于强酸.
高氯酸在中学中是含氧酸中的最强酸.
这四种氯的含氧酸中,Cl的化合价不一样,存在一个规律,某元素的不同正价的含氧酸,其化合价越高,酸性越强.这条规律也适用于S、N、P等其它元素,如硫酸酸性强于亚硫酸,硝酸酸性强于亚硝酸等等.
建议你整理一下影响酸性强弱的一些基本规律,并整理一下常见的强酸和弱酸.1年前查看全部
- CrO5中氧的价态是多少?氯酸分解的反应方程式是什么?氧化亚铜与稀硝酸的反应方程式是什么?
CrO5中氧的价态是多少?氯酸分解的反应方程式是什么?氧化亚铜与稀硝酸的反应方程式是什么?
各位大哥大姐帮帮正在化学入门的小弟吧!希望有清楚一点的过程哈! 在风中的雨1年前1
在风中的雨1年前1 -
 庙前江水怒为涛 共回答了16个问题
庙前江水怒为涛 共回答了16个问题 |采纳率100%1.CrO5其结构式为:
,O--O
, /
,O=Cr=O
原因:Cr的价电子为6个所以CrO5的Cr的价态应为+6,所以可以知道其中必含过氧键.
CrO5的制法:(Cr2O7)2-+4H2O2+2H+=2CrO5(蓝紫色)+5H2O
2.常温下:6HClO3=4ClO2+2HClO4+2H2O,其中ClO2有容易分解成Cl2和O2,而HClO4的浓度大于75%时容易分解成O2和HCl.(此反应要求HClO3浓度大于30%),原因HClO3浓度过大酸性增强(ClO3)-的氧化性增强导致歧化为两种相对稳定的价态.
你说的是加热吧,有:2HClO3=2HCl↑+3O2↑,其实也有上述反应,可加热导致两种产物仍不稳定于是继续分解,你想验证的话可以将加热后的HClO3溶液加入K+会产生少量白色的KClO4沉淀.
3.3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
因为稀硝酸和有较弱的还原性的物质反应易生成NO(这是做题的经验;当然也是热力学上的事实,这我就不再多说了)
就这样吧!1年前查看全部
- 次氯酸,亚氯酸,氯酸,高氯酸受热都如何分解?
 守护者-集云1年前1
守护者-集云1年前1 -
 xiafan2001 共回答了16个问题
xiafan2001 共回答了16个问题 |采纳率87.5%2HClO=2HCL+O2↑
亚氯酸很不稳定,容易分解生成Cl2、ClO2和H2O.1年前查看全部
- 高氯酸\氯酸\亚氯酸\次氯酸,它们的酸性强弱和氧化性强弱怎么排?
 lizongzongcn1年前4
lizongzongcn1年前4 -
 yufancai 共回答了14个问题
yufancai 共回答了14个问题 |采纳率78.6%楼上的不要误导人啊,按这个顺序,酸性依次减弱,氧化性依次增强.高氯酸是中学阶段所见的最强酸,其酸性比硫酸盐酸都强,而次氯酸是中所周周的弱酸.
一般来说元素的价态越高,氧化性越强,偏偏这几个酸是例外的.氧化性依次增强.1年前查看全部
- HClO3是强酸吗?这是氯酸吗?次氯酸怎么写
 jw66661年前5
jw66661年前5 -
 慕司的滋味 共回答了21个问题
慕司的滋味 共回答了21个问题 |采纳率90.5%氯酸是HClO3
次氯酸是HClO
亚氯酸是HClO2
高氯酸是HClO4
HClO3在水里完全电离,是强酸.1年前查看全部
- 高氯酸与水反应生成亚氯酸还是氯酸
高氯酸与水反应生成亚氯酸还是氯酸
懂的告诉我一下,不会的别胡说 idtf7051年前1
idtf7051年前1 -
 hxh198nn19 共回答了20个问题
hxh198nn19 共回答了20个问题 |采纳率100%2HClO4=2HClO3+O2,是高氯酸的分解,生成的是氯酸,因为氯酸比亚氯酸稳定多了1年前查看全部
- 氯酸比盐酸酸性更强么,如果是,为什么
 玉树临疯啊1年前3
玉树临疯啊1年前3 -
 gledechen 共回答了17个问题
gledechen 共回答了17个问题 |采纳率82.4%其实你这根本就不好说,如果都是水溶液,那么盐酸和氯酸都是完全电离的,那么它们的酸性是一样的1年前查看全部
- 什么是氯酸,氯酸根,高氯酸,高氯酸根(化学方程式)?
什么是氯酸,氯酸根,高氯酸,高氯酸根(化学方程式)?
就是搞不清楚题目中所说的化学物质,写不出他们的方程式,对这些化合物的性质也模模糊糊的~. 事长帮1年前5
事长帮1年前5 -
 我已不再是天使 共回答了13个问题
我已不再是天使 共回答了13个问题 |采纳率100%氯酸:HClO3
氯酸根:ClO3^(-)
高氯酸:HClO4
高氯酸根:ClO4^(-)
亚氯酸:HClO2
亚氯酸根:ClO2^(-)
次氯酸:HClO
次氯酸根:ClO^(-)
氢氯酸(即盐酸中的溶质,氯化氢):HCl
氢氯酸根(即氯离子):Cl^(-)
记忆方法:你只需记住氯酸的化学式HClO3,然后高的多一个氧原子,亚的少一个氧原子,次的少两个氧原子.
如:硫酸H2SO4,而亚硫酸少一个氧,就是H2SO3.
硝酸HNO3,而亚硝酸少一个氧,就是HNO2.
但这是普遍规律,也并不绝对,如:锰酸:H2MnO4,高锰酸:HMnO41年前查看全部
- 如何用盐酸制取高氯酸?或氯酸
 FINC1年前1
FINC1年前1 -
 乳猪 共回答了21个问题
乳猪 共回答了21个问题 |采纳率76.2%制酸的规律一般是强酸制弱酸的
高氯酸和氯酸的酸性都比盐酸强,所以理论上是不能由盐酸制它们的.
制高氯酸的方法:
1、实验室中,用浓硫酸与KClO4作用的方法:KClO4 +H2SO4 =KHSO4 + HClO4.
2、工业上,用电解氧化盐酸的方法制取HClO4,电解时用铂作阳极,银或铜作阴极.1年前查看全部
- 常见氧化剂 次氯酸 高氯酸 氯酸的化学式 性质 各是什么?
 mjx19751年前3
mjx19751年前3 -
 mqqep 共回答了14个问题
mqqep 共回答了14个问题 |采纳率92.9%HCLO
次氯酸化学式HClO,结构式H-O-Cl,其中氯的价态为+1,仅存在于溶液中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的气味,极不稳定,是很弱的酸,比碳酸弱,和氢硫酸相当.有很强的氧化性和漂白作用,它的盐类可用做漂白剂和消毒剂,次氯酸盐中最重要的是钙盐,它是漂白粉(次氯酸钙和碱式氯化钙的混合物)的有效成分.漂白粉可由氯和消石灰反应而制得:
3Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2·Ca(OH)2·H2O+H2O
在放置漂白粉的地方具有氯的气味,就是因为有氧化二氯放出的缘故.
次氯酸在溶液中发生3种形式的分解,它们彼此无关,称为平行反应,即:
一,在阳光直接作用下,按第一种形式分解;在有脱水物质(如CaCl2)存在时,按第二种形式分解;加热时特别容易按第三种形式分解.如将氯通入热碱溶液中产物是氯酸盐而不是次氯酸盐:3Cl2+6KOH=KClO3+5KCl+3H2O
二,一氧化二氯和水作用生成次氯酸:H2O+Cl2O=2HClO
三,氯气与水反应生成次氯酸:H2O+Cl2=可逆=HCl+HClO
将氯气通入混有碳酸钙粉末的水中,次氯酸则积集在溶液中,蒸馏反应混合物,可以收集到稀次氯酸溶液.
次氯酸易分解
2HClO=2HCL+O2(气体符号)
HCLO4
强氧化剂.与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸的危险.在室温下分解,加热则爆炸.无水物与水起猛烈作用而放热.具有强氧化作用和腐蚀性.
HCLO3
浓酸浅黄色,有类似硝酸的刺激性气味.稀酸无色,在常温时没有气味.有强烈氧化性,常用作化学试剂.由氯酸钡溶液与硫酸作用后,经过滤、蒸浓而得.〔方程式:Ba(ClO3)2+H2SO4=====2HClO3+BaSO4(沉淀)〕
氯酸浓度在超过40%时发生分解,并剧烈爆炸:
8HClO3=====4HClO4+2H2O+3O2+2Cl2
(产生大量气体,爆炸效果与硝酸铵类似)
有强烈氧化性,常用作强氧化剂.1年前查看全部
- 次氯酸,氯酸,亚氯酸,高氯酸氧化性、酸性比较
 ujsadam1年前1
ujsadam1年前1 -
 小卖兜 共回答了13个问题
小卖兜 共回答了13个问题 |采纳率84.6%酸性由弱到强,氧化性由强到弱.1年前查看全部
- 氯气与不同浓度的氢氧化钠反应生成物不同?好像不同的 一个是次氯酸 一个是什么氯酸哦 忘了
氯气与不同浓度的氢氧化钠反应生成物不同?好像不同的 一个是次氯酸 一个是什么氯酸哦 忘了
马上 谢 答得好有奖励的 phoebedeng1年前2
phoebedeng1年前2 -
 细妖怪 共回答了19个问题
细妖怪 共回答了19个问题 |采纳率89.5%温度不同产物不同
与浓度无关1年前查看全部
- 氯酸氨就是高氯酸氨吗
 2cmn023pk1年前1
2cmn023pk1年前1 -
 张自明 共回答了23个问题
张自明 共回答了23个问题 |采纳率91.3%不是
氯酸铵为NH4ClO3
高氯酸铵NH4ClO4,
氯一个为+5价,一个为+7价.
并且我觉得高氯酸铵可能不稳定.1年前查看全部
- 生成硼酸,磷酸,高锰酸,锰酸,氯酸,高氯酸,乙酸,硝酸的化学式是什么?
 ΗySТêRiΑ1年前1
ΗySТêRiΑ1年前1 -
 m2bz2cu 共回答了18个问题
m2bz2cu 共回答了18个问题 |采纳率100%B2O3+3 H2O=2 H3BO3(硼酸)
P2O5+3 H2O=2 H3PO4(磷酸)
Mn2O7+H2O=2 HMnO4(高锰酸)(T1年前查看全部
- 氯酸和“次”氯酸“亚”氯酸的区别?硫酸“亚"铁为什么要加一个“亚”?甲烷的“甲”?
氯酸和“次”氯酸“亚”氯酸的区别?硫酸“亚"铁为什么要加一个“亚”?甲烷的“甲”?
.{其他的呢}
亚对应的是什么?{其他的呢}
甲对应的乙丙是什么?{其中我记得好像跟天干地支有关系}
【以及他们之间的关系,按先大后小的顺序排列,我主要是搞不懂前面的
次
亚
甲 好心态好心情1年前1
好心态好心情1年前1 -
 落日街主 共回答了16个问题
落日街主 共回答了16个问题 |采纳率100%HCLO次氯酸次是一价
HCLO2亚氯酸亚是三价
HCLO3氯酸
FESO4亚硫酸铁亚是+2价
FE2(SO4)3硫酸铁
CH4甲烷甲代表一1年前查看全部
- 氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为a HClO3=bO2↑+c Cl2↑+d HClO4+e H2
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为a HClO3=bO2↑+c Cl2↑+d HClO4+e H2O,下列说法正确的是( )
A. 由反应可知,氧气、氯气均为氧化产物
B. 若化学计量数a=8、b=3,则生成2 mol Cl2时,该反应转移电子的物质的量为l2 mol
C. 若b确定,则方程式中其他物质的化学计量数均能确定
D. 若氯酸分解所得的1mol混合气体的质量为51.5 g,则反应方程式可表示为5HCl03=02↑+Cl2↑+3HCl04+H20 浓本多情1年前1
浓本多情1年前1 -
 yokiki7 共回答了13个问题
yokiki7 共回答了13个问题 |采纳率84.6%解题思路:A.元素化合价升高得到的生成物是氧化产物,结合方程式中元素化合价判断;
B.还原产物只有Cl2,由HClO3→Cl2,Cl元素化合价由+5价降低为0价,据此计算生成2molCl2时转移电子的物质的量;
C.HClO4、O2是氧化产物,生成物中同种元素在不同的物质中出现,只确定O2的系数,无法确定气体物质的化学计量数;
D.根据混合气体的物质的量、质量,计算n(O2)、n(Cl2),确定b、c关系,再根据电子转移守恒、元素守恒配平方程式.A.HClO4、O2是氧化产物、Cl2是还原产物,故A错误;
B.还原产物只有Cl2,由HClO3→Cl2,Cl元素化合价由+5价降低为0价,故生成2molCl2时转移电子的物质的量为2mol×2×(5-0)=20mol,故B错误;
C.HClO4、O2是氧化产物,且生成物中同种元素在不同的物质中出现,只确定O2的系数,无法确定其它物质的化学计量数,故C错误;
D.n(Cl2)+n(O2)=1mol,n(Cl2)×71g/mol+n(O2)×32g/mol=51.5g,解得n(Cl2)=0.5mol,n(O2)=0.5mol,故n(Cl2):n(O2)=1:1,令b=c=1,则由电子守恒得d×(7-5)+b×4=c×2×(5-0),即d×(7-5)+1×4=1×2×(5-0),解得d=3,根据Cl原子守恒故a=2c+d=2+3=5,再根据H原子守恒有a=d+2e,即5=3+2e,故e=1,故该情况下反应方程式为:5HClO3=O2↑+Cl2↑+3HClO4+H2O,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应反应的计算、配平、基本概念等,题目难度较大,D选项为易错点,涉及计算与配平,注意电子守恒的应用.1年前查看全部
- 氯气与水反应中,为什么在光照下次氯酸会减小?
 jiaolong761年前5
jiaolong761年前5 -
 王道大地 共回答了17个问题
王道大地 共回答了17个问题 |采纳率94.1%因为次氯酸在光照下会分解成氧气和HCL,所以次氯酸会减少.
2HCLO=2HCL+O2 (条件是光照)1年前查看全部
- 写出下列物质的化学式碳酸碳酸钠碱式碳酸铜碳酸氢钠碳酸钙碳酸氢钙氯化氢氯气氯化钾二氧化锰氯酸氯酸钾二氧化氯氧化二氯硝酸硝酸
写出下列物质的化学式
碳酸
碳酸钠
碱式碳酸铜
碳酸氢钠
碳酸钙
碳酸氢钙
氯化氢
氯气
氯化钾
二氧化锰
氯酸
氯酸钾
二氧化氯
氧化二氯
硝酸
硝酸钾
硝酸钡
硝酸铵
硝酸铜
硝酸汞
硝酸银
硫酸
硫酸铵
硫酸氢铵
硫酸钡
硫酸铝
硫酸铁
硫酸亚铁
磷酸
磷酸钠
磷酸氢钠
磷酸氢二钠
磷酸氢铵
磷酸钙
磷酸二铵
氮气
硫磺
白磷
金刚石
氦气
二氧化硅
氖气
二氧化氮
氩气
氧化铁
氧化铝
氢氧根离子
硫酸根离子
碳酸根离子
硝酸根离子
铵根离子 lcon011年前2
lcon011年前2 -
 lewis_xuxu 共回答了16个问题
lewis_xuxu 共回答了16个问题 |采纳率100%碳酸 H2CO3
碳酸钠 Na2CO3
碱式碳酸铜 Cu2(OH)2CO3
碳酸氢钠 NaHCO3
碳酸钙 CaCO3
碳酸氢钙 Ca(HCO3)2
氯化氢 HCl
氯气 Cl2
氯化钾 KCl
二氧化锰 MnO2
氯酸 HClO3
氯酸钾 KClO3
二氧化氯 ClO2
氧化二氯 Cl2O
硝酸 HNO3
硝酸钾 KNO3
硝酸钡 Ba(NO3)2
硝酸铵 NH4NO3
硝酸铜 Cu(NO3)2
硝酸汞 Hg(NO3)2
硝酸银 AgNO3
硫酸 H2SO4
硫酸铵 (NH4)2SO4
硫酸氢铵 NH4HSO4
硫酸钡 BaSO4
硫酸铝 Al2(SO4)3
硫酸铁 Fe2(SO4)3
硫酸亚铁 FeSO4
磷酸 H3PO4
磷酸钠 Na3PO4
磷酸氢钠 NaH2PO4
磷酸氢二钠 Na2HPO4
磷酸氢铵 NH4H2PO4
磷酸钙 Ca3(PO4)2
磷酸二铵 (NH4)2HPO4
氮气 N2
硫磺 S
白磷 P
金刚石 C
氦气 He
二氧化硅 SiO2
氖气 Ne
二氧化氮 NO2
氩气 Ar
氧化铁 Fe2O3
氧化铝 Al2O3
氢氧根离子 OH^-
硫酸根离子 SO4^2-
碳酸根离子 CO3^2-
硝酸根离子 NO3^-
铵根离子 NH4^+1年前查看全部
- 为什么次氯酸的氧化性大于氯酸?正五价的氯的氧化性为什么还要弱于正一价?
 shuxd11051年前1
shuxd11051年前1 -
 tangjilv 共回答了19个问题
tangjilv 共回答了19个问题 |采纳率94.7%因为在某些情况下物质的性质有差异:比如氧化亚铜在1000度的时候比氧化铜稳定,还有硝酸与铜反应时,浓硝酸与铜放出二氧化氮,稀硝酸放出一氧化氮1年前查看全部
- (2008•肇庆二模)氯酸是一种强酸,浓度超过40%时会发生分解:a HClO3═bO2↑+c Cl
(2008•肇庆二模)氯酸是一种强酸,浓度超过40%时会发生分解:a HClO3═bO2↑+c Cl2↑+d HClO4+e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )
A.由反应可确定:氧化性HClO4>HClO
B.若化学计量数a=8,b=3,生成2molCl2,则该反应转移电子数为20e-
C.变蓝的淀粉碘化钾试纸褪色是因为发生了:5Cl2+I2+6H2O═12H++10Cl-+2IO3-
D.若氯酸分解所得混合气体1mol,其气体质量为47.6g,则反应方程式可表示为:26HClO3═15O2↑+8Cl2↑+10HClO4+8H2O mengba5211年前1
mengba5211年前1 -
 八月的爱人ai 共回答了12个问题
八月的爱人ai 共回答了12个问题 |采纳率91.7%解题思路:A.反应没有涉及HClO,根据该反应不能确定HClO4和HClO的强氧化性强弱;
B.还原产物只有Cl2,由HClO3→Cl2,Cl元素化合价由+5价降低为0价,据此计算生成2molCl2时转移电子的物质的量;
C.试纸先变蓝后褪色,说明氯气可氧化碘单质;
D.根据混合气体的物质的量、质量,计算n(O2)、n(Cl2),确定b、c关系,再根据电子转移守恒、元素守恒配平方程式.A.反应没有涉及HClO,根据该反应不能确定HClO4和HClO的强氧化性强弱,故A错误;
B.还原产物只有Cl2,由HClO3→Cl2,Cl元素化合价由+5价降低为0价,故生成2molCl2时转移电子的物质的量为2mol×2×(5-0)=20mol,故B正确;
C.试纸先变蓝后褪色,说明氯气可氧化碘,反应的方程式为5Cl2+I2+6H2O═12H++10Cl-+2IO3-,故C正确;
D.n(Cl2)+n(O2)=1mol,n(Cl2)×71g/mol+n(O2)×32g/mol=47.6g,
解得n(Cl2)=0.4mol,n(O2)=0.6mol,
故n(Cl2):n(O2)=2:3,与方程式中的计量数关系不同,
故D错误.
故选:BC.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应反应的计算、配平、基本概念等,题目难度较大,D选项为易错点,涉及计算与配平,注意电子守恒的应用.1年前查看全部
大家在问
- 1一个圆柱底面周长和高相等,如果高缩短2了厘米,表面积就减少了12平方厘米,求圆柱的体积和表面积.
- 2比如说一篇作文投稿日期:2012年9月30日止,那么请问9月30日那天还可以投稿吗?
- 3一个圆柱的底面周长和高相等.如果高缩短了两厘米,那么表面积就减少十二点五六平方厘米.求这个圆柱的体积
- 4并联电路中,各支路电压之和是否等于干路电压?各支路电流之和是否等于干路电流?
- 5已知CB//OA,∠C=∠A=100°,E、F两点在CB上,且满足∠FOB=∠AOB,OE平分∠COF
- 6语文80分数学60分化学60分英浯54分政史70分这样的成绩怎样abcdef为几等
- 7一,三字为反意字的成语
- 8氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为a HClO3=bO2↑+c Cl2↑+d HClO4+e H2
- 9如图,AB//CD,AF=FB,EC=EB,求证OC²=OF×OD
- 107年级上册数学同步205页17题
- 11有一个长6分米,宽4分米,高五分米的长方体木块,要把它加工成一个体积最大的圆柱,用哪个面做底面最合适
- 12请把大门难推开了,会卡住等等中文,翻译成英语,谢谢!
- 13His family depend ________ him to feed A.in B.of C.for D.on
- 14出於意料之外的成功,用什麼词急用.是词拉,不是以下这些,
- 15某人从甲地到乙地,如果每小时走15千米,就能比计划时间早到24分钟,如果每小时走12千米,就要比计划晚到24分钟,问甲、
