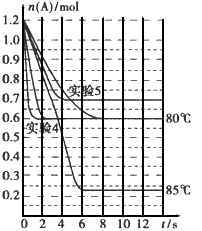
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g) 2B(g)。在三种不同条件下进行实验,A的物质的量随时间
 风约湘君2022-10-04 11:39:541条回答
风约湘君2022-10-04 11:39:541条回答 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)  2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如下图所示。试回答下列问题: 2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如下图所示。试回答下列问题: |
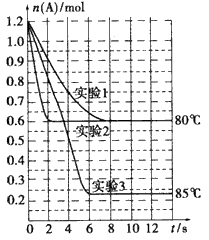 |
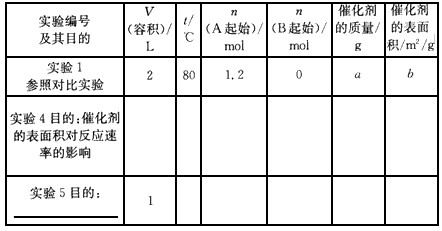
| (1)在实验1中,反应在4s内A的平均反应速率=____;4 s时A的转化率=____;此条件下该反应的平衡常数K1的值为___。 (2)实验2与实验1对比,其可能隐含的反应条件是_____。 (3)根据实验3与实验1的图象比较,可推测该反应是____(填“放热”或 “吸热”)反应。设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1____K2___K3(填“>”“=”或“<”)。 (4)为了验证增大催化剂的表面积、压强可提高化学反应速率这一结论,某同学在 下表实验1的基础上又利用该容器设计了实验4、5,部分实验条件及数据见下表。 请你完成下表,并在上图中完成实验4、5中A的物质的量随时间变化趋势曲线图。 |
 |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 填空.1.2mol硫酸含有约( )硫酸分子,硫酸溶于水可电离出( )mol氢离子.2.0.5mol水中约含( )水分子(
填空.
1.2mol硫酸含有约( )硫酸分子,硫酸溶于水可电离出( )mol氢离子.
2.0.5mol水中约含( )水分子( )氧原子.
3.10mol钠离子约含( )个钠离子,( )电子.
4.5mol氧气中含( )mol氧原子,( )mol质子.
5.3molNH3中含( )个N,( )个H
6.n个CO2的物质的量为( )mol,共含( )个原子.
7.相同物质的量的CO2和O2,其分子量之比为( ),原子数之比为( ),氧原子个数比为( )
8.含氢原子5mol个的CH4为( )mol
自信可以做全对的来... 青山碧烟1年前3
青山碧烟1年前3 -
 那怎么样 共回答了26个问题
那怎么样 共回答了26个问题 |采纳率80.8%设1mol的个数为6.02*10^23方,设为N.
1.2N,4N.
2.0.5*N,0.5*N
3.10N,100N
4.10N,80N
5.3N,9N
6.n/N,3n
7.44:32,3:2,1:1
8.1.25
这是我做的,有不对的地方可以再联系我.1年前查看全部
- 某生物实验小组需配置1L含K+.Na+.NO3-.SO42-分别为0.2mol 1.2mol 0.6mol 0.4mol
某生物实验小组需配置1L含K+.Na+.NO3-.SO42-分别为0.2mol 1.2mol 0.6mol 0.4mol的营养液 若要配置这种营养
 冷漠的真实1年前1
冷漠的真实1年前1 -
 holywu 共回答了19个问题
holywu 共回答了19个问题 |采纳率94.7%需要0.4mol硫酸钠,0.4mol硝酸钠,0.2mol硝酸钾.1年前查看全部
- (4分)当0.2mol烃A在足量氧气中完全燃烧时生成CO 2 和H 2 O各1.2mol,催化加氢后生成2,2-二甲基丁
(4分)当0.2mol烃A在足量氧气中完全燃烧时生成CO 2 和H 2 O各1.2mol,催化加氢后生成2,2-二甲基丁烷,则
(1)A的结构简式为 ▲ ,
(2)A的命名为: ▲ 。 k5121年前0
k5121年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某烃A 0.2mol 在氧气中完全燃烧后,生成CO2和H2O各1.2mol.试回答:
某烃A 0.2mol 在氧气中完全燃烧后,生成CO2和H2O各1.2mol.试回答:
(1)烃A的分子式为______.
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3mol,则有______g烃A参加了反应,燃烧时消耗标准状况下的氧气______L.
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为______.
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为______. qingyue1年前0
qingyue1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在10L密闭容器中进行如下反应:A(g)+B(g)⇌2C(g),2分钟后,B由2mol减少到1.2mol,则用单位内A的
在10L密闭容器中进行如下反应:A(g)+B(g)⇌2C(g),2分钟后,B由2mol减少到1.2mol,则用单位内A的浓度变化表示的反应速率(VA)是( )
A.0.02mol/(L•min)
B.0.04mol/(L•min)
C.0.08mol/(L•min)
D.0.8mol/(L•min) beepincn1年前1
beepincn1年前1 -
 amala_yu 共回答了18个问题
amala_yu 共回答了18个问题 |采纳率94.4%解题思路:2min后,B由2mol减少到1.2mol,v(B)=
=0.04mol•L-1•min-1,结合反应速率之比等于化学计量数之比来解答.(2mol−1.2mol) 10L 2min 2min后,B由2mol减少到1.2mol,v(B)=
(2mol−1.2mol)
10L
2min=0.04mol•L-1•min-1,由反应可知,A、B的化学计量数均为1,
反应速率之比等于化学计量数之比,
则用单位时间内A的浓度变化表示的化学反应速率为0.04mol•L-1•min-1,
故选B.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查反应速率的计算,明确计算公式及反应速率与化学计量数的关系即可解答,注重基础知识的考查,题目难度不大.1年前查看全部
- 在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2 (g)+3H2
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2 (g)+3H2 (g)
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2 (g)+3H2 (g)═2NH3 (g);△H<0,反应中NH3的物质的量浓度变化情况如图1: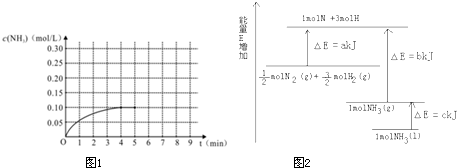
(1)根据上图,计算从反应开始到平衡时,平均反应速率v (NH3)为______mol/(L?min).
(2)该反应的化学平衡常数表达式K______,随温度升高,K值将______(填“增大”、“减小”“不变”).
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______.
a.0.20mol/Lb.0.12mol/Lc.0.10mol/Ld.0.08mol/L
(4)在一定条件下,合成氨反应已达化学平衡状态的是______ (填序号).
A.3v(H2)(正)=2v(NH3)(逆) B.混合气体的密度保持不变
C.容器内压强保持不变D.条件一定,混合气体的平均相对分子质量不再变化
E.单位时间内1mol N≡N键断裂的同时,有3mol H-H键生成
F.单位时间内生成了n mol N2的同时,减少了n mol NH3
(5)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数______(填“增大”、“减小”或“不变”).
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),请在图1中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(7)已知化学反应N2+3H2=2NH3 的能量变化如图2所示,
①1mol N 和3mol H 生成1mol NH3(g)是______能量的过程(填“吸收”或“释放”).
②[1/2]N2(g)+[3/2]H2(g)=NH3(g);△H=______;
③N2(g)和H2生成NH3(l)的热化学方程式为______.
 以精致洞1年前1
以精致洞1年前1 -
 我拽 共回答了19个问题
我拽 共回答了19个问题 |采纳率84.2%(1)由图可知到平衡时生成氨气为0.1mol/L,v(NH3)=[△C/△t]=[0.1mol/L/4min]=0.025 mol/(L.min)
故答案为:0.025 mol/(L.min).
(2)化学平衡常数K=
C2(NH3)
C (N2)C3(H2),已知N2 (g)+3H2 (g)═2NH3 (g)△H<0,升高温度平衡逆移,K减小;
故答案为:
C2(NH3)
C (N2)C3(H2),减小;
(3)该反应是可逆反应,所以反应物不能完全转化为生成物,所以氨气的浓度不可能为0.20mol/L;△H<0,所以该反应是放热反应,升高温度,平衡向逆反应方向移动,降低温度,平衡向正反应方向移动,所以氨气的浓度不可能为0.10mol/L,故选ac.
故答案为:ac;
(4)A.2v(H2)(正)=3v(NH3)(逆)是平衡状态,故错误;
B.容器中混合气体的密度保持不变不能作为判断的依据,因为容器的体积不变,气体的质量不变,无论是否达到平衡状态,气体的密度都不变,故错误;
C.反应前后的气体的计量数之和不相等,容器中气体的压强逐渐减小,当压强不变时,说明达到平衡状态,故正确;
D.反应前后的气体的计量数之和不相等,随反应进行,气体物质的量减少,质量不变,平均相对分子质量逐渐增大,平均相对分子质量不再变化,说明达到平衡状态,故正确;
E.单位时间内1mol N≡N键断裂为正速率,同时,有3mol H-H键生成为逆速率,而且正逆速率之比等于计量数之比,是平衡状态,故正确;
F.单位时间内生成了n mol N2为逆速率,同时,减少了n mol NH3为逆速率,都是逆速率不能判断平衡状态,故错误;
故答案为:C、D、E;
(5)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变.
故答案为;向正反应方向;不变.
(6)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L,其第5分钟末到此平衡时NH3浓度的变化曲线为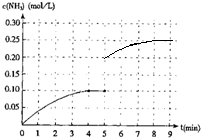 ;
;
故答案为: ;
;
(7)①由图可以看出,1molN和3molH的总能量大于1mol NH3(g)的能量,则生成NH3(g)的过程为释放能量的过程,故答案为:释放;
②由图可以看出,[1/2]molN2(g)+[3/2]molH2(g)的能量为akJ,1molNH3(g)的能量为bkJ,所以[1/2]N2(g)+[3/2]H2(g)=NH3(g)△H=(a-b)kJ/mol,
故答案为:(a-b)kJ/mol;
③由(2)可知[1/2]N2(g)+[3/2]H2(g)=NH3(g)△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:[1/2]N2(g)+[3/2]H2(g)=NH3(l);△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ?mol-1.
故答案为:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1.1年前查看全部
- 某烃A0.2mol在氧气中完全燃烧后,生成CO2和H2O各1.2mol.
某烃A0.2mol在氧气中完全燃烧后,生成CO2和H2O各1.2mol.
1)烃A的分子式为________________.
(2)若取一定量的烃完全燃烧后,生成CO2和H2O各0.3mol,则有________g烃参加了反应,燃烧时消耗标况下氧气的体积为___________.
(3)若烃A不能使溴水退色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为__________________________.
(4)若烃A能使溴水退色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为______________________________________.
(5)比烃A少一个碳原子且能使溴水退色的A的同系物有________种同分异构体. wihhy20061年前1
wihhy20061年前1 -
 libensen77 共回答了18个问题
libensen77 共回答了18个问题 |采纳率88.9%1)0.2molA生成1.2molCO2和H2O,所以A:C:H=1:6:12,所以分子式是C6H12
2)根据上面的比例,生成0.3molCO2和H2O,即0.05molA=4.2g,O2=0.9/2=0.45mol=10.08L
3)CnH2n为烯烃或环烷烃的通式,不能使溴水退色,即无双键;一氯代物只有1种,即所有H同环境,所以A是环己烷,结构式自己写吧
4)能使溴水退色,即A是烯烃,H2加成后有4甲基,即加成后的6碳烷烃有2支链,该烷烃只可能是二甲基丁烷,甲基位置可能是2,2或2,3,然后倒推烯烃:若是2,2-二甲基丁烷,则烯烃只可能是3,3-二甲基-1-丁烯;若是2,3-二甲基丁烷,则烯烃可能是2,3-二甲基-1-丁烯或2,3-二甲基-2-丁烯
5)该同系物是5碳烯烃,C5H10,同分异构体5种1年前查看全部
- 某烃A 0.2mol在氧气中完全燃烧后,生成化合物B、C各1.2mol.试回答:
某烃A 0.2mol在氧气中完全燃烧后,生成化合物B、C各1.2mol.试回答:
(1)42g A完全燃烧时,应消耗的氧气在标准状况下的体积为______;
(2)若A能使溴水褪色,且在催化剂存在下与H2加成的产物分子中含有4个甲基,则A可能的结构简式为(任写一种)______;
(3)某有机物的分子式为CxHyO2,若x的值与A分子中的碳原子个数相同,则该分子中y的最大值为______. 天长地久65561年前1
天长地久65561年前1 -
 251379364 共回答了18个问题
251379364 共回答了18个问题 |采纳率88.9%解题思路:烃含有C、H两种元素,某烃A 0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则据原子守恒,烃A的分子式为C6H12,(1)根据m=mM计算烃的物质的量,再根据1mol烃CxHy的耗氧量为(x+y4)mol计算,根据V=nVm计算氧气的条件;(2)若A能使溴水褪色,则A分子含有1个碳碳双键,且在催化剂存在下与H2加成的产物分子中含有4个甲基,则加成产物为(CH3)2CHCH(CH3)2或(CH3)3CCH2CH3,还原双键确定A的结构;(3)某有机物的分子式为CxHyO2,若x的值与A分子中的碳原子个数相同,C、H关系符合烷烃组成时y的值最大.烃含有C、H两种元素,某烃A 0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则据原子守恒,烃A的分子式为C6H12,
(1)4.2g烃的物质的量=[42g/84g/mol]=0.5mol,完全燃烧消耗氧气物质的量=0.5mol×(6+[12/4])=4.5mol,标况下,氧气的体积=4.5mol×22.4L/mol=100.8L,
故答案为:100.8;
(2)若A能使溴水褪色,则A分子含有1个碳碳双键,且在催化剂存在下与H2加成的产物分子中含有4个甲基,则加成产物为(CH3)2CHCH(CH3)2或(CH3)3CCH2CH3,还原双键,则A的结构为(CH3)2C=C(CH3)2或CH2=C(CH3)CH(CH3)2或(CH3)3CCH=CH2,
故答案为:(CH3)2C=C(CH3)2或CH2=C(CH3)CH(CH3)2或(CH3)3CCH=CH2;
(3)某有机物的分子式为CxHyO2,若x的值与A分子中的碳原子个数相同,C、H关系符合烷烃组成时y的值最大,故y的最大值=2×6+2=14,故答案为:14.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式的确定、限制条件同分异构体书写等,难度不大,注意掌握烷烃同分异构体的书写.1年前查看全部
- 某烃A 0.2mol在氧气中充分燃烧后生成化合物B、C各1.2mol,试回答:
某烃A 0.2mol在氧气中充分燃烧后生成化合物B、C各1.2mol,试回答:
(1)烃A的分子式______.
(2)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有______g烃A参加反应. kelven261年前2
kelven261年前2 -
 lvxiaoxue 共回答了13个问题
lvxiaoxue 共回答了13个问题 |采纳率84.6%解题思路:(1)烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则根据原子守恒可以确定分子式;
(2)根据燃烧法结合原子守恒思想来确定有机物的量.烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,所以碳原子和氢原子的个数是6、12,所以烃A的分子式为C6H12,故答案为:C6H12;
(2)取一定量的烃A完全燃烧后,生成CO2、H2O各3mol,根据碳原子和氢原子守恒,所以烃的物质的量是0.5mol,所以质量是0.5mol×84g/mol=42g,故答案为:42.点评:
本题考点: 有关有机物分子式确定的计算;有机物的推断.
考点点评: 本题考查有机物分子式的确定及有机物结构简式和同分异构体的判断,题目难度中等,1年前查看全部
- CaC2O4溶于稀硫酸中,然后用0.5mol/l的KMnO4溶液滴定,用去KMnO4溶液1.2mol,求钙的质量
 ericer20021年前2
ericer20021年前2 -
 soant 共回答了18个问题
soant 共回答了18个问题 |采纳率100%设物质的量为X
根据草酸根守恒得知
Ca(2+)----CaC2O4----H2C2O4
草酸与KMnO4的反应方程式如下
5H2C2O4+2KMnO4+3H2SO4===K2SO4+2MnSO4+10CO2+8H2O
所以1mol草酸对应2/5=0.4mol的KMnO4
Ca(2+)----CaC2O4----H2C2O4----0.4KMnO4
简化为Ca(2+)----0.4KMnO4
1-------------0.4
x-----------1.2mol
X=0.0012/0.4
所以Ca(2+)质量为 40*1.2/0.4=120克1年前查看全部
- 0.3molCu和含1.2mol HNO3的浓硝酸,充分反应后,生成NO2的量( )
0.3molCu和含1.2mol HNO3的浓硝酸,充分反应后,生成NO2的量( )
A.0.2mol
B.0.6mol
C.小于0.6mol
D.大于0.6mol mygod20001年前1
mygod20001年前1 -
 happyshine_2006 共回答了24个问题
happyshine_2006 共回答了24个问题 |采纳率95.8%解题思路:随着反应的进行,浓硝酸变稀,稀硝酸与铜反应得到的是NO.因铜与浓硝酸反应:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,随着反应的进行,浓硝酸变稀,
稀硝酸与铜反应:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,
所以放出的NO2小于0.6mol,
故选:C.点评:
本题考点: 硝酸的化学性质;有关范围讨论题的计算.
考点点评: 铜与浓硝酸的反应中要考虑量变引起质变,同样的例子还有二氧化锰与浓盐酸反应,随着反应的进行稀盐酸与二氧化锰 不反应.1年前查看全部
- 在一定条件下,一定量的A单质与1.2MOL CL2发生反应,生成0.8MOL ACLX,问X=?
在一定条件下,一定量的A单质与1.2MOL CL2发生反应,生成0.8MOL ACLX,问X=?
如标题
麻烦说详细一点~我是自习高一知识~暑假要去夏令营的。所以哥哥姐姐们麻烦每一步都说的详细点~我明白了~还有 答案应该是3 呵呵 qjysqjy1年前1
qjysqjy1年前1 -
 冻结的瞬间 共回答了26个问题
冻结的瞬间 共回答了26个问题 |采纳率84.6%1.2*2=0.8*x,X=0.31年前查看全部
- 某烃A0.2mol在氧气中充分燃烧时,生成化合物B、C各1.2mol.试回答:
某烃A0.2mol在氧气中充分燃烧时,生成化合物B、C各1.2mol.试回答:
(1)烃A的分子式________,B、C的分子式分别是_________.
(2)若取一定量的烃A燃烧后生成B、C各3mol,则有__________g烃A参加了反应,燃烧时消耗标准状况下氧气_______L.
(3)若烃A不能因反应而使溴水褪色在一定条件下不能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为_________.
(4)如果该烃能使溴水褪色,且分子中所有碳原子共平面,则A的结构式为——
(5)比A少两个碳原子的A的烯烃的同系物的同分异构体共有——种
(6)如果该烃能使溴水褪色,在催化剂作用下与H2发生加成反应后生成(CH3)3CCH2CH3,则A的结构简式为—— Solomon_dan1年前2
Solomon_dan1年前2 -
 每日一推16 共回答了14个问题
每日一推16 共回答了14个问题 |采纳率100%(1)烃A的分子式___C6H12_____,B、C的分子式分别是__CO2和H2O_______.
(2)若取一定量的烃A燃烧后生成B、C各3mol,则有____42______g烃A参加了反应,燃烧时消耗标准状况下氧气____100.8___L.
3)若烃A不能因反应而使溴水褪色在一定条件下不能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为____环己烷,就是正六边形_____.
(4)如果该烃能使溴水褪色,且分子中所有碳原子共平面,则A的结构式为 不好画,我大概表示一下有点像这个样子>=<.
(5)有3种
(6)(CH3)3CCH=CH21年前查看全部
- 132克CO2有多少摩尔?有多少个?149克硫酸有多少摩尔?有多少个?1.2mol二氧化碳有多少克?有多少个?
 浅间知子1年前2
浅间知子1年前2 -
 tarenawuhan 共回答了16个问题
tarenawuhan 共回答了16个问题 |采纳率93.8%物质的量 ===质量/摩尔质量 ==132/44==3 mol
有 3NA 个
149 H2SO4 149/98==1.52 mol
有 1.52NA 个
质量==物质的量*摩尔质量 ==1.2*44==52.8g
有 1.2NA 个1年前查看全部
- 设NA为阿伏伽德罗常数1.2mol 钠与过量稀盐酸反应生成NA个H2分子,为什么2.7g CnH2n 中含有的氢原子数目
设NA为阿伏伽德罗常数
1.2mol 钠与过量稀盐酸反应生成NA个H2分子,为什么
2.7g CnH2n 中含有的氢原子数目为NA.为什么 红粉菲菲42981年前1
红粉菲菲42981年前1 -
 我用青春赌明天 共回答了23个问题
我用青春赌明天 共回答了23个问题 |采纳率87%1.利用得失电子来计算就比较好懂.
反应完成后,钠成了+1价,H由+1价变为0价,其余没变,所以2mol钠可以置换1mol氢气.所以就是NA个氢气分子.
2.CnH2n可以写作(CH2)n,所以7gCnH2n就是(0.5/n)mol,所以氢原子数目就=(0.5/n)×2n=1mol,所以就是NA个.
懂了么?1年前查看全部
- NH3中的N是正价还是负价6NO2+8NH3=7N2+12H2O 转移1.2mol电子时消耗标况下NO2多少升
 心有罅隙1年前1
心有罅隙1年前1 -
 fbwkimi 共回答了11个问题
fbwkimi 共回答了11个问题 |采纳率90.9%负三价的1年前查看全部
- 2CuFeS2+O2→Cu2S+2FeS+SO2,问:每生成1molCu2S,有 mol硫被氧化,每转移1.2mol电子
2CuFeS2+O2→Cu2S+2FeS+SO2,问:每生成1molCu2S,有 mol硫被氧化,每转移1.2mol电子,有 mol硫被氧化?
 5爱你13141年前1
5爱你13141年前1 -
 classicdog 共回答了17个问题
classicdog 共回答了17个问题 |采纳率88.2%1,0.2
2CuFeS2+O2→Cu2S+2FeS+SO2中CuFeS2 Cu 为正二价,Fe为正二价,S为负二价,Cu2S中Cu 为正一价,FeS中Fe为正二价,S为负二价,SO2中S为正四价,所以铜被还原,氧被还原;硫被氧化,每mol反应转移6mol电子,每2mol CuFeS2就有1molCu2S生成,但是1molCu2S中S为负二价化合价不变,所以只有1molS被氧化,所以第一个空填1
每mol反应转移6mol电子,每转移1.2mol电子即发生了0.2mol反应,所以只有0.2molS被氧化,故填0.21年前查看全部
- 1.2mol金属钠与下列物质反应,在标准状况下生成11.2molL.H2的是( )
1.2mol金属钠与下列物质反应,在标准状况下生成11.2molL.H2的是( )
A.1mol乙醇 B.1mol乙二醇 C.甲醇的水溶液 D.甘油
为什么BCD不行? 蔡学梅1年前3
蔡学梅1年前3 -
 史美玲 共回答了17个问题
史美玲 共回答了17个问题 |采纳率64.7%首先我们知道 醇羟基都与Na反应
B中1mol的乙二醇 有2mol的醇羟基可以和Na反应 此时乙二醇过量 产生氢气以Na为主 所以是0.6mol 即13.44L
C中不仅仅是甲醇 水也会和Na反应 产生H2
D中甘油是丙三醇 同理于B应该有13.44L气体产生
PS:这题有问题的其实 C和D都没有明说它们的物质的量什么的 其实是有可能的1年前查看全部
- 0.2mol某烃A在氧气中充分燃烧后,生成1.2molCO2,该烃A的分子式不可能是 A .C6H12 B. C6H18
0.2mol某烃A在氧气中充分燃烧后,生成1.2molCO2,该烃A的分子式不可能是 A .C6H12 B. C6H18 C.C6H14
D.C2H4 傲視De猪1年前3
傲視De猪1年前3 -
 tammy610 共回答了16个问题
tammy610 共回答了16个问题 |采纳率100%是不可能的存在的
d是不符合条件1年前查看全部
- 1.下列说法正确的是( )1.2mol铁原子 2.1molFe^3+ 3.0.5mol氧 4.0.5mol氮气 5.1m
1.下列说法正确的是( )
1.2mol铁原子 2.1molFe^3+ 3.0.5mol氧 4.0.5mol氮气 5.1mol氯的质量是35.5g,1molCl-质量也为35.5g 6.氨的摩尔质量是17g
A.1246 B.12456 C.124 D.都正确
2.将1.氢气; 2.氧气;3.甲烷三种气体分别乘放在三个容器中,并保持三个容器内气体的温度和密度均相等,这三种气体对气体容器所施加的压强的大小关系是( ).
A.1>2=3 B.12 D.1 双鱼女子1年前1
双鱼女子1年前1 -
 回头看看旧zz 共回答了21个问题
回头看看旧zz 共回答了21个问题 |采纳率90.5%1.选 c 6当中摩尔质量的单位是g/mol
2.选c 同质量的三种气体相同条件下氢气密度最小,氧气密度最大,因此密度相同就必须让压强1>3>2
3.标准状况下,混合气体的物质的量为0.2mol,体积为4.48L1年前查看全部
- 某烃A0.2mol在氧气中充分燃烧后,生成化合物B,C各1.2mol,则烃A的分子式为?
 小换1年前1
小换1年前1 -
 lmrlsz 共回答了17个问题
lmrlsz 共回答了17个问题 |采纳率88.2%烃在氧气中充分燃烧
C完全转为CO2
H完全转为H20
所以C~CO2
x 1.2
C=1.2mol
所以1.2/0.2=6 同理
H~H20
X 1.2
H=2.4mol
2.4/0.2=12
所以 该烃分子式为C6H12环己烷
答案是不是?1年前查看全部
- 用物质的量浓度为1.2molmol/L 的NaOH溶液吸收一定量的氯气,消耗了NaOH溶液的体积为500ml,在标准状况
用物质的量浓度为1.2molmol/L 的NaOH溶液吸收一定量的氯气,消耗了NaOH溶液的体积为500ml,在标准状况下,吸收了氯气的体积为多少?
取4.6g钠投入水中,完全反应后,溶液的体积为1L求:
1生成的气体体积在标准状况下为多少?
2所得溶液溶质的物质的量为多少? q5q51年前3
q5q51年前3 -
 whj624 共回答了17个问题
whj624 共回答了17个问题 |采纳率94.1%设在标准状况下,吸收了氯气的体积为X
氢氧化钠的物质的量=1.2mol/L*0.5L=0.6mol
Cl2 + 2NaOH=NaCl+NaClO+H2O
22.4 2X
0.6mol X
X=6.72L
答:在标准状况下,吸收了氯气的体积为6.72升.
设生成气体体积在标准状况下为X,生成氢氧化钠的物质的量为Y
2Na+2H2O=2NaOH+H2↑
46 2 22.4
4.6g Y X
X=2.24L
Y=0.2mol
答:1生成的气体体积在标准状况下为2.24升
2所得溶液溶质的物质的量为0.2摩尔.1年前查看全部
- 为什么D最后的量为1.2mol在一定温度下将2molA和2molB两种气体相混合于容积为2L的某密闭容器中发生如下反应:
为什么D最后的量为1.2mol
在一定温度下将2molA和2molB两种气体相混合于容积为2L的某密闭容器中发生如下反应:3A(g)+B(g)=xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD并测得C的浓度0.4mol/L,请填写下列空白:
(1)X 的值(2)A的转化率(3)生成D的反应速率(4)如果上述反应在相同的条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡完全相同,则还应加入( )物质( )mol liyuehua04201年前1
liyuehua04201年前1 -
 caihua066 共回答了13个问题
caihua066 共回答了13个问题 |采纳率92.3%1.x=2
2.60%
3.0.2mol/L·min
平衡时C的物质的量是n=cV=0.4*2=0.8mol
3A(g)+B(g)=xC(g)+2D(g)
化学计量数 3 1 x 2
起始 2 2 0 0
变化 1.2 0.4 0.8 0.8
平衡 0.8 1.6 0.8 0.8
变化量等于化学计量数,x/0.8=2/0.8,x=2
A的转化率是1.2/2*100%=60%
D的浓度变化是△c=△n/V=0.8/2=0.4mol/L,速率是v=△c/t=0.4/2=0.2mol/L·min
4. 4/3mol的B1年前查看全部
- 在4L容器中进行如下反应:2A(g)+B(g)⇌2C(g),2分钟后,B由2mol减少到1.2mol,则单位时间内C的化
在4L容器中进行如下反应:2A(g)+B(g)⇌2C(g),2分钟后,B由2mol减少到1.2mol,则单位时间内C的化学反应速率v(C)是( )
A.0.8mol/(L•min)
B.0.2mol/(L•min)
C.0.06mol/(L•min)
D.0.12mol/(L•min) wzp11271年前1
wzp11271年前1 -
 yingyi215 共回答了16个问题
yingyi215 共回答了16个问题 |采纳率106.3%解题思路:先根据v=
计算B的反应速率,再结合同一可逆反应中,同一时间段内,各物质的反应速率之比等于其计量数之比计算C的反应速率.△n V △t 2分钟内B的平均反应速率=
(2−1.2)mol
4L
2min=0.1mol/(L•min),同一可逆反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(C)=2v(B)=0.2mol/(L•min),
故选:B.点评:
本题考点: 化学反应速率和化学计量数的关系.
考点点评: 本题考查了化学反应速率的计算,根据化学反应速率与计量数之间的关系来分析解答即可,难度不大.1年前查看全部
- 在50MPA,500`C和铁触媒催化的条件下,用1.2MOL氨气和3MOL氢气合成氨.氢气完全消耗掉?
 lemontree2171年前2
lemontree2171年前2 -
 urchin2008 共回答了20个问题
urchin2008 共回答了20个问题 |采纳率80%.题目写错了吧,是1.2mol氮气吧...首先写出方程式或者熟悉的话直接写关系式1N2----3H2
然后呢,判断过量,两种思路:一是可以从H2出发,3molH2需要1MOL N2,现在N2是1.2MOL,所以H2可以反应完
二呢是可以从N2出发,1.2MOL N2需要3.6MOL氢气,明显N2有剩余,H2反应完毕
上面的阿门写错了吧,极端条件下小于1X10-5次方认为反应完全吧.不过做题目时看情况而定咯1年前查看全部
- 0.3molCu和含1.2mol HNO3的浓硝酸,充分反应后,生成NO2的量( )
0.3molCu和含1.2mol HNO3的浓硝酸,充分反应后,生成NO2的量( )
A. 0.2mol
B. 0.6mol
C. 小于0.6mol
D. 大于0.6mol 旁边_ee1年前1
旁边_ee1年前1 -
 首句用了 共回答了17个问题
首句用了 共回答了17个问题 |采纳率82.4%解题思路:随着反应的进行,浓硝酸变稀,稀硝酸与铜反应得到的是NO.因铜与浓硝酸反应:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,随着反应的进行,浓硝酸变稀,
稀硝酸与铜反应:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,
所以放出的NO2小于0.6mol,
故选:C.点评:
本题考点: 硝酸的化学性质;有关范围讨论题的计算.
考点点评: 铜与浓硝酸的反应中要考虑量变引起质变,同样的例子还有二氧化锰与浓盐酸反应,随着反应的进行稀盐酸与二氧化锰 不反应.1年前查看全部
- MnO2+HCl==mncl2+cl2+2h2o,当转移1.2mol电子时,生成cl多少L?被氧化hcl多少mol?未被
MnO2+HCl==mncl2+cl2+2h2o,当转移1.2mol电子时,生成cl多少L?被氧化hcl多少mol?未被氧化hcl多少mol?
参加反应mno2多少克 zhangyoufu20061年前4
zhangyoufu20061年前4 -
 floating2004 共回答了18个问题
floating2004 共回答了18个问题 |采纳率83.3%配平方程式:MnO2+4HCl浓=加热=MnCl2+Cl2+2H2O其中4HCl中被氧化的HCl(化合价升高从-1升到0)只有2个占一半(2HCl--Cl2氯原子守恒),转移电子数2e-MnO2+4HCl浓=加热=MnCl2+Cl2+2H2O 转移2e-87 4 22.4 2z y x 1.2mol解...1年前查看全部
- 某烃A 0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol.试回答:
某烃A 0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol.试回答:
(1)烃A的分子式______
(2)若取一定量的烃A完全燃烧后,生成B,C各3mol,则有______克烃A参加反应,燃烧时消耗标准状况下的氧气______升.
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则此烃A的结构简式为______.
(4)若烃A能使溴水褪色,在催化剂作用下与H 2 加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为______.
(5)比烃A少2个碳原子的烯烃同系物有______种同分异构体. 毁褪1年前0
毁褪1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生
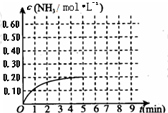 (2010•烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=______.
(2010•烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=______.
(2)该反应的化学平衡常数表达式为c(NH3)2 c(N2).c(H2)3 .c(NH3)2 c(N2).c(H2)3
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______(填序号)
a.0.82mol•L-1b.0.25mol•L-1c.0.20mol•L-1d.0.08mol•L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡______移动(填“向右”、“向左”或“不”),化学平衡常数______(填“增大”、“减少”或“不变”).
(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线. andyboy12111年前1
andyboy12111年前1 -
 零下一度003 共回答了24个问题
零下一度003 共回答了24个问题 |采纳率91.7%解题思路:(1)由图可知,达到平衡时氨气增加0.20mol/L,先根据反应速率公式计算氨气的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算氮气的反应速率;
(2)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(3)△H<0,该反应为放热反应,升高温度逆向移动,氨气浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应;
(4)体积减小,气体压强增大,平衡向气体体积减小的方向移动,化学平衡常数只与温度有关,温度不变,化学平衡常数不变;
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol•L-1.(1)由图可知,达到平衡时氨气增加0.20mol/L,其反应速率=[0.20mol/L/5min=0.04mol/(L.min),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以氮气的反应速率是氨气的一半,为
0.02 mol•L-1•min-1,故答案为:0.02 mol•L-1•min-1;
(2)该反应的化学平衡常数K=
c(NH3)2
c(N2).c(H2)3],故答案为:
c(NH3)2
c(N2).c(H2)3;
(3)该反应是可逆反应,所以反应物不能完全转化为生成物,所以氨气的浓度不可能为0.8mol/L;
该反应是放热反应,升高温度,平衡向逆反应方向移动,降低温度,平衡向正反应方向移动,所以氨气的浓度不可能为0.20mol/L,故选a、c;
(4)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变,
故答案为:向右;不变;
(5)第5分钟末将容器的体积缩小一半后,氨气浓度为0.40mol/L,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.50mol•L-1,
则图象为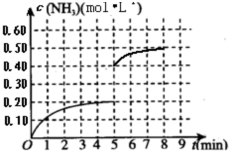 ,故答案为:
,故答案为: .
.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的调控作用.
考点点评: 本题考查化学平衡的计算,明确反应速率计算、平衡的影响因素及图象的分析试剂解答本题的关键,题目难度中等,难点是(5)题图象,注意缩小体积瞬间,氨气浓度变为原来的2倍,为易错点.1年前查看全部
- 有0.2mol某烃,在氧气中充分燃烧后,生成化合物H2O和CO2各1.2mol,
有0.2mol某烃,在氧气中充分燃烧后,生成化合物H2O和CO2各1.2mol,
①写出该烃的分子式.
②如果该烃不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则该烃的一氯取代物的名称是------,将其与NaOH水溶液共热,则反应后生成的有机物的结构简式为------,它是属于---类.
③如果该烃能使溴水褪色,在热镍粉存在的情况下,能与氢气发生反应,生成物为2,3—二甲基丁烷,写出该烃可能的结构简式. 轨未tt1年前1
轨未tt1年前1 -
 耕火者ww5 共回答了19个问题
耕火者ww5 共回答了19个问题 |采纳率89.5%①C:H=1.2/0.2:1.2*2/0.2=6:12
该烃的分子式C6H12
②该烃的一氯取代物的名称是1-氯环已烷,将其与NaOH水溶液共热,则反应后生成的有机物的结构简式为环己醇(六个碳形成环状结构,其中一个碳连有一个氢和一个羟基,其它的碳上连有两个氢),它是属于醇类.
③该烃可能的结构简式.
CH2=C(CH3)CH(CH3)2
(CH3)2C=C(CH3)21年前查看全部
- 救急,初三摩尔化学计算题若干道1.2mol三氧化硫含有( )个三氧化硫分子2.3mol铜含有( )个铜原子3.3.01*
救急,初三摩尔化学计算题若干道
1.2mol三氧化硫含有( )个三氧化硫分子
2.3mol铜含有( )个铜原子
3.3.01*10的24次方个水分子是( )mol水
4.2mol氮气的质量为( ),含有( )个氮分子
计算下列分子和原子的个数(要过程)
5.4mol氦原子;0.05mol蔗糖分子
计算下列物质的物质的量(要过程)
88克二氧化碳;4克氧化镁;多少克二氧化硫与三氧化硫所含的分子个数相同 盐重分子1年前1
盐重分子1年前1 -
 菠萝菠萝蜜宝宝 共回答了22个问题
菠萝菠萝蜜宝宝 共回答了22个问题 |采纳率90.9%1.2mol三氧化硫含有(1.204*10的24次方 )个三氧化硫分子
2.3mol铜含有(1.806*10的24次方 )个铜原子
3.3.01*10的24次方个水分子是(5 )mol水
4.2mol氮气的质量为(56 ),含有( 1.204*10的24次方)个氮分子
计算下列分子和原子的个数(要过程)
5.4mol氦原子;0.05mol蔗糖分子
计算下列物质的物质的量(要过程)
88克二氧化碳;88g/44g/mol=2mol 4克氧化镁4g/40g/mol=0.1mol;多少克二氧化硫与三氧化硫所含的分子个数相同 要分子数相同 已知的三氧化硫的质量/64g/mol/80g/mol1年前查看全部
- 原电池一题将0.4molAgNO3,0.8mol Cu(NO)3,1.2mol KCl的混合物溶于水配制成1L溶液,用惰
原电池一题
将0.4molAgNO3,0.8mol Cu(NO)3,1.2mol KCl的混合物溶于水配制成1L溶液,用惰性电极电解一段时间后,在一极析出0.4mol铜,此时在另一极上产生的气体的物质的量:
A 0.4mol
B 0.5mol
C 0.6mol
D 0.8mol xiamc1年前1
xiamc1年前1 -
 dashankm 共回答了15个问题
dashankm 共回答了15个问题 |采纳率100%0.2mol氧气.
0.4mol硝酸银与0.4mol氯化钾反应生成氯化银沉淀,溶液中只有0.8mol硝酸铜和0.8mol硝酸钾.
阴极生成0.4mol铜,得到0.8mol电子.则阳极生成0.2mol氧气.1年前查看全部
- 某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答:
某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答:
(1)烃A的分子式是______.
(2)若取一定量的烃A充分燃烧后,生成B、C各3mol,则有______g的A参加了反应,燃烧时消耗标准状况下的氧气______L.
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式是______.
(4)若烃A能使溴水褪色,在催化剂作用下与H2发生加成反应后生成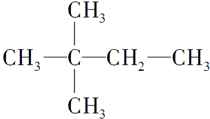 ,则A的结构简式为______.
,则A的结构简式为______.
(5)若烃A能使溴水褪色,且分子中所有碳原子共平面,则A的结构简式为______. xiaolong9061年前1
xiaolong9061年前1 -
 速度女孩 共回答了17个问题
速度女孩 共回答了17个问题 |采纳率94.1%解题思路:(1)烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则1mol烃中含有6molC,12molH原子,A分子式为C6H12;
(2)根据燃烧方程式计算A的物质的量、消耗氧气的物质的量,再根据m=nM计算烃A的质量,根据V=nVm计算消耗氧气的体积;
(3)若烃A不能使溴水褪色,说明有机物中不含C=C官能团,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷;
(4)若烃A能使溴水褪色,在催化剂作用下与H2加成生成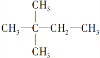 ,说明分子中含有1个C=C键,相邻两个碳原子都含有H原子为C=C双键位置,据此确定A的结构简式;
,说明分子中含有1个C=C键,相邻两个碳原子都含有H原子为C=C双键位置,据此确定A的结构简式;
(5)若烃A能使溴水褪色,且分子中所有碳原子共平面,则C=C双键中不饱和C原子连接四个甲基,据此确定A的结构简式.(1)烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则1mol烃中含有6molC,12molH原子,分子式为C6H12,
故答案为:C6H12;
(2)C6H12完全燃烧,生成3molCO2和H2O,则:
C6H12+9O2
点燃
.
6CO2+6H2O,
1mol 9mol 6mol 6mol
0.5mol 4.5mol 3mol 3mol
当生成3molCO2和H2O时,需要0.5molC6H12,m(C6H12)=0.5mol×84g/mol=42g,
需要氧气的体积为V(O2)=4.5mol×22.4L/mol=100.8L,
故答案为:42;100.8;
(3)若烃A不能使溴水褪色,说明有机物中不含C=C官能团,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷,结构简式为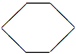 ,故答案为:
,故答案为: ;
;
(4)若烃A能使溴水褪色,在催化剂作用下与H2加成生成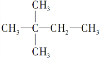 ,说明分子中含有1个C=C键,相邻两个碳原子都含有H原子为C=C双键位置,故A的结构简式为:(CH3)3CCH=CH2,
,说明分子中含有1个C=C键,相邻两个碳原子都含有H原子为C=C双键位置,故A的结构简式为:(CH3)3CCH=CH2,
故答案为:(CH3)3CCH=CH2;
(5)若烃A能使溴水褪色,且分子中所有碳原子共平面,则C=C双键中不饱和C原子连接四个甲基,故A的结构简式为:(CH3)2C=C(CH3)2,
故答案为:(CH3)2C=C(CH3)2.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式确定、限制条件同分异构体的书写,题目难度中等,注意掌握烯烃的结构与性质.1年前查看全部
- 某生物实验小组需配置1升含钾离子、钠离子、硝酸根离子、硫酸根离分别为0.2mol,1.2mol,0.6mol ,0.4m
某生物实验小组需配置1升含钾离子、钠离子、硝酸根离子、硫酸根离分别为0.2mol,1.2mol,0.6mol ,0.4mol的营养液,则配置这种营养液,需要哪些物质?物质的量分别为多少?(所用药品不能超过三种,并写出解题过程)
我只剩这个问题了
 dishy211年前1
dishy211年前1 -
 stupid2000 共回答了19个问题
stupid2000 共回答了19个问题 |采纳率84.2%几种离子组成的物质可能为Na2SO4,K2SO4,NaNO3,KNO3,硫酸根0.4,则不管是Na2SO4还是K2SO4,阳离子应为0.8,硝酸根离,0.6,则不管是NaNO3还是KNO3,阳离子应为0.6.所以任意两种组合是不行的,所以至少三种,而又有要求所用药品不能超过三种,所以用三种来假设,1.硫酸根Na2SO4,K2SO4都存在,则NaNO3,KNO3只能存在一种,用硝酸根做突破口,则知Na2SO4,K2SO4,KNO3不行,Na2SO4,K2SO4,NaNO3,用硝酸根做突破口NaNO3 0.6,则Na2SO4 0.3,K2SO4 0.1成立.
2.NaNO3,KNO3都存在,则Na2SO4,K2SO4只能存在一种,用硫酸根做突破口,NaNO3,KNO3,K2SO4不成立,NaNO3,KNO3,Na2SO4,用硫酸根做突破口,Na2SO4 0.4,则NaNO3 0.4,KNO3 0.2成立.
所以结论:1.NaNO3 0.6,Na2SO4 0.3,K2SO4 0.1
2.Na2SO4 0.4,NaNO3 0.4,KNO3 0.21年前查看全部
- 1mol碘化亚铁与1.2mol氯气反应.请讲一下反应过程和离子方程式.
 彦云1年前4
彦云1年前4 -
 人间八月天 共回答了21个问题
人间八月天 共回答了21个问题 |采纳率100%Cl2>Br2>Fe3+>I2>S,故先有2I-+CL2=I2+2CL-(氧化出1mol I2,剩0.2molCL2)
再有2FE2+CL2=2FE3+2CL-(氧化出0.2mol FE3+,剩0.8mol FE3+)1年前查看全部
- 2.4g镁所含电子数为什么为1.2MOL
 edzw20021年前1
edzw20021年前1 -
 kate1011b 共回答了29个问题
kate1011b 共回答了29个问题 |采纳率75.9%2.4克镁就是0.1mol
一个镁原子有12个电子,即1mol镁有12mol电子,所以是1.2mol电子1年前查看全部
- 1mol碘化亚铁与1.2mol氯气反应.请讲一下反应过程和离子方程式.
 卡车Q1年前2
卡车Q1年前2 -
 杯子把儿 共回答了17个问题
杯子把儿 共回答了17个问题 |采纳率94.1%2FE2+CL2=2FE3+2CL-(氧化出1mol FE3+,剩0.2molCL2)
2I-+CL2=I2+2CL-(氧化出0.2mol I2,剩下1.6mol I-)1年前查看全部
- 0.2mol单质Ax和1.2molB2完全反应,生成0.8molAB3,则单质Ax的化学式是______.
 styletop1年前1
styletop1年前1 -
 赎罪的天蝎 共回答了25个问题
赎罪的天蝎 共回答了25个问题 |采纳率100%解题思路:根据阿伏伽德罗定律可得反应的方程式为Ax+6B2═4AB3,根据质量守恒定律可得单质的化学式.根据阿伏伽德罗定律可得反应的方程式为Ax+6B2═4AB3,结合质量守恒定律可知x为4,单质Ax的化学式为A4,
故答案为:A4.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查反应方程式的计算,侧重于考查学生的计算能力,注意根据质量守恒定律和阿伏伽德罗定律解答该题,难度不大.1年前查看全部
- 0.2mol单质Ax和1.2molB2完全反应,生成0.8molAB3,则单质Ax的化学式是______.
 gfhd2g1htr1年前1
gfhd2g1htr1年前1 -
 零度飞贼 共回答了16个问题
零度飞贼 共回答了16个问题 |采纳率87.5%解题思路:根据阿伏伽德罗定律可得反应的方程式为Ax+6B2═4AB3,根据质量守恒定律可得单质的化学式.根据阿伏伽德罗定律可得反应的方程式为Ax+6B2═4AB3,结合质量守恒定律可知x为4,单质Ax的化学式为A4,
故答案为:A4.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查反应方程式的计算,侧重于考查学生的计算能力,注意根据质量守恒定律和阿伏伽德罗定律解答该题,难度不大.1年前查看全部
- 0.2mol单质Ax和1.2molB2完全反应,生成0.8molAB3,则单质Ax的化学式是______.
 追赶时间的少年1年前1
追赶时间的少年1年前1 -
 whjd5455 共回答了20个问题
whjd5455 共回答了20个问题 |采纳率95%解题思路:根据阿伏伽德罗定律可得反应的方程式为Ax+6B2═4AB3,根据质量守恒定律可得单质的化学式.根据阿伏伽德罗定律可得反应的方程式为Ax+6B2═4AB3,结合质量守恒定律可知x为4,单质Ax的化学式为A4,
故答案为:A4.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查反应方程式的计算,侧重于考查学生的计算能力,注意根据质量守恒定律和阿伏伽德罗定律解答该题,难度不大.1年前查看全部
- 1.2mol Cl2与元素A单质完全反应生成0.80mol AClx,则x值为( )
1.2mol Cl2与元素A单质完全反应生成0.80mol AClx,则x值为( )
A. 1
B. 2
C. 3
D. 4 weiahjingjing1年前2
weiahjingjing1年前2 -
 rockroi 共回答了16个问题
rockroi 共回答了16个问题 |采纳率81.3%解题思路:氯气完全反应生成AClx,根据氯原子守恒列方程计算x的值.1.2molCl2与足量的元素A的单质完全反应生成0.80mol AClx,
根据Cl原子守恒有:1.2mol×2=0.8mol×x,解得x=3,
故选C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的计算,注意根据原子守恒计算,比较基础.1年前查看全部
- 有0.2mol某烃,在氧气中充分燃烧后,生成化合物H2O和CO2各1.2mol,①写出该烃的分子式.②如果该烃不能使溴水
有0.2mol某烃,在氧气中充分燃烧后,生成化合物H2O和CO2各1.2mol,①写出该烃的分子式.②如果该烃不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则该烃的一氯取代物的名称是------,将其与NaOH水溶液共热,则反应后生成的有机物的结构简式为------,它是属于---类.③如果该烃能使溴水褪色,在热镍粉存在的情况下,能与氢气发生反应,生成物为2,3—二甲基丁烷,写出该烃可能的结构简式.
 sleepywitch051年前1
sleepywitch051年前1 -
 昆仑71虎跃 共回答了22个问题
昆仑71虎跃 共回答了22个问题 |采纳率95.5%C 1.2/0.2 =6 H 1.2*2/0.2 = 12 C6H12 一氯环己烷 环己醇 (六边形上一个碳连着-OH)醇 可能为 2,3-二甲基-1-丁烯或者2,3-二甲基-2-丁烯1年前查看全部
- 1.2mol氯气与元素a的单质完全反应生成0.8mol的氯化物ACLx,则x的值为?
 封雪1年前1
封雪1年前1 -
 xiaolm013 共回答了20个问题
xiaolm013 共回答了20个问题 |采纳率100%根据元素的质量守恒定律,元素前后的质量要不变.
那么物质的量也要不变.
原来CL元素的物质的量为:1.2*2=2.4mol
后来为0.8x
所以0.8x=2.4
x=31年前查看全部
- 1.2mol的氧气与金属单质A反应生成0.8mol的氧化物,求A的化合价
 KENVINLEI1年前2
KENVINLEI1年前2 -
 cdfowimr 共回答了18个问题
cdfowimr 共回答了18个问题 |采纳率83.3%氧化物中O原子数为 2*1.2/0.8==3 个
则 AO3 ,即化合价为 +2*3==+61年前查看全部
- 某烃A0.2mol在氧气充分燃烧后,生成化合物B、C各1.2mol.则A的分子式是?
 jhgfuysa1年前3
jhgfuysa1年前3 -
 vicorljj 共回答了18个问题
vicorljj 共回答了18个问题 |采纳率94.4%还BC,烃充分燃烧产物只有CO2和H2O不会有其他产物.
0.2molA中有C元素1.2mol,H元素2.4mol
则A的分子式是C6H121年前查看全部
- 化学38分钟,38页:2,将1.2mol金属钠与下列物质反应,在标准状况下能生成11.2L H2的是
化学38分钟,38页:2,将1.2mol金属钠与下列物质反应,在标准状况下能生成11.2L H2的是
A 1mol乙醇 B 1mol乙二醇 C 含1mol甲醇的水溶液 D 1mol甘油 晓静1年前1
晓静1年前1 -
 布哈斯赫 共回答了16个问题
布哈斯赫 共回答了16个问题 |采纳率100%1.2mol的金属钠,如果完全反应,可置换出0.6mol的H2.换算成体积后大于11.2L.因此,本题的考点在于找出一个反应物,使之不能够将1.2mol的Na完全反应.
由于醇羟基、水均可和Na反应产生H2,因此C选项相当于反应物足够的多.
A、B、D选项的差别则在于羟基数量,1mol乙醇含有1NA个羟基;1mol乙二醇含有2NA个羟基;1mol甘油(丙三醇)则含有3NA的羟基.
由于醇羟基与金属钠1:1置换,因此,只有A选项的羟基数目小于金属钠的数量:1.2mol.答案选A
如有疑惑,欢迎追问1年前查看全部
- 金属重2.4克,其原子核外有1.2mol电子,核内共有7.224*10的23次方个中子,该金属与足量盐酸反应,有0.2m
金属重2.4克,其原子核外有1.2mol电子,核内共有7.224*10的23次方个中子,该金属与足量盐酸反应,有0.2mol电子发生转移,生成6.02*10的22次方个阳离子问这个金属什么?原子核内有几个质子,几个中子
 kkde城市1年前1
kkde城市1年前1 -
 朝自己开一枪 共回答了12个问题
朝自己开一枪 共回答了12个问题 |采纳率91.7%6.02*10的22次方为0.1mol,根据质量2.4g,得知原子质量为24g/mol,所以为金属镁,有12个质子,12个中子.1年前查看全部
- 将1.2MOL 金属钠与下列物质反应在标准状况下能生成11.2L氢气的是
将1.2MOL 金属钠与下列物质反应在标准状况下能生成11.2L氢气的是
(A)1MOL乙醇
(B)1MOL乙二醇
(C)含1MOL甲醇的水溶液
(D)1MOL丙二醇
我做出来怎么每个选项都是生成0.6mol的氢气啊 uway1年前1
uway1年前1 -
 nqwi 共回答了20个问题
nqwi 共回答了20个问题 |采纳率85%2NA+2H2O=2NaOH+H2
2CH3CH2OH+2NA=2CH3CH2ONA+H2
选A的.1MOL乙醇反应完了就完了,NA是过量的.没有水的.1年前查看全部
- 为什么生成0.4mol的一氧化氮需要1.2mol电子,完全生成0.4mol的二氧化氮需要0.4mol
 爱在xqjc雪狼湖1年前2
爱在xqjc雪狼湖1年前2 -
 纳兰存古 共回答了28个问题
纳兰存古 共回答了28个问题 |采纳率85.7%NO3-中的N是+5价,NO中的N是+2价,NO2中的N是+4价
生成NO,N从+5价下降到+2价,需要得到3个电子,所以生成0.4mol的NO需要3*0.4=1.2mol电子
生成NO2,N从+5价下降到+4价,需要得到1个电子,所以生成0.4mol的NO需要1*0.4=0.4mol电子1年前查看全部
大家在问
- 1下图表示某中学初一1班学生的胸围差测量数据,请分析下列图表并回答问题:
- 2已知[X+3]的N次方的展开式中的各项的系数和比各项的二项式系数和大992,求展开殊中间的项
- 3廊坊美好畜牧养殖股份有限公司用英文翻译为langFang Perfect Animal Husbandry Co.,LT
- 4问:在泰戈尔的这首散文诗榕树仿佛是一位(),张开()的怀抱,让()、()、()、在它的怀抱中玩耍、劳作,表达了作者对榕树
- 522,23,24题有点,难拜托大神们了哦!
- 6名副其实的反义词 please help me
- 7Wilson ___(study) for a test until 12:00 last night.
- 8英语翻译“我愿用我一生的痛苦换取一时的辉煌”,将这句话译成英文,
- 9古人常用“丝竹”代指音乐,分别写出两句含有此意象的语句,意思要相对完整。并写明作者或出处
- 10证明:81^7+27^9-19^13必能被45整除
- 11英语翻译How are you?I hope you've had a pleasant day so far :) W
- 12英国著名剧作家萧伯纳个子瘦高,有一次他碰见一位大腹便便的资本家.资本家讥笑他说:“一看到你,就知道世界上正在闹饥荒!”萧
- 13自来水厂的清水池起什么作用
- 14下图中甲图表示某海滨地区海洋与陆地近地面的气温日变化
- 15一道简单的高一物理题!网球与乒乓球比较,用同样大小的力,乒乓球抽杀的速度比网球快得多,试简述其中的道理.