硫化氢与浓硫酸反应生成硫、二氧化硫和水.在这个反应中,所有含硫物质硫元素的化合价共有几种?
 简单雅2022-10-04 11:39:541条回答
简单雅2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 冰冰块儿 共回答了18个问题
冰冰块儿 共回答了18个问题 |采纳率88.9%- 有4种 硫酸中的硫 正六价硫化氢中的硫 负二价硫单质 零价二氧化硫 正四价
- 1年前
相关推荐
- 向8克氢氧化钠里加入一定量硫化氢气体,将得到的溶液蒸干,得到8克无水固体,问个
 xiaobao0081年前1
xiaobao0081年前1 -
 lijunyong0309 共回答了21个问题
lijunyong0309 共回答了21个问题 |采纳率95.2%2NaOH+H2S=Na2S+H2O;NaOH+H2S=NaHS
...xg.78x/80g.yg.56y/40g
x+y=8
78x/80 + 56y/40 = 81年前查看全部
- 硫化氢通入亚硫酸溶液中
 肥肥黑眼圈1年前1
肥肥黑眼圈1年前1 -
 南师风范 共回答了17个问题
南师风范 共回答了17个问题 |采纳率82.4%2H2S+H2SO3=3S+3H2O
归中反应1年前查看全部
- “硫化氢”的化学式不是H2SO4吗?为什么是H2S?
 吾好昆我1年前3
吾好昆我1年前3 -
 流行飞逝 共回答了15个问题
流行飞逝 共回答了15个问题 |采纳率80%H2SO4是硫酸的分子式,
硫化氢 的分子式是H2S1年前查看全部
- 将硫化亚铁和稀盐酸在常温下反应生成硫化氢,是什么化学性质?是不是还原性?
 菲菲蝴蝶1年前1
菲菲蝴蝶1年前1 -
 天l涯王子 共回答了20个问题
天l涯王子 共回答了20个问题 |采纳率85%还原性是指元素失去电子的性质
一种元素非常容易失去电子,也就是容易 [被] 氧化,就说这种元素的还原性较强.
至于硫化亚铁和稀盐酸生成硫化氢的反应,不是还原性.因为此反应是复分解反应,体现的应该是硫化氢的挥发性.因为硫化氢是气体且为弱电解质,从溶液中逸出,从而使反应顺利进行1年前查看全部
- 硫化氢气体通入到硫酸铜溶液中出现黑色沉淀的离子方程式(要配平和注明反应条件)?
 jerryxu20031年前2
jerryxu20031年前2 -
 cutecat0555 共回答了10个问题
cutecat0555 共回答了10个问题 |采纳率90%Cu2+ + H2S == 2H+ +CuS↓
是弱酸制强酸的特例1年前查看全部
- 高一有关元素的化学问题硫化氢的水溶液在空气中存放容易变质么?
 得意潇洒1年前3
得意潇洒1年前3 -
 小白麻麻 共回答了16个问题
小白麻麻 共回答了16个问题 |采纳率100%容易因为H2S中负二价的S易氧化易于空气中的O2反应1年前查看全部
- 化学,向硫化氢溶液中加入硫酸铜溶液,为什么硫离子的浓度会减少?
 zhouyifei1年前2
zhouyifei1年前2 -
 x80bzr 共回答了28个问题
x80bzr 共回答了28个问题 |采纳率89.3%发生反应H2S + CuSO4 == CuS↓ + H2SO4 ,生成了更难电离的CuS沉淀,故硫离子浓度减小1年前查看全部
- 硫化氢气体除用水来吸收,还有什么比水吸收能力更强的液体
 Baldhawk1年前1
Baldhawk1年前1 -
 li0213 共回答了15个问题
li0213 共回答了15个问题 |采纳率100%用碱性溶液.如氢氧化钠溶液比水吸收能力更强.1年前查看全部
- 硫化氢溶液中,在采取错施使pH增大的时候,则j硫离子的溶度的变化情况
 无限期的等待1年前3
无限期的等待1年前3 -
 fsdagou 共回答了20个问题
fsdagou 共回答了20个问题 |采纳率100%在碱性溶液中提高PH值,需要加大OH的量,若加入氨水,则氨的浓度加大,如NH3·H2O=NH4++OH-,根据化学平衡移动规律,增大PH,即增加OH-离子浓度,1年前查看全部
- 下列反应的现象是什么饱和碳酸钠溶液与二氧化碳(现象)硫化氢与三氯化铁的反应(现象)氨气与氯化氢的反应(现象)铁与氯气的反
下列反应的现象是什么
饱和碳酸钠溶液与二氧化碳(现象)
硫化氢与三氯化铁的反应(现象)
氨气与氯化氢的反应(现象)
铁与氯气的反应(现象) 萍儿41年前1
萍儿41年前1 -
 只是爱过你 共回答了24个问题
只是爱过你 共回答了24个问题 |采纳率79.2%生成沉淀
生成黄色沉淀,溶液由黄色变为浅绿色
生成白色晶体
产生大量棕黄色烟1年前查看全部
- 如何用溴水区别硫化氢,二氧化硫,二氧化碳
 stonehaven1年前2
stonehaven1年前2 -
 viviansz 共回答了20个问题
viviansz 共回答了20个问题 |采纳率100%溴水与硫化氢和二氧化硫发生氧化还原反应与二氧化碳不反应
溴水与二氧化硫:2H2O+Br2+SO2==2HBr+H2SO4
现象:溴水褪色
溴水与硫化氢:Br2+H2S==2HBr+S↓
现象:溴水褪色并产生黄色沉淀
同入C02无现象1年前查看全部
- 英语翻译主动进攻—就是最有效的防守自然界的异味、臭味的主要成分是氨(R3N)、硫化氢(H2S)、甲硫醇(CH3SH)二甲
英语翻译
主动进攻—就是最有效的防守
自然界的异味、臭味的主要成分是氨(R3N)、硫化氢(H2S)、甲硫醇(CH3SH)二甲化硫物(CH3SCH3)等;
臭氧除臭的原理是通过其强大的氧化作用,分解上述产生臭味物质的分子结构,以达到净化空气的目的.细菌病毒与臭氧
(O3)结合后能迅速破坏细菌的细胞膜,导致细菌病毒死亡并且不再形成新病菌.
臭氧分子式为O3;有极强的氧化性,其氧化还原单位仅次于氟.在常温状态下,臭氧很容易就会分解还原成氧气,
使用后并无任何残留物; 科学界已经能稳妥成熟地运用臭氧科技:臭氧在自来水消毒、污水处理、化工氧化、食品加工
消毒与防霉保鲜、以及医疗与家庭等领域都能发挥广泛的用途,被誉为“最清洁的氧化剂和消毒剂”.
人们在雷雨后总感觉空气特别清新,这就是臭氧作用的缘故. 一生有-你1年前3
一生有-你1年前3 -
 火_牛 共回答了14个问题
火_牛 共回答了14个问题 |采纳率92.9%以下是本篇章的人工翻译,如有不佳之处,还望原谅!(1) The driving attack - is the most effective defense The nature unusual smell.
(2)the fetid odor principal constituentis the ammonia (R3N), the hydrogen sulfide (H2S), the methanthiol(CH3SH) two armor sulfur (CH3SCH3) and so on
(3)The ozone deodorizes the principle is through its formidableoxidation, the decomposition above has the fetid odor matter molecularstructure, achieves the purification air the goal.
(4)Bacterium virus andozone after (O3) unifies can rapidly destroy the bacterium the cellmembrane, causes the bacterium virus death and no longer to form thenew germ. the ozone molecular formula is O3; has the greatly strengthenedoxidability, its oxidation reduction unit is only inferior to thefluorine.
(5) under the normal temperature condition, the ozone is veryeasy to be able to decompose returns to original state the oxygen, after the use and does not have any residuum; The scientificcircles already could safely maturely utilize the ozone science andtechnology: Ozone in running water disinfection, sewage treatment,chemical oxidation, food processing The disinfection and the mold proofing maintain freshness.
(6)aswell as domain and so on medical service and family all can displaythe widespread use, by the reputation is " the cleanest oxidant and thedisinfectant".the people after the thunderstorm , always felt the air is speciallyfresh, this is the ozonization reason.1年前查看全部
- 硫化氢在空气中变质条件不是加热或点燃吗?
 听见楚声1年前1
听见楚声1年前1 -
 85652511 共回答了24个问题
85652511 共回答了24个问题 |采纳率95.8%缓慢氧化也行的1年前查看全部
- 氯化氢\硫化氢 酸性比较氯化氢不是更稳定么,那是不是硫化氢更易电离出氢离子,这样不就是硫化氢酸性更强了么?我是类比卤化氢
氯化氢硫化氢 酸性比较
氯化氢不是更稳定么,那是不是硫化氢更易电离出氢离子,这样不就是硫化氢酸性更强了么?
我是类比卤化氢的酸性来着.还是因为硫化氢是弱酸,而卤化氢都是强酸?
还有个问题,我总是弄不明白一个族或一个周期该比些什么,稳定性?对应酸碱强弱? 我来了也1年前4
我来了也1年前4 -
 其言也善 共回答了16个问题
其言也善 共回答了16个问题 |采纳率93.8%稳定的意思是氯化氢分子不易分解 像水可以通电变成氢气和氧气 稳定性和酸碱性不同,没直接关系 卤化氢酸性同一族越来越强 因为同一族原子半径越来越大,对电子的束缚能力越来越小,只是比较他们酸性的根本依据,同一周期原子半径越来越小,最高价氧化物对应水化物酸性越来越强 原因是与他们的结构有关,不易打字说明,记住就行了,原因找根本1年前查看全部
- 硫化氢气体通入氢氧化钠溶液中请大家写一下离子方程式
 jack8781年前1
jack8781年前1 -
 fangcui22 共回答了15个问题
fangcui22 共回答了15个问题 |采纳率100%(H2S) + 2(OH-) = 2(H2O) + (S2-)
为区分,我用括号括起来了1年前查看全部
- 氯气,氨气,二氧化碳,硫化氢,二氧化氮,二氧化硫一体积水大约可以溶解多少体积气体?
 iiangel1年前5
iiangel1年前5 -
 ziyouzhixing 共回答了1个问题
ziyouzhixing 共回答了1个问题 |采纳率100%氯气是1:2 氨气是1:700 二氧化碳是1:1 硫化氢是1:2.6二氧化硫是1:40 二氧化氮我不是很清楚好像是1:31年前查看全部
- 请用化学符号表示:①1个氧原子______; ②2个氯离子______; ③3个硫化氢分子_____
请用化学符号表示:①1个氧原子______; ②2个氯离子______; ③3个硫化氢分子______
④硫酸铵______⑤标出NaNO2中氮元素的化合价Na
O2+3 N Na.
O2+3 N  bbslove1091年前1
bbslove1091年前1 -
 招待所对面 共回答了16个问题
招待所对面 共回答了16个问题 |采纳率93.8%解题思路:①根据原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字进行分析;
②根据离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字进行分析;
③根据分子的表示方法:正确书写物质的化学式,由分子构成的物质,其化学式能表示一个分子进行分析;
④根据化学式的正确书写方法进行分析;
⑤根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后进行分析.①由原子的表示方法可知:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,所以两个氧原子表示为:2O;
②由离子的表示方法可知,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,所以2个氯离子可表示为:2Cl-;
③由分子的表示方法可知:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,所以3个硫化氢分子表示为:3H2S;
④硫酸铵可以表示为:(NH4)2SO4;
⑤由元素化合价的表示方法可知:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以NaNO2中氮元素的化合价为:Na
+3
NO2.
故答案为:2O;2Cl-;3H2S;(NH4)2SO4;Na
+3
NO2.点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.1年前查看全部
- 硫化氢和硒化氢的区别包括状态、是否与浓硫酸反应、水溶液酸性强弱、能否燃烧、热稳定性比较等等
 yaojingdeyao1年前1
yaojingdeyao1年前1 -
 多空平衡 共回答了23个问题
多空平衡 共回答了23个问题 |采纳率91.3%都是气态,都能与浓硫酸反应,硫化氢酸性大于硒化氢,都能燃烧,硫化氢热稳定性大于硒化氢1年前查看全部
- (14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H 2 S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S 2 - —2e - S (n—1)S+ S 2 -
S (n—1)S+ S 2 -  S n 2 -
S n 2 -
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
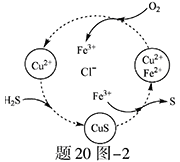
(2)将H 2 S和空气的混合气体通入FeCl 3 、FeCl 2 、CuCl 2 的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH 2 S转化为硫单质时,保持溶液中Fe 3 + 的物质的量不变,需要消耗O 2 的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
(3)H 2 S在高温下分解生成硫蒸气和H 2 。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H 2 S在高温下分解反应的化学方程式为 。

 zhaozhao3151年前1
zhaozhao3151年前1 -
 混脸熟 共回答了23个问题
混脸熟 共回答了23个问题 |采纳率95.7%1年前查看全部
- 常温常压下,a升二氧化硫与b升硫化氢混合,反应后的气体体积是反应前气体体积的四分之一,则a与b得比是?
 喜聊1年前2
喜聊1年前2 -
 东边的海 共回答了18个问题
东边的海 共回答了18个问题 |采纳率100%1)如果SO2过量
SO2+2H2S=3S+2H2O
1-------2
b/2-----b
反应后剩余的SO2有a-b/2 L
a-b/2=(a+b)/4
a=b得a:b=1:1
2)如果H2S过量
SO2+2H2S=3S+2H2O
1-------2
a-------2a
反应后剩余的H2S有b-2a L
b-2a=(a+b)/4
3a=b得a:b=1:3
a,b的比值为1:1或1:31年前查看全部
- 硫化氢和二氧化硫反应,氧化剂______,还原剂_______;氧化产物______,还原产物_______;发生氧化反
硫化氢和二氧化硫反应,氧化剂______,还原剂_______;氧化产物______,还原产物_______;发生氧化反应的是________,被还原的元素是_______.
还有高锰酸钾加热制取氧气的反应,非常急,
解释一下硫元素是+4价的降了还是-2价的升了? 异乡浪子1年前3
异乡浪子1年前3 -
 qq猫 共回答了18个问题
qq猫 共回答了18个问题 |采纳率88.9%二氧化硫、硫化氢、硫、硫、硫化氢、硫
高锰酸钾、高锰酸钾、氧气、二氧化锰、高锰酸钾、氧
硫化氢和二氧化硫反应是归中反应,硫元素+4价的降了,-2价的也升了1年前查看全部
- 硫化氢的水溶液叫氢硫酸 有还原性在空气中放置一段事件后无色溶液中会出现黄色沉淀 该反映化学方程式是
硫化氢的水溶液叫氢硫酸 有还原性在空气中放置一段事件后无色溶液中会出现黄色沉淀 该反映化学方程式是
_____________
氧化剂是什么 被氧化物质是什么 有理ffww1年前6
有理ffww1年前6 -
 月夜听话花落 共回答了15个问题
月夜听话花落 共回答了15个问题 |采纳率93.3%2 H2S + O2 == S(沉淀) + 2 H2O
氧化剂是O2,被氧化物质是H2S
在空气中放置,首先想到的氧化剂就是氧气.H2S有还原性,可被氧气氧化.
酸性条件下氧气的还原产物是水.1年前查看全部
- 硫酸亚铁和硫化氢反应吗?为什么
 掬一片心情品味1年前3
掬一片心情品味1年前3 -
 asl521 共回答了30个问题
asl521 共回答了30个问题 |采纳率80%假如反应,生成的是硫化亚铁和稀硫酸,但硫化亚铁是溶于稀酸的,所以不反应.1年前查看全部
- 硫化钠溶液通入硫化氢中反应的离子方程式是什么?
 王越0241年前1
王越0241年前1 -
 6814785 共回答了17个问题
6814785 共回答了17个问题 |采纳率88.2%S2- +H2S=HS-1年前查看全部
- 已知标准状况下,1lh2s气体完全燃烧生成液态水时放出akj的热量,写出硫化氢燃烧热的热化学方程式
 tt的羚羊1年前2
tt的羚羊1年前2 -
 咏真 共回答了27个问题
咏真 共回答了27个问题 |采纳率92.6%H2S(q)+3/2O2(q)=H2O(l)+SO2(q) ;ΔH=— 22.4a kJ/mol1年前查看全部
- 为什么硫化氢通入硫酸锰溶液中得不到硫化锰沉淀,若将硫化铵溶液加入硫酸锰溶液中,却又硫化锰沉淀生产?
 吾乃oo1年前1
吾乃oo1年前1 -
 jiang385 共回答了19个问题
jiang385 共回答了19个问题 |采纳率94.7%因为MnS 溶于硫酸,所以硫化氢通入硫酸锰溶液中得不到硫化锰沉淀
而硫化铵溶液加入硫酸锰溶液中,生产MnS 和 (NH4)2SO4,所以可以形成沉淀1年前查看全部
- 硫化氢与二氧化氮反应化学方程式似乎和二氧化氮与二氧化硫的反应有些像.
 19879131年前1
19879131年前1 -
 高原竹影 共回答了18个问题
高原竹影 共回答了18个问题 |采纳率100%等于氮气、水、二氧化硫1年前查看全部
- (8分)同温同压下,同体积的氨气和硫化氢(H 2 S)气体的质量比为______________;同质量的氨气和硫化氢(
(8分)同温同压下,同体积的氨气和硫化氢(H 2 S)气体的质量比为______________;同质量的氨气和硫化氢(H 2 S)气体的体积比为__________________,所含原子个数比为
_____________;若两者所含氢原子数相等,它们的物质的量比是__________________。 pass4ever1年前1
pass4ever1年前1 -
 adam_xcz 共回答了20个问题
adam_xcz 共回答了20个问题 |采纳率80%1:2 2:1 8:3 2:3
略1年前查看全部
- 硫化氢在空气中完全燃烧的化学方程式
 带袖子的uu1年前3
带袖子的uu1年前3 -
 tietong01 共回答了17个问题
tietong01 共回答了17个问题 |采纳率94.1%2H2S+3O2=2H2O+2SO21年前查看全部
- 乙炔中混有硫化氢磷化氢,用什么除杂?
乙炔中混有硫化氢磷化氢,用什么除杂?
乙炔中混有硫化氢磷化氢,为什么不用氢氧化钠溶液除杂,而用硫酸铜溶液除杂? amyhj11211年前1
amyhj11211年前1 -
 先邑名家 共回答了21个问题
先邑名家 共回答了21个问题 |采纳率95.2%因为NaOH不与PH3反应,也就是说无法去除PH3.
而4CuSO4+PH3+4H2O—H3PO4+4H2SO4+4Cu↓
CuSO4+H2S=CuS↓+H2SO4.1年前查看全部
- 蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H2S).硫化氢气体是一种大气污染物,它在空气中点燃时,生成二氧化硫和
蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H2S).硫化氢气体是一种大气污染物,它在空气中点燃时,生成二氧化硫和水,把硫化氢气体通人浓硫酸中,发生的反应为:H2S+H2SO4(浓)=SO2+X↓+2H2O.
(1)上述内容中,属于硫化氢物理性质的是______.
(2)硫化氢在空气中完全燃烧的化学方程式是:2H2S+3O2
2SO2+2H2O点燃 .2H2S+3O2.其中硫化氢是______(填“‘氧化剂”或“还原剂”).
2SO2+2H2O点燃 .
(3)硫化氢与浓硫酸反应时,生成物中X的化学式是______. 冬无名1年前1
冬无名1年前1 -
 飞言海声 共回答了27个问题
飞言海声 共回答了27个问题 |采纳率88.9%解题思路:(1)不需要通过化学变化表现出来的性质属于物质的物理性质;
(2)根据质量守恒定律可以书写反应的化学方程式;反应中得氧的物质是还原剂;
(3)根据质量守恒定律可以判断物质的化学式.(1)硫化氢的颜色、气味等方面的性质不需要通过化学变化表现出来,属于物理性质.
故答案为:无色、有臭鸡蛋气味的气体;
(2)硫化氢在空气中完全燃烧的化学方程式为:2H2S+3O2
点燃
.
2SO2+2H2O;该反应中硫化氢得氧,是还原剂;
故答案为:2H2S+3O2
点燃
.
2SO2+2H2O;还原剂;
(3)由H2S+H2SO4(浓)═SO2+X↓+2H2O可知,反应物中有4个氢原子、2个硫原子、4个氧原子,生成物除X外,有4个氢原子、1个硫原子、4个氧原子,根据质量守恒定律,每个X中含有1个硫原子,是硫,化学式是S.
故答案为:S.点评:
本题考点: 化学性质与物理性质的差别及应用;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查物质的性质和化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.1年前查看全部
- 用醋酸铅试纸检验硫化氢气体反而看不到硫化铅产生的特征亮黑色
 wldw6101年前1
wldw6101年前1 -
 ligl_520 共回答了14个问题
ligl_520 共回答了14个问题 |采纳率92.9%因为醋酸铅试纸使用之前要润湿1年前查看全部
- 某溶液中加入过量盐酸产生沉淀,滤液中再通入硫化氢又产生沉淀,不符合此现象的组是:
某溶液中加入过量盐酸产生沉淀,滤液中再通入硫化氢又产生沉淀,不符合此现象的组是:
A.Hg2+、Al3+、Ba2+、Na+ B.Ag+、Fe3+、Mg2+、Cs+
C.Ag+、Cu2+、Rb+、NH4+ D.Fe2+、Ca2+、Li+、K+.
谁能说明一下为什么 jackie1211年前1
jackie1211年前1 -
 oyeqeoei 共回答了13个问题
oyeqeoei 共回答了13个问题 |采纳率100%加入过量盐酸产生沉淀
根据四个选项排除D
因为D中没有可以与氯离子产生沉淀的
在滤液中通入硫化氢产生沉淀
排除A
因为A中可与S离子产生沉淀的是Hg离子
而前面加入过量盐酸
说明Hg离子已经没有了
故答案为AD1年前查看全部
- 硫化氢为什么不能用浓硫酸干燥?而二氧化硫为什么能?不会被氧化成硫酸吗
 388330791年前3
388330791年前3 -
 qwe22666 共回答了13个问题
qwe22666 共回答了13个问题 |采纳率92.3%H2S具有还原性可以被浓硫酸氧化.但是SO2不能被氧化.+4,+6化合价是相连的,所以不能发生氧化还原反应1年前查看全部
- 除去乙炔中的硫化氢用什么试剂,分离方法是?详细点撒
 海若生1年前1
海若生1年前1 -
 爱_之_殇 共回答了22个问题
爱_之_殇 共回答了22个问题 |采纳率86.4%用硫酸铜溶液,直接把生成的乙炔通入硫酸铜溶液,洗气,即可.因为生成硫化铜沉淀,1年前查看全部
- 氢氧化钠和硫化氢反应的化学方程式(足量和少量)
 xiaoyuerkwy1年前5
xiaoyuerkwy1年前5 -
 jingzhouxue 共回答了20个问题
jingzhouxue 共回答了20个问题 |采纳率80%NAOH+H2S=NAHS+H2O少量硫化氢
NAOH+H2S=NA2S+H2O足量硫化氢1年前查看全部
- 通硫化氢能生成硫化锌沉淀吗?
 petermahero1年前1
petermahero1年前1 -
 纳木错_羚 共回答了18个问题
纳木错_羚 共回答了18个问题 |采纳率83.3%常选择的锌盐是可溶于水的醋酸锌,分子式(CH3COO)2-Zn.反应生成的醋酸不能溶解硫化锌.
反应式如下:
(CH3COO)2-Zn+H2S=2CH3COOH+ZnS.↓1年前查看全部
- (2013•海淀区二模)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的
(2013•海淀区二模)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示.A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液.资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸.
②H2S可与许多金属离子反应生成沉淀.
③H2S在空气中燃烧,火焰呈淡蓝色.
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为______.
②B中的现象是______.
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为______.
④D中盛放的试剂可以是______(填标号).
a.水b.盐酸c.NaCl溶液d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
已知:电离平衡常数:H2SKa1=1.3×10-7;Ka2=7.1×10-15实验操作 实验现象 实验1 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 无明显现象 实验2 将H2S通入Na2SO3溶液中 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 实验3 将SO2通入Na2S溶液中 有浅黄色沉淀产生
H2SO3Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在______条件下,+4价硫的化合物可以氧化-2价硫的化合物.
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______(填序号).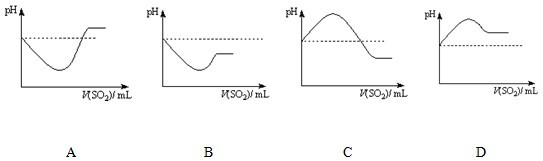
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______. cc11091年前1
cc11091年前1 -
 阿露儿 共回答了15个问题
阿露儿 共回答了15个问题 |采纳率86.7%解题思路:(1)①CuSO4与H2S反应生成CuS沉淀;
②H2S水溶液呈酸性;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+;
④H2S可与碱反应.
(2)①H2S与SO2发生氧化还原反应生成S;
②根据H2SO3 酸性比H2S强判断;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验.(1)①CuSO4与H2S反应生成CuS沉淀,反应的方程式为H2S+CuSO4=CuS↓+H2SO4,故答案为:H2S+CuSO4=CuS↓+H2SO4;
②H2S水溶液呈酸性,可使湿润的蓝色石蕊试纸变红,故答案为:蓝色石蕊试纸变红;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+,反应的离子方程式为H2S+2Fe3+=S↓+2H++2Fe2+,故答案为:H2S+2Fe3+=S↓+2H++2Fe2+;
④H2S有毒,不能排放到空气中,可与碱反应,故答案为:d;
(2)①由实验现象可知反应应下酸性条件下发生氧化还原反应生成S,故答案为:酸性(或酸性较强);
②H2SO3 酸性比H2S强,通入过量的SO2,溶液酸性更强,pH更小,故答案为:C;
(3)如与Ag发生置换反应生成H2,可用点燃的方法检验,但应先将H2S除去,方法是将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应,
故答案为:将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应.点评:
本题考点: 制备实验方案的设计;含硫物质的性质及综合应用.
考点点评: 本题考查实验制备方案的设计,侧重于硫化氢的性质的设计,题目难度不大,注意把握实验原理和实验的基本操作方法的学习.1年前查看全部
- 硫化氢和铁反应吗?
 lkzhangjie1年前1
lkzhangjie1年前1 -
 用左眼微笑的猫 共回答了21个问题
用左眼微笑的猫 共回答了21个问题 |采纳率95.2%干燥时不反应.当有水时,硫化氢形成氢硫酸会部分电离产生氢离子,而单质铁会置换氢离子生成氢气.单质置换氢气与酸性的强弱是没有关系的(氧化性酸例如硝酸除外),只看金属的活动性.随着氢气的产生使氢离子不断被消耗,相当于减少了硫化氢电离的生成物浓度,这时硫化氢的电离方程式不断正移,继续电离出氢离子,如此循环,直到有一种物质被全部反应完.1年前查看全部
- 帮忙写下化学反应离子方程式1.氯化铁溶液中通入硫化氢气体.2.向次氯酸钙溶液中通入二氧化硫.3.硫酸铁的酸性溶液中通入足
帮忙写下化学反应离子方程式
1.氯化铁溶液中通入硫化氢气体.
2.向次氯酸钙溶液中通入二氧化硫.
3.硫酸铁的酸性溶液中通入足量硫化氢.
4.氯化铝溶液中加入过量氨水.
5.碳酸钠溶液中加入过量苯酚.
6.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液. wdy442791年前1
wdy442791年前1 -
 lina138 共回答了21个问题
lina138 共回答了21个问题 |采纳率66.7%晕,不会打小加号和小数字,怎么办
算了,应该看得明白吧.
2Fe3+ + H2S ==2H+ + S↓+ 2Fe
2ClO- + Ca2+ +2H2O+2SO2==2Cl- +CaSO4↓+4H+ + SO4 2-
Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4
Al3+ +3NH3.H2O=Al(OH)3↓+3NH4+
AlCl3+3NH4.H2O==3NH4Cl+Al(OH)3 ↓
Ca2+ +HCO3- +OH-==CaCO3↓+H2O
打到手累1年前查看全部
- (2004•浦东新区模拟)前不久,重庆市发生严重的井喷事件,喷出大量有害气体硫化氢(H2S).硫化氢能溶于水,它的水溶液
(2004•浦东新区模拟)前不久,重庆市发生严重的井喷事件,喷出大量有害气体硫化氢(H2S).硫化氢能溶于水,它的水溶液叫氢硫酸.实验室用固体硫化亚铁(FeS)与稀硫酸在常温下反应制取硫化氢,应选用制取______(填O2或CO2)的发生装置,多余的H2S可用______溶液吸收.
 奈何面1年前1
奈何面1年前1 -
 抛眉眼 共回答了15个问题
抛眉眼 共回答了15个问题 |采纳率80%固体硫化亚铁(FeS)与稀硫酸在常温下反应制取硫化氢属于固体和液体混合反应不需要加热的反应,所以实验室制取二氧化碳的发生装置;硫化氢能溶于水,它的水溶液叫氢硫酸,所以多余的H2S可用碱液吸收例如氢氧化钠溶液.
故答案为:CO2;NaOH.1年前查看全部
- 硫化氢(H2S)是一种有毒气体,密度比空气大,且能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)与稀H2SO4混
硫化氢(H2S)是一种有毒气体,密度比空气大,且能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)与稀H2SO4混合,在常温下反应制得硫化氢气体,同时生成硫酸亚铁.试回答:
(1)实验室制取硫化氢气体的化学方程式为:______;
(2)根据装置图回答下列问题: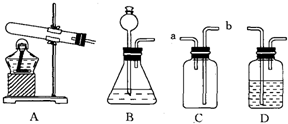
①制取硫化氢气体的发生装置可选用(填序号)______;
②若用C装置收集硫化氢气体,H2S气体应从(填“a”或“b”)______进入,原因是______;
③为验证硫化氢气体的水溶液呈酸性,可将该气体通入装置D中.D中所盛试剂应该是______,现象是______;
④制取H2S气体实验中,多余的气体能否直接排放到空气中?为什么?应怎样处理?______. zings1231年前1
zings1231年前1 -
 sl3397837 共回答了14个问题
sl3397837 共回答了14个问题 |采纳率92.9%(1)实验室制取硫化氢气体的化学方程式为:FeS+H2SO4═FeSO4+H2S↑.
故填:FeS+H2SO4═FeSO4+H2S↑.
(2)①硫化亚铁和稀硫酸反应不需要加热,应该用B装置作为发生装置.
故填:B.
②因为硫化氢气体的密度比空气大,所以H2S气体应从b导管进入.
故填:b;硫化氢气体的密度比空气大.
③为验证硫化氢气体的水溶液呈酸性,可将该气体通入装置D中,D中所盛试剂应该是紫色石蕊试液,现象是溶液由紫色变成红色.
故填:紫色石蕊试液;溶液由紫色变成红色.
④因为硫化氢气体有毒,排放到空气中会污染环境,所以不能把硫化氢排放到空气中;
处理方法:将尾气用氢氧化钠等碱溶液吸收,这是因为氢氧化钠溶液能和硫化氢反应生成硫化钠和水.
故填:不能;因为H2S气体有毒,会污染空气;处理方法:将尾气用氢氧化钠等碱溶液吸收.1年前查看全部
- (1)常温下向20l真空容器中通入amol硫化氢和bmol二氧化硫(a,b都是正整数,且a
 潮汐乘风1年前2
潮汐乘风1年前2 -
 朴原1 共回答了22个问题
朴原1 共回答了22个问题 |采纳率90.9%(1)容器中发生的反应为:2H2S+SO2=3S↓+2H2O,
欲使容器内气的密度(ρ=m÷V,容器的体积一定)最大,则要让容器中的气体质量最大(质量与物质的量成正比,即物质的量最大).
两种气体反应,最后剩余的气体为过量的气体,所以只要让剩余的气体的质量(物质的量)最大,容器内气体的密度最大.要让剩余气体的物质的量最大,则让硫化氢气体和二氧化硫气体的物质的量差值最大即可;
所以欲使容器中气体密度最大,则b取最大值5,a取最大值1即可;
此时硫化氢完全反应,剩余的SO2的物质的量为5-0.5=4.5mol(通过方程式计算可知);
所以容器中气体的质量为m=n×M=4.5mol×64g/mol=288g;
所以此时容器中的气体的密度为:ρ=m÷V=288g÷20L=14.4g/L;
综上所述,容器内气体可能达到的最大密度约是14.4g/mol.
(楼上错误的原因是a取了0,0不是正整数)
(2)根据气体状态方程PV=nRT可知:同问同体积时,压强和物质的量成正比,即P1/P2=n1/n2;所以反应前后容器中气体的总物质的量之比为P1/P2=2:1;
根据反应方程式可知若恰好完全反应则无气体剩余,所以剩余的气体为过量的气体;
设反应前H2S的物质的量为x,SO2的物质的量为y.
①若H2S过量;则有:
(x-2y)/(x+y)=1/2,所以x:y=5:1;
②若SO2过量,则有:
(y-0.5x)/(x+y)=1/2,所以x:y=1:2;
综上所述:反应前H2S和SO2的体积比是5:1或1:2.1年前查看全部
- 求醋酸铅与硫化氢的反应方程式醋酸铅【(CH2COO)2PB】
 jdan05191年前3
jdan05191年前3 -
 正宗cc 共回答了24个问题
正宗cc 共回答了24个问题 |采纳率87.5%(CH3COOH)2Pb+H2S=PbS↓+2CH3COOH
醋酸铅的化学式是(CH3COOH)2P1年前查看全部
- 二氧化硫和硫化氢反应生成琉和水的反应条件?
二氧化硫和硫化氢反应生成琉和水的反应条件?
他们是常温下在空气中就可以反应吗?还是在什么条件下? 876428291年前1
876428291年前1 -
 ljj5399 共回答了13个问题
ljj5399 共回答了13个问题 |采纳率76.9%相遇即反应1年前查看全部
- 同温同压下,同体积的氨气和硫化氢(H 2 S)气体的质量比为______;同质量的氨气和硫化氢(H 2 S)气体在相同条
同温同压下,同体积的氨气和硫化氢(H 2 S)气体的质量比为______;同质量的氨气和硫化氢(H 2 S)气体在相同条件下的体积比为______,所含原子个数比为______;若两者所含氢原子数相等,它们的物质的量比是______.  zhangshi1001年前1
zhangshi1001年前1 -
 leebay 共回答了21个问题
leebay 共回答了21个问题 |采纳率90.5%同温同压下,气体的V m 相等,由n= V V m = m M 可知,同温同压下,同体积的氨气和硫化氢(H 2 S)气体的质量比与气体的摩尔质量成正比,则m(NH 3 ):m(H 2 S)=M(NH 3 ):M(H...1年前查看全部
- 亚硫酸和硫化氢的反应写出方程式
 与谁能共1年前1
与谁能共1年前1 -
 yltd2007 共回答了16个问题
yltd2007 共回答了16个问题 |采纳率81.3%答:
H2SO3+2H2S=3S+3H2O
硫是沉淀1年前查看全部
- 检验氯气,硫化氢,氨气,溴化氢这四种气体,可选用的试纸有:醋酸铅试纸,碘化钾淀粉试纸,酚酞试纸,蓝色石蕊试纸,红色石蕊试
检验氯气,硫化氢,氨气,溴化氢这四种气体,可选用的试纸有:醋酸铅试纸,碘化钾淀粉试纸,酚酞试纸,蓝色石蕊试纸,红色石蕊试纸,假定每种试纸限用一次.以下选择对应试纸的顺序中,正确的是
2135 5423 5312 2134 秋水11111年前1
秋水11111年前1 -
 janezhu200 共回答了13个问题
janezhu200 共回答了13个问题 |采纳率92.3%氯气是淀粉碘化钾 发生的反应时Cl2+2KI===2KCl+I2
硫化氢是醋酸铅 Pb(CH3COO)2+H2S===PbS+2CH3COOH
氨气是湿润的红色石蕊试纸 因为氨气是碱性的
溴化氢则是湿润的蓝色石蕊试纸 因为溴化氢是酸性的
石蕊试纸可以看做是石蕊溶液1年前查看全部
- 化学以弱碱和盐制强碱用硫化氢和硫酸铜溶液可以制硫酸,是弱酸制强酸 那么有没有一种弱碱和盐可以制强碱? 可以多举几个例子吗
 鉃麮钫銄1年前1
鉃麮钫銄1年前1 -
 尼克库博 共回答了23个问题
尼克库博 共回答了23个问题 |采纳率82.6%氨是弱碱,甲基化后生成甲胺,是强碱.其他广义的:水,醇等是弱碱,与金属钠反应生成强碱.碳酸氢钠、碳酸氢钾等是较弱的碱,加热生成碱性较强的碳酸盐.氯化钠电解得到氢氧化钠.还有络合的超强碱,也是用一般强碱制的,但碱性更强.1年前查看全部
大家在问
- 1跪求一篇英语小短文?talk about your school rules 哈哈
- 2英语 动词原型换比较级hard quick kind clear usual real heavy
- 3为什么滑动变阻器不能改变并联电路中的电流?
- 4生物中观察动物和植物细胞用碘液一样吗
- 5说一下初中数学题库有谁了解的告诉下哟,本人先在此感谢大家了米
- 6方程2x²+2x-1=0的两根为x1x2则│x1-x2│=
- 7他 作文
- 81.从前有甲乙两个庄主.甲庄主的土地是乙庄主的4倍,土地的形状都接近正方形.有一天两个庄主打赌,乙庄主说:“我骑马围自己
- 9高中三角函数,求教下面这两个化简分别用了什么公式?
- 10写一封信邀请你的好朋友到动物园附近的书店看书,详细介绍路线.英语,不少于30个单词!
- 11完成一项工程,甲单独工作需要18小时,乙需要24小时,丙需要30小时,现甲、乙、丙按照如下的顺序工作:
- 12解limx→0[cos(sinx)-cosx]/x^4
- 13首字母填空he 's r_____gas after diving a long waywe moved into ne
- 14小青上电影院去看电影,座位票是22排32座,这是电影院最后一排的最旁边的座位.算一算,这个电影院可以坐多少观众?如果每张
- 15listen后面的动词是不是也需要变动词不定式或动词ing?

