沉淀溶解平衡中比如Fe(oH)3=3OH+Fe就这个,一般认为铁离子到了一乘以十的负五次方的时候就是沉淀完全了,但是离子
 papermech2022-10-04 11:39:542条回答
papermech2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 soloveUwhy 共回答了15个问题
soloveUwhy 共回答了15个问题 |采纳率93.3%- 在沉淀溶解平衡中,如果产生沉淀是要看离子浓度与溶度积的关系,即溶度积规则:
Qi > Ksp是,即可以产生沉淀:
例如,对于溶解平衡:Fe(OH)3 = 3OH- + Fe3+
若 c(Fe3+) c(OH-)^3 > Ksp
就可以开始沉淀了.所以取决于Fe3+ 初始浓度和OH-的浓度,查表可以得到Ksp,计算即可. - 1年前
 otzb3h 共回答了75个问题
otzb3h 共回答了75个问题 |采纳率- 那么得用公式了生成物的浓度比上反应物的浓度
- 1年前
相关推荐
- 5.Cu(OH)2在水中存在5.Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s) === Cu 2+(a
5.Cu(OH)2在水中存在5.Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s) === Cu 2+(aq) + 2OH-(aq)在常
5.Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s) === Cu 2+(aq) + 2OH-(aq)在常温下,Ksp=2×10-20 mol3.L-3.某CuSO4溶液中,c(Cu2+)=0.02mol/L,在常温下如果要生成Cu(OH)2沉淀,需要CuSO4溶液中加入碱溶液来调整pH,使溶液的pH大于( ) A、2 B、3 C、4 D、5 133083197671年前2
133083197671年前2 -
 xueqin10 共回答了12个问题
xueqin10 共回答了12个问题 |采纳率91.7%中性溶液中c(OH-)=c(H+)=1*10-7mol3.L-3
当Ksp=2×10-20 mol3.L-3,c(Cu2+)=0.02mol/L时
c(OH-)=0.02mol/L
c(H+)=1*10-5
所以答案是D1年前查看全部
- 同温度下加水可促进沉淀溶解平衡向溶解方向移动,但为什么溶度积不变
 心情飞扬眉吐气1年前1
心情飞扬眉吐气1年前1 -
 syy306027660 共回答了10个问题
syy306027660 共回答了10个问题 |采纳率80%溶度积只和温度有关,加水后沉淀溶解平衡向确实溶解方向移动,离子数增多的同时水也多了,实际上浓度是没有变化的,所以浓度的乘积也没有变化1年前查看全部
- 关于沉淀溶解平衡问题,Hg2Cl2溶液溶解后阳离子是什么?是Hg+离子还是(Hg2)2+呢
 傻爱庚1年前1
傻爱庚1年前1 -
 koichidomoto 共回答了15个问题
koichidomoto 共回答了15个问题 |采纳率93.3%通常亚汞离子是二聚体,有利于稳定,即是(Hg2)2-1年前查看全部
- (2009•梅州模拟)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
(2009•梅州模拟)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
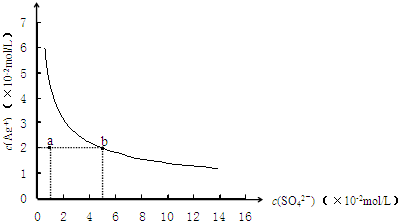
A.含有大量SO42-的溶液中肯定存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 一根天使稻草1年前1
一根天使稻草1年前1 -
 海豚轻吻 共回答了23个问题
海豚轻吻 共回答了23个问题 |采纳率91.3%解题思路:Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)⇌2Ag+(aq)+SO42-(aq),ksp=c2(Ag+)×c(SO42-),处于曲线上的点为饱和状态,随着SO42-浓度的增大,Ag+浓度减小,以此解答该题.A.Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)⇌2Ag+(aq)+SO42-(aq),溶解为可逆过程,溶液中一定存在Ag+,故A正确;
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(SO42-)=0.1mol/L时,c(Ag+)=0.01mol/L,c2(Ag+)×c(SO42-)=1×10-5<ksp,不会生成沉淀,故B正确;
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;
D.a点c(SO42-)=1×10-2mol/L,c(Ag+)=2×10-2mol/L,c2(Ag+)×c(SO42-)=4×10-6<ksp,不是饱和溶液,温度升高,物质溶解度也增大,溶度积常数增大,蒸发不能使溶液由a点变到b点,故D错误.
故选AB.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的计算,题目难度中等,注意把握溶度积的计算,并以此判断溶液是否饱和,为解答该题的关键.1年前查看全部
- (2014•合肥一模)在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,
 (2014•合肥一模)在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )
(2014•合肥一模)在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )
A.在t℃时,AgBr的Ksp为4.9×10-13
B.图中b点对应的是向AgBr饱和溶液中加入NaBr固体后的溶液
C.图中a点对应的是AgBr的不饱和溶液
D.AgCl沉淀能较容易转化为AgBr沉淀 muyi_jq1年前1
muyi_jq1年前1 -
 windsup 共回答了16个问题
windsup 共回答了16个问题 |采纳率93.8%解题思路:A.根据图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为4.9×10-13;
B.在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小;
C.在a点时Qc<Ksp,故为AgBr的不饱和溶液;
D.溶解度小沉淀转互为溶解度更小的沉淀容易实现.A.根据图中c点的c(Ag+)=7×10-7mol/L、c(Br-)=7×10-7mol/L,则该温度下AgBr的Ksp=c(Ag+)×c(Br-)=4.9×10-13,故A正确;
B.在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小,b点与c点相比只增大了溴离子的浓度,故B错误;
C.在a点时Qc<Ksp,故a点为AgBr的不饱和溶液,故C正确;
D.溶解度小沉淀转互为溶解度更小的沉淀容易实现,已知AgCl的溶解度比AgBr的溶解度大,所以AgCl沉淀能较容易转化为AgBr沉淀,故D正确;
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了沉淀溶解平衡曲线,曲线为饱和溶液,曲线以上为过饱和溶液,以下为不饱和溶液,要掌握Ksp及简单计算,题目难度不大.1年前查看全部
- 向溶液中加入氢氧化钠有利于三价铁沉淀 理由写方程式.写水解平衡还是沉淀溶解平衡?
向溶液中加入氢氧化钠有利于三价铁沉淀 理由写方程式.写水解平衡还是沉淀溶解平衡?
我能分出电离水解平衡和沉淀溶解平衡 但是对于氢氧化铁这样电离和溶解度都不大的物质 感觉不太好理解 殴打杨千桦1年前2
殴打杨千桦1年前2 -
 圣章鱼 共回答了10个问题
圣章鱼 共回答了10个问题 |采纳率100%如果加入极少量的NaOH,那么仅仅是改变溶液的pH,增加了氢氧根离子的浓度,这样,以下三个平衡会往左进行.
Fe(OH)3 = [Fe(OH)2]+ +OH-
[Fe(OH)]2 + = [ Fe(OH)] 2+ +OH-
[ Fe(OH)] 2+ = Fe 3+ +OH-
以上三个平衡就是分步电离,就是挨个电离出氢氧根离子,也可以写成一个:
Fe(OH)3 = Fe 3+ + 3OH-
这个过程主要是跟pH有关系的,就是电离水解平衡
当然如果加入大量的氢氧化钠,就是直接沉淀啦,这就跟离子积常数Ksp,也就是电离水解平衡有关了.
这是高中化学吗,如果是,那么以上回答就没问题了.
不过往深了说,这题这么问其实没什么意义,根本就是跟这两个都有关的,氢氧化铁其实是很复杂的一个基团,里面有三价铁带一个氢氧根,或者带两个氢氧根,可以吸引负价离子( Lewis Base),巴拉巴拉,反正挺复杂,不过上面的应该是够用了~1年前查看全部
- 某温度时,BaSO 4 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是 [
某温度时,BaSO 4 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是 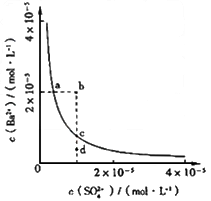 [ ]
[ ]A.加入Na 2 SO 4 可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO 4 沉淀生成
D.a点对应的Ksp大于c点对应的Ksp 卡卡goal1年前1
卡卡goal1年前1 -
 hy52415241 共回答了8个问题
hy52415241 共回答了8个问题 |采纳率100%C1年前查看全部
- 磷酸钙在水中存在的沉淀溶解平衡的方程式
 jzkdjzkd1年前1
jzkdjzkd1年前1 -
 deepcoolsea 共回答了11个问题
deepcoolsea 共回答了11个问题 |采纳率100%Ca3(PO4)2=可逆号=3Ca2+ + 2PO43- ( 2PO43-中4是下角标,3-是上角标
)1年前查看全部
- (2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡
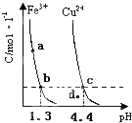 (2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳
(2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳
离子浓度随溶液pH的变化如图所示.下列判断正确的是( )
A.加适量浓NH3•H2O可使溶液由a点变到b点
B.c、d两点代表的溶液中c(H+)与c(OH-)乘积不相等
C.Cu(OH)2在c点比在d点代表的溶液中溶解程度小
D.该温度下,氢氧化铁的Ksp[Fe(OH)5大于氢氧化铜的Ksp[Cu(OH)2] 苦涩的小草1年前1
苦涩的小草1年前1 -
 kafeiggw9 共回答了21个问题
kafeiggw9 共回答了21个问题 |采纳率95.2%解题思路:A.由a点变到b点,pH增大;
B.Kw只与温度有关,与溶液的酸碱性无关;
C.注意分析处在曲线上的点与曲线外的点有什么区别;
D.根据图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,可用b、c进行计算.A.向溶液中加入氨水,溶液的pH增大,则铁离子浓度降低,所以可以由a点变到b点,故A正确;
B.只要温度不发生改变,溶液中c(H+)与c(OH-)的乘积(即Kw)就不变.该题中温度条件不变,故c、d两点代表的溶液中c(H+)与c(OH-)的乘积相等,故B错误;
C.在C点表示饱和溶液,在d点表示不饱和溶液,所以Cu(OH)2在c点比在d点代表的溶液中溶解程度大,故C错误;
D.由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)•(OH-)3=c(Fe3+)•(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)•(OH-)2=c(Cu2+)•(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故D错误;
故选A.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查沉淀溶解平衡、溶度积、pH、水的离子积等知识点,对图象中的数据进行定量或定性处理,找出数据(或坐标点)之间存在的相互关系;明确坐标点所表达的涵义;对溶度积和水的离子积有正确的理解.1年前查看全部
- 难容电解质的沉淀溶解平衡在2mL含有物质的量浓度相等的NaCl和NaI的混合溶液中滴入几滴AgNO3溶液,发生的反应为
难容电解质的沉淀溶解平衡
在2mL含有物质的量浓度相等的NaCl和NaI的混合溶液中滴入几滴AgNO3溶液,发生的反应为
A、只有AgCl沉淀生成 B、只有AgI沉淀生成
C、生成等物质的量的AgCl和AgI沉淀 D、两种沉淀都有,但以AgI为主
答案是B,又没错?
有一种解释是“因为溶液中的离子均匀分布,银离子遇到的不会都是碘离子,故也有氯化银生成。也许你会感到奇怪,氯化银遇碘离子不是会转化为碘化银吗?但你不要忘了,在溶液中,氯化银也存在溶解平衡!所以一定会有氯化银的(很少很少)。”我觉得挺有道理的,那不是和B冲突了吗? 永远完治0361年前2
永远完治0361年前2 -
 eyu117 共回答了18个问题
eyu117 共回答了18个问题 |采纳率88.9%答案就是B,首先是容易沉淀的先沉淀,也就是Ksp最小的先沉淀,而AgI 的Ksp比AgCl的要小,所以先沉淀,况且只有几滴的AgNO3,所以答案是B,希望可以帮到你哦,亲~1年前查看全部
- 几道沉淀溶解平衡里的选择题~~~ 大家帮忙看看啊~~谢谢谢谢
几道沉淀溶解平衡里的选择题~~~ 大家帮忙看看啊~~谢谢谢谢
1.CuS沉淀可溶解于:A热浓硝酸 B浓氨水 C盐酸 D醋酸
麻烦再解释一下为啥~~
2.欲将AgCl、AgBr、AgI 混合物中的AgCl分离出来,适宜的试剂为:A氨 B硫代硫酸钠 C锌 D碳酸铵
再加一道大题吧~~
饮用含有过量硫酸根的水会引起腹泻,故规定饮用水中硫酸根离子浓度不得超过2.6X10^-3mol/l.若天然水流经含有石膏的土壤,被硫酸钙饱和,请问此水还能引用么?一直KspCaSO4
我不明白的就是被饱和的意思,是说流经以后水就变成了硫酸钙的饱和溶液?那要计算能否饮用就是计算硫酸根离子浓度吧?但是没有给钙离子浓度 所以我想是“被饱和”是有什么深层次的意思?比如就像硫化氢饱和溶液是0.1mol/l那样 毒谷的蓝1年前1
毒谷的蓝1年前1 -
 03121687 共回答了14个问题
03121687 共回答了14个问题 |采纳率92.9%1、选A,因为:CuS+10HNO3(浓)=Cu(NO3)2+H2SO4+8NO2↑+4H2O
2、选A,因为:AgC1+2NH3·H2O=[Ag(NH3)2]Cl+2H2O
溴化银、碘化银不溶解
3、被饱和的意思,是说流经以后水就变成了硫酸钙的饱和溶液,就是这样.一般说,硫酸根与钙离子浓度相等的.
KspCaSO4 =4.93×10-5,就是C(Ca2+)×C(SO42-)=KspCaSO4 =4.93×10-5,而C(Ca2+)=C(SO42-)
所以C(SO42-)=√4.93×10-5=7.02×10-3mol/L>2.6X10^-3mol/l,不能饮用.1年前查看全部
- 下列情况哪些用可逆符号和箭头化学反应平衡、电离平衡、水解平衡、沉淀溶解平衡在高中化学选修范围内,这些情况下什么时候要用可
下列情况哪些用可逆符号和箭头
化学反应平衡、电离平衡、水解平衡、沉淀溶解平衡
在高中化学选修范围内,这些情况下什么时候要用可逆符号什么时候等号,什么时候可以加气体符号沉淀符号什么时候不能? haode_12341年前2
haode_12341年前2 -
 侃153座大山 共回答了15个问题
侃153座大山 共回答了15个问题 |采纳率93.3%像强电解质电离、水解、沉淀溶解可以用等号,但弱电解质只能用可逆号.注意沉淀溶解平衡中不一定可溶才用等号,一定要分清几种常见强弱电解质的这些性质,经常用到.
又产生气体或沉淀就可以用气体符号和沉淀符号.1年前查看全部
- 高中化学沉淀溶解平衡这一节特别难,有没有什么经验?或者有生么需要特别注意的地方?
高中化学沉淀溶解平衡这一节特别难,有没有什么经验?或者有生么需要特别注意的地方?
还有要写化学方程式的时候,有时候连产物都搞不清楚,怎么办?
就像S有+6,+4,0价,有时候根据氧化乎还原反应原理知道化合价要升高,就是不知道升到+4价还是+6家 ypwdd1年前5
ypwdd1年前5 -
 lybpxc 共回答了14个问题
lybpxc 共回答了14个问题 |采纳率92.9%可以用口诀背,按氧化还原规律来写方程式,我也是高中生,学多了就好了1年前查看全部
- 用沉淀溶解平衡原理,说明用碳酸钡除去食盐中钙离子,硫酸根的根据和条件?
 donna65621年前1
donna65621年前1 -
 冰点坠儿 共回答了14个问题
冰点坠儿 共回答了14个问题 |采纳率100%由于25度时,饱和溶液中
碳酸钡的浓度积2.58×10^-9, 碳酸钙的浓度积3.36×10^-9 ,硫酸钡的浓度积10.8×10^-9
碳酸钡放入水中以后,溶解,溶液中的钡离子与原来的硫酸根离子结合成浓度积更高的硫酸钡,而碳酸根离子则与钙离子形成碳酸钙.使得溶液中碳酸根离子和钡离子的浓度减小,碳酸钡的溶解平衡破坏,向正反应方向进行,最终导致碳酸根离子和钡离子的耗竭,同事也除去了原来溶液中的钙离子和硫酸根离子1年前查看全部
- 下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是
1.热纯碱溶液的洗涤油污能力强 2.误将钡盐【BaCl、Ba(NO3)2】当作食盐食用时,常用0.5%的Na2SO4溶液解毒 3.溶洞珊瑚的形成 4.碳酸钡不能做“钡餐”而硫酸钡则能 5.泡抹灭火器的原理
A.234 B.123 C.345 D.12345
要解析 seseggg1年前1
seseggg1年前1 -
 kicky_ty 共回答了20个问题
kicky_ty 共回答了20个问题 |采纳率80%选A.
1利用的是Na2CO3的水解生成OH-.
2利用Ba2+ +SO42-=BaSO4↓的沉淀反应.
3利用Ca(HCO3)2、CaCO3的转换.
CaCO3+H2O+CO2=Ca(HCO3)2
Ca(HCO3)2=CaCO3↓+H2O+CO2↑
4.利用BaSO4不能溶于盐酸,BaCO3可以溶于HCl.
5.利用Al2(SO4)3和NaHCO3溶液反应,产生二氧化碳来灭火的.1年前查看全部
- (2009•宣城三模)在一定温度下,氢氧化镁存在如下沉淀溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq
(2009•宣城三模)在一定温度下,氢氧化镁存在如下沉淀溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq)试推断氢氧化镁在下列物质中的溶解度最大的是( )
A.0.1mol•L-1MgCl2溶液
B.0.1mol•L-1KOH溶液
C.0.1mol•L-1KCl溶液
D.0.1mol•L-1NH4Cl溶液 重庆麻辣烫1年前0
重庆麻辣烫1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数
下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是( )
A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka•Kh lunest1年前1
lunest1年前1 -
 不服就干 共回答了19个问题
不服就干 共回答了19个问题 |采纳率94.7%解题思路:A.K值越大,反应物的转化率越大、生成物的量越大;
B.根据Ksp与离子积Qc的相对大小确定难溶物是否产生或溶解;
C.平衡常数只有温度有关,与浓度无关;
D.Kw=c(H+).c(OH-)=
.c(H+).c(A−) c(HA)
.c(OH−).c(HA) c(A−) A.K值越大,反应物的转化率越大、生成物的量越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了,故A正确;
B.根据Ksp与离子积Qc的相对大小确定难溶物是否产生或溶解,如果Ksp>Qc,则难溶物没有沉淀生成,如果Ksp=Qc,则溶液恰好饱和,如果Ksp<Qc,则有沉淀生成,故B正确;
C.平衡常数只有温度有关,与浓度无关,如果化学反应正反应是放热反应,升高温度化学平衡常数减小,故C错误;
D.Kw=c(H+).c(OH-)=
c(H+).c(A−)
c(HA).
c(OH−).c(HA)
c(A−)=Ka•Kh,故D正确;
故选C.点评:
本题考点: 化学平衡常数的含义.
考点点评: 本题考查了平衡常数的有关知识,知道平衡常数的含义、表达式,平衡常数只与温度有关,弱电解质的电离平衡常数与溶液酸碱性无关、溶液浓度无关,为易错点.1年前查看全部
- 常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,Ksp(CaSO4)=910-6.下列说法中正确的是( )
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,Ksp(CaSO4)=910-6.下列说法中正确的是( )
 A. 通过蒸发可以使溶液由d点变到c点
A. 通过蒸发可以使溶液由d点变到c点
B. a点对应的Ksp等于c点对应的Ksp
C. 常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点
D. b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L 凌晨五点五四1年前1
凌晨五点五四1年前1 -
 sxj12 共回答了19个问题
sxj12 共回答了19个问题 |采纳率89.5%解题思路:该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不是平衡状态,
A.蒸发使离子浓度增大,d点不可能到c点;
B.Ksp与温度有关,a和c的Ksp相等;
C.常温下CaSO4饱和溶液中,c(Ca2+)=c(SO42-);
D.b点Qc>Ksp.A.d为不饱和溶液,蒸发时硫酸根的浓度会增大,所以蒸发使离子浓度增大,d点不可能到c点,故A错误;
B.Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故B正确;
C.常温下CaSO4饱和溶液中,c(Ca2+)=c(SO42-),而曲线上的点所表示的c(Ca2+)与c(SO42-),不一定相同,故C错误;
D.d根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO4-)会小于4×l0-3mol/L,由于c(Ca2+)>c(SO42-),则c(SO4-)小于3×l0-3mol/L,故D错误.
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了沉淀溶解平衡的应用,图象分析应用,溶度积计算分析,平衡移动方向的判断,关键是计算混合溶液中钙离子浓度和硫酸根离子浓度,题目难度中等.1年前查看全部
- 某温度时,BaSO 4 在水中的沉淀溶解平衡:BaSO 4 (s) Ba 2 + (aq)+SO 4 2- (aq) K
某温度时,BaSO 4 在水中的沉淀溶解平衡:BaSO 4 (s)
 Ba 2 + (aq)+SO 4 2- (aq) K sp =c(Ba 2 + )·c(SO 4 2- ),沉淀溶解平衡曲线如图所示。下列说法正确的是
Ba 2 + (aq)+SO 4 2- (aq) K sp =c(Ba 2 + )·c(SO 4 2- ),沉淀溶解平衡曲线如图所示。下列说法正确的是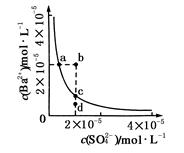
A.b点时c(Ba 2 + )·c(SO 4 2- )小于K sp B.a点对应的K sp 等于c点对应的K sp C.加水稀释可以使溶液由b点变到c点 D.加入适量的Na 2 SO 4 不可能使溶液由a点变到c点  limmlao1年前1
limmlao1年前1 -
 乖乖猪脑壳 共回答了23个问题
乖乖猪脑壳 共回答了23个问题 |采纳率91.3%B
1年前查看全部
- 求大神罗列化学平衡,电离平衡,沉淀溶解平衡常数的表达式。急急急
 丢雨1年前1
丢雨1年前1 -
 惊羡无语 共回答了1个问题
惊羡无语 共回答了1个问题 |采纳率100%生成物浓度幂之积除以反应物浓度幂之积,固态物质和水无浓度1年前查看全部
- 关于溶度积~假设碳酸钡的溶度积为a,那么将适量碳酸钡固体溶于水,达到沉淀溶解平衡,那么此时溶液中钡离子的浓度为根号a吗?
关于溶度积~
假设碳酸钡的溶度积为a,那么将适量碳酸钡固体溶于水,达到沉淀溶解平衡,那么此时溶液中钡离子的浓度为根号a吗?答案竟然是大于根号a,是因为碳酸根离子水解的缘故吗? hk82s6m1年前2
hk82s6m1年前2 -
 wuhuaguo 共回答了21个问题
wuhuaguo 共回答了21个问题 |采纳率85.7%是的.
如果不考虑水解的话,如下平衡:BaCO3 =可逆= Ba2+ + CO32-
达到平衡时,钡离子的浓度=根号a
但是现在要考虑水解,那么碳酸根会被消耗,所以碳酸钡的电离平衡会向右移动,则Ba2+浓度大于根号a1年前查看全部
- (1)已知t℃时AgCl的Ksp=2×10-10(2)在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法
(1)已知t℃时AgCl的Ksp=2×10-10(2)在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正
 (1)已知t℃时AgCl的Ksp=2×10-10
(1)已知t℃时AgCl的Ksp=2×10-10
(2)在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A.在t℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/L AgNO3溶液滴定20mL 0.01mol/L KCl和0.01mol/L的K2CrO4的混和溶液,Cl-先沉淀
D.在t℃时,AgCl的溶解度大于Ag2CrO4
 67432811年前1
67432811年前1 -
 ldssxy 共回答了13个问题
ldssxy 共回答了13个问题 |采纳率100%A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag+CrO42-,
Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A错误;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B错误;
C、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=
10?12
0.01=10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=
2×10?10
0.01=2×10-8mol/L,所以先析出氯化银沉淀,故C正确;
D、则S(AgCl)=
Ksp=
2×10?10=1.41×10-5,而S(Ag2CrO4)=
3
KSP
4
=
32
2×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,故D错误;
故选C.1年前查看全部
- 无机化学沉淀溶解平衡题!求高手!
无机化学沉淀溶解平衡题!求高手!
0.100molBaSO4(Ksp=1.5*10^-9)和0.200molSrCrO4(Ksp=3.6*10^-5)放入1升水中,建立了平衡.问此溶液在平衡时各离子浓度为多少?(不考虑水解)
(Ksp,BaCrO4=8.5*10^-11,Ksp,SrSO4=7.6*10^-7).(假设混合后溶液的体积为1升)
答案是[Ba2+]=1.4*10^-8mol/L,[SO42-]=1.3*10^-4mol/L,[Sr2+]=6.0*10^-3mol/L,[CrO42-]=6.0*10^-3mol/L
求具体解题过程方法解释啊啊!
 zl8208171年前1
zl8208171年前1 -
 夜幕降临后 共回答了16个问题
夜幕降临后 共回答了16个问题 |采纳率87.5%1,根据判断,重铬酸被BaCrO4 的溶解度最小(Ksp,BaCrO4=8.5*10^-11,),那么BaSO4沉淀最终转化为BaCrO4 .
2,0.200molSrCrO4(Ksp=3.6*10^-5)此物质过量,且溶度积最高.假设反应完全的话,还有0.100molSrCrO4,溶度积仍然是Ksp=3.6*10^-5,那么计算Sr2+]=6.0*10^-3mol/L,[CrO42-]=6.0*10^-3mol/L.
3,根据Ksp,BaCrO4=8.5*10^-11,[CrO42-]=6.0*10^-3mol/L.那么[Ba2+]=1.4*10^-8mol/L,
4,根据Ksp,SrSO4=7.6*10^-7).Sr2+]=6.0*10^-3mol/L,那么,[SO42-]=1.3*10^-4mol/L,[
步骤就是:
1,找出最难溶的物质,那么沉淀最终是它,
2,找出反应后,溶液中溶度积最高的物质,并计算这2者离子浓度
3,根据溶度积最高的物质离子浓度计算最难溶的物质离子的浓度
4,计算剩余离子浓度!1年前查看全部
- 盐类水解和沉淀溶解平衡翻译成英语
 ly3175071041年前1
ly3175071041年前1 -
 bubu猫 共回答了21个问题
bubu猫 共回答了21个问题 |采纳率90.5%盐类水解
salt hydrolysis
沉淀溶解平衡
sediment dissolving equilibrium1年前查看全部
- 下列关于化学平衡常数(K),电离平衡常数(K a 或K b ),水解平衡常数(K h ),沉淀溶解平衡常数(K sp )
下列关于化学平衡常数(K),电离平衡常数(K a 或K b ),水解平衡常数(K h ),沉淀溶解平衡常数(K sp ),水的离子积常数(K w )的叙述中错误的是
A.K值越大,正反应进行的程度越大,一般地说,K>10 5 时,该反应进行得就基本完全了 B.比较K sp 与离子积Q c 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 C.K、K a 或K b 、K h 、K sp 、K w 都与温度有关,温度越高,常数值越大 D.弱酸HA的K a 与NaA的K h 、水的离子积常数K w 三者间的关系可表示为:K w =K a ·K h  Premo_light1年前1
Premo_light1年前1 -
 mailinda5201314 共回答了20个问题
mailinda5201314 共回答了20个问题 |采纳率100%C
1年前查看全部
- CA(OH)2 的沉淀溶解平衡 正反应是吸热的吗?
 短发翘呀翘1年前2
短发翘呀翘1年前2 -
 shore1111 共回答了18个问题
shore1111 共回答了18个问题 |采纳率77.8%溶解过程的热效应:物质的溶解包括以下两个过程:
⑴物理过程:溶质分子或离子的扩散过程,是一个吸热过程;
⑵化学过程:物质分子或离子与水结合形成水合分子或水合离子的过程,是一个放热过程.
某种物质溶于水是吸热还是放热则是物理过程和化学过程的综合结果.例如:浓硫酸、NaOH,CA(OH)2等溶解于水时明显放热1年前查看全部
- 达到沉淀溶解平衡时,溶液是否饱和?为什么.
 剩余工时1年前3
剩余工时1年前3 -
 马从 共回答了18个问题
马从 共回答了18个问题 |采纳率94.4%一定是饱和的,如果不饱和则体系还会向溶解的方向进行也就是说未达到平衡;
请采纳.1年前查看全部
- 有关沉淀溶解平衡已知25℃时,AgI饱和溶液中c(ag+)为1.22*10^-8mol/L,AgCl的饱和溶液中c(Ag
有关沉淀溶解平衡
已知25℃时,AgI饱和溶液中c(ag+)为1.22*10^-8mol/L,AgCl的饱和溶液中c
(Ag+)为1.25*10^-5.若在5ml含有KCl和KI各为0.01mol/L的溶液中,加入8ml0.01mol/LAgNO3溶液,计算最终溶液中c(Cl-)约为_________ (保留二位有效数字)
5×10^-3, 枫叶题诗1年前1
枫叶题诗1年前1 -
 neth 共回答了21个问题
neth 共回答了21个问题 |采纳率85.7%两溶液混合后,c(Ag+)=0.01*8/13=6.15*10^-3,由于AgI的Ksp1年前查看全部
- 沉淀溶解平衡常数越大,溶解度如何变化
 偶爱向日葵少年1年前1
偶爱向日葵少年1年前1 -
 高兴就好330 共回答了23个问题
高兴就好330 共回答了23个问题 |采纳率78.3%溶解度不一定变大.平衡常数变大,其浓度单位是摩尔/升,而溶解度单位是可/100克溶剂.不能之间关联的.1年前查看全部
- 氯化银在水中是强电解质,那就不存在电离平衡了?那为什么会有沉淀溶解平衡?不是变成氯离子和银离子就不可以再返回去了吗?
氯化银在水中是强电解质,那就不存在电离平衡了?那为什么会有沉淀溶解平衡?不是变成氯离子和银离子就不可以再返回去了吗?
为什么啊 wz20988891年前1
wz20988891年前1 -
 东门扫地 共回答了21个问题
东门扫地 共回答了21个问题 |采纳率90.5%说的是已经溶解的氯化银是完全电离的,达到溶解平衡时,CL-和Ag+的浓度不再变化,但溶解平衡还是存在的,即CL-和Ag+结合成固体AgCl的速度和AgCl溶解的 是相等的.1年前查看全部
- 升高温度沉淀溶解平衡常数变小的物质有哪些?
 yykai1年前2
yykai1年前2 -
 床上里的温度 共回答了10个问题
床上里的温度 共回答了10个问题 |采纳率100%Ca(OH)2
看溶解度大小变化就可以了 溶解度变小,那么溶解平衡常数也变小1年前查看全部
- 硫化亚铁除去废水中的重金属比硫化氢好?学到 沉淀溶解平衡
 丝丝妖气1年前1
丝丝妖气1年前1 -
 紫色尘埃 共回答了29个问题
紫色尘埃 共回答了29个问题 |采纳率86.2%重金属离子比如铜离子 锌离子 汞离子等 都可以和硫离子或硫化氢或硫化亚铁等生成极难溶于水的金属硫化物而达到除去重金属离子的目的 因为硫化氢溶于水后形成的氢硫酸是弱电解质 而弱电解质的电离微弱 而硫化亚铁是盐 可以直接和重金属离子反应生成比硫化亚铁溶度积更小的金属硫化物 所以等量的硫化亚铁比硫化氢能与更多的重金属离子反应 即硫化亚铁比硫化氢效果好1年前查看全部
- 硫酸钡不溶于酸原因,用沉淀溶解平衡解释
 lishuo55011年前1
lishuo55011年前1 -
 囊萤映雪1976 共回答了19个问题
囊萤映雪1976 共回答了19个问题 |采纳率89.5%硫酸钡溶于浓硫酸,通过形成Ba(HSO4)21年前查看全部
- 沉淀溶解平衡实验时的问题2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1
沉淀溶解平衡实验时的问题
2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol/L硝酸铅溶液,观察首先生成黄色沉淀还是黑色沉淀?离心沉降后向清液中加2滴0.1mol/L硝酸铅溶液,会出现什么沉淀?
我的问题是,实验的时候我看到先生成的是黄色沉淀,后来清液中生成的也是黄色的.但是硫化铅的沉淀溶解系数小于铬酸铅的,为什么先生成铬酸铅?是我看错了?后来清液中的铬酸铅是怎么生成的. zzg20081年前1
zzg20081年前1 -
 fchisking 共回答了20个问题
fchisking 共回答了20个问题 |采纳率90%选C 加入生石灰,发生反应CaO + H2O === Ca(OH)2 由于本来已经是悬浊液(饱和),加入CaO,不改变溶液中各微粒的浓度.(B、D)但由于反应消耗了水1年前查看全部
- 几个关于沉淀溶解平衡的小问题.谢谢!
几个关于沉淀溶解平衡的小问题.谢谢!
第一个是判断题
1.向氯化银沉淀中加入氯化钠固体,氯化银沉淀的溶解度不不变
请问,上面说的对吗?原因,谢谢!
第二个是填空题
1.向饱和碘化银溶液中加入固体硝酸银,则I-的浓度会怎样变化?原因?
2.若改用溴化银固体,则I-的浓度如何变化,Ag+的浓度如何变化?原因?
已知 溶解度:氯化银>溴化银>碘化银>硫化银
谢谢,一定要写明原因,谢谢 蔚蓝琴空1年前2
蔚蓝琴空1年前2 -
 jinbinqi123 共回答了17个问题
jinbinqi123 共回答了17个问题 |采纳率88.2%1、不对,溶解度应该是减小才对
AgCl溶水后很少部分电离为银离子和氯离子
而NaCl溶于水也有氯离子生成
使AgCl的溶解平衡左移
导至AgCl的溶解度降低
2、减少
AgI =可逆= Ag+ + I-
增加 增加 减少
因为溴化银>碘化银,所以碘化银沉淀不会变少,加入溴化银反应而会促使碘化银增多
I-的浓度变小,Ag+的浓度不变吧1年前查看全部
- 硫化亚铁和硫化铁在水中的沉淀溶解平衡方程式?
 erstd1年前1
erstd1年前1 -
 修道的魊 共回答了12个问题
修道的魊 共回答了12个问题 |采纳率91.7%FeS=====Fe2+ + S2-1年前查看全部
- 大学无机沉淀溶解平衡 欲使0.10mol的MnS和CuS溶于1.0L盐酸中,问所需盐酸的最低浓度各是多少?
大学无机沉淀溶解平衡 欲使0.10mol的MnS和CuS溶于1.0L盐酸中,问所需盐酸的最低浓度各是多少?
题目答案是先算溶解MnS所需盐酸,再算CuS的,然后相加
我认为这个方法不太对 我是列出总方程式MnS+CuS+4H+=2H2S+Mn2+Cu2+
然后再求所需盐酸
请问哪个正确? tom2161年前0
tom2161年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 沉淀溶解平衡19,在2mL物质的量浓度相等的和NaI溶液中滴入几滴AgNO3溶液,发生的反应为( )(已知Ksp(AgI
沉淀溶解平衡
19,在2mL物质的量浓度相等的和NaI溶液中滴入几滴AgNO3溶液,发生的反应为( )(已知Ksp(AgI) > Ksp(AgCl))
A.只有AgCl沉淀生成 B.只有AgI沉淀生成
C.生成等物质的量的AgCl和AgI沉淀 D.两种沉淀都有,但以AgI为主
为什么答案说选B?
我觉得选D 含金量1年前2
含金量1年前2 -
 wshunfu1123 共回答了17个问题
wshunfu1123 共回答了17个问题 |采纳率88.2%Ksp(AgI) > Ksp(AgCl))的含义是生成AgI比生成AgCl沉淀更稳定
即,反应都生成AgI之后,才可以生成AgCl.
当然,你的认为是正确的.但很显然这道题是一道高中水平的题,不严谨.他强调的是一种反应优先.对于Ksp没有给出限定条件具体数值.因为我们真正计算该问题时,比较的是Ksp* C的大小.浓度是变化的,在I-到达一定低浓度时就会生成AgCl沉淀了,因为此时生成AgCl更容易.
但这道题题目说“滴入几滴AgNO3溶液”,暗示一种Ag+少量的感觉,回答选B是可以理解的.但决不是说就科学,我们可以假设:2mL物质的量浓度相等的(NaCl)和NaI溶液很稀,滴入几滴很浓AgNO3,那么就不好说了,甚至不产生沉淀.这所谓老师所讲:不要将竞赛带入日常学习,不要死板.因为练习题大多还是不那么精准的1年前查看全部
- 沉淀溶解平衡的过程是可逆的单拿这句话是对是错,我要确定的答案,
 没情趣的男人1年前2
没情趣的男人1年前2 -
 水蓝拖鞋 共回答了18个问题
水蓝拖鞋 共回答了18个问题 |采纳率83.3%是对的,这就是沉淀溶解平衡,Ksp.
☆⌒_⌒☆ 希望可以帮到you~1年前查看全部
- 在沉淀溶解平衡中AGCL H+ + OH- 水的电离总是H+ 与OH-的离子浓度一样.还是...
 多岁年1年前3
多岁年1年前3 -
 tpmf52bi_s0699 共回答了21个问题
tpmf52bi_s0699 共回答了21个问题 |采纳率90.5%不是!
因为Ag+还可以和溶液中的OH-有一个水解平衡
如果说,AgCl溶解在水里,溶液中C(Cl-)=C(H+)1年前查看全部
- 任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示对吗?
 dhhceeq1年前1
dhhceeq1年前1 -
 gangling2007 共回答了19个问题
gangling2007 共回答了19个问题 |采纳率94.7%不完全正确,非电解质不存在电离平衡,就不能用Ksp了,如铁块、硫粉、白磷、塑料等等;应该说是难溶的电解质都能用Ksp来表示!
而且Ksp不光能用来表示难溶的电解质,只要电解质溶液达到饱和,并析出电解质,也可以用Ksp表示!1年前查看全部
- 举例说明,什么是沉淀溶解平衡中的同离子效应?
 2794944141年前2
2794944141年前2 -
 Tracy23 共回答了16个问题
Tracy23 共回答了16个问题 |采纳率81.3%沉淀溶解平衡:适用于溶解度较高的物质的饱和溶液,氯化钠、硫酸钠的饱和溶液中存在沉淀溶解平衡.
同离子效应:两种含有相同离子的盐(或酸、碱)溶于水时,它们的溶解度(或酸度系数)都会降低,这种现象叫做同离子效应.在弱电解质的溶液中,如果加入含有该弱电解质相同离子的强电解质,就会使该弱电解质的电离度降低的效应.同理,在电解质饱和溶液中,加入含有与该电解质相同离子的强电解质,也会降低该电解质的溶解度.
例子:如在醋酸溶液中加入少量固体醋酸钠,可以降低醋酸的电离度;如在氨水中加入氯化铵,可以降低氨的电离度;1年前查看全部
- 沉淀溶解平衡,求离子浓度已知25°C时,Ksp(AgCl)=1.8*10^-10 Ksp(AgBr)=4.9*10^-1
沉淀溶解平衡,求离子浓度
已知25°C时,Ksp(AgCl)=1.8*10^-10 Ksp(AgBr)=4.9*10^-13
现在向0.001mol/L的KBr和0.01mol/L的KCl混合溶液中滴加0.1mol/L的AgNO3溶液
(反应过程中的溶液体积变化忽略不计)
当出现Agcl沉淀时,c(Br-)= 月光之夜1年前1
月光之夜1年前1 -
 freebrook 共回答了20个问题
freebrook 共回答了20个问题 |采纳率90%由Ksp比较得知:AgBr先沉淀.
当AgCl开始沉淀时,溶液中的c(Ag+)为:
c(Ag+)c(Cl-) = Ksp(AgCl)
c(Ag+) = 1.8*10^-10 / 0.01 = 1.8*10^-8 (mol/L)
此时:
c(Br-) = Ksp(AgBr) / c(Ag+)
= 4.9*10^-13 /1.8*10^-8
= 2.72*10^-5 (mol/L)1年前查看全部
- 高中化学沉淀溶解平衡部分(高手进)
高中化学沉淀溶解平衡部分(高手进)
已知常温下FeS的Ksp=6.25×10的负18次方.
(1)常温下FeS的溶解度为____________(设饱和溶液的密度为1 g·cm^3)
(2)在常温下将过量的FeS投入到0.10mol/L的Na2S溶液中,则平衡时c(Fe3+)为多少?
才学着部分,看了题目不知怎么下手,望高手赐教,谢谢!
急~~~~~~~~~~~~~~~~~~~~~ 夜雨巷1年前1
夜雨巷1年前1 -
 说得来888 共回答了22个问题
说得来888 共回答了22个问题 |采纳率81.8%FeS的Ksp=6.25×10的负18次方,即[Fe2+]=[S2-]=2.5×10^-9.这也是1升溶液中硫化亚铁溶解的物质的量.所以:
常温下FeS的溶解度=2.5×10^-9×88=2.2×10^-7(g/L)
硫离子浓度等于0.1mol/L,代入[Fe2+][S2-]=6.25×10^-18中,求出C(Fe2+)=6.25×10^-17(mol/L).1年前查看全部
- 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L -1 的(NH 4 ) 2 SO 4 溶液,在该溶液中离子浓度由大到小的顺序为 。
(2)B为0.1 mol·L -1 的NaHCO 3 溶液,NaHCO 3 在该溶液中存在的平衡有(用离子方程式表示) 。
(3)某温度时,0.01mol/L的NaOH溶液PH=11,则该温度 25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H + 浓度为1×10 -10 mol/L,则该溶液的pH为 。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 (填“酸性”、“碱性”或“中性”),溶液中c(Na + ) c(CH 3 COO - )(填“>”、“<”或“=”)。
(5)若物质的量浓度相同的CH 3 COOH和NaOH溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 (填“酸性”、“碱性”或“中性”),醋酸体积 氢氧化钠溶液体积(填“>”、“<”或“=”)。
(6)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s) Ag + (aq)+Cl - (aq)在25℃时,AgCl的K sp =1.8×10 -10 。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L -1 AgNO 3 溶液 ③100 mL 0.1 mol·L -1 MgCl 2 溶液充分搅拌后冷却到相同温度,Ag + 浓度由大到小的顺序为 (填序号),此时溶液②中Cl - 物质的量浓度为 。
Ag + (aq)+Cl - (aq)在25℃时,AgCl的K sp =1.8×10 -10 。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L -1 AgNO 3 溶液 ③100 mL 0.1 mol·L -1 MgCl 2 溶液充分搅拌后冷却到相同温度,Ag + 浓度由大到小的顺序为 (填序号),此时溶液②中Cl - 物质的量浓度为 。 kissthesnow1年前1
kissthesnow1年前1 -
 taowangbnu 共回答了18个问题
taowangbnu 共回答了18个问题 |采纳率94.4%1年前查看全部
- 关于沉淀溶解平衡的问题1、若某以AgCl为溶质的溶液中AgCl沉淀和溶解速率相等,能说明该溶液是AgCl的饱和...
关于沉淀溶解平衡的问题1、若某以AgCl为溶质的溶液中AgCl沉淀和溶解速率相等,能说明该溶液是AgCl的饱和...
关于沉淀溶解平衡的问题1、若某以AgCl为溶质的溶液中AgCl沉淀和溶解速率相等,能说明该溶液是AgCl的饱和溶液吗2、往水中加入过量NaCl形成饱和溶液,该溶液中存在NaCl的析出速率和溶解速率相等吗?3、不饱和溶液中沉淀和溶解速率相等吗 br541年前1
br541年前1 -
 McData 共回答了23个问题
McData 共回答了23个问题 |采纳率87%1.该溶液是AgCl的饱和溶液
2.该溶液中存在NaCl的析出速率和溶解速率相等
3.不饱和溶液中沉淀和溶解速率不相等,溶解的速率更大1年前查看全部
- 为什么沉淀溶解平衡,溶解度小的容易转化为溶解度更小的?
为什么沉淀溶解平衡,溶解度小的容易转化为溶解度更小的?
如题.为什么不是容易转化为溶解度较大的? 147258a1年前3
147258a1年前3 -
 aha_yan 共回答了19个问题
aha_yan 共回答了19个问题 |采纳率100%这是一个规律,叫做物质总是倾向于更稳定的状态.稳定意味着物体所包含的能量低.假设三种物质A、B、C.如果能够形成AB和AC两种沉淀,并且AB比AC更难溶解,那么有:
对于AB,能够满足沉淀溶解平衡 AB=A+B(可逆,平衡严重向生成AB方向)
同理有AC=A+C(可逆、严重向AC方向,但程度没有AB那个大).
在一个已经存在AC析出的溶液中,AC一定是饱和的,这时溶液中有一定量的A和C,如果此时在溶液中加入B,由于AB更稳定,B会与少量的A结合,这导致AC的平衡右移,生成的A不断被反应,C进入溶液中,最终成了AB沉淀和低浓度的A、B、C混合溶液,在混合溶液中,A的浓度对B饱和,AC达不到析出条件.
整个过程就是溶解度小的容易转化为溶解度更小的.1年前查看全部
- 沉淀溶解平衡的问题2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol
沉淀溶解平衡的问题
2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol/L硝酸铅溶液,观察首先生成黄色沉淀还是黑色沉淀?离心沉降后向清液中加2滴0.1mol/L硝酸铅溶液,会出现什么沉淀?
我的问题是,实验的时候我看到先生成的是黄色沉淀,后来清液中生成的也是黄色的.但是硫化铅的沉淀溶解系数小于铬酸铅的,为什么先生成铬酸铅?是我看错了?后来清液中的铬酸铅是怎么生成的. bud021年前1
bud021年前1 -
 784562560 共回答了19个问题
784562560 共回答了19个问题 |采纳率94.7%(Ag2CrO4),但实际上KCl溶液中产生沉淀时c(Ag+) 要远小于Ag2CrO4中银离子的浓度,因此KCl溶液中先有沉淀.这类题目不能光看Ksp,还要注意盐的形式 AB1年前查看全部
- 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.
 硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.
(1)请根据图形判断下列说法正确的是______
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
(2)请根据图中b点的数据计算283K时SrSO4的溶度积常数(计算结果用负指数表示).
(3)又知283K时硫酸钡(BaSO4)的溶度积常数Ksp═1.00×10-10mol2•L-2,试判断在该温度下,在SrSO4的饱和溶液中加入BaCl2溶液______(填“有”或“没有”)BaSO4产生,理由是:______.
(4)假定在283K时该反应(SrSO4(s)+Ba2+⇌BaSO4(s)+Sr2+)是一个可逆反应,求此温度下该反应的平衡常数K(计算结果用指数表示). 荆棘鸟19751年前1
荆棘鸟19751年前1 -
 沂蒙心 共回答了21个问题
沂蒙心 共回答了21个问题 |采纳率85.7%解题思路:(1)沉淀溶解平衡中的溶度积常数只与温度有关,与浓度改变无关;溶解度随温度变化而变化,也随离子浓度改变;硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线,纵轴是锶离子浓度的对数,横轴是硫酸根离子浓度的对数.图象分析采取定一议二的方法进行分析;(2)根据Ksp(SrSO4)=c(Sr2+)×c(SO42-)计算;(3)根据Ksp(SrSO4)与Ksp(BaSO4)的相对大小分析,溶度积大的能转化为溶度积小的;(4)平衡常数K=c(Sr2+)c(Ba2+),根据Ksp(SrSO4)与Ksp(BaSO4)计算.(1)A、Ksp只与温度有关与浓度无关,故A错误;
B、由图象可知:在相同条件下,温度越低,c(Sr2+)×c(SO42-)越大,Ksp(SrSO4)越大,故B正确;
C、a点在283K的下方,属于不饱和溶液,故C正确;
D、283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,故D错误.
故答案为:BC;
(2)由图可知b点时lgc(Sr2+)=-1.65,lgc(SO42-)=-1.50,则c(Sr2+)=10-1.65mol•L-1,c(SO42-)=10-1.5mol•L-1,
则Ksp(SrSO4)=c(Sr2+)×c(SO42-)=10-1.65mol•L-1×mol•L-1=1.00×10-3.15 mol2•L-2;
答:283K时SrSO4的溶度积常数为:1.00×10-3.15 mol2•L-2;
(3)已知283K时硫酸钡(BaSO4)的溶度积常数Ksp=1.00×10-10mol2•L-2,Ksp(SrSO4)=1.00×10-3.15 mol2•L-2,溶度积大的沉淀转化为溶度积小的沉淀容易实现,Ksp(SrSO4)>sp(BaSO4),所以在SrSO4的饱和溶液中加入BaCl2溶液会有硫酸钡沉淀生成;
故答案为:有;Ksp(SrSO4)=1.00×10-3.15 mol2•L-2>Ksp(BaSO4)=1.00×10-10mol2•L-2,反应向离子浓度减小的方向进行;
(4)已知反应SrSO4(s)+Ba2+⇌BaSO4(s)+Sr2+,则平衡常数K=
c(Sr2+)
c(Ba2+)=
Ksp(SrSO4)
Ksp(BaSO4)=1.00×106.85,
答:此温度下该反应的平衡常数K=1.00×106.85.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了沉淀转化的分析判断,平衡移动原理的应用和方向判断,解答本题的关键是正确分析图象中纵坐标和横坐标的意义,理解曲线的变化趋势,题目难度中等.1年前查看全部
大家在问
- 1欢呼声一浪高过一浪这句话用了什么修辞手法
- 2现场抽取一个词条,词条上有三个词语,根据词语组成一段话(2-3分钟),三分钟的准备时间
- 3判断:两个一样大的梯形一定能拼成一个平行四边形
- 4判定直角三角形全等的方法有几种其中哪个只适合用于直角三角形,其他三角形不能用
- 5英语翻译大家好·我是XX·下面我想简单介绍一下自己最近的习作·首先这几十张的照片··我的照片用是纪实摄影的手法表现的·是
- 6甲乙赛跑400米的跑道 背对2分钟相遇 相对23分钟相遇 甲的速度比乙快 两人的速度各是多少 带过程
- 721.4x1.75该怎么样列竖式
- 8在三角形abc中,角c=2角b,画角BAC的平分线与BC相交于D.证明:AC+CD=AB
- 9压力与压强有何区别 怎么判断 还有什么叫大气压强和什么叫液体压强
- 10圆o是三角形abc的外接圆,cd平分∠acb交圆o于点d,de平行于ac交圆o于点e,那么de与bc相等.试说明其中道理
- 11x乘(cosx)平方的二阶导数
- 12小学六年级数学AAA1.在3分之1和5分之3之间插进3个最简单分数,使这5个数中每相邻两个树的差相等,这三个最简单分数分
- 13霜鬓明朝又一年的意思是什么?
- 14病人经常对医生说.英语的
- 15请帮我翻译下面越南地址 23/2 TA 16 Street,quater 2,Thoi An town,dictrict

