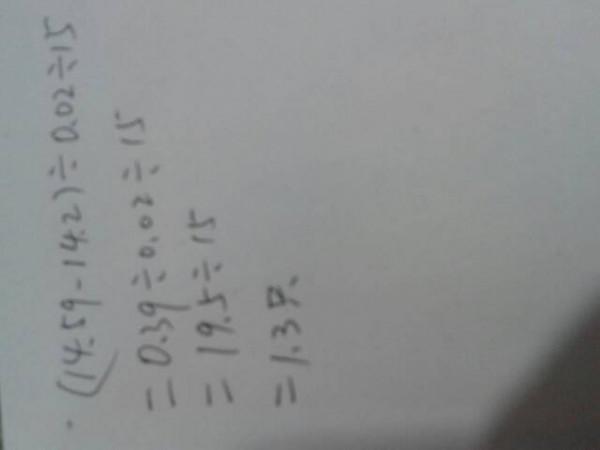14.2克CaCO3和MgCO3加盐酸生成的气体通入200ml2mol/L的NaOH中得固体19.9克求MgCO3质量
 cherrylovewen2022-10-04 11:39:541条回答
cherrylovewen2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 wangchun1696 共回答了16个问题
wangchun1696 共回答了16个问题 |采纳率87.5%- NaOH;16克
所以CO2;3.9克,即0.088mol
设CaCO3;xmol ,MgCO3;ymol
则100x+84y=2
x+y=0.088
去解x.y - 1年前
相关推荐
- 有氧化镁和氧化铝的混合物14.2克,加盐酸使混合物完全溶解后,再加过量的氢氧化钠,过滤得沉淀5.8克,计算混合物中氧化铝
有氧化镁和氧化铝的混合物14.2克,加盐酸使混合物完全溶解后,再加过量的氢氧化钠,过滤得沉淀5.8克,计算混合物中氧化铝的质量
 ljf10301年前0
ljf10301年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有一种气体的质量是14.2克,体积是4.48升(标准状况),求该气体的摩尔质量.
有一种气体的质量是14.2克,体积是4.48升(标准状况),求该气体的摩尔质量.
分离沸点不同但又互溶的液体混合物,常用什么方法 紫苏12311年前3
紫苏12311年前3 -
 shuilianshui 共回答了16个问题
shuilianshui 共回答了16个问题 |采纳率81.3%物质的量===体积/22.4==4.48/22.4==0.2 mol
则摩尔质量==质量/物质的量==14.2/0.2==71 是 Cl21年前查看全部
- 实验室欲制取14.2克五氧化二磷,需燃烧多少克磷?同时还要消耗氧气多少?
实验室欲制取14.2克五氧化二磷,需燃烧多少克磷?同时还要消耗氧气多少?
实验室欲制取14.2克五氧化二磷,需燃烧多少克磷?同时还要消耗氧气多少?这些氧气在标准状况下占多少体积? susan8709141年前5
susan8709141年前5 -
 983kjfdngkl 共回答了14个问题
983kjfdngkl 共回答了14个问题 |采纳率92.9%4P + 5O2 ====2P2O
124 160 284
x y 14.2g
124/x=160/y=284/14.2g
x=6.2g y=8g
需燃烧6.2克磷
消耗氧气8g 氧气标况下密度为1.429g/L
氧气体积为.429g/L=5.6L
氧气在标准状况下占5.6L体积1年前查看全部
- 在A+B=C+2D的反应中,9.8克A和8克的B完全反应生成14.2克的C,同时得到D的质量是( )
在A+B=C+2D的反应中,9.8克A和8克的B完全反应生成14.2克的C,同时得到D的质量是( )
A.1.8克
B.3.6克
C.7.2克
D.14.4克 微笑的花儿1年前1
微笑的花儿1年前1 -
 lixiang19826 共回答了17个问题
lixiang19826 共回答了17个问题 |采纳率94.1%解题思路:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.所以同时得到D的质量=A的质量+B的质量-C的质量.由质量守恒定律和化学方程式可知,生成D的质量=9.8g+8g-14.2g=3.6g.所以:
A、得到D的质量不是1.8克,故A错误;
B、得到D的质量是3.6克,故B正确;
C、得到D的质量不是7.2克,故C错误;
D、得到D的质量不是14.4克,故D错误.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是有关质量守恒定律的简单计算,比较简单.学生需熟知质量守恒定律,才能正确答题.1年前查看全部
- 在A+2B=C+2D的反应式中,9.8克A和8克B恰好完全反应生成14.2克C,同时得到____D.
 lsnn991年前1
lsnn991年前1 -
 mm21 共回答了19个问题
mm21 共回答了19个问题 |采纳率89.5%由质量守恒原则,得:m(D)=9.8+8-14.2=3.6g1年前查看全部
- 8克氢氧化钠长期放置后与一定量的稀硫酸完全反应生成硫酸钠的一定为14.2克吗
 星星的铃铛1年前4
星星的铃铛1年前4 -
 amy_1006 共回答了22个问题
amy_1006 共回答了22个问题 |采纳率81.8%是:
8g氢氧化钠 NaOH 中Na元素的物质的量为:(8/40)=0.2mol
氢氧化钠长期放置,不管生产什么物质,Na不会消失,始终是0.2mol,在与稀硫酸反应时,不管是NaOH,Na2CO3等,都是生产Na2SO4.根据钠元素的物质的量守恒:
0.1molx142g/mol=14.2g1年前查看全部
- 在A+B=C+D的反应中,9.8克A与8克B正好完全反应,生成14.2克C和3.6克D.已知C的相对分子质量为142
在A+B=C+D的反应中,9.8克A与8克B正好完全反应,生成14.2克C和3.6克D.已知C的相对分子质量为142
则D的相对分子质量为—— 42352311年前2
42352311年前2 -
 huangqiuxiong 共回答了17个问题
huangqiuxiong 共回答了17个问题 |采纳率76.5%36,通过化学方程式可以得知相对分子质量与参加反应的物质质量是十倍关系,已知D是3.6g,所以D的相对原子质量应该乘十就是361年前查看全部
- 求助一道高二化学题某链烃中碳元素的质量分数为88.9%, 5.4克该烃能与14.2克氯气发生加成反应,且产物具有对称结构
求助一道高二化学题
某链烃中碳元素的质量分数为88.9%, 5.4克该烃能与14.2克氯气发生加成反应,且产物具有对称结构. 试确定该烃的分子式和可能的结构简式.
 wxjmty1年前1
wxjmty1年前1 -
 zeroflower 共回答了23个问题
zeroflower 共回答了23个问题 |采纳率87%某链烃中碳元素的质量分数为88.9%,所以含氢11.1%,所以质量比C:H=8:1,所以物质的量之比是C:H=2:3,该烃的最简式是C2H3,因为5.4克该烃能与14.2克氯气发生加成反应,且产物具有对称结构.所以该烃应该是CH2=CH-CH=CH21年前查看全部
- 14.2克CaCO3和MgCO3加盐酸生成的气体通入200ml2mol/L的NaOH中得固体19.9克求MgCO3质量
 asdf87281年前1
asdf87281年前1 -
 -痴呆- 共回答了25个问题
-痴呆- 共回答了25个问题 |采纳率96%先判断固体是碳酸钠还是碳酸氢钠又或是二者的混合物
当14.2克全是CaCO3
n(CO2)=14.2/100=0.142mol
当14.2克 全是MgCO3时
产生的CO2=14.2/84=0.169摩尔
2NaOH-----CO2
2-----------1
0.2*2=0.4-----0.2mol
均小于0.2摩尔
所以
最后固体是碳酸钠
n(Na2CO3)=19.9/106=0.188mol
n(CO2)=0.188mol
设碳酸钙是X摩尔
碳酸镁是Y摩尔
则
100*X+84*Y=14.2
X+Y=0.188
解得
Y=0.2875摩尔
碳酸镁的质量=84*0.2875=24.2克1年前查看全部
- 有0.2摩某元素的单质直接与氯气反应后,质量增加14.2克,则该原子的相对原子质量是多少?
 wxpwxp1231年前2
wxpwxp1231年前2 -
 永忆梅香 共回答了22个问题
永忆梅香 共回答了22个问题 |采纳率100%0.2摩质量增加14.2克
就是说1摩质量增加71克
则该方程应该为
x+cl2=xcl2
应为正2价的单质
这题应该是选择题吧?否则答案不唯一1年前查看全部
- 有人把蝙蝠放在有蚊子的房间做实验。蝙蝠原来重14.2克,15分后,由于吃蚊子,体重变成了14.59克。如果一只蚊子平均体
有人把蝙蝠放在有蚊子的房间做实验。蝙蝠原来重14.2克,15分后,由于吃蚊子,体重变成了14.59克。如果一只蚊子平均体重是0.02克,蝙蝠平均每分吃几只蚊子?
 128红1年前4
128红1年前4 -
 bszhaowei 共回答了83个问题
bszhaowei 共回答了83个问题 |采纳率14.5%1年前查看全部
- 14.2克含1种杂质的硫酸钠样品,加水全部溶解后,往溶液中加入足量的氯化钡溶液,过滤,洗涤,干燥得25克沉淀物,
14.2克含1种杂质的硫酸钠样品,加水全部溶解后,往溶液中加入足量的氯化钡溶液,过滤,洗涤,干燥得25克沉淀物,
则样品中的杂质为:硫酸钾,硫酸铝,硫酸镁还是硫酸锌? sitong1年前2
sitong1年前2 -
 nameless212 共回答了21个问题
nameless212 共回答了21个问题 |采纳率90.5%若为纯净的Na2SO4,则有
Na2SO4~BaSO4
142 233
14.2g 23.3g1年前查看全部
- 在A+B═C+2D的反应中,9.8克A和8克B恰好完全反应生成14.2克C,则同时得到D的质量是( )
在A+B═C+2D的反应中,9.8克A和8克B恰好完全反应生成14.2克C,则同时得到D的质量是( )
A. 3.6
B. 1.8
C. 14.4
D. 7.2 贞子被我吓kk1年前4
贞子被我吓kk1年前4 -
 kanpast 共回答了19个问题
kanpast 共回答了19个问题 |采纳率84.2%解题思路:根据质量守恒定律,在化学反应前后,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.在此化学反应中,参加反应A和B的质量和等于生成的C和D的质量和,由参加反应的A和B的质量,生成的C的质量,可计算出生成D的质量.由质量守恒定律,参加反应A和B的质量和等于生成的C和D的质量和,9.8克A和8克B恰好完全反应生成14.2克C,则同时得到D的质量是9.8g+8g-14.2g=3.6g.
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,解答此类题的关键是熟练掌握质量守恒定律:参加反应前各物质的质量总和等于反应后生成各物质的质量总和.1年前查看全部
- 实验室欲制取14.2克五氧化二磷,需燃烧多少克磷?同时还要消耗氧气多少克..不要直接写个6.2和8g
 愚愚鱼鱼1年前1
愚愚鱼鱼1年前1 -
 uicu 共回答了23个问题
uicu 共回答了23个问题 |采纳率82.6%设P的质量为X ,O2的质量为y
4P + 5O2 == 2P2O5
124 160 284
X Y 14.2g
124:284=X:14.2g X=6.2g
160;284=Y:14.2g Y=8g
答:需要燃烧6.2g磷,需要消耗氧气8g.
我也是初三的,好好学吧1年前查看全部
- 有一种气体的质量是14.2克,体积是4.48升(STP),该气体的摩尔质量是?A.28.4 B.28.4g.C.71 D
有一种气体的质量是14.2克,体积是4.48升(STP),该气体的摩尔质量是?A.28.4 B.28.4g.C.71 D.71g.mol
 水景一色1年前2
水景一色1年前2 -
 nickapple 共回答了20个问题
nickapple 共回答了20个问题 |采纳率85%14.2/(4.48/22.4)=71g/mol1年前查看全部
- 14.2克氯气跟足量的氢气反应生成氯化氢全部被水吸收,可以制得36%盐酸多少千克?
14.2克氯气跟足量的氢气反应生成氯化氢全部被水吸收,可以制得36%盐酸多少千克?
14.2千克 1219391421年前2
1219391421年前2 -
 staidzhou 共回答了15个问题
staidzhou 共回答了15个问题 |采纳率93.3%n(Cl2)=200mol
Cl2+H2=2HCl
1 2
200mol n(HCl)
求出 n(HCl)=400mol
m(HCl)=400mol×36.5g/mol=14600g
所以盐酸的质量为14600g/36%=40600g1年前查看全部
- 如图,24.1克的氯化钠和氯化钡的混合物溶解99.2克的水中,所得溶液与14.2克的硫酸钠完全反应完
如图,24.1克的氯化钠和氯化钡的混合物溶解99.2克的水中,所得溶液与14.2克的硫酸钠完全反应完
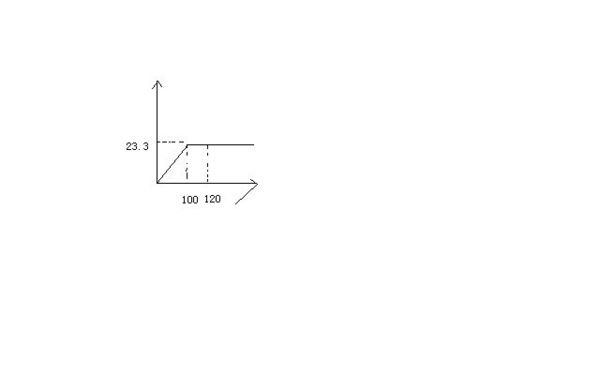
问:反应后所得溶液中的溶质质量分数为多少?(写计算过程和化学方程式) baby1233211年前1
baby1233211年前1 -
 zhuomin_168 共回答了17个问题
zhuomin_168 共回答了17个问题 |采纳率100%坐标中的23.3克为硫酸钡沉淀的质量吗?
BaCl2 + Na2SO4 === 2NaCl + BaSO4
硫酸钡沉淀有23.3/233=0.1mol;硫酸钠有14.2/142=0.1mol;
与硫酸钠完全反应完,是指氯化钡正好也是0.1mol吗,否则剩下的质量就不知道氯化钡和氯化钠各有多少了.
则原氯化钡的质量为23.3/233*208=20.8克;
原来初始氯化钠质量为24.1-20.8=3.3克,反应生成氯化钠质量为0.2*58.5=11.7克,共计11.7+3.3=15克;溶液最后质量为24.1+99.2+14.2-23.3=114.2克;
则溶质质量百分比为15/114.2=13.1%;1年前查看全部
- 把红磷放在氧气中燃烧制取14.2克五氧化二磷,如果所需氧气由过氧化氢催化分解制得,
 冷一泉1年前2
冷一泉1年前2 -
 MEIMEI1122 共回答了22个问题
MEIMEI1122 共回答了22个问题 |采纳率95.5%磷+氧气---->五氧化二磷
4P+5O2=2P2O5 P2O5,31×4+16×10= 284
14.2克五氧化二磷中有8克氧气
2H2O2=2H2O+O2 O2,32 2H2O2,68
比一下就知道需要17克由过氧化氢1年前查看全部
- 某元素R的原子最外层有5个电子,6.5克R单质完全氧化后生成14.2克氧化物,R原子核内的质子数比中子数少1个,
 2383031年前2
2383031年前2 -
 我是lanana 共回答了19个问题
我是lanana 共回答了19个问题 |采纳率100%首先判断是第五主族元素
有N P 等
14.2-6.5=7.3,大约是3摩尔氧元素
初步判断是P1年前查看全部
- 6.2克某非金属元素x形成14.2克氧化物,其化学式为X2O5,若一个X原子中有15个电子,则X核内中子数为多少
6.2克某非金属元素x形成14.2克氧化物,其化学式为X2O5,若一个X原子中有15个电子,则X核内中子数为多少
运用初三上的知识 jennifer1601年前3
jennifer1601年前3 -
 古今8877 共回答了16个问题
古今8877 共回答了16个问题 |采纳率93.8%由题意得,氧的质量为14.2-6.2=8克,
设化合物为n摩尔,有n=8/(16x5)=0.1摩尔.
设非金属摩尔质量为M,有0.1x2xM=6.2,解得,M=31 克每摩尔.
又已知X中有15个电子,所以其质子数也为15,因此中子数为31-15=16.1年前查看全部
- 有一种气体的质量是14.2克,体积是4.48升(标准状况),该气体的摩尔质量是( )
有一种气体的质量是14.2克,体积是4.48升(标准状况),该气体的摩尔质量是( )
A 28.4 B 28.4克每摩尔 C 71 D 71克每摩尔
要有解题过程. 5039780001年前1
5039780001年前1 -
 huabikai 共回答了27个问题
huabikai 共回答了27个问题 |采纳率63%14.2/(4.48/22.4)=71g/mol1年前查看全部
- 在14.2克Na2SO4中,含有多少个Na+;有多少克SO4⒉-;含氧原子的物质的量为(过程要详细)
 tftrtrreer1年前1
tftrtrreer1年前1 -
 爱是不能忘记的 共回答了15个问题
爱是不能忘记的 共回答了15个问题 |采纳率80%Na2SO4 的分子质量为 23×2+96=142 含有Na+是 14.2÷142×2=0.2mol ,即 0.2NA 个 含有SO4 的质量是 14.2÷142×96=9.6 g 含氧原子的物质的量为14.2÷142×4=0.4 mol1年前查看全部
大家在问
- 124.5的英文单词是什么
- 2x是整数,2x+1是[ ] A奇数 B质数 C偶数
- 3-a的平方加6a减九.
- 4计算(4/7b的立方-7ab的平方+2/5b的平方)÷2/5b的平方
- 5某高山植物沿高山分布...
- 6十三分之七除以七加七分之一乘以十三分之七怎么用简便算法?
- 7研究凸透镜成像规律用到的实验器材有?
- 8They dislike the colour,如何完成反义疑问句
- 9当n是正整数时,(-1)的2n次方是多少?(-1)的2n+1次方呢?
- 10晴朗的夜晚,星光闪烁,我们所见的星星的位置是不是它的实际位置?
- 11骨髓怎么读标准答案 髓是二声还是三声?
- 12地球上一共有几多种金属元素?
- 13急求人教版生物必修二的第五章第二节练习答案!
- 14-2又9分之7的绝对值的算术平方根是几?
- 15求绝对值:4分之3乘负9分之4等于多少?