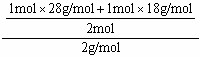将1molCO和1molNO 2 充入密闭容器中,在催化剂存在下发生反应:NO 2 (g)+CO(g)⇌CO 2 (g)
 sjpaihj2022-10-04 11:39:541条回答
sjpaihj2022-10-04 11:39:541条回答 将1molCO和1molNO 2 充入密闭容器中,在催化剂存在下发生反应:NO 2 (g)+CO(g)⇌CO 2 (g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO 2 .在其它条件不变的情况下,若将1molCO和2molNO 2 充入上述反应器中,则反应达到化学平衡时,混合气体中的CO的体积分数是( )
|

已提交,审核后显示!提交回复
共1条回复
 不知该怎么说 共回答了16个问题
不知该怎么说 共回答了16个问题 |采纳率93.8%- 将1molCO和1molNO 2 充入密闭容器中,平衡时CO的转化率为50%,则参加反应的CO为1mol×50%=0.5mol,则:
NO 2 (g)+CO(g)⇌CO 2 (g)+NO(g)
开始(mol):1 10 0
变化(mol):0.5 0.50.5 0.5
平衡(mol):0.5 0.5 0.5 0.5
故该温度下平衡常数k=
0.5×0.5
0.5×0.5 =1
其它条件不变的情况下,若将1molCO和2molNO 2 充入上述反应器中,令反应达到化学平衡时CO的物质的量为amol,则:
NO 2 (g)+CO(g)⇌CO 2 (g)+NO(g)
开始(mol):2 10 0
变化(mol):1-a1-a1-a 1-a
平衡(mol):1+aa 1-a 1-a
故
(1-a)×(1-a)
(1+a)×a =1,解得a=
1
3
故平衡时CO的体积分数为
1
3 mol
1mol+2mol =
1
9
故选A. - 1年前
相关推荐
- 在一定条件下,将1molCO和1molH 2 O(g)混合后,发生如下反应:CO(g)+H 2 O(g) CO 2 (g
在一定条件下,将1molCO和1molH 2 O(g)混合后,发生如下反应:CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g),反应达到平衡时,测得CO的转化率为21.75%,则平衡时混合气体密度为相同条件下H 2 密度的()
CO 2 (g)+H 2 (g),反应达到平衡时,测得CO的转化率为21.75%,则平衡时混合气体密度为相同条件下H 2 密度的()A.11.5倍 B.15.75倍 C.23倍 D.46倍  fhcar1年前1
fhcar1年前1 -
 新袜志 共回答了20个问题
新袜志 共回答了20个问题 |采纳率90%1年前查看全部
- 将1molCO和1molH 2 O充入容器中,在催化剂存在下发生反应H 2 O (g)+CO(g)
将1molCO和1molH 2 O充入容器中,在催化剂存在下发生反应H 2 O (g)+CO(g) 
H 2 (g)+CO 2 (g)
达到平衡时,发现有50%的CO转化为CO 2 .在其他条件不变的情况下,若将1molCO和2molH 2 O充入反应器中,则反应达平衡后,混合气体中CO 2 的体积分数可能为( )A. 1 9 B. 1 6 C. 2 9 D. 1 2  tala611年前1
tala611年前1 -
 tangying852 共回答了18个问题
tangying852 共回答了18个问题 |采纳率88.9%由到平衡时,发现有50%的CO转化为CO 2 ,则
H 2 O (g)+CO(g)
H 2 (g)+CO 2 (g)
开始1 1 0 0
转化 0.5 0.5 0.50.5
平衡 0.5 0.5 0.50.5
则CO 2 的体积分数为
0.5
0.5+0.5+0.5+0.5 =
1
4 ,
若将1molCO和2molH 2 O充入反应器,CO的转化率为100%,则
H 2 O (g)+CO(g)
H 2 (g)+CO 2 (g)
开始2 1 0 0
转化 1 1 1 1
平衡 10 1 1
CO 2 的体积分数为
1
1+0+1+1 =
1
3 ,
即CO的转化率介于50%--100%之间,所以CO 2 的体积分数介于
1
4 --
1
3 之间,
2
9 介于
1
6 --
1
3 之间,故选C.1年前查看全部
- 1mol氢这种说法正不正确,1molCO,1mol小米呢
 ydb0081年前3
ydb0081年前3 -
 半个吻 共回答了18个问题
半个吻 共回答了18个问题 |采纳率94.4%1mol氢 错的
氢表示不明确,用mol表示的时候一定要指出微粒种类 1mol氢气(分子), 氢原子等
1molCO 对的 就是表示1molCO分子
1mol小米 错的 不能表示宏观物质,mol只能表示微观粒子(分子,原子,离子,质子,中字,电子)1年前查看全部
- 1molCO,1molCO2具有相同的( )
 zerox41年前2
zerox41年前2 -
 海上_闻人 共回答了25个问题
海上_闻人 共回答了25个问题 |采纳率92%分子数1年前查看全部
- 将1molCO和1molH2O(g)充入某固定体积的反应器中,在某条件下达到平衡:CO+H2O(g)可逆CO2+H2,此
将1molCO和1molH2O(g)充入某固定体积的反应器中,在某条件下达到平衡:CO+H2O(g)可逆CO2+H2,此时有1/2的CO转化为CO2.若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,达到平衡时,混合物中CO2的体积分数可能是下列各值中的
A.22.2% B.25.5% C.32.2% D.66.7%
[答案选A,求详解, eleckli1年前1
eleckli1年前1 -
 12227 共回答了16个问题
12227 共回答了16个问题 |采纳率100%设容器的体积为V升
CO+H2O(g)=可逆= CO2+ H2
起始 1/V 1/V 0 0
转化 1/2V 1/2V 1/2V 1/2V
平衡1/2V 1/2v 1/2V 1/2v
平衡常数K=1
CO+H2O(g)=可逆= CO2+ H2
起始 0 1/V 1/V 1/V
转化 X/v X/v X /v X/v
平衡 X/v 1/v +X/v 1/V-X/v 1/v-X/v
K= (1/V-X/v )( 1/V-X/v)/[(X/v )(1/v +X/v)]=1
X=1/3
气体总体积=3摩尔
CO2的体积分数=(2/3)/3=22.2%
A是正确的.1年前查看全部
- 在一定温度下,将1molCO和1mol水蒸气放入一固定容积的密闭容器中,发生反应:CO(g)+H2O(g)=(可逆)CO
在一定温度下,将1molCO和1mol水蒸气放入一固定容积的密闭容器中,发生反应:CO(g)+H2O(g)=(可逆)CO2(g)+H2(g),达到平衡状态后,得到CO2 0.6mol;再通入0.3 mol水蒸气,达到新的平衡状态后,CO2的物质的量可能是( )
A.0.9mol B.0.8mol C.0.7mol D.0.6mol 劫米uu621年前6
劫米uu621年前6 -
 2006lovestation 共回答了14个问题
2006lovestation 共回答了14个问题 |采纳率85.7%C
1mol CO能产生0.6molCO2
那再加0.3molCO H2O不加,应该另外产生小于0.3/1*0.6mol==0.18mol 的CO2
也就是说总共的CO2 应该小于0.6+0.18mol=0.78mol 又一定会比0.6mol大
那就只有C可能拉1年前查看全部
- 将1molCO和1molH2O(g)充入某固定容积的密闭容器中,在一定条件下发生反应CO(g)+H2O(g)
 淡雪蓝蓝1年前2
淡雪蓝蓝1年前2 -
 DDTOY 共回答了18个问题
DDTOY 共回答了18个问题 |采纳率94.4%首先列方程式(题目的条件是等容)
CO H2O(g)==== CO2 H2
起始状态 1mol 1mol 0 0
变化 1/3mol 1/3mol 2/3mol 2/3mol
变化了 2/3mol 2/3mol 2/3mol 2/3mol
第二问(注重条件)
起始状态 1mol 1mol 1mol
然后用极端假设法、极端转换法(这是做此类化学选择题常用的方法)
只加入了1molCO2和1molH2就等于第一问的条件加入1molCO和1molH2O(g).两个达到的结果完全一样,在次基础上加入1molH2o反映肯定朝着正反应方向进行
这是就要关注条件了,因为只有体积不变,在加入这些气体后,导致压强增大,再联系朝着正反应进行,则co2体积分数必定在2/9和1/3之间.
加酸的时候,溶液中的氢离子主要有酸提供,所以算水电离出来的氢离子,抓住水电离出来的氢离子等于氢氧跟离子,就是溶液中的氢氧跟离子的浓度
加碱的时候,溶液中的氢离子主要有水提供,所以算水电离出来的氢离子,抓住水电离出来的氢离子等于氢氧跟离子,就可以算了
碱性或者酸性越强,那么水电离出来的氢离子都是越少的
1234水电离出来的氢离子浓度分别为10的-14次方,-13次方,-12次方,-11次方
所以是1:10:100:10001年前查看全部
- 请老师们赐教!1molCO(g,理想气体)在25度、101.325kpa时,被506.63kPa的环境压力压缩到200度
请老师们赐教!
1molCO(g,理想气体)在25度、101.325kpa时,被506.63kPa的环境压力压缩到200度的最终状态,求此过程的Q、W、U、H、S.已知Co(g)的cp,m=3.5R
希望老师能说的详细点,我不太懂. 骘天子_cc1年前1
骘天子_cc1年前1 -
 艾力克斯 共回答了22个问题
艾力克斯 共回答了22个问题 |采纳率90.9%PV=NRT先算出25℃,101.325Kpa时的体积V1
然后再把等压升温到200℃时的体积V2
W=-P(V2-V1) (P=506.63Kpa)
从你给的条件看此压缩应该是等压压缩,由Cpm-Cvm=R可得Cvm=2.5R
∴Cvm*△T U=Q+W可以得到 Q,W,U. Cpm*△T可以得到H
这样代入数据就可已得到S1年前查看全部
- 在一定条件下,将1molCO和1mol水蒸气混合后发生如下变化:
在一定条件下,将1molCO和1mol水蒸气混合后发生如下变化:
CO(g)+H2O(g) CO2(g)+H2(g)若反应达平衡时测得CO转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的
A.5.75倍 B.11.5倍 C.30.67倍 D.46倍 lyra_20041年前1
lyra_20041年前1 -
 yang206 共回答了18个问题
yang206 共回答了18个问题 |采纳率100%答案是B
首先要注意的是,这个反应前后气体密度不发生变化,因为前后平均分子量没有变化,就是说转化率根本就无关的.这样就算1molCO和1mol水蒸气混合后的平均分子量就行了.平均分子量=(28+18)/2 =23.氢气分子量为21年前查看全部
- 比较1moln2和1molco的共同点A分子的物质的量B原子的物质的量C质量D电子数E质子数选择正确的选项
 matthew_lin1年前1
matthew_lin1年前1 -
 陈ffuu了 共回答了14个问题
陈ffuu了 共回答了14个问题 |采纳率100%答案都是正确的,嘿嘿
ABCDE
1molN2和1molCO的分子的物质的量为1mol、原子的物质的量为2mol,质量为28g,电子数、质子数均为14mol
明白了?o(∩_∩)o...1年前查看全部
- 已知在25℃1.01×10 5 Pa下,1molCO燃烧放出热量20kJ;使1kg水的温度每升高1℃需热量近以为4kJ.
已知在25℃1.01×10 5 Pa下,1molCO燃烧放出热量20kJ;使1kg水的温度每升高1℃需热量近以为4kJ.
(1)224升(标准状况)CO在25°、1.01×10 5 Pa下燃烧,释放出的热量是多少?
(2)若热量损失20%,则上述CO燃烧时能使多少千克25℃的水沸腾? manbu1231年前1
manbu1231年前1 -
 雨天风筝 共回答了17个问题
雨天风筝 共回答了17个问题 |采纳率82.4%(1)n(CO)=
224L
22.4L/mol =10mol,
完全燃烧放出的热量为:10mol×20kJ/mol=200kJ,
答:224升(标准状况)CO在25°、1.01×10 5 Pa下燃烧,释放出的热量是200kJ.
(2)设上述CO燃烧时能使x千克25℃的水沸腾,
则有:200kJ×80%=(100℃-25℃)×4kJ/kg×xkg,
解之得:x=0.53,
答:若热量损失20%,则上述CO燃烧时能使0.53千克25℃的水沸腾.1年前查看全部
- 将1molCO(g)和1molH2O(g)充入某固定容积的反应器中,在一定条件下CO(g)+H20(g)--CO2(g)
将1molCO(g)和1molH2O(g)充入某固定容积的反应器中,在一定条件下CO(g)+H20(g)--CO2(g)+H2(g)达到平衡时有2/3的CO转化成CO2,在相同条件下,将1molCO(g)和2molH2O(g)充入同一反应器中,当反应达到平衡时混合气体CO2的体积分数可能是( )
A22.2%B28.2%C33.3%D37.8% 寒月西轩1年前1
寒月西轩1年前1 -
 stepknee 共回答了14个问题
stepknee 共回答了14个问题 |采纳率92.9%设条件中的将1molCO(g)和1molH2O(g)充入某固定容积的反应器中,在一定条件下CO(g)+H20(g)--CO2(g)+H2(g)达到平衡时有2/3的CO转化成CO2为平衡状态1
则将1molCO(g)和2molH2O(g)充入同一反应器中就是在平衡条件1的情况下+入1molH2O,增加了反应物的量,平衡右移,则有超过2/3的CO转化为CO2,总物质量为3mol(反应前后物质量没变),CO2物质量大于2/3,做个除法,则得到CO2体积分数大于2/9,又因为CO2物质量小于1mol,得到CO2体积分数小于1/3,如此得到B和C为正确选项1年前查看全部
- 恒温恒压amolCO和3amolH2制取甲醇,再充入1molCO和3molH2,反应怎样移动
 xmz1141年前3
xmz1141年前3 -
 claire122300 共回答了14个问题
claire122300 共回答了14个问题 |采纳率85.7%化学平衡增加反应物的浓度、在反应条件不变的情况下、反应向生成物反向移动.1年前查看全部
- 1molN2的质子数与1molCO质子数相同吗?怎么看的
 wycdw5551年前1
wycdw5551年前1 -
 158955812 共回答了21个问题
158955812 共回答了21个问题 |采纳率81%相同,原子序数=核电荷数=质子数=核外电子数,所以N2=7×2=14 co=6+8=141年前查看全部
- 1molCO2和1molCO所含的分子数相同,所占的体积相同吗?为什麼?
1molCO2和1molCO所含的分子数相同,所占的体积相同吗?为什麼?
1molCO2和1molCO的混合气体在标准状况下,所占体积约是22.为什麼? 红豆娘1年前5
红豆娘1年前5 -
 宝宝坤 共回答了15个问题
宝宝坤 共回答了15个问题 |采纳率100%这个内容应该是高一的阿伏加德罗定律,内容如下:阿伏加德罗定律(Avogadro's hypothesis)同温同压下,相同体积的任何气体含有相同的分子数,称为阿伏加德罗定律.气体的体积是指所含分子占据的空间,通常条件下,气体分子间...1年前查看全部
- 合成氨工业中的h通过反应:co(g)+h2o(g)===co2(g)+h2(g)制得,今在一定温度下,将1molco和3
合成氨工业中的h通过反应:co(g)+h2o(g)===co2(g)+h2(g)制得,今在一定温度下,将1molco和3mol水蒸气于密闭容器中反应,得到平衡后测得co2为0.75mol,再通入6mol水蒸气,重新达到平衡后,CO2和H2的物质的量之和可能为
A.1.2mol B1.5mol C1.8mol D2.5mol yongask821年前1
yongask821年前1 -
 悠91 共回答了19个问题
悠91 共回答了19个问题 |采纳率94.7%答案是C
在第一次平衡后 因为二氧化碳有0.75,所以氢气也是0.75 二者之和就是1.5.再又通入水蒸汽后,化学平衡向右移动 所以答案肯定比1.5要大.同时 反应物一氧化碳只有1mol 所以 二氧化碳和氢气都不会超过1mol,他们的和也不会超过2mol 所以答案就是1.5与2之间 的 C1年前查看全部
- 已知通常情况下,1molC(石墨)完全燃烧生成CO2气体时放热393.5KJ,1molCO气体完全燃烧生成CO2气体时放
已知通常情况下,1molC(石墨)完全燃烧生成CO2气体时放热393.5KJ,1molCO气体完全燃烧生成CO2气体时放热283.0KJ.下列说法正确的是( )
A. 石墨燃烧生成CO气体的热化学方程式为:2C(石墨)+O2(g)=2CO(g)△H=-110.5kJ/mol
B. C(石墨)不完全燃烧,生成CO2和CO两种气体时,可放热283.0kJ
C. C(石墨)和CO2(g)反应生成CO(g)的反应是吸热反应
D. 若金刚石的燃烧生成CO2气体放出的热量大于石墨,则石墨变成金刚石的变化是放热反应 马婷1年前1
马婷1年前1 -
 zhjjly 共回答了21个问题
zhjjly 共回答了21个问题 |采纳率90.5%解题思路:A、根据石墨、一氧化碳的燃烧的热化学方程式,利用盖斯定律,进行方程式叠加,构造出目标反应式;
B、1mol石墨不完全燃烧,无法计算生成CO2和CO各自物质的量,无法计算具体反应热;
C、根据石墨、一氧化碳的燃烧的热化学方程式,利用盖斯定律,进行方程式叠加,构造出目标反应式分析判断;
D、金刚石的燃烧热大于石墨的燃烧热,可知金刚石的能量比石墨能量高,根据能量守恒判断.A、石墨、一氧化碳的燃烧热分别是393.5kJ•mol-1和283.0KJ•mol-1,
石墨燃烧的热化学方程式为(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol;
一氧化碳燃烧的热化学方程式为(2)CO(g)+[1/2]O2(g)═CO2(g)△H2=-283.0kJ/mol;
根据盖斯定律,(1)-(2)得C(石墨)+[1/2]O2(g)=CO(g)△H=-110.5kJ•mol-1,
即2C(石墨)+O2(g)=2CO(g)△H=-221kJ•mol-1,故A错误;
B、1mol石墨不完全燃烧生成CO2和CO,无法计算生成CO2和CO各自物质的量,无法计算具体反应热,故B错误;
C、石墨燃烧的热化学方程式为(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol;
一氧化碳燃烧的热化学方程式为(2)CO(g)+[1/2]O2(g)═CO2(g)△H2=-283.0kJ/mol;
根据盖斯定律,(1)-(2)×2得C(s,石墨)+CO2(g)=2CO(g)△H=+172.5kJ•mol-1,反应是吸热反应,故C正确;
D、金刚石的燃烧放热大于石墨的燃烧放热,根据能量守恒,可知金刚石的能量比石墨能量高,所以石墨转变为金刚石需要吸热,故D错误;
故选C.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查了盖斯定律的应用,热化学方程式书写,反应中的能量转化等,难度中等.1年前查看全部
- (10分)由等物质的量烃A和烃的衍生物B组成的混合物共0.5摩,恰好能和1.25摩O 2 完全燃烧生成1molCO 2
(10分)由等物质的量烃A和烃的衍生物B组成的混合物共0.5摩,恰好能和1.25摩O 2 完全燃烧生成1molCO 2 和1molH 2 O,请用分子式给出A和B的可能组合方式(可不填满)
A B (1) (2) (3) (4) (5)  geersl4gi7xkrf1年前1
geersl4gi7xkrf1年前1 -
 YFG698 共回答了23个问题
YFG698 共回答了23个问题 |采纳率87%A
A
B
1
CH 4
C 3 H 4 O 2
2
C 2 H 4
C 2 H 4 O 2
3
C 2 H 6
C 2 H 2 O 2
4
C 3 H 6
CH 2 O 2
5
C 2 H 2
C 2 H 6 O 2
由题目所给信息可知,C x H y1年前查看全部
- 2CO(g)+O 2 (g)⇌2CO 2 (g)反应过程的能量变化如图所示.已知1molCO(g)氧化为1molCO 2
2CO(g)+O 2 (g)⇌2CO 2 (g)反应过程的能量变化如图所示.已知1molCO(g)氧化为1molCO 2 (g)的△H=-283kJ/mol.请回答下列问题:
(1)图中A点表示:______;E的大小对该反应的反应热______(填“有”或“无”)影响.
(2)图中△H=______kJ/mol.
 零下佰度1年前1
零下佰度1年前1 -
 yiuuwu 共回答了20个问题
yiuuwu 共回答了20个问题 |采纳率90%(1)已知1molCO(g)氧化为1molCO 2 (g)的△H=-283kJ/mol,反应是放热反应,分析图象A点能量高为反应物的能量,C点为生成物的能量,E是反应的活化能,决定反应进行的难易;故答案为:反应物的总能量,无;(2...1年前查看全部
- 化学平衡中关于体积分数的问题向某一密闭容器中充入1molCO和2molH2O,发生反应 CO+H2O==CO2+H2 当
化学平衡中关于体积分数的问题
向某一密闭容器中充入1molCO和2molH2O,发生反应 CO+H2O==CO2+H2 当反应达到平衡时,CO的体积分数为x,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A0.5molCO+2molH2O+1molCO2+1molH2
B1 +1 +1 +1
C0.5 +1.5 +0.4 +0.4
D0.5 +1.5 +0.5 +0.5
(B C D略去单位了…)
我以B项为例,说说我哪里理解不了吧!转化过去应该是相当于2molCO和2molH2O,比原平衡多加了1molCO,所以平衡正向移动.但是为什么CO的体积分数就大于x?不是说改变压强,温度的时候可以判断体积分数的变化而改变浓度不可以吗?你看这里,加入CO不仅使它自身物质的量增大,也使整个体积增大,怎么判断得了? 独孤客小仙1年前1
独孤客小仙1年前1 -
 我牛我COOL 共回答了22个问题
我牛我COOL 共回答了22个问题 |采纳率100%增加某物质的浓度,其他物质的转化率升高,但是自身转化率下降.
AC水蒸汽的量增加,平衡向右移动,一氧化碳浓度减小.D等效平衡.所以选B.1年前查看全部
- 合成氨工业中的H2通过反应:CO+H2O=CO2+H2制得,今在一定温度下,将1molCO和 3mol水蒸气于密闭容器中
合成氨工业中的H2通过反应:CO+H2O=CO2+H2制得,今在一定温度下,将1molCO和 3mol水蒸气于密闭容器中反应,达到平衡后测得co2为0.75mol,再通入6mol水蒸气,重新平衡后,CO2,H2的物质的量之和为?
答案是1.8mol
平衡时,K=c(CO2)*c(H2) / c(CO)*c(H2O)=0.75*0.75 / [(1-0.75)*(3-0.75)]=1
(1-0.75)和3-0.75怎么理解啊?
 Vivianchang1年前1
Vivianchang1年前1 -
 43201955 共回答了20个问题
43201955 共回答了20个问题 |采纳率95%从反应方程式看,消耗一分子CO和H2O会生成一分子CO2和H2,所以平衡时生成了0.75molCO2,则同样生成了0.75molH2,消耗了0.75mol的H2O和CO.额,能理解了么?平衡常数就是生成物浓度积比上反应物浓度积,密闭容器,体积相同,所以mol比就是浓度比.1年前查看全部
- 将1molCO和NO2充入一容积恒定的密闭容器中,在催化剂存在下发生反应:CO(g)+NO2(g)——(可逆反应符号)—
将1molCO和NO2充入一容积恒定的密闭容器中,在催化剂存在下发生反应:CO(g)+NO2(g)——(可逆反应符号)——CO2(g)+NO(g)达到平衡时有50%的CO转化为CO2.在其他条件不变的情况下,若将1molCO和2molNO2充入上述密闭容器中,则反应达平衡后,混合气体中CO2的体积分数为1/6
如何计算得到 . 秋秋小小1年前1
秋秋小小1年前1 -
 超级电脑 共回答了21个问题
超级电脑 共回答了21个问题 |采纳率90.5%(1) CO(g) + NO2(g) CO2(g)+ NO(g)
起始1mol/L----1mol/L -------0---------0
平衡0.5 ----0.5--------0.5--------0.5mol/L
k == [CO2][NO]/[CO][NO2] == 1
(2) CO(g) + NO2(g) CO2(g)+ NO(g)
起始1mol/L----2mol/L ----0---------0
平衡(1-x)--(2-x)---------x-------- xmol/L
k == x*x/(1-x)*(2-x) == 1
x == 2/3
(3)反应达平衡后,混合气体中CO2的体积分数为2/9!1年前查看全部
- 将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应:NO2(g)+CO(g)⇌CO2(g)+NO(g)
将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应:NO2(g)+CO(g)⇌CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2.在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO的体积分数是( )
A.[1/9]
B.[1/6]
C.[2/9]
D.[1/3] Q版小辛1年前1
Q版小辛1年前1 -
 21878852 共回答了25个问题
21878852 共回答了25个问题 |采纳率88%解题思路:将1molCO和1molNO2充入密闭容器中,根据CO的转化率计算参加反应的CO的物质的量,利用三段式计算平衡时各组分的物质的量,由于反应前后气体的化学计量数之和相等,故可以利用物质的量代替浓度计算该温度下的平衡常数k,令1molCO和2molNO2充入上述反应器中,反应达到化学平衡时CO的物质的量为amol,利用三段式表示出平衡时各组分的物质的量,代入平衡常数计算a的值,再利用体积分数定义计算.将1molCO和1molNO2充入密闭容器中,平衡时CO的转化率为50%,则参加反应的CO为1mol×50%=0.5mol,则:
NO2(g)+CO(g)⇌CO2(g)+NO(g)
开始(mol):1 10 0
变化(mol):0.5 0.50.5 0.5
平衡(mol):0.5 0.5 0.5 0.5
故该温度下平衡常数k=[0.5×0.5/0.5×0.5]=1
其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,令反应达到化学平衡时CO的物质的量为amol,则:
NO2(g)+CO(g)⇌CO2(g)+NO(g)
开始(mol):2 10 0
变化(mol):1-a1-a1-a 1-a
平衡(mol):1+aa 1-a 1-a
故
(1−a)×(1−a)
(1+a)×a=1,解得a=[1/3]
故平衡时CO的体积分数为
1
3mol
1mol+2mol=[1/9]
故选A.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算,难度中等,注意根据化学平衡常数进行计算.1年前查看全部
- 将1molCO和1molH2O(g)充入某固定容积的反应器中,在某条件下达到平衡:CO+H2O(g)=CO2+H2
将1molCO和1molH2O(g)充入某固定容积的反应器中,在某条件下达到平衡:CO+H2O(g)=CO2+H2
现在在相同条件下,向容器中充入1molCO2,1molH2,1molH2O,则平衡应向哪移动?
答案写的是向正反应方向移动,原因是第二次相当于充入1molCO和2molH2O,H2O浓度变大,所以向右移动.
但我觉得,第二次由于多充入了1molH2O,所以压强变大,而增大压强,反应应向体积缩小的方向移动,但由于是等体积反应,所以平衡不移动,我的理解哪里错了? aona8881年前2
aona8881年前2 -
 luoyong0213 共回答了18个问题
luoyong0213 共回答了18个问题 |采纳率94.4%朋友,你在+H2和CO2时,反应已经开始进行,就相当与:你有2个容器,一个是原来的,另一个是+有H2 CO2的,有H2 CO2的容器已经在发生反应,达到平衡.现在将2个容器合在一起,为保持体积不变,既需要增大压强,因为系数相同,平衡不变.注意:到现在我还没有+H2O.在缩小体积后,你再+H2O,即增加反应物浓度,所以平衡正向移动.
理解否?这个是我们高三复习时又讲了一遍,我才听懂的,这块是比较难,需要合理的转化.
记住:平衡的向哪里移动,只能运用勒沙特里原理,而且只能改变1个条件,若改变多个条件,则必须要以等价的形式转化,使得其只变化一个条件.1年前查看全部
- A为烃,B为烃的含氧衍生物,取等物质的量的A和B混合物共0.5mol在1.5mol的氧气中完全燃烧,生成1molCO 2
A为烃,B为烃的含氧衍生物,取等物质的量的A和B混合物共0.5mol在1.5mol的氧气中完全燃烧,生成1molCO 2 和1.5molH 2 O。另取一定量的A和B完全燃烧,将其以任意物质的量比混合,且物质的量之和一定。试通过计算回答
(1)若生成CO 2 和水的物质的量一定,则A和B的分子式分别是______________(任写一组)
(2)若耗氧量一定,则A和B的分子式分别是________________(任写一组) shyshu1年前1
shyshu1年前1 -
 忘却xzh 共回答了24个问题
忘却xzh 共回答了24个问题 |采纳率91.7%(1)C 2 H 6 与C 2 H 6 O 2
(2)C 2 H 4 与C 2 H 6 O1年前查看全部
- 某密闭容器中充入1molCO和2molH 2 O(g),当反应:CO+H 2 O(g)⇌CO 2 +H 2 达到平衡时,
某密闭容器中充入1molCO和2molH 2 O(g),当反应:CO+H 2 O(g)⇌CO 2 +H 2 达到平衡时,CO的体积分数为X.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于X的是( ) A.1molCO+3molH 2 O(g) B.1molCO+1molH 2 O C.2molCO+4molH 2 O(g) D.1molH 2 O(g)+1molCO 2 +1molH 2  songbin1231年前1
songbin1231年前1 -
 劝你回头 共回答了22个问题
劝你回头 共回答了22个问题 |采纳率86.4%根据等效平衡解答,恒温恒容下,该反应前后气体体积不发生变化,将物质全部转化到左边满足n(CO):n(H 2 O)=1:2,为等效平衡,平衡时CO的体积分数相同,不同配比达到平衡时CO的体积分数大于原平衡中CO的体积分数X,说明不同配比全部转化到左边应n(CO):n(H 2 O)>1:2,
A.n(CO):n(H 2 O)=1:3<1:2,平衡时CO的体积分数小于X,故A错误;
B.n(CO):n(H 2 O)=1:1>1:2,平衡时CO的体积分数大于X,故B正确;
C.n(CO):n(H 2 O)=2mol:4mol=1:2,平衡时CO的体积分数小于X,故C错误;
D.1molH 2 O(g)+1molCO 2 +1molH 2 等效为1molCO+3molH 2 O(g),n(CO):n(H 2 O)=1:3<1:2,平衡时CO的体积分数小于X,故D错误;
故选:B.1年前查看全部
- 合成氨工业中的H2是通过反应CO+H2O⇌CO2+H2制得的.现在一定温度下,将1molCO和3mol水蒸气置于密闭容器
合成氨工业中的H2是通过反应CO+H2O⇌CO2+H2制得的.现在一定温度下,将1molCO和3mol水蒸气置于密闭容器中反应,达平衡后测得CO2为0.75mol,再通入6mol水蒸气,重新达到平衡后,CO2和H2的物质的量之和为( )
A. 1.2 mol
B. 1.5 mol
C. 1.8 mol
D. 2.5 mol 麻麻亮1年前1
麻麻亮1年前1 -
 flashboydaijun 共回答了20个问题
flashboydaijun 共回答了20个问题 |采纳率95%解题思路:反应CO+H2O(g)⇌CO2+H2达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物.根据题意:CO+H2O(g)⇌CO2 +H2,
初始物质的量:1 3 00
变化物质的量:0.750.750.75 0.75
平衡物质的量:0.25 2.250.75 0.75
此时二氧化碳和氢气的物质的量之和是1.5mol,再通入6mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各1mol,此时CO2和H2的物质的量之和是2mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2和H2的物质的量之和介于1.5mol-2mol之间.
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查学生可逆反应的特征以及化学平衡移动方面的知识,注意知识的积累是解题的关键,难度不大.1年前查看全部
- 向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O(g)⇌CO2+H2.当反应达到平衡时,CO
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O(g)⇌CO2+H2.当反应达到平衡时,CO的体积分数为x.若维持容器的体和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A. 0.5molCO+2molH2O(g)+1molCO2+1molH2
B. 1molCO+1molH2O(g)+1molCO2+1molH2.
C. 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D. 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 子小草三心1年前1
子小草三心1年前1 -
 huosile 共回答了22个问题
huosile 共回答了22个问题 |采纳率95.5%解题思路:此题考查判断等效平衡的方法,一般是将物质全部向一边进行极限转化,再与原反应进行比较来判断,若各物质与原来相等,则等效,否则不等效.A、0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:1.5mol:3mol=1:2,反应前后气体体积不变,平衡相同,CO的体积分数为x,故A不符合;
B、1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:2mol:2mol=1:1,反应前后气体体积不变,平衡正向进行,CO的体积分数大于x,故B符合;
C、0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2,假如反应完全转化为CO和H2O物质的量为:0.9mol:l.9mol=9:19,反应前后气体体积不变,平衡相同,CO的体积分数为x,故C不符合;
D、0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mo H2,假如反应完全转化为CO和H2O物质的量为1mol:2mol=1:2,当反应达到平衡时,CO的体积分数为x,故D不符合;
故选B.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查了化学平衡的影响因素分析,等效平衡的应用判断,极值转化是解题的关键,题目难度中等.1年前查看全部
- 、在一定条件下将1molCO和1mol水蒸气通入容器中发生下述反应,CO+H2O=(可逆号CO2……
、在一定条件下将1molCO和1mol水蒸气通入容器中发生下述反应,CO+H2O=(可逆号CO2……
在一定条件下将1molCO和1mol水蒸气通入容器中发生下述反应,CO+H2O=(可逆号CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.3摩尔水蒸气,又达到平衡后,CO2的物质的量为多少?为什么? sdg3641年前1
sdg3641年前1 -
 cys_hff8183 共回答了19个问题
cys_hff8183 共回答了19个问题 |采纳率94.7%CO + H2O === CO2 + H2平衡:0.4 0.4 0.6 0.6平衡常数:K == 0.6*0.6 / (0.4*0.4) == 2.25加入0.3mol水蒸气CO + H2O === CO2 + H2起始:0.4 0.7 0.6 0.6转化:x x x x平衡:0.4-x 0.7-x 0.6+x 0.6+xK == 2.25 == (0....1年前查看全部
- 已知1molCO气体完全燃烧生成CO2气体放出283kJ热量;1mol氢气完全燃烧生成液态水放出286kJ热量;1mol
已知1molCO气体完全燃烧生成CO2气体放出283kJ热量;1mol氢气完全燃烧生成液态水放出286kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ热量.
(1)写出氢气燃烧的热化学方程式H2(g)+[1/2]O2(g)═H2O(l)△H=-286kJ/molH2(g)+[1/2]O2(g)═H2O(l)△H=-286kJ/mol.
(2)若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为______ 890kJ( 填“>”、“<”、“=”).
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量(Q)的取值范围是______.
(4)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的取值范围是______. 破立相宜1年前1
破立相宜1年前1 -
 l_yunping 共回答了21个问题
l_yunping 共回答了21个问题 |采纳率81%解题思路:(1)依据热化学方程式的书写方法写出,标注物质聚集状态和对应焓变;
(2)根据不同聚集状态的水的能量不同,以及能量高低进行判断;
(3)利用极限法计算;
(4)CO2气体和水的物质的量相等,利用讨论法计算.(1)1mol氢气完全燃烧生成液态水放出286kJ热量,氢气燃烧的热化学方程式为:H2(g)+[1/2]O2(g)═H2O(l)△H=-286kJ/mol;
故答案为:H2(g)+[1/2]O2(g)═H2O(l)△H=-286kJ/mol;
(2)水由气态变为液态时要放热,1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热量,则1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量小于890kJ,故答案为:<;
(3)nmol全部是CO2,放出热量为283n kJ;
同理,nmol全部是CH4,放出热量为890n kJ;
nmol全部是H2,放出热量为286n kJ;
故将将n mol CH4、CO和H2的混合气体完全燃烧生成气体和液态水,放出热量Q的取值范围是:283n kJ<Q<890n kJ.
故答案为:283n kJ<Q<890n kJ;
(4)生成的CO2和液态H2O的物质的量相等,还用假设分析,有以下几种可能
①若无CO,生成的CO2和液态H2O的物质的量不相等,故不合题意
②若无H2,可能是CO和CH4各为[a/2]mol,
放出的热量(Q)=[a/2]×(283+890)=586.5a kJ,
③若无CH4,可能是CO和H2各为[a/2]mol,
放出的热量(Q)=[a/2]×(283+286)=284.5a kJ,
若无两种气体均不可能,
所以放出的热量(Q)的取值范围为:284.5a kJ<Q<586.5a kJ
故答案为:284.5a kJ<Q<586.5a kJ;点评:
本题考点: 热化学方程式;化学能与热能的相互转化.
考点点评: 本题考查反应热的计算,题目难度中等,注意极限法和讨论法的计算运用.1年前查看全部
- 下列叙述中正确的是( ) A.硝酸的摩尔质量63g B.1molCO 2 中含有1mol碳和2mol氧 C.3molO
下列叙述中正确的是( ) A.硝酸的摩尔质量63g B.1molCO 2 中含有1mol碳和2mol氧 C.3molO 2 与2molH 2 O所含原子数相同 D.H 2 SO 4 的摩尔质量就等于N A 个硫酸分子的质量  xixi4451年前1
xixi4451年前1 -
 79885651 共回答了17个问题
79885651 共回答了17个问题 |采纳率88.2%A、硝酸的摩尔质量是63g/mol,1mol硝酸的质量为63g,故A错误;
B、1mol碳和2mol氧指代不明确,故B错误;
C、3molO 2 含有6mol原子,2molH 2 O含有6mol原子(其中4mol氢原子、2mol氧原子),故C正确;
D、H 2 SO 4 的摩尔质量与N A 个硫酸分子的质量,二者单位不同.若硫酸的摩尔质量以g/mol为单位,N A 个硫酸分子的质量以g为单位,二者在数值上相等,故D错误.
故选:C.1年前查看全部
- 高一化学1molN2和1molCo所含的分子数和所含的原子数是怎么一回事,怎样求,
高一化学1molN2和1molCo所含的分子数和所含的原子数是怎么一回事,怎样求,
分子数和原子数是怎么办个求法?我这个地方特别糊涂. ewuihuihuihuk1年前2
ewuihuihuihuk1年前2 -
 独舟飘海 共回答了14个问题
独舟飘海 共回答了14个问题 |采纳率92.9%1molN2分子数是1NA,原子数是2NA
1molCO分子数是1NA,原子数是2NA
任何1mol物质,它的分子数都是NA个,
原子数目=分子的个数*每个分子中含有原子的个数
分子个数的求法:
求出物质的量,组织的量的数值乘以NA就是分子的个数
原子的求法:
求出物质的量,物质的量的数值乘以每个分子的个数乘以NA就是原子的个数.1年前查看全部
- CO(g)+2H2(g)可逆CH3OH(g)保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时
CO(g)+2H2(g)可逆CH3OH(g)保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小,
 小华小美1年前1
小华小美1年前1 -
 jkololo 共回答了13个问题
jkololo 共回答了13个问题 |采纳率92.3%不对,n(CH3OH)/n(CO)会增大.
根据你的叙述可知:此题应是在恒温和恒容密闭容器容积的充入1molCO和2molH2发生下面反应:
CO(g)+2H2(g)﹤=﹥CH3OH(g)当达到平衡后再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小,对吗?
CO(g)和H2(g)反应达到平衡后再充入1molCO和2molH2,平衡向正反应方向移动,体积中
CO(g)、H2(g)、CH3OH(g)的物质的量都增加,因此不容易判断前后两次平衡中
n(CH3OH)/n(CO)的大小,因平衡的建立与途径无关,可设计另外一个解题途径:
设想在两个体积完全相同的密闭容器容积中分别充入1molCO和2molH2,在保持温度和密闭容器容积不变的条件下,分别达到平衡,新建立的两个平衡完全相同.然后把这两个平衡压缩到其中一个密闭容器容积中保持温度和密闭容器容积不变,开始平衡体系的浓度同时增大两倍,但由于增大了压强,平衡向气体体积减少的方向移动,所以平衡向正反应方向移动,导致n(CH3OH)/n(CO)会增大.1年前查看全部
- 若1molco和H2的混合气体与H20反应,得到1.18mol co co2和H2的混合气体 ,则co的转化率为
 第3ss1年前2
第3ss1年前2 -
 了解十月天 共回答了14个问题
了解十月天 共回答了14个问题 |采纳率92.9%CO+H2O=可逆=H2 + CO2
初始 x 1-x 0
平衡后 y 1.18-(x-y)-y x-y
其中 x-y=0.18
所以转化率为 0.18/x1年前查看全部
- 在1L的密闭容器中,充入1molCO和1molH2O (g),于850℃时进行化学反应:CO(g)+H2O
在1L的密闭容器中,充入1molCO和1molH2O (g),于850℃时进行化学反应:CO(g)+H2O (g)⇌CO2(g)+H2(g)△H<0,达平衡时,有50%的CO转化为CO2.在相同温度下,将1molCO和4molH2O(g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表.下列说法正确的是( )
时间/min n(CO)/mol n(H2O)/mol n(CO2)/mol n(H2)/mol 0 1 4 0 0 4 0.25 3.25 0.75 0.75 6 n1 n2 n3 n4 8 n1 n2 n3 n4
A.前4min,用CO表示的化学反应速率为v(CO)=0.25mol/(L•min)
B.反应在第4 min时处于化学平衡状态
C.8分钟时,混合气体中CO2的体积分数为16%
D.若初始条件相同,绝热下进行上述反应,6 min时n(CO)>n1 caoyudehome1年前0
caoyudehome1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 向某一密闭容器中充入1molCO和2molH2O,发生反应 CO+H2O==CO2+H2 当反应达到平衡时,CO的体积分
向某一密闭容器中充入1molCO和2molH2O,发生反应 CO+H2O==CO2+H2 当反应达到平衡时,CO的体积分数为x,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A0.5molCO+2molH2O+1molCO2+1molH2
B1 +1 +1 +1
C0.5 +1.5 +0.4 +0.4
D0.5 +1.5 +0.5 +0.5
(B C D略去单位了…)
体积分数如何计算?若体积分数不再变化是否达到平衡?为什么?
老师讲的时候说B项物质的量是起始投料的1.5倍,所以压强就增大了1.5倍,为什么? 殇鱼1年前1
殇鱼1年前1 -
 麦香牛奶 共回答了27个问题
麦香牛奶 共回答了27个问题 |采纳率85.2%答案是B.
1、体积分数不用计算,只须判断平衡转移就行了,不增加反应物时,若平衡向右,则CO
的体积分数必定减小,反之则增大;若增加H2O,平衡也向右移,CO体积分数也减小;若增加CO,平衡也向右移,但CO体积分数增加.
2、体积分数指的是该物质的物质的量占总物质的量的百分比,故体积分数不变时,说明该物质的物质的量不再变化,反应达到平衡.
3、此题采用“等效转换法”来解决,即把右边的所有物质按比例折回左边和原来的相加,若得到的物质的量和起始加入量一致或成正比关系,则它们的状态是一样的.
A项中,CO2和H2转换后,得到CO为1.5,H2O为3,符合1:2,因为反应前后体积是不变的,所以A项中CO的体积分数和原来一样,但压强增大为原来的1.5倍,平衡并不移动.(可以这样理假设原来的容器体积为1L,现在加压,把容器体积变为2/3L,平衡不移动,但压强变为原来的1.5倍)
B项中,CO2和H2转换后,得到CO为2,H2O为2,相当于在原来的基础上加入1mol的CO,平衡右移,达新平衡后CO的体积分数大于x.
C项中,CO2和H2转换后,得到CO为0.9,H2O为1.9,体积比小于1:2,等效于加入H2O,平衡右移,达新平衡后CO的体积分数小于x.
D项中,CO2和H2转换后,得到CO为1,H2O为2,和原来一样,体积分数不变.1年前查看全部
- 在一定温度下将1molCO和3mol水蒸气放在密闭的容器中发生如下反应CO(g)+H2O(g)=====CO2(g)+H
在一定温度下将1molCO和3mol水蒸气放在密闭的容器中发生如下反应CO(g)+H2O(g)=====CO2(g)+H2(g)
达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为?
A 1.2 B 1.5 C 1.8 D 2.5 gkj20011年前1
gkj20011年前1 -
 大宇_鼻涕虫 共回答了16个问题
大宇_鼻涕虫 共回答了16个问题 |采纳率93.8%C
大于1.5,小于2.0.1年前查看全部
- 在密闭容器中加入1molCO和1.5molH2O(气),在一定条件下达到平衡生成[2/3]molCO2,反应为CO+H2
在密闭容器中加入1molCO和1.5molH2O(气),在一定条件下达到平衡生成[2/3]molCO2,反应为CO+H2O(g)⇌CO2+H2,当其他条件不变,充入的水蒸气变为2mol,平衡时CO2的物质的量可能是( )
A.[4/3]mol
B.0.73mol
C.1mol
D.[2/3]mol lance_tang1年前1
lance_tang1年前1 -
 忘不了那抹红 共回答了18个问题
忘不了那抹红 共回答了18个问题 |采纳率77.8%解题思路:设容器的体积为V,利用三段式分析,求得平衡常数,再由平衡常数计算出二氧化碳可能的物质的量;设容器的体积为V,利用三段式分析,
CO+H2O(g)⇌CO2 +H2
起始 1 1.5 0 0
转化 [2/3] [2/3] [2/3] [2/3]
平衡 1-[2/3] 1.5-[2/3] [2/3] [2/3]
所以平衡常数K=
2
3V×
2
3V
(
1−
2
3
V)(
1.5−
2
3
V)=1.6,
当充入的水蒸气变为2mol时,设平衡时CO2的物质的量为xmol,
则有 CO+H2O(g)⇌CO2 +H2
起始 1 2 0 0
转化 x x x x
平衡 1-x 2-x x x
根据K=
(
x
V)2
(
1−x
V)(
2−x
V)=1.6,得x=0.73,x的另一个值大于1,不符合题意,舍去.
故选B.点评:
本题考点: 化学平衡建立的过程;化学反应的可逆性.
考点点评: 本题主要考查了化学平衡常数的应用,中等难度,本题的难点在于计算有点繁.1年前查看全部
- 向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O(g)⇌CO2+H2.当反应达到平衡时,CO
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O(g)⇌CO2+H2.当反应达到平衡时,CO的体积分数为x.若维持容器的体和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A. 0.5molCO+2molH2O(g)+1molCO2+1molH2
B. 1molCO+1molH2O(g)+1molCO2+1molH2.
C. 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D. 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2 jpljabjx1年前1
jpljabjx1年前1 -
 燕不语 共回答了12个问题
燕不语 共回答了12个问题 |采纳率83.3%解题思路:此题考查判断等效平衡的方法,一般是将物质全部向一边进行极限转化,再与原反应进行比较来判断,若各物质与原来相等,则等效,否则不等效.A、0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:1.5mol:3mol=1:2,反应前后气体体积不变,平衡相同,CO的体积分数为x,故A不符合;
B、1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:2mol:2mol=1:1,反应前后气体体积不变,平衡正向进行,CO的体积分数大于x,故B符合;
C、0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2,假如反应完全转化为CO和H2O物质的量为:0.9mol:l.9mol=9:19,反应前后气体体积不变,平衡相同,CO的体积分数为x,故C不符合;
D、0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mo H2,假如反应完全转化为CO和H2O物质的量为1mol:2mol=1:2,当反应达到平衡时,CO的体积分数为x,故D不符合;
故选B.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查了化学平衡的影响因素分析,等效平衡的应用判断,极值转化是解题的关键,题目难度中等.1年前查看全部
- (1)图1是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______.

(2)观察图2a和b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系.
图a:______;
图b:______. 意纵天高1171年前1
意纵天高1171年前1 -
 十二月初三 共回答了22个问题
十二月初三 共回答了22个问题 |采纳率81.8%解题思路:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,根据热化学方程式书写原则进行书写;
(2)根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等).
图a:以A为起点,最终又回到A,整个过程没有能量变化;
图b:变化有两个途径A→F,A→B→C→D→E→F,两个途径的热效应相同.(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(2)图a:以A为起点,最终又回到A,整个过程没有能量变化,所以△H1+△H2+△H3+△H4+△H5+△H6=0;
图b:变化有两个途径A→F,A→B→C→D→E→F,两个途径的热效应相同,所以△H1+△H2+△H3+△H4+△H5=△H6,
故答案为:△H1+△H2+△H3+△H4+△H5+△H6=0;△H1+△H2+△H3+△H4+△H5=△H6.点评:
本题考点: 用盖斯定律进行有关反应热的计算;热化学方程式.
考点点评: 本题考查热化学方程式书写、盖斯定律等,难度不大,注意能量变化示意图的理解,反应物、生成物应注明状态与物质的量.1年前查看全部
- 合成氨工业中的H2是通过反应CO+H2O⇌CO2+H2制得的.现在一定温度下,将1molCO和3mol水蒸气置于密闭容器
合成氨工业中的H2是通过反应CO+H2O⇌CO2+H2制得的.现在一定温度下,将1molCO和3mol水蒸气置于密闭容器中反应,达平衡后测得CO2为0.75mol,再通入6mol水蒸气,重新达到平衡后,CO2和H2的物质的量之和为( )
A.1.2 mol
B.1.5 mol
C.1.8 mol
D.2.5 mol polygraph1年前1
polygraph1年前1 -
 dancy1184 共回答了19个问题
dancy1184 共回答了19个问题 |采纳率84.2%解题思路:反应CO+H2O(g)⇌CO2+H2达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物.根据题意:CO+H2O(g)⇌CO2 +H2,
初始物质的量:1 3 00
变化物质的量:0.750.750.75 0.75
平衡物质的量:0.25 2.250.75 0.75
此时二氧化碳和氢气的物质的量之和是1.5mol,再通入6mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各1mol,此时CO2和H2的物质的量之和是2mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2和H2的物质的量之和介于1.5mol-2mol之间.
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查学生可逆反应的特征以及化学平衡移动方面的知识,注意知识的积累是解题的关键,难度不大.1年前查看全部
- 1molN2与1molCO的电子数是否相同
 护花使者王1年前3
护花使者王1年前3 -
 kitezhu 共回答了13个问题
kitezhu 共回答了13个问题 |采纳率84.6%相同1年前查看全部
- 下列说法正确的是 A.在101kPa时,1molC与适量O 2 反应生成1molCO时,放出110.5kJ热量,则C的燃
下列说法正确的是
A.在101kPa时,1molC与适量O 2 反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol B.在101kPa时,1molH 2 完全燃烧生成液态水,放出285.8kJ热量,H 2 燃烧热为
—285.8kJ/molC.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 D.在稀溶液中:H + (aq) + OH -- (aq) ="==" H 2 O(l);△H= —57.3kJ/mol,若将含0.5molH 2 SO 4 的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ  wufang0051年前1
wufang0051年前1 -
 sth-changes 共回答了22个问题
sth-changes 共回答了22个问题 |采纳率72.7%B
1年前查看全部
- 将1molCO和1molH 2 O充入容器中,在催化剂存在下发生反应
将1molCO和1molH 2 O充入容器中,在催化剂存在下发生反应
H 2 O (g) + CO(g) H 2 (g) + CO 2 (g)
H 2 (g) + CO 2 (g)
达到平衡时,发现有50%的CO转化为CO 2 。在其他条件不变的情况下,若将1molCO和2molH 2 O充入反应器中,则反应达平衡后,混合气体中CO 2 的体积分数可能为()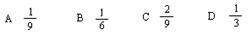
 A6M51年前1
A6M51年前1 -
 alon2008 共回答了22个问题
alon2008 共回答了22个问题 |采纳率77.3%C
若转化率为50%,CO 2 的体积分数为1/6,若转化率为100%,CO 2 的体积分数为1/3,由于CO的转化率介于50%——100%之间,所以CO 2 的体积分数介于1/6——1/3之间。1年前查看全部
- 在一定温度下将各1molCO和水蒸气放在密闭的容器中反应:CO+H2OCO2+H2
在一定温度下将各1molCO和水蒸气放在密闭的容器中反应:CO+H2OCO2+H2
(反应物生成物都是气体),达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为()A等于0.6mol B等于1mol C大于0.6mol小于1mol D大于1mol yj_ys1年前3
yj_ys1年前3 -
 guangvicky 共回答了27个问题
guangvicky 共回答了27个问题 |采纳率92.6%增加水蒸气的浓度,有利于平衡右移,使二氧化碳的物质的量增加,所以大于0.6摩尔,又由于该反应是可逆反应,不能进行到底,反应物一氧化氮只有1摩尔,所以产物二氧化碳的物质的量达不到1摩尔.答案为C1年前查看全部
- 四川的一题反应平衡的题目向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO(g)+H2O(g)=CO2
四川的一题反应平衡的题目
向某密闭容器中充入1molCO和2molH2O(g),发生反应:
CO(g)+H2O(g)=CO2(g)+H2(g).当反应达到平衡时,CO的体积分数为X.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于X的是()
A.0.5molCO+2molH2O+1molCO2+1molH2
B.1molCO+1molH2O+1molCO2+1molH2 C.0.5molCO+1.5molH2O+0.4molCO2+0.4molH2 D.0.5molCO+1.5molH2O+0.5molCO2+0.5molH2
我知道选B, kvkv02541年前1
kvkv02541年前1 -
 天使猪猪2004 共回答了28个问题
天使猪猪2004 共回答了28个问题 |采纳率92.9%题目中给的:CO(g)+H2O(g)=CO2(g)+H2(g).
当充入1molCO和2molH2O的时候,也就是n(CO):n(H2O)=1:2时,CO的体积分数为X.
而且反映是恒温恒容的,所以只要选项中的反应物的物质的量之比与原平衡成比例就可以了,也就是当n(CO):n(H2O)=1:2就是与原平衡完全等效的. 但是注意他问的是大于X,所以n(CO):n(H2O)要大于1:2的才是正确答案.
A:CO(g)+H2O(g)=CO2(g)+H2(g).
n.0.5.2.1.1
再把生成物1molCO2+1molH2 根据化学方程式的化学计量数之比,直接转化成为反应物,
所以最后平衡时得到n(CO)=0.5+1=1.5mol
n(H2O)=2+1=3mol
1.5:3符合1:2的关系,所以A中CO的体积分数还是为X不变.
B呢,大致还是像A那么算啦,把生成物的物质的量全部转化成为反应物的.
最后得出的结果平衡时n(CO)=1+1=2, n(H2O)=1+1=2
所以他们的物质的量之比是1:1,不符合1:2了,很明显是CO多了吧?
如果要1:2.那么CO只要0.5 mol就够了呀,最后B选项达到平衡时CO的体积分数大于X,就选这个.
这样说详细了吗?CD也是这种方法得到的,你自己可以尝试做做哦.1年前查看全部
- 已知1molCO气体完全燃烧生成CO2气体放出284KJ热量;1mol氢气完全燃烧生成液态水放出286KJ热量;
已知1molCO气体完全燃烧生成CO2气体放出284KJ热量;1mol氢气完全燃烧生成液态水放出286KJ热量;
1molCH4气体完全燃烧生成二氧化碳气体和液态水放出890KJ热量.若将amolCH4、CO和H2的混合气体完全燃烧时生成二氧化碳气体和液态水则放出的热量的取值范围是 目目1年前1
目目1年前1 -
 sdfs0 共回答了20个问题
sdfs0 共回答了20个问题 |采纳率95%248a~890a1年前查看全部
- 1mol C与1 1mol C与1 mol H2O(g)反应生成1molCO(g)和1molH2O(g),需要吸收131
1mol C与1 1mol C与1 mol H2O(g)反应生成1molCO(g)和1molH2O(g),需要吸收131.5kj能量,求△H
我想说△H是不是就是131.5KJ啊…… 小猪乖曦1年前2
小猪乖曦1年前2 -
 一个错误的人 共回答了20个问题
一个错误的人 共回答了20个问题 |采纳率85%C + H2O(g) === CO(g) + H2(g)反应物各1mol时,这个反应需要吸收131.5KJ能量,ΔH为131.5KJ/mol,注意单位.
希望对你有所帮助.1年前查看全部
- 向某密闭容器中充入1molCO和2molH 2 O(g),发生反应:CO+H 2 O (g) CO 2 +H 2 。当反
向某密闭容器中充入1molCO和2molH 2 O(g),发生反应:CO+H 2 O (g)
 CO 2 +H 2 。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO 2 +H 2 。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是A.0.5molCO+2molH 2 O(g)+1molCO 2 +1molH 2 B.1molCO+1molH 2 O(g)+1molCO 2 +1molH 2 C.0.5molCO+1.5molH 2 O(g)+0.4molCO 2 +0.4molH 2 D.0.5molCO+1.5molH 2 O(g)+0.5molCO 2 +0.5molH 2  开心吗1年前1
开心吗1年前1 -
 已删除的记忆 共回答了18个问题
已删除的记忆 共回答了18个问题 |采纳率88.9%B
1年前查看全部
大家在问
- 1亲问一下这道题如何解用一只棱长6厘米的正方体容器盛满水后,倒入一只长12厘米,宽6厘米,高5厘米的长方体水箱里,水面高多
- 2物体静止在光滑水平面上,先对物体施加一水平向右的恒力F1经时间t后撤去F1立即再对它施加一水平向左的恒力F2,又经时间t
- 3翻译How can we do this?
- 4我的烦恼 作文
- 51×3×5+2×6×10+4×12×20+7×21×35分之 1×2×3+2×4×6+4×8×12+7×14×21=?
- 6初中英语题The building is now a supermarket. It ___a cinema.A.is
- 7古诗中,五言绝句是四句诗,每句五个字;七言绝句是四句诗,每句都是7个字,有一本诗集,其中五言绝句比七言绝句多13首,总字
- 8某中学组织七年级学生秋游,原计划租用45座的客车若干辆,但有15人没有座位;如果租用同样数量的60座客车则多出一辆车,且
- 9温度与催化剂改变活化分子数的 性质一样吗
- 10关于地磁场,下列说法正确的是( )
- 11一道关于化学题某食品公司在“XX饼干”的包装袋内放入一小包干燥剂,它的主要成分是生石灰.(1)干燥剂包装袋上标明“请勿食
- 12求值:sin10°sin50°sin70°sin80°
- 13everywhere 和肯定句中的anywhere有什么区别
- 14证明函数极限:若x-->2,则5x+2-->12.
- 15在平面直角坐标系中,直线l1的解析式为y=x-3,直线l2过原点且l2与直线l1交于点P(-2,a).