工业是国民经济的主导产业,合理分布工业是工业建设中的一个重大的战略问题.我国东部沿海地区分布着四大工业基地.读图,回答1
 tutu_1252022-10-04 11:39:541条回答
tutu_1252022-10-04 11:39:541条回答 工业是国民经济的主导产业,合理分布工业是工业建设中的一个重大的战略问题.我国东部沿海地区分布着四大工业基地.读图,回答16-18题.
工业是国民经济的主导产业,合理分布工业是工业建设中的一个重大的战略问题.我国东部沿海地区分布着四大工业基地.读图,回答16-18题.图甲代表的工业基地是( )
A.辽中南工业基地
B.沪宁杭工业基地
C.京津唐工业基地
D.珠江三角洲工业基地

已提交,审核后显示!提交回复
共1条回复
 USB2-0 共回答了21个问题
USB2-0 共回答了21个问题 |采纳率100%- 解题思路:我国的四大工业基地:辽中南工业基地、京津唐工业基地、沪宁杭工业基地和珠江三角洲工业基地.四大工业基地都位于东部沿海.
从北向南我国的四大工业基地分别为:辽中南工业基地、京津唐工业基地、沪宁杭工业基地、珠江三角洲工业基地;图中所示甲为辽中南工业基地;乙为沪宁杭工业基地.
故选:A.点评:
本题考点: 京津唐、辽中南工业基地的位置和特点.
考点点评: 认真观察地图,熟记四大工业基地的名称和位置. - 1年前
相关推荐
- 今年一月份某地区的农业总产值与工业总产值均为a亿元
今年一月份某地区的农业总产值与工业总产值均为a亿元
在2、3两个月,农业总产值平均每月减少的百分率为x,我想问一下,这里的“百分率为x”的x里包含了百分吗?是列a(1+x)²还是a(1+x%)²?
 穿201件衣服1年前1
穿201件衣服1年前1 -
 千古不唱 共回答了19个问题
千古不唱 共回答了19个问题 |采纳率89.5%3月份农业总产值为A*(1-x%)²,
工业总产值为A*(1+x%)²,
那么A*(1+x%)²-A*(1-x%)²
=A*[(1+x%)²-*(1-x%)²]
=4*A*x%
即3月份工业总产值比农业总产值多4*A*x%亿元.1年前查看全部
- 工业用酒精食用酒,工业用醋酸与食用醋,工艺有何不同?它们的化学方程式是?
 翼神龙DRAGON1年前1
翼神龙DRAGON1年前1 -
 sp_lele 共回答了12个问题
sp_lele 共回答了12个问题 |采纳率100%工业用酒精:甲醇CH3IH
食用酒:乙醇CH3CH3OH
工业用醋酸:冰醋酸CH3COOH
食用醋:稀释的冰醋酸CH3COOH
❤您的问题已经被解答~~(>^ω^1年前查看全部
- (Ⅰ)从海水中可提取各种化工原料.如图是工业上对海水综合利用的示意图如图1.
(Ⅰ)从海水中可提取各种化工原料.如图是工业上对海水综合利用的示意图如图1.

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时需用四种试剂,使上述离子逐一沉淀,加入试剂的顺序是:NaOH溶液→①______→②______→盐酸.
(2)由MgCl2•6H2O晶体脱水制无水MgCl2时,需要控制的条件是______;若对该晶体直接加热,将发生反应的化学方程式为MgCl2•6H2O
Mg(OH)2+2HCl+4H2O△ .MgCl2•6H2O.
Mg(OH)2+2HCl+4H2O△ .
(Ⅱ)A、B、C、D、E、F六种物质的相互转化关系如图2所示(反应条件未标出),其中反应①是置换反应.
(1)若A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是2C+SiO2
Si+2CO高温 .2C+SiO2.
Si+2CO高温 .
(2)若A、D、F都是单质,且A为金属,F为黄绿色气体,则反应②的离子方程式是______. 十二浪子1年前0
十二浪子1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 以下说法哪个是对的?( )A. 工业是国民经济的基础B. 农业是国民经济的主导C. 交通运输业是经济发展的“先行官”D
以下说法哪个是对的?( )
A. 工业是国民经济的基础
B. 农业是国民经济的主导
C. 交通运输业是经济发展的“先行官”
D. 旅游业是支柱产业 盗拓x1年前1
盗拓x1年前1 -
 牛肉面2碗 共回答了10个问题
牛肉面2碗 共回答了10个问题 |采纳率70%解题思路:依据交通运输业的地位来解答此题.交通运输业被称为经济发展的“先行官”,交通运输业是指利用各种运输工具,促使客、货沿特定的路线实现空间位移的物质生产部门,它起着连接工业与农业、生产与消费、城市与乡村的纽带作用,交通运输不仅与我们的生活息息相关,而且对地区的发展起着极其重要的作用,所以人们形象的把交通运输业称为经济发展的“先行官”.
故选:C.点评:
本题考点: 交通运输业的地位.
考点点评: 本题考查了被称为先行官的交通运输业,常见的基础选择题.1年前查看全部
- 如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH) 2 的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH) 2 ,使用硫酸钠做电解质溶液,阳极选用 作电极。
 过眼vs云烟1年前1
过眼vs云烟1年前1 -
 ttqqTT 共回答了16个问题
ttqqTT 共回答了16个问题 |采纳率93.8%(1)CH 4 -8e - +10OH - =CO 3 2 - +7H 2 O
(2)2Cl - -2e - =Cl 2 ↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
1年前查看全部
- 导致酸雨的主要原因是空气中含有大量的( ) A.由工业燃烧排放的二氧化碳 B.由工业燃烧排放的二氧化硫 C.由人类活动
导致酸雨的主要原因是空气中含有大量的( ) A.由工业燃烧排放的二氧化碳 B.由工业燃烧排放的二氧化硫 C.由人类活动引起的臭氧增加 D.由人类活动排放的含氮物质  l7non1年前1
l7non1年前1 -
 fdsdsaff 共回答了25个问题
fdsdsaff 共回答了25个问题 |采纳率88%酸雨是由于人类大量使用含硫量高的煤、石油、天然气等燃料,燃烧后产生的含有二氧化硫等的气体,在大气中经过复杂的化学反应后,形成硫酸或亚硫酸气溶胶,或为云、雨、雪、雾捕捉吸收,降到地面成为酸雨.
故选:B1年前查看全部
- 工业上主要分离液态空气的方法制氧气,所利用的原理是
 xfwld1年前3
xfwld1年前3 -
 sabrina0213 共回答了23个问题
sabrina0213 共回答了23个问题 |采纳率95.7%不同气体的沸点不同1年前查看全部
- 硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢.(皓矾为
硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(baso4+zns)和过氧化氢.(皓矾为znso4•7h2o)

(1)上述流程***有7个化学反应,其中有______个属于氧化还原反应.
(2)写出过氧化氢和物质c的电子式:______,______.
(3)写出f、g的化学式:f______、g______.
(4)写出下列化学反应方程式:反应③______.反应⑦______.
(5)取锌钡白固体16.5g溶于100ml 1mol/l的h2so4 溶液中,放出h2s 气体1008ml(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为______mol/l;
②加热驱尽溶液中h2s 后,为使锌离子刚好完全沉淀,应加入 1mol/l的naoh溶液______ml. fjfcvvf551年前1
fjfcvvf551年前1 -
 didididd 共回答了23个问题
didididd 共回答了23个问题 |采纳率91.3%解题思路:重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4•7H2O)反应生成锌钡白(BaSO4和ZnS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)元素化合价在反应前后发生变化的反应属于氧化还原反应;
(2)H2O2属于共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对;
C是CO2,属于共价化合物,分子中碳原子与氧原子之间形成2对共用电子对;
(3)由分析可知,F是BaCO3,G是BaO;
(4)根据上述分析可知各反应中反应物与产物,配平书写方程式;
(5)①锌钡白固体中n(ZnS)=n(BaSO4),计算16.5g锌钡白固体中n(ZnS)=n(BaSO4)=0.05ml,1008mLH2S气体的物质的量为[1.008L/22.4L/mol]=0.045mol,所以溶液中氢硫酸的物质的量为0.05mol-0.045mol=0.005mol,再根据c=[n/V]计算硫化氢的浓度;
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,形成的溶液为硫酸钠溶液,根据硫酸根守恒可知,n(Na2SO4)=n(H2SO4),由钠离子守恒可知,n(NaOH)=2n(Na2SO4)=2n(H2SO4),再根据V=[n/c]计算.重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4•7H2O)反应生成锌钡白(BaSO4和ZnS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)流程中7个化学反应,反应①BaSO4+4C=BaS+4CO↑,碳元素的化合价由0价升高为+2价,硫元素化合价由+6价降低为-2价,属于氧化还原反应;反应②是CO的燃烧,碳元素、氧元素化合价发生变化,属于氧化还原反应;反应③BaS+ZnSO4=ZnS↓+BaSO4↓,各元素化合价未发生变化,属于复分解反应;反应④BaS+H2O+CO2=BaCO3↓+H2S,各元素化合价未发生变化,属于复分解反应;反应⑤为BaCO3
高温
.
Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2
△
.
2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应,故答案为:3;
(2)H2O2属于共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对,电子式为 ;
;
C是CO2,属于共价化合物,分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ,
,
故答案为: ;
; ;
;
(3)由分析可知,F是BaCO3,G是BaO,故答案为:BaCO3;BaO;
(4)由分析可知,反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.反应⑦:BaO2+H2SO4=BaSO4↓+H2O2,
故答案为:BaS+ZnSO4=ZnS↓+BaSO4↓;BaO2+H2SO4=BaSO4↓+H2O2;
(5)①由工艺流程,反应③:BaS+ZnSO4=ZnS↓+BaSO4↓可知,锌钡白固体中n(ZnS)=n(BaSO4),所以n(ZnS)×97g/mol+=n(BaSO4)×233g/mol=16.5g,解得n(ZnS)=n(BaSO4)=0.05ml,1008mLH2S气体的物质的量为[1.008L/22.4L/mol]=0.045mol,所以溶液中氢硫酸的物质的量为0.05mol-0.045mol=0.005mol,溶液中氢硫酸的物质的量浓度为[0.005mol/0.1L]=0.05mol/L,
故答案为:0.05;
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,形成的溶液为硫酸钠溶液,根据硫酸根守恒可知,n(Na2SO4)=n(H2SO4),由钠离子守恒可知,n(NaOH)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×1mol/L=0.2mol,故需要1mol/L的NaOH溶液体积为[0.2mol/1mol/L]=0.2L=200mL,故答案为:200.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;含硫物质的性质及综合应用.
考点点评: 本题以制备锌钡白和过氧化氢为载体,考查物质推断、氧化还原反应、化学用语、化学计算等,难度中等.是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.1年前查看全部
- (15分) 铝土矿(主要成分为Al 2 O 3 ,还含有SiO 2 、Fe 2 O 3 )是工业上制备氧化铝的主要原料。
(15分) 铝土矿(主要成分为Al 2 O 3 ,还含有SiO 2 、Fe 2 O 3 )是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

① 沉淀 A、B的成分分别是 、 ;步骤②中的试剂a是 ;
② 试写出步骤③中发生反应的离子方式 __________ 、
__________ __________ ;
③试写出步骤③中滤液分解反应的方程式____________________________________.
④简述氯化铝溶液经过结晶得到氯化铝晶体的实验条件是 。 风中怪杰1年前1
风中怪杰1年前1 -
 萝卜英子 共回答了17个问题
萝卜英子 共回答了17个问题 |采纳率82.4%(1) ① SiO 2 Fe(OH) 3 NaOH溶液(各2分)
② CO 2 + OH - =HCO 3 - CO 2 + AlO 2 - + 2H 2 O = Al(OH) 3 ↓+ HCO 3 - (各2分)
③ 2NaHCO 3 Na 2 CO 3 + CO 2 ↑ + H 2 O (各2分)
Na 2 CO 3 + CO 2 ↑ + H 2 O (各2分)
④将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解。(3分)
(1)二氧化硅和盐酸不反应,所以A是二氧化硅。滤液甲中含有铝离子和铁离子,加入过量的氢氧化钠,则生成氢氧化铁沉淀,即B是氢氧化铁。滤液乙中含有偏铝酸钠,通入CO 2 生成氢氧化铝沉淀。
(2)滤液乙中还含有过量的氢氧化钠,所以方程式为CO 2 + OH - =HCO 3 - 、CO 2 + AlO 2 - + 2H 2 O = Al(OH) 3 ↓+ HCO 3 - 。
(3)碳酸氢钠不稳定,受热易分解,方程式为2NaHCO 3 Na 2 CO 3 + CO 2 ↑ + H 2 O。
Na 2 CO 3 + CO 2 ↑ + H 2 O。
(4)由于氯化铝易水解,所以在蒸发浓缩时必须防止水解,因此方法是将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解。1年前查看全部
- 高中物理:下列事实不能用勒夏特列原理解释的是 ( ) A.合成氨工业采用高温和催化剂等条件
高中物理:下列事实不能用勒夏特列原理解释的是 ( ) A.合成氨工业采用高温和催化剂等条件
下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业采用高温和催化剂等条件
B.H2.I2.HI混合气体加热后颜色变深
C.合成氨时尽可能增大体系压强
D.打开汽水瓶,看到大量的气泡逸出
标准答案是 A.这与网上的答案不同.请您向详细解释其中的道理.谢谢.
是高中化学 tuna_lover1年前1
tuna_lover1年前1 -
 NoRoomintheArk 共回答了18个问题
NoRoomintheArk 共回答了18个问题 |采纳率88.9%合成氨是一个放热反应,按照勒夏特列原理,降低温度有利于提高氨气产率.实际工业中取高温是为了最大发挥催化剂的活性.且催化剂不影响化学平衡,所以本题选A1年前查看全部
- 在细菌作用下,用氨处理含甲醇的工业废水,使其变为无毒的氮气和二氧化碳,从而消除对环境的污染,有关的反应为:6NH3+5C
在细菌作用下,用氨处理含甲醇的工业废水,使其变为无毒的氮气和二氧化碳,从而消除对环境的污染,有关的反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;上述反应中B物质的化学式为( )
A. H2
B. O2
C. NO
D. CO 朝晖路打更的1年前1
朝晖路打更的1年前1 -
 半点微笑005 共回答了19个问题
半点微笑005 共回答了19个问题 |采纳率84.2%解题思路:由反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;根据质量守恒定律的元素守恒可知:反应前后的元素种类、原子个数,则可推测B物质的化学式.由反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;根据质量守恒定律的元素守恒可知:反应前后的元素种类、原子个数,则反应前的原子个数为:氮原子为6个,氢原子为38个,碳原子5个,氧原子5个;而反应后的原子个数为:氮原子为6个,氢原子为38个,碳原子5个,氧原子29个,故可知12B中含有24个氧原子.故为:O2.
故选B.点评:
本题考点: 质量守恒定律及其应用;有关化学式的计算和推断.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力,学会利用质量守恒定律的元素守恒处理问题.1年前查看全部
- 硝酸工业生产中的尾气可用纯碱溶液吸收.有关的化学反应为:1、2NO2+Na2CO3=NaNO2+NaNO3+CO2 2、
硝酸工业生产中的尾气可用纯碱溶液吸收.有关的化学反应为:1、2NO2+Na2CO3=NaNO2+NaNO3+CO2 2、NO+NO2+Na2CO2=2NaNO+CO2 现有1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.计算吸收液中NaNO2与NaNO3的物质的量比
 猪头肉炒饭1年前1
猪头肉炒饭1年前1 -
 fly1025228 共回答了26个问题
fly1025228 共回答了26个问题 |采纳率84.6%第二个反应该是:NO + NO2 + Na2CO3 ==== 2NaNO2 + CO2
【解析】
反应①
2NO2 + Na2CO3==== NaNO2 + NaNO3 + CO2 液体增重
质量 2×46 92-44=48
物质的量 2 1
反应②
NO + NO2 + Na2CO3 ==== 2NaNO2 + CO2 液体增重
质量 30 46 138 44 30+46-44=32
物质的量 1 1 2 1
现在假设,由NO2和Na2CO3反应,生成的CO2为 Xmol
而,有NO、NO2和Na2CO3反应,生成的CO2为Y mol
得到俩方程: X + Y = 1 (该等式为CO2的物质的量)
48X + 32Y = 44 (该等式为、溶液增重的质量)
====> X=0.75 Y =0.25
所以,在反应①中,生成NaNO2 0.75mol、NaNO3 0.75mol
在反应②中,生成NaNO2 0.5mol
也就是说,总共生成NaNO2 1.25mol NaNO3 0.75mol
物质的量比为: NaNO2 : NaNO3 = 0.75 : 1.25 = 3:5
就是这样~~~
回答满意请采纳!1年前查看全部
- 关于化学的题一道题,某工厂的工业废水中含有大量的FeSo4、较多的Cu2+和Na+。为了减少污染,工厂计划从废水中回收硫
关于化学的题
一道题,某工厂的工业废水中含有大量的FeSo4、较多的Cu2+和Na+。为了减少污染,工厂计划从废水中回收硫酸亚铁和金属铜。请说明操作方法,完成回收硫酸亚铁和铜的简单实验方案。谢了!尽量说仔细一点!
各位高手,我赶时间!我先谢谢了! 当午妹锄禾哥又要1年前1
当午妹锄禾哥又要1年前1 -
 yukiwa 共回答了15个问题
yukiwa 共回答了15个问题 |采纳率93.3%用铁屑将Cu置换出来,再用硫酸洗涤过量的铁粉,过滤可以得到纯净的铜单质,然后对滤液进行加热浓缩,冷却结晶,可以得到含有结晶水的硫酸亚铁,最后烘干晶体。1年前查看全部
- 工业上利用反应3Cl2+8NH3═N2+6NH4Cl检查氯气管道是否漏气.下列说法错误的是( )
工业上利用反应3Cl2+8NH3═N2+6NH4Cl检查氯气管道是否漏气.下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应中NH3被还原
D.该反应中氧化剂与还原剂的物质的量之比为3:2 liangzhi1111年前1
liangzhi1111年前1 -
 善解人意的心 共回答了17个问题
善解人意的心 共回答了17个问题 |采纳率88.2%解题思路:反应3Cl2+8NH3═N2+6NH4Cl中,Cl元素化合价降低,被还原,Cl2为氧化剂,N元素化合价升高,被氧化,NH3为还原剂,NH3与HCl反应生成氯化铵,有白烟生成,以此解答.A.反应生成氯化铵,有白烟生成,故A正确;
B.Cl元素化合价降低,被还原,Cl2为氧化剂,故B正确;
C.N元素化合价升高,被氧化,NH3为还原剂,故C错误;
D.反应中Cl2为氧化剂,NH3为还原剂,由方程式可知,当有8molNH3参加反应,有2mol被氧化,则该反应中氧化剂与还原剂的物质的量之比为3:2,故D正确.
故选C.点评:
本题考点: 氯气的化学性质;氧化还原反应.
考点点评: 本题考查氯气的性质,侧重于化学与生活、生产的联系以及氧化还原反应的考查,注意从元素化合价的角度解答该题,难度不大.1年前查看全部
- 工业上用电解饱和食盐水的方法制取氢氧化钠、氢气和氯气.当制取112m(S.T.P)氢气时制取氢氧化钠多少克?氯气多少立方
工业上用电解饱和食盐水的方法制取氢氧化钠、氢气和氯气.当制取112m(S.T.P)氢气时制取氢氧化钠多少克?氯气多少立方米?第二小题我做出来112m.答案上是56m.
 A200121061年前1
A200121061年前1 -
 shenzhenhyj 共回答了16个问题
shenzhenhyj 共回答了16个问题 |采纳率87.5%可以是用电荷守恒做 那样可以算出是 112m 所以是答案错了 相信你自己 我支持你1年前查看全部
- 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2□+8CO2高温 .
②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①中的氧化剂是O2,还原剂是FeO•Cr2O3
C.□内的物质是Fe3O4
D.生成1 mol Na2Cr2O7,时共转移6 mol电子 亲爱的ミ1年前1
亲爱的ミ1年前1 -
 yyuu852 共回答了11个问题
yyuu852 共回答了11个问题 |采纳率72.7%解题思路:A.有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的升降;
B.得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
C.根据元素守恒及原子守恒判断;
D.根据Na2Cr2O7和转移电子之间的关系式计算.A.在反应前后,②中各元素的化合价都不变化,所以不是氧化还原反应,故A错误;
B.反应①氧气得电子化合价降低,所以氧气是氧化剂,FeO•Cr2O3中铁和铬元素化合价都升高,所以FeO•Cr2O3是还原剂,故B正确;
C.根据原子守恒知,□内的物质是Fe2O3,故C错误;
D.反应②中生成1molNa2Cr2O7需要2molNa2CrO4,由反应①可知,参加反应FeO•Cr2O3为1mol,反应中Fe元素化合价由+2价升高为+3价,Cr由+3升高为+6,故生成1molNa2Cr2O7共转移电子的物质的量为1mol×[1+(6-3)]=7mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应基本概念与计算等,难度中等,注意根据化合价理解氧化还原反应.1年前查看全部
- 日本是世界上发达的工业大国,你认为日本工业发展的有利条件有哪些?不利条件有哪些?
 mokiyu1年前1
mokiyu1年前1 -
 doinotdid 共回答了20个问题
doinotdid 共回答了20个问题 |采纳率85%有利条件:劳动力素质高,高精尖产业发达,这是日本之所以强大的最主要的原因.不利条件:很明显,资源极度缺乏,粮食无法自给,百分之九十的工业原料需要进口,过度依赖海上生命线.一旦发生战争,只要切断他的海上生命线,不出四个月,日本将不战而降.1年前查看全部
- 高中化学氨气是一种重要工业原料,在工农业生产中具有重要的应用. (1)已知:N2(g)+O2(g)===2NO(g);Δ
高中化学
氨气是一种重要工业原料,在工农业生产中具有重要的应用. (1)已知:N2(g)+O2(g)===2NO(g);ΔH=+180.5 kJ·mol-1 4NH3(g)+5O2(g)===4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1 bm 2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ·mol-1 则N2(g)+3H2(g)===2NH3(g);ΔH= . (2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g).在一定温度下,将一定量的N2和H2通入 到初始体积为1 L的密闭容器中达到平衡后,单独改变下列条件,能使平衡向正反应方向移动且 平衡常数不变的是 . ①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度 (3)①常温下0.1 mol/L氨水中电离出的c(OH- ) 10-1 mol/L(填写“>”、“<”或“=”); ②将相同体积、pH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为 . (4)用氨水和40 mL 0.5 mol/L硫酸铝溶液来制备一定量的氢氧化铝,该反应的离子方程式 为 .某同学改用2 mol/L的氢氧化钠溶液代替氨水来制备,结果只得到了0.78克的沉淀,其加入的氢氧化钠溶液的体积可能为__________求高人详解(4)答案为15ml或75ml不明白75ml谢
 银座1年前1
银座1年前1 -
 大胖子_ss 共回答了23个问题
大胖子_ss 共回答了23个问题 |采纳率87%最后一问两种情况 第一种情况是加入的碱少量 氢氧根直接与铝离子生成沉淀 第二种情况就是碱过量 先全部生成氢氧化铝 再生成偏铝酸钠 剩余少部分未反应的氢氧化铝1年前查看全部
- 日本的主要工业区有1.2.3.4.日本的工业主要分布在( )的狭长地带,其原因( ) 日本的( )附近因有
日本的主要工业区有1.2.3.4.日本的工业主要分布在( )的狭长地带,其原因( ) 日本的( )附近因有
日本的( )附近因有暖寒交汇,( )丰富,鱼群密集,是世界著名的渔场 雪域梦想1年前1
雪域梦想1年前1 -
 重庆英语150 共回答了9个问题
重庆英语150 共回答了9个问题 |采纳率88.9%1.京滨工业带2.阪神工业带3.濑户内海工业带4.北九州工业带
主要分步在太平洋沿岸和濑户内海沿岸
原因:海上运输便利,原材料输入与商品输出便捷:临近海洋,水源充足.科技基础雄厚.(原因集不清楚了.抱歉)
北海道附近有寒暖流交汇,浮游生物丰富,1年前查看全部
- 怎样用酸碱洗工业废油,块状烧碱先要水溶解吗
 zhaoshx1年前1
zhaoshx1年前1 -
 黎叔0531 共回答了13个问题
黎叔0531 共回答了13个问题 |采纳率84.6%一般是先加热水溶解,块状烧碱必须要水溶解1年前查看全部
- (2013•南安市一模)氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反
(2013•南安市一模)氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反应的化学方程式为:2N2+6H2O
4NH3+3O2.计算生产34t NH3所需N2的质量.通电 . 心自在1年前1
心自在1年前1 -
 zhangxgym 共回答了17个问题
zhangxgym 共回答了17个问题 |采纳率94.1%解题思路:根据生成氨气的质量,由反应的化学方程式计算出产生氮气的质量即可.设生产34tNH3所需N2的质量的为x,
2N2+6H2O
通电
.
4NH3+3O2
56 68
x 34t
[56/68=
x
34t] x=28t.
答:生产34tNH3所需N2的质量为28t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.1年前查看全部
- (2009•宝安区模拟)工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质
(2009•宝安区模拟)工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质.现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究.
实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0mol•L-1H2SO4、1.0mol•L-1HNO3、1.0mol•L-1HCl、NaOH稀溶液、0.1mol•L-1AgNO3、0.1mol•L-1BaCl2、0.1mol•LBa(NO3)2、蒸馏水.
以下是实验探究过程:
1)提出假设:
假设1工业碳酸钠中只含有Na2SO4 杂质;
假设2工业碳酸钠中只含有NaCl 杂质;
假设3工业碳酸钠中含有______杂质;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(1)某同学基于假设1进行了实验:取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1mol•L-1的BaCl2溶液,有白色沉淀产生.他认为样品中含有Na2SO4.请你对他的结论的正确性提出你的观点,并简要说出理由:______.
(2)基于假设3,请你根据你的实验方案,将实验操作和预期的现象及结论填入下表中:(编号不够可以再加)
编号 实验操作 预期现象和结论 ① ______ ______ ② ______ ______ ③ ______ ______  流儿浪1年前1
流儿浪1年前1 -
 为了轩 共回答了22个问题
为了轩 共回答了22个问题 |采纳率86.4%解题思路:1)含有Na2SO4、NaCl中的一种或两种杂质,结合假设1和假设2的内容来确定假设3;
3)(1)碳酸根、硫酸根均可以和钡离子反应生成白色沉淀;
(2)①碳酸钠可以和酸反应生成二氧化碳气体;
②白色且不溶于硝酸的沉淀有硫酸钡和氯化银两种;
③能和硝酸酸化的硝酸银反应生成白色沉淀的是含有氯离子的化合物.1)含有Na2SO4、NaCl中的一种或两种杂质,结合假设1和假设2的内容可知假设3为碳酸钠中含Na2SO4和NaCl杂质,故答案为:Na2SO4和NaCl;
(1)碳酸根、硫酸根均可以和钡离子反应生成白色沉淀,向试管中滴入0.1mol•L-1的BaCl2溶液,有白色沉淀产生,样品中含有碳酸钠或者是Na2SO4,
故答案为:不正确,溶液中含有CO32-,可与BaCl2溶液产生BaCO3沉淀,因此无法确定该沉淀是BaSO4;
(2))①只有碳酸钠可以和酸反应生成二氧化碳气体,可以用硝酸检验是否生成二氧化碳气体来检验碳酸钠的存在;
②向酸化后的试管中加入0.1mol•L-1的Ba(NO3)2 溶液至过量,生成的白色且不溶于硝酸的沉淀是硫酸钡,证明含有硫酸钠;
③能和硝酸酸化的硝酸银反应生成的白色沉淀一定是氯化银,证明含有氯化钠,故答案为:
编号 实验操作 预期现象和结论
① 取少许样品于试管中,加蒸馏水溶解.向试管中加足量的1.0 mol•L-1HNO3.(或加入1.0 mol•L-1HNO3至溶液中不再有气体放为止.) 有气体产生,说明样品中含有Na2CO3.
② 向试管中加入0.1 mol•L的Ba(NO3)2 溶液.若有沉淀产生,则继续加入0.1 mol•LBa(NO3)2至过量. 若有沉淀产生,则含Na2SO4,若没有沉淀产生,则不含Na2SO4.
③ 若②操作无沉淀,则向试管中加入0.1 mol•L-1AgNO3溶液.若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1 mol•L-1AgNO3溶液. 有沉淀产生,则含NaCl,若无沉淀,则不含NaCl.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质检验、鉴别的实验方案的设计,侧重离子检验及实验探究的考查,注意混合物中一定存在、一定不存在和可能存在的是什么物质,题目难度不大.1年前查看全部
- 工业的不断发展,逐步提高了人类的生活质量,同时也带来了一系列的环境问题.
工业的不断发展,逐步提高了人类的生活质量,同时也带来了一系列的环境问题.
(1)化石原料的大量燃烧,造成大气中的______含量不断上升,从而引起温室效应.
(2)合成材料的应用和发展,大大方便了人类生活,但是废弃塑料带来的______也很严重,为了解决这个问题,我们可以采取的措施有______(答一条即可). pufaguo1年前1
pufaguo1年前1 -
 tancx 共回答了7个问题
tancx 共回答了7个问题 |采纳率71.4%解题思路:(1)根据化石燃料会产生大量的二氧化碳及酸雨形成的原因分析;
(2)根据白色污染是人们对难降解的塑料垃圾污染环境的现象分析.(1)化石燃料会产生大量的二氧化碳,二氧化碳是造成温室效应的主要气体之一;故答案为:二氧化碳;
(2)白色污染是人们对难降解的塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓.回收利用是废塑料处理技术的发展趋势.故答案为:白色污染;回收利用废旧塑料.点评:
本题考点: 二氧化碳对环境的影响;白色污染与防治.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 纯碱吸收SO2的化学式是什么?为了保护环境,变害为利,工业上常用纯碱吸收有害气体SO2,同时得到亚硫酸氢钠,该反应的化学
纯碱吸收SO2的化学式是什么?
为了保护环境,变害为利,工业上常用纯碱吸收有害气体SO2,同时得到亚硫酸氢钠,该反应的化学方程是什么?
从这一反应可见亚硫酸的酸性比碳酸的酸性_____。
亚硫酸钠常用于除去漂白织物后生育的游离氯,该反应的化学方程式为?
 bvtcpig1年前2
bvtcpig1年前2 -
 握右手 共回答了17个问题
握右手 共回答了17个问题 |采纳率94.1%Na2CO3+H2O+2SO2=2NaHSO3+CO2↑
从这一反应可见亚硫酸的酸性比碳酸的酸性(强)
NaHSO3+Cl2+H2O=NaHSO4+2HCl1年前查看全部
- 根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
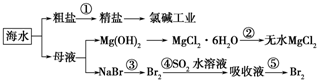
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了浓缩 涂土1年前1
涂土1年前1 -
 香自苦寒来 共回答了23个问题
香自苦寒来 共回答了23个问题 |采纳率95.7%解题思路:A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸;
B、氯化镁易水解,为防止水解过程③中结晶出的MgCl2•6H2O要一定条件下加热脱水制得无水MgCl2;
C、电解原理分析,电解饱和食盐水是电能转化为化学能;
D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素;A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,如果再过滤沉淀前加入过量BaCl2溶液,稀盐酸不能除去氯化钡溶液,所以会产生杂质,故A错误;
B、氯化镁易水解,为防止水解,过程③中结晶出的MgCl2•6H2O要氯化氢氛围中加热脱水制得无水MgCl2,故B错误;
C、电解原理分析,电解饱和食盐水是电能转化为化学能,故C错误;
D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩,故D正确;
故选D.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源的综合利用,明确该过程中发生的反应及反应原理是解本题关键,注意除杂剂的滴加顺序、由MgCl2•6H2O制备无水MgCl2的条件,为易错点,题目难度中等.1年前查看全部
- 20世纪末,人类进入到 20世纪末,人类进入到高度的时代 [ ] A.电气 B.蒸汽 C.信息化 D.工业20世
20世纪末,人类进入到
20世纪末,人类进入到高度的时代 [ ] A.电气
B.蒸汽
C.信息化
D.工业20世纪 VIP相爱好百年1年前1
VIP相爱好百年1年前1 -
 kevinfengfei 共回答了16个问题
kevinfengfei 共回答了16个问题 |采纳率93.8%C1年前查看全部
- 有道逻辑题不理解,如图所示,所有商人S都支持沿海工业的发展P,为什么一些支持沿海工业发展P的人是商人S不对?所有的S都是
有道逻辑题不理解,

如图所示,所有商人S都支持沿海工业的发展P,为什么一些支持沿海工业发展P的人是商人S不对?所有的S都是P明明就是可以换位成有些P是S的啊,哪里不对?
 dbqpwmij1年前1
dbqpwmij1年前1 -
 suiyidage 共回答了26个问题
suiyidage 共回答了26个问题 |采纳率92.3%因为一些投资者是乘船游玩的热心人
所以就另有一些乘船游玩的不热心的投资者
而支持沿海工业的发展的还可能就是这些对乘船游玩不热心的投资者
所以一些支持沿海工业发展的人就不一定是商人,也可能是这些投资者1年前查看全部
- (10分)硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
(10分)硝酸是一种重要的
 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N 2 和H 2 为原料合成氨气。一定温度下,在密闭容器中充入ImolN 2 和3molH 2 发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N 2 的转化率
,则N 2 的转化率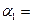 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则
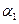 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH 3 +5O 2 4NO+6H 2 O 4NO+3O 2 +2H 2 O=4HNO 3
4NO+6H 2 O 4NO+3O 2 +2H 2 O=4HNO 3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO 2 +Na 2 CO 3 =NaNO 2 +NaNO 3 +CO 2 ,NO+NO 2 +Na 2 CO 3 =2NaNO 2 +CO 2 。若在标准状况下有NO、NO 2 的混合气体(不考虑N 2 O 4 )恰好与50mL 1. 0 mol·L -1 的Na 2 CO 3 溶液反应完全,且生成NaNO 2 和NaNO 3 的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L -1 的Na 2 CO 3 溶液反应完全,且生成NaNO 2 和NaNO 3 的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程) h686421861年前1
h686421861年前1 -
 叫我qq胡 共回答了12个问题
叫我qq胡 共回答了12个问题 |采纳率91.7%(1)12.5%或1/8、>(4分,每空2分)(2)9(3分)
(2)解析:由反应4NH 3 +5O 2 4NO+6H 2 O、4NO+3O 2 +2H 2 O=4HNO 3 得:
4NO+6H 2 O、4NO+3O 2 +2H 2 O=4HNO 3 得:
NH 3 +2O 2 =HNO 3 +H 2 O,3.4吨液氨产生的硝酸为12.6吨,水为3.6吨,则理论上需加水的质量为为:126.t/50%-(12.6+3.6)t=9t
(3)(3分)由反应转化关系知,反应过程中钠元素 守恒,设NaNO 2 和NaNO 3 的物质的量分别为4a mol和a mol,则4a+a=50mL×10 -3 mL·L -1 ×1.0 mol·L -1 ×2,解得:a=0.02 mol,于是,推出NO、NO 2 的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
守恒,设NaNO 2 和NaNO 3 的物质的量分别为4a mol和a mol,则4a+a=50mL×10 -3 mL·L -1 ×1.0 mol·L -1 ×2,解得:a=0.02 mol,于是,推出NO、NO 2 的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
略1年前查看全部
- 硝酸铵(化学式为NH4NO3)在农业与工业生产中有重要作用,下列有关硝酸铵的说法正确的是( )
硝酸铵(化学式为NH4NO3)在农业与工业生产中有重要作用,下列有关硝酸铵的说法正确的是( )
A.它属于氧化物
B.其相对分子质量是80g
C.它可用作复合肥
D.其中氮、氢元素的质量比是7:1 wuupp1年前1
wuupp1年前1 -
 思念漫溢 共回答了16个问题
思念漫溢 共回答了16个问题 |采纳率81.3%解题思路:A、根据氧化物的概念进行分析判断.
B、相对分子质量单位是“1”,不是“克”,常常省略不写.
C、根据含有氮元素的肥料称为氮肥进行分析判断.
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.A、硝酸铵(化学式为NH4NO3)由三种元素组成,不属于氧化物,故选项说法错误.
B、相对分子质量单位是“1”,不是“克”,故选项说法错误.
C、硝酸铵中含有氮元素,属于氮肥,不属于复合肥,故选项说法错误.
D、硝酸铵中氮、氢元素的质量比是(14×2):(1×4)=7:1,故选项说法正确.
故选:D.点评:
本题考点: 常见化肥的种类和作用;从组成上识别氧化物;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 读“日本工业分布图”,回答下列问题.
读“日本工业分布图”,回答下列问题.

(1)图中①是______洋②是______海.
(2)日本的工业主要集中分布在______沿岸和______沿岸地区,这里发展工业的有利条件是______.
(3)想一想,除了多优良港湾这一优势条件外,日本经济能快速发展依靠的条件还有哪些?______. 火ji1年前1
火ji1年前1 -
 148242117 共回答了18个问题
148242117 共回答了18个问题 |采纳率88.9%解题思路:日本东临太平洋西临日本海是一个群岛国家.海岸线曲折,多优良港湾,经济发达,是世界上的强国,但是由于地域狭小,资源贫乏,是一个资源小国,因此对外依赖性较强.日本从国外进口大量的原料和燃料,然后依靠先进的科学技术和充足的劳动力资源,对原料进行加工,制成工业产品大量出口.工业主要分布在太平洋沿岸和濑户内海沿岸的狭长地带,便于原料的进口和工业产品的出口.读图可知:(1)日本东临太平洋西临日本海;(2)日本工业主要分布在太平洋沿岸和濑户内海沿岸的狭长地带,便于原料的进口和工业产品的出口;(3)日本发展经济的有利条件有:①海岸线曲折、多优良港湾,②劳动力资源丰富,③科技先进.
故答案为:
(1)太平洋,日本;(2)太平洋,濑户内海,多良港,便于进口原料、燃料和出口工业品,也是人口众多的消费区;(3)先进的科学技术,充足的劳动力资源.点评:
本题考点: 日本工业布局的特点和地理意义;日本的资源和经济.
考点点评: 认真阅读地图,把知识点落实到图上,是学习地理的重要方法.1年前查看全部
- 海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:
海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:

回答下列问题:
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是______.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为______,与电源负极线连的电极附近溶液pH______(变大、不变、变小).
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO2或NH3,则气体A应是______(填化学式).C的制得发生反应的化学方程式为2NaHCO3
Na2CO3+CO2↑+H2O△ .2NaHCO3.
Na2CO3+CO2↑+H2O△ .
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品
NH4Cl晶体,则通入NH3的作用是______.
(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①______;④______.
b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:______.
c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是______. kathleena05061年前1
kathleena05061年前1 -
 话梅四号 共回答了26个问题
话梅四号 共回答了26个问题 |采纳率88.5%解题思路:(1)①根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
②根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质;
(2)①根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
②根据氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)a、氯气具有氧化性,能将溴离子氧化;单质溴具有氧化性,能将二氧化硫氧化;
b、在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
c、海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩以节约成本.(1)①因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为CBDA或BCDA,故答案为:CBDA或BCDA;
②电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程:2Cl--2e-=Cl2↑;阴极是氢离子得电子生成氢气的过程为2H++2e-=H2↑,在该极附近氢离子减少,氢氧根浓度增加,所以大量的氢氧化钠在阴极出现,溶液的PH增大,故答案为:2Cl--2e-=Cl2↑;变大;
(2)①向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱.上述反应的化学方程式分别为NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
△
.
Na2CO3+CO2↑+H2O,故答案为:NH3;2NaHCO3
△
.
Na2CO3+CO2↑+H2O;
②氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,
故答案为:氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)a、氯气具有氧化性,能将溴离子氧化成单质溴:2Br-+Cl2=2Cl-+Br2,故答案为:2Br-+Cl2=2Cl-+Br2;
单质溴具有氧化性,能将二氧化硫氧化成硫酸:SO2+Br2+2H2O=2HBr+H2SO4,故答案为:SO2+Br2+2H2O=2HBr+H2SO4;
b、在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
c、海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,故答案为:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.点评:
本题考点: 海水资源及其综合利用;纯碱工业(侯氏制碱法);电解原理;氯、溴、碘及其化合物的综合应用;粗盐提纯.
考点点评: 本题主要考查了粗盐的提纯、候氏制碱、海水提溴的原理,难度不大,根据课本知识即可完成.1年前查看全部
- 某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份1
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量AgNO3溶液,得干燥沉淀3.50g.
②第二份加足量BaCl2溶液后,得干燥沉淀2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变.
根据上述实验,以下推测正确的是( )
①一定存在Mg2+②可能存在CO32-③一定存在Cl-④可能存在Ba2+⑤可能存在Mg2+.
A. ①③
B. ②③
C. ③⑤
D. ④⑤ 无敌双城1年前1
无敌双城1年前1 -
 打字小老鼠 共回答了21个问题
打字小老鼠 共回答了21个问题 |采纳率90.5%解题思路:据题意分析,pH=1的工业废液,含有H+,第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、SO42-.第二份加足量BaCl2溶液后,得干燥沉淀2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变,利用发生的离子反应,经过计算、推得一定存在SO42-,一定不存在Ba2+、根据溶液中阴阳离子的电荷守恒,即可推出Mg2+一定存在.①根据题意,pH=1的工业废液,含有H+,100mL溶液H+物质的量═0.01mol,因CO32-+2H+═CO2↑+H2O,因此两者不能大量共存,一定不存在CO32-,故②错误;
Ba2+和SO42-,可发生离子反应生成BaSO4沉淀,因此两者不能大量共存,一定存在SO42-,故④错误;
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、SO42-;
第二份加足量BaCl2溶液后,得干燥沉淀2.33g,经足量盐酸洗涤、干燥后,沉淀质量不变,因BaCO3沉淀可溶于盐酸,BaCO3+2HCl═BaCl2+CO2↑+H2O,所以得沉淀2.33g为不溶于盐酸的BaSO4,发生反应SO42-+Ba2+═BaSO4↓,因此溶液中一定存在SO42-,一定不存在Ba2+、CO32-、由条件可知BaSO4为2.33g,物质的量为 [2.33g/233g/mol]=0.01mol,SO42-的物质的量等于0.01mol,根据SO42-+2Ag+═Ag2SO4↓,生成沉淀Ag2SO4为0.01mol×312g/mol=3.12g,第一份加入足量AgNO3溶液,得干燥沉淀3.50g,说明发生Cl-+Ag+═AgCl↓生成沉淀AgCl为3.50g-2.33g═1.17g,Cl- 的物质的量等于0.02mol,所以一定存在Cl-,故③正确;
Cl-、SO42-所带负电荷分别为0.02mol×1、0.01mol×2,H+所带正电荷为0.01mol,
根据溶液中的电荷守恒,溶液呈电中性,则一定含有镁离子,且镁离子的物质的量为0.02mol×1+0.01mol×2-0.01mol×1=0.03mol,故①正确;
故选A.点评:
本题考点: 常见离子的检验方法.
考点点评: 本题考查了离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,题目难度较大.1年前查看全部
- (2014•普陀区一模)工业上常利用反应 3Cl2+6KOH(热)→KClO3+5KCl+3H2O制取KClO
(2014•普陀区一模)工业上常利用反应 3Cl2+6KOH(热)→KClO3+5KCl+3H2O制取KClO3(混有KClO).实验室模拟上述制备:在含溶质14mol的KOH(aq,热)中通入一定量Cl2,充分反应后,测得溶液中n(Cl-)=11mol;将此溶液低温蒸干,得到的固体中KClO3的物质的量可能为( )
A.2.20
B.2.33
C.2.00
D.0.50 叮叮ling1年前1
叮叮ling1年前1 -
 x521779 共回答了18个问题
x521779 共回答了18个问题 |采纳率88.9%解题思路:在氧化还原反应中转移电子数相等,且各元素的原子个数相等,假设反应后溶液中的溶质是氢氧化钾和氯酸钾结合得失电子守恒计算氯酸钾的物质的量,假设反应后溶液中的溶质是氯酸钾和次氯酸钾,根据钾离子守恒和得失电子守恒计算氯酸钾的物质的量.假设反应后溶液中的溶质是氢氧化钾和氯酸钾,根据转移电子守恒得氯酸钾的物质的量=
11mol×(1−0)
5−0=2.2mol;
假设反应后溶液中的溶质是次氯酸钾和氯酸钾,
设氯酸钾的物质的量为x,次氯酸钾的物质的量为y,
根据转移电子守恒和钾离子守恒得方程式组
5x+y×1=11×1
x+y+11=14,
所以得
x=2
y=1,
实际上溶液中含有氯酸钾和次氯酸钾,所以得到的氯酸钾的物质的量可能为2.00mol,
故选C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了物质的量的有关计算,根据溶液中的溶质及转移电子守恒和钾原子守恒来分析解答即可,难度中等.1年前查看全部
- 下列有关说法,错误的是( ) A.氮氧化物、二氧化硫都是形成酸雨的主要物质 B.工业合成氨及用NH 3 制化肥(NH
下列有关说法,错误的是()
A.氮氧化物、二氧化硫都是形成酸雨的主要物质 B.工业合成氨及用NH 3 制化肥(NH 4 ) 2 SO 4 都属于氮的固定 C.一定条件下,镁能与一些非金属氧化物反应,铝能与一些金属氧化物反应 D.玻璃中含有硅酸钠和二氧化硅  阳光喜悦1年前1
阳光喜悦1年前1 -
 iudanshaner 共回答了21个问题
iudanshaner 共回答了21个问题 |采纳率100%B
氮的单质生成氮的化合物的反应,才是氮的固定,用NH 3 制化肥(NH 4 ) 2 SO 4 不属于氮的固定。1年前查看全部
- 氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为
氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为:2N 2 +6H 2 O
 4NH 3 +3O 2 。计算生产34t NH 3 所需N 2 的质量。
4NH 3 +3O 2 。计算生产34t NH 3 所需N 2 的质量。 yxl9061年前1
yxl9061年前1 -
 红鱼游来了 共回答了17个问题
红鱼游来了 共回答了17个问题 |采纳率94.1%28t
1年前查看全部
- (18分)工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH 3 与NOx在催化剂作用下反应生成无毒的物质。某校活动小
(18分)工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH 3 与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物 的处理过程。
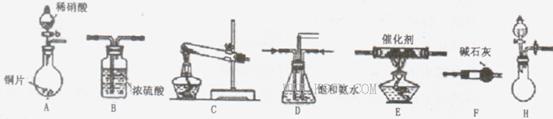
I.探究制取NH 3 的方法
(1)B装置的名称:______________
(2)在上述装置中,H能快速、简便制取,装置中需要添加的反应试剂为_________ 。
(3)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
分析表中数据,你认为哪种方案制取氨气的效果最好________(填序号),从该方案选择的原料分析制气效果好的可能原因是________,__________。试剂组合序号 固体试剂 NH 3 体积(mL) a 6.0gCa(OH) 2 过量 5.4gNH 4 Cl 1344 b 5.4g(NH 4 ) 2 SO 4 1364 c 6.0gNaOH过量 5.4gNH 4 Cl 1568 d 5.4g(NH 4 ) 2 SO 4 1559 e 6.0gCaO过量 5.4gNH 4 Cl 1753 f 5.4g(NH 4 ) 2 SO 4 1792
II.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验。
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复)。
(2)A中反应的离子方程式为__________________________
(3)D装置的作用有:_____________、____________、_____________。
(4)D装置中的液体还可换成(填序号)。
A.H 2 OB.CCl 4 C.浓H 2 SO 4 D.CuSO 4 溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是___________. 6233388271年前1
6233388271年前1 -
 萧萧的宝 共回答了18个问题
萧萧的宝 共回答了18个问题 |采纳率94.4%(18分)Ⅰ(1)洗气瓶(1分)
(2)生石灰与浓氨水(或烧碱与浓氨水)(答化学式给分)(2分)
(3)f (2分);(NH 4 ) 2 (SO 4 )受热不分解,CaO又有吸水作用(合理答案均给分)(2分)
Ⅱ(1)F E B(2分)
(2)3Cu+2NO 3 - +8H + =2NO↑+4H 2 O +3Cu 2+ (2分)
(3)使气体混合均匀,调节气流速度,防止氨气溶解(或防倒吸)(3分)
(4)b(2分)
(5)未反应的NO无法处理,会污染环境(2分)
1年前查看全部
- 碳捕捉,就是捕捉释放到大气中的二氧化碳,压缩之后,压回到枯竭的油田和天然气领域或者其他安全的地下场所.工业上用“碳捕捉”
碳捕捉,就是捕捉释放到大气中的二氧化碳,压缩之后,压回到枯竭的油田和天然气领域或者其他安全的地下场所.工业上用“碳捕捉”技术将含有CO和CO2混合气体的CO2捕捉并回收CO,其基本过程如图所示(部分条件及物质未标出)

(1)整个过程中,可循环利用的物质——、——.(2)“捕捉室”中发生反应的化学方程式————————————.(3)你认为“捕捉室”技术要大范围推广,需克服的问题有:——————————————.(4)二氧化碳加氢的甲烷化反应是利用二氧化碳在催化剂的作用下和氢气反应,生成甲烷和水.写出该反应化学方程式————————.
 ll之1年前1
ll之1年前1 -
 0ming0 共回答了18个问题
0ming0 共回答了18个问题 |采纳率94.4%1) CaO NaOH
2)2NaOH+CO2——Na2CO3+H2O
3)CaCO3分解耗能 CO2压缩耗能问题
4)CO2+4H2——催化剂 CH4+2H2O1年前查看全部
- 工业废水处理达标后能作为溶剂,石灰,等药品吗,增加水处理压力吗
 lovelydragon1年前1
lovelydragon1年前1 -
 qiuxinzeng 共回答了24个问题
qiuxinzeng 共回答了24个问题 |采纳率100%如果是处理废物,这样做成本就高了,可以考虑综合处理,如果你说的是中水回用,就要达到回用标准.1年前查看全部
- 用醋酸钠自制暖手袋1)试剂店里有卖无水醋酸钠和结晶醋酸钠,两者用起来效果是不是一样的?2)如何抑制醋酸钠的水解?3)工业
用醋酸钠自制暖手袋
1)试剂店里有卖无水醋酸钠和结晶醋酸钠,两者用起来效果是不是一样的?
2)如何抑制醋酸钠的水解?
3)工业用醋酸钠有没有毒?(分析纯,标称是说醋酸钠含量不少于99.0%)
4)配置过饱和溶液时有什么注意事项?
5)过饱和溶液析出晶体后,能否重复使用?(由液态析出晶体变成固态后能否加热熔化重复使用) csumhf1年前1
csumhf1年前1 -
 fancai1314 共回答了23个问题
fancai1314 共回答了23个问题 |采纳率82.6%因为做暖手袋时,需要把醋酸钠配成溶液,所以都一样;
醋酸钠水解时生成醋酸分子和氢氧根离子,所以加入氢氧化钠可以抑制其水解,但自制暖手袋时不用考虑其水解;
工业用的醋酸钠怎么能是分析纯的呢?
析出晶体后放入热水中,暖手袋可以重复使用
醋酸钠晶体很容易析出,你搜索“十大最令人惊奇的化学反应”,有一个实验就是关于醋酸钠晶体析出的实验
看了你就知道了,它的析出速度相当快1年前查看全部
- 高铁的快速发展方便了人们的出行.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O3 高温&
高铁的快速发展方便了人们的出行.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O3
Al2O3+2Fe,其中Fe2O3是( )高温 .
A. 氧化剂
B. 还原剂
C. 既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂 zheng6291年前1
zheng6291年前1 -
 parmachiesa 共回答了18个问题
parmachiesa 共回答了18个问题 |采纳率94.4%解题思路:2Al+Fe2O3
Al2O3+2Fe,该反应中铝元素化合价由0价变为+3价,铁元素的化合价由+3价变为0价,得电子化合价降低的是氧化剂,失电子化合价升高的反应物是还原剂.高温 .2Al+Fe2O3
高温
.
Al2O3+2Fe,该反应中铁元素的化合价由+3价变为0价,所以氧化铁得电子化合价降低是氧化剂,故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应中氧化剂、还原剂的判断,根据元素化合价变化与氧化剂、还原剂之间的关系解答即可,难度不大.1年前查看全部
- 氢气的 实验室制法 还有工业制法.
氢气的 实验室制法 还有工业制法.
用化学方程式表达. 9qhbud1年前1
9qhbud1年前1 -
 kele555 共回答了12个问题
kele555 共回答了12个问题 |采纳率91.7%实验室制法:
用锌与稀盐酸反应
Zn+H2SO4=ZnSO4+H2↑
工业制法:
利用电解饱和食盐水产生氢气
2NaCl+2H2O=电解=2NaOH+Cl2↑+H2↑1年前查看全部
- 工业上用高温煅烧石灰石(主要成分CaCO3)可制得生石灰(CaO)和二氧化碳,如果煅烧含杂质百分之5的石灰石100吨,可
工业上用高温煅烧石灰石(主要成分CaCO3)可制得生石灰(CaO)和二氧化碳,如果煅烧含杂质百分之5的石灰石100吨,可得到石灰石多少吨?(提示:CaCO3=CaO+CO3)
 757968041年前1
757968041年前1 -
 cs_skybaotou 共回答了13个问题
cs_skybaotou 共回答了13个问题 |采纳率92.3%可得到生石灰吧?
CaCO3 = CaO + CO2
100 56
100 X 95% x
直接按比例得出生石灰53.2吨.
很简洁的.1年前查看全部
- 英语翻译热流道模具与普通流道模具相比,具有注塑效率高、成型塑件质量好并节约原料等优点,随着聚合物工业的发展,热流道技术正
英语翻译
热流道模具与普通流道模具相比,具有注塑效率高、成型塑件质量好并节约原料等优点,随着聚合物工业的发展,热流道技术正不断地发展完善,其应用范围也越来越广泛.热流道是通过加热的办法来保证流道和浇口的塑料保持熔融状态.由于在流道附近或中心设有加热棒和加热圈,从注塑机喷嘴出口到浇口的整个流道都处于高温状态,使热流道模具与普通流道模具相比,具有注塑效率高、成型塑件质量好和节约原料等优点,随着聚合物工业的发展,热流道技术正不断地发展完善,其应用范围也越来越广泛.
热流道是通过加热的办法来保证流道和浇口的塑料保持熔融状态.由于在流道附近或中心设有加热棒和加热圈,从注塑机喷嘴出口到浇口的整个流道都处于高温状态,使流道中的塑料保持熔融,停机后一般不需要打开流道取出凝料,再开机时只需加热流道到所需温度即可.
热流道注射成型法于20世纪50年代问世,经历了一段较长时间地推广以后,其市场占有率逐年上升,80年代中期,美国的热流道模具占注射模具总数的15%~17% ,欧洲为12%~15% ,日本约为10% .但到了90年代,美国生产的塑料注射模具中热流道模具已占40%以上,在大型制品的注射模具中则占90%以上.
未来的时代,将是"移动互联网"的时代,我们本着远大的目标,以及对客户无微不至的服务,所以我们走在了未来发展趋势的前沿.在未来的两个月后,无论你身在何处,只要你在手机上登陆3G浏览器,直接输入关键词"热流道",你就可以轻松的进入我们的主页,搜索我们所有的服务和产品,我们也将随时在线,为您排优解难.同时,我们也可以免费为您提供相应的广告位,让您将自己的产品登上"移动互联网",为您的产品带来更多的机会和知明度.所以,让我们共同携手,为适应未来发展的趋势而提前做好准备. zhaohuashou1年前1
zhaohuashou1年前1 -
 随见飘 共回答了26个问题
随见飘 共回答了26个问题 |采纳率96.2%64961年前查看全部
- 工业上制漂白粉的化学方程式为2Cl2+2Ca(OH)=Ca(ClO)2+CaCl2+2H2O.某干燥样品中有效成分(接下
工业上制漂白粉的化学方程式为2Cl2+2Ca(OH)=Ca(ClO)2+CaCl2+2H2O.某干燥样品中有效成分(接下)
(接上)Ca(ClO)2的质量分数为55%,则生产过程中Ca(OH)2的利用率为? A96.1% B86.4% C77.8% D71.3% 过程? 操之有道1年前1
操之有道1年前1 -
 pandoraeb 共回答了19个问题
pandoraeb 共回答了19个问题 |采纳率100%n(Ca(ClO)2)=55/143=0.3846mol
m(CaCl2)=0.3846*111=42.69g
m(Ca(OH)2)=100-55-42.69=2.3g
m(Ca(OH)2反应)=0.3846*2*74=56.9g
Ca(OH)2%=56.9/(56.9+2.3)=96.1%
A1年前查看全部
- 近代伦敦是一个大量用煤的工业城市,号称雾都.未解决能源问题又能减排,伦敦人建起核电站.为防止流量流失导致浪费,伦敦鼓励居
近代伦敦是一个大量用煤的工业城市,号称雾都.未解决能源问题又能减排,伦敦人建起核电站.为防止流量流失导致浪费,伦敦鼓励居民用电,甲、乙两户去购买电卡,价格如下:“不超过30度,每度0.3元;30度以上但不超过50度,打八折;50度以上,打六折.”甲家分两天共购买70度电(第二天多余第一天),共付18.3元;乙家则一次性购买70度.
(1)乙家比甲家少付出多少元?
(2)甲家第一天,第二天分别购买多少度?
人家回答过的你不许跟人家一样 zt19851年前1
zt19851年前1 -
 aisini147 共回答了22个问题
aisini147 共回答了22个问题 |采纳率86.4%(1)30x0.3+20x0.24+20x0.18=17.4元,
18.3-17.4=0.9元,
所以乙比甲少付出0.9元.
(2)设第一天购电为X度,第二天为70-X, 0.3X+(50-30)x0.24+30x0.3+(70-X-50)x0.18=18.3,
即0.3X+4.8+9+3.6-0.18X=18.3
即0.12X=0.9
所以X=7.5,
70-X=62.5
第一天购电7.5度,第二天购电62.5度.1年前查看全部
- 求生物与人类的关系,急!粮食工业和药用
 wunuofan1年前2
wunuofan1年前2 -
 dongfangjm 共回答了18个问题
dongfangjm 共回答了18个问题 |采纳率83.3%药用:生物尤其是微生物的中间或最后代谢产物可以抑制病原菌或病毒的生长如青霉菌产青霉素等
粮食工业:如固氮菌与植物是共生关系,可帮助氮循环并促进植物对于氮源的吸收,可大幅度增产..等等1年前查看全部
- 工业制取HCl的程序框图
 wolfsky19831年前0
wolfsky19831年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 几个方程式 (急!)工业制盐酸方程式?漂白粉在空气中久置失效的原因?金属钠在空气中放置最终变成碳酸钠涉及到的四个方程式?
 chongqinglijun1年前1
chongqinglijun1年前1 -
 xukunwww2006 共回答了16个问题
xukunwww2006 共回答了16个问题 |采纳率87.5%工业制盐酸方程式?
两个步骤:
1,电解饱和食盐水
2NaCl+2H2O=Cl2+H2+2NaOH
2,氯气氢气混合
H2+Cl2=2HCl
漂白粉在空气中久置失效的原因?
漂白粉的有效成分是Ca(ClO)2,失效方程式为:
Ca(ClO)2+H2O+CO2=CaCO3+2HClO
次氯酸分解;
4HClO=2H2O+O2+2Cl2
金属钠在空气中放置最终变成碳酸钠涉及到的四个方程式?
这个问题应该是:金属钠在空气中放置最终变成碳酸氢钠涉及到的三个方程式?
第一个方程;
2Na+2H20=2NaOH+H2O
第二个方程;
2NaOH+CO2=Na2CO3+H2O
第三个方程;
Na2CO3+CO2+H2O=2NaHCO31年前查看全部
- 工业废水含氢氧化钠低于5%以下,普通槽罐车运输可以运输吗?(没有危险品运输证的)
工业废水含氢氧化钠低于5%以下,普通槽罐车运输可以运输吗?(没有危险品运输证的)
要运输的话,要有什么条件! 好好恋爱1年前1
好好恋爱1年前1 -
 我土容易吗 共回答了23个问题
我土容易吗 共回答了23个问题 |采纳率91.3%不可以,运输会产生反应1年前查看全部
大家在问
- 1三角形面积一定时,底和高成反比例吗?
- 2英语翻译Sam is a dog who lives in Maryland,the US.But he's also
- 3先计算,并把结果化成只含正整数指数幂的形式
- 45个人各拿一只水桶接满水所需的时间分别是5.4.3.8.6分钟.现在只有这一个水龙头可用,这6个人都接到水且等
- 5如图,将矩形ABCD沿对角线AC对折,使△ABC落在△ACE的位置,且CE与AD相交于点F.
- 6Lucy like playing sports 为什么play后加ing
- 7错综复杂句的虚拟语气
- 8麻雀变凤凰 英语怎么说
- 9请详细说出理由Is _______here?--No,Tom isn'there.But it's time tohav
- 10若直线过点M(-3,-3/2),且被圆x^2+y^2=25截得的弦长为8,则这条直线的方程为?
- 111、用50以内的一个质数与一个合数,组成一个比值最小的比是( ).
- 12(2002•上海)17世纪人们认为水能变成土,1768年科学家拉瓦锡对此进行研究.他将一定量的蒸馏水加入特殊的蒸馏器,反
- 13带电粒子在电磁场中运动的相关例题和知识点介绍
- 14植物经过秋水仙素加倍产生的配子是单倍体还是二倍体
- 15写出圆心在点A(2,π/2)处且过极点的圆的极坐标方程,并把它化成直角坐标方程
