将镁片和铝片平行插入到NaOH溶液中,用导线连接成闭合回路,该装置在工作时下列说法正确的是?
 cxbyxh2022-10-04 11:39:543条回答
cxbyxh2022-10-04 11:39:543条回答A.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
B.该装置开始工作时,铝片表面的氧化膜可以不必处理
这两个选项对还是错?请解释说明,越详细越好.

已提交,审核后显示!提交回复
共3条回复
 朴朴羔 共回答了22个问题
朴朴羔 共回答了22个问题 |采纳率90.9%- A错 铝是负极 但不会开始工作是就有沉淀 因为NaOH过量 会生成偏铝酸钠
2Al+2NaOH+2H2O=2NaAlO2+3H2
B对 Al2O3也可与NaOH反应
Al2O3+2NaOH=2NaAlO2+H2O - 1年前
 xiaoyuhuihui 共回答了24个问题
xiaoyuhuihui 共回答了24个问题 |采纳率- A不会看到有沉淀吧
楼上说的对 - 1年前
 rainyhe 共回答了35个问题
rainyhe 共回答了35个问题 |采纳率- A错 铝是负极 但不会开始工作时就有沉淀 因为铝与NaOH反应 会生成偏铝酸钠
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
B对 Al2O3可与NaOH反应
Al2O3+2NaOH=2NaAlO2+H2O - 1年前
相关推荐
- 把试管方入盛有25摄食度的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管...
把试管方入盛有25摄食度的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管...
把试管方入盛有25摄食度的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中会什么现象,原理是什么 梦缘芭比1年前2
梦缘芭比1年前2 -
 嘻哈天堂 共回答了24个问题
嘻哈天堂 共回答了24个问题 |采纳率87.5%会看到澄清的石灰水变浑浊,这是因为Mg+2HCl=MgCl2+H2↑是放热反应,Ca(OH)2的溶解度随着温度的升高而降低,所以会出现浑浊.
由实验得MgCI2溶液和H2的总能量小于镁片和盐酸的总能量.
放热反应,生成物的总能量小于反应物的总能量.
MgCI2溶液和H2的总能量小于镁片和盐酸的总能量1年前查看全部
- (2008•道外区二模)向试管中放人几小块镁片.把试管固定在盛有饱和石灰水(25℃)的烧杯中.再向试管中滴人约5mL盐酸
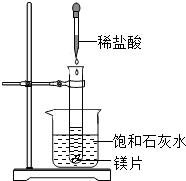 (2008•道外区二模)向试管中放人几小块镁片.把试管固定在盛有饱和石灰水(25℃)的烧杯中.再向试管中滴人约5mL盐酸.如右图所示.请回答:
(2008•道外区二模)向试管中放人几小块镁片.把试管固定在盛有饱和石灰水(25℃)的烧杯中.再向试管中滴人约5mL盐酸.如右图所示.请回答:
(1)实验观察到的现象有:______
(2)产生上述现象的原因是______
(3)放置一段时问后,发现烧杯的底部有固体物质出现,产生固体的可能原因是:
①______
②______. 工7721年前1
工7721年前1 -
 justin195 共回答了18个问题
justin195 共回答了18个问题 |采纳率88.9%解题思路:该实验流程是:镁片与稀盐酸反应生成氢气,同时放热,使得饱和石灰水溶解度下降.镁片会与稀盐酸反应,生成氢气,所以有气泡产生,同时该反应放热,而氢氧化钙的溶解度随温度的升高而降低,从而氢氧化钙会析出一部分,所以烧杯内石灰水会变浑浊.
放置一段时问后,发现烧杯的底部有固体物质出现,出现这种现象可能有两个原因,一方面是:氢氧化钙与空气中的二氧化碳反应生成碳酸钙沉淀;另一可能是:溶剂挥发,溶质氢氧化钙析出一部分.
故答案为:(1)镁片不断溶解,其表面有气泡产生,烧杯内石灰水变浑浊
(2)镁片与稀盐酸反应,生成气体,且反应放热,使石灰水温度升高,溶解度减小
(3)①石灰水与空气中的二氧化碳反应生成白色碳酸钙沉淀
②水分蒸发,溶剂量减少,使饱和溶液中溶质析出点评:
本题考点: 固体溶解度的影响因素;金属的化学性质;酸的化学性质;物质发生化学变化时的能量变化;反应现象和本质的联系.
考点点评: 对于大多数固体来说,溶解度随温度的升高而增大,但也有的固体溶解度随温度的升高而降低,如氢氧化钙.1年前查看全部
- 取一块2.75克表面被氧化的金属镁样品跟足量的稀盐酸反应,完全反应后共收集到0.11mol氢气,试计算镁片的质量分数.
 爱乐坊1年前1
爱乐坊1年前1 -
 猴子恼月 共回答了12个问题
猴子恼月 共回答了12个问题 |采纳率91.7%由题意可知:Mg + 2HCl ===MgCl2 +H2↑
所以反应的Mg的物质的量n=0.11mol
Mg的质量:m=2.64g
镁片的质量分数:2.64/2.75 *100%=96%
很高兴为你解决问题!1年前查看全部
- (2005•镇江)向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如图
(2005•镇江)向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如图所示.请回答:
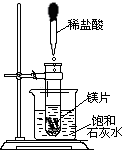
(1)实验中观察到的明显现象有:①剧烈反应,有气泡产生;②镁条逐渐溶解;③______.
(2)产生上述现象③的原因是:
①______;
②______. 甲基笨丙安1年前3
甲基笨丙安1年前3 -
 披件tt上TY 共回答了15个问题
披件tt上TY 共回答了15个问题 |采纳率86.7%解题思路:根据物质的性质进行分析,氢氧化钙的溶解度随温度的升高而减小,金属与酸的反应是放热反应.金属镁与盐酸反应放出热量,导致石灰水的温度升高,石灰水中的溶质为氢氧化钙,氢氧化钙的溶解度随温度的升高而减小,故会析出氢氧化钙溶质,导致石灰水变浑浊.
故答案为:
(1)①石灰水变浑浊;
(2)①镁与盐酸反应放出热量,导致石灰水的温度升高;②氢氧化钙的溶解度随温度的升高而减小.点评:
本题考点: 物质发生化学变化时的能量变化;固体溶解度的影响因素.
考点点评: 本题考查了物质间反应时的能量变化以及影响物质溶解度的因素,完成此题,可以依据已有的知识进行.1年前查看全部
- 将过量的镁片加入到100g稀盐酸中(化学方程式为Mg+2HCl==MgCl2(可溶)+H2↑,充分反应后取出镁片,所得溶
将过量的镁片加入到100g稀盐酸中(化学方程式为Mg+2HCl==MgCl2(可溶)+H2↑,充分反应后取出镁片,所得溶液质量为104.4g,则生成氢气的质量为( ).
A.4.4g B.0.3g C.0.4g D.0.2g 默的注视1年前4
默的注视1年前4 -
 kukeri 共回答了15个问题
kukeri 共回答了15个问题 |采纳率86.7%C
你初中的没学摩尔吧
那就这样做
你投入Mg为24g时
就会增重 22g (MgCl2 == 95g ,2HCl == 73g)
现在增重4.4g
所以实际反应Mg= 4.4/22 *24=4.8g
Mg -- H2
24 2
4.8 X
X=4.8*2/24
=0.4g1年前查看全部
- (2014•蓟县一模)将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确
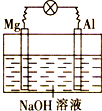 (2014•蓟县一模)将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
(2014•蓟县一模)将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理 半夜三点开始下雪1年前1
半夜三点开始下雪1年前1 -
 番茄绿油油 共回答了17个问题
番茄绿油油 共回答了17个问题 |采纳率88.2%解题思路:A、金属镁和氢氧化钠溶液不能发生氧化还原反应;
B、铝离子在过量的碱性溶液中不会产生氢氧化铝沉淀;
C、电池的外电路,是由电子的定向移动形成电流,而内电路,则是由溶液中自由移动的离子的定向移动形成电流;
D、铝片表面的氧化膜也能与NaOH溶液反应.A、在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,而属镁和氢氧化钠溶液不能发生氧化还原反应,故A错误;
B、在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,由于电池开始工作时,生成的铝离子的量较少,NaOH过量,此时不会有Al(OH)3白色沉淀生成,故B错误;
C、该装置外电路,是由电子的定向移动形成电流,而内电路,则是由溶液中自由移动的离子的定向移动形成电流,故C错误;
D、由于铝片表面的氧化膜也能与NaOH溶液反应,故其不必处理,故D正确.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题是一道有关原电池工作原理的综合题目,要求学生熟悉教材基本知识,知道原电池正负极的判断方法和工作原理,具备分析和解决问题的能力.1年前查看全部
- 镁片与硫酸铜溶液反应有哪两个离子方程式?
镁片与硫酸铜溶液反应有哪两个离子方程式?
那与镁反应的氢离子从水里来吗?活泼金属中钾和钠直接与水反应,镁也可以吗? qinking1年前2
qinking1年前2 -
 oydqifgp 共回答了25个问题
oydqifgp 共回答了25个问题 |采纳率96%Mg+2H+==Mg2++H2(气体符号)
Mg+Cu2+==Mg2++Cu1年前查看全部
- 怎么看发生化学反应时温度升高一种物质和另一种物质反应反应放热还是吸热怎么看?为什么镁片与稀盐酸反应就会放出大量的热?
 baicai33101年前3
baicai33101年前3 -
 中元节回家 共回答了14个问题
中元节回家 共回答了14个问题 |采纳率92.9%就要看它是吸热,还是放热.在化学反应中,伴随能量的变化,应该是键能变化.反应热等于生成物生成焓-反应物生成焓或等于反应物键能-生成物键能.焓代表了物质具有的能量,而键能是断开1摩尔键吸收的能量或形成1摩尔键放出的能量,吸热取正值 ,放热取负值,所以断开反应物键热量取正值,形成生成物键热量取负值,即反应热等于反应物键能-生成物键能.
放热:化合反应、燃烧、中和、金属和酸反应、生石灰和水反应、糖类和脂肪在人体内的氧化.
吸热:分解反应、铵盐和碱反应.
化学反应的过程是旧键断裂吸热,新键形成放热,旧键断裂要吸收能量,新键形成要放出能量!如果旧键断裂吸收的能量大于新键形成放出的能量,化学反应就是一个吸热的化学反应
镁片之所以与稀盐酸反应就会放出大量的热,是因为金属与酸的置换反应(如镁与盐酸)及活泼金属与水的反应(如钠放于水中),这两类反应都是属于放热反应中之其二
仍有不懂的 可以M我1年前查看全部
- 如图2-25所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中
如图2-25所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。

图2-25
试完成下列问题:
(提示:氢氧化钙的溶解度随温度升高而降低)
(1)实验中观察到的现象是_______________________________________________________。
(2)产生上述现象的原因是_______________________________________________________。
(3)写出有关反应的离子方程式:________________________________________________。
(4)由实验推知,MgCl 2 溶液和H 2 的总能量______________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。 linweitao19801年前1
linweitao19801年前1 -
 你我mm人 共回答了19个问题
你我mm人 共回答了19个问题 |采纳率94.7%(1)试管中有气泡产生、饱和石灰水中有白色固体析出(2)镁片溶于稀盐酸放出氢气,且此反应为放热反应,而温度升高,Ca(OH) 2 的溶解度变小(3)Mg+2H + ====Mg 2+ +H 2 ↑(4)小于 镁和盐酸的反应产生氢气...1年前查看全部
- 在天平两边的托盘上各放一只等质量的烧杯,烧杯中各盛主放等质量、等浓度的稀硫酸.向两烧杯中分别放入一块镁片和铝片(均与硫酸
在天平两边的托盘上各放一只等质量的烧杯,烧杯中各盛主放等质量、等浓度的稀硫酸.向两烧杯中分别放入一块镁片和铝片(均与硫酸完全反应)天平平衡是放入的镁片和铝片的比是
为什么是3:4不是32:33?
明显硫酸过量.此时平衡应该减少的质量相同.若质量为24g:18g则天平应偏向镁才对.
那个问句打反了,应该是“为什么是4:3不是32:33?”我觉着镁应该放少一点. 朽_木1年前1
朽_木1年前1 -
 duguizhou 共回答了23个问题
duguizhou 共回答了23个问题 |采纳率95.7%铝镁化合价不同,12份镁生成1份氢气,9份铝生成1份氢气,这点列方程可以看出(铝正三价,镁正二,你是不是记差了)1年前查看全部
- 镁片与铝片用导线连接,插入NAOH溶液中,写出负电极的反应式
镁片与铝片用导线连接,插入NAOH溶液中,写出负电极的反应式
答案是负极:AL+4OH-4e=ALO2+2H2O
为什么:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
就变成了 AL+4OH-4e=ALO2+2H2O
正极:2H+ + 2e- =H2↑
正极也不知道什么回是!
我真的搞不懂?
答对的再加50分! 爱过一头猪1年前6
爱过一头猪1年前6 -
 该名已注册 共回答了10个问题
该名已注册 共回答了10个问题 |采纳率100%因为Al与NaOH溶液反应,所以Al为负极,在电极反应中失去电子,因为Al显+3价所以在电极反应中失去3个电子并与NaOH反应
负极反应方程式为:Al-3e-+4OH-=AlO2-+2H2O,因为Al是两性金属,与碱溶液反应生成偏铝酸盐(AlO2-的盐).你给的负极反应有两个错误,一是反应的生成物AlO2-是个离子,不是分子,二是Al的化合价不正确,失去的电子个数不对.
正极反应方程式:2H2O+2e-=H2+2OH-,你给的反应完全不靠谱,NaOH溶液里哪来的H+呢1年前查看全部
- 下列叙述正确的是( ) A.镁片放置在空气中,不需加热就能在表面生成MgO B.红磷放置在空气中,不需加热就能燃烧产生
下列叙述正确的是( )
A.镁片放置在空气中,不需加热就能在表面生成MgO
B.红磷放置在空气中,不需加热就能燃烧产生P 2 0 5
C.硫粉加热后放入氧气中,燃烧产生SO 3 气体
D.铁丝加热后放入氧气中,燃烧产生Fe 2 0 3 固体 liefengliefeng1年前1
liefengliefeng1年前1 -
 collin2200 共回答了15个问题
collin2200 共回答了15个问题 |采纳率93.3%A、镁的化学性质较活泼,在空气中直接就能与氧气发生氧化反应生成氧化镁,故A正确;
B、红磷的着火点高,需要点燃,故B错误;
C、硫粉在氧气中燃烧生成二氧化硫,故C错误;
D、铁丝在氧气中燃烧生成黑色的四氧化三铁,故D错误;
故选A.1年前查看全部
- 取一块2.75g表面被氧化的金属镁样品跟足量的稀盐酸反应,完全反应后共收集到0.11mol氢气,试计算镁片中金属镁的质量
取一块2.75g表面被氧化的金属镁样品跟足量的稀盐酸反应,完全反应后共收集到0.11mol氢气,试计算镁片中金属镁的质量分数。
要过程~~ 小本生意1111年前2
小本生意1111年前2 -
 √随缘的风√ 共回答了20个问题
√随缘的风√ 共回答了20个问题 |采纳率95%Mg + 2HCl = MgCl2 + H2
1 1
0.11 0.11
Mg的质量=0.11*24=2.64g
Mg的质量分数=2.64/2.75=96%1年前查看全部
- 25摄氏度时把试管放入盛有少量饱和石灰水的烧杯中试管中开始放镁片再滴加5毫升稀硫酸观察实验现象
25摄氏度时把试管放入盛有少量饱和石灰水的烧杯中试管中开始放镁片再滴加5毫升稀硫酸观察实验现象
是稀盐酸打错了 linaeus1年前2
linaeus1年前2 -
 灏子药咬咬 共回答了19个问题
灏子药咬咬 共回答了19个问题 |采纳率94.7%发现烧杯里的澄清石灰石变浑浊
这是因为Mg和硫酸的反应是放热反应,因此热量传导到烧杯里,造成烧杯内石灰水的温度升高,氢氧化钙的溶解度随温度升高而减小,故出现过饱和现象,氢氧化钙析出,石灰水变浑浊1年前查看全部
- 实验室不选用镁片与稀硫酸反应制取氢气的主要原因是1.?2.?
 qinxinsandie1年前3
qinxinsandie1年前3 -
 xinbawang 共回答了1个问题
xinbawang 共回答了1个问题 |采纳率因为镁的反应速率太快,不易收集1年前查看全部
- 某学生为了确定何种金属与稀硫酸(H 2 SO 4 )反应制取氢气,分别用1克铁屑、锌粒、镁片和足量的稀硫酸反应.完全反反
某学生为了确定何种金属与稀硫酸(H 2 SO 4 )反应制取氢气,分别用1克铁屑、锌粒、镁片和足量的稀硫酸反应.完全反反应时所需的时间与当地的金属价格如下表所示,并确定选用金属锌.请你回答相关问题:
(1)写出锌与稀硫酸反应的化学方程式______物质 所需时间 价格 Fe 约13900秒 10.00元/1000g Zn 约50秒 40.00元/1000g Mg片 约10秒 432.00元/1000g
(2)选用金属铁的优点是______,缺点是______.
(3)选用Mg片的两个缺点是______和______. bomcogao1年前1
bomcogao1年前1 -
 sunalexlo 共回答了16个问题
sunalexlo 共回答了16个问题 |采纳率93.8%(1)锌与稀硫酸反应生成硫酸锌和氢气,化学方程式为Zn+H 2 SO 4 ═ZnSO 4 +H 2 ↑
(2)铁与硫酸反应速度太慢,但价格便宜.
(3)镁与硫酸反应速度太快,不易控制,镁的价格又太贵.
故答案为:(1)Zn+H 2 SO 4 ═ZnSO 4 +H 2 ↑
(2)价格低廉,反应太慢.
(3)价格太贵,反应太快,不易控制1年前查看全部
- 分别用10克的铁屑.锌粒.镁片与足量的稀硫酸起反应制取氢气,完全反应反所需时间与当地金属价格如下表所示
分别用10克的铁屑.锌粒.镁片与足量的稀硫酸起反应制取氢气,完全反应反所需时间与当地金属价格如下表所示
物质 所需时间 价格
铁 约14000钞 1000克/10元
锌 约50秒 500克/10元
镁 约20秒 25克/元
有上表所知,
(1)实验室一般不选用铁屑制取氢气的主要原应是_.
(2)不选用镁片的主要原应—.
(3)要制取10克氢气需锌粒多少克? foottalk1年前4
foottalk1年前4 -
 米花饭团e270 共回答了26个问题
米花饭团e270 共回答了26个问题 |采纳率88.5%(1)实验室一般不选用铁屑制取氢气的主要原应是_速度太慢.
(2)不选用镁片的主要原应,反应太快来不及收集,还有就是价格有点儿贵.
(3)要制取10克氢气需锌粒多少克?
设,需要xg锌粒
Zn+2HCl=ZnCl2+H2(气体符号)
65.2
x.10g
65/x=2/10g
解得x=325g
答,要制取10克氢气需锌粒325克1年前查看全部
- 铁片\镁片和15%的盐酸反应,那个产生气体快?
 李愚蠢切ee吧1年前6
李愚蠢切ee吧1年前6 -
 新手110 共回答了15个问题
新手110 共回答了15个问题 |采纳率93.3%先指出Ls部分的错误,即便是Fe和HCl反应,生成物也是FeCl2而不是FeCl3.因此无需考虑化合价.
影响反应速率的因素有:
①反应物的性质:Mg金属性比Fe强
②外界因素:
a.温度:看题意可以不考虑
b.浓度:15%HCL
c.压强:固液反应不考虑
d.催化剂:不存在……(可恨还有光照,触媒,等等)
③反应物的状态:题目只说了铁片和镁片,并没有交代他们的表面积. (无法确认和溶液接触面的大小)
结论:如果两者同等表面积或者镁片表面积更大的情况,Mg产生气体快如果铁片比镁片大,根据情况有可能铁片产生H2的速率更快(比如巴掌大小的铁片和手指大小的镁片……夸张了点...)1年前查看全部
- 把试管放入盛有25℃的饱和生石灰的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中
 淌混水1年前1
淌混水1年前1 -
 风之子13 共回答了15个问题
风之子13 共回答了15个问题 |采纳率93.3%会发现有气泡产生,烧杯中的溶液变浑浊.
产生气泡是因为Mg+2HCl=MgCl2+H2↑
因为Mg与HCl反应是放热反应,Ca(OH)2的溶解度随温度升高而降低,所以会出现浑浊.1年前查看全部
- 镁片在饱和食盐水中与盐酸反应现象
镁片在饱和食盐水中与盐酸反应现象
要现象,原因,和离子方程式 卡西莫多啊1年前1
卡西莫多啊1年前1 -
 ganmao54 共回答了18个问题
ganmao54 共回答了18个问题 |采纳率88.9%生成无色气体,镁是活泼金属,能置换酸中的氢.Mg+2H+=Mg2++H21年前查看全部
- 原电池中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针向哪边偏转?为什么
 gaobenshi1年前4
gaobenshi1年前4 -
 索妮娅1 共回答了20个问题
索妮娅1 共回答了20个问题 |采纳率95%指向铝.因为Al能和NaoH反应.而Mg不能,所以Al失去电子,是负极.Mg为正级.所以外电路电流由Mg流向Al.故指向Al.1年前查看全部
- 7.某同学分别用1g铁屑,锌粒,镁片与足量的某酸反应制取氢气,完全反应所需时间与当地价格见下表:
7.某同学分别用1g铁屑,锌粒,镁片与足量的某酸反应制取氢气,完全反应所需时间与当地价格见下表:
物 质 所需时间 价格
铁 约1390s 100g/10元
锌 约50s 500g/20元
镁 约20s 25g/10.8元
你认为实验室应选用何种金属跟酸反应来制取氧气?
请说明理由 ID已被注册已注册1年前3
ID已被注册已注册1年前3 -
 viviaan 共回答了21个问题
viviaan 共回答了21个问题 |采纳率90.5%铁时间太长
镁太贵
所以锌1年前查看全部
- 下列有关原电池的说法中,正确的是( ) A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,
下列有关原电池的说法中,正确的是()
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极 B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极 C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 D.将反应2Fe 3 + +Fe=3Fe 2 + 设计为原电池,则可用锌片作负极,铁片作正极,FeCl 3 溶液作电解质  A_min451年前1
A_min451年前1 -
 跛马王子 共回答了23个问题
跛马王子 共回答了23个问题 |采纳率87%B
1年前查看全部
- (2005•镇江)向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如图
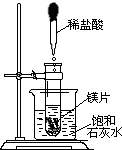 (2005•镇江)向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如图所示.请回答:
(2005•镇江)向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如图所示.请回答:
(1)实验中观察到的明显现象有:①剧烈反应,有气泡产生;②镁条逐渐溶解;③石灰水变浑浊石灰水变浑浊.
(2)产生上述现象③的原因是:
①镁与盐酸反应放出热量,导致石灰水的温度升高镁与盐酸反应放出热量,导致石灰水的温度升高;
②氢氧化钙的溶解度随温度的升高而减小氢氧化钙的溶解度随温度的升高而减小. LXIN131年前1
LXIN131年前1 -
 4fds5f4d4 共回答了13个问题
4fds5f4d4 共回答了13个问题 |采纳率84.6%金属镁与盐酸反应放出热量,导致石灰水的温度升高,石灰水中的溶质为氢氧化钙,氢氧化钙的溶解度随温度的升高而减小,故会析出氢氧化钙溶质,导致石灰水变浑浊.
故答案为:
(1)①石灰水变浑浊;
(2)①镁与盐酸反应放出热量,导致石灰水的温度升高;②氢氧化钙的溶解度随温度的升高而减小.1年前查看全部
- 为什么不用镁片和稀硫酸反应取氢气,而要用锌?2个原因
 成都娇子1年前2
成都娇子1年前2 -
 娃哈哈154 共回答了16个问题
娃哈哈154 共回答了16个问题 |采纳率100%Mg反应过快,反应无法控制,用于气体制备实验比较危险,不适合实验室制取H2.
锌比Mg易保存,形状:Zn粒和Mg条,Mg金属性强,表面都是氧化膜.
等质量Zn比Mg产的氢气要少,一楼回答有误.1年前查看全部
- 如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中(试管中有几小块镁片),再用滴管滴加5ml盐酸于试管中
如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中(试管中有几小块镁片),再用滴管滴加5ml盐酸于试管中
(1)实验现象
(2)产生上述现象原因
(3)相关离子方程式
(4)由实验得Mgcl2溶液与H2总能量是大于/小于/等于Mg与盐酸总能量 呦呦呦呦呦1年前1
呦呦呦呦呦1年前1 -
 承德老鬼 共回答了13个问题
承德老鬼 共回答了13个问题 |采纳率92.3%(1)试管中有气泡产生,镁片逐渐减小;烧杯中有气泡产生
(2)Mg+2HCl=MgCl2+H2;反应放热,二氧化碳溶解度减小.
(3)Mg+2H++2Cl-=Mg2++2Cl-+H2
(4)因为反应放热,所以Mgcl2溶液与H2总能量小于Mg与盐酸总能量1年前查看全部
- 某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,
某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,
但甲同学将电极放入6mol/L稀硫酸中,乙同学将电极放入6mol/L的NaOH溶液中
写出
1写出甲池中发生的有关电极反应式
2写出乙池中发生的有关电极反应式
3如果甲与乙两位同学认为构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼,则甲会判断出( )活动性更强,而乙会判断出( )活动性更强(填元素符号)
4由此实验,可得到如下哪些结论
A利用原电池反应判断金属活动性顺序应注意选择合适的介质
B镁的金属性不一定比铝的金属性强
C该实验说明金属活动性顺序表已经过时,已没有实用价值
D该实验说明化学研究对象复杂,反应条件多变,应具体问题具体分析
5上述实验也反过来证明了利用金属活动性顺序表直接判断原电池中正负极,)(填可靠或不可靠)。如不可靠则请你提出另一个判断原电池正负极可行的实验方案 三联生气1年前2
三联生气1年前2 -
 68189957 共回答了18个问题
68189957 共回答了18个问题 |采纳率94.4%1、负:Mg - 2e = Mg2+
正:2H+ + 2e = H2↑
2、负:2Al + 8OH- - 6e = 2AlO2- + 4H2O
正:6H2O + 6e = 6OH- + 3H2↑
3、Mg Al
4、AD
5、不可靠 加电流计,电流流向的是负极,流出的是正极.1年前查看全部
- 稀盐酸与镁片反应的实验现象、稀盐酸与碳酸钠反应的实验现象分别是什么?
 devgel19941年前3
devgel19941年前3 -
 blueheart26 共回答了18个问题
blueheart26 共回答了18个问题 |采纳率88.9%固体溶解,有大量气泡产生
Mg+2HCl=MgCl2+H2
Na2CO3+2HCl=2NaCl+H2O+CO21年前查看全部
- 将表面去掉氧化膜的镁片与铝片用带电流表的导线连接,插入盛烧碱溶液的烧杯中,此时发现电流计指针偏转,判断此原电池的正负极,
将表面去掉氧化膜的镁片与铝片用带电流表的导线连接,插入盛烧碱溶液的烧杯中,此时发现电流计指针偏转,判断此原电池的正负极,并写出电极反应式和总反应方程式.
铝片做负极,镁作正极
负极:
2Al- 6e- +2OH- =2AlO2- +H2O
正极:
2H2O +2e- =2OH- +H2
我不明白正极和负极这两个电极反应怎麽来的,指导一下,谢谢! clhsnow1年前4
clhsnow1年前4 -
 advarl 共回答了16个问题
advarl 共回答了16个问题 |采纳率93.8%首先明确,铝能和氢氧化钠反应,而镁不能.所以原电池总反应为:
Al+NaOH+H2O→NaAlO2+H2 (未配平)
(镁电极不用考虑,完全可以用石墨代替)
然后电池负极是相电路中提供电子的,所以必有物质失去电子,发生氧化反应,即Al.
在溶液中:铝失去电子:
铝失去电子,应当成为正三价铝离子,在强碱性溶液中,会继续与氢氧根离子反应,生成偏铝酸根离子.两步离子方程式,加起来:
2Al- 6e- +2OH- =2AlO2- +H2O
氢气来源于水:
水微弱电离出的氢离子,氢离子结合电子成氢气.两步离子反应式加起来:
2H2O +2e- =2OH- +H21年前查看全部
- 这道题怎么做:用镁片和铝片做电极,
这道题怎么做:用镁片和铝片做电极,
用镁片和铝片做电极,用导线连接同时插入NaOH溶液中,下列说法正确的是 [ ] A.镁片做负极,电极反应:Mg- 2e - =Mg 2+
B.铝片做负极,电极反应:Al - 3e-+4OH - = AlO 2 - +2H 2 O
C.电子从镁电极沿导线流向铝电极
D.镁片上有气泡产生
 魔草珠珠1年前1
魔草珠珠1年前1 -
 半笼金翡翠 共回答了14个问题
半笼金翡翠 共回答了14个问题 |采纳率92.9%BD1年前查看全部
- 关于原电池的问题10、有甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片做电极,但甲将电极放入
关于原电池的问题
10、有甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片做电极,但甲将电极放入 6mol?L-1 H2SO4溶液中,乙将电极放入
6mol?L-1 NaOH的溶液中,如图所示.(1)写出甲池中正极的电极反应式:.
(2)乙池中负极的电极反应式为 .
(3)由此实验可得到的结论是 .(填选项)
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(4)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种说法 (选填“可靠”或“不可靠”.)如不可靠,请你提出另一个判断原电池正负极的可行的实验方案 (如认为“可靠”,次空可不填).
我主要是第二问想不通啊…… ff1年前1
ff1年前1 -
 莫晚晚 共回答了12个问题
莫晚晚 共回答了12个问题 |采纳率91.7%这个实验设计错误,说明不了什么问题.比较金属活动顺序要测量他们的标准电极电位,直接比较电位差.如 Al I Al+++ Mg I Mg++
Al I H2AlO3- Mg I Mg(OH)2
影响电位的因素很多,物质的溶解性 浓度 介质的pH 温度.所以金属的活动顺序是有前提有条件的,如是否是气态原子或者是在溶液里?与金属接触的物质种类和介质的pH,不仅与元素的电离能有关还与离子的水合能有关.1年前查看全部
- 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为10002L,供选择的电极材料有纯镁片
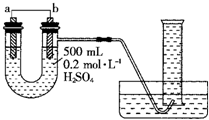 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为10002L,供选择的电极材料有纯镁片和纯铝片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为10002L,供选择的电极材料有纯镁片和纯铝片.请回答下列问题:
(1)b电极的电极反应式为______.
(2)当量筒中收集到4472L(标准状况下)气体时,通过导线的电子的物质的量为______,此时a电极质量减少______克.
(口)如果U形管中的硫酸溶液换成氢氧化钠溶液,U形管中出现的现象______,a电极的电极反应式为______. liyinghuilove1年前1
liyinghuilove1年前1 -
 AiTi_Y 共回答了23个问题
AiTi_Y 共回答了23个问题 |采纳率82.6%解题思路:(1)纯镁片和纯铝片、稀硫酸组成原电池,由图可知b电极处有氢气生成,则b为Al,为正极;a为Mg,为负极;b上氢离子得电子生成氢气;
(2)根据电极方程式结合气体的物质的量求算电子的物质的量,a极为Mg作负极失电子,根据电子守恒计算Mg的质量;
(3)若电解质溶液换为氢氧化钠溶液,则Al失电子作负极,Mg作正极,则Mg上有氢气生成.(1)纯镁片和纯铝片、稀硫酸组成原电池,由图可知b电极处有氢气生成,则b为Al,为正极;a为Mg,为负极;b上氢离子g电子生成氢气,其电极反应式为:2H++2e-═H2↑,
故答案为:2H++2e-═H2↑;
(2)当量筒8收集到448mL(标准状况下)气体,则n(H2)=[V/Vm]=[0.448L/22.4L/mol]=0.02mol,已知b上的电极反应式为:2H++2e-═H2↑,则通过导线的电子的物质的量为0.04mol,a电极上的反应为:Mg-2e-═Mg2+,则溶解的Mg的物质的量为0.02mol,则溶解的Mg的质量为0.48g,
故答案为:0.04mol;0.48;
(0)如果U形管8的硫酸溶液换成氢氧化钠溶液,则Al失电子作负极,即b为负极,Mg电极上水g电子作正极,即a为正极,正极上有氢气生成,所以U形管8左端溶夜下降,个端溶夜上升;a为正极,正极上水g电子生成氢气,电极反应式为:2H2O+2e-═2OH-+H2↑,
故答案为:左端溶夜下降,个端溶夜上升;2H2O+2e-═2OH-+H2↑.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的工作原理知识,主要考查正负极的判断、电极方程式的书写、电子守恒在计算中的应用等,注意知识的积累是解题关键,难度中等.1年前查看全部
- 2.4G含一种杂质的镁片加到足够的稀硫酸中,共收集到0.19G氢气,该镁片中不可能含有的杂质是( )
2.4G含一种杂质的镁片加到足够的稀硫酸中,共收集到0.19G氢气,该镁片中不可能含有的杂质是( )
A,铝B.铁 C.锌 D.铜 鲜花满街1年前1
鲜花满街1年前1 -
 肚腩ww 共回答了21个问题
肚腩ww 共回答了21个问题 |采纳率90.5%A,如果全部是Mg会产生0.2g氢气.现在比0.2g少,说明镁片中含有比纯镁产生氢气少的元素.铁、锌、铜和镁相同的价态,都比镁重.铝由于是三价的,产生的氢气比镁多,只能是A.1年前查看全部
- (2010•江西)某学生分别用1g的铁屑、锌粒、镁片与足量的某酸反应以制取氢气,完全反应所需时间与当地的金属价格如下表所
(2010•江西)某学生分别用1g的铁屑、锌粒、镁片与足量的某酸反应以制取氢气,完全反应所需时间与当地的金属价格如下表所示.
你认为实验室中一般不选用铁屑、镁片与酸反应制取氢气的主要原因是什么?物 质 所需时间 价 格 铁屑 约13900s 10.00元/1000g 锌粒 约50s 20.00元/500g 镁片 约20s 10.80元/25g  l472681年前1
l472681年前1 -
 路人_某某 共回答了15个问题
路人_某某 共回答了15个问题 |采纳率80%解题思路:实验室制取气体选择药品时,要综合考虑.首先选择的药品反应时,只能生成所需要的那一种气体,否则收集的气体不纯;其次考虑反应速度不能太快,快了不利于操作和收集,也不能太慢,太慢在有限的时间内收集不到所需要的气体;最后还要考虑操作是否简单安全,是否无污染,成本是否廉价等.答:一般不用铁屑的原因是:从所给表可以看出,铁虽然比较廉价,但需要的时间长,说明铁反应得太慢;镁反应所需时间少,反应过快,且镁的价格较高.故一般选锌粒,反应速度适中,价格适中.
点评:
本题考点: 实验室制取气体的思路.
考点点评: 该题主要考查实验室制取气体时选择药品的思路,同时渗透了金属的活动性顺序.1年前查看全部
- 把试管放如盛有25度的饱和石灰水的烧杯中,试管中放如几小块镁片,再滴入5ML的HCL于试管中
把试管放如盛有25度的饱和石灰水的烧杯中,试管中放如几小块镁片,再滴入5ML的HCL于试管中
(1)实验中观察至的现象是__________________
(2)产生上述现象的原因
第一题答案是 有大量气泡产生 镁片溶解 烧杯中有晶体析出
第二题答案是 MG与HCL反应产生H2,放热反应,CA(OH)2在水中溶解度减小,析出晶体
但是我有个疑问,为什么Mg与HCL反应生成MgCl2,它为什么不与ca(oh)2反映生成氢氧化镁沉淀? iteyt1年前1
iteyt1年前1 -
 迪克小妖 共回答了15个问题
迪克小妖 共回答了15个问题 |采纳率93.3%镁与盐酸在试管里,试管泡在石灰水里……1年前查看全部
- 为什么铝片和镁片放在硫酸溶液镁片是负极,而铝片和镁片放在氢氧化钠溶液中镁片是正极
 朝天大笑1年前3
朝天大笑1年前3 -
 singapore2007 共回答了21个问题
singapore2007 共回答了21个问题 |采纳率90.5%在酸性溶液当中镁比铝活泼,所以镁为负极;而在碱性溶液当中,只有铝可以和氢氧化钠溶液反应,而镁不可以1年前查看全部
- 铝片和镁片在一起,为什么铝片优先与氢氧化钠发生反应?
 天才斑斑1年前6
天才斑斑1年前6 -
 鸣远100 共回答了18个问题
鸣远100 共回答了18个问题 |采纳率83.3%金属镁是典型的金属,不与碱反应
金属铝是两性金属既可跟酸反应也可跟碱反应,所以铝片与强氧化钠发生反应
当铝片跟金属镁两者在一起时组成了原电池,由于铝片可以跟氢氧化钠反应,所以铝片为负极发生氧化反应,镁为正极.组成原电池时铝片与氢氧化钠的反应速率明显比一般反应快1年前查看全部
- 锌片和镁片同时与稀盐酸反应,哪个更快?
 ccbmozi1年前1
ccbmozi1年前1 -
 HA有你有我 共回答了25个问题
HA有你有我 共回答了25个问题 |采纳率88%镁片
在金属活动性顺序表里 镁排在锌的前面1年前查看全部
- 取表面被氧化成氧化镁的镁片1.4克,跟53.9克10%的硫酸溶液恰好完全反应,在标准状况下生成1.12升氢气(已知氢气密
取表面被氧化成氧化镁的镁片1.4克,跟53.9克10%的硫酸溶液恰好完全反应,在标准状况下生成1.12升氢气(已知氢气密度是0.09克/升),求:
(1)镁片上有氧化镁多少克?
(2)反应后溶液的溶质质量分数是多少? 笨笨0011041年前1
笨笨0011041年前1 -
 521哼哼 共回答了18个问题
521哼哼 共回答了18个问题 |采纳率94.4%解题思路:(1)根据氢气的质量利用化学方程式计算出镁的质量,进而求出氧化镁的质量;
(2)反应后溶液中的溶质为镁与氧化镁分别于硫酸反应生成的硫酸镁之和,据此解答氢气的质量为:1.12升×0.09克/升≈0.1g,
(1)设镁的质量为x,生成硫酸镁的质量为y
Mg+H2SO4=MgSO4+H2↑
24842
xy 0.1g
[24/2=
x
0.1g],[84/2=
y
0.1g]
x=1.2g,y=4.2g
氧化镁的质量为:1.4g-1.2g=0.2g;
(2)设氧化美与硫酸反应生成的硫酸镁的质量为z
MgO+H2SO4=MgSO4+H2O
40 84
0.2g z
[40/84=
0.2g
z]
z=0.42g
反应后所得溶液的质量为:1.4g+53.9g-0.1g=55.2g
反应后溶液的溶质质量分数是:
4.2g+0.42g
55.2g×100%=8.4%
答:(1)镁片上有氧化镁0.2g;
(2)反应后溶液的溶质质量分数是8.4%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.1年前查看全部
- 向试管中放入几块镁片,把试管固定在盛有饱和石灰水的烧杯中,再向试管中滴入盐酸,有什么明显现象
向试管中放入几块镁片,把试管固定在盛有饱和石灰水的烧杯中,再向试管中滴入盐酸,有什么明显现象
试管中镁片变小,产生无色的气体,烧杯中出现白色沉淀.
能否说明一下上述现象产生的原因? kkzhu1年前1
kkzhu1年前1 -
 1233哥哥 共回答了13个问题
1233哥哥 共回答了13个问题 |采纳率92.3%酸的通性,酸与镁反应,硫酸镁微溶1年前查看全部
- 在天平两边托盘上,各放等质量的烧杯,烧杯中盛放等质量、相同质量分数的盐酸,如往两个烧杯中分别放入一块镁片和一块铝片(均与
在天平两边托盘上,各放等质量的烧杯,烧杯中盛放等质量、相同质量分数的盐酸,如往两个烧杯中分别放入一块镁片和一块铝片(均与酸完全反应),要使天平保持平衡,问镁和铝的质量比是多少?
 sky4021年前1
sky4021年前1 -
 Google测试员176 共回答了20个问题
Google测试员176 共回答了20个问题 |采纳率85%楼上错了吧.铝的原子量是27耶.所以投入24克镁生成2克氢气是增加了22克 投入54克铝生成6克氢气是增加了48克.所以镁铝的质量比是24*48比54*22等于32比33.1年前查看全部
- (14分)Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2
(14分)
Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2 mol/L H 2 SO 4 溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图: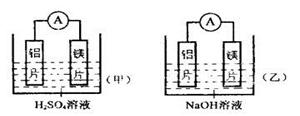
(1)写出甲池中正极的电极反应式: ;
(2)写出乙池中负极的电极反应式: ;
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填元素符号)。
(4)由此实验,可得到如下哪些正确结论?()
Ⅱ.向一个容积为2 L的密闭容器中充入2 mol A和1 mol B,发生如下反应:2 A(g) + B(g)A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质 B.镁的金属性不一定比铝的金属性强 C.该实验说明金属活动顺序表已过时,已设有实用价值 D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析  xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
(1)x= ;
(2)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(填“吸热”或“放热”)反应;
(3)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是 (用序号填空)
①4 mol A + 2 mol B
②3 mol C + 1 mol D
③3 mol C + 1 mol D +1 mol B 剑文飞1年前1
剑文飞1年前1 -
 272671053 共回答了26个问题
272671053 共回答了26个问题 |采纳率80.8%Ⅰ.(1)2H + +2e - = H 2 ↑(2分)
(2)2Al+8OH - -6e - = 2AlO 2 - +4H 2 O (或Al+4OH - -3e - = AlO 2 - +2H 2 O)(2分)
(3)Mg;Al (每空1分)(4)A D(2分)
Ⅱ.(1)3(2分)(2)吸热(2分)(3)②(2分)
Ⅰ.(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。甲中铝是正极,镁是负极。正极反应式为2H + +2e - = H 2 ↑。
(2)乙中,由于铝可以和氢氧化钠溶液反应,而镁不能,所以镁是正极,铝是负极。负极反应式为2Al+8OH - -6e - = 2AlO 2 - +4H 2 O 。
(3)根据原理可知,甲中镁的活泼性强于铝的。而乙中则得出铝的活泼性强于镁的。
(4)根据以上实验事实可知,选项AD是正确的。
Ⅱ.(1)平衡时B的浓度为0.1 mol/L,则消耗的B的浓度是0.5mol/L-0.1mol/L=0.4mol/L。由于浓度的变化之比是相应的化学计量数之比,所以x=3。
(2)由于正反应是体积增大的反应,所以当混合气体的平均相对分子质量减小时,平衡是向正反应方向移动的,即正反应是吸热反应。
(3)由于平衡的建立和途径无关,②③分别相当于AB的物质的量是2mol、1mol和2mol、2mol,所以②符合。③相当于增大A的转化率,达到平衡时C的浓度大于1.2 mol/L。①相当于在原平衡的基础上增大压强,平衡向逆反应方向移动,但达到平衡时C的浓度大于1.2 mol/L,而小于2.4mol/L。答案选②。1年前查看全部
- 稀盐酸与镁片反应的实验现象有哪些
 leewawa1年前3
leewawa1年前3 -
 xuchenbiao 共回答了25个问题
xuchenbiao 共回答了25个问题 |采纳率88%1、放热
2、气泡(H2)
3、反应速率先变快(温度上升),后变慢(盐酸变稀)
4、镁条溶解1年前查看全部
- 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用胶头滴管滴入5ml盐酸于试管中,试回答
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用胶头滴管滴入5ml盐酸于试管中,试回答下列问题:

①实验中试管内观察到的现象是______.
②产生该现象的原因是______.
③写出有关反应的离子反应方程式______. 卑鄙教煮饭的1年前3
卑鄙教煮饭的1年前3 -
 奶粉1号 共回答了19个问题
奶粉1号 共回答了19个问题 |采纳率94.7%解题思路:如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使烧杯中的溶液变浑浊.①镁与盐酸剧烈反应,可观察到产生大量气体,镁片逐渐溶解,
故答案为:镁片上有大量气泡,镁片逐渐溶解;
②镁与盐酸剧烈反应,产生氢气,
故答案为:镁与盐酸反应产生H2;
③镁与盐酸发生置换反应,生成氯化镁和氢气,反应的离子方程式为:Mg+2H+=Mg2++H2↑,
故答案为:Mg+2H+=Mg2++H2↑.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题考查金属与酸的反应,该反应为放热反应,难度不大.要注意氢氧化钙的溶解度随温度升高而减小,但本题没考到这一点,是一点创新.1年前查看全部
- 把试管放入盛有25℃时饱和石灰水的烧杯中 试管中开始放入几小块镁片,再用滴滴入m0L盐酸于试管中
把试管放入盛有25℃时饱和石灰水的烧杯中 试管中开始放入几小块镁片,再用滴滴入m0L盐酸于试管中
把试管放入盛有25℃时饱和石灰水的烧杯中 试管中开始放入几小块镁片,再用滴滴入m0L盐酸于试管中 观察到的现像是?有关反应离子方程式! 说事11年前2
说事11年前2 -
 靓龙 共回答了14个问题
靓龙 共回答了14个问题 |采纳率85.7%现象:有大量气泡产生.
离子方程式为:Mg + 2H+ == Mg2+ + H2(气体)1年前查看全部
- 将镁片和铝片分别投入浓naoh溶液,只有铝片表面产生起泡,说明铝比镁活泼.为撒推理是错的?
将镁片和铝片分别投入浓naoh溶液,只有铝片表面产生起泡,说明铝比镁活泼.为撒推理是错的?
将镁片和铝片分别投入浓naoh溶液,只有铝片表面产生起泡,说明铝比镁活泼.
为撒推理是错的?我知道钾钙钠镁铝~就是不知道推理哪里错了. 鼎铁dd1年前4
鼎铁dd1年前4 -
 陈章华 共回答了16个问题
陈章华 共回答了16个问题 |采纳率100%这样推理是不行的.
我们说金属活泼,是指和酸反应生成H2速率的快慢.生成H2快的金属比较活泼.
现在是和NaOH反应,NaOH不是酸,所以不能用“铝能和NaOH反应,而Mg不能和NaOH反应”来说明Al比Mg活泼.
事实上,Al能和NaOH反应说明了Al的两性(金属性和非金属性),从而说明了Al的金属性不如Mg,Mg更活泼.1年前查看全部
- 初三科学竞赛题在天平的两端,各放一只等质量的烧杯,烧杯中盛放等质量等浓度的稀硫酸.像两只烧杯中分别放入一块镁片和铝片(均
初三科学竞赛题
在天平的两端,各放一只等质量的烧杯,烧杯中盛放等质量等浓度的稀硫酸.像两只烧杯中分别放入一块镁片和铝片(均与硫酸完全反应),若天平保持平衡,则放入的镁片和铝片的比是
A.32:33 B.33:32 C.4:3 D.3:4 999381年前1
999381年前1 -
 漂泊的人_ss 共回答了16个问题
漂泊的人_ss 共回答了16个问题 |采纳率93.8%选A,设镁的质量为X,铝为Y.根据其各自与稀硫酸反应的特点得出,
镁置换出的氢气为x/12,铝为Y/9.得到等式X-X/12=Y-Y/9.计算后得出A.1年前查看全部
- 下列有关原电池的说法正确的是 [ ] A.铝片和镁片用导线连接后插入Na
下列有关原电池的说法正确的是 [ ]A.铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe 3+ +Fe = 3Fe 2+ 设计为原电池,则可用Zn为负极,Fe为正极,FeCl 3 为电解质 teatime_20051年前1
teatime_20051年前1 -
 现在才懂我傻 共回答了20个问题
现在才懂我傻 共回答了20个问题 |采纳率85%B1年前查看全部
- 镁片放置在空气中,不需要加热就能在表面生成MgO对吗详解
 沈华丽1年前2
沈华丽1年前2 -
 核心网新ee 共回答了24个问题
核心网新ee 共回答了24个问题 |采纳率91.7%对.
因为镁是活泼金属,在能和空气中的氧气发生反应,生成MgO.1年前查看全部
大家在问
- 1Are you willing to live in an age _____ 4G technology will b
- 2由太阳和宇宙中的所有星球组成的天体系统叫什么?叫太阳系吗?为什么?
- 3李白《闻王昌龄左迁龙标遥有此寄》中,诗人将月亮人格化,把无知的明月成了善解人意的知心人的诗句是:
- 4英语类的填空那个女孩讨厌与别人一样,她总是想与众不同The girl hates to be ------ anyone
- 5首字母填空You can go to the m to buy some food for this birthday
- 6Your English is very good中为什么要加is
- 7如果x,y,是两种相关联的量,且x=9y,那么x和y成正比例吗?
- 8下列各组稀溶液中,不用其他任何实际就能鉴别出来的是( )
- 9一般不选用浓盐酸与石灰石反应制二氧化碳的原因是什么
- 10赞颂人物优秀品质的成语有( 5个)描写自然景物( 3个)
- 11NH3.H2O属于碱吗?
- 12如:1米=10分米之类的就可以了!
- 13四边形abcd内接于圆o,角a:角c=1:4,求角a
- 14为自己喝彩的相关内容为自己喝彩的相关内容
- 15如何做三角形的外接圆(尺规作图)
