0.3mol氧分子中含多少个氧分子,多少个氧原子
 becky_wen2022-10-04 11:39:542条回答
becky_wen2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 风岩残缺 共回答了11个问题
风岩残缺 共回答了11个问题 |采纳率100%- 1.806乘以10的23次方
3.612乘以10的23次方 - 1年前
 三围很棒的螃蟹 共回答了364个问题
三围很棒的螃蟹 共回答了364个问题 |采纳率- 0.3NA 0.6NA
- 1年前
相关推荐
- (紧急)0.3mol/L的葡萄糖溶液和0.3mol/L的甘油溶液都和血浆浓相等,为什么会使红细胞发生溶血?
 2840749901年前1
2840749901年前1 -
 平凡精灵 共回答了14个问题
平凡精灵 共回答了14个问题 |采纳率100%人血浆的等渗溶液为0.9%NaCl溶液,红细胞在低于0.45%NaCl溶液中,因水渗入,红细胞膨胀而破裂,血红蛋白逸出
渗透压不是仅按一个因素决定的,还要看其他的溶质的1年前查看全部
- 问题是这样的:现有A.B两种链状饱和一元醇的混合物0.3mol,其质量为13.8g.已知A和B的碳原子数均不大于4,且A
问题是这样的:
现有A.B两种链状饱和一元醇的混合物0.3mol,其质量为13.8g.
已知A和B的碳原子数均不大于4,且A<B.
(1)混合物中A可能的分子式:
B可能的分子式:
(2)若n(A):n(B)=1:1时,A的名称为:
B的名称为:
(3)若n(A):n(B)≠1:1时,A的结构简式为:
B的结构简式为:
则n(A):n(B)=:
这道题应该如何去想?
特别是比值那,还有给出的限制条件应该如何理解? zhuizi1年前3
zhuizi1年前3 -
 我爱小猪啊 共回答了12个问题
我爱小猪啊 共回答了12个问题 |采纳率91.7%先求平均摩尔质量,就是把混合物当成单一物质来看.
13.8g/0.3mol=46g/mol
46g/mol不大,乙醇摩尔质量就是46g/mol,因此可选范围很小.
“链状”“饱和”“一元醇”
既然AB不一样,那么肯定是一大一小.A是小的,那么肯定甲醇CH3OH.
B是大的,碳原子数不大于4,那么只可能是1-丙醇或1-丁醇.
2.“n(A):n(B)=1:1”的意义在于
46g/mol=平均摩尔质量=[n(A)M(A)+n(B)M(B)]/(n(A)+n(B))=[M(A)+M(B)]/2
既然刚才说了A是甲醇,其摩尔质量为32g/mol,代进去算出来是60g/mol,就是1-丙醇.其实不算也可以看得出,但这里是计算题,所以得算算.
3.“n(A):n(B)≠1:1”,刚才说过A肯定是甲醇,B可能是1-丙醇或1-丁醇,既然上题是1-丙醇,那么这题就是1-丁醇.
n(A):n(B)的算法还是要用上面的式子
平均摩尔质量=[n(A)M(A)+n(B)M(B)]/(n(A)+n(B))
其中,平均摩尔质量=46g/mol;M(A)=32g/mol;M(B)=74g/mol
求得n(A):n(B)=2:11年前查看全部
- 0.3mol浓硫酸含有多少molO多少molS多少molH
 单行道玫瑰1年前3
单行道玫瑰1年前3 -
 海浪花花 共回答了20个问题
海浪花花 共回答了20个问题 |采纳率95%0.3mol浓硫酸含有 1.2molO;0.3molS;0.6molH.1年前查看全部
- 把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3mol NO2和0.2mol NO.向反应后的溶液
把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3mol NO2和0.2mol NO.向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止.得到固体质量不可能为( )
A.18g
B.24g
C.30g
D.36g 罗大虾1年前1
罗大虾1年前1 -
 muhe112 共回答了15个问题
muhe112 共回答了15个问题 |采纳率80%硝酸得电子变成氮的氧化物,铁在反应中失电子变成铁离子或亚铁离子,加碱后生成氢氧化物,对沉淀加热生成氧化铁沉淀,在反应中铁失电子数和硝酸得电子数相等.根据HNO3
+3e−
NO,HNO3
e−
NO2,生成0.3molNO2转移的电子为0.3×1=0.3mol,生成0.2molNO转移的电子为0.2×3=0.6mol,共转移0.9mol电子,
若反应中Fe失去3个电子变成铁离子Fe
3e−
Fe3+
3OH−
Fe(OH)3
△
,[1/2]Fe2O3,
3mol 80g
0.9mol 24g
若反应中Fe失去2个电子变成亚铁离子Fe
2e−
Fe2+
2OH−
Fe(OH)2
△
,[1/2]Fe2O3,
2mol 80g
0.9mol 36g
若铁既变成铁离子由变成亚铁离子,则得到的沉淀介于24g-36g之间,30g可能,18g不可能,
故选A.1年前查看全部
- 0.3molH2O中有多少氢分子 多少mol氢原子 约有多少个氢原子 0.2mol O2与多少molH2O所含有的氢原子
0.3molH2O中有多少氢分子 多少mol氢原子 约有多少个氢原子 0.2mol O2与多少molH2O所含有的氢原子个数相等
36克水的物质的量为多少mol 16克某物质为0.5mol,则该物质的摩尔质量为 leanaa371年前5
leanaa371年前5 -
 自家人 共回答了17个问题
自家人 共回答了17个问题 |采纳率88.2%(1)0.3molH2O中有无氢分子,n(H原子) == 0.3mol*2==0.6mol,N(H原子) == 0.6NA
(2)O2无氢原子啊?应该是氧原子个数相等吧
n(O) == 0.2mol *2 == n(H2O)*1 解得 n(H2O)== 0.4mol
(3)n(H2O) == 36g / 18g/mol == 2mol
(4)M == 16g / 0.5mol == 32g/mol1年前查看全部
- 50ML0.1mol/L硫酸铝溶液与100ML0.3mol/L硫酸钠溶液相比,它们的硫酸根离子浓度比为?
50ML0.1mol/L硫酸铝溶液与100ML0.3mol/L硫酸钠溶液相比,它们的硫酸根离子浓度比为?
- -..我就是做不到答案那样饿.
是惊天DI~...它说是,1:1..我汗 谁的悠悠1年前4
谁的悠悠1年前4 -
 快乐与花钱有关吗 共回答了13个问题
快乐与花钱有关吗 共回答了13个问题 |采纳率53.8%答案就是1:1
楼主被题目耍了.审题的关键在于比较硫酸根离子浓度,而不在于比较它们的量.因此,从溶液的浓度入手就可以,其他无视.
题目说0.1mol/L硫酸铝Al2(SO4)3也就是说硫酸根离子浓度是0.3mol/L.
而0.3mol/L硫酸钠NaSO4的硫酸根离子浓度是0.3mol/L
所以硫酸根离子浓度就是1:1年前查看全部
- 某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2
某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2SO2+O2
 2SO3反应.5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%.求
2SO3反应.5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%.求
(1)以SO3的浓度变化表示该反应的化学反应速率;
(2)该反应中SO2的平衡转化率. 你是牛A我是牛B1年前1
你是牛A我是牛B1年前1 -
 JasmineMo 共回答了19个问题
JasmineMo 共回答了19个问题 |采纳率89.5%解题思路:设平衡时转化的氧气的物质的量为x,根据同温同体积时气体的压强之比等于物质的量之比,利用三段式法计算反应的氧气的物质的量,进而计算出反应的三氧化硫的物质的量,则可求出反应速率;根据反应方程式计算出反应的二氧化硫的物质的量,进而求出反应中SO2的平衡转化率.设平衡时转化的氧气的物质的量为x,利用三段式法计算.
2SO2+O2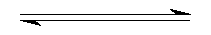 2SO3
2SO3
初始 0.3mol0.2mol 0
变化 2xx 2x
平衡0.3mol-2x0.2mol-x 2x
同温同体积下
P1
P2=
n1
n2=
0.3mol−2x+0.2mol−x+2x
0.3mol+0.2mol=90%
解得x=0.05mol,
(1)平衡时n(SO3)=2×0.05mol=0.1mol,则v(SO3)=
2×0.05mol
2L×5min=0.01mol•L−1•min−1
答:以SO3的浓度变化表示该反应的化学反应速率为0.01mol/(L•min).
(2)平衡时反应的物质的量为2×0.05mol=0.1mol,则SO2的转化率为
2×0.05mol
0.03mol×100%=33.3%
答:该反应中SO2的平衡转化率为33.3%.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算,题目难度不大,本题注意根据阿伏伽德罗定律,利用三段式法计算.1年前查看全部
- FeS与足量的稀硝酸反应,生成Fe(NO3)3,S,NO和H2O.若反应中有0.3mol的电子转移,则参加反应的硝酸中未
FeS与足量的稀硝酸反应,生成Fe(NO3)3,S,NO和H2O.若反应中有0.3mol的电子转移,则参加反应的硝酸中未被还原的物质的量为 ( ) A.0.9 mol B.0.45 mol C.0.3 mol.D.0.1 mol
 殒落流星1年前1
殒落流星1年前1 -
 panda8897 共回答了14个问题
panda8897 共回答了14个问题 |采纳率92.9%依题可知FeS中铁转移一个电子,S转移两个电子,一个硝酸根接受3个电子,反应中有0.3mol的电子转移,则有0.1molFeS参加反应,未被还原的硝酸即等于生成的Fe(NO3)3物质的量的3倍,故应选C,一楼的答案是不对的.1年前查看全部
- 将0.3mol乙烯和乙烷的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了2.8g
将0.3mol乙烯和乙烷的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了2.8g
求原气体中,乙烯和乙烷的物质的量之比 男人都是mm1年前1
男人都是mm1年前1 -
 小小焰小小 共回答了23个问题
小小焰小小 共回答了23个问题 |采纳率95.7%溴水吸收乙烯而不吸收乙烷.
所以乙烯的物质的量:2.8÷28=0.1mol
乙烷的物质的量:0.3-0.1=0.2mol
所以原气体中,乙烯和乙烷的物质的量之比为1:21年前查看全部
- 0.3mol 氧气中 氧原子的物质的量是多少 怎么算
 萱萧1年前1
萱萧1年前1 -
 猫眯蓉 共回答了13个问题
猫眯蓉 共回答了13个问题 |采纳率100%一个氧气分子是由2个氧原子构成的,所以氧原子为0.3*2=0.6mol1年前查看全部
- 往含0.2摩尔氢氧化钠和0.1mol氢氧化钙中持续通入二氧化碳当通入气体为0.3mol时立刻停止 溶液中离子数
往含0.2摩尔氢氧化钠和0.1mol氢氧化钙中持续通入二氧化碳当通入气体为0.3mol时立刻停止 溶液中离子数
和通入二氧化碳气体的关系是
 2754835171年前1
2754835171年前1 -
 上罗人氏 共回答了21个问题
上罗人氏 共回答了21个问题 |采纳率81%先生成碳酸钙 (二氧化碳0.1摩尔以前)
大于0.1mol时继续通入生成 碳酸钠(这一阶段又通入0.1mol ,加上之前的共0.2mol)
继续通会生成碳酸氢钠 (又是0.1mol CO2 共0.3mol)
继续通会使碳酸钙沉淀转化为碳酸氢钙溶解 (还是0.1mol 共0.4mol)
反应: Ca(OH)2 + CO2 = C...1年前查看全部
- 0.2mol二氧化锰和0.6mol盐酸混合加热,加入硝酸银,为什么沉淀的物质的量大于0.3mol
 函哲1年前2
函哲1年前2 -
 lc_freely 共回答了19个问题
lc_freely 共回答了19个问题 |采纳率89.5%MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
0.2molMnO2与0.6mol盐酸反应,MnO2过量,盐酸不足
0.6molHCl如果完全反应,生成0.15mol的MnCl2,0.15mol的Cl2
0.15molMnCl2加入硝酸银,理论上应该生成0.3molAgCl沉淀
但是实际上生成沉淀多于0.3mol
因为MnO2只能与浓盐酸反应,在反应过程中,HCl浓度不断减小,所以到了后期盐酸浓度比较低的时候,反应已经停止了,那么生成氯气的量就会少于0.15mol,由于体系中的氯元素只以氯气和氯离子的形式存在,氯气少了,那么氯离子就多了,所以生成氯化银沉淀比“理论值”多1年前查看全部
- 有二氧化碳与CO的混合气体共10.8g,其物质的量为0.3mol
有二氧化碳与CO的混合气体共10.8g,其物质的量为0.3mol
问混合气体中二氧化碳与CO的物质的量各为多少 海天一色07431年前2
海天一色07431年前2 -
 飞天小雪猪 共回答了22个问题
飞天小雪猪 共回答了22个问题 |采纳率95.5%设二氧化碳的物质的量为x,氧化碳的物质的量为y
x+y=0.3mol
44x+28y=10.8g
x=y=0.15mol1年前查看全部
- 0.3mol NH3 所含分子数与( )g H2O所含的分子数相等.
0.3mol NH3 所含分子数与( )g H2O所含的分子数相等.
顺便问问:铵根离子,甲烷的化学式是什么啊? 扫雪烹新茶1年前5
扫雪烹新茶1年前5 -
 冰风蓝 共回答了20个问题
冰风蓝 共回答了20个问题 |采纳率85%分子数相等,即为物质的量相等n=N/NA
0.3*18=5.4g
铵根离子NH4+,
甲烷CH41年前查看全部
- 含有0.3mol/L氯化钠 pH为8.3的硼酸缓冲液怎么配置?
 aaa67630971年前1
aaa67630971年前1 -
 yudi818 共回答了18个问题
yudi818 共回答了18个问题 |采纳率100%硼酸是一种弱酸,水解后会成碱性,可以根据它的水解度去配制的1年前查看全部
- 提出你的疑问0.3mol钠和100ml 1mol/L的HCL产生的气体是多少摩尔(NA与H2O)
 shirley28031年前3
shirley28031年前3 -
 石头xx是我 共回答了19个问题
石头xx是我 共回答了19个问题 |采纳率100%将Na、Mg、Al各0.3mol分别放入100mL 1mol·L-1的盐酸中,同温同压下产生气体的体积比为(3:1:1 )因为Na还可以和盐酸中的H2O反应生成H2 2Na+1年前查看全部
- 0.3mol氨气和0.4mol二氧化碳的质量____(填“相等”或“不相等”,下同),所含分子数_____,所含原子数_
0.3mol氨气和0.4mol二氧化碳的质量____(填“相等”或“不相等”,下同),所含分子数_____,所含原子数_____.
 TopFirstOne11年前1
TopFirstOne11年前1 -
 Laohaorener 共回答了19个问题
Laohaorener 共回答了19个问题 |采纳率94.7%不相等 不相等 相等(NH3 4个原子 CO2 3个原子 4*0.3=3*0.4)1年前查看全部
- 将钠,镁,铝各0.3mol分别放入100ml 1mol\L的盐酸中,怎么看出盐酸是不足还是过量
 462884361年前1
462884361年前1 -
 clj1986612 共回答了15个问题
clj1986612 共回答了15个问题 |采纳率93.3%钠,镁,铝各0.3mol分别需要HCl0.3、0.6、0.9mol,根据方程式盐酸都不足1年前查看全部
- 在标准状况下,把体积为VL的Cl2通入0.3mol的Kl溶液中,充分反应后,将溶液蒸干,灼烧的31.5g残渣
在标准状况下,把体积为VL的Cl2通入0.3mol的Kl溶液中,充分反应后,将溶液蒸干,灼烧的31.5g残渣
① 通入CI2的体积 ,②生成KCl的质量为 安雅琦1年前1
安雅琦1年前1 -
 521xln 共回答了22个问题
521xln 共回答了22个问题 |采纳率95.5%(1)设参加反应的KI的物质的量为 x mol,则根据反应:
2 KI + CL2 == 2 KCl + I2
2 1 2
x 0.5x x
因灼烧后 I2单质会升华,所以剩余残渣只可能是KCl 或 KI 或两者的混合物.
残渣质量 m = m(KCl) + m(KI) = 74.5x + 166*(0.3-x) = 31.5
解得x=0.2 mol,即通入的Cl2体积为22.4*0.1=2.24L
(2)生成提KCl的质量 m(KCl) = 0.2 * 74.5=14.9g1年前查看全部
- 怎么求 0.3mol镁与0.1mol盐酸生成的氢气的物质的量
 fine1年前2
fine1年前2 -
 隐隐飞桥隔野烟 共回答了25个问题
隐隐飞桥隔野烟 共回答了25个问题 |采纳率92%Mg+2HCl=MgCl2+H2↑
由此看出Mg和HCl以物质的量之比1:2反应
而0.3mol镁与0.1mol盐酸,由此看出金属过量,酸全反应,此时按酸求氢气物质的量,即0.05molH21年前查看全部
- 在5L的密闭容器中发生反应:4NH3+5O2═4NO+6H2O,半分钟后NO的物质的量增加了0.3mol,在这段时间内N
在5L的密闭容器中发生反应:4NH3+5O2═4NO+6H2O,半分钟后NO的物质的量增加了0.3mol,在这段时间内NO的化学反应速率为( )
A. 0.12mol/(L•S)
B. 0.012mol/(L•S)
C. 0.6mol/(L•S)
D. 0.002mol/(L•S) hanshu1231年前2
hanshu1231年前2 -
 symln 共回答了29个问题
symln 共回答了29个问题 |采纳率93.1%解题思路:根据v=[△c/△t]计算v(NO).半分钟后NO的物质的量增加了0.3mol,
所以△c(NO)=[0.3mol/5L]=0.06mol/L,
所以v(NO)═[0.06mol/L/30s]=0.002mol/(L•S).
故选:D.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 考查学生利用定义计算反应速率,难度不大,旨在考查学生对基础知识的掌握,加强基础学习.1年前查看全部
- 已解决将钠镁铝各0.3mol分别放入足量的盐酸中,同温同压下产生的气体体积比为多少?
 lcw221年前3
lcw221年前3 -
 handir2008 共回答了18个问题
handir2008 共回答了18个问题 |采纳率88.9%2 Na-------H2 Mg---------H2 2Al----------3H2 根据电子守恒
2mo 1mol 1mol 1mol 2mol 3mol
0.3mol x=0.15mol 0.3mol x=0.3mol 0.3mol x=0.45mol
体积比=物质的量比=0.15:0.3:0.45=1:2:31年前查看全部
- 将钠镁铝各0.3mol分别放入100ml1mol/L的盐酸中,同温同压下产生的气体体积比
将钠镁铝各0.3mol分别放入100ml1mol/L的盐酸中,同温同压下产生的气体体积比
要详细点,方法越简单越好~~另外不要用太超前的知识.毕竟只学到摩尔这块,后面的氧化还原都没学到,所以如果解释最好可以说清楚点,谢谢各位
 we清风1年前1
we清风1年前1 -
 蓝之弦 共回答了12个问题
蓝之弦 共回答了12个问题 |采纳率83.3%2Na +2HCl==2NaCl +H2 Mg +2HCl ==MgCl2 +H2 2Al +6HCl==2AlCl3 +3H2
2 2 1 2 2 6
HCl有 0.1*1==0.1 mol
由方程知,
0.3 mol Na 消耗 HCl 为 0.3 mol
0.3 mol Mg 消耗HCl 为 0.6 mol
0.3 mol Al 消耗 HCl 为 0.9 mol
现在HCl只有 0.1 mol
即金属都是过量的,HCl不足量
0.1 mol HCl 可以产生 0.1/2=0.05 mol H2
则产生的H2 0.05 mol
体积相等之比 为 1:1:11年前查看全部
- 0.3MOL二氧化碳和0.2MOL氨气的质量比
 阿拉类1年前1
阿拉类1年前1 -
 hmjfun 共回答了20个问题
hmjfun 共回答了20个问题 |采纳率90%由于n=m/M(物质的量等于质量除以摩尔质量),所以m=n*M(质量等于物质的量乘以摩尔质量).物质的摩尔质量与它的相对分子质量数值相等!所以二氧化碳的质量是0.3*44=13.2氨气的质量是0.2*17=3.4所以0.3MOL二氧化碳和0.2MOL氨气的质量比约为3.9.1年前查看全部
- 0.1mol某有机物在0.3molO2中全部燃烧后,生成CO CO2和水蒸气 通入盛有cacl2的干燥管,发现干燥管增重
0.1mol某有机物在0.3molO2中全部燃烧后,生成CO CO2和水蒸气 通入盛有cacl2的干燥管,发现干燥管增重7.2g,剩余气体再通过灼热的cuo,使其减轻1.6g,到处的气体与足量Na2O2反应,产生的气体在标准状况下体积为3.36L求有机物燃烧后生成CO的物质的量!
以及该有机物的分子式. 烟色Y1年前2
烟色Y1年前2 -
 nn2188 共回答了28个问题
nn2188 共回答了28个问题 |采纳率92.9%CO:0.1mol ,有机物为C3H8
设有机物分子式为CxHyOz,
(1)通入盛有CaCl2的干燥管,吸收的是水蒸气,干燥管增重7.2g,说明水蒸气质量为7.2g,则水的物质的量为7.2/18=0.4mol,由于水中的氢全部来自有机物,所以0.1mol有机物中含氢0.4*2=0.8mol,可得y=8.
(2)通过灼热的CuO,发生的反应是CO+CuO=Cu+CO2,减轻的1.6g实际就是反应的CuO中氧元素质量,所以反应的CuO的量为1.6/16=0.1mol,即参与反应的CO的量也是0.1mol,同时产生0.1molCO2.
(3)与Na2O2反应的是CO2,反应式为2Na2O2+2CO2=Na2CO3+O2,产生的气体即氧气在标准状况下体积为3.36L,可得O2的量为3.36/22.4=0.15,则CO2的量为2*0.15=0.3mol,这里CO2包括两部分,一部分来自有机物燃烧生成,还有0.1mol由CO转化而来,所以有机物燃烧生成的CO2为0.3-0.1=0.2mol.碳原子来自有机物,所以有机物中碳原子个数为3(由0.3:0.1得),即x=3.
(4)由上,产物中氧原子(CO、CO2、H2O)数目为0.1+2*0.2+0.1=0.6,这些氧可能来自两部分,一是有机物本身,一是氧气,而所使用的氧气中的氧原子刚好为0.3*2=0.6,因为产物中含有CO,所以O2没有剩余,由此可知有机物中不含氧,即z=0,所以有机物分子式为C3H8.1年前查看全部
- 0.3mol铜和浓硝酸的反应中铜全部溶解生成0.1mol气体.(1)转移电子的物质的量
0.3mol铜和浓硝酸的反应中铜全部溶解生成0.1mol气体.(1)转移电子的物质的量
1)转移电子的物质的量?(2)消耗硝酸的物质的量?(3)被还原硝酸的物质的量? jasonfaye1年前1
jasonfaye1年前1 -
 夜雨推窗 共回答了17个问题
夜雨推窗 共回答了17个问题 |采纳率76.5%解析: Cu + HNO3 ---》 Cu(NO3)2 + NOx () + H2O
(1)转移电子的物质的量n(e-)= 2n(Cu)=2*0.3=0.6mol
(2)消耗硝酸的物质的量n(HNO3)=2n(Cu)+ n(NOx)=2*0.3+0.1=0.7mol
(3)被还原硝酸的物质的量n(HNO3)=n(NOx)=0.1mol
答:略1年前查看全部
- 温度为500℃时,反应4NH3+5O2⇌4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol
温度为500℃时,反应4NH3+5O2⇌4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率
(x)为( ).v
A.
(O2)=0.01mol/(L•s).v
B.
(NO)=0.08mol/(L•s).v
C.
(H2O)=0.003mol/(L•s).v
D.
(NH3)=0.02mol/(L•s).v  sisdalong1年前2
sisdalong1年前2 -
 千江明珠 共回答了21个问题
千江明珠 共回答了21个问题 |采纳率85.7%解题思路:根据v=[△c/△t]计算v(NO),在根据速率之比等于化学计量数之比计算用其它物质表示的反应速率.半分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=
0.3mol
5L
30s=0.002mol/(L•s).
A、根据速率之比等于化学计量数之比,所以v(O2)=[5/4]v(NO)=[5/4]×0.002mol/(L•s)=0.0025mol/(L•s),故A错误;
B、半分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=
0.3mol
5L
30s=0.002mol/(L•s),故B错误;
C、根据速率之比等于化学计量数之比,所以v(H2O)=1.5v(NO)=1.5×0.002mol/(L•s)=0.003mol/(L•s),故C正确;
D、根据速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(L•s),故D错误.
故选:C.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 考查化学反应速率,难度不大,注意反应速率计算常用两种方法定义法与化学计量数法,根据情况选择使用.1年前查看全部
- 现有A、B两种链状饱和一元醇的混合物0.3mol,其质量为13.8g.已知A和B的碳原子数均不大于4且A的碳原子数小
 xiaomao19801111年前1
xiaomao19801111年前1 -
 aqzwd2 共回答了17个问题
aqzwd2 共回答了17个问题 |采纳率88.2%一元醇的通式CmHnOH,A、B的平均摩尔质量为13.8g/0.3mol=46g/mol,去掉羟基剩余烃基部分的式量为46-17=29,29÷12=2……5,平均组成为C2H5OH,A和B的碳原子数均不大于4且A的碳原子数小的可能有:CH3OH、C3H7OH;CH3OH、C4H9OH两种.1年前查看全部
- 有CO2和CO的混合气体公10.8g,其物质的量为0.3mol.求⑴混合气体中CO2与CO的物质的量各位多少?⑵混合气体
有CO2和CO的混合气体公10.8g,其物质的量为0.3mol.求⑴混合气体中CO2与CO的物质的量各位多少?⑵混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是什么?其质量为多少?所含分子数为多少?
 偏爱飞1年前1
偏爱飞1年前1 -
 wairon 共回答了15个问题
wairon 共回答了15个问题 |采纳率93.3%【1】设CO2为Xmol 则CO为Ymol=(0.3-X)mol
44*X+(0.3-X) *28=10.8
16X+8.4=10.8
x=2.4/16
x=0.15mol 则Y=0.15mol
【2】剩余气体是CO 质量为0.15mol*28=4.2g
分子数0.15mol+22.4*10的多少次方.1年前查看全部
- 0.3mol硫酸氢有几个硫酸氢分子 含有几mol的原子
0.3mol硫酸氢有几个硫酸氢分子 含有几mol的原子
质量为多少g与多少g的二氧化碳含有的原子数一样?`````
像这类的摩尔关系的题目都还弄不清楚
请大家帮忙帮我讲讲怎么看 含有的原子分子多少这样的!
列举几个例子 Meclwood1年前1
Meclwood1年前1 -
 哦依呀哇 共回答了17个问题
哦依呀哇 共回答了17个问题 |采纳率82.4%摩尔是一个计量单位,你可以理解为和各十百千万一样的就行
1mol就代表了有6.02*10的23次方个个体
0.3mol硫酸氢有1.806*10的23次方个
一个HSO4有5个原子,所以有1.5mol原子1年前查看全部
- 下列气体压强最大的是?9. 常温常压下,密闭容器中充入下列气体压强最大的是( )A. 0.3molHCl和0.3molN
下列气体压强最大的是?
9. 常温常压下,密闭容器中充入下列气体压强最大的是( )
A. 0.3molHCl和0.3molNH3 B. 0.2molH2和0.1molO2
C. 0.2molNO和0.2molO2 D. 0.2molH2S和0.1molSO2
答案是B,为什么?C不也是0.3mol么? shueiyuandexin1年前1
shueiyuandexin1年前1 -
 泪真得绵绵不绝 共回答了17个问题
泪真得绵绵不绝 共回答了17个问题 |采纳率94.1%C 反应生成0.2molNO2,0.1molO2
但是2NO2=N2O4,可逆,所以.1年前查看全部
- 设NA为阿伏加德罗常数,下列对0.3mol/LK₂SO₄溶液的正确说法是(B)
设NA为阿伏加德罗常数,下列对0.3mol/LK₂SO₄溶液的正确说法是(B)
A.1L溶液中含有0.3NA个钾离子
B.1L溶液中含有钾离子和硫酸根离子的总数为0.9NA
C.2L溶液中钾离子的物质的量浓度为1.2mol/L
D.2L溶液中含有0.3NA个硫酸根离子 不喝太湖水1年前1
不喝太湖水1年前1 -
 laji288 共回答了14个问题
laji288 共回答了14个问题 |采纳率100%B
A.1L溶液中含有0.6NA个钾离子
B.1L溶液中含有钾离子和硫酸根离子的总数为0.9NA
C.2L溶液中钾离子的物质的量浓度为0.6mol/L
D.2L溶液中含有0.6NA个硫酸根离子1年前查看全部
- 某醇0.1mol与标准状况下10.08LO2恰好完全反应,生成0.4mol水和0.3molCO2,求此醇的化学式和名称.
 杨美容1年前1
杨美容1年前1 -
 戴维_李 共回答了14个问题
戴维_李 共回答了14个问题 |采纳率78.6%标准状况下10.08LO2即0.45molO2
因为0.1mol醇燃烧生成0.4mol水和0.3molCO2,所以该醇的分子中有3个碳原子,8个氢原子.
因为0.4mol水和0.3molCO2中含1mol氧元素,0.45molO2中含0.9mol氧元素,所以该醇分子中含1个氧原子.
所以该醇是C3H8O,是丙醇.1年前查看全部
- 1.将钠、镁、铝各0.3mol,分别放入100mL 1mol/L的盐酸中,同温同压下产生的气体的体积比是()
1.将钠、镁、铝各0.3mol,分别放入100mL 1mol/L的盐酸中,同温同压下产生的气体的体积比是()
A.1:2:3
B.6:3:2
C.3:1:1
D.1:1:1
2.钠、镁、铝三种金属单质的混合物跟足量的稀硫酸溶液充分反应后,得到标准状况下的氢气2.24L,则这三种金属的总物质的量可能是()
A.0.050mol
B.0.060mol
C.0.100mol
D.0.200mol 馒头的童年1年前5
馒头的童年1年前5 -
 紫魅jing 共回答了13个问题
紫魅jing 共回答了13个问题 |采纳率92.3%1 理论上 物质的量相同 产生的气体的体积比 就是化合价之比 1:2:3
但是 仅有盐酸0.1mol 不足 所以镁和铝产生的气体相同 都是0.05mol 钠可以与水反应 产生0.15mol
所以 同温同压下产生的气体的体积比 3:1:1 选 C
2 2.24LH2 需要得到电子 (2.24/22.4)×2 = 0.2mol
需要钠 0.2mol 需要镁 0.1mol 需要铝 0.067mol
所以 必须在0.067到0.2之间 C正确1年前查看全部
- 比例物质 10 g ( 0.3mol ).是什么意思是加入10克物质还是需要根据摩尔质量换算呢.
比例物质 10 g ( 0.3mol ).是什么意思是加入10克物质还是需要根据摩尔质量换算呢.
液体20 g ( 0.3mol )是加入20毫升的液体还是要根据摩尔质量换算啊. 外的但是1年前1
外的但是1年前1 -
 music游牧人 共回答了24个问题
music游牧人 共回答了24个问题 |采纳率83.3%感觉是加入20g液体吧.这个括号里的意思是你加入的20g液体自身所包含了物质0.3mol.我觉得是这么理解的.1年前查看全部
- 标准状况下,有O2和CO2组成的混合气体0.3mol,其质量为11.4克,则混合气体中氧气的质量分数为____
 jc51161年前4
jc51161年前4 -
 foxxylady 共回答了9个问题
foxxylady 共回答了9个问题 |采纳率77.8%42.1%
设氧气的物质的量为 x mol 二氧化碳的物质的量为 y mol
列方程组 x + y = 0.3
32x +44y= 11.4
解得 x = 0.15
y = 0.15
氧气的质量分数=(0.15*32)/ 11.4 * 100% = 42.1%
希望亲能再检查下 我的计算能力一直都很差1年前查看全部
- 将钠、镁、铝各0.3mol分别加入100mL 1mol/L 的盐酸中,在同温同压下产生的气体体积比是
将钠、镁、铝各0.3mol分别加入100mL 1mol/L 的盐酸中,在同温同压下产生的气体体积比是( )
A. 1:2:3
B. 6:3:2
C. 3:1:1
D. 1:1:1 晓lisa1年前1
晓lisa1年前1 -
 itjushou 共回答了14个问题
itjushou 共回答了14个问题 |采纳率92.9%解题思路:根据反应物的量先判断金属与酸哪种过量,按不足量计算.钠与酸反应完会继续与水反应;将三种金属各0.3mol分别投入100mL 1mol/L的盐酸中,可知三种金属都过量,
应按盐酸的量计算,镁、铝产生氢气物质的量相等,产生氢气的物质的量为:
(0.1L×1mol/L)×[1/2]═0.05 mol.
但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,
钠与水反应产生氢气应按钠的物质的量计算:0.3mol钠产生0.15mol氢气.
故将钠、镁、铝各0.3mol 分别放入100mL 1mol/L的盐酸中,产生氢气的物质的量之比为:
0.15mol:0.05mol:0.05mol═3:1:1,所以同温同压下产生的气体体积比是3:1:1.
故选C.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;化学方程式的有关计算.
考点点评: 本题考察金属与酸反应的计算.此类题应先判断谁过量,按不足量计算,同时注意一些活泼金属与酸反应完会继续与水反应.本题易错选D.1年前查看全部
- 3.612*10的23次方个HNO3与0.3molH2O中含有相同氢原子数,为什么?
 cxqmail1年前1
cxqmail1年前1 -
 ljjdts 共回答了18个问题
ljjdts 共回答了18个问题 |采纳率77.8%因为1mol = 6.02×10^23,0.3mol H2O里有0.6mol氢原子,0.6 × 6.02 × 10^23 = 3.612 × 10^231年前查看全部
- 2FeCl3+Cu=2FeCl2+CuCl2当有0.3mol电子发生转移时,发生反应的Cu的质量
 圆球1年前1
圆球1年前1 -
 魅歌 共回答了19个问题
魅歌 共回答了19个问题 |采纳率84.2%解析: 2FeCl3+Cu=2FeCl2+CuCl2-----2e-
64 2
m 0.3 m=9.6(g) 答:略1年前查看全部
- 急求!1升水中配制浓度为 0.3mol的硅酸钠溶液需要多少克硅酸钠?
 xuefuchun1年前2
xuefuchun1年前2 -
 大危危 共回答了19个问题
大危危 共回答了19个问题 |采纳率84.2%0.3mol乘上硅酸钠的分子量就行了.硅酸钠的分子量是122,则需要的硅酸钠克数是122X0.3=36.6克.1年前查看全部
- 化学:麻烦配平...Cu+HNO3----Cu(NO3)2+NO+H2O就是配平下谢谢啦若有0.3mol铜参加反应,可以
化学:麻烦配平...
Cu+HNO3----Cu(NO3)2+NO+H2O
就是配平下
谢谢啦
若有0.3mol铜参加反应,可以生成NO----L?
记得过程
谢谢 vszp1年前1
vszp1年前1 -
 海海的梦 共回答了17个问题
海海的梦 共回答了17个问题 |采纳率94.1%3Cu+8HNO3----3Cu(NO3)2+2NO+4H2O1年前查看全部
- 某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2
某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2SO2+O2
 2SO3反应.5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%.求
2SO3反应.5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%.求
(1)以SO3的浓度变化表示该反应的化学反应速率;
(2)该反应中SO2的平衡转化率. simonpig321年前3
simonpig321年前3 -
 也许当时生纪小 共回答了13个问题
也许当时生纪小 共回答了13个问题 |采纳率100%解题思路:设平衡时转化的氧气的物质的量为x,根据同温同体积时气体的压强之比等于物质的量之比,利用三段式法计算反应的氧气的物质的量,进而计算出反应的三氧化硫的物质的量,则可求出反应速率;根据反应方程式计算出反应的二氧化硫的物质的量,进而求出反应中SO2的平衡转化率.设平衡时转化的氧气的物质的量为x,利用三段式法计算.
2SO2+O2 2SO3
2SO3
初始 0.3mol0.2mol 0
变化 2xx 2x
平衡0.3mol-2x0.2mol-x 2x
同温同体积下
P1
P2=
n1
n2=
0.3mol−2x+0.2mol−x+2x
0.3mol+0.2mol=90%
解得x=0.05mol,
(1)平衡时n(SO3)=2×0.05mol=0.1mol,则v(SO3)=
2×0.05mol
2L×5min=0.01mol•L−1•min−1
答:以SO3的浓度变化表示该反应的化学反应速率为0.01mol/(L•min).
(2)平衡时反应的物质的量为2×0.05mol=0.1mol,则SO2的转化率为
2×0.05mol
0.03mol×100%=33.3%
答:该反应中SO2的平衡转化率为33.3%.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算,题目难度不大,本题注意根据阿伏伽德罗定律,利用三段式法计算.1年前查看全部
- 在——mol硫酸铝中含有0.3mol硫酸根离子,其中含有铝离子——个
 市井大人1年前3
市井大人1年前3 -
 rao_wei 共回答了21个问题
rao_wei 共回答了21个问题 |采纳率95.2%在0.1mol硫酸铝中含有0.3mol硫酸根离子,其中含有铝离子0.2NA个
0.1mol Al2(SO4)3含有硫酸根离子0.1*3=0.3mol
含有铝离子0.1*2=0.2mol 1mol含有NA个 那么0.2mol含有0.2NA个1年前查看全部
- 0.1mol氢气、0.2mol氧气、0.3mol氮气和0.4mol二氧化碳组成的混合气体在标准状况下的体积约为22.4L
0.1mol氢气、0.2mol氧气、0.3mol氮气和0.4mol二氧化碳组成的混合气体在标准状况下的体积约为22.4L.正确吗
请求回答... 爱笑的小狗狗1年前1
爱笑的小狗狗1年前1 -
 lilysatan 共回答了14个问题
lilysatan 共回答了14个问题 |采纳率78.6%对,1mol气体就是22.4L1年前查看全部
- 向1L 1mol/L的处于等电点的甘氨酸溶液加入0.3mol/L HCL,pH?如果加入0.3molNaOH,pH?
 酱猪手1年前2
酱猪手1年前2 -
 windend 共回答了17个问题
windend 共回答了17个问题 |采纳率76.5%等电点时,溶液成中性,如是HCL的H+的浓度就是0.3 你就按PH的定义去算就好了,NAOH 也一样1年前查看全部
- A、B两种物质当浓度恒定时,在不同温度下进行反应,A+3B=(逆反应)2C.10摄氏度时,反应速率v(B)=0.3mol
A、B两种物质当浓度恒定时,在不同温度下进行反应,A+3B=(逆反应)2C.10摄氏度时,反应速率v(B)=0.3mol/(L`s),50摄氏度时,V(A)=25.6mol/(L`s),若该反应每升高10摄氏度,反应速率增至n倍,则n值为()
A.4 B.3 C.3.5 D.2.5 jihaichao1年前2
jihaichao1年前2 -
 冷非桥 共回答了16个问题
冷非桥 共回答了16个问题 |采纳率81.3%答案为A
过程是这样的
首先计算出10摄氏度时V(A)=0.1mol/L.S
然后就有算式0.1乘以X的4次方等于25.6
那么X就等于41年前查看全部
- 将0.3mol NaCl固体与0.1mol CuSO4•5H2O固体混合溶于水,配成1升混合液.然后
将0.3mol NaCl固体与0.1mol CuSO4•5H2O固体混合溶于水,配成1升混合液.然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解).
求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?
所得溶液的pH为多少(假设溶液体积不变)? zjjkiller1年前1
zjjkiller1年前1 -
 爱似夏花 共回答了29个问题
爱似夏花 共回答了29个问题 |采纳率86.2%解题思路:(1)根据溶液中阴阳离子的放电顺序,判断每一阶段放电的离子,然后写出电解反应的离子方程式;
(2)先确定最后阶段放电的离子,再写出阴极上发生的电极反应式;
(3)先根据题意判断当阴极有气体产生时发生的电解反应,然后计算铜全部析出时剩余的氯离子的物质的量,根据氯离子的物质的量计算阴极上生成气体的体积.根据题意知,取出的溶液中含有的溶质的物质的量分别为:NaCl 0.06mol,CuSO4 0.02mol;溶液中阴阳离子的放电顺序分别为:阳离子放电顺序Cu2+>H+>Na+,阴离子放电顺序为Cl->OH->SO42-,所以,该溶液电解三个阶段分别为:
第一阶段:Cu2+和Cl-放电,生成氯气和铜.阴极电极反应Cu2++2e-=Cu,阳极电极反应2Cl--2e-=Cl2↑;
根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
第二阶段:H+ 和Cl-放电,生成氢气和氯气;
根据得失电子相等知,氯离子完全电解,发生第三阶段反应,
第三阶段:H+ 和OH-放电,生成氢气和氧气.
根据以上分析知,第一阶段的电解反应为Cu2++2Cl-
通电
.
Cu+Cl2
电解的最后阶段,H+ 在阴极上放电,OH-的阳极上放电,分别生成氢气和氧气.
第一阶段根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
当阴极上有气体生成时,发生的电解反应为:
2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-
2 22.4L 2
0.02mol 0.224L 0.02mol
阴极上生成氢气0.224L;生成氢氧根离子浓度=[0.02mol/0.2L]=0.1mol/L
溶液pH=13.
答:Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是 0.224L;所得溶液的pH为13.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的分析判断,解题时注意以下几点:混合溶液中离子的放电顺序.发生电解反应的三个阶段.只有明确知道这些问题才能正确解答本题,题目难度较大.1年前查看全部
- 惰性电极,电解串联电路中甲乙俩个烧杯中的200ml 0.3mol每升的氯化钠溶液和300ml 0.2mol每升的硝酸银溶
惰性电极,电解串联电路中甲乙俩个烧杯中的200ml 0.3mol每升的氯化钠溶液和300ml 0.2mol每升的硝酸银溶液,产生0.56升氯气时停止电解(标况),将俩杯溶液混合,求混合后氢离子的浓度.混合后体积为500ml
 梅冷1年前6
梅冷1年前6 -
 达观淡然 共回答了13个问题
达观淡然 共回答了13个问题 |采纳率100%2Cl- - 2e- = Cl2
2mol 2mol 22.4L
X X 0.56L X=0.05mol
Ag+ + e- = Ag
1mol 1mol
y 0.05mol y=0.05mol
所以剩余Cl-和Ag+都是0.06-0.05=0.01mol,将两杯溶液混合,恰好得到硝酸钠溶液,其中氢离子的浓度=1×10^-7mol/L1年前查看全部
- 难住了.有二氧化碳与一氧化碳的混合气体共10.8g 其物质的量为0.3mol求:1.混合气体中二氧化碳与一氧化碳的物质的
难住了.
有二氧化碳与一氧化碳的混合气体共10.8g 其物质的量为0.3mol求:
1.混合气体中二氧化碳与一氧化碳的物质的量为多少?
2.混合气体缓慢通过足量氢氧化钠溶液侯后,剩余的气体是什么?其质量为多少?所含分子数为多少?
希望能解的详细一点. tidetimewt1年前2
tidetimewt1年前2 -
 爱米粒儿22 共回答了17个问题
爱米粒儿22 共回答了17个问题 |采纳率70.6%有二氧化碳与一氧化碳的混合气,设他们物质的量分别为n1、n2
则
n1+n2=0.3
44n1+28n2=10.8
则n1=?n2=?
混合气体中二氧化碳与一氧化碳的物质的量分别为n1、n2
CO2被吸收,剩余的气体是CO
其质量为28n2
所含分子数n2NA1年前查看全部
大家在问
- 1哪些名言警句可以用在海伦•凯勒的身上
- 2少阴老阴老阴老阴少阳老阳是什么意思?
- 3怎么证明某角是两个面的二面角?数学20题第二小问遇到困难,本人不会空间直角坐标系只能硬找,
- 4已知a是根号5的整数部分,b是-根号10的整数部分,c是根号2的整数部分,求(根号5)/a-(根号10)/b+(根号2)
- 5请解析下面一句话If you promote our goods, we will give you a good di
- 6麻烦老师解答:常温下,有甲、乙两份
- 7You must go to the bus( )first 括号中怎么填
- 8关于液体压强的两道物理题..急.///
- 9当X是多少时分式2X-3/3x的平方的值大于零?
- 10请问有没有描写母亲思念远方孩子的古代诗词
- 11若集合M={y|y=2的X次方}P={y|根号下(X-1)求M与P的交集
- 12在唐人街每个春节都放烟花吗?翻译
- 13作者是如何塑造人物形象的?这种题答题步骤是什么?必采纳
- 14已知双曲线的中心在原点,焦点在坐标轴上,设双曲线的一个焦点为F,虚轴的一个端点为B,如果/直线FB与该双`曲线的一条渐近
- 15用100字左右概括《草船借箭》的故事,用上“妒忌、推却、自有妙用、大雾漫天、神机妙算”等词语。
