溶质质量分数为10%的氢氧化钠溶液100克的ph值
 南生5202022-10-04 11:39:541条回答
南生5202022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 守候我们的童话 共回答了16个问题
守候我们的童话 共回答了16个问题 |采纳率87.5%- 大约是14.3
- 1年前
相关推荐
- 100克溶质质量分数为60%的氢氧化钠与100克稀盐酸恰好充分反应
100克溶质质量分数为60%的氢氧化钠与100克稀盐酸恰好充分反应
求:1.稀盐酸中溶质的质量分数
2 反应后所得溶液中溶质的质量分数 孙庄不肖生1年前1
孙庄不肖生1年前1 -
 Pink-landy 共回答了21个问题
Pink-landy 共回答了21个问题 |采纳率76.2%100克溶质质量分数为60%的氢氧化钠中含有的NaOH的质量为60g
根据化学方程式:NaOH+HCl===NaCl+H2O
40 36.5 58.5
60 x y
根据质量守恒定律:40/60=36.5/x 解得x=54.75
54.75/100×100%=54.75%
即稀盐酸的质量分数为54.75%
同理 40/60=58.5/y 解得 y=87.75
87.75/200×100%=43.875%
反应后所得溶液中溶质的质量分数43.875%1年前查看全部
- 在一烧杯中盛有100g含CaCl2和HCl两种溶质的溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,生成沉淀
在一烧杯中盛有100g含CaCl2和HCl两种溶质的溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,生成沉淀的总质量与所滴入Na2CO3溶液的质量关系曲线如图所示,根据题意回答问题:
试通过计算求出原烧杯中CaCl2的质量分数.
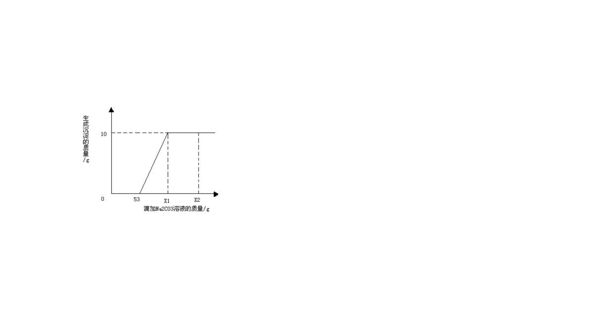
 mazhou9451年前1
mazhou9451年前1 -
 lihuabing 共回答了18个问题
lihuabing 共回答了18个问题 |采纳率88.9%先根据方程式计算出生成CO2和NaCI的质量,然后根据方程式求出CaCO3和NaCI的质量.NaCI的质量除以100+Na2CO3的质量-CO2和CaCO3的质量
你那图看不清数值.没法给你写过程1年前查看全部
- naoh nacl so3 cao各10克放入90克水中反应后溶质质量分数最大的是那个
 大眼睛果奶1年前1
大眼睛果奶1年前1 -
 treefield81 共回答了24个问题
treefield81 共回答了24个问题 |采纳率83.3%首先.cao肯定最小 因为氢氧化钙饱和的溶解度也小得可怜
应该是三氧化硫最大
因为它会跟水反应生成硫酸 溶剂少了 所以质量分数就会变大1年前查看全部
- 计算题(第三题需要过程)在一烧杯中盛有100g的FeCl3和HCl的混合溶液,向其中逐渐滴加溶质质量分数为12%的NaO
计算题(第三题需要过程)
在一烧杯中盛有100g的FeCl3和HCl的混合溶液,向其中逐渐滴加溶质质量分数为12%的NaOH溶液,沉淀的质量与所滴入NaOH溶液的质量关系如图所示.请根据题意回答下列问题:
(1)在实验过程中产生沉淀的质量是________;
(2)在实验过程中加入65g的NaOH溶液时所得溶液的pH是_______7(选填大于、小于或等于)
(3)计算原混合溶液中HCl的质量分数.(计算结果精确至0.01%)

 balanacong1年前1
balanacong1年前1 -
 思智 共回答了16个问题
思智 共回答了16个问题 |采纳率87.5%(1)在实验过程中产生沉淀的质量是__4.28g__;
(2)在实验过程中加入65g的NaOH溶液时所得溶液的pH是__大于_7(选填大于、小于或等于)
(3)计算原混合溶液中HCl的质量分数.(计算结果精确至0.01%)
与HCl反应的氢氧化钠溶液的质量为20g(如图)
原混合溶液中HCl的质量 x
HCl + NaOH===NaCl+H2O
36.5 40
y 20g*12%
36.5/Y=40/2.4g
y=2.19g
原混合溶液中HCl的质量分数2.19g/100g*100%=2.19%1年前查看全部
- (2006•北京)配制一定溶质质量分数的氯化钠溶液,操作顺序正确的是( )
(2006•北京)配制一定溶质质量分数的氯化钠溶液,操作顺序正确的是( )
A.计算、溶解、称量、量取
B.溶解、量取、计算、称量
C.计算、称量、量取、溶解
D.称量、量取、溶解、计算 月独酌1年前1
月独酌1年前1 -
 tony1661 共回答了14个问题
tony1661 共回答了14个问题 |采纳率85.7%解题思路:根据配制溶质质量分数一定的溶液的基本步骤考虑;配制溶质质量分数一定的溶液的基本步骤:计算(算出需要溶质质量和溶剂体积)、用天平称量溶质放到烧杯中、用量筒量取液体倒入烧杯中、用玻璃棒搅拌进行溶解、装瓶存放.
故选C.点评:
本题考点: 一定溶质质量分数的溶液的配制;实验步骤的探究.
考点点评: 要真正理解配制溶液的过程,能够自己去配制需要的溶液.1年前查看全部
- 向含CuCl2和HCl的100g混合溶液中,逐滴加溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉
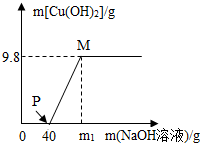 向含CuCl2和HCl的100g混合溶液中,逐滴加溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图.据图回答:
向含CuCl2和HCl的100g混合溶液中,逐滴加溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图.据图回答:
(1)在滴加NaOH溶液过程中,原溶液中______离子个数不变.(填离子符号)
(2)P点(此后开始有沉淀出现)溶液中的溶质是______.
(3)M点溶液中的溶质质量分数是多少? cdefgg1年前1
cdefgg1年前1 -
 糟老头子2 共回答了26个问题
糟老头子2 共回答了26个问题 |采纳率88.5%解题思路:(1)根据复分解反应的实质生成沉淀 气体或水时离子数目减少,没参与反应的离子数目不变分析;
(2)根据整个反应过程的生成物及反应物来判断;
(3)M点溶液中的溶质是氯化钠,氯化钠有两部分,一是盐酸与氢氧化钠生成的,另一部分是氯化铜和氢氧化钠反应生成的;溶液质量可用质量守恒法来求,加入的混合溶液的总质量+氢氧化钠溶液的质量-生成的氢氧化铜沉淀的质量.从而求出溶液中溶质质量分数.(1)CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,由化学方程式可以看出,在此整个过程中,氯离子不变,其符号为:Cl-.
(2)P点表示氯化氢和氢氧化钠恰好完全反应,此时氯化铜还没和氢氧化钠反应,故溶液中的溶质为NaCl CuCl2;
(3)设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为x,生成氯化钠的质量为z
CuCl2+2NaOH═Cu(OH)2↓+2NaCl,
8098 117
x•10% 9.8g z
[80/x•10%=
98
9.8g=
117
z]
x=80gz=11.7g
氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以m1=40g+80g=120g
设氯化氢与氢氧化钠反应生成氯化钠的质量为y
NaOH+HCl═NaCl+H2O
40 58.5
40×10%=4g y
[40/4g=
58.5g
y]
解得:y=5.85g
M点溶液中的溶质氯化钠的质量为11.7g+5.85g=17.55g
M点溶液的溶质质量分数=[17.55g/100g+120g−9.8g]×100%=8.35%
答:M点溶液的溶质质量分数为8.34%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题考查化学方程式与溶液的综合计算,解题关键是分析清楚反应过程的先后,找出每个过程中已知物质的质量.1年前查看全部
- 将4.6g钠投入95.6g水中所得溶液中溶质质量分数?
 香蕉绿茶1年前1
香蕉绿茶1年前1 -
 renning008 共回答了17个问题
renning008 共回答了17个问题 |采纳率70.6%百分之4.61年前查看全部
- 无土栽培是一种在营养液中培育植物的农业高新技术.某课外实验小组要配制100 g溶质质量分数为2.4%的硝酸钾溶
无土栽培是一种在营养液中培育植物的农业高新技术.某课外实验小组要配制100 g溶质质量分数为2.4%的硝酸钾溶液用于配制营养液.
(1)需硝酸钾______g,需水______mL(水的密度是1.0 g•cm -3 ).
(2)若在量取水时仰视凹液面最低处,其它操作正确,则所得溶液的溶质质量分数为______2.4%(填“>”或“<”或“=”).
(3)配制该营养液,需用到的玻璃仪器有______、______、______. 紫焰流芒1年前1
紫焰流芒1年前1 -
 微笑江流 共回答了16个问题
微笑江流 共回答了16个问题 |采纳率93.8%(1)配制100 g溶质质量分数为2.4%的硝酸钾溶液需硝酸钾的质量=100g×2.4%=2.4g;需要水的质量=100g-2.4g=97.6g(合97.6mL);
故答案为:2.4;97.6;
(2)仰视,所取液体体积会大于97.6mL,溶剂量偏大而使所得溶液的溶质质量分数小于2.4%;
故答案为:<;
(3)量取溶剂时需要玻璃仪器为100mL的量筒,溶解时需要的玻璃仪器为烧杯和玻璃棒;
故答案为:烧杯;玻璃棒;100mL量筒(无单位不得分).1年前查看全部
- 制作“叶脉书签”需要lOOg溶质质量分数为10%的氢氧化钠溶液.请问:
制作“叶脉书签”需要lOOg溶质质量分数为10%的氢氧化钠溶液.请问:
(1)配制时需要氢氧化钠固体的质量和水的质量分别是多少?
(2)若用20%的氢氧化钠溶液配制lOOg溶质质量分数为10%的氢氧化钠溶液,需要20%的氢氧化钠溶液质量是多少? 2ii21年前1
2ii21年前1 -
 zhou1979_99 共回答了14个问题
zhou1979_99 共回答了14个问题 |采纳率100%解题思路:(1)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量.
(2)根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.(1)溶质质量=溶液质量×溶质的质量分数,配制lOOg溶质质量分数为10%的氢氧化钠溶液,需氢氧化钠的质量=100g×10%=10g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-10g=90g.
(2)设需要20%的氢氧化钠溶液质量为x,根据溶液稀释前后,溶质的质量不变,
则100g×10%=x×20% x=50g.
答:(1)配制时需要氢氧化钠固体的质量和水的质量分别是10g、90g;(2)需要20%的氢氧化钠溶液质量是50g.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题难度不大,掌握溶质质量分数的有关解释、溶液稀释前后溶质的质量不变是正确解答此类题的关键所在.1年前查看全部
- 在80g质量分数为15%硝酸钠溶液里加入20g水或再溶解20g硝酸钠,则两种溶液中溶质质量分数分别为______和___
在80g质量分数为15%硝酸钠溶液里加入20g水或再溶解20g硝酸钠,则两种溶液中溶质质量分数分别为______和______.
 sun_lei_96041年前1
sun_lei_96041年前1 -
 今晚你约谁 共回答了19个问题
今晚你约谁 共回答了19个问题 |采纳率89.5%解题思路:根据溶质的质量分数=[溶质的质量/溶液的质量]×100%进行解答.在80g质量分数为15%硝酸钠溶液里加入20g水后溶质的质量分数是:[80g×15%/80g+20g]×100%=12%;
在80g质量分数为15%硝酸钠溶液里再溶解20g硝酸钠后溶质的质量分数是:[80g×15%+20g/80g+20g]×100%=32%;
故答案为:12%;32%.点评:
本题考点: 一定溶质质量分数的溶液的配制;有关溶质质量分数的简单计算.
考点点评: 了解溶质质量分数的计算方法,并能根据题意灵活分析解答即可.1年前查看全部
- 化学反应中溶质质量分数的计算的步骤与格式是什么
 qiaoaishu1年前1
qiaoaishu1年前1 -
 ydp2004 共回答了14个问题
ydp2004 共回答了14个问题 |采纳率78.6%1先算溶质质量
2后算溶剂/溶液质量
3求解
过程: 先摆公式 W=m溶质/m溶质+溶剂 ×100% 再带入m值 直接求得即可1年前查看全部
- (2008•哈尔滨)某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢溶液,为测定瓶内
 (2008•哈尔滨)某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g.请根据要求回答下列问题:
(2008•哈尔滨)某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g.请根据要求回答下列问题:
(1)加入二氧化锰后发生反应的化学方程式为2H202
2H20+02↑MnO2 .2H202;
2H20+02↑MnO2 .
(2)生成氧气的质量是______;
(3)根据氧气的质量列出求解过氧化氢质量(x)的比例式为[68/32=
=X 3.2g] [68/32X 3.2g];
(4)瓶内过氧化氢溶液中溶质的质量分数是______;
(5)若取一定量的瓶内溶液配制成溶质质量分数为3%的过氧化氢溶液100g,需加入水的质量是______.赞
ji28941 幼苗
共回答了18个问题采纳率:94.4% 举报
解题思路:(1)过氧化氢在常温可以发生分解反应生成氧气和水(缓慢分解),在加热或者加入催化剂后能加快反应,通常使用的催化剂为二氧化锰.据此写出化学方程式即可;
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.故生成氧气的质量=反应前各物质的质量总和-反应后生成各物质的质量总和;
(3)根据过氧化氢分解的化学方程式和生成氧气的质量,列出比例式,就可得出求解过氧化氢质量(x)的比例式;
(4)根据溶质质量分数=[溶质质量/溶液质量]×100%计算即可;
(5)根据溶质一定,列出方程式,就可计算出需瓶内溶液的质量,然后100g-需瓶内溶液的质量就是需加入水的质量.(1)加入二氧化锰后发生反应的化学方程式为:2H202 MnO2 . 2H20+02↑;(2)生成氧气的质量为:34g+3g-33.8g=3.2g;(3)设参与反应的过氧化氢的质量为x,2H202 MnO2 . 2H20+02↑68-...
点评:
本题考点: 根据化学反应方程式的计算;实验室制取氧气的反应原理;有关溶质质量分数的简单计算;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生运用化学方程式和溶质质量分数和质量守恒定律综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前
1可能相似的问题-
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.019 s. - webmaster@yulucn.com nanayi1年前1
nanayi1年前1 -
 ji28941 共回答了18个问题
ji28941 共回答了18个问题 |采纳率94.4%解题思路:(1)过氧化氢在常温可以发生分解反应生成氧气和水(缓慢分解),在加热或者加入催化剂后能加快反应,通常使用的催化剂为二氧化锰.据此写出化学方程式即可;
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.故生成氧气的质量=反应前各物质的质量总和-反应后生成各物质的质量总和;
(3)根据过氧化氢分解的化学方程式和生成氧气的质量,列出比例式,就可得出求解过氧化氢质量(x)的比例式;
(4)根据溶质质量分数=[溶质质量/溶液质量]×100%计算即可;
(5)根据溶质一定,列出方程式,就可计算出需瓶内溶液的质量,然后100g-需瓶内溶液的质量就是需加入水的质量.(1)加入二氧化锰后发生反应的化学方程式为:2H202 MnO2 . 2H20+02↑;(2)生成氧气的质量为:34g+3g-33.8g=3.2g;(3)设参与反应的过氧化氢的质量为x,2H202 MnO2 . 2H20+02↑68-...
点评:
本题考点: 根据化学反应方程式的计算;实验室制取氧气的反应原理;有关溶质质量分数的简单计算;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生运用化学方程式和溶质质量分数和质量守恒定律综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- (2012•佛山)在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是( )
(2012•佛山)在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是( )
A.
氯化钠的取用
B.
氯化钠的称量
C.
水的取用
D.
氯化钠的溶解 kikiloveyy1年前1
kikiloveyy1年前1 -
 wql0703123 共回答了23个问题
wql0703123 共回答了23个问题 |采纳率95.7%解题思路:A、根据固体药品的取用方法分析,取固体粉末时用药匙.
B、根据托盘天平的使用要遵循“左物右码”的原则进行分析判断.
C、根据量筒读数时视线要与凹液面的最低处保持水平进行分析判断.
D、溶解时用玻璃棒不断搅拌可以加速溶解.A、取用氯化钠时,瓶塞应倒放,用药匙取药品,图中实验操作正确.
B、托盘天平的使用要遵循“左物右码”的原则,图中实验操作正确.
C、量取水时,量筒读数时视线要与量筒内液体的凹液面的最低处保持水平,图中所示操作错误.
D、溶解氯化钠时,为了加速其溶解,可以用玻璃棒搅拌,图中实验操作正确.
故选C.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 本题难度不大,以配制一定溶质质量分数的氯化钠溶液的实验为情景素材,考查了化学实验基本操作,掌握常见化学实验基本操作的注意事项即可正确解答本题.1年前查看全部
- 下列说法中正确的是( )A.15℃时,KNO3的溶解度是25g,15℃时饱和溶液的溶质质量分数为20%B.24%的Na
下列说法中正确的是( )
A.15℃时,KNO3的溶解度是25g,15℃时饱和溶液的溶质质量分数为20%
B.24%的NaOH溶液取出一半其溶质质量分数为12%
C.把5mL98%硫酸倒入20mL的水中就得到稀硫酸25mL
D.饱和溶液升高温度一定变成不饱和溶液 cxd_000001年前1
cxd_000001年前1 -
 烟雨泡泡 共回答了25个问题
烟雨泡泡 共回答了25个问题 |采纳率96%解题思路:A、根据饱和溶液中溶质质量分数=
×100%,进行分析判断.溶解度 溶解度+100g
B、根据溶液具有均一性进行分析判断.
C、溶液分子间有间隔进行分析判断.
D、饱和溶液升高温度不一定变成不饱和溶液.A、15℃时,KNO3的溶解度是25g,15℃时饱和溶液的溶质质量分数为
25g
25g+100g×100%=20%,故选项说法正确.
B、溶液具有均一性,24%的NaOH溶液取出一半,其溶质质量分数仍为24%,故选项说法错误.
C、分子之间有间隔,把5mL98%硫酸倒入20mL的水中得到的稀硫酸小于25mL,故选项说法错误.
D、饱和溶液升高温度不一定变成不饱和溶液,如氢氧化钙的饱和溶液,升高温度后溶解度减小,溶液仍为饱和溶液,故选项说法错误.
故选:A.点评:
本题考点: 溶质的质量分数、溶解性和溶解度的关系;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数.
考点点评: 本题难度不大,掌握饱和溶液溶质质量分数与溶解度的关系、分子的基本性质、饱和溶液与不饱和溶液的转化等是正确解答本题的关键.1年前查看全部
- 如果等质量的不同的金属和足量的等溶质质量分数的同种稀酸溶液反应时,而且这些金属元素在化合物中的化合价相同,则金属的相对原
如果等质量的不同的金属和足量的等溶质质量分数的同种稀酸溶液反应时,而且这些金属元素在化合物中的化合价相同,则金属的相对原子质量越大得到的氢气就越少
 雄二1年前1
雄二1年前1 -
 moses 共回答了17个问题
moses 共回答了17个问题 |采纳率94.1%在金属能和稀酸溶液反应的前提下这个结论是正确的,但是有些金属单质是不和稀酸溶液反应的1年前查看全部
- (2008•怀柔区一模)配制一定溶质质量分数的溶液,肯定用到的仪器是( )
(2008•怀柔区一模)配制一定溶质质量分数的溶液,肯定用到的仪器是( )
A.试管
B.量筒
C.酒精灯
D.托盘天平 zhaojunwei10181年前1
zhaojunwei10181年前1 -
 相逢宝刀 共回答了27个问题
相逢宝刀 共回答了27个问题 |采纳率88.9%解题思路:配制一定质量分数的溶液的步骤是计算、称量、溶解,称量时用到的仪器有:天平、药匙、量筒;溶解时用到的仪器有:烧杯、玻璃棒.如果是固体肯定用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒.如果是溶液和溶液之间的配置,就不用天平、药匙.A、肯定用到的仪器有:量筒、烧杯、玻璃棒,不用试管,故选项错误;
B、肯定用到的仪器有:量筒、烧杯、玻璃棒,故选项正确;
C、肯定用到的仪器有:量筒、烧杯、玻璃棒,不用酒精灯,故选项错误;
D、如果是溶液和溶液之间的配置,就不用天平、药匙,故选项错误;
故选B点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 本考点考查了配制一定质量分数的溶液的步骤,主要考查了需要用到的仪器,要注意是固体配置,还是溶液的稀释,同学们要加强记忆,理解应用.本考点主要出现在选择题和填空题中.1年前查看全部
- 现有铁和另一种金属组成的混合物,在5.6g该混合物中加入100g一定溶质质量分数的稀盐酸,两者恰好完全反应,产生氢气的质
现有铁和另一种金属组成的混合物,在5.6g该混合物中加入100g一定溶质质量分数的稀盐酸,两者恰好完全反应,产生氢气的质量为m.下列说法正确的是( )
A. 若混合物为Fe、Mg,m可能是0.2g
B. 若混合物为Fe、Zn,m大于0.2g
C. 若混合物为Fe、Zn,m可能是0.1g,则该混合物中铁的质量分数为50%
D. 若混合物为Fe、Mg,则稀盐酸中溶质质量分数一定大于7.3% 果色甜香是梦乡1年前1
果色甜香是梦乡1年前1 -
 拿来送往 共回答了22个问题
拿来送往 共回答了22个问题 |采纳率72.7%解题思路:镁的相对原子质量比铁、锌都小,所以相同质量的镁与盐酸完全反应时,产生的氢气质量多.假设合金中铁的质量为5.6 g,根据化学反应方程式:Fe+2HCl=FeCl2+H2↑可计算出此时产生氢气的质量为0.2 g,同理可计算出5.6 g镁与足量盐酸反应产生氢气的质量大于0.2 g,5.6gZn与足量盐酸反应产生氢气的质量小于0.2 g,
A、若混合物为Fe、Mg,m一定大于0.2g,故错误;
B、若混合物为Fe、Zn,m一定小于0.2g,故错误;
C、若混合物为Fe、Zn,m一定小于0.2g,混合物中铁的质量分数为50%,则m一定大于0.1g,故错误;
D、当粉末为Fe、Mg合金时,因相同质量的镁消耗稀盐酸的质量比铁消耗盐酸的质量大,而5.6 g铁时,消耗盐酸的质量为7.3 g,所以合金为为Fe-Mg合金时,所需盐酸溶质质量分数一定大于7.3%,故正确;
故选D.点评:
本题考点: 金属的化学性质;根据化学反应方程式的计算.
考点点评: 相同质量的金属与酸反应产生氢气的质量的多少与金属的相对原子质量有关,若相对原子质量越大,产生的氢气质量越小,据此分析解答.1年前查看全部
- 6.5g锌与一定量的7.3%稀盐酸恰好完全反应,求盐酸的溶质质量及反应后氯化锌溶液的溶质质量分数.
 squallcpp1年前1
squallcpp1年前1 -
 松尾 共回答了18个问题
松尾 共回答了18个问题 |采纳率94.4%设盐酸的溶质质量为x,生成ZnCl2的质量为y,生成H2的质量为z.
Zn+2HCl=ZnCl2+H2↑
65 73 136 2
6.5g x y z
65/6.5=73/x=136/y=2/z
x=7.3g
y=13.6g
z=0.2g
盐酸的质量是7.3/7.3%=100g
反应后溶液质量是6.5+100-0.2=106.3g
氯化锌溶液的溶质质量分数是13.6/106.3*100%=12.8%
答:盐酸的溶质质量是7.3g,反应后氯化锌溶液的溶质质量分数是12.8%1年前查看全部
- 如果把100g溶质质量分数为15%的A溶液与100g溶质质量分数为5%的B溶液混合,那么A溶液的溶质质量分数为?
如果把100g溶质质量分数为15%的A溶液与100g溶质质量分数为5%的B溶液混合,那么A溶液的溶质质量分数为?
1.A与B反应时---说一下思路吧~
2.A与B不反应时 wshaoying1年前1
wshaoying1年前1 -
 mona928 共回答了17个问题
mona928 共回答了17个问题 |采纳率88.2%如果A和B反应,则,先计算反应了多少,还剩多少,用余下的A的总质量除以溶液总质量.这里要注意反应后是否有气体、沉淀,如果产生气体或沉淀则计算溶液质量时要减去气体或沉淀的量才是最后溶液的质量.
如果A和B不反应,则A的质量分数为100*15%/(100+100)*100%=7.5%1年前查看全部
- 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相等、溶质质量分数的稀盐酸,再向两烧杯中分别投入质量
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相等、溶质质量分数的稀盐酸,再向两烧杯中分别投入质量相等的锌粒和镁条,待反应停止后,天平指针的可能指向是:①刻度盘上偏向放锌粒的一方;②刻度盘的中央;③刻度盘上偏向镁条的一方.
◆答案是选①和②,我选出了①,但②我不太确定.所以想问②的情况是锌粒和镁条都过量吗? 大漠狂想1年前1
大漠狂想1年前1 -
 詠遠Dê箛獨 共回答了37个问题
詠遠Dê箛獨 共回答了37个问题 |采纳率94.6%天平上减少的质量就是反应产生氢气的质量
Zn ---- H2
65 2
X 2X/65
Mg ---- H2
24 2
X X/12
相同质量的锌和镁,镁产生的氢气多一些,所以放锌粒的烧杯要重一些.刻度盘上偏向放锌粒的一方.
如果要发生第二种情况,也不一定二者都过量,只要二者产生的氢气量相同就行.1年前查看全部
- 足量的铁粉与50g稀硫酸反应生成0.2g氢气,则所用稀硫酸的溶质质量分数是多少?
 verglas_yiyi1年前1
verglas_yiyi1年前1 -
 karenkam 共回答了26个问题
karenkam 共回答了26个问题 |采纳率84.6%Fe + H2SO4 === FeSO4 + H2↑
98 2
x 0.2g
98/x=2/0.2g
x=9.8g
9.8g/50g*100%=19.6%1年前查看全部
- 问一道初中化学试题某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢(图见下),为测定
问一道初中化学试题
某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢(图见下),为测定瓶内溶液中溶质的质量分数,取该溶液34克于烧杯中,加入一定量的二氧化锰.完全反应后,称得烧杯内剩余物质的总质量是33.8克,将杯内剩余物质过滤、洗涤、干燥后得滤渣3克.请回答下列问题:
(图内容:体积,500毫升.溶质化学式,H2O2.密度,1.2克/立方厘米.溶质质量分数,已破损.)
1.加入二氧化锰后发生反应的化学方程式为:______.
2.生成氧气的质量是______.
3.根据氧气的质量列出求解过氧化氢质量(X)的比例式为______.
4.瓶内过氧化氢溶液中溶质的质量分数是______.
5.若取一定量的瓶内溶液配制成溶质质量分数为3%的过氧化氢溶液100克,需加入水的质量是______.
我想要的是每个答案的具体计算过程.我实在不会做吖.谢谢.
 znkl5211年前1
znkl5211年前1 -
 xycaocao 共回答了16个问题
xycaocao 共回答了16个问题 |采纳率87.5%1.二氧化锰仅仅作为催化剂催化过氧化氢的分解,本身并不参加反应,所以加入二氧化锰以后的反应是过氧化氢的分解反应,即2H2O2=2H2O+O2↑
2.生成氧气的质量是_3.2g__.(34g+3g-33.8g=3.2g)
3.根据方程式2H2O2=2H2O+O2↑可知
2*34 32
x 3.2
=>x=3.2*2*34/32=6.8g
4.瓶内过氧化氢溶液中溶质的质量分数是_20%__.(100%*6.8g/34g=20%)
5.欲配置质量分数为3%的过氧化氢100g需要过氧化氢的质量为3g
瓶内过氧化氢的质量分数为20%,假设需要瓶内的过氧化氢为xg,则0.2x=3=>x=15g
即需要瓶内过氧化氢15g,需要水的质量为100-15=85g1年前查看全部
- (2007•大兴安岭)小娇同学准备配制50g溶质质量分数为16%的氯化钠溶液,应先用天平称量______g氯化钠放在烧杯
(2007•大兴安岭)小娇同学准备配制50g溶质质量分数为16%的氯化钠溶液,应先用天平称量______g氯化钠放在烧杯中,再用规格为______量筒(从1OOmL、5OmL、2OmL申选择)量取______mL水(水的密度为lg/mL),倒入烧杯中搅拌,即可得到所需溶液.
 kuangruipei1年前1
kuangruipei1年前1 -
 361man 共回答了21个问题
361man 共回答了21个问题 |采纳率85.7%解题思路:配制50g溶质质量分数为16%的氯化钠溶液,首先需要计算配制溶液所需的氯化钠和水的量;在量取水时,应选择稍大于所要量取水体积的量筒一次性量取.配制50g溶质质量分数为16%的氯化钠溶液,需要氯化钠的质量=50g×16%=8g;
需要水的质量=50g-8g=42g,合42mL;
量取42mL水应选取稍大于该体积的50mL量筒;
故答:8,50mL,42.点评:
本题考点: 一定溶质质量分数的溶液的配制;有关溶质质量分数的简单计算.
考点点评: 选用量筒时,根据所需液体体积,选取量程稍大于所需液体体积的量筒,一次量取所需液体,减少实验误差.1年前查看全部
- 一定质量的稀盐酸和100g溶质质量分数为80%的氢氧化钠溶液恰好完全反应,所得溶液的溶质质量分数为5.85%,求稀盐酸的
一定质量的稀盐酸和100g溶质质量分数为80%的氢氧化钠溶液恰好完全反应,所得溶液的溶质质量分数为5.85%,求稀盐酸的溶质质量分数.
 aan_10001年前1
aan_10001年前1 -
 雪50328456 共回答了17个问题
雪50328456 共回答了17个问题 |采纳率100%HCl + NaOH == NaCl + H2O
36.5 40 58.5
x 80 5.85%y
36.5:40=x:80 x=71
40:58.5=80:5.85%y y=200
则所加HCl(稀)质量为: 200-100=100
质量分数:71/100*100%=71%1年前查看全部
- 生理盐水是溶质质量分 生理盐水是溶质质量分数约为0.9%的氯化钠溶液,现有100g生理盐水给某病人输液,进入病人体内的氯
生理盐水是溶质质量分
生理盐水是溶质质量分数约为0.9%的氯化钠溶液,现有100g生理盐水给某病人输液,进入病人体内的氯化钠的质量是 [ ] A.0.9g
B.9g
C.90g
D.18g 天地无棱1年前1
天地无棱1年前1 -
 jason197611 共回答了15个问题
jason197611 共回答了15个问题 |采纳率93.3%A1年前查看全部
- 农业上经常要配制一定量溶质质量分数的食盐水溶液来选种,配制的步骤是计算、 _____ 、溶解,需要用到的仪器有天平、药匙
农业上经常要配制一定量溶质质量分数的食盐水溶液来选种,配制的步骤是计算、 _____ 、溶解,需要用到的仪器有天平、药匙、烧杯、玻棒、 _______ ,其中玻棒的作用是 _______ __ .  shankss1年前1
shankss1年前1 -
 mm21 共回答了19个问题
mm21 共回答了19个问题 |采纳率89.5%称量;量筒;搅拌作用.1年前查看全部
- 20℃时氯化钠的溶剂度为36克,则此温度下氯化钠饱和溶液的溶质质量分数为_______;当把改溶液蒸发掉10克水再降温至
20℃时氯化钠的溶剂度为36克,则此温度下氯化钠饱和溶液的溶质质量分数为_______;当把改溶液蒸发掉10克水再降温至20℃后,剩余溶液的溶质质量分数_________
 垃圾我都踢1年前1
垃圾我都踢1年前1 -
 老街区 共回答了13个问题
老街区 共回答了13个问题 |采纳率92.3%20℃时氯化钠的溶剂度为36克,则此温度下氯化钠饱和溶液的溶质质量分数为_36g/(36g+100g)*100%=26.47%______;当把改溶液蒸发掉10克水再降温至20℃后,剩余溶液的溶质质量分数__26.47%__
温度没变,溶解度不变,溶质质量分数不变.1年前查看全部
- (2014•工业园区一模)如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线.现分别向50克M、80克N固体
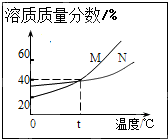 (2014•工业园区一模)如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线.现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是( )
(2014•工业园区一模)如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线.现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是( )
A.M、N两溶液的溶质质量分数相等
B.只有N析出晶体
C.M、N均有晶体析出
D.M、N两溶液均是饱和溶液 艰难的旅行1年前1
艰难的旅行1年前1 -
 mootty 共回答了12个问题
mootty 共回答了12个问题 |采纳率91.7%解题思路:根据题意,加水150克,加热溶解,同时蒸发掉50克水,冷却至t℃,这一系列变化后,相当于在t℃时用150g-50g=100g水分别去溶解50克M和80克N固体,判断此时的溶解情况;因此可根据饱和溶液的溶质质量分数随温度变化的曲线,算出t℃两物质的溶解度,然后判断此时100g水所能溶解两种物质的最大值,从而对所做的判断进行评价.首先计算t℃时M、N两物质的溶解度:根据饱和溶液的溶质质量分数随温度变化的曲线,t℃时M、N两物质的饱和溶液的溶质质量分数相等都为40%,根据饱和溶液的溶质质量分数与溶解度的关系:溶质质量分数=[溶解度/溶解度+100g]×100%,可知此时两物质的溶解度相等,设为x,则有[x/100g+x]×100%=40%,解得x≈67g;
然后根据溶解度判断两物质在t℃时的溶解情况:t℃时M、N两物质的溶解度为67g,即此时100g水最多溶解M、N物质的质量都为67g,所以,加入的50gM可以全部溶解且形成不饱和溶液,加入的80gN不能全部溶解而成为饱和溶液;故B正确,CD错误;
综合以上分析,当降温到t℃时固体M不会析出,而固体N物质析出80g-67g=13g;由于此时M溶液是不饱和溶液而N溶液为饱和溶液,因此两溶液的溶质质量分数也不相等;故A错误;
故选:B.点评:
本题考点: 固体溶解度曲线及其作用;晶体和结晶的概念与现象.
考点点评: 解题时一定要注意:所给的曲线不是溶解度曲线,而是饱和溶液的溶质质量分数随温度变化的曲线,并使用饱和溶液中溶质质量分数与溶解度的关系进行分析解答.1年前查看全部
- 将5克固体氢氧化钠完全溶解在50克溶质质量分数为12%的氢氧化钠溶液中.
将5克固体氢氧化钠完全溶解在50克溶质质量分数为12%的氢氧化钠溶液中.
(1)求所得溶液的溶质质量分数;
(2)为测算某盐酸的溶质质量分数,现取10克上述所得的氢氧化钠溶液与18.25克此盐酸混合,且恰好完全反应.求此盐酸的溶质质量分数. seachh1年前1
seachh1年前1 -
 鹅蛋碰石头 共回答了20个问题
鹅蛋碰石头 共回答了20个问题 |采纳率85%解题思路:(1)溶液的溶质质量分数═[溶质质量/溶液质量]×100%;加入5gNaOH固体完全溶解后,所得溶液中溶质质量为原溶液中溶质质量与后加入的氢氧化钠质量之和,溶液质量为原溶液质量与所加入氢氧化钠质量之和.
(2)根据氢氧化钠的质量可以求出18.25g盐酸溶液中溶质的质量,再根据溶液的溶质质量分数═[溶质质量/溶液质量]×100%,得出盐酸的溶质质量分数.(1)所得溶液中溶质质量分数=
50g×12%+5g
50g+5g×100%=20%;
(2)设所用盐酸中溶质的质量为X,由于反应只消耗了10g的上述溶液,则反应的氢氧化钠的质量为10g×20%=2g.
NaOH+HCl=H2O+NaCl
40 36.5
2g X
40
36.5=
2g
x解得,X=1.825g,
盐酸的溶质质量分数=
1.825g
18.25g×100%=10%.
故答为:(1)所得溶液的溶质质量分数为20%;(2)此盐酸的溶质质量分数为10%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.解题的关键是分析物质之间的反应情况,确定反应的化学方程式;弄清楚溶质质量和溶液质量的计算方法.1年前查看全部
- 初二科学实验题病人输液时用的生理盐水是一种溶质质量分数为0.9%的氯化钠溶液,下面是一瓶生理盐水的标签,请根据标签上给出
初二科学实验题
病人输液时用的生理盐水是一种溶质质量分数为0.9%的氯化钠溶液,下面是一瓶生理盐水的标签,请根据标签上给出的信息,回答下列问题.
标签:氯化钠注射液
【规格】495ml 内含氯化钠4.5g
【注意】如发现溶液有絮状物、瓶身细微破裂等均不可使用
【储存】密封保存
0.9%
该瓶生理盐水如果用溶质的质量分数为20%的氯化钠溶液(密度为1.07g/cm立方)来配制的话,问:需20%的氯化钠溶液___克
急 zhangbo8004291年前1
zhangbo8004291年前1 -
 南京2001 共回答了21个问题
南京2001 共回答了21个问题 |采纳率85.7%4.5===M*20%
M=22.5g1年前查看全部
- amol钠和amol铝同时加入mg足量水中,密度为dg/ml,溶质质量分数是多少?
 落樱061年前1
落樱061年前1 -
 lchsgjsh 共回答了20个问题
lchsgjsh 共回答了20个问题 |采纳率90%答案 溶质质量分数是 82a/(m+46a)*100%
反应 2Na+2H2O=2NaOH+H2
2Al+2NaOH+2H2O=2NaAlO2+3H2
所以,a mol钠和a mol铝均全反应而进入溶液,放出氢气共2a mol
则 溶液质量为 27a + 23a + m - 2*2a=m+46a g
溶质为NaAlO2 a mol 质量就=82a g
溶质质量分数是 82a/(m+46a)*100%1年前查看全部
- 一定质量的氢氧化钠和100g溶质质量分数为49%的稀硫酸恰好完全反应,问需要氢氧化钠的质量?
 风中飘扬的全是罪1年前1
风中飘扬的全是罪1年前1 -
 禾下甜 共回答了18个问题
禾下甜 共回答了18个问题 |采纳率88.9%解题思路:根据化学方程式和硫酸的质量求氢氧化钠的质量.硫酸的质量为:100g×49%=49g
设氢氧化钠的质量为x
H2SO4 +2NaOH=2H2O+Na2SO4
98 80
49gx
[98/80=
49g
x]
x=40g
答:需要氢氧化钠的质量为40g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式进行计算的能力,掌握化学方程式基本计算是解题的关键所在.1年前查看全部
- 要配置80克溶质质量分数为20%的氯化钠溶液,现提供40克溶质质量分数为40%的氯化钠溶液,20克溶质质量分数为15%的
要配置80克溶质质量分数为20%的氯化钠溶液,现提供40克溶质质量分数为40%的氯化钠溶液,20克溶质质量分数为15%的氯化钠溶液及足够多的固体氯化钠和水.请选用上述的药品,设计三种配制的方案(说明配制时所需的各种药品用量)
 xiaoxiaogd1年前1
xiaoxiaogd1年前1 -
 默的可以 共回答了22个问题
默的可以 共回答了22个问题 |采纳率86.4%1.直接称量16g的固体氯化钠,再称取64ml的水,进行溶解.
2.将40克溶质质量分数为40%的氯化钠溶液中加入40ml的水.
3.取13g固体氯化钠溶于47ml的水中,然后再与20克15%的氯化钠溶液混合.1年前查看全部
- 要配制100g 溶质质量分数为10%的氯化钠溶液,下列说法中正确的是( )
要配制100g 溶质质量分数为10%的氯化钠溶液,下列说法中正确的是( )
A. 配制步骤为:称量、溶解、装瓶
B. 需要的玻璃仪器有:烧杯、量筒、细口瓶
C. 称量10g氯化钠固体,量取90ml水
D. 为加快溶解速率可用温度计搅拌 lxhai31年前1
lxhai31年前1 -
 妮妮哒哒 共回答了21个问题
妮妮哒哒 共回答了21个问题 |采纳率85.7%解题思路:要配制100g 溶质质量分数为10%的氯化钠溶液,首先应计算配制所需水和氯化钠的量,然后根据计算结果称量所需物质,接下来进行溶解,完全溶解后进行装瓶保存.A、配制步骤中缺少计算过程,故A不正确;
B、所需要的玻璃仪器中没有溶解时所要使用的玻璃棒等仪器,故B不正确;
C、要配制100g 溶质质量分数为10%的氯化钠溶液,需要称量10g氯化钠固体,量取90ml水;故C正确;
D、为加快溶解速率需使用玻璃棒搅拌而不能使用温度计;故D不正确;
故选C.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 使用固体溶质配制溶液时,由于既要称取固体溶质的质量又要量取液体溶剂的体积,其操作过程为计算-称量-溶解.1年前查看全部
- 医疗上常用溶质的质量分数约为0.9%的生理盐水给病人补充体液,现用45g溶质质量分数为10%的氯化钠溶液来配制这种生理盐
医疗上常用溶质的质量分数约为0.9%的生理盐水给病人补充体液,现用45g溶质质量分数为10%的氯化钠溶液来配制这种生理盐水,需加水的质量约为( ) A.405g B.450g C.455g D.500g  lesley_z1年前1
lesley_z1年前1 -
 phpcom 共回答了15个问题
phpcom 共回答了15个问题 |采纳率86.7%根据加水前后溶质的质量不变列等式,设需要加水的质量为x
45g×10%=(45g+x)×0.9%
解之得 x=455g
故选C1年前查看全部
- (2008•浦东新区二模)如图是A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线
(2008•浦东新区二模)如图是A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,现将20gA和40gB分别置于100g水中,加热使其完全溶解,然后再冷却到t℃,下列有关叙述中正确的是( )

A.t℃时,A溶液的质量百分比浓度(溶质质量分数)小于B
B.t℃时,A、B溶液均达到饱和状态
C.t℃时,A、B溶液中均无固体物质析出
D.t℃时,A物质的溶解度小于B adang14971年前1
adang14971年前1 -
 单行道上的色盲 共回答了25个问题
单行道上的色盲 共回答了25个问题 |采纳率88%解题思路:A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,t℃时,A、B两种物质的饱和溶液的质量百分比浓度(溶质质量分数)相等,均为20%,由饱和溶液中溶质的质量分数=
×100%,计算出t℃时的溶解度;据此结合选项进行分析判断.溶解度 溶解度+100g t℃时,A、B两种物质的饱和溶液的质量百分比浓度(溶质质量分数)相等,均为20%,由饱和溶液中溶质的质量分数=
溶解度
溶解度+100g×100%,设t℃时,A、B两种物质的溶解度为S,则
S
S+100g×100%=20%,S=25g;将20gA和40gB分别置于100g水中,加热使其完全溶解,然后再冷却到t℃,A为不饱和溶液,B有晶体析出,为饱和溶液.
A、t℃时,A、B两种物质的溶解度均为25g,则t℃时,100g水中溶解20gA,能溶解25gB,则A溶液的质量百分比浓度(溶质质量分数)小于B,故选项说法正确.
B、t℃时,A溶液未达到饱和状态,B溶液达到饱和状态,故选项说法错误.
C、t℃时,A溶液中无固体物质析出,B溶液中有固体物质析出,故选项说法错误.
D、t℃时,A物质的溶解度等于B,故选项说法错误.
故选A.点评:
本题考点: 固体溶解度曲线及其作用.
考点点评: 本题难度不大,主要考查了A、B两种物质(均不含结晶水)的饱和溶液的质量百分比浓度(溶质质量分数)随温度变化的曲线,通过本题可以培养学生应用知识解决问题的能力.1年前查看全部
- (2013•丹东)用固体氯化钠和水配制100g溶质质量分数为12%的氯化钠溶液.
(2013•丹东)用固体氯化钠和水配制100g溶质质量分数为12%的氯化钠溶液.
(1)量取所需水的体积.最好选用______(填“50mL”、“100mL”或“500mL”)的量筒.
(2)用量筒量水时,若俯视,则量取水的体积会______(填“偏大”、“偏小”或“不变”).
(3)规范的溶解操作,用到的仪器有______. 朱霖臻朱朱1年前1
朱霖臻朱朱1年前1 -
 LLY大hh1 共回答了29个问题
LLY大hh1 共回答了29个问题 |采纳率89.7%解题思路:(1)100g 12%的氯化钠溶液所需溶质的质量为100g×12%=12g,需要水的质量为100g-12g=88g,其体积为88mL,量筒量程的选取方法是比所量液体多,并最接近的;
(2)根据取用定量液体视线与刻度线及量筒内液体凹液面的最低点保持水平的原则,仰视读量筒内液体体积,读数比实际液体体积小;俯视读数液体体积比实际偏大;所以俯视量取水的实际体积会比读数偏小;
(3)用固体和水配制溶液时,先用天平称取一定质量的药品,放入烧杯中,然后用量筒量取一定体积的水,加入烧杯中,用玻璃棒搅拌以加速溶解,配成溶液.(1)100g 12%的氯化钠溶液所需溶质的质量为100g×12%=12g,需要水的质量为100g-12g=88g,其体积为88mL,量筒量程的选取方法是比所量液体体积大,并最接近的,所以应选量程为100mL的量筒,
故答案为:100mL;
(2)根据取用定量液体视线与刻度线及量筒内液体凹液面的最低点保持水平的原则,仰视读量筒内液体体积,读数比实际液体体积小;俯视读数液体体积比实际偏大;所以俯视量取水的实际体积会比读数偏小,
故答案为:偏小;
(3)规范的溶解操作,用到的玻璃仪器有量筒、烧杯、玻璃棒,
故答案为:量筒、烧杯、玻璃棒.点评:
本题考点: 一定溶质质量分数的溶液的配制;测量容器-量筒;物质的溶解.
考点点评: 本题主要通过氯化钠溶液配制方法及注意事项,考查相关的基础知识.1年前查看全部
- 质量分数为10%和30%的氨水等体积混合,溶质质量分数为什么小于20%?
质量分数为10%和30%的氨水等体积混合,溶质质量分数为什么小于20%?
如果把氨水换成等质量分数的硫酸再进行等体积混合,溶质质量分数为什么大于20%? 逢头勿语1年前1
逢头勿语1年前1 -
 11696471 共回答了15个问题
11696471 共回答了15个问题 |采纳率86.7%设质量分数为10%和30%的氨水密度分别为p1、p2,体积为V等体积混合溶质质量分数=(V*p1*10%+V*p2*30%)/(V*p1+V*p2)*100%=(p1*10%+p2*30%)/(p1+p2)*100%=[(p1*(20%-10%)+p2*(20%+10%)/(p1+p2)*100%=[(p1...1年前查看全部
- 实验室欲配制溶质质量分数4%的NaOH溶液200g,需水的质量为( )
实验室欲配制溶质质量分数4%的NaOH溶液200g,需水的质量为( )
A.8 g
B.192 g
C.196 g
D.200 g piapo1年前1
piapo1年前1 -
 ytj1984 共回答了14个问题
ytj1984 共回答了14个问题 |采纳率85.7%解;溶质质量=溶液质量×溶质的质量分数,配制溶质质量分数4%的NaOH溶液200g,需氢氧化钠的质量=200g×4%=8g;溶剂质量=溶液质量-溶质质量,则所需水的质量=200g-8g=192g.
故选B.1年前查看全部
- 实验室配制90g溶质质量分数为10%的稀硫酸,需要60%的硫酸(密度1.5g/cm3)多少毫升?需水多少
实验室配制90g溶质质量分数为10%的稀硫酸,需要60%的硫酸(密度1.5g/cm3)多少毫升?需水多少
要过程、、那个密度有什么用啊@@ 8303191年前1
8303191年前1 -
 婷儿BLOG 共回答了8个问题
婷儿BLOG 共回答了8个问题 |采纳率75%需要60%浓硫酸的质量90×10/60=15克
15克浓硫酸的体积15/1.5=10毫升
需要水75克.1年前查看全部
- 配置50克10%的NaCl溶液,下列实验操作中,所得溶液溶质质量分数可能大于10%的是( ) 选项如下:
配置50克10%的NaCl溶液,下列实验操作中,所得溶液溶质质量分数可能大于10%的是( ) 选项如下:
A 称量固体时,天平指针略向右倾斜
B 用天平称量固体时,固体放右盘,砝码放左盘
C 用量筒量取水时俯视读数
D 配置溶液时烧杯先用少量蒸馏水润洗
(是不是C?可是不是俯大仰小吗,水的读数偏大,那质量分数要更小才对呀?) 王小二子1年前1
王小二子1年前1 -
 午后的热咖啡 共回答了22个问题
午后的热咖啡 共回答了22个问题 |采纳率86.4%是C.
楼主也知道了俯视和仰视的区别,但是就是一点没想明白.
你量取水的时候是要量一个固定体积的水,比如说1L,而不是只叫你读数.
也就是说,你是一直加水,加到你俯视读数读1L的时候停止加水.而俯视的读数是偏大的,所以现在你读数是1L,而其实量筒里的水是不到1L的,所以质量分数会变大.1年前查看全部
- (2009•崇明县二模)实验室用氯化钠配制lOOg溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;
(2009•崇明县二模)实验室用氯化钠配制lOOg溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③计算;④量取水;⑤装瓶贴标签.正确的操作顺序是( )
A.①②③④⑤
B.③②④①⑤
C.①③⑤②④
D.③②④⑤① intria1年前1
intria1年前1 -
 startle 共回答了19个问题
startle 共回答了19个问题 |采纳率89.5%解题思路:根据配制溶质质量分数一定的溶液的基本步骤考虑;配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放.
故选B.点评:
本题考点: 一定溶质质量分数的溶液的配制.
考点点评: 通过回答本题知道了配制溶质质量分数一定的溶液的基本步骤,要熟记它们并能灵活运用.1年前查看全部
- 溶解度与溶质质量分数的关系.选择题里问使硝酸钾饱和溶液溶质质量分数发生变化的有:
溶解度与溶质质量分数的关系.选择题里问使硝酸钾饱和溶液溶质质量分数发生变化的有:
A,升高温度
B,降低温度
C,恒温加溶质
D,恒温蒸发溶剂. 随风飘dh1年前1
随风飘dh1年前1 -
 杰才杰色 共回答了16个问题
杰才杰色 共回答了16个问题 |采纳率81.3%答案选A,B,由于已经是饱和溶液,因此升高或降低温度可以改变溶解度(溶解度与温度有关,具体我不记得硝酸钾的溶解度是随温度上升而增大还是降低了,总之可以改变溶解度),至于C,恒温的情况再加溶质已经加不进去了,恒温蒸发溶剂的话,溶液也一直是饱和的,质量分数不变,蒸发掉了溶剂相应就有溶质析出1年前查看全部
- 1::将200克10%的食盐水蒸发掉40克水,求溶液的溶质质量分数
1::将200克10%的食盐水蒸发掉40克水,求溶液的溶质质量分数
2:将200克10%的食盐水蒸发掉40克,有5克晶体析出.求溶液的溶质质量分数
3:将40克硝酸钾完全溶解在360克水中,要使溶质质量分数增大一倍,应蒸发多少克水 甜蜜妞儿1年前1
甜蜜妞儿1年前1 -
 我夫 共回答了18个问题
我夫 共回答了18个问题 |采纳率83.3%200×10%=20 20÷(200-40)=12.5%
200×10%=20 (20-5)÷(200-40-5)=9、67%
应该蒸发:(40+360)÷2=200克1年前查看全部
- 将CO2通入一定量的氢氧化钠溶液,反应完全后,得到200g溶质质量分数为26.5%的溶液,求原氢氧化钠溶液中溶质的质量.
 jhb99091年前1
jhb99091年前1 -
 无辜qq 共回答了24个问题
无辜qq 共回答了24个问题 |采纳率87.5%2NaOH+CO2=Na2CO3+H2O 80 106 X 200g*26.5% X=40 (200g-200g*26.5%)+40=187 40/187=24.1%1年前查看全部
- 30℃时,将30克A物质投入50克水中充分搅拌恰好饱和,求30℃时A物质的溶解度及溶液的溶质质量分数
 linderxlj1年前1
linderxlj1年前1 -
 pgly 共回答了19个问题
pgly 共回答了19个问题 |采纳率100%溶解度指100克水中能够溶解的溶质的最大质量,所以溶解度为60克.
质量分数=溶质质量/溶液质量=30/(30+50)=37.5%1年前查看全部
- 将67.9g碳酸钠溶液与一定量的溶质质量分数为20%的盐酸混合后,恰好完全反应,生成4.4g二氧化碳气体.
将67.9g碳酸钠溶液与一定量的溶质质量分数为20%的盐酸混合后,恰好完全反应,生成4.4g二氧化碳气体.
1碳酸钠溶液的浓度 2所得溶液的浓度 teamtech1年前1
teamtech1年前1 -
 爱已封印 共回答了15个问题
爱已封印 共回答了15个问题 |采纳率80%设Na2CO3的质量是x,盐酸溶液的质量是x,反应生成NaCl的质量是z.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 20%y z 4.4g
106/x=73/20%y=117/z=44/4.4
x=10.6g
y=36.5g
z=11.7g
碳酸钠溶液的浓度是10.6/67.9*100%=15.6%
反应后溶液的质量是67.9+36.5-4.4=100g
所得溶液的浓度是11.7/100*100%=11.7%
答:1.碳酸钠溶液的浓度是15.6%
2.所得溶液的浓度是11.7%1年前查看全部
- 溶质质量分数为7.3%的稀盐酸100g,与足量的铁反应,最多能制得H2多少克
 sdmbf1年前1
sdmbf1年前1 -
 love169 共回答了19个问题
love169 共回答了19个问题 |采纳率94.7%HCl的质量为100×7.3%=7.3g
2HCl+Fe=H2↑+FeCl2
73 2
7.3g m
m=0.2g1年前查看全部
- 一道关于PH值的科学题完全中和某一强酸溶液,需用10克溶质质量分数为百分之5.6的KOH溶液.如果改用10克溶质质量分数
一道关于PH值的科学题
完全中和某一强酸溶液,需用10克溶质质量分数为百分之5.6的KOH溶液.如果改用10克溶质质量分数为百分之5.6的NaOH溶液,反应后溶液的PH值是大于7还是小于7或等于7
不过答案好像是大于7 谁能给我详细的思路啊 iiilhb1年前1
iiilhb1年前1 -
 lcmxx 共回答了20个问题
lcmxx 共回答了20个问题 |采纳率85%考虑相对分子质量就行,KOH的相对分子质量要比NaOH要大.然后通过化学方程式可以得出反应相同质量的酸,需要相对分子质量小的碱比相对分子质量大的碱要少.1年前查看全部
大家在问
- 1彩色电视机的屏幕上,若在某一时刻,屏上某一区域内各三原色色点的强度都相同,则在该区域呈现的颜色是( )
- 2已知:三角形ABD和三角形CBD关于直线BD对称,点A的对称点是点C,点E、F分别是线段BC和BD上的点,且点F在线段E
- 3I found that boy interesting.里的 interesting 可用 interested 为什
- 4李白《送友人》是给去哪里的友人写的?
- 5圆内一条弦的长度等于半径的长度,其所对的圆心角是不是1弧度的角?
- 6(2011•呼和浩特)下列实验操作中,正确的是( )
- 7她真棒 作文
- 8depend on可以用于被动语态么
- 9英语翻译"国食药监械(准)字2005第xxxxxxx号"怎么翻译?
- 10已知:如图,抛物线y=ax2+ax+c与y轴交于点C(0,-2),与x轴交于点A、B,点A的坐标为(-2,0).
- 11(x-1)(2x+3)+x(1-x)=0,因式分解解方程
- 12全等三角形判断题如图,已知点E是∠AOB平分线上的一点,EC⊥OA,ED⊥OB,垂足分别为C,D,连CD交OE于M,则下
- 13关于特征值,特征向量的求法.B=( 1 1 0 0 2 1 0 0 3) 有一个特征值为 入=1,那么,特征向量怎么求呢
- 141.结合上下文,品味下列语句中加点词的含义.
- 15onward transmission是什么意思



