KMnO4与Na2C2O4在稀硫酸的离子方程式
 A200109382022-10-04 11:39:542条回答
A200109382022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 003yang 共回答了19个问题
003yang 共回答了19个问题 |采纳率78.9%- 5 C2O42- + 2MnO4- + 16H+ = 10CO2 + 2Mn2+ + 8H2O
C改变量(4-3)×2=2,Mn改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,再由电荷守恒在H+前配16,最后根据离子方程式两边的H个数相等在水前面配8,经检验离子方程式两边的氧原子相等. - 1年前
 chord123 共回答了343个问题
chord123 共回答了343个问题 |采纳率- 稀硫酸提供氢离子,
使高锰酸钾氧化性增强
且高锰酸钾在酸性条件下的还原产物为二价锰离子
2MnO4- + 5C2O42- +16H+ → 2Mn2+ + 10CO2↑ + 8H20 - 1年前
相关推荐
- Na2C2O4分解方程式?
 xrayl1年前1
xrayl1年前1 -
 yuan981111 共回答了11个问题
yuan981111 共回答了11个问题 |采纳率100%草酸在189.5℃或遇浓硫酸会分解生成二氧化碳、一氧化碳和水.
HOOCCOOH====CO2↑+CO↑+H2O1年前查看全部
- 大学分析化学题.有Na2C2O4样品0.2203g,用KMnO4溶液滴定至终点用去29.30ml.1mlKMnO4=0.
大学分析化学题.
有Na2C2O4样品0.2203g,用KMnO4溶液滴定至终点用去29.30ml.1mlKMnO4=0.006023gFe,求试样中Na2C2O4的含量. 我为锋刃1年前1
我为锋刃1年前1 -
 yanghongtao1968 共回答了15个问题
yanghongtao1968 共回答了15个问题 |采纳率86.7%5Na2C2O4 —— 2KMnO4 —— 10Fe
5*134 10*55.85
m 29.30*0.006023
m=0.2117g
含量=(0.2117/0.2203 )*100%=96.10%1年前查看全部
- 配制C(1/2Na2C2O4)=0.1000mol/L的Na2C2O4溶液1000ml,要称取105~110℃烘干1小时
配制C(1/2Na2C2O4)=0.1000mol/L的Na2C2O4溶液1000ml,要称取105~110℃烘干1小时,并冷却的Na2C2O4多少克
(Na2C2O4分子量=134.0),要详细解题步骤,谢谢! 我爱你佳洁1年前1
我爱你佳洁1年前1 -
 shruru 共回答了18个问题
shruru 共回答了18个问题 |采纳率83.3%在这里,以1/2Na2C2O4为基本单元,由分式:m=nM(1/2Na2C2O4)=cVM(1/2Na2C2O4)=0.1000X1.000X134.0/2=6.700g1年前查看全部
- 酸式高锰酸钾滴定法里面c(1/2Na2C2O4)=0.1mol/L 是什么意思啊? 6.701g溶在1000ml水中应该
酸式高锰酸钾滴定法里面c(1/2Na2C2O4)=0.1mol/L 是什么意思啊? 6.701g溶在1000ml水中应该是0.05mol/L啊
 doctorxl1年前1
doctorxl1年前1 -
 hh好女人 共回答了23个问题
hh好女人 共回答了23个问题 |采纳率95.7%因为采用的是氧化还原滴定,而草酸里面被还原的价值总共变化为2价,所以名义的价浓度就是2倍的实际浓度1年前查看全部
- 常温下,将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中.已知NaHC
常温下,将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中.已知NaHC2O4溶液显酸性,关于
常温下,将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中.已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是( )
A.c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4)
B.[1/2]c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
C.c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小
 tadetaotao1年前1
tadetaotao1年前1 -
 半只小孩 共回答了19个问题
半只小孩 共回答了19个问题 |采纳率89.5%A.c(Na+)=2c(Cl-),酸式盐NaHC2O4的溶液呈酸性,说明HC2O4-电离程度大于HC2O4-水解程度,所以c(HC2O4-)>c(C2O42-)>c(HC2O4),即c(Na+)>c(Cl-)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4),故A正确;
B.由电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)+c(Cl-)①,而c(Na+)=2c(Cl-)②,由①-[1/2×②得
1
2]c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故B正确;
C.根据物料守恒可知:n(HCl)=n(Na2C2O4),即:c(Cl-)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)故C错误;
D.加水稀释时,显性离子氢离子的浓度减小,但溶液中隐性离子c(OH-)增大,其它各离子浓度均减小,故D正确.
故选C.1年前查看全部
- 为什么用高锰酸钾法测COD时用过量的Na2C2O4还原,不直接在这一步就滴定了?
 爽歪歪111年前1
爽歪歪111年前1 -
 你听告白 共回答了12个问题
你听告白 共回答了12个问题 |采纳率91.7%用高锰酸钾法测COD,这叫做高锰酸盐指数,而其中用到的草酸钠是标准溶液,这可以和用重铬酸钾法测COD相比,只不过是两个反应中的氧化剂和还原剂调换了一下,基作用就相当于重铬酸钾法测COD中的重铬酸钾标准溶液.
你再仔细看看高锰酸盐指数的测定方法可以发现,在滴定之前高锰酸钾在水中是过量的,你要是再直接滴定还有变化吗,当然有,颜色会变得更红.所以要加入草酸钠标准溶液进行滴定.
如果还不明白,Please 再去学习化学的基本知识.1年前查看全部
- 用Na2C2O4作基准物质标定HCl时,是将准确称取的Na2C2O4灼烧为Na2CO3后再用HCl滴定至甲基橙终点
用Na2C2O4作基准物质标定HCl时,是将准确称取的Na2C2O4灼烧为Na2CO3后再用HCl滴定至甲基橙终点
若灼烧时部分Na2CO3分解为Na2O,对标定结果有无影响?为什么? lmyhbb1年前3
lmyhbb1年前3 -
 园明居士 共回答了16个问题
园明居士 共回答了16个问题 |采纳率93.8%没有影响,因为 Na2O和 Na2CO3 一样都是1分子消耗2分子HCl
不管有没有分解,最后消耗的Hcl的量都是一样的.1年前查看全部
- 物质的量倒算?n1/5 KMnO4=()nKMnO4c1/2 Na2C2O4=()cNa2C2O4也希望有人简短的解释一
物质的量倒算?
n1/5 KMnO4=()nKMnO4
c1/2 Na2C2O4=()cNa2C2O4
也希望有人简短的解释一下下面的意思
n1/5 KMnO4=C1/5KMnO4 * V KMnO4
n1/2 Na2C2O4= mNa2C2O4/MNa2C2O4 wymszh1年前1
wymszh1年前1 -
 jet911 共回答了14个问题
jet911 共回答了14个问题 |采纳率85.7%n1/5 KMnO4=1/5nKMnO4
c1/2 Na2C2O4=1/2cNa2C2O4
这是旧版分析化学上的当量浓度表示法,现在其实直接用nKMnO4计算就可以了1年前查看全部
- 200707b2准确称取0.1475克基准物Na2C2O4,溶于水,酸化并加热至适当温度,用待标定的KMnO4溶液滴定至
200707b2准确称取0.1475克基准物Na2C2O4,溶于水,酸化并加热至适当温度,用待标定的KMnO4溶液滴定至终点,用去21.70ml,计算此KMnO4溶液的准确浓度.Na2C2O4的摩尔质量=134.0g/mol,滴定反应方程式:
2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O iyh181年前2
iyh181年前2 -
 这就是MJ 共回答了18个问题
这就是MJ 共回答了18个问题 |采纳率100%设,反应消耗KMnO4 X mol
2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O
2 5
X 0.1475/134
X=4.403×10^-4
所以高锰酸钾溶液的物质的量浓度为 4.403×10^-4mol÷0.0217L≈0.02029mol/L1年前查看全部
- Na2C2O4能否作为酸碱滴定的基准物质
 兰天也有雨1年前2
兰天也有雨1年前2 -
 tyalyy 共回答了12个问题
tyalyy 共回答了12个问题 |采纳率91.7%不行.Na2C2O4在水中溶解度很大,不易获得组分固定的晶体(都会带有数量不定的结晶水)1年前查看全部
- 由甲乙丙三瓶同体积同浓度的Na2C2O4,H2C2O4,NaHC2O4溶液,若用NaOH或HCl调节至同样的PH,最后补
由甲乙丙三瓶同体积同浓度的Na2C2O4,H2C2O4,NaHC2O4溶液,若用NaOH或HCl调节至同样的PH,最后补加水至同样的体积,此时三瓶中[HC2O4-]浓度的关系是
A甲瓶最小
B乙瓶最小
C丙瓶最小
D三瓶相等 as464516391年前1
as464516391年前1 -
 Janice2005 共回答了17个问题
Janice2005 共回答了17个问题 |采纳率94.1%HC2O4-的分布系数=[H+]*Ka1 / {[H+]^2 +[H+]*Ka1 +Ka1*Ka2}
显然在PH相同时,即[H+]相同,HC2O4-的分布系数相等
总浓度相等
因此D三瓶相等1年前查看全部
- 准确称取Na2C2O4 o.3400g,溶于100ml1mol/LH2SO4中,滴定用去KMnO
准确称取Na2C2O4 o.3400g,溶于100ml1mol/LH2SO4中,滴定用去KMnO
准确称取Na2C2O4 o.3400g,溶于100ml1mol/LH2SO4中,滴定用去KMnO4标准溶液25.24ml,求KMnO4标准溶液的浓度 vaporshow1年前0
vaporshow1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 欲用Na2C2O4基准试剂在酸性介质中标定0.020mol/L KMnO4溶液应称取Na2C2O4多少克?
 维纳斯德鲁依1年前1
维纳斯德鲁依1年前1 -
 AMEN_MEN 共回答了18个问题
AMEN_MEN 共回答了18个问题 |采纳率94.4%你还没给出KMnO4溶液取多少啊!假设为V L则设取Na2C2O4xmol
5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O
5 2
x 0.020mol/LxV
5/x=2/0.020V
解得x=0.05Vmol所以MNa2C2O4=o.05Vx134=6.7V克1年前查看全部
- 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
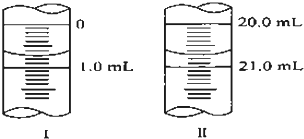 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
2MnO4-+5C2O42-+16H+
2Mn2++10CO2↑+75℃−85℃ .
8H2O.
(1)若用托盘天平称取W g Na2C2O4晶体,称量开始时和称量结束时的共同操作步骤是______.
(2)若将W g Na2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定达到终点的现象是______.
(3)若滴定管的起始读数和终点读数如图所示,则所取标准溶液的体积为______,酸性KMnO4的物质的量浓度为[2W/67]mol•L-1[2W/67]mol•L-1(填表达式).
(4)下列实验操作会对滴定结果产生的后果(填“偏高”、“偏低”或“无影响”):
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果______.
②若将锥形瓶用标准液润洗,则滴定结果______. hunterhome1年前1
hunterhome1年前1 -
 孙nn 共回答了26个问题
孙nn 共回答了26个问题 |采纳率80.8%解题思路:(1)称量固体时,无论开始时,还是称量结束时,都需移动游码;
(2)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管;KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色为滴定到终点;
(3)根据滴定管的结构、精确度以及测量原理来解答;根据关系式KMnO4~5Na2C2O4来计算;
(4)根据c(待测)=
分析不当操作对V(待测)的影响,以此判断浓度的误差.V(标准)×c(标准) V(待测) (1)若用托盘天平称取W g Na2C2O4晶体,称量开始时和称量结束时的共同操作步骤是移动游码,使游码回零处;
故答案为:把游码拨回零处;
(2)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应装在酸式滴定管中;KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色为滴定到终点,
故答案为:酸式;滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;
(3)滴定管的起始读数为0.70mL,终点读数为20.70mL,酸性KMnO4溶液消耗的体积为20.70mL-0.70mL=20.00mL;
KMnO4溶液的物质的量浓度为c,WgNa2C2O4配成100mL标准溶液,20.00mL溶液中含有Na2C2O4的质量为[W/5]g;
2KMnO4 ~5Na2C2O4
2moL 5×134g
0.02L×c [W/5]g
解得:c=[2W/67]mol•L-1,
故答案为:22.00;[2W/67]mol•L-1;
(4)①观察酸式滴定管液面时,开始俯视,滴定终点平视,造成V(待测)偏大,据c(待测)=
V(标准)×c(标准)
V(待测)分析,则滴定结果偏小;
②若将锥形瓶用标准液润洗,标准液的物质的量偏多,造成V(待测)偏大,据c(待测)=
V(标准)×c(标准)
V(待测)分析,则滴定结果偏小;
故答案为:偏小;偏小;点评:
本题考点: 中和滴定.
考点点评: 本题是一道氧化还原反应滴定的综合题,涉及天平的使用、中和滴定的注意事项和化学计算,注意该题为待测液滴定标准液,考查了学生分析问题和解决问题的能力.1年前查看全部
- 用Na2C2O4标定KMnO4溶液浓度时,溶液的酸度过低,这会导致测定结果
用Na2C2O4标定KMnO4溶液浓度时,溶液的酸度过低,这会导致测定结果
A:偏高
B:偏低
C:无影响 auodis1年前1
auodis1年前1 -
 我爱我的大笨熊 共回答了18个问题
我爱我的大笨熊 共回答了18个问题 |采纳率94.4%偏低1年前查看全部
- nahc2o4 na2c2o4 溶液碱性
nahc2o4 na2c2o4 溶液碱性
nahc2o4 和NAOH等体积等浓度混合,最后的溶液为啥是碱性?nahc2o4 是酸性 na2c2o4水解碱性 可是电离大于水解 最后不还是应该酸性? hootom1年前4
hootom1年前4 -
 1990132 共回答了18个问题
1990132 共回答了18个问题 |采纳率94.4%原因是草酸钠溶液中的酸根离子的水解程度比草酸氢钠溶液中的草酸氢根离子的电离程度大.所以混合后显碱性.
理解请及时采纳!1年前查看全部
- 常温下,将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中.已知NaHC
常温下,将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中.已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是( )
A.c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4)
B.[1/2]c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
C.c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 zivanz1年前1
zivanz1年前1 -
 laohaire 共回答了16个问题
laohaire 共回答了16个问题 |采纳率81.3%解题思路:将20mL 0.1mol/L的HCl溶液逐滴加入到20mL 0.1mol/L Na2C2O4溶液中,得到等物质量浓度的氯化钠和NaHC2O4,酸式盐NaHC2O4的溶液呈酸性,说明HC2O4-电离程度大于HC2O4-水解程度,结合电荷守恒和物料守恒判断.A.c(Na+)=2c(Cl-),酸式盐NaHC2O4的溶液呈酸性,说明HC2O4-电离程度大于HC2O4-水解程度,所以c(HC2O4-)>c(C2O42-)>c(HC2O4),即c(Na+)>c(Cl-)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4),故A正确;
B.由电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)+c(Cl-)①,而c(Na+)=2c(Cl-)②,由①-[1/2×②得
1
2]c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故B正确;
C.根据物料守恒可知:n(HCl)=n(Na2C2O4),即:c(Cl-)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)故C错误;
D.加水稀释时,显性离子氢离子的浓度减小,但溶液中隐性离子c(OH-)增大,其它各离子浓度均减小,故D正确.
故选C.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查离子浓度的大小比较,题目难度较大,注意把握电解质的电离和盐类水解原理,结合守恒的方法解答该题.1年前查看全部
- Na2C2O4标定KMnO4时,为什么要加热到70摄氏度到80摄氏度?溶液温度过高或过低有何影
 mark520x1年前1
mark520x1年前1 -
 sun85126 共回答了18个问题
sun85126 共回答了18个问题 |采纳率88.9%常温下,高锰酸钾氧化草酸根的速率很慢,加热到70至80摄氏度可以加快反应速率,而温度又不宜高于85度,否则草酸会缓慢的分解.1年前查看全部
- D、含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H
D、含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] 为什么不对?
 黑嘴有多黑1年前1
黑嘴有多黑1年前1 -
 grase27 共回答了12个问题
grase27 共回答了12个问题 |采纳率100%1年前查看全部
- 称取基准Na2C2O4物质0.2262克以标定KMnO4 溶液的浓度,滴定达化学计量点时,消耗KMnO4 41.50毫升
称取基准Na2C2O4物质0.2262克以标定KMnO4 溶液的浓度,滴定达化学计量点时,消耗KMnO4 41.50毫升,计算KMnO4溶液的物质的量浓度 TKMnO4/Fe TKMnO4/ Fe2O3=?
 ii万金油1年前1
ii万金油1年前1 -
 skywuhan 共回答了20个问题
skywuhan 共回答了20个问题 |采纳率90%Na2C2O4被氧化成Na2CO3,失去2个电子,而高锰酸钾被还原成二价锰离子,得到5个电子.消耗比例为5:2.Na2C2O4为0.2262克,0.0169mol.对应高锰酸钾的物质的量为0.000675mol.消耗量为41.5毫升,所以高锰酸钾浓度为0.0163mol/L.1年前查看全部
- 标定碘的基准物质是什么书上就是这样(三氧化二砷)讲的,可为什么做题时没这个选项,并且答案是Na2C2O4?反应方程式~I
标定碘的基准物质是什么
书上就是这样(三氧化二砷)讲的,可为什么做题时没这个选项,并且答案是Na2C2O4?
反应方程式~I2和NA2C2O4的。 牧马汉子1年前1
牧马汉子1年前1 -
 myguest 共回答了18个问题
myguest 共回答了18个问题 |采纳率100%草酸钠,硫代硫酸钠,三氧化二砷之类的还原性基准物质都可标定碘,但在实际运用中三氧化二砷毒性大,用得少.LZ看的是什么书啊,不可能只有三氧化二砷,肯定也讲了其他基准物质吧.学化学不能靠死记
就是碘变成碘离子,草酸根变成二氧化碳,
标准电势为0.055V1年前查看全部
- (2011•龙岩模拟)实验室中,通常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应
(2011•龙岩模拟)实验室中,通常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:C2O42-+MnO4-+H+-Mn2++CO2↑+H2O(未配平)下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是( )
A.滴定过程中,高锰酸钾被氧化,草酸钠被还原
B.温度需超过100℃,草酸钠与高锰酸钾才会反应
C.反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2
D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂 风神3211年前1
风神3211年前1 -
 sherlockqi 共回答了16个问题
sherlockqi 共回答了16个问题 |采纳率93.8%解题思路:A、高锰酸钾具有强氧化性,能将草酸钠氧化;
B、草酸钠滴定高锰酸钾常温下就可以反应,实验必须在室温下进行;
C、化学反应中的是电子的数目必须相等;
D、进行滴定实验时,指示剂的加入必须是根据反应物的特点来选择的.A、高锰酸钾具有强氧化性,草酸具有还原性,高锰酸钾能将草酸钠氧化,高锰酸钾被还原,草酸钠被氧化,故A错误;
B、滴定实验必须在常温条件下发生,草酸钠与高锰酸钾的反应常温下即可发生,故B错误;
C、高锰酸钾中的锰离子由+7价降为+2价,共得到5mol电子,草酸钠中碳元素的化合价由+3价升为+4价,共失去2mol电子,要使得失电子守恒,消耗的草酸钠与高锰酸钾的物质的量之比应为5:2,故C正确;
D、高锰酸钾本身为紫红色,以草酸钠(Na2C2O4)为标准液进行滴定时,滴定终点的判断依据是紫红色消失,不需要加指示剂,故D错误.
故选C.点评:
本题考点: 氧化还原反应;中和滴定.
考点点评: 本题是一道有关氧化还原反应知识的题目,反应的考查结合了滴定实验,要求学生具有分析和解决问题的能力.1年前查看全部
- 用Na2C2O4标定KMnO4时,可以用HNO3或HCl调节酸度吗?为什么要加热到70-80°C?
用Na2C2O4标定KMnO4时,可以用HNO3或HCl调节酸度吗?为什么要加热到70-80°C?
主要是体现出why?越详细越好,
还有就是:酸度调节用硫酸是3mol/L如果增加到6mol/就会出现滴几滴高锰酸钾就变红了。why?用硝酸的话开始是黄色再滴就是咖啡色吧!why? 13生tt契阔371年前1
13生tt契阔371年前1 -
 煤气炉子 共回答了10个问题
煤气炉子 共回答了10个问题 |采纳率90%不行
酸性高锰酸钾溶液会氧化盐酸
2MnO4- + 10Cl- + 16H+ == 2Mn2+ + 5Cl2↑+8H2O
所以不能用盐酸酸化(高锰酸钾溶液是永远不能用盐酸来酸话的,记住)
由于硝酸也有强氧化性,对于分析滴定时会产生干扰,因为我们是利用消耗的高锰酸钾的量来计算草酸钠的量的.
加热到70-80℃是为了在反应初期加速反应,高锰酸钾的还原产物Mn2+可以催化高锰酸钾滴定,但反应初期产生的Mn2+很少,所以通过加热来增加反应速率
你后面的问题我也不清楚,我高中化学竞赛时做过这个实验,高锰酸钾滴定时开始红色在短时间内并不退色,稍微加加热,红色逐渐退去,反应一会儿后再滴高锰酸钾溶液红色便立即退去,因为反应生成的Mn2+对反应有催化作用.1年前查看全部
- 用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度
用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度
用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度实验步骤:准确称取2.0gNa2C2O4固体,配成100 mL溶液,取出20.00mL于锥形瓶中.再向瓶中加人足量稀H2SO4 ,用0.0160mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
计算时体积为什么是100/20 而不是20/100呢 不是从100ml里取了20ml么 求详解 一直很纠结 天空中的飞燕1年前1
天空中的飞燕1年前1 -
 心草心心 共回答了30个问题
心草心心 共回答了30个问题 |采纳率86.7%因为浓度和你取的体积无关,这是很容易出错的地方.1年前查看全部
- (1)用Na2C2O4标定KMnO4溶液浓度时,指示剂是?(2)在高锰酸钾法中,调节酸度使用的酸是?(3)间接碘量法中,
(1)用Na2C2O4标定KMnO4溶液浓度时,指示剂是?(2)在高锰酸钾法中,调节酸度使用的酸是?(3)间接碘量法中,应选择的指示剂和加入时间是?
 yzkelvin1年前1
yzkelvin1年前1 -
 你是够 共回答了19个问题
你是够 共回答了19个问题 |采纳率100%答:
【1】用Na2C2O4标定KMnO4溶液浓度时,指示剂是 ”高锰酸钾“
【2】采用硫酸进行酸化;
【3】间接碘量法中,应选择的指示剂是淀粉溶液;加入时间是在临近滴定终点前加入.1年前查看全部
- 硫酸酸化的Na2C2O4生成什么(化学方程式)
硫酸酸化的Na2C2O4生成什么(化学方程式)
是和高锰酸钾反应 kpjx011年前3
kpjx011年前3 -
 jackalkilu 共回答了14个问题
jackalkilu 共回答了14个问题 |采纳率85.7%草酸钠和酸性高锰酸钾反应,生成二氧化碳和二价锰离子(硫酸的作用就是使反应在酸性条件下进行)
就是氧化还原反应
5C2O4(2-)+2MnO4(-)+16H(+)=10CO2+2Mn(2+)+8H2O1年前查看全部
- 用Na2C2O4(A)标定KMnO4(B)时,其反应系数之间的关系为(
用Na2C2O4(A)标定KMnO4(B)时,其反应系数之间的关系为(
A.nA = 5/2 nB B.nA = 2/5 nBC.nA = 1/2 nB D.nA = 1/5 nB 仲夏的素儿1年前1
仲夏的素儿1年前1 -
 yhb2006 共回答了19个问题
yhb2006 共回答了19个问题 |采纳率78.9%5Na2C2O4+2KMnO4+8H2SO4=K2SO4 +2MnSO4 +5 Na2SO4 +10CO2 +8H2O
答案为A1年前查看全部
- 已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓
已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mol•L-1,则生成沉淀所需Na2C2O4溶液的最小起始浓度为( )
A.2.3×10-7mol•L-1
B.4.6×10-7mol•L-1
C.9.2×10-7mol•L-1
D.
×10-3mol•L-123  luo14371年前1
luo14371年前1 -
 风中的燕子 共回答了11个问题
风中的燕子 共回答了11个问题 |采纳率100%解题思路:根据Ksp(CaC2O4)=c(C2O42-)×c(Ca2+)计算.一定温度下溶度积是常数;CaCl2溶液的浓度为1×10-2mol/L,等体积混合后浓度为5×10-3mol/L,
由Ksp(CaC2O4)=c(C2O42-)×c(Ca2+)可知,混合后c(C2O42-)=
Ksp
C(Ca2+)=
2.3×10−9
5×10−3=4.6×10-7mol•L-1
所以所需Na2C2O4溶液的最小起始浓度为4.6×10-7mol•L-1×2=9.2×10-7mol/L;
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了难溶电解质的沉淀溶解平衡的计算,溶液等体积混合是解题注意的关键.1年前查看全部
- 用Na2C2O4标准溶液标定KnMO4时 应该注意控制哪些条件?
用Na2C2O4标准溶液标定KnMO4时 应该注意控制哪些条件?
有助于回答者给出准确的答案 xt123c1年前2
xt123c1年前2 -
 爱上酷子的女人 共回答了14个问题
爱上酷子的女人 共回答了14个问题 |采纳率92.9%1.酸度控制在0.5-1mol/L,若酸度过低KMnO4易分解为MnO2,酸度过高,H2C2O4易分解
2.温度控制在70-85摄氏度,温度过低,反应速率慢,温度过高H2C2O4分解
3.滴定速度不宜太快,否则加入的KMnO4溶液来不及与C2O42-反应,即在热的酸性溶液中分解1年前查看全部
- NA2C2O4标定KMNO4应在什么温度下进行,温度过高或低有什么影响
 仙人指路3151年前1
仙人指路3151年前1 -
 zhangwow01 共回答了13个问题
zhangwow01 共回答了13个问题 |采纳率69.2%室温. 温度高或低一点儿影响不大.1年前查看全部
- 死到分析化学题求解!所有的题都需要详细解答过程!1.用NA2C2O4作为基准物标定HCl溶液的浓度.若用甲基橙作为指示剂
死到分析化学题求解!
所有的题都需要详细解答过程!
1.用NA2C2O4作为基准物标定HCl溶液的浓度.若用甲基橙作为指示剂,称取NA2C2O4 0.3524g用去HCl溶液25.49ml,求HCl的浓度.
2用凯氏法测定氮的含量.称取式样1.026g,缠身的NH3用H3BO3吸收用甲基红作为指示剂,用HCl同业(0.1002mol/L)滴定,用去HCl溶液22.85ml,求式样中氮的含量.
3.取50.00ml H2SO4溶液(0.05505mol/L),溶解氧化锌0.1g,过量的H2SO4用NaOH溶液(0.12mol/L)滴定,消耗NaOH溶液25.50ml,求氧化锌的百分含量.
4称取干燥Al(OH)3凝胶0.3896g于250ml容量品中,溶解后吸取25.00ml,精密加入0.05mol/L的EDTA液25ml,过量的edta液用0.05mol/L标准锌溶液反滴,用去15.02ml,求样品中Al2O3的含量.(MAl2O3=101.94) j583641年前3
j583641年前3 -
 rr若比邻-是吗 共回答了19个问题
rr若比邻-是吗 共回答了19个问题 |采纳率89.5%1.用NA2C2O4作为基准物标定HCl溶液的浓度.若用甲基橙作为指示剂,称取NA2C2O4 0.3524g用去HCl溶液25.49ml,求HCl的浓度.
草酸有两个滴定终点,一个在pH=3-4处,另一个在pH>6的地方.甲基橙变色范围大约在pH=4-5.所以用甲基橙做指示剂,HCl为标液能滴到终点在pH=3-4处.
C2O42- + 2H+ ---> H2C2O4
Na2C2O4摩尔=0.3524/134= 0.00263 摩尔 ==〉0.00526 摩尔HCl
[HCl]=0.00526/0.02549=0.0958 M
2.N摩尔=0.1002 x 0.02285 = 0.002290 ==>N重量=0.03205 克
氮的含量=0.03205/1.026= 0.03124 =3.124%
3.氧化锌重量 =(50.00x0.05505-25.50x0.12/2)x81.39/1000=0.0995 克
氧化锌的百分含量=0.0995/0.1=99.5%
4.Zn摩尔=(0.05x25-0.05x15.02)x10/1000=0.00499 摩尔
样品中Al2O3的含量=0.00499x101.94/2x0.3896=65.3%1年前查看全部
- 草酸钠(Na2C2O4)溶液和硫酸钙发生复分解反应的化学方程式
 transtent1年前2
transtent1年前2 -
 zlpwater 共回答了18个问题
zlpwater 共回答了18个问题 |采纳率88.9%Na2C2O4+CaSO4=CaC2O4↓+Na2SO41年前查看全部
- 用20ml锰酸钾溶液,恰能氧化0.15g的Na2C2O4,试计算锰酸钾溶液的浓度为多少?
用20ml锰酸钾溶液,恰能氧化0.15g的Na2C2O4,试计算锰酸钾溶液的浓度为多少?
详细一点 海上渔夫1年前1
海上渔夫1年前1 -
 phoebe福柏 共回答了17个问题
phoebe福柏 共回答了17个问题 |采纳率94.1%草酸根中碳元素从+3价变为+4价,总共升高2价,猛从+6降到+2降了4价,又草酸钠0.15g那么其物质的量为0.00112mol,所以转移电子数0.00224mol所以需要锰酸钾物质的量为0.00056mol所以其浓度为0.00056mol/0.02L=0.028mol/L1年前查看全部
- Ⅰ.实验室称取0.867g草酸钠(Na2C2O4,式量为134),溶解于水,加入一定量硫酸,用未知浓度的KMnO4溶液滴
Ⅰ.实验室称取0.867g草酸钠(Na2C2O4,式量为134),溶解于水,加入一定量硫酸,用未知浓度的KMnO4溶液滴定,用去KMnO4溶液22.50mL,反应式如下(未配平):MnO4-+C2O42-+H+→Mn2++CO2+H2O.则装KMnO4的滴定管是______(填“酸式”或“碱式”); KMnO4溶液的浓度是______mol/L.
Ⅱ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)⇌N(g)+H2(g)
①该反应的平衡常数为______.该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正______V逆(填“>”、“<”或“=”)起始n(M):n(H2O) M转化率 H2O转化率 1:1 0.5 0.5 1:2 0.67 0.33 1:3 0.75 0.25
②结合表中数据,判断下列说法中正确的是______.
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的量之比为1:4时,M的转化率为0.85
③该温度下,向容器中充入2molM、2mol H2O,当达平衡时放出a KJ热量,则该反应的△H=______. 儋州歌调1年前1
儋州歌调1年前1 -
 摇曳透明 共回答了20个问题
摇曳透明 共回答了20个问题 |采纳率95%解题思路:Ⅰ.酸性高锰酸钾可腐蚀橡胶管,由电子守恒可知2MnO4-~5C2O42-,以此计算;
Ⅱ.①利用1:1时转化率为0.5,可知平衡时各物质浓度相同,K=
;再利用Qc、K的关系判断反应方向;c(N)c(H2) c(M)c(H2O)
②初始量之比等于化学计量数之比时转化率相同,增大某反应物的量,必定增大另一反应物的转化率,以此解答;
③2molM、2mol H2O,当达平衡时放出a KJ热量,即转化率为0.5,反应1molM放出akJ的热量.Ⅰ.酸性高锰酸钾可腐蚀橡胶管,则应盛放在酸式滴定管中,由电子守恒可知2MnO4-~5C2O42-,n(Na2C2O4)=[0.867g/134g/mol]=0.0065mol,KMnO4溶液的浓度是
0.0065×
2
5mol
0.0225L=0.115(或0.12)mol/L,故答案为:酸式;0.115(或0.12);
Ⅱ.①由1:1时转化率为0.5,可知起始量相同,平衡时各物质浓度相同,K=
c(N)c(H2)
c(M)c(H2O)=1;由Qc=[2×1.5/1×3]=1=K,则平衡不移动,即V正=V逆,
故答案为:1;=;
②A.增加H2O(g)的量,促进M的转化,则M的转化率升高而H2O(g)的总物质的量增大,其转化率降低,故A正确;
B.若M与H2O(g)的转化率相同时,化学计量数相同,所以二者的初始投入量一定相同,故B正确;
C.由表格中后两组数据可知,M和H2O(g)初始物质的量之比不一定等于二者转化率之比,故C错误;
D.当M与H2O(g)物质的量之比为1:4时,
M(g)+H2O(g)⇌N(g)+H2(g)
开始 n 4n 0 0
转化x x x x
平衡n-x n-x xx
x×x
(n−x)×(4n−x)=1,解得x=0.8n,M的转化率为0.8,故D错误,
故答案为:AB;
③2molM、2mol H2O,当达平衡时放出a KJ热量,即转化率为0.5,反应1molM放出akJ的热量,即该反应的△H=-akJ/mol,故答案为:-aKJ/mol.点评:
本题考点: 氧化还原反应的计算;反应热和焓变;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考查氧化还原反应的计算及化学平衡的计算,为高频考点,侧重学生分析能力和计算能力的考查,注意电子守恒及化学平衡常数K的计算与应用,题目难度中等.1年前查看全部
- 用电位测定法以0.1 mol·L-1 AgNO3溶液滴定含有Na2C2O4和NaI的混合物样品,以银电极为指示电极,加入
用电位测定法以0.1 mol·L-1 AgNO3溶液滴定含有Na2C2O4和NaI的混合物样品,以银电极为指示电极,加入10 mL
加入10 mL AgNO3溶液后,达第一等当点;加入20 mL AgNO3溶液后.达第二等当点.然后,再取一份与第一份完全相同的混合物样品,向其中加入8×10-2 mol·L-1 KMnO4溶液10 mL,0.66 mol·L-1 H2SO410 mL,稀释至100 mL,插入铂电极和饱和甘汞电极(SCE)
(1)计算在两个等当点处银电极的电极电位;
(2)计算由铂电极和饱和甘汞电极(SCE)组成的电池的电动势.
(已知:Ag2C2O4、AgI的溶度积Ksp分别为10-11、10-16;电极的标准电位:E0Ag+/Ag= 0.799 V E0Mno4-/Mn2+ = 1.51 V ESCE = 0.248 V) xooxman1年前1
xooxman1年前1 -
 bbs23824511 共回答了26个问题
bbs23824511 共回答了26个问题 |采纳率84.6%【解析】:(1)第一等当点对应于碘化物被沉淀:
[Ag+] = [I-] = = 10-8 mol·L-1
根据奈斯特方程:
E = E0(Ag+/Ag)+ 0.0591 lg[Ag+]
= 0.799 + 0.0591 lg10-8 = 0.327 V
第二等当点对应于C2O42-离子被沉淀:
Ag2C2O4 = 2Ag+ + C2O42-
设 [C2O42-] = x ,则 [Ag+] = 2x
Ksp(Ag2C2O4)= [Ag+]2[ C2O42-]
= (2x)2·x = 10-11
x = (10-11)1/3 = 1.357 × 10-4 mol·L-1
[Ag+] = 2x
= 2.714 × 10-4 mol·L-1
E = E0Ag+/Ag+ 0.0591 lg[Ag+]
= 0.799 + 0.0519 lg(2.714× 10-4) = 0.589 V
(2)混合溶液未反应前:
nI- = 0.1×10 ×10-3 = 10-3 mol
nC2O42- = 1/2(0.1×10×10-3 )= 5×10-4 mol
nMnO4- = 8×10-2×10×10-3 = 8×10-4 mol
nH+ = 0.66×2×10×10-3 =1.32×10-2 mol
5I- + Mn O4- + 8H+ = 5/2I2 + Mn2+ + 4H2O
5 C2O42-+ 2MnO4-+16H+ = 10CO2 + 2Mn2+ + 8H2O
此反应中5×10-4 mol C2O42- 需2×10-4 mol MnO4-和1.6×10-3 mol H+,有2×10-4 mol Mn2+ 生成.以上两反应共消耗4×10-4 mol MnO4-和3.2×10-3 mol H+.共有4×10-4 mol Mn 2+生成,因剩余的MnO4-物质的量为8×10-4 - 4×10-4 = 4×10-4 mol,剩余H+物质的量为1.32×10-2 -3.2×10-2 = 1×10-2 mol.
反应完成后:
[MnO4-] = [Mn2+] = 4×10-4/100×10-3= 4 ×10-3 mol·L-1
[H+] = 1×10-2/100×10-3 = 0.1 mol·L-1
E = E0(MnO4-/Mn2+) + 0.0591/5lg(0.1)8 = 1.416 V
Emf = E -ESCE = 1.416 - 0.248 = 1.168 V1年前查看全部
- 谁知道KMnO4与热的经硫酸酸化的Na2C2O4的方程式.
 huyixin5091年前1
huyixin5091年前1 -
 猴子的开始 共回答了14个问题
猴子的开始 共回答了14个问题 |采纳率78.6%KMnO4 + Na2C2O4 + H2SO4 = MnSO4 + K2SO4 + Na2SO4 + CO2 + H2O
KMnO4 Mn +7 —— +2(KMnO4在酸性条件下一般被还原为+2Mn) 降5
Na2C2O4 C +3 —— +4 升1x 2
最小公倍数为10 配平得
2KMnO4 + 5Na2C2O4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 10CO2 + 8H2O
检查原子守恒1年前查看全部
- 化学ki中加入fecl3再加入na2c2o4
化学ki中加入fecl3再加入na2c2o4
写出现象及方程式 沙沙蟹1年前1
沙沙蟹1年前1 -
 猫猫moon 共回答了24个问题
猫猫moon 共回答了24个问题 |采纳率91.7%2KI+2FeCl3=I2+2FeCl2+2KCl,现象:溶液由无色变为棕黄色(亚铁离子和碘的水溶液颜色)
加入草酸钠:I2+Na2C2O4=2NaI+2CO2,现象:溶液变成绿色(上一步生成亚铁离子的颜色)1年前查看全部
- 测定未知液中Ca2+含量时,用Na2C2O4溶液做沉淀剂比同浓度的Na2CO3好
测定未知液中Ca2+含量时,用Na2C2O4溶液做沉淀剂比同浓度的Na2CO3好
为什么? livingblithely1年前2
livingblithely1年前2 -
 qaz159753 共回答了15个问题
qaz159753 共回答了15个问题 |采纳率86.7%是的
草酸钙的沉淀溶解常数(溶积数)比较小,Ksp比较小
能溶解在溶液中的草酸钙含量特别低,所以比较精确
碳酸钙的Ksp比较大,钙离子在溶液中的残留明显1年前查看全部
- 高锰酸钾和Na2C2O4在硫酸酸化下反应的化学方程式
 shan20001年前1
shan20001年前1 -
 greenorangecat 共回答了15个问题
greenorangecat 共回答了15个问题 |采纳率100%高锰酸根在硫酸(不能是HCL因为高锰酸根可以将CL-氧化为CL2)提供的酸性环境下具有强的氧化性,而草酸根有还原性,二者在一起会发生氧化还原反应,分别变成锰离子和二氧化碳.
离子方程式为:2MnO4- + 5C2O42- +16H +==2Mn2+ + 10CO2 +8H2O1年前查看全部
- 用Na2C2O4作基准物质,进行标定高锰酸钾浓度所用的公式
用Na2C2O4作基准物质,进行标定高锰酸钾浓度所用的公式
怎么算的 李小松1年前1
李小松1年前1 -
 hezhewu 共回答了22个问题
hezhewu 共回答了22个问题 |采纳率100%高锰酸钾滴定液的浓度C(mol/L)按下式计算:
C(mol/L)=Ms/(V *0.335)
式中:Ms:基准草酸钠的称取量(g);
V:滴定所耗高锰酸钾滴定液的体积(ml);
0.335:每1ml的高锰酸钾滴定液(1.000mol/L)相当的以g表示的草酸钠的质量.1年前查看全部
- 在氯化钡溶液中滴加草酸钠溶液在BaCl2溶液中滴加Na2C2O4(草酸钠)溶液,产生白色沉淀,在白色沉淀中加入盐酸,沉淀
在氯化钡溶液中滴加草酸钠溶液
在BaCl2溶液中滴加Na2C2O4(草酸钠)溶液,产生白色沉淀,在白色沉淀中加入盐酸,沉淀溶解.
1、试用离子方程式和有关平衡知识解释.
2、根据上述判断,可得出盐跟酸反应的一种规律是? 2474241年前1
2474241年前1 -
 涩橄榄的爱 共回答了16个问题
涩橄榄的爱 共回答了16个问题 |采纳率87.5%Ba2+ +C2O42-==BaC2O4
BaC2O4+2H+==Ba2+ +H2C2O4
草酸钡与盐酸反应生成弱电解质草酸使反应能够完成,同时破坏草酸钡溶解平衡,使其不断溶解,不断反应.符合强酸制弱酸规律.1年前查看全部
- [分析化学]Na2C2O4能否作为滴定酸的基准物?为什么?
[分析化学]Na2C2O4能否作为滴定酸的基准物?为什么?
大学分析化学实验,酸碱滴定 藕叫狗狗1年前1
藕叫狗狗1年前1 -
 人情冷暖63 共回答了16个问题
人情冷暖63 共回答了16个问题 |采纳率93.8%Na2C2O4晶体可以作为滴定酸的基准物.
它比较稳定,是一种碱性物质.1年前查看全部
大家在问
- 1有一个小灯泡上标有“4V 2W”的字样,现在要用伏安法描绘这个灯泡的伏安特性曲线,有下列器材供选用
- 2小半圆半径3分米,阴影部分占小半圆的五分之一,占大半圆的十分之一,大半圆面积?
- 30.1 mol氯气的质量与0.1NA个氯气分子的质量相等
- 4在△ABC中,O为外心,∠A=92°,则∠BOC的度数为: (
- 5安徽生物竞赛考题济南植物园中有一个用透明玻璃围成的热带植物馆,该馆内除了生长着一些热带植物 外,还有少量的以这些植物为食
- 6求圆的方程式求直径两端为 A(-4,0) B(0,2) 的圆的方程式
- 7季羡林的 《怀念母亲》的段落 并填空
- 8轮船顺流航行时m千米/小时,逆流航行时(m-6)千米/小时,求水流速度是多少?
- 9初中英语题,求正解.解释~!1.____that pair of ___ a little cheaper? A.Is;
- 10做一道连线题夜不能寐 渴望 直把杭州作卞州望眼欲穿 思念 忽闻岸上踏歌声满腔愤慨 感动 但悲不见九州同喜出望外 失望 明
- 11蝌蚪和青蛙在形态上有哪些主要的区别?
- 12第三义务教育课程标准试验教科书数学八年级下册第六章习题6.3 第三题
- 13已知抛物线y^2=2px(p>0),准线l与x轴交与N点过焦点F作直线与抛物线交与A(x1,y1) B(x2,y2
- 14四位中国古代科学家?
- 15氢氧化钠变质后的白色固体的成分可能是?急求,谢了

