自发反应举例 熵增加本人希望了解\涉猎在常温(最好常压)下进行的吸热的自发反应方程式.不要点燃或加热的,更不要给些氨盐的
 zhuzhu1981ii_re2022-10-04 11:39:541条回答
zhuzhu1981ii_re2022-10-04 11:39:541条回答本人希望了解涉猎在常温(最好常压)下进行的吸热的自发反应方程式.不要点燃或加热的,更不要给些氨盐的方程.我要高级点的,最好是大学的.越多越好
刚说错了,点燃是放热的噢,我是指不是H2,C0做还原剂的反应

已提交,审核后显示!提交回复
共1条回复
 zgtlp 共回答了19个问题
zgtlp 共回答了19个问题 |采纳率89.5%- 这方面的书很多,真想学就买本书看看,边学边做. 遇到实际问题再来问我.
- 1年前
相关推荐
- 下列反应在任何温度下均能自发进行的是( )
下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1
B.Ag(s)+[1/2]Cl2(g)═AgCl(s)△H=-127 kJ•mol-1
C.HgO(s)═Hg(l)+[1/2]O2(g)△H=+91 kJ•mol-1
D.H2O2(l)═[1/2]O2(g)+H2O(l)△H=-98 kJ•mol-1 企鹅宝宝881年前1
企鹅宝宝881年前1 -
 善良的双鱼 共回答了23个问题
善良的双鱼 共回答了23个问题 |采纳率87%解题思路:反应自发进行的判断依据是:△H-T△S<0;分析选项是否符合要求.A、反应是吸热反应△H>0,△S<0,△H-T△S>0,任何温度下不能自发进行,故A错误;
B、反应是放热反应△H<0,△S<0,高温下不能自发进行,故B错误;
C、反应是吸热反应△H>0,△S>0,低温下不能自发进行,故C错误;
D、反应是放热反应△H<0,△S>0,△H-T△S<0,任何温度下都能自发进行,故D正确;
故选:D.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的判断依据应用,注意反应自发进行的判断由焓变、熵变、温度共同决定,题目较简单.1年前查看全部
- 放射性元素能自发地放出射线,变成别的元素,同时伴随核能的释放.下列表述中正确的是( )
放射性元素能自发地放出射线,变成别的元素,同时伴随核能的释放.下列表述中正确的是( )
A.α、β、γ三种射线都是电磁波
B.在α、β、γ三种射线中电离能力最弱的是α射线
C.太阳辐射的能量是由轻核聚变产生的
D.将放射性元素掺杂到其他稳定元素中并大幅度降低其温度,它的半衰期不发生改变 孙维前男友1年前1
孙维前男友1年前1 -
 明月松间0 共回答了25个问题
明月松间0 共回答了25个问题 |采纳率88%解题思路:α射线是氦核流,β射线是电子流,γ射线是电磁波,三种射线,α射线的电离能力最强,穿透能力最弱,γ射线的穿透能力最强,电离能力最弱.A、射线是氦核流,β射线是电子流,γ射线是电磁波.故A错误.
B、三种射线中,α射线的电离能力最强.故B错误.
C、太阳辐射的能量由轻核聚变产生.故C正确.
D、半衰期的大小由原子核内部因素决定,与温度、压强以及所处的化学状态无关.故D正确.
故选CD.点评:
本题考点: 原子核衰变及半衰期、衰变速度.
考点点评: 解决本题的关键知道三种射线的实质,以及三种射线的特点,知道影响半衰期的因素.1年前查看全部
- 已知氧化性:Cl2>Br2>Fe3+>I2;还原性:I->Fe2+>Br->Cl-.下列反应能正向自发进行的是( )
已知氧化性:Cl2>Br2>Fe3+>I2;还原性:I->Fe2+>Br->Cl-.下列反应能正向自发进行的是( )
A.Br2+2Fe2+=2Fe3++2Br-
B.2Fe3++2I-=2Fe2++I2
C.I2+2Fe2+=2Fe3++2I-
D.2Fe3++2Cl-=2Fe2++Cl2 DJnum11年前1
DJnum11年前1 -
 伊人平凡 共回答了8个问题
伊人平凡 共回答了8个问题 |采纳率100%解题思路:在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,根据物质的性质分析解答.A、该反应中氧化剂是溴,氧化产物是铁离子,氧化性强弱顺序是Br2>Fe3+,与已知符合,所以该反应能发生,故A正确;
B.该反应中氧化剂是铁离子,氧化产物是碘,氧化性强弱顺序是Fe3+>I2,与已知相符合,所以该反应能发生,故B正确;
C、该反应中氧化剂是碘,氧化产物是铁离子,氧化性强弱顺序是I2>Fe3+,与已知不符合,所以该反应不能发生,故C错误;
D、该反应中氧化剂是铁离子,氧化产物是氯气,氧化性强弱顺序是Cl2>Fe3+,与已知不符合,所以该反应不能发生,故D错误;
故选:AB.点评:
本题考点: 氧化性、还原性强弱的比较.
考点点评: 本题考查了氧化性、还原性强弱,明确氧化性和还原性强弱的判断方法即可解答,难度不大.1年前查看全部
- 耦合反应是否万能?利用耦合反应,是不是对于任何不能自发的反应都可以转变成为自发?请举例说明.
 douzino11年前1
douzino11年前1 -
 力大如牛 共回答了17个问题
力大如牛 共回答了17个问题 |采纳率82.4%应该不能 确实利用耦合反应可以使不能自发的反应能够反应,比如TiO2 + 2Cl2 + 2C===TiCl4 + 2CO 但这不能表明该反应自发进行,还需要很高的条件,高温等等1年前查看全部
- 一道经济学的题目,假定某一经济中,自发消费为100,边际消费倾向是0.8;投资是50;政府购买为200;政府转移支付是6
一道经济学的题目,
假定某一经济中,自发消费为100,边际消费倾向是0.8;投资是50;政府购买为200;政府转移支付是62.5;税率是0.25,(单位:亿美元)求:
(1)如果实际收入是2000亿美元,国民收入核算恒等式如何?经济如何调整?调整结果如何?
(2)调整之后的政府预算节余是多少?
(3)当政府减少购买10亿美元时,均衡收入水平是多少?
(4)如果充分就业的收入水平为2000亿美元,政府应该采取什么措施?
(5)如果政府决定削弱转移支付,同时增加等量的政府购买,均衡收入水平是增加、减少还是不变? 旋2071年前1
旋2071年前1 -
 蔑视一切怀疑者 共回答了24个问题
蔑视一切怀疑者 共回答了24个问题 |采纳率91.7%最后一题,是增加了1年前查看全部
- 下列说法不正确的是 [ ] A.自发反应在恰当条件下才能实现
下列说法不正确的是 [ ]A.自发反应在恰当条件下才能实现
B.升高温度,活化分子百分数增大,化学反应速率一定增大
C.所有的化学反应都有能量变化
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率,从而提高反应物的转化率 书生WJB1年前1
书生WJB1年前1 -
 威客信息 共回答了17个问题
威客信息 共回答了17个问题 |采纳率82.4%D1年前查看全部
- 某反应其△H="=" -122 kJ/mol,∆S="=" 231 J/(mol·K),则此反应在下列哪种情况下可自发进
某反应其△H="=" -122 kJ/mol,∆S="=" 231 J/(mol·K),则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行 C.仅在高温下自发进行 D.仅在低温下自发进行  重庆英语5271年前1
重庆英语5271年前1 -
 优诺八八 共回答了22个问题
优诺八八 共回答了22个问题 |采纳率86.4%A
1年前查看全部
- 下列有关说法正确的是 [ ] A.所有氧化还原反应都能自发进行
下列有关说法正确的是 [ ]A.所有氧化还原反应都能自发进行
B.Fe(NO 3 ) 2 溶液中加入硝酸,可以抑制二价铁离子水解
C.稀硝酸和稀硫酸都有氧化性,起作用的微粒相同
D.若用湿润的pH试纸测定某溶液的pH,测定结果也可能正确 cys02271年前1
cys02271年前1 -
 lixiao_0806 共回答了12个问题
lixiao_0806 共回答了12个问题 |采纳率100%D1年前查看全部
- 物理学中有个什么理论的说是能量总是自发的朝能量低的方向转移
物理学中有个什么理论的说是能量总是自发的朝能量低的方向转移
具体是怎么说的,是什么理论来着,好像是高中就学过的了~ wzf938251年前4
wzf938251年前4 -
 沙漠_孤狼 共回答了13个问题
沙漠_孤狼 共回答了13个问题 |采纳率84.6%热力学第二定律 一种表述是:不可能使热量从低温物体传递到高温物体,而不引起其他变化,这是按热传导的方向性来描述的.另一种表述是:不可能从单一热源吸收热量并把他全部用来做功,而不引起其它变化.这是按照机械能与内能转化过程的方向性来表述的.它也可以表述为:第二类永动机是不可能制成的1年前查看全部
- 关于自发反应..为什么高温石灰石分解成生石灰和二氧化碳是自发反应?而高温高压下可以使石墨转化成金刚石是非自发反应?(高温
关于自发反应..
为什么高温石灰石分解成生石灰和二氧化碳是自发反应?而高温高压下可以使石墨转化成金刚石是非自发反应?(高温高压不是做功了吗?) weixb_84121年前3
weixb_84121年前3 -
 水12345 共回答了18个问题
水12345 共回答了18个问题 |采纳率88.9%区分自发反应是标准吉布斯能是否大于0,如果△G0,则反应不可以自发进行.根据△G=△H-T△S,高温高压下石墨转化成金刚石这个反应,△H项大于T△S,故反应不可以自发进行.1年前查看全部
- 自发进行的反应一定是( )A. 吸热反应B. 放热反应C. 熵增加反应D. 熵增加或者放热反应
 未激活1641年前2
未激活1641年前2 -
 zengsean 共回答了16个问题
zengsean 共回答了16个问题 |采纳率93.8%解题思路:自发进行的反应符合△H-T△S<0,依据判断依据分析选项;反应自发进行需要焓变、熵变、温度共同决定.A、吸热反应△H>0,若△S<0,反应一定是非自发进行的反应,故A不符合;
B、放热反应△H<0,若△S>0,高温可能非自发反应,故B不符合;
C、熵增加反应,放热反应△H<0,若△S>0,高温可能非自发反应,故C不符合;
D、熵增加或者放热反应,△S>0,△H<0,△H-T△S<0,故D符合;
故选:D.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的判断依据,反应焓变、熵变、温度共同决定反应是否自发进行,题目较简单.1年前查看全部
- 什么是自发反应无需外界帮助.外界帮助指什么?
 聊林盟主聊天天1年前2
聊林盟主聊天天1年前2 -
 西北浪子2006 共回答了20个问题
西北浪子2006 共回答了20个问题 |采纳率90%在给定的条件下,无需外界帮助,一经引发即能自动进行的过程或反应,称为自发反应.
可用吉布斯自由能变△G=△H-T△S 判断:如果△G1年前查看全部
- 求教燃料电池的反应原理一般电池的反应都是自发的氧化还原,可是燃料电池跟这个没什么关系啊,我不明白燃料电池的反应机理,哪位
求教燃料电池的反应原理
一般电池的反应都是自发的氧化还原,可是燃料电池跟这个没什么关系啊,我不明白燃料电池的反应机理,哪位高手可以给我讲一下:
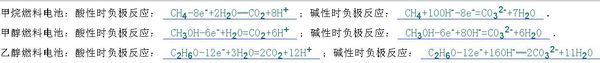
酸性时为什么失电子还要加个水上去?
 kk男孩991年前1
kk男孩991年前1 -
 kimi661O 共回答了21个问题
kimi661O 共回答了21个问题 |采纳率100%燃料电池电极判断很简单1、通入燃料的作负极,助燃剂是正极2、总反应方程式与燃料的燃烧反应类似(不需要点燃)写电极方程式时要考虑产物与电解质是否反应,这个题目的负极写法比较复杂,告诉你一个技巧先写总反应方程...1年前查看全部
- 水结成冰是非自发的!那请问它需要借助什么外力呢?非自发过程是必须借助于外力才能进行的.
 eswsgg1年前1
eswsgg1年前1 -
 rock_68 共回答了19个问题
rock_68 共回答了19个问题 |采纳率89.5%温度到冰点以下1年前查看全部
- 今年春季不少地区爆发“非典”灾害,人民财产损失惨重.很多师生自发地给灾区人民献爱心.某校师生捐款购买了大量消毒液,分别装
今年春季不少地区爆发“非典”灾害,人民财产损失惨重.很多师生自发地给灾区人民献爱心.某校师生捐款购买了大量消毒液,分别装入大小相同的包装箱中,若每箱装25瓶,则余40瓶无处可装,若每箱装40瓶,又余20只空箱.若每瓶消毒液卖12.5元,则该校共捐了多少元?
 qlian1年前3
qlian1年前3 -
 指尖上的阳光 共回答了21个问题
指尖上的阳光 共回答了21个问题 |采纳率100%解题思路:要求该校共捐了多少元,需要知道购买了多少消毒液,可设共有x个包装箱,根据题意列出一元一次方程解答即可求出包装箱的数量,再求出消毒液的瓶数,最后乘以消毒液的单价即可解答.设共有x个包装箱,根据题意得
25x+40=40(x-20),
解得x=56,
56×25+40=1440瓶,
1440×12.5=18000元.
答:该校共捐了18000元.点评:
本题考点: 一元一次方程的应用.
考点点评: 此题考查的知识点是一元一次方程的应用,弄清题意,找出等量关系是解答本题的关键.1年前查看全部
- 当利率水平下降时,自发总支出增加/减少,IS曲线左移/右移?
当利率水平下降时,自发总支出增加/减少,IS曲线左移/右移?
5、当利率水平下降时()
a.自发总支出减少,IS曲线向右方移动
b.自发总支出减少,IS曲线向左方移动
c.自发总支出增加,IS曲线向左方移动
d.自发总支出增加,IS曲线向右方移动
 我又回到人间1年前1
我又回到人间1年前1 -
 做人与做文 共回答了13个问题
做人与做文 共回答了13个问题 |采纳率84.6%利率下降,投资支出会增加,因此自发总支出增加,IS曲线向右移动.因此选D1年前查看全部
- 室温下只要放热过程都能自发进行.为什么不对?常温下...
室温下只要放热过程都能自发进行.为什么不对?常温下...
室温下只要放热过程都能自发进行.为什么不对?
常温下放热反应焓变决定性作用 此时焓变<0所以应该对啊 snowfoxlai1年前1
snowfoxlai1年前1 -
 wht016 共回答了29个问题
wht016 共回答了29个问题 |采纳率89.7%不能只看焓变,反应能否自发进行要用活化能判断,焓变△H<0时,如果熵变为正值,则自由能△G=△S+△H可能大于0,这时反应不一定能自发进行.楼上说的火柴就算一个例子1年前查看全部
- (2009•江门二模)一群氢原子处于n=4的激发态,当它们自发地跃迁到较低的能级时,下列判断错误的是( )
(2009•江门二模)一群氢原子处于n=4的激发态,当它们自发地跃迁到较低的能级时,下列判断错误的是( )
A.可能辐射出六种不同频率的光子
B.从n=4的能级直接跃迁到n=1的能级时释放出的光子频率最低
C.从n=4的能级跃迁到n=3的能级时释放出的光子频率最低
D.从n=2的能级跃迁到n=1的能级时,释放出的光子波长最长 nature701年前1
nature701年前1 -
 泡沫鱼 共回答了19个问题
泡沫鱼 共回答了19个问题 |采纳率89.5%解题思路:氢原子能级间跃迁时辐射的光子能量等于两能级间的能级差,能级差越大,则辐射的光子频率越大,波长越小.A、根据数学组合公式
C24=6知,可能放出6种不同频率的光子.故A正确.
B、由n=4跃迁到n=1能级辐射的光子能量最大,频率最大.故B错误.
C、从n=4跃迁到n=3能级辐射的光子能量最小,频率最低,波长最长.故C正确,D错误.
本题选错误的,故选BD.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键掌握能级间跃迁所遵循的规律,即Em−En=hv=hcλ.1年前查看全部
- 下列说法正确的是( )A.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H>0B.A
下列说法正确的是( )
A.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H>0
B.Al2(SO4)3溶液蒸干所得固体产物为Al(OH)3
C.电解NH4Cl和HCl混合溶液可在阴极生成NCl3
D.等体积AgCl、AgI饱和清液混合后加入足量AgNO3固体,生成沉淀物质的量:n(AgCl)>n(AgI) 平淡认真生活1年前1
平淡认真生活1年前1 -
 梦梦蓝皮鼠 共回答了18个问题
梦梦蓝皮鼠 共回答了18个问题 |采纳率88.9%解题思路:A、反应自发进行的判断依据是△H-T△S<0;反应2Na2SO3(s)+O2(g)=2Na2SO4(s)的△S<0;
B、硫酸铝溶液水解生成氢氧化铝和硫酸,蒸干是蒸发水,溶液中硫酸是难挥发性酸;
C、电解原理是惰性电极电解,溶液中阳离子移向阴极得到电子发生还原反应,阴离子移向阳极失电子反应氧化反应;
D、氯化银溶解度大于碘化银溶解度,沉淀溶解平衡状态下银离子浓度大.解;A、反应自发进行的判断依据是△H-T△S<0;反应2Na2SO3(s)+O2(g)=2Na2SO4(s)的△S<0;sy△H<0,故A错误;
B、硫酸铝溶液水解生成氢氧化铝和硫酸,蒸干是蒸发水,溶液中硫酸是难挥发性酸,所以蒸干得到固体为硫酸铝,故B错误;
C、电解原理是惰性电极电解,溶液中阳离子移向阴极得到电子发生还原反应,阴离子移向阳极失电子反应氧化反应;阴极得到电子的是氢离子,故C错误;
D、氯化银溶解度大于碘化银溶解度,沉淀溶解平衡状态下银离子浓度大;,等体积AgCl、AgI饱和清液混合后加入足量AgNO3固体,生成沉淀物质的量:n(AgCl)>n(AgI),故D正确;
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;焓变和熵变;盐类水解的应用;电解原理.
考点点评: 本题考查了自发进行的判断依据,盐类水解的应用,电解原理的应用分析,沉淀溶解平衡的影响因素判断,题目难度中等.1年前查看全部
- 下列有关说法正确的是( )A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0B.
下列有关说法正确的是( )
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0
B.放热反应的反应速率总是大于吸热反应的反应速率
C.N2(g)+3H2(g)⇌2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
D.液氨是一种重要的制冷剂,说明氨气在液化时吸收大量的热 koni261年前1
koni261年前1 -
 tt41 共回答了14个问题
tt41 共回答了14个问题 |采纳率92.9%A、该反应的△S>0,不能自发反应说明其△H-T△S>0,所以,其△H>0,故A正确;
B、反应速率与反应放热吸热无关,决定于反应物的性质,故B错误;
C、升温时反应速率加快,△H<0,升温时平衡逆向移动,反应物转化率减小,故C错误;
D、物质液化时放热,液氨的制冷是利用其气化时吸热,故D错误.
故选:A.1年前查看全部
- 理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag + =2 Ag +Cu 2+ ”设制一个化
理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag + =2 Ag +Cu 2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
该电池的电解质溶液是 ;负极发生 反应(填“氧化”或“还原”),电极反应式 zseqsx1年前1
zseqsx1年前1 -
 ZGO球球 共回答了25个问题
ZGO球球 共回答了25个问题 |采纳率88%(1)硝酸银 ,氧化反应, Cu -2e - =Cu 2+
1年前查看全部
- 怎样判断,电解池和原电池?是原电池能自发进行氧化还原反应,电解池不能?
 yjqqqqyv1年前2
yjqqqqyv1年前2 -
 sally_17 共回答了13个问题
sally_17 共回答了13个问题 |采纳率69.2%没错,还可以从装置中用没用电源,电极材料是不是一活一钝,是不是燃料电池等来判断1年前查看全部
- 对于化学反应能否自发进行,下列说法中不正确的是( )
对于化学反应能否自发进行,下列说法中不正确的是( )
A. 若△H<0,△S>0,任何温度下都能自发进行
B. 若△H>0,△S<0,任何温度下都不能自发进行
C. 若△H>0,△S>0,低温时可自发进行
D. 若△H<0,△S<0,低温时可自发进行 yhb11981年前1
yhb11981年前1 -
 云边一片天 共回答了13个问题
云边一片天 共回答了13个问题 |采纳率92.3%解题思路:反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行.A、若△H<0,△S>0,△H-T△S<0,任何温度下都能自发进行,故A正确;
B、若△H>0,△S<0,△H-T△S>0,任何温度下都不能自发进行,故B正确;
C、若△H>0,△S>0,高温时可自发进行,故C错误;
D、若△H<0,△S<0,依据△H-T△S分析判断,低温时可自发进行,故D正确;
故选C.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了反应自发进行的判断依据,注意反应是否自发进行取决于焓变熵变和温度,题目较简单.1年前查看全部
- 下列有关说法正确的是( )A.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0B
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 cindy_jinzi1年前1
cindy_jinzi1年前1 -
 勇敢爱吧 共回答了13个问题
勇敢爱吧 共回答了13个问题 |采纳率76.9%解题思路:A、依据自发进行的判断依据是△H-T△S<0分析;B、碳酸钠溶液中加入氢氧化钙,抑制碳酸根离子水解,溶液PH增大;C、偏铝酸钠溶液中加入碳酸氢钠,偏铝酸根离子结合氢离子促进碳酸氢根离子电离,生成氢氧化铝沉淀;D、醋酸铵水溶液中双水解,水的电离得到促进.A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,反应熵变△S<0,依据自发进行的判断依据是△H-T△S<0分析,△H<0,故A正确;B、碳酸钠溶液中加入氢氧化钙,氢氧根离子浓度增大抑制碳酸根离子水解,溶...
点评:
本题考点: 反应热和焓变;盐类水解的应用.
考点点评: 本题考查了化学反应能能量变化,盐类水解的分析应用,注意偏铝酸根离子和氢离子形成氢氧化铝沉淀,促进碳酸氢根离子的电离,题目难度中等.1年前查看全部
- 书上说碳酸钙在高温下分解是向体系中输入了能量,说该反应是不能自发进行的.但根据吉布森自由能在高温下该反应是可自发进行的.
书上说碳酸钙在高温下分解是向体系中输入了能量,说该反应是不能自发进行的.但根据吉布森自由能在高温下该反应是可自发进行的.但高温不就是向体系输入了能量了吗?不就是不能自发进行了吗?
 shanyanting1年前1
shanyanting1年前1 -
 委委涛 共回答了19个问题
委委涛 共回答了19个问题 |采纳率89.5%你们高中就讲Gibbs能了,什么高中超纲了.常温下是不能自发进行,但是反应条件变了,再那种条件(1000K的样子)下不就能自发进行了么.可能是低温时给予的能量少,不足以使碳酸钙达到分解的临界温度.1年前查看全部
- 吉布斯自由能降低的过程,是否一定是自发过程?
 蛛蛛郁郁1年前1
蛛蛛郁郁1年前1 -
 zhouliyu 共回答了17个问题
zhouliyu 共回答了17个问题 |采纳率94.1%没问题,可以的.吉布斯自由能判据是反应发生的三大判据之一,另外两个是熵判据和平衡常数判据.另外再多说两句,如果题目中说是焓降低的过程是不能作为自发反应的判据的.1年前查看全部
- 原电池中 电解质溶液一定会与负极发生自发的氧化还原反应吗
原电池中 电解质溶液一定会与负极发生自发的氧化还原反应吗
如果是的话 那么钢铁在发生的吸氧腐蚀 为什么要有氯化钠做电解质呢 那位仁兄帮帮忙 curarpiki1年前1
curarpiki1年前1 -
 新60 共回答了21个问题
新60 共回答了21个问题 |采纳率100%那个氯化钠可以无视.只是为了了增加溶液导电性而已~
实际反应的还是氧气1年前查看全部
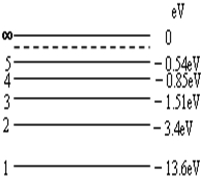
- 根据氢原子的能级图,现让一束单色光照射到大量处于基态(量子数n=1)的氢原子上,受激的氢原子能自发地发出3种不同频率的光
根据氢原子的能级图,现让一束单色光照射到大量处于基态(量子数n=1)的氢原子上,受激的氢原子能自发地发出3种不同频率的光,则照射氢原子的单色光的光子能量为( )
 A. 13.6eV
A. 13.6eV
B. 3.4eV
C. 10.2eV
D. 12.09eV liw5111年前2
liw5111年前2 -
 annny 共回答了19个问题
annny 共回答了19个问题 |采纳率84.2%解题思路:能级间跃迁吸收或辐射的能量等于两能级间的能级差,受激的氢原子能自发地发出3种不同频率的光,可知跃迁到第3能级,从而根据能级差求出照射的光子能量.受激的氢原子能自发地发出3种不同频率的光,知跃迁到第3能级,则吸收的光子能量为△E=-1.51+13.6eV=12.09eV.故D正确,A、B、C错误.
故选:D.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 解决本题的关键知道能级间跃迁所满足的规律,即Em-En=hv.1年前查看全部
- 下列说法或表示正确的是( )A.次氯酸的电离方程式:HClO⇌H++ClO-B.只有熵增加的过程才能自发进行C.HS-
下列说法或表示正确的是( )
A.次氯酸的电离方程式:HClO⇌H++ClO-
B.只有熵增加的过程才能自发进行
C.HS-水解离子方程式:HS-+H2O⇌H3O++S2-
D.已知中和热为57.3kJ•mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ•mol-1 59551301年前1
59551301年前1 -
 冲冠一怒为了钱 共回答了14个问题
冲冠一怒为了钱 共回答了14个问题 |采纳率92.9%解题思路:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等.A、次氯酸是弱电解质,存在电离平衡,电离方程式为HClO⇌H++ClO-,故A正确;
B、△G=△H-T△S,如果△G<0 反应可以自发进行,反之则不可以自发进行,如果熵减小,放热反应中且满足△G<0,反应能够自发进行,故B错误;
C、HS-水解结合水电离的氢离子,溶液显示碱性,正确的水解方程式为HS-+H2O⇌OH-+H2S,故C错误;
D、已知中和热为57.3kJ•mol-1,氢离子和氢氧根离子生成1mol液态水放出57.3kJ热量,生成2mol水,放出热量为114.6kJ热量,故D正确;
故选:AD.点评:
本题考点: 电离方程式的书写;离子方程式的书写;热化学方程式.
考点点评: 本题考查学生电离方程式的正误判断方法,是现在考试的热点,注意常见的书写错误的归纳,本题难度不大.1年前查看全部
- 任意温度都能自发进行的反应,升高温度,平衡常数如何变化?
任意温度都能自发进行的反应,升高温度,平衡常数如何变化?
一个反应,在任意温度下都能自发进行,若升高温度,平衡常数是增大还是减小?怎么解释? _m_weh79bkn1e081年前1
_m_weh79bkn1e081年前1 -
 痴情猎手 共回答了20个问题
痴情猎手 共回答了20个问题 |采纳率85%平衡常数减小
这个不能用一般的方法判断
用范特霍夫等温方程 G(T)=G(T标准)+RTlnJ
此处的G为吉布斯自由能,表示反应的限度,任何温度下都自发表示G(T标准)1年前查看全部
- 标准态,任何温度下都能正向自发进行的反应,温度越高,反应的标准平衡常数怎么变化,为什么
 苏北的北1年前1
苏北的北1年前1 -
 harrisonfo 共回答了25个问题
harrisonfo 共回答了25个问题 |采纳率80%平衡常数只与温度有关.判断方法很简单.看方向向正方向还是反方向移动.平衡也是这样移动的1年前查看全部
- 下列说法中正确的是( )A. X射线是处于激发态的原子核辐射出的B. 一群处于n=3能级激发态的氢原子,自发跃迁时能发
下列说法中正确的是( )
A. X射线是处于激发态的原子核辐射出的
B. 一群处于n=3能级激发态的氢原子,自发跃迁时能发出3种不同频率的光
C. 放射性元素发生一次β衰变,原子序数增加1
D. 235U的半衰期约为7亿年,随地球环境的变化,半衰期可能变短 流恋的风1年前1
流恋的风1年前1 -
 think7474 共回答了23个问题
think7474 共回答了23个问题 |采纳率91.3%解题思路:X射线是原子核内层电子受到激发产生的;光电效应和康普顿效应说明光具有粒子性.半衰期与外界的环境无关.A、X射线是原子核内层电子受到激发产生的.故A错误.
B、一群处于n=3能级激发态的氢原子,自发跃迁时能发出3种不同频率的光.故B正确.
C、放射性元素发生一次β衰变,电荷数增加1,质量数不变,则原子序数增加1.故C正确.
D、半衰期的长短是由元素本身决定的,与外界的环境无关.故D错误.
故选:BC.点评:
本题考点: 原子核衰变及半衰期、衰变速度
考点点评: 本题考查了电磁波的产生机理、衰变的实质、半衰期等知识点,比较简单,关键要熟悉教材,多加积累,牢记这些基础知识点.1年前查看全部
- 下列有关说法正确的是( )A.焓变大于零的反应一定不能自发进行B.熵判据可作为判断反应进行方向的唯一判据C.综合考虑焓
下列有关说法正确的是( )
A.焓变大于零的反应一定不能自发进行
B.熵判据可作为判断反应进行方向的唯一判据
C.综合考虑焓判据和熵判据的复合判据,更适用于所有的过程
D.根据过程的自发性,不仅能判断过程的方向,也能确定过程是否一定会发生和过程发生的速率 xueshengbi1年前1
xueshengbi1年前1 -
 070426 共回答了14个问题
070426 共回答了14个问题 |采纳率78.6%解题思路:反应自发进行的判断依据是△H-T△S<0,依据判断依据分析选项.A、△H>0、△S>0,△H-T△S不一定小于0,高温下自发进行,低温下不能自发进行,故A错误;
B、焓变熵变是共同决定反应自发进行的因素,故B错误;
C、综合考虑焓判据和熵判据的复合判据,更适用于所有的过程,故C正确;
D、根据过程的自发性,只能判断过程的方向,不能确定过程是否一定会发生和过程发生的速率,故D错误;
故选C.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的判断方法,注意焓变熵变是共同决定反应自发进行的因素,题目较简单.1年前查看全部
- 下列说法正确的是( )A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行B.NH4HCO3(s)═NH3(g
下列说法正确的是( )
A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 流金岁月1101年前1
流金岁月1101年前1 -
 都叫我花花 共回答了24个问题
都叫我花花 共回答了24个问题 |采纳率87.5%解题思路:A、某些吸热反应也可以自发进行,依据△H-T△S<0分析判断;
B、反应焓变大于0,熵变大于0,反应向熵变增大的方向进行;
C、依据反应自发进行的判断依据△H-T△S<0分析;
D、催化剂改变反应速率不改变化学平衡;A、某些吸热反应也可以自发进行,依据△H-T△S<0分析,△H>0,△S>0,常温下可以△H-T△S<0,如氢氧化钡晶体和氯化铵反应,是吸热反应,常温下可以蒸发进行,故A错误;
B、反应焓变大于0,熵变大于0,反应向熵变增大的方向进行,NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C、依据反应自发进行的判断依据△H-T△S<0分析,反应自发进行需要焓变、熵变和温度共同决定,故C错误;
D、催化剂改变反应速率不改变化学平衡,使用催化剂不可以改变化学反应进行的方向,故D错误;
故选B.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的分析判断,注意反应特征和焓变、熵变的分析判断,掌握基础是关键,题目较简单.1年前查看全部
- caco3=cao+co2仅在高温下自发
caco3=cao+co2仅在高温下自发
仅在高温下自发到底是啥意思 是不是说高温时是自发反应而低温时是非自发反应
还有 书里说这是吸热反应,可是这个反应熵是变大的,又吸热又熵变大怎么会是自发呢 够了9991年前3
够了9991年前3 -
 zhutou12345 共回答了18个问题
zhutou12345 共回答了18个问题 |采纳率88.9%H>0(打不出那个三角形,H和S前面都有),S>0
G=H-TS,当T增大的时候G就有可能小于0.使得反应自发进行
低温时由于T小,G正,所以反应不能自发进行1年前查看全部
- 氯气与次氯酸氧化性强弱有人解释说: “注意,用来判断氧化性强弱的反应必须是能够大程度进行的自发反应.以上反应不能算做自发
氯气与次氯酸氧化性强弱
有人解释说:
“注意,用来判断氧化性强弱的反应必须是能够大程度进行的自发反应.以上反应不能算做自发反应,所以不能得到CL2氧化性强于HCLO的结论.
但是其逆反应却是自发的,所以可以得到:HCLO氧化性强于CL2的结论 ”
为什么氯气与水的反应不是能大程度进行的自发反应? hainanwdq1年前2
hainanwdq1年前2 -
 果果bo 共回答了19个问题
果果bo 共回答了19个问题 |采纳率100%不能大程度的自发反应是因为这是个可逆反应,不能够完全反应,并且还有一部分氯气溶入水中.
有很多化学反应仅仅从化学方程式上来判断化学性质的强弱可能会有问题,就像这个.要从本质上看,是得失电子能力的强弱.
这要从化合价来判断,因为氯气中的CL是零价,次氯酸中的氯离子是整一价,从得失电子能力上判断低价的比高价的还原性强.也就是说次氯酸的氧化性强.
能斯特方程,电极电势,大学无机化学的电化学那一张里就有详细解释1年前查看全部
- Na2CO3+H2O+CO2=2NaHCO3这个反应自发能进行吗
 魔鬼不在线1年前1
魔鬼不在线1年前1 -
 Mirage_cpa 共回答了19个问题
Mirage_cpa 共回答了19个问题 |采纳率89.5%能.就是往碳酸钠溶液中通入二氧化碳,浓度高的时候会析出溶解度小的碳酸氢钠.1年前查看全部
- 下列叙述中,正确的是( )A.对于同一物质在不同状态时的熵值是:气态>液态>固态B.焓变小于0的反应肯定是自发的C.熵
下列叙述中,正确的是( )
A.对于同一物质在不同状态时的熵值是:气态>液态>固态
B.焓变小于0的反应肯定是自发的
C.熵变大于0的反应肯定是自发的
D.自发反应的反应速率肯定很快 千棵树21年前1
千棵树21年前1 -
 大大玲玲 共回答了21个问题
大大玲玲 共回答了21个问题 |采纳率100%解题思路:A、熵值是指混乱度,同一物质的不同状态熵值不同;
B、熵变不是决定反应能否自发的唯一条件;
C、焓变不是决定反应能否自发的唯一条件;
D、反应自发与否与反应速率无关.A、同一物质的固态、液态、气态的混乱度依次增大,故A正确;
B、△H-T△S<0的反应能够自发进行,仅仅是△H<0时,不一定自发,故B错误;
C、△H-T△S<0的反应能够自发进行,仅仅是△S>0时,不一定自发,故B错误;
D、反应自发进行只是一种可能,能否发生和反应速率有关,比如氢气与氧气反应生成水是自发过程,常温下几乎不反应,故D错误.
故选:A.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查反应自发进行的条件,△H-T△S<0时反应能够自发进行,题目难度不大.1年前查看全部
- 下列说法正确的是( )A.化学键的断裂和形成是化学反应的实质,化学反应前后能量不变B.凡是放热反应都是自发的,吸热反应
下列说法正确的是( )
A.化学键的断裂和形成是化学反应的实质,化学反应前后能量不变
B.凡是放热反应都是自发的,吸热反应都是非自发的
C.若一个反应的平衡常数越大,则表示该反应速率也越大
D.升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 朵朵_monica1年前1
朵朵_monica1年前1 -
 okyxf 共回答了16个问题
okyxf 共回答了16个问题 |采纳率87.5%解题思路:A、任何化学反应前后都有能量变化;
B、反应自发与否决定于焓变和熵变两方面;
C、平衡常数可以表示反应正向进行程度,与反应速率无关;
D、升高温度,分子能量增大,活化分子数目增多.A、任何化学反应的反应物和生成物所含能量都不相同,故A错误;
B、反应自发与否决定于焓变和熵变两方面,看△H-T△S的大小,故B错误;
C、平衡常数越大反应正向进行的程度越大,反应速率不一定快,故C错误;
D、升高温度,分子能量增大,活化分子数目增多,所以活化分子百分数增大,故D正确;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应中能量变化的原因、反应自发与否的条件、化学平衡常数、活化分子的相关知识,题目难度不大.1年前查看全部
- 吸热反应一定贮存能量吗化学反应会自发地向能量降低方向进行,如果吸热反应一定贮存能量,能量增加,那岂不是所有吸热反应都不能
吸热反应一定贮存能量吗
化学反应会自发地向能量降低方向进行,如果吸热反应一定贮存能量,能量增加,那岂不是所有吸热反应都不能自发进行了? lvxinxin001年前2
lvxinxin001年前2 -
 jy_aribian 共回答了14个问题
jy_aribian 共回答了14个问题 |采纳率85.7%吸热反应往往都是外界提供能量供他反应.但是化学反应的自发性指的是 能量趋于低,状态趋于散乱.G=H-TS,G0非自发
所以受很多因素的影响 不是说吸热反应就一定不能自发进行 的0.0 还有状态 是一个综合影响的过程1年前查看全部
- 下列表述中正确的是( ) A.任何能使熵值增大的过程都能在常温下自发进行 B.已知热化学方程式2SO 2 (g)+O
下列表述中正确的是( ) A.任何能使熵值增大的过程都能在常温下自发进行 B.已知热化学方程式2SO 2 (g)+O 2 (g)⇌2SO 3 (g)△H=-QkJ•mol -1 (Q>0),则将2molSO 2 (g)和1molO 2 (g)置于一密闭容器中充分反应后放出QkJ的热量 C.化学平衡发生移动,平衡常数一定发生变化 D.等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多  isseymiyake81741年前1
isseymiyake81741年前1 -
 双面的人 共回答了16个问题
双面的人 共回答了16个问题 |采纳率100%A.使熵值增大的过程常温下不一定能进行,如水的分解,故A错误;
B.反应为可逆反应,不能完全反应,放出的热量小于Q kJ,故B错误;
C.化学平衡常数只受温度的影响,如温度不变,则平衡常数不变,故C错误;
D.气体变为固体放出热量,则等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故D正确.
故选D.1年前查看全部
- 高温高压下可以使石墨转化为金刚石是自发的化学反应,这句话为什么不对
 赫狼1年前1
赫狼1年前1 -
 天马行空4 共回答了20个问题
天马行空4 共回答了20个问题 |采纳率90%不是化学反应,只是分子结构的变化,石墨和金刚石的成份都是碳1年前查看全部
- 下列说法中,正确的是① 同种元素的原子的性质相同② 能自发进行的化学反应,不一定是△H<0 、△S>0③ 胶体与溶液的本
下列说法中,正确的是
① 同种元素的原子的性质相同
② 能自发进行的化学反应,不一定是△H<0 、△S>0
③ 胶体与溶液的本质区别是胶体具有丁达尔现象
④ K sp 不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关
⑤“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
⑥ 食盐可以融冰化雪,用食盐作融雪剂不会对环境、植物生长产生任何危害
⑦1 molNH 2 - 中含电子数为9N AA.①③④ B.①④⑥⑦ C.②⑤ D.①⑤⑦  徐大少爷1年前1
徐大少爷1年前1 -
 菊花茶加aa 共回答了13个问题
菊花茶加aa 共回答了13个问题 |采纳率92.3%C
① 错误,同种元素的原子的化学性质相同,物理性质不同
②正确,只要△G<0,反应就能自发进行。
③错误, 胶体与溶液的本质区别是微粒的直径。
④ 错误,K sp 只与难溶电解质的性质和温度有关
⑤正确,水放热才得到冰,水的热量高于冰
⑥错误。食盐作融雪剂对植物生长有影响
⑦错误,1 molNH 2 - 中含电子数为10N A
故选C。1年前查看全部
- 下列叙述中,不正确的是( )A. 在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行B. 升高温度会加快化学反应
下列叙述中,不正确的是( )
A. 在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行
B. 升高温度会加快化学反应速率,其原因是增加了活化分子的百分数
C. 青石棉的化学式为Na2Fe3Si8O22(OH)2,用氧化物的形式可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O
D. 红外光谱法可以确定物质相对分子质量 tt没我胡子长1年前1
tt没我胡子长1年前1 -
 xiaocao561 共回答了21个问题
xiaocao561 共回答了21个问题 |采纳率90.5%解题思路:A、依据反应自发进行的判断依据△H-T△S<0分析判断;
B、升高温度,分子能量增大,活化分子百分数增大;
C、依据化学式原子守恒和元素化合价代数和为0分析判断;
D、有机物结构确定的一般步骤是分离,提纯→元素定量分析→测定相对分子质量→波谱分析,用质谱法确定有机物的相对分子质量,红外光谱分析能通过有机物功能基团对红外光谱波长的吸收来判定其基团的类别.A、依据反应自发进行的判断依据△H-T△S<0分析,在相同条件下,焓变小于0△H<0,熵变大于0△S>0,△H-T△S<0,反应肯定能自发进行,故A正确;
B、升高温度,分子能量增大,活化分子百分数增大,故B正确;
C、依据化学式原子守恒和元素化合价代数和为0分析,用氧化物的形式可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O,青石棉的化学式为Na2Fe5Si8O22(OH)2,故C错误;
D、有机物结构确定的一般步骤是分离,提纯→元素定量分析→测定相对分子质量→波谱分析,用质谱法确定有机物的相对分子质量,红外光谱分析能通过有机物功能基团对红外光谱波长的吸收来判定其基团的类别,故D错误;
故选CD.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的分析判断,化学式书写方法的理解化学反应速率影响因素,有机物结构确定的方法判断,题目难度中等.1年前查看全部
- 为什么由碳酸钙分解高温下自发进行,可推导出该反应吸热
 能吃有错吗1年前2
能吃有错吗1年前2 -
 stonezhezhe 共回答了19个问题
stonezhezhe 共回答了19个问题 |采纳率94.7%反应能否自发进行是根据ΔG是否小于0判断的,而ΔG=H-TS,H为焓变,吸热大于0,吸热小于0,T(K)为温度,分解反应熵变大于0.在低温时,碳酸钙不分解,即G大于0,而TS是大于0的,因此H大于0,该反应吸热.并不是由于该反应在高温时自发进行而推导出这一结论的1年前查看全部
- 化学反应能否自发题首先这里向右自发 说明G
 coler1年前1
coler1年前1 -
 wcp_wx 共回答了16个问题
wcp_wx 共回答了16个问题 |采纳率93.8%ΔH-TΔS = -17
如果ΔH = 17 ,那么 TΔS = 34
如果ΔH = -17 ,那么 TΔS = 0(除非T=0否则不可能)
选择A1年前查看全部
- 化学反应能否自发进行与什麽有关?拜托了各位 谢谢
 kaixin_family1年前1
kaixin_family1年前1 -
 多中接利 共回答了25个问题
多中接利 共回答了25个问题 |采纳率92%与吉布斯自由能的变化情况有关,即熵变与焓变的值有关.公式为ΔG=ΔH-TΔS.当ΔG小于零时,自发进行.1年前查看全部
- 化学反应进行方向碳酸铵〔(NH4)2CO3〕在室温下就能自发地分解产生氨气,对其说法正确的是A.碳酸铵分解是因为生成了易
化学反应进行方向
碳酸铵〔(NH4)2CO3〕在室温下就能自发地分解产生氨气,对其说法正确的是
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解是因为外界给予了能量
C.碳酸铵分解是吸热反应,根据能量判据不能自发分解
D.碳酸盐都不稳定,都能自发分解
C和D为什么不对?
恩、D我知道啦、高温情况下CaCO3才能自发分解、
C 它不是说 “根据能量判据”了么?能量判据是说“能量判据解释方向问题、体系趋向于由能量高处向低处的转变” 那么碳酸铵分解吸热、说明是能量低处向高处的转变、根据能量判据确实说明不能自发分解啊、没错嘛 > 离去的芳草1年前3
离去的芳草1年前3 -
 好时光1 共回答了13个问题
好时光1 共回答了13个问题 |采纳率100%应该就是选A吧,这很明显就是个熵增反应.
D是很明显的不对啦,像碳酸钙就不能自发分解.
至于C,我也不清楚,要具体看
我记得好像光凭一个能量判据是不能判断反应是否能自发进行的.
有两个条件呢1年前查看全部
- 平衡常数判断在298.15K,标准状态下,反应N2(g) + O2 (g) = 2NO (g) 自发进行的方向,求出标准
平衡常数
判断在298.15K,标准状态下,反应
N2(g) + O2 (g) = 2NO (g) 自发进行的方向,求出标准平衡常数.已知298.15K时△fGmΘ(NO,g)=87.6KJ·mol-1 CZQ87221年前2
CZQ87221年前2 -
 雅客77521 共回答了17个问题
雅客77521 共回答了17个问题 |采纳率88.2%△G=-RTlnK
△G就等于87.6,因为,单质为0!
带入计算就行了.
强调一点,K为无量纲,所以楼上写单位有点画蛇添足了:)
87.6*1000=-8.314*298.15lnK(单位要统一,△G是kj,8.314是j)
k=4.67*10-161年前查看全部
大家在问
- 1如何将图中所示的方程组化成平面方程?
- 2英语作文关于如何与陌生人交际假设你的朋友JIM很内向`在聚会是不知道如何与陌生人交谈请求你的帮助```请你针对如何选取闲
- 3一个分数的分子与分母的和是74,如果分子、分母同时减少10后,化简后变成五分之四
- 4求arccos√((x+y)/(x^2y^2))的偏导数
- 5我坐在第一排最边上 数学课板书我总是看不见 我能和老师申请数学课换到后排空位吗 会不会显得我多事
- 6mg-f=ma适用于变速运动吗?
- 73名商人个带一名随从乘船渡河,小船只能容纳2人,随从们密约,在河的任意岸,一旦随从人数比商人多,就杀商人,此密约被商人知
- 8我会把画线字的音节补充完整。 w____ j____
- 9我在阅读中得到快乐 作文
- 10I will translate what you are write\翻译一哈,
- 11知函数f(x)=2根号3sinXcosX+2cos^2X-1(X属于R)
- 12∫X^2/1-x^2 dx.
- 13如果实数M,N满足关系式m+n=4,求m^2+N^2的最小值
- 14某型号电热水壶,将一满壶20℃的水在额定电压下烧开需时5min.(已知电热水壶额定电压为220V,额定功率为800W,水
- 15一扇玻璃门2.4m高,上有固定玻璃0.5m,玻璃门两边都是固定玻璃,这扇玻璃门需要几个七字夹
