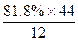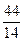1mol气态烃与1mol溴单质加成.其产物又能与6mol氯气取代.请问该烃是A乙烯B丙烯.为什么
 xx玫瑰loverose2022-10-04 11:39:542条回答
xx玫瑰loverose2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 rwggac 共回答了10个问题
rwggac 共回答了10个问题 |采纳率100%- 丙烯
- 1年前
 妍紫 共回答了165个问题
妍紫 共回答了165个问题 |采纳率- 那不就是丙烯,一个双键加成一摩尔卤素。变成CH2BrCHBrCH3,一共六个氢,所以可以和六摩尔氯气取代
- 1年前
相关推荐
- 烷类物质有几种气态的如题,顺便考虑一下同分异构体.并且分别说明.
 baba21211年前2
baba21211年前2 -
 简单394 共回答了12个问题
简单394 共回答了12个问题 |采纳率83.3%甲烷 乙烷 丙烷 丁烷 异丁烷
一般的 烷烃,烯烃,炔烃等有机物在碳原子数小于四的时候都是气态的1年前查看全部
- 为了使气态CO2变为液态,可采取的措施是
为了使气态CO2变为液态,可采取的措施是
A.减压 升温
B.加压 升温
C.减压 降温
D.加压 降温
为什么,方程式是什么 eGadoidvvv1年前1
eGadoidvvv1年前1 -
 yjlovezmz 共回答了18个问题
yjlovezmz 共回答了18个问题 |采纳率88.9%根据化学平衡原理,增加气压,就会使系统中气体体积减小,也就是转化为液体了,而气体液化过程是放热过程,所以降低系统温度,会使平衡向液态方向移动,所以选D
CO2(g)=CO2(l) △ H1年前查看全部
- 气态的二氧化碳能加热吗?如果可以加热,被加热后的二氧化碳会发生化学反应吗?
气态的二氧化碳能加热吗?如果可以加热,被加热后的二氧化碳会发生化学反应吗?
高温情况下的气态二氧化碳跟常温情况下的气态二氧化碳 它的重量相同吗?比例是多少? laikanyixia1年前3
laikanyixia1年前3 -
 bobo_1106 共回答了13个问题
bobo_1106 共回答了13个问题 |采纳率84.6%气态的二氧化碳可以被加热,在一般情况下加热只会使二氧化碳气体的温度升高,不会发生化学反应.因为二氧化碳的热稳定性很高,分解较困难.
高温情况下的二氧化碳和常温的二氧化碳重量(质量)是相同的,不同的是密度,具体比例取决于温度差.1年前查看全部
- 火箭刚发射时高温火焰是什么物态初二物理就只是这个问题不要写的我看不懂 固态液态还是气态?
 宝宝糖10151年前1
宝宝糖10151年前1 -
 xinhaoJJJ 共回答了28个问题
xinhaoJJJ 共回答了28个问题 |采纳率92.9%气态1年前查看全部
- 离子化合物在固态时为离子晶体,液态气态时呢?还是离子晶体吗?
离子化合物在固态时为离子晶体,液态气态时呢?还是离子晶体吗?
如果不是又是什么? yuleispeed1年前2
yuleispeed1年前2 -
 摄风 共回答了20个问题
摄风 共回答了20个问题 |采纳率95%物质在液态、气态时就已经不是晶体了.还谈什么离子晶体?1年前查看全部
- 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
A.1 mol 由元素A、B组成的化合物一定含有18 mol e-
B.元素D的最高价氧化物对应的水化物可以溶于过量的氨水中
C.含D的盐溶液既可能显酸性,也可能显碱性
D.化合物AE与DE含有不同类型的化学键 NEW2121年前1
NEW2121年前1 -
 hwayik 共回答了19个问题
hwayik 共回答了19个问题 |采纳率100%解题思路:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,则C为Na元素;元素D是地壳中含量最多的金属元素,则D为Al元素;元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数等于铝元素,E为Cl元素.A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,则C为Na元素;元素D是地壳中含量最多的金属元素,则D为Al元素;元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数等于铝元素,E为Cl元素.
A、元素C、H组成的化合物属于烃,1mol烃中含有的电子数不一定是18mole-,如1mol甲烷含有10mol电子等,故A错误;
B、D为Al元素,氢氧化铝溶于强碱,不溶于弱碱,不能溶于氨水,故B错误;
C、D为Al元素,硫酸铝溶液呈酸性,偏铝酸钠溶液呈碱性,故C正确;
D、化合物AE是HCl,属于共价化合物,含有共价键;DE形成化合物是AlCl3,属于共价化合物物,含有共价键,二者含有的化学键类型相同,故D错误.
故选:C.点评:
本题考点: 原子结构与元素的性质.
考点点评: 考查元素推断、物质结构、元素化合物性质等,难度不大,推断元素是解题的关键.1年前查看全部
- 下列叙述中,正确的是( )A.对于同一物质在不同状态时的熵值是:气态>液态>固态B.焓变小于0的反应肯定是自发的C.熵
下列叙述中,正确的是( )
A.对于同一物质在不同状态时的熵值是:气态>液态>固态
B.焓变小于0的反应肯定是自发的
C.熵变大于0的反应肯定是自发的
D.自发反应的反应速率肯定很快 千棵树21年前1
千棵树21年前1 -
 大大玲玲 共回答了21个问题
大大玲玲 共回答了21个问题 |采纳率100%解题思路:A、熵值是指混乱度,同一物质的不同状态熵值不同;
B、熵变不是决定反应能否自发的唯一条件;
C、焓变不是决定反应能否自发的唯一条件;
D、反应自发与否与反应速率无关.A、同一物质的固态、液态、气态的混乱度依次增大,故A正确;
B、△H-T△S<0的反应能够自发进行,仅仅是△H<0时,不一定自发,故B错误;
C、△H-T△S<0的反应能够自发进行,仅仅是△S>0时,不一定自发,故B错误;
D、反应自发进行只是一种可能,能否发生和反应速率有关,比如氢气与氧气反应生成水是自发过程,常温下几乎不反应,故D错误.
故选:A.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查反应自发进行的条件,△H-T△S<0时反应能够自发进行,题目难度不大.1年前查看全部
- 关于等效平衡向某密闭容器中充入1 mol一氧化碳和2 mol 水(气态),发生反应:CO+H2O(g)=CO2 + H2
关于等效平衡
向某密闭容器中充入1 mol一氧化碳和2 mol 水(气态),发生反应:CO+H2O(g)=CO2 + H2 (反应条件是高温、催化剂,有可逆符号).当反应达到平衡时,一氧化碳的体积分数为x.若维持容器的体积和温度不变,起始物质按以下列配比充入该容器中:0.5 mol一氧化碳+2mol水(气态)+1 mol 二氧化碳+ 1 mol 氢气 .
把加入的物质按照反应方程式的计量数转化为反应物或生成物,请问:
为什么按上述配比充入后,经转化,n(CO):n(H2O)=1.5:3=1:2 请问这是怎么算出来的?请详细分析说明, 6803815011年前1
6803815011年前1 -
 暖桃 共回答了24个问题
暖桃 共回答了24个问题 |采纳率91.7%分析:
CO+H2O(g)↔CO2 + H2
1 2 0 0
0.5 2 1 1
1.5 3 0 0
其中后两种方式是一样的.因为1molCO2和1molH2反应生成1molCO和1molH2O,再加上原有的0.5molCO和2molH2O,CO就是1.5mol了,H2O就是3mol了.1年前查看全部
- 蜡烛燃烧是固态、液态还是气态的石蜡在燃烧?有什么实验能加以证明吗?
 monom1年前2
monom1年前2 -
 不愿cc 共回答了20个问题
不愿cc 共回答了20个问题 |采纳率85%用一根玻璃管的一头放在点燃着的蜡烛火焰中,可以看到有白色的蒸汽沿着玻璃管流到另一头,这时点燃这一头,可以看到燃烧现象,从而证明是气态的蜡在燃烧.1年前查看全部
- 某气态烃的组成中碳元素的质量分数为81.8%,其密度是相同条件下氢气密度的22倍,则该烃的分子式为( ) A.C 2
某气态烃的组成中碳元素的质量分数为81.8%,其密度是相同条件下氢气密度的22倍,则该烃的分子式为()
A.C 2 H 6 B.C 3 H 6 C.C 3 H 8 D.C 4 H 8  淡粉snow1年前1
淡粉snow1年前1 -
 wanguang0203 共回答了12个问题
wanguang0203 共回答了12个问题 |采纳率91.7%1年前查看全部
- (高二化学题)一种气态烷烃和一种气态烯烃组成的混合气体共13.2g,此混合气体的密度是相同状况下H2
(高二化学题)一种气态烷烃和一种气态烯烃组成的混合气体共13.2g,此混合气体的密度是相同状况下H2
(接上)H2的13.2倍,将该混合气体通过装有足量溴水的洗气瓶时,洗气瓶总质量增加了8.4g.(1)计算该混合气体的成分及其物质的量(2)写出气体通过溴水时的化学方程式,并指出反应类型 paopaoadman1年前3
paopaoadman1年前3 -
 横剑笑苍生 共回答了29个问题
横剑笑苍生 共回答了29个问题 |采纳率89.7%烷烃是甲烷且物质量为0.3mol,同时可设烯烃的分子质量为x.13.2/(8.4/x+0.3)=26.4.x=42(烯烃)1年前查看全部
- 某气态烃1mol能与2molHCl完全加成,加成后产物分子上的氢原子又可被4molCl2取代,生成物只含碳和氯两种元素,
某气态烃1mol能与2molHCl完全加成,加成后产物分子上的氢原子又可被4molCl2取代,生成物只含碳和氯两种元素,则此气态烃可能是( )
A.乙炔 B.乙烯 C.丙炔 D.1,3-丁二烯
选A.为什么? clear_liu1年前1
clear_liu1年前1 -
 渐老 共回答了17个问题
渐老 共回答了17个问题 |采纳率82.4%加成后产物分子上的氢原子又可被4molCl2取代,
说明
加成后产物分子上的氢原子为4,而其中2个是由氯化氢加成得到的,故气态烃中2个了.
只有A是含有2个氢1年前查看全部
- (2004•长春)人类生命活动离不开的气态单质是 ______、液态氧化物是 ______、绿色植物发生光合作用所需的气
(2004•长春)人类生命活动离不开的气态单质是 ______、液态氧化物是 ______、绿色植物发生光合作用所需的气体是 ______.(写化学式)
 哀猫1年前1
哀猫1年前1 -
 兔子耳朵长不了 共回答了19个问题
兔子耳朵长不了 共回答了19个问题 |采纳率78.9%解题思路:由题意可知:供给呼吸的气态单质是氧气;“生命之源”为水;绿色植物发生光合作用所需的物质为水和二氧化碳,气体则为二氧化碳.则根据化学式的书写原则和常用化合价,可正确书写化学式.①氧气为双原子单质分子,故化学式为O2;
②水的化合价标注
+1
H
−2
O,故化学式为H2O;
③二氧化碳的化合价标注
+4
C
−2
O,故化学式为CO2.
故答为:O2;H2O;CO2.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题既考查了常见元素与常见原子团的化合价以及化合价的规律和原则,还考查了化学式的书写方法和技巧.1年前查看全部
- 为什么物质从液态变为气态时会吸收很大的热量?
 hiy89geww1年前5
hiy89geww1年前5 -
 wumomo52 共回答了10个问题
wumomo52 共回答了10个问题 |采纳率90%分子的运动速度快慢不同固态分子运动速度最慢,液态其次,气态的最活跃分子越活跃,运动速度越快,说明能量越大根据能守恒,能量小的边为能量大的状态,就必须吸收能量,而热量是能量最普遍的表现形式其他能量输入方式,如电解等,也能使液态转变到气态而需要多大的能量就与分子本身性质有关了,如水和酒精1年前查看全部
- 20mL由两种气态烃组成的混合物,和足量的氧气完全燃烧生成了50mLH2O(g)和40mLCO2(在同温同压下测定)该混
20mL由两种气态烃组成的混合物,和足量的氧气完全燃烧生成了50mLH2O(g)和40mLCO2(在同温同压下测定)该混合物可能由哪两种烃组成
 cfshcsw1年前2
cfshcsw1年前2 -
 castrostreet 共回答了21个问题
castrostreet 共回答了21个问题 |采纳率95.2%设气态烃平均化学式为CxHy
CxHy + (x+y/4) O2----->xCO2 + y/2 H2O
1 x y/2
20ml 40ml 50ml
解得x=2,y=5,
根据极端思维法,两种烃要么碳原子数都是2,要么一个小于2(是甲烷)、一个大于2;
所以可以:1、C2H6+C2H4,2、C2H6、C2H2,3、CH4+C3H6,4、CH4+C3H8
5、CH4+C4H6,6、CH4+C4H8,7、CH4+C4H101年前查看全部
- 水是如何从液态变为气态的水是如何从液态蒸发为气态的?
 dudy_111年前1
dudy_111年前1 -
 emed73915 共回答了15个问题
emed73915 共回答了15个问题 |采纳率100%分几个阶段:1、低温的水上升到100度的水;2、100度的水变成100度的蒸汽;3、100度的蒸汽变成高温的蒸汽1年前查看全部
- 已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过
已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比。实验装置如图所示(已知CuO可以作为碳氢化合物燃烧的催化剂):

(1)若A装置中所盛放的药品是浓NaOH 溶液,写出装置A的一种作用:_
(2)C装置中所盛放的药品是:
(3)D装置中所盛放的药品是:
(4)E装置中所盛放的药品是:
(5)上述装置中有一处错误, (不考虑
酒精灯和加热方法可能存在的错误;
若增加仪器和药品,请指明仪器、药
品名称和位置):其改正方法是
(6) 若实验装置经过改正后,进行如下定量实验:准确称取7.2 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,U形管C管质量增加10.8 g,广口瓶D质量增加22 g,则该有机物的最简式为
(7)若能确定其分子式,则其同分异构体中沸点最低物质的名称__ (习惯命名法)。 simon12341年前1
simon12341年前1 -
 宇里不留行 共回答了18个问题
宇里不留行 共回答了18个问题 |采纳率94.4%(1)①除去空气中的CO 2 气体或②调节X和空气的通入速率,保证O 2 过量
(2)无水CaCl 2 或P 2 O 5 (3)浓NaOH溶液 (4)碱石灰或固体NaOH
(5) 在A、B 之间加一个盛浓硫酸的洗气瓶或盛无水CaCl 2 (或P 2 O 5 、碱石灰、固体NaOH等)
的干燥管 (6) C 5 H 12 (7)新戊烷
考查有机物分子式及结构简式的判断。
(1)由于空气中含有CO 2 ,会干扰燃烧产物CO 2 的吸收,所以必须利用氢氧化钠除去空气中的CO 2 。其次还可以利用A中气泡的产生的快慢来可知通入通入速率,以保证O 2 过量。
(2)根据燃烧产物水和CO 2 可知,首先应该先吸收水,然后再吸收CO 2 。由于C是吸收水蒸气的,而C是U型管,所以盛放的试剂是无水CaCl 2 或P 2 O 5 。
(3)D是吸收CO 2 的,所以盛放的试剂是浓NaOH溶液。
(4)由于空气中也含有水蒸气和CO 2 ,所以E装置是吸收空气中的水和CO 2 的,因此试剂是碱石灰或固体NaOH。
(5)由于从A中出来的气体中一定含有水蒸气,会对后续的实验产生影响,所以需要在A和B之间加一个盛浓硫酸的洗气瓶或盛无水CaCl 2 (或P 2 O 5 、碱石灰、固体NaOH等)的干燥管。
(6)C管质量增加10.8 g,广口瓶D质量增加22g,所以水和CO 2 的质量分别是10.8g和22g,物质的量分别是0.6mol和0.5mol,其中碳和氢原子的质量之和是1.2g+6.0g=7.2,这说明有机物中不含有氧元素,所以该有机物的最简式为C 5 H 12 。
(7)因为5个碳原子最多结合12个氢原子,因此最简式也就是分子式。戊烷同分异构体中,支链越多,沸点越低,所以沸点最低的新戊烷,结构简式为C(CH 3 ) 4 。1年前查看全部
- 高压能不能使水由液态变为气态
 haopine1年前4
haopine1年前4 -
 吹泡泡的泡泡 共回答了15个问题
吹泡泡的泡泡 共回答了15个问题 |采纳率93.3%不能、液体加压不会气化1年前查看全部
- 气态乙醇能否形成分子间氢键?
 wangjianwu1年前1
wangjianwu1年前1 -
 qwgxa 共回答了24个问题
qwgxa 共回答了24个问题 |采纳率91.7%当氢与F、O、N形成共价键时,键结电子被吸引偏向F、O、N原子而带部分负电荷,此时氢形成近似氢离子(H+)的状态,能吸引邻近电负度较大之F、O、N原子上的孤对电子.
氢原子介於两分子的氮或氧或氟原子之间,有如键结,称为氢键
1. 氢键的表示法
(1) X属於电负度大的原子,如F、O、N(Cl电负度和N相同,但Cl的体积较大不易生成氢键,故HCl无氢键)
(2) Y必须具有未共用电子对
2. 氢键兼具离子键、共价键及凡得瓦引力的部份特性
(1) 离子性:氢核(正电)和未键结电子(负电)间之引力
(2) 共价性:氢原子与另一分子十分接近,其方向乃孤对电子之混成轨域方向,几近共用电子,此性质使氢键具有方向性
(3) 凡得瓦引力:氢键被视为很强的偶极–偶极力
3. 强度比较 共价键:氢键:凡得瓦引力=100:10:1
4. 电负度:F > O > N,故三种氢键强度
F¾H……F > O¾H……O > N¾H……N
5. 氢键形成时可放出5~40 kJ/mole的能量1年前查看全部
- 完全燃烧2mol两种气态烃组成的混合气体后所得到3.2molCO2和4molH2O混合烃中乙烯__甲烷__丙烷__乙烷_
完全燃烧2mol两种气态烃组成的混合气体后所得到3.2molCO2和4molH2O混合烃中乙烯__甲烷__丙烷__乙烷__乙炔__(填“一定有”“一定无”“可能有”)
 刺_儿1年前1
刺_儿1年前1 -
 我不是新来的啊 共回答了18个问题
我不是新来的啊 共回答了18个问题 |采纳率94.4%设平均分子式为CxHy,则由燃烧方程式
CxHy+(x+y/4)O2→点燃→xCO2+y/2H2O
1 x y/2
2mol 3.2mol 4mol
X=1.6mol
y=4mol
因为混合气体是由两种气态烃组成,根据计算可知:碳原子的平均物质的量为1.6mol,所以含碳原子的物质的量一定有小于1.6、一定有大于1.6,而小于1.6的只有甲烷中碳原子数小于1.6,所以一定含有甲烷;
而甲烷分子中氢原子数是4,与平均相同,所以另一气态烃的氢原子数也应为4,因此另一气态烃为乙烯.
乙烯 一定有_甲烷_一定有_丙烷_一定无_乙烷_一定无_乙炔_一定无_1年前查看全部
- 高中化学两种气态烃混合气体两种气态烃混合气体,在同温同压下占有的体积是等质量H2体积的1/12,混合气体中两种烃的体积比
高中化学两种气态烃混合气体
两种气态烃混合气体,在同温同压下占有的体积是等质量H2体积的1/12,
混合气体中两种烃的体积比1:4,此两种烃可能()
A,C2H6,C3H4
B,CH4,C2H2
C,C2H6,C3H6
D,CH4,C4H4 1029387we1年前2
1029387we1年前2 -
 xxj1004 共回答了16个问题
xxj1004 共回答了16个问题 |采纳率100%B,CH4,C2H2
两种气态烃混合气体,在同温同压下占有的体积是等质量H2体积的1/12,则该混合烃的平均分子量为12X2=24,
A,C2H6,C3H4 分子量为 30,40
B,CH4,C2H2 分子量为 16,26
C,C2H6,C3H6 分子量为 30,42
D,CH4,C4H4 分子量为 16,52
由此可以A、C不符合,
混合气体中两种烃的体积比1:4,只有B符合
B:16X1/5+26X4/5=241年前查看全部
- 什么物质在300℃左右液态变成气态
什么物质在300℃左右液态变成气态
液态的物质在300℃时,可以变成气态了,压力不变化的情况下. 雪白的燧石1年前3
雪白的燧石1年前3 -
 易枝粉笔ㄑ 共回答了19个问题
易枝粉笔ㄑ 共回答了19个问题 |采纳率100%水的沸点是100度 当周围温度聚变到300度时 液态水在常压下直接转变为气态1年前查看全部
- 某固体物质受热后变成该物质的气态,这个变化属于?C可能是物理变化,也可能是化学变化 D既是物理变化,也是化学变化
 9月171年前1
9月171年前1 -
 黄毛丫头naddy 共回答了21个问题
黄毛丫头naddy 共回答了21个问题 |采纳率95.2%变成该物质的气态,说明不是化学变化,这个过程就是单纯的物理变化,升华,选B1年前查看全部
- 一道化学平衡问题已知可逆反应2A=B+C,A状态不明,B为气态,C为固态,恒压下平衡时升高温度气体密度增大.问为什么平衡
一道化学平衡问题
已知可逆反应2A=B+C,A状态不明,B为气态,C为固态,恒压下平衡时升高温度气体密度增大.
问为什么平衡体系中加少量C,平衡会向逆反应方向移动?不是说增加固体的量,其固体浓度不变,不影响移动吗? 呵牛1年前2
呵牛1年前2 -
 catmiu 共回答了18个问题
catmiu 共回答了18个问题 |采纳率94.4%可以肯定A为气态,“恒压下平衡时升高温度气体密度增大”,若A为固态,则体系中只有B为气态,恒压下平衡时升高温度气体密度就会不变的.
但平衡体系中加少量C,平衡是不会移动的1年前查看全部
- 在标准状况下,112ml气态氮的氧化物质量为0.38g.该氧化物中氧元素的质量分数是63.10%求该氧化物的化学式
在标准状况下,112ml气态氮的氧化物质量为0.38g.该氧化物中氧元素的质量分数是63.10%求该氧化物的化学式
A NO2 B N2O C N2O5 D N2O3【本人化学实在不好,如有学好化学的的一些方法,也请教教我, renata_yu1年前1
renata_yu1年前1 -
 tsui_shine 共回答了19个问题
tsui_shine 共回答了19个问题 |采纳率94.7%该气态氮的氧化物的摩尔质量=m/n=m/(v/Vm)=0.38/(0.112/22.4)=76g/mol
因为氧占其质量分数的63.1%=76*0.631=48所以n=3mol,nN=2mol 所以选D
学好化学的话,做笔记非常重要1年前查看全部
- 1吨液氧可以充多瓶40升的气瓶气化成气态氧的体积是874.89*799.86=699790.02L=699.9m³?怎么
1吨液氧可以充多瓶40升的气瓶
气化成气态氧的体积是874.89*799.86=699790.02L=699.9m³?怎么来 ffkof1年前3
ffkof1年前3 -
 荠萱 共回答了24个问题
荠萱 共回答了24个问题 |采纳率87.5%液氮的密度是1.143Kg/L,一吨等于1000KG,所以1吨液氮的体积是874.89L,液氧的汽化量是799.86,气化成气态氧的体积是874.89*799.86=699790.02L=699.9m³,如果40L的钢瓶所充的压力是15MPA时,也就是一瓶能充6m³气体.那么总共能充699.9/(15*40/0.1)=116.65瓶.1年前查看全部
- ABCD四种短周期元素的原子序数依次增大,AD同主族,BC同周期,AB组合成的化合物甲为气态.
 yan-he1年前1
yan-he1年前1 -
 penghuall 共回答了21个问题
penghuall 共回答了21个问题 |采纳率90.5%问题不够清楚,不过先给你个大概的可能吧,你再把题看看做相应的处理;常温下为气体的,NH3、CO、CO2、HF、CH4、H2S、HCl;再根据ABCD的顺序,A很可能就是H,而B可能就是C、N、F、S、Cl、中的一个;我们的常识D也很可能就是K,Na,极为可能就是Na吧!1年前查看全部
- 下列说法中正确的是( )A.水在天然循环过程中,发生的是化学变化B.水在气态和液态时,分子都在不断地运动;而水在固态时
下列说法中正确的是( )
A.水在天然循环过程中,发生的是化学变化
B.水在气态和液态时,分子都在不断地运动;而水在固态时,分子是不运动的
C.水的三态变化是水分子的运动速率、分子间隔和排列方式的改变造成的
D.水蒸发时,分子获得能量;水结冰时,分子失去能量 taoliping1年前1
taoliping1年前1 -
 叶希望 共回答了15个问题
叶希望 共回答了15个问题 |采纳率86.7%解题思路:A.根据水的天然循环过程来分析;
B.根据分子特征来分析;
C.根据水的三态变化来分析;
D.根据水的三态变化中能量的改变来分析.A.水在天然循环中,并没有新物质生成,属于物理变化,故错误;
B.分子在不同状态下均在不断运动,故错误;
C.从微粒角度看水的三态变化是分子自身的能量、运动速率、分子间隔和排列方式的改变造成的,故正确;
D.水变成水蒸气的过程中,水分子获得能量,运动速度加快,分子间隔变大;水结成冰,水分子失去能量,运动速度减慢.故正确.
故选CD.点评:
本题考点: 分子的定义与分子的特性;化学变化和物理变化的判别.
考点点评: 要理解水的三态变化以及水的天然循环过程,才能正确解答此类试题.1年前查看全部
- 红磷燃烧所产生的白烟是什么P2O5 不是固体吗 为什么这里以气态存在
 baibing72491年前2
baibing72491年前2 -
 ever4u 共回答了22个问题
ever4u 共回答了22个问题 |采纳率90.9%红磷燃烧所产生的白烟是五氧化二磷
燃烧所产生的烟是固体,雾是液体1年前查看全部
- 下列说法中正确的是( )A.分子是化学变化中的最小粒子B.液态和气态物质分子有间隔,固态物资分子间则没有C.不同温度下
下列说法中正确的是( )
A.分子是化学变化中的最小粒子
B.液态和气态物质分子有间隔,固态物资分子间则没有
C.不同温度下的水,其水分子运动速率相同
D.水蒸发后,化学性质没有改变 vv原子核1年前1
vv原子核1年前1 -
 kirchies 共回答了20个问题
kirchies 共回答了20个问题 |采纳率95%解题思路:根据分子的定义及特征进行分析.分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;分子是保持物质化学性质的一种粒子,分子在化学变化中可以再分.A、分子在化学变化中可以再分,分子不是化学变化中的最小粒子.故A错误;
B、分子之间有间隔,液态、气态、固态物质的分子间都有有间隔,只是物质状态不同,分子的间隔不同.故B错误;
C、分子是运动的,运动的速率与温度有关,温度越高,运动的速率越快.所以,不同温度下的水,其水分子运动速率不同.故C错误;
D、水蒸发成水蒸气是物理变化,液态水的水分子和水蒸气的水分子属于同种物质的分子,化学性质相同.故D正确.
故选D.点评:
本题考点: 利用分子与原子的性质分析和解决问题.
考点点评: 水蒸发是物理变化,物理变化中分子不改变,改变的是分子之间的间隔或分子的排列方式;在化学变化中,分子才能分解成原子.1年前查看全部
- 甲烷,NH4,SIH4,H2S这几种气态H化物最不稳定的是哪个?为什么?
 离子蓝1年前1
离子蓝1年前1 -
 wjhxf604 共回答了11个问题
wjhxf604 共回答了11个问题 |采纳率100%根据元素周期表,主族非金属元素从上到下,氢化物稳定性依次降低,同周期主族元素由左到右,氢化物稳定性依次升高,所以为SIH41年前查看全部
- 将水在固态,气态,液态时的分子间的间隙按大小排列一下顺序.
将水在固态,气态,液态时的分子间的间隙按大小排列一下顺序.
只要把顺序排列一下就行了.
是按从大到小顺序。 0id2ja1年前3
0id2ja1年前3 -
 艾斯马代 共回答了19个问题
艾斯马代 共回答了19个问题 |采纳率94.7%气态》液态》固态1年前查看全部
- 原题,两种气态烃以任意比例混合,在105度时1L该烃与9LO2混合,充分燃烧后回复到原状态,所得气体体积仍为10L,下列
原题,
两种气态烃以任意比例混合,在105度时1L该烃与9LO2混合,充分燃烧后回复到原状态,所得气体体积仍为10L,下列各组混合烃中一定不符合此条件的是
A CH4 C2H4
B CH4 C3H6
C C2H4 C3H4
D C2H2 C3H6
本题靠的是有机物的燃烧规律及审题能力,在水为气态时,气体变化量=0的规律是CxHy中的y=4,又必须符合任意比例混合,故 B 一定不符合,D是只有在1:1时才符合
谁能在说说看,让我明白明白, zupwa1年前2
zupwa1年前2 -
 娃哈哈f190 共回答了18个问题
娃哈哈f190 共回答了18个问题 |采纳率88.9%假如有1molCxHy充分燃烧需要x+y/4mol氧气生成XmolCO2和y/2mol水蒸气则前后体积变化为(1+x+y/4)和(x+y/2)若前后体积不变则1+x+y/4=x+y/2得Y=4是成立 d项必须当时1:1时他才可以看成氢分子是41年前查看全部
- 400K、101KPa时,10ml某气态烃与50ml氧气混合,完全燃烧后生成二氧化碳和水蒸气,体积变为65ml.
400K、101KPa时,10ml某气态烃与50ml氧气混合,完全燃烧后生成二氧化碳和水蒸气,体积变为65ml.
(1)该烃在组成上应该有 个氢原子.
(2)若该烃为烯烃,其结构简式和名称为 和 .
(3)该烃能否为芳香烃的蒸气?;为什么?. 似水d年华1年前1
似水d年华1年前1 -
 xqc258 共回答了27个问题
xqc258 共回答了27个问题 |采纳率96.3%设烃为CxHy,则其完全燃烧通式为
CxHy+(x+0.25y)O2→xCO2+0.5yH2O
其中xCO2与氧气的一部分,即xO2等体积抵消,因此实际影响体积变化的为
CxHy+0.25yO2→0.5yH2O
题中,气体燃烧前后体积增加了65-(10+50)=5ml
10ml烃所需的氧气为2.5y ml,生成的水蒸汽体积为5y ml,增加了5y-(10+2.5y)=(2.5y-10) ml;因此2.5y-10=5,解得y=6【第一问答案】
单烯烃时,由CnH2n通式可得n=3,为丙烯,结构简式CH3CH=CH2【第二问答案】
(10ml丁二烯不可能在50ml氧气内完全燃烧,碳数更多的烯烃当然更不可能)
第三问,芳香烃中含有苯环,因此每个分子中至少有6个C;而仅仅6个C完全燃烧为CO2就需要6倍于烃体积的氧气,再加上H和更多的C更不可能.因此10ml芳香烃蒸汽不可能在50ml氧气里完全燃烧.1年前查看全部
- 在120C时,某气态烃与过量的O2混合物10L点火反应,……
在120C时,某气态烃与过量的O2混合物10L点火反应,……
.RT
在120C时,某气态烃与过量的O2混合物10L点火反应,反应结束后,所得混合气体在相同条件下仍为10L.冷却至室温后通过浓硫酸,体积变为6L,再通过NaOH溶液体积变为2L,求该烃的分子式. lorfy1年前1
lorfy1年前1 -
 violit 共回答了17个问题
violit 共回答了17个问题 |采纳率70.6%冷却只室温后通过浓H2SO4,体积变为6L------4L水
在通过NaOH溶液体积变为2L-----------4L二氧化碳,因为是过量,所以剩下的是氧气
N(C)/N(H)=1/2
用了氧气6L,所以有2L烃
根据N+2N/4=3可以得出N=2,所以是C2H41年前查看全部
- 物理气态方程.一端封闭粗细均匀的U形管.其水平部分长为L.U形管绕口臂的轴线以角速度W转动
物理气态方程.一端封闭粗细均匀的U形管.其水平部分长为L.U形管绕口臂的轴线以角速度W转动
如图,一端封闭粗细均匀的U形管,其水平部分长L,U形管绕开口臂的轴线以角速度w匀速转动,有长为L的水银柱封闭一段气柱,若处于U形管水平部分的水银柱的长度为L/2,则被封闭的气柱的压强为多少?(设水银的密度为P,大气压强为p0)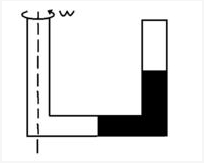
 liyongchang111年前1
liyongchang111年前1 -
 cliuq 共回答了16个问题
cliuq 共回答了16个问题 |采纳率93.8%这个题目的关键是如何求出水银柱对封闭气体的作用力.
首先把水银柱分成两段,竖直的一段和水平的一段.
现在观察右下角的拐点,因为现在是平衡的,所以它受到的竖直管的压力和水平管的压力是相等的.
竖直管的压力=气体的压强×截面积+竖直部分水银柱的重力
水平管的压力=大气压强×截面积+水平部分水银柱的离心力
因为对于离转轴距离为r处的质点的离心加速度是rw^2,w是角速度.这个加速度是正比于r的,所以
水平部分水银柱的离心力可以看作水平水银柱聚集在它的中心处所产生的离心力.这个中心距离转轴是3L/4,这样就可以算出来了.
其余三个部分都好算.然后就得到气体压强了.1年前查看全部
- 泡沫灭火器是气态二氧化碳还是固态二氧化碳?
 123小雪1年前2
123小雪1年前2 -
 苦瓜在hh 共回答了13个问题
苦瓜在hh 共回答了13个问题 |采纳率100%泡沫灭火器内有两个容器,分别盛放两种液体,它们是硫酸铝和碳酸氢钠溶液,两种溶液互不接触,不发生任何化学反应.(平时千万不能碰倒泡沫灭火器)当需要泡沫灭火器时,把灭火器倒立,两种溶液混合在一起,就会产生大量的二氧化碳气体,发生如下反应:
Al2(SO4)3+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
除了两种反应物外,灭火器中还加入了一些发泡剂.打开开关,泡沫从灭火器中喷出,覆盖在燃烧物品上,使燃着的物质与空气隔离,并降低温度,达到灭火的目的.1年前查看全部
- 干冰暴露在常温下!干冰暴露在常温下是,它会直接由固态变为气态,这种现象叫( )用干冰( )在舞台上产生淡淡的白雾,是由于
干冰暴露在常温下!
干冰暴露在常温下是,它会直接由固态变为气态,这种现象叫( )
用干冰( )在舞台上产生淡淡的白雾,是由于干冰( ),使周围的空气温度降低,空气中的水蒸气遇冷( )形成( ). dxzll1年前6
dxzll1年前6 -
 wjm333 共回答了22个问题
wjm333 共回答了22个问题 |采纳率100%干冰暴露在常温下是,它会直接由固态变为气态,这种现象叫(升华)
用干冰(放置)在舞台上产生淡淡的白雾,是由于干冰(升华吸热),使周围的空气温度降低,空气中的水蒸气遇冷(凝结)形成(小液滴).1年前查看全部
- 两种气态烃组成的混合气体0.1mol,完全燃烧得0.16 mol CO2和3.6g水混合物,则原混合
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16 mol CO2和3.6g水混合物,则原混合气体中( )
A. 一定有甲烷
B. 一定是甲烷和乙烯
C. 一定有乙烷
D. 一定有丙炔 wx3021年前1
wx3021年前1 -
 西西625 共回答了9个问题
西西625 共回答了9个问题 |采纳率88.9%解题思路:n(H2O)=[3.6g/18g/mol]=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,根据平均分子式进行判断.n(H2O)=[3.6g/18g/mol]=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4.烃中C原子数小于1.6的只有甲烷,则一定含有甲烷,CH4分子中含4个氢原子,故另一种分子中一定含4个氢原子,且其碳原子数大于1.6,故可能是C2H4或C3H4,一定没有C2H6或C2H2,二者的H原子不等于4,
A、由上述分析可知,混和气体中一定有甲烷,故A正确;
B、由上述分析可知,混和气体中一定有甲烷,可能含有是C2H4或C3H4,故B错误;
C、由上述分析可知,混和气体中一定没有C2H6或C2H2,故C错误;
D、由上述分析可知,混和气体中一定没有C2H6或C2H2,故D错误.
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合烃组成的判断,难度中等,本题关键是能够正确分析有机物完全燃烧生成的CO2和H2O的物质的量关系,根据平均分子式进行判断.1年前查看全部
- 世上的物质除了固态、液态和气态外,还有什麼态?
世上的物质除了固态、液态和气态外,还有什麼态?
请问以下的东西是甚麼态:
光、
火、
雪糕
电
 naxijingdi1年前1
naxijingdi1年前1 -
 刀粉团老太 共回答了21个问题
刀粉团老太 共回答了21个问题 |采纳率90.5%世界上的物质大致可以分为5种:
1、气态
2、固态
3、液态
4、离子态,在地球上就可看到,如日光灯中就存在.
5、中子态,中子态的物质在地球上是不存在的.如中子星1年前查看全部
- 干冰不经过液态而直接变为气态二氧化碳,这一变化属于?变化,在此变化过程中,微粒间的间隙变?了
 1963971年前5
1963971年前5 -
 314426613 共回答了20个问题
314426613 共回答了20个问题 |采纳率85%干冰不经过液态而直接变为气态二氧化碳,这一变化属于(物理)变化,在此变化过程中,微粒间的间隙变(大)了.
这种现象叫做升华.1年前查看全部
- 液态CO2储罐中的2.2MPA的压力是气态的压力还是液态的压力?
 炸鸡翅1年前1
炸鸡翅1年前1 -
 精灵小怪怪 共回答了19个问题
精灵小怪怪 共回答了19个问题 |采纳率89.5%当系统平衡之后的气、液的压力都是2.2MPA.
液态CO2刚刚装入时,不是这样的,因为储罐内的温度可能比液态CO2温度高,但经过很短一段时间之后,就相等了.1年前查看全部
- 相对分子质量最大的气态烷烃是什么
 轻轻飘过的白云1年前2
轻轻飘过的白云1年前2 -
 闪光的金子888 共回答了12个问题
闪光的金子888 共回答了12个问题 |采纳率100%新戊烷:C(CH3)4,相对分子质量为72
外观与性状:常温常压下为无色气体,标准状况下为极易挥发的液体.
熔点(℃):-19.5 沸点(℃):9.51年前查看全部
- 标准状况下,A,B两种气态烷烃的混合气体的质量为9.8g,体积为7.84L,相对分子质量A
 fairy_韩雪1年前1
fairy_韩雪1年前1 -
 feelingzdj 共回答了17个问题
feelingzdj 共回答了17个问题 |采纳率94.1%混合气体的物质的量n=V/Vm=7.84L/22.4L/mol=0.35mol
混合气体的平均摩尔质量=m/n=9.8g/0.35mol=28g/mol
则混合气体中一种烷烃的相对分子质量小于28、一种相对分子质量大于28,相对分子质量A1年前查看全部
- 在标准状况下,2.24L的某气态烷烃和具有一个双键的烯烃的混合气体完全燃烧后,将高温下产生的气体缓慢通过浓硫酸,浓硫酸增
在标准状况下,2.24L的某气态烷烃和具有一个双键的烯烃的混合气体完全燃烧后,将高温下产生的气体缓慢通过浓硫酸,浓硫酸增重4.05g,剩余气体通过碱石灰,碱石灰增重6.60g.另再取2.24L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05g.
问:(1)混合气体由哪两种烃组成,写出它们的结构简式.
(2)混合气体中两种烃的体积分数各为多少? 82895721年前0
82895721年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某种氮的气态氧化物的质量是相同状态下同体积氧气质量的1.375倍,求此氧化物的相对分子质量?
 有你youni1年前3
有你youni1年前3 -
 ronaldomhl1 共回答了19个问题
ronaldomhl1 共回答了19个问题 |采纳率94.7%氮的氧化物的相对分子质量为:
1.375*32=44
设氮的氧化物的化学式为N2Ox
14*2+16x=44
x=1
氮的氧化物的化学式为N2O.1年前查看全部
- 1.在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增强了75%,则此反应
1.在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增强了75%,则此反应的化学方程式是----------
2.将氢气,氧气,氮气分别放入不同容器中,当温度和密度完全相同时,三种气体压强(p)的大小关系是----------
3.实验测得一氧化碳和氧气混合气体的密度是氢气的14.5倍,可知其中一氧化碳的体积分数为-------------------
4.在20℃时,一钢性容器内部有一个不漏气且可滑动的活塞将容器分割成左右两室,左室冲入氮气,右室冲入氢气和氧气,活塞正好停留在离左端的1/4处,然后点燃氢气和氧气,反应完毕后恢复到原来温度,活塞恰好停在中间,水蒸气的体积可忽略,则反应前后氢气和氧气的体积比可能为------------- sarah_chan1年前1
sarah_chan1年前1 -
 旅游指南 共回答了18个问题
旅游指南 共回答了18个问题 |采纳率94.4%1、设A单质为Ax,则方程式为:2xAH3=2Ax + 3xH2,压强增强了75%即(3x+2)/2x=1.75,解得x=4,即此反应的化学方程式:4AH3=A4 + 6H2
2、温度和密度完全相同时,单位体积内气体质量相同,假设为1的话,氢气,氧气,氮气的物质的量分别为:1/2、1/32、1/28,所以三种气体压强(p)的大小关系为:p(H2)>p(N2)>p(O2).
3、密度是氢气的14.5倍即相对分子质量是2*14.5=29,设一氧化碳的体积分数为x,则:
28x+32(1-x)=29,解得x=75%
4、原来活塞正好停留在离左端的1/4处,说明原来H2、O2总体积是N2的三倍,设氮气为1,则H2、O2总体积是3,反应后活塞恰好停在中间,说明反应后剩余气体体积为1(和氮气一样),所以体积减少2,根据方程式2H2+O2=2H2O可得参加反应氢气体积为2*2/3、氧气体积为2*1/3
当剩余1体积是H2时,反应前氢气和氧气的体积比=7:2;当剩余1体积是O2时,反应前氢气和氧气的体积比=4:51年前查看全部
- 燃烧1.68g某气态烃得到5.28gCO2,该气态烃相对空气密度1.93
燃烧1.68g某气态烃得到5.28gCO2,该气态烃相对空气密度1.93
到H这不会求.不能直接减不知道有没有O
怎么知道没有氧呢? zou101年前1
zou101年前1 -
 kelly105 共回答了16个问题
kelly105 共回答了16个问题 |采纳率93.8%见到了你的补充说明,题目已经说是某气态烃了呀.烃也叫碳氢化合物,只含C、H两种元素.通常状况下气态烃分子中的碳原子数一般1年前查看全部
- 水的熔点是0摄氏度,那么在该温度下水可能存在的状态是()a固态b液态c气态d三种状态都有可能
 njfast1年前1
njfast1年前1 -
 梁山198 共回答了20个问题
梁山198 共回答了20个问题 |采纳率90%d 是固.液.气共存态1年前查看全部
大家在问
- 1已知5条线段的长分别是2,4,7,9,11,若每次以其中3条线段为边组成三角形,则最多可围成多少个不同的三角形
- 2为什么有些人的待人接物的态度那么差呢?
- 3年利率 换算成日利率 是除以360 还是365啊?
- 4空虚寂寞冷,怎样形容得高大上?
- 5分解因试:x2平方+4y2平方+4z2平方+4xy—4xy—8yz
- 6《一水果商店从水果行购进苹果100个,共花了120元,在零售时,其中70个较大的苹果以每个1.8元卖出,余下30个小的苹
- 7一件服装的售价是560元,其盈利率为40%,求这件服装的成本价.
- 83由3的1次方=3,3的2次方=27,3的3次方=27······试探究3的5次方,3的6次方的末尾数是多少
- 9等腰梯形的一条对角线与一条腰垂直,如果两条腰长的和为12
- 10碳酸氢钠中的碳酸钠用什么试剂除去 CO2不算试剂吧?
- 11为什么细胞质壁分离及其复原实验,在两次高倍镜观察之间时间不宜停留过长?
- 12春色满园关不住,一枝红杏出墙来蕴含的哲理
- 13一项工程有甲、乙、丙三个工程队来竞标,由甲、乙合作这项工程需要12天,由乙、丙合作需要9天完成这项工程的
- 14如图,在△ABC中,D,E为边AC,AB上的点,且∠aed=∠abc,连接be,cd交与点f,求证:三角形DEF∽三角形
- 15谁有《春望》的诗配画?要简单一点的就行,