极性溶剂对Sn2反应有什么影响?
 Angellisha2022-10-04 11:39:541条回答
Angellisha2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 oo949686 共回答了19个问题
oo949686 共回答了19个问题 |采纳率94.7%- 第三节 亲核取代反应历程
卤代烷的亲核取代反应是一类重要反应.亲核取代历程可以用一卤代烷的水解为例来说明.
在研究水解速度与反应物浓度的关系时,发现有些卤代烷的水解仅与卤代烷的浓度有关.而另一些卤代烷的水解速度则与卤代烷和碱的浓度都有关系.
例如:(在碱性条件下水解)
υ=κ[CH3Br][OH-]
在动力学研究中,把反应速率式子里各浓度项的指数叫做级数,把所有浓度项指数的总和称为该反应的反应级数.对上述反应来说,反应速率相对于[CH3Br]和[OH-]分别是一级,而整个水解反应则是二级反应.
υ=κ[(CH3)3CBr]
反应速率只与卤代烷的浓度成正比,而与碱的浓度无关.反应速率对[(CH3)3CBr]是一级反应.对碱则是零级,整个水解反应是一级反应.从上述实验现象和大量的事实说明:卤代烷的亲核取代反应是按照不同的历程进行的.
一、两种历程:SN2与SN1
1.双分子历程(SN2)
对溴甲烷等这类水解反应,认为决定反应速率的一步是由两种分子参与的.反应过程可以描述如下:认为整个反应是一步完成的,亲核试剂是从反应物离去基团的背面向碳进攻.
这类反应进程中的能量变化可用反应进程一位能曲线表示.
由于在反应过程中,其决定反应速度的一步发生共价健变化的有两种分子,或者说有两种分子参与了过渡态的形成,因此,这类反应历程称为双分子亲核取代反应历程,简称为双分子历程,用SN2表示(SN代表亲核取代反应,Substitution,Nucleophilic,bimolecular,"2"代表双分子).
从轨道理论来看,在SN2在反应的过渡态中,中心碳原子从原来的sp3杂化轨道变为sp2杂化轨道,三个C-H键排列在一平面上,互成1200:另外还有一个p轨道与OH-和Br部分键合.
如果OH-从溴的同侧进攻,则形成的过渡态C-OH和C-Br势必处在同一侧,它们之间斥力较大,内能高,不稳定,难生成.
因此,在反应中亲核试剂只能从背面进攻碳原子.
2.单分子历程(SN1)
溴代叔丁烷的水解分两步:
⑴.
(2).
对于多步反应来说,生成最后产物的速率由速率最慢的一步来控制.叔丁基溴的水解反应中,C-Br键的离解需要较大的能量,反应速度比较慢,而生成的碳正离子只有高度的活泼性,它生成后立即与OH-作用,因为第一步反应所需活化能较大,是决定整个反应速率的步骤,所以整个反应速率仅与卤代烷的浓度有关.这类反应历程进行过程的能量变化可用位能曲线图表示.
SN1反应的特征是分步进行的单分子反应,并有活泼中间体碳正离子的生成.
二、SN1和SN2的立体化学
1.SN2的立体化学.
亲核取代反应按双分子历程进行时,被认为亲核试剂是从离去基团的背面进攻中心碳原子的.
在反应中手性碳原子的构型发生了翻转,即产物的构型与原来化合物的相反.这种反应过程称为构型的翻转或叫做瓦尔登(Wslden)转化.大量立体化学的实验事实已经证明了SN2反应过程往往伴随着构型转化.如:已知(一)-2-溴辛烷和(一)-2-辛醇属同一构型,其比旋光度分别为-34.90,-9.90
将(一)-2-溴辛烷与NaOH进行水解反应而制得2-辛醇比旋光度为+9.90 .
这说明,通过水解反应,手性中心碳原子的构型已翻转.根据大量立体化学和动力学研究材料,可以得下面结论:按双分子历程进行亲核取代反应政治,总伴随着构型的翻转,也可以这样说,完全的构型转化可作为双分子亲核取代反应的标志.
1.SN1的立体化学.
在SN1的反应中,决定反应速率的一步中形成的碳正离子具有平面构型(sp2杂化)
亲核试剂向平面的任一面进攻的几率是相等的,因此生成的产物按理是外消旋化合物,是非光学活性物.这个过程称为外消旋化.
在有些SN1反应情况下,实验结果确实如此,但在多数情况下,结果并不那么简单,往往是在外消旋化的同时,构型转化部分和构型保持部分不相等,从而使产物具有不同程度的旋光性.2-溴代辛烷水解后,生成34%外消旋物质和66%构型转化的旋光物质.(即构型保持占17%,构型转化占83%)
所以,从立体化学观点看,SN1历程通过生成碳正离子进行取代反应时,在发生消旋作用的同时,通常还伴随着部分构型的转化.
温思坦(Winstein,S.)离子对理论对上述SN1出现的部分构型转化的现象进行了说明.
离子对历程:
离子对历程认为,反应物在溶液中的离解是分阶段的.首先是分子离解生成碳正离子和负离子,但这两个带相反电荷的离子仍紧靠在一起形成离子对,称为紧密离子对;接着是少数溶剂分子掺入到离子对中间而把两个离子对分隔开来,但仍然是一个离子对,通常称为溶剂分隔离子对;最后被离解成离子,每个离子被溶剂的分子所包围.
在紧密离子对中R+和X-之间尚有一定键连,因此仍能保持原来的构型.溶剂分子(S)或亲核试剂是从背面进攻,导致构型翻转.在溶剂分隔的离子对中不及紧密离子对那么紧密,如果亲核试剂在这时取代介入溶剂的位置进攻碳中心,产物将保持原有构型.如果试剂从介入溶剂的背面进攻,就发生构型的翻转.因此,在这个阶段进行的取代反应,随着亲核试剂的强弱,溶剂极性的大小和反应物结构的不同,除得到外消旋产物外,有时还会生成相当数量构型转化的旋光性物质(即从离去基团背后进攻的几率较大).如果反应物全部解离成离子后,由于生成碳正离子的平面构型,就只能得到外消旋产物,这就是典型的SN1历程.
因为传统的SN2历程中的过渡态并未得到直接的实验证明,所以有人建议:所有亲核取代反应都是通过离子对历程进行的,而SN2、SN1历程只是亲核取代历程的两种极限情况.
离子对理论提出了一个连续一体的概念,即在化学反应进程中反应物是在不断变化的.至于在这一反应的连续进程中,反应物的空间结构究竟是如何随着时间、条件的不同而变化的,尚有待进一步提索、论证.
典型的SN1反应基本得到外消旋产物,因此,比较产物与反应物之间旋光性的变化,可有助于初步鉴别反应是SN1还是SN2.SN1反应,常伴随着部分构型转化,还有重排产物.最后我们还得指出,这是所讲的一个反应完全按SN1或SN2历程进行是比较少见的,对于一般卤代物的亲核取代反应来讲,这两种历程是并存的.
3.邻近基因的参与.
α-溴代烷丙酸负离子按SN1历程进行水解,醇解反应时,其构型完全保持不变.
这种异常现象的产生可能是α-溴代丙酸负离子按SN1历程电离产生碳正离子时,分子内中心碳原子邻近带负电荷的羧基离子,象亲核试剂一样,从连接溴离子的背面向中心碳原子进攻,进行了分子内的类似于SN2反应,生成不稳定的内酯.在此同时,产生碳原子的构型发生了转化.这时,羧基负离子好象在背面固定了碳正离子的构型.
因此,当亲核试剂(HO-)进攻时,就只能从原来溴离子脱离的方向引入,手性碳原子的构型再发生一次转化.经过两次转化,使保持原来的构型不变.在有机化学反应中,有很多与此类似的有邻近基因参与的亲核取代反应.若反应物分子内中心碳原子邻近有:
等基因存在,则空间距离适当时,这些基因就可以借它们的负电荷或未共用电子对参与分子内的亲核取代反应.如:
三、影响亲核取代反应活性的因素
饱和碳原子上的亲核取代反应可按两种不同历程进行.但对一种反应物来说,在一定条件下究竟按什么历程进行,反应活性如何,这与反应物的结构,亲核试剂的性质和溶剂的性质等因素都有密切的关系.
1.烷基结构.
卤代烷烷基的电子效应和空间效应对取代反应活性都有明显的影响.
(1)对SN2历程的影响.
甲基溴、乙基溴、已丙基溴和叔丁基溴在极性较小的无水丙酮中与碘化钾作用是按SN2历程进行的,生成相应的碘化烷.
在SN2反应中,决定反应速率的关键是其过渡态是否容易形成.从电子效应来看:α-碳上电子云密度低,有利于亲核试剂进攻.从空间效应看:当α-碳原子周围取代数目越多,拥挤程度也将越大,对反应所表现的立体障碍也将加大,进攻试剂必须克服空间阻力,才能接近中心碳原子而达到过渡态.所以,从空间效应来说,随着α-碳原子上烷基的增加,SN2反应速率将依次下降.空间效应是最重要的因素.
(2)对SN1历程的影响.
当反应按SN1历程进行时,α-碳原子上的烷基取代基增多,使其反应速率增加.
卤代烷起SN1反应的速率与碳正离子稳定性的次序是一致的.中间体越稳定反应速率越大,SN1电子效应是主要影响因素.综上所述:(反应速度)
在伯碳原子上的亲核取代反应主要按SN2历程进行,在叔碳原子的亲核取代反应主要按SN1历程进行,在仲碳原子的亲核取代反应则根据具体反应条件而定.
空间阻力较大,又不易形成碳正离子的卤代物不易发生SN1、SN2亲核取代反应.
如果被取代的基团连接在桥环化合物的桥头碳原子上进行亲核取代反应时,不论是SN1或SN2历程都是显得十分困难.如:
若亲核试剂按SN2历程,从背面进攻中心碳原子,位阻大,可能性几乎完全被排除.(氯的背面是一个环,亲核试剂不能从背面进攻,所以SN2反应也很难进行)
若按SN1历程进行,氯化物首先要离解为碳正离子,但桥环系统牵制着桥头碳正离子伸展为平面构型,不稳定.因此阻碍了氯化物的解离,取代反应很难进行.
2.离去基团的性质.
亲核取代反应无论按那种历程进行,离去基团总是带着电子对离开中心碳原子的.因此,无论是SN1或SN2反应,离去基团的碱性越弱,在决定速率步骤中愈容易带着电子对离开中心碳原子,即反应物愈容易被取代.假使离去基团特别容易离去,那么反应中有较多的碳正离子中间体生成,反应就按SN1,假使离去基团不容易离去,反应就按SN2.
如:碱性次序 I- < Br- < Cl- .
在卤代烷中它们的离去倾向是:I- > Br- > Cl-
卤代烷的亲核取代反应活性是:RI > RBr > RCl
也可以从C-X键的键能和可极性化来解释.
一些离去基团的离去次序为:
至于碱性很强的基团如:R3C-、R2N-、RO-、HO-等则不能作为离去基团进行亲核取代反应,它们只是在酸性(包括路易斯酸)条件下形成如:R-OH+2、R-OH+-R,使离去基团的碱性相应减弱后,才有可能进行亲核取代反应.如:
3.试剂的亲核性.(指试剂与碳原子的结合能力)
在亲核取代反应中,亲核试剂的作用是提供一对电子与RX的中心碳原子成键,若试剂给电子的能力强,则成键快,亲核性就强.
按SN1进行是时,反应速率只决定于RX的解离,而与亲核试剂无关,因此试剂亲核性的强弱,对反应速率不产生显著影响.
按SN2进行时,亲核试剂参与过渡态的形成,其亲核性能的大小对反应速度将产生一定的影响.一般说,进攻的试剂亲核能力越强,反应经过SN2过渡态所需的活化能就越低,SN2反应越易进行.
试剂亲核性与以下因素有关:
(1)一个带负电荷的亲核试剂要比相应呈中性的试剂更为活泼. 如:HO- > H2O , RO- > ROH
(2)试剂的碱性.
亲核试剂都是带有负电荷或未共用电子对的,所以它们都是路易斯碱,一般说,试剂的碱性愈强,亲核能力也愈强.亲核试剂的亲核能力大致与其碱性强弱次序相对应.
如:EtO- > HO- > C6H5O- > CH3COO- (相同原子负离子越稳定,碱性越弱)
同周期的:R3C- > R2N- > RO- > F- (电负性越大,碱性越弱,越不易提供电子对)
(3)试剂的可极化性.
亲核试剂的可极化性越大,它进攻中心碳原子时,其外层电子就越易变形而伸向中心碳原子,从而降低了形成过渡态时所需的活化能,因此其亲核性能也越强.(碳原子在正电荷的吸引下,亲核试剂负电荷伸向碳正离子)
对碘负离子来说,无论作为亲核试剂还是作为离去基团都表现出很高的活性.因碘负离子可极化性大.亲核性强,碱性弱,易离去.
当伯氯代烷进行SN2水解反应时,常可在溶液中加入少量I-,使反应大为加快,而I-自身却未耗损.
(4)溶剂化作用
卤代烷不溶于水,而亲核试剂往往是无机盐,溶于水而不溶或几乎不溶于非极性有机溶剂中,要使亲核取代反应在溶液中进行,常用醇或其他溶液如丙酮中加水,使两者都能溶解.
①.在醇和水这样的质子溶剂中,亲核试剂与溶剂之间可以形成氢键,即能发生溶剂化作用.带相同电荷的原子,体积小的亲核试剂,形成氢键的能力强,溶剂化作用大,这样,削弱了亲核试剂与中心碳原子之间的作用,其亲核性受到溶剂的抑制最为显著,而象I-这样体积较大的试剂,被溶剂化较小,故表现出强的亲核性能.
②.在非质子溶剂(DMSO,DMF)中,亲核性为: F- > Cl- > Br- > I-.这是因为负电荷裸露在外,正电荷被掩蔽,它易溶剂化正离子,而不易溶剂化亲核试剂负离子.这样的负离子是"赤裸裸"的,有较大的亲核性.亲核性即亲核试剂与碳原子 结合的能力.F-与碳为同周期,轨道大小相近、重叠好,F-C键能大,故在非质子溶剂中F-的亲核性最大.
4.溶剂的影响.
溶剂和分子或离子通过静电的作用称为溶剂化效应.对SN1历程:
过渡态的极性大于反应物,因此,极性大的溶剂对过渡态溶剂化的力量也大于反应物,这样溶剂化释放的能量也大,所以离解就能很快地进行.增加溶剂的极性能够加速卤代烷的离解,对SN1历程有利.
SN2历程:
亲核试剂电荷比较集中,而过渡态的电荷比较分散,也就是过渡态的极性不及亲核试剂,因此,增加溶剂的极性,反而使极性化大的亲核试剂溶剂化,而对SN2过渡态的形成不利.因此,在SN2历程中增加溶剂的极性一般对反应不利.极性小的溶剂对SN2有利.如:C6H5CH2Cl水解的反应,在水中按SN1历程,在极性较小的丙酮中则按SN2历程进行.一般来说,在极性不太弱的溶剂(如含水乙醇)中,叔卤代烃的取代反应是按SN1历程进行.在极性不太强的溶剂(乙醇)中,伯卤代烃的取代反应是按SN2进行.仲卤代烃的取代反应则按两种历程进行,通常是以SN2为主.改变溶剂的极性和溶剂化的能力,常可改变反应历程.在极性很大的溶剂(甲酸)中,伯卤代烷也按SN1.在极性小的非质子性溶剂中(无水丙酮,介电常数21)中,叔卤代烃也可按SN2进行. - 1年前
相关推荐
- 下列说法中错误的是:( )A. SO2、SO3都是极性分子B. 在NH4+和[Cu(NH3)4]2+中都存在配位键C.
下列说法中错误的是:( )
A. SO2、SO3都是极性分子
B. 在NH4+和[Cu(NH3)4]2+中都存在配位键
C. 元素电负性越大的原子,吸引电子的能力越强
D. 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 eye之清水眸子1年前1
eye之清水眸子1年前1 -
 roto_2006 共回答了14个问题
roto_2006 共回答了14个问题 |采纳率78.6%解题思路:A、对于ABn型共价分子,若中心原子A达到了最高正价,没有孤对电子时,为非极性分子,若中心原子未达到最高正价,有孤对电子对,为极性分子.
B、配位键形成条件:一是中心原子或离子,它必须有能接受电子对的空轨道;二是配位体,组成配位体的原子必须能提供配对的孤对电子.
C、电负性是元素的原子在化合物中吸引电子能力的标度,电负性越大,表示该元素的非金属性越强.
D、原子晶体中,组成晶体的微粒是原子,原子间的相互作用是共价键,共价键结合牢固,原子晶体的熔、沸点高,硬度大,不溶于一般的溶剂,多数原子晶体为绝缘体.A、SO2中心原子S的化合价为+4价,最外层电子未全部参与成键,含有孤对电子对,为极性分子;SO3中心原子S的化合价为+6价,最外层电子全部参与成键,没有孤对电子对,SO3是平面三角形的分子,是非极性分子,故A错误;
B、氨气分子与氢离子通过配位键形成NH4+,铜离子提供空轨道,氨气分子提供孤对电子对,Cu2+与NH3通过配位键形成
[Cu(NH3)4]2+,故B正确;
C、电负性是元素的原子在化合物中吸引电子能力的标度,元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性数值越小,相应原子在化合物中吸引电子的能力越弱,故C正确;
D、原子晶体中相邻原子间以共价键结合而形成的空间网状结构的晶体,共价键结合牢固,原子晶体的熔、沸点高,硬度大,故D正确.
故选:A.点评:
本题考点: 极性分子和非极性分子;元素电离能、电负性的含义及应用;配合物的成键情况;晶体的类型与物质熔点、硬度、导电性等的关系.
考点点评: 综合性较大,涉及分子极性、配位键、电负性、晶体结构与性质,难度不大,注意基础知识的掌握.1年前查看全部
- 如图,根据通电螺线管外小磁针的极性,判断通电螺线管内的小磁针的极性及电源的极性.
 136457261年前0
136457261年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 分子极性大小应该如何判断?谁能回答一下 最好能用高中范围知识解释
 龙飞语1年前1
龙飞语1年前1 -
 soa0932 共回答了18个问题
soa0932 共回答了18个问题 |采纳率66.7%极性大小的判断是大学无机化学的内容,可以根据键能来进行计算,中学阶段只要求定性的了解!
是否是极性分子,以及极性的大小,与分之中正负电子中心有关!正负电荷中心中和或抵消,就是非极性分之,否则就是极性分之!
高中阶段最好直接记住常见的几个就好了!1年前查看全部
- 极性分子中键的极性对称可以抵消不对称就不可以抵消 为什么呢
极性分子中键的极性对称可以抵消不对称就不可以抵消 为什么呢
对称为什么能抵消呢 BBDOG1年前1
BBDOG1年前1 -
 dicklin 共回答了20个问题
dicklin 共回答了20个问题 |采纳率80%很简单啊
假设你左右胳膊各有一个人拉你
如果你们三人站一直线上(对称)
你本身会留在原地动不了
但是那两个人成其他角度拉你
你肯定被落在一边了
就这么个道理1年前查看全部
- 非极性共价键和极性共价]键怎么分别?
非极性共价键和极性共价]键怎么分别?
是两种不同元素之间形成的键都是非极性吗?还是对称的才是呢?
那,极性呢?怎么分别呢? 7790894881年前1
7790894881年前1 -
 mouse-mouse 共回答了20个问题
mouse-mouse 共回答了20个问题 |采纳率95%1、非极性共价键:由同种元素的原子间通过共用电子对形成的共价键,又称为非极性键.
存在于非金属单质中.某些共价化合物分子中也有非极性键,如:H2O2中的O-O键,C2H6中的C-C键等.少数离子化合物中也有非极性键,如:Na2O2中的O-O键,CaC2中的碳碳三键等.
2、极性共价键:不同种元素的原子形成分子时共用电子对偏向吸引电子能力强的原子而形成的共价键,又称为极性键.
所有的共价化合物分子中都存在极性键,离子化合物的原子团中也存在极性键.1年前查看全部
- 五氯化磷是非极性分子吗
 dongshuaijie1年前2
dongshuaijie1年前2 -
 ary006 共回答了21个问题
ary006 共回答了21个问题 |采纳率90.5%是,五氯化磷中心原子磷为sp3d2杂化,构形为三角双锥,五个氯在五个顶点上,正负电荷重心重合,所以为非极性分子1年前查看全部
- 关于晶体的判断问题?双原子分子一定是极性分子,分子晶体中一定有共价键,为什么都不对?
 那孩子不是我的1年前1
那孩子不是我的1年前1 -
 rosaponselle 共回答了27个问题
rosaponselle 共回答了27个问题 |采纳率70.4%第一句的反例:氢气,双原子非极性分子
第一句的反例:固态的稀有气体,单原子分子晶体,里面没有共价键1年前查看全部
- 力的大小:离子键>共价键(极性键>非极性键)>金属键>氢键>分子间作用力?力越大该化合物越稳定吗?
 linyyky1年前1
linyyky1年前1 -
 118129099 共回答了15个问题
118129099 共回答了15个问题 |采纳率86.7%一般,氢键>分子间力
但是前3个,不能这样排,没有可比性
很多的共价键强度是大于离子键的
为什么有些化合物左正价右负价?而又有一些是左负价右正价?究竟为什么会这样?我应怎么分辨?
金属都是正价,非金属大部分都是负价..总的来说,元素中期表靠近左下方的元素多是正价,右上方的多是负价.比如NaF,氟就是-1价,钠是+1价.见到物质以后想想它们在元素周期表的位置或者是氧化性和还原性,因为氧化性元素都是负价,还原性元素都是正价.这两种方法通用的.化合价和左右没什么关系的..
希望对你有所帮助..1年前查看全部
- 化学键的极性大小看什么如此题:下列物质中,建的极性大小不正确的是A.Nacl>Hcl>cl2 B.ccl4>cBr4 C
化学键的极性大小看什么
如此题:下列物质中,建的极性大小不正确的是A.Nacl>Hcl>cl2 B.ccl4>cBr4 C.siF4>co2 D.NH3>H2O>HF. hainan58851年前3
hainan58851年前3 -
 lijie520csp 共回答了18个问题
lijie520csp 共回答了18个问题 |采纳率72.2%看成键原子的电负性之差,差值越大,则键的极性越大.
电负性有周期性变化
同周期,从左到右,增大
同主族,从上到下,减小
所以
A.Nacl>Hcl>cl2 --正确,NaCl是离子键,相当于极性很大的极性键,HCl是极性共价键,Cl2是非极性键
B.ccl4>cBr4 --对,C相同,Cl的电负性大于Br,所以C-Cl键的极性大
C.siF4>co2 --对,Si的电负性比C小,F的电负性比O大,所以SiF4中的电负性差异更大,键的极性也大
D.NH3>H2O>HF--错,H相同,N、O、F的电负性增大,所以HF键的极性最强1年前查看全部
- 什么是硅-磷键?硅磷键 这种物质的化学和物理性质是什么?一般情况下是如何产生的?具体些等吗?比如:它属于哪类?极性键、非
什么是硅-磷键?
硅磷键 这种物质的化学和物理性质是什么?一般情况下是如何产生的?
具体些等吗?比如:它属于哪类?极性键、非极性键、配位键、单键、双键、叁键、σ键、π键.性质是最想知道的.还有有什么简单的获取方法? shanhu78781年前1
shanhu78781年前1 -
 dongliqianting 共回答了26个问题
dongliqianting 共回答了26个问题 |采纳率84.6%可能为共价键,在分子中P(SiH3)3中可以存在1年前查看全部
- 什么是 共价键 离子键 极性键 非极性键 共价化合物 离子化合物 说通俗些
 闲-饮1年前5
闲-饮1年前5 -
 冰豆浆 共回答了21个问题
冰豆浆 共回答了21个问题 |采纳率90.5%1.两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比较稳定的化学结构叫做共价键
2.离子键阴离子,阳离子间通过静电作用形成的化学键.
3.由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的
原子一方,因而吸引电子能力较弱的原子一方相对的显正电性.这样的共价键
叫做极性共价键
4.由同种元素的原子间形成的共价键,叫做非极性键1年前查看全部
- 如图所示的通电螺线管,周围放着能自由转动的a、b、c、d,当它们静止时极性正确的是(N为黑色)( )
如图所示的通电螺线管,周围放着能自由转动的a、b、c、d,当它们静止时极性正确的是(N为黑色)( )
 A. a
A. a
B. b
C. c
D. d 白衣方歌吟1年前1
白衣方歌吟1年前1 -
 天地only沙鸥 共回答了13个问题
天地only沙鸥 共回答了13个问题 |采纳率84.6%解题思路:知道电流方向,根据安培定则判断螺线管的磁极,根据磁极间的作用判断小磁针的磁极.电流从螺线管的左端进入,从右端流出,根据安培定则知,螺线管的右端是S极,左端是N极;根据同名磁极相互排斥,异名磁极相互吸引,所以a的右端应该是S极(正确),b的右端是N极(错误),c的右端是N极(错误),d的左端是N极(错误).
故选A.点评:
本题考点: 通电螺线管的极性和电流方向的判断.
考点点评: 知道螺线管的电流方向、磁极、小磁针的磁极、磁感线中的任意一者,都可以根据磁极间的作用和安培定则判断另外几者.1年前查看全部
- 离自键 非极性公价键 极性共价键 氢键 分子间作用力都解释下
离自键 非极性公价键 极性共价键 氢键 分子间作用力都解释下
是的话,那是人类所了解的四种自然作用中的那些 clover111年前1
clover111年前1 -
 wangpeng279 共回答了24个问题
wangpeng279 共回答了24个问题 |采纳率95.8%是
离子键是阴阳离子之间的强相互作用
极性共价键是相同原子之间的强相互作用
非极性共价键是相同原子之间的强相互作用
氢键是N、O、F和氢原子之间形成的弱相互作用(但强于一般的分子间作用力)
分子间作用力是分子间形成的弱相互作用1年前查看全部
- 磷化氢是极性还是非极性,
 雨尘丫头1年前2
雨尘丫头1年前2 -
 mythmaker0_0 共回答了9个问题
mythmaker0_0 共回答了9个问题 |采纳率100%磷化氢 PH3
P原子最外层有5个电子,其中有3个电子与H原子形成共价键,还有两个电子是孤对电子,所以是非极性的.
或者从化合价角度看,P是-3价,不是最高价(+5价),也能说明PH3是极性分子.1年前查看全部
- 羰基为什么是极性的?原话是:因为羰基的极性,醛和酮是极性化合物,因此分子间产生偶极--偶极吸引力.
 青花40201年前1
青花40201年前1 -
 宋朝苏轼 共回答了20个问题
宋朝苏轼 共回答了20个问题 |采纳率65%-C=O羰基中的碳氧双键是不同种元素的原子间形成的极性共价键.1年前查看全部
- 如图甲所示为某一型号二极管,其两端分别记为A和B.图乙为它的伏安特性曲线,其外表所标示的极性已看不清,为确定该二极管的极
如图甲所示为某一型号二极管,其两端分别记为A和B.图乙为它的伏安特性曲线,其外表所标示的极性已看不清,为确定该二极管的极性,用多用电表的电阻档进行测量.
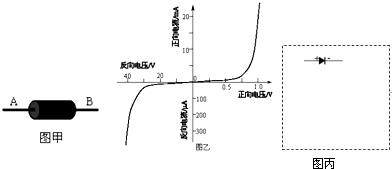
(1)首先对多用电表进行机械调零,然后将红、黑表笔正确插入插孔后,选用×100档进行测量,在测量前要进行的操作步骤为:______
(2)将多用电表的红表笔与二极管的A端、黑表笔与二极管的B端相连时,表的指针偏转角度很大;调换表笔的连接后,表的指针偏转角度很小,由上述测量可知该二极管的正极为______端(填“A”或“B”)
(3)当给该二极管加上反向30V电压时,用伏安法测量其电阻值,提供的器材有:
①直流40V电源;
②电流表A1,量程0.6A,内阻约10Ω;
③电流表A2,量程50μA,内阻约100Ω;
④电压表V,量程为50V,内阻约100kΩ;
⑤滑动变阻器,总电阻100Ω;
⑥开关、导线若干.
在提供的两块电流表中应选用______(填“②”或“③”),在虚线框内画出实验电路图丙(二极管的符号已画在图中). 似魔似幻滴凌乱1年前0
似魔似幻滴凌乱1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 我想做一个磁铁极性检测装置,工作原理,用霍尔开关靠近磁极,如果是N极,则于霍尔开关串联的发光二极管灯亮,整个电路用直流电
我想做一个磁铁极性检测装置,工作原理,用霍尔开关靠近磁极,如果是N极,则于霍尔开关串联的发光二极管灯亮,整个电路用直流电路实现.
不知道这个方案可不可行,还望大家多多指点!
回答完美 再追分!
本实用新型公开一种磁铁极性识别装置,在壳体的前端安放磁敏感元件,磁敏感元件的正极通过开关、电阻分别接电池的正极,其负极接电源的负极.在磁敏感元件的输出端分别接有两个支路,一个支路通过两个二极管和一个发光二极管接磁敏感元件的正极,另一个支路通过另外两个二极管和一个发光二极管接磁敏感元件的负极.开关闭合时,磁敏感元件接入回路,当有外界磁场接近时,磁敏感元件输出端的电位将发生变化,使其中一个支路的二极管和发光二极管导通点亮,使磁铁的极性得到识别.本装置是利用霍尔效应,充分利用了在不同磁铁极性下磁敏感元件所产生电压的差异,结构简单,使用携带方便,适合在加速器磁铁及其它磁铁相关领域中得到应用. 原理和这说的差不多 ,帮我画个图呗! 姜纲炳1年前1
姜纲炳1年前1 -
 jms_2005 共回答了20个问题
jms_2005 共回答了20个问题 |采纳率95%用单极性霍尔开关,可以实现,单极霍尔开关一般是用S极驱动有字的那面,N极驱动无字的那面
引脚:看着霍尔有字的那面,最左边的脚是电源(1脚),中间的是接地(2脚),右边的是输出(3脚).
电路:
1、2脚接电源24V以内都可以
2、3脚接LED灯
1、3脚接上拉电阻1K左右即可
作用:如果磁铁靠近霍尔有字的那面,如果LED灯有反应,那么则是磁铁S极靠近霍尔,如果LED灯没反应,则是N极在靠近霍尔
反过来,磁铁靠近霍尔开关无字的那面,LED灯有反应,则是N极在靠近霍尔1年前查看全部
- 下列关于水的叙述,不正确的是A.水能使细胞的温度基本稳定在一定范围 B.水是各种极性分子和离子的溶剂选哪个
 hongte123451年前6
hongte123451年前6 -
 鹊192 共回答了19个问题
鹊192 共回答了19个问题 |采纳率94.7%A
细胞一个温度调控系统来调节其温度,主要原理是对代谢速率的控制产生或减少热量1年前查看全部
- 极性较低容易溶于极性高的有机溶剂吗?还有,乙醇的浓度越高,为什么越易溶解极性小的物质,
极性较低容易溶于极性高的有机溶剂吗?还有,乙醇的浓度越高,为什么越易溶解极性小的物质,
乙醇的浓度和它的极性有什么关系? 社長千金tt1年前1
社長千金tt1年前1 -
 汤多比 共回答了21个问题
汤多比 共回答了21个问题 |采纳率95.2%乙醇的极性比水小,所以乙醇的浓度越高越易溶解极性小的物质1年前查看全部
- 蛋白质为什么是极性的?是因为R基还是因为顶端的NH3+和COO-?
 3827841年前2
3827841年前2 -
 sbin520 共回答了23个问题
sbin520 共回答了23个问题 |采纳率87%蛋白质的极性与否主要是由R基决定.除了R基之外,一个蛋白质通常只有一个NH3+和COO-,它们对极性与否的贡献很小.1年前查看全部
- 只有非金属原子才能构成共价键吗举个例子 什么叫极性非极性共价键和配位键
 idmeid1年前1
idmeid1年前1 -
 zhkun1 共回答了23个问题
zhkun1 共回答了23个问题 |采纳率87%氯化铝是特例,金属化合物形成的共价.极性非极性是按分子结构是否对称来划分,对称是非极性,不对称是极性.要想在这点上高分或全分,就要熟悉基本的化合物的分子结构是否对称.1年前查看全部
- 物质的电子式怎么写啊,怎么判断共价键,极性键,非极性键于离子键等啊,最好举点例子
 xiaguoquan1年前2
xiaguoquan1年前2 -
 Laufei 共回答了20个问题
Laufei 共回答了20个问题 |采纳率85%电子式就是在元素符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子.
比如说钠:×Na或者·Na镁:×Mg×或者 ·Mg·
判断共价键,极性键,非极性键和离子键,先要知道定义
离子键:指阴离子,阳离子间通过静电作用形成的化学键.
共价键:原子间通过共享电子所形成的化学键.
极性键:在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性.这样的共价键叫做极性共价键,简称极性键.
非极性键意思相反,由同种元素的原子间形成的共价键,叫做非极性共价键.
了解定义,做题再仔细分析,记住有离子键的一定是离子化合物,有共价键的不一定是共价化合物,共价化合物只有共价键.
 1年前查看全部
1年前查看全部
- 怎么判断一个物质含有极性键还是非极性键
怎么判断一个物质含有极性键还是非极性键
C2H2含有极性还是非极性?
是C2H4 ShiHQ1年前1
ShiHQ1年前1 -
 云自飘飘月自明 共回答了17个问题
云自飘飘月自明 共回答了17个问题 |采纳率100%离子化合物一般就是指的金属元素和非金属元素组成的化合物(比如氯化钠),非极性键就是指相同元素组成的共价键比如氧气中的非极性键,氯气中的非极性键,非极性键一般就是在非金属之间产生,所以判断的时候看有没有2个非金属元素在一起形成一个价键,并且还连有一个金属元素,这样的就是题干要求的化合物了,比如过氧化钠,两个氧元素组成了过氧离子是非极性键,和钠元素结合形成了离子化合物1年前查看全部
- 正相色谱溶剂的极性增大保留时间如何变化
 black_knight1年前2
black_knight1年前2 -
 hjqk 共回答了14个问题
hjqk 共回答了14个问题 |采纳率85.7%保留时间越小.1年前查看全部
- 极性分子中键的极性对称可以抵消不对称就不可以抵消 为什么呢
 李安森1年前1
李安森1年前1 -
 红骆驼555 共回答了13个问题
红骆驼555 共回答了13个问题 |采纳率92.3%就像是力的平衡一样,要大小相等才能抵消,不对称就是力的大小不一样!1年前查看全部
- 根据如图的磁感线,确定磁极A的极性,并判断电源正负极.
 lim2cn1年前0
lim2cn1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 二氯化锡是极性分子吗,谢谢各位大神
 不是老白1年前1
不是老白1年前1 -
 痛快安可 共回答了21个问题
痛快安可 共回答了21个问题 |采纳率100%是极性分子1年前查看全部
- 电火花极性效应产生的根本原因?窄脉宽和宽脉冲放电时各采用哪种极性,并说明理由.
电火花极性效应产生的根本原因?窄脉宽和宽脉冲放电时各采用哪种极性,并说明理由.
书上找不到 gemini_F911年前1
gemini_F911年前1 -
 weigd525 共回答了14个问题
weigd525 共回答了14个问题 |采纳率85.7%电火花加工时,无论是正极还是负极都会受到不同程度的电腐蚀.即使两个电极材料相同也往往会出现正,负两极的蚀除速度不一样,这种现象就是极性效应.在生产中,把工件接脉冲电源正极时的加工称为正极性加工,反之则称为负极性加工.短脉宽精加工选用正极性加工,长脉宽加工时,选用负极性加工.理由就是为了减小电极损耗1年前查看全部
- 下列各组物质中,都是由极性键构成为极性分子的一组的 A.CH 4 和 H 2 O B.CO 2 和 HCl C.NH 3
下列各组物质中,都是由极性键构成为极性分子的一组的
A.CH 4 和 H 2 O B.CO 2 和 HCl C.NH 3 和 H 2 S D.HCN 和 BF 3  loverain7111年前1
loverain7111年前1 -
 ai_zcw 共回答了22个问题
ai_zcw 共回答了22个问题 |采纳率95.5%C
甲烷、CO 2 、BF 3 都是非极性分子,所以答案选C。1年前查看全部
- 一道关于电子键化学题目哪些物质含有极性键,哪些含有非极性键.极性键只有共价化合物才有吗?共价化合物主要有那些物质?怎么判
一道关于电子键化学题目
哪些物质含有极性键,哪些含有非极性键.极性键只有共价化合物才有吗?共价化合物主要有那些物质?怎么判断哪些是极性键哪些是非极性键! copyna1年前3
copyna1年前3 -
 gomars15 共回答了19个问题
gomars15 共回答了19个问题 |采纳率84.2%在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性.这样的共价键叫做极性共价键,简称极性键.
由同种元素的原子间形成的共价键,叫做非极性共价键
在做这样的题目的时候,要区分两组不同的概念.
第一.极性键和非极性键的概念.
第二.极性分子和非极性分子的概念.
离子键 阴阳离子通过静电作用所形成的化学键
阴、阳离子间的相互作用
活泼金属和不活泼非金属通过得失电子形成离子
共价键
非极性键 原子间通过共用电子对而形成的化学键
共用电子对不发生偏移
相同非金属元素原子的电子配对成键
极性键 共用电子对偏向一方原子
不同非金属元素原子的电子对配对成键
以极性键结合成的多原子分子可能是极性分子,也可能是非极性分子,这取决于分子中各键的空间排列.如果分子能造成键的极性互相抵消的就生成非极性分子,如:CO2,如果整个分子的结构不能造成键的极性互相抵消,就生成极性分子
1、以非极性键结合的双原子分子必为非极性分子,如Cl2、H2等;
2、以极性键结合的双原子分子一定是极性分子,如HCl、NO等;
3、以极性键结合的多原子分子,是否是极性分子,由该分子的分子空间结构决定,如H2O为极性分子,如CO2为非极性分子
【同种原子之间的是非极性键
极性键存在于不同种元素间
但是存在极性键的物质不一定是极性分子】
区分极性分子和非极性分子的方法:
非极性分子的判据:中心原子化合价法和受力分析法
1、中心原子化合价法:
组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl5
2、受力分析法:
若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF3
3、同种原子组成的双原子分子都是非极性分子.
不是非极性分子的就是极性分子了!
高中阶段知道以下的就够了:
极性分子:
HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH
非极性分子:
Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油1年前查看全部
- 为什么该有极性溶剂就可以是pi—pi* 跃迁的吸收峰长移啊
 sih4_4081年前1
sih4_4081年前1 -
 伤了心的我伤心 共回答了13个问题
伤了心的我伤心 共回答了13个问题 |采纳率84.6%在吸收光谱中,随着溶剂的极性增大,极性大的p*轨道会被稳定化的更多一些.从而导致p-p*能级差减小,产生光谱的红移.1年前查看全部
- 苯甲酸与甲苯的极性大小
 wangjiashy1年前1
wangjiashy1年前1 -
 绿妒轻裙 共回答了18个问题
绿妒轻裙 共回答了18个问题 |采纳率94.4%苯甲酸是酸极性比甲苯的极性强1年前查看全部
- 含几个碳的烃开始是极性分子,请尽快回答,我存在困惑啊,谢谢
 mind08291年前2
mind08291年前2 -
 lijinguo_123 共回答了13个问题
lijinguo_123 共回答了13个问题 |采纳率100%甲烷,乙烷,乙烯,乙炔都不是极性分子.
丙烷有极弱的极性.即从三个碳的烃开始 有可能 是极性分子.1年前查看全部
- 为什么原子对称排列 键的极性会抵消
 werth1年前1
werth1年前1 -
 zzq5160 共回答了21个问题
zzq5160 共回答了21个问题 |采纳率100%O=C=O,关于中心原子对称,力O对C左边的电子束缚和右边的能力相等,所以抵消,如果是同位素则不然1年前查看全部
- 乙醛分子中有几个极性键,其中碳氧双键是算一个极性键还是两个?
 az246891年前2
az246891年前2 -
 nie1981 共回答了23个问题
nie1981 共回答了23个问题 |采纳率95.7%有五个极性键,碳氧双键算一个1年前查看全部
- 以下关于甲烷的说法中错误的是 ( ) A.甲烷分子是由极性键构成的分子 B.甲烷分子具有正四面体结构 C.甲烷分子中四
以下关于甲烷的说法中错误的是 ( )
A.甲烷分子是由极性键构成的分子 B.甲烷分子具有正四面体结构 C.甲烷分子中四个C—H键是完全等价的键 D.甲烷分子中具有非极性键  ncspider1年前1
ncspider1年前1 -
 喜欢樱桃的女巫 共回答了23个问题
喜欢樱桃的女巫 共回答了23个问题 |采纳率95.7%D
甲烷是极性键构成的非极性分子,正四面体结构,四个C—H键是完全等价的键,D错误。1年前查看全部
- 下列叙述正确的是( ) A.两种元素构成的共价化合物分子中的化学键都是极性键 B.含有非极性键的化合物不一定是共价
下列叙述正确的是( )
A.两种元素构成的共价化合物分子中的化学键都是极性键 B.含有非极性键的化合物不一定是共价化合物 C.只要是离子化合物,其熔点就一定比共价化合物的熔点高 D.只要含有金属阳离子,则此物质中必定存在阴离子  辛辛苦苦找工作1年前1
辛辛苦苦找工作1年前1 -
 bueollowsp 共回答了10个问题
bueollowsp 共回答了10个问题 |采纳率100%B
H 2 O 2 两个O原子之间是非极性键,A选项不正确;Na 2 O 2 是离子化合物,两个O原子之间存在非极性键,B选项正确;二氧化硅的熔点比氯化钠的高,C错误;金属晶体中有金属阳离子和自由电子,没有阴离子,D错误。1年前查看全部
- NA2O2是极性键吗?
 alienken1年前1
alienken1年前1 -
 -偷心- 共回答了24个问题
-偷心- 共回答了24个问题 |采纳率87.5%没有,有离子键和非极性键.
Na2O2中Na+与O22-之间是离子键,O22-中的O与O之间是非极性键.1年前查看全部
- (2009•郑州一模)下列物质分子中,既含有极性键又含有非极性键的非极性分子是( )
(2009•郑州一模)下列物质分子中,既含有极性键又含有非极性键的非极性分子是( )
A.C2H4
B.Br2
C.Na2O2
D.H2O2 蔓妹儿1年前1
蔓妹儿1年前1 -
 xsf04 共回答了27个问题
xsf04 共回答了27个问题 |采纳率100%解题思路:非极性共价键为同种非金属元素的原子间形成共价键;极性共价键是由不同种非金属元素的原子间易形成的共价键;由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,据此进行判断.A.乙烯分子中含有碳氢极性键和碳碳非极性键,由于乙烯分子结构对称,乙烯分子为非极性分子,故A正确;
B.溴分子中共价键为非极性键,不存在极性键,故B错误;
C.过氧化钠为离子化合物,不存在极性键且不属于极性分子,故C错误;
D.H2O2分子中含有氧氢极性共价键和氧氧非极性共价键,但是双氧水结构不对称,属于极性分子,故D错误;
故选:A.点评:
本题考点: 极性键和非极性键;极性分子和非极性分子.
考点点评: 本题考查化学键的极性、分子极性,题目难度不大,明确化学键、分子极性判断的方法是解答本题的关键,注意熟悉常见分子的构型,试题培养了学生灵活应用所学知识解决实际问题的能力.1年前查看全部
- HF和HI哪个极性大?如何判断变形性的大小
 塞外独行客1年前7
塞外独行客1年前7 -
 围巾的夏天 共回答了9个问题
围巾的夏天 共回答了9个问题 |采纳率88.9%HF极性大,因为F的电负性实在太强了,泡林标度里F的电负性是4,最高的.
判断变形性的方法:
1.电子层结构相同的离子,随着负电荷的减小和正电荷的增加而变形性减小.
如:O2->F->(Ne)>Na+>Mg2+>Al3+>Si4+
2.电子层相同的离子,电子层越多,离子的半径越大,变形性越大,
如:I->Br->Cl->F-
3.影响离子变形性的主要因素
(1)离子的电子层构型相同,正电荷越高的阳离子变形性越小.
例如:O2- > F- > Ne > Na+ > Mg2+ > Al3+ > Si4+
(2)离子的电子层构型相同,半径越大,变形性越大.
例如:F- < Cl- < Br- < I-
(3)若半径相近,电荷相等,18电子层构型和不规则(9—17电子)构型的离子,其变形性大于8电子构型离子的变形性.
例如:Ag+ > K+ ; Hg2+ > Ca2+
(4)复杂阴离子的变形性通常不大,而且复杂阴离子中心原子氧化数越高,其变形性越小.
例如:ClO4- < F- < NO3- < H2O < OH- < CN- < Cl- < Br- < I- SO42- < H2O < CO32- < O2- < S2-
从上面的影响因素看出,最容易变形的离子是体积大的阴离子(如I-、S2-等)和18电子层或不规则电子层的少电荷的阳离子(如:Ag+、Hg2+等).最不容易变形的离子是半径小,电荷高,8电子构型的阳离子(如:Be2+、Al3+ 、Si4+等).1年前查看全部
- 水与DMF相比,哪个极性更大?
 孤独潮1年前1
孤独潮1年前1 -
 伊人喵喵 共回答了19个问题
伊人喵喵 共回答了19个问题 |采纳率89.5%DMF二甲基甲酰胺是强极性溶剂没水的极性强1年前查看全部
- 醇分子中,碳原子上烷基越多,给电子效应增强,为什么C-O键的极性就增强;
醇分子中,碳原子上烷基越多,给电子效应增强,为什么C-O键的极性就增强;
然后为什么C-O键极性越强,醇分子就越容易与卢卡斯试剂反应 夏日棉花糖1年前2
夏日棉花糖1年前2 -
 受伤的老狗 共回答了11个问题
受伤的老狗 共回答了11个问题 |采纳率81.8%因为烷基是给电子基,羟基是吸电子基,所以,使得羟基和烷基连接的力变强,不易断键1年前查看全部
- 重点离子键,共价键还有书写方式,极性键 本人高中生,老师不讲清楚 做题遇到,最好全面点.(》2000字)
 barbee鱼1年前1
barbee鱼1年前1 -
 shcrl 共回答了16个问题
shcrl 共回答了16个问题 |采纳率93.8%1. 离子键与化学键的比较 类型 成键本质 成键条件 表示方法(电子式) 离子键 阴、阳离子间通过静电作用形成 成键原子得、失电子能力差别很大 共价键 非极性键 相邻原子间通过共用电子对(电子云重叠)与原子核间的静电作用形成 成键原子得、失电子能力相同 极性键 成键原子得、失电子能力差别较小 2. 化学键与分子间作用力的比较 类型 化学键 分子间作用力 概念 相邻原子间强烈的相互作用 把分子聚集在一起的作用力 存在 分子内或某些晶体内 分子间 强弱 作用较强,一般在 10~600 作用较弱,一般只有 性质影响 主要影响物质的化学性质,化学反应的本质就是旧化学键的断裂和新化学键的形成过程 主要影响物质(由分子构成)的熔沸点、溶解度等物理性质 3. 离子键的强弱与阴、阳离子的半径大小以及电荷数的多少有关.离子半径越小,电荷数越多,离子键的作用就越强. 共价键的强弱与成键双方原子核间距有关.原子半径越小,原子核间距就越小,共价键就越牢固,作用就越强. 离子键的强弱影响离子化合物的熔沸点、溶解度等,共价键的强弱往往会影响分子的稳定性或一些物质的熔沸点. 化学键的强弱与成键微粒的关系 4. 化学键与物质类别的关系1)只含有非极性共价键的物质:同种非金属元素形成的单质,如金刚石等.2)只含有极性共价键的物质:一般是不同种非金属元素形成的共价化合物如氯化氢,氨气.3)既含有极性键又含有非极性键的物质 过氧化氢.4)只含有离子键的物质:活泼金属与活泼非金属形成的化合物 氯化钠.5)既含有离子键又含有非极性键的物质 过氧化纳.6)同时含有离子键、共价键和配位键的物质 氯化铵7)只含有共价键而无范德华力的化合物:原子晶体的化合物 碳化硅.8)无化学键的物质:稀有气体,如氦、氖、氩等.1年前查看全部
- 生长素在成熟器官中的运输方向?植物生长素的极性运输,生长素在成熟器官中的运输可以是横向运输吗?
 风吹大树1年前1
风吹大树1年前1 -
 you明媚 共回答了25个问题
you明媚 共回答了25个问题 |采纳率88%可以,但要有单侧光才可以进行横向运输的,极性运输不一定要单侧光.
横向运输就是指生长素由茎(光源)的一侧横向移动到另一侧(背光)的运输方式.由此造成的生长素分布不均实际上应与电荷分布有关.1年前查看全部
- 解释一下天然药物化学的极性,谢谢
解释一下天然药物化学的极性,谢谢
什么是极性?解释一下是什么概念 bbsong1年前1
bbsong1年前1 -
 雨嫁之殇 共回答了18个问题
雨嫁之殇 共回答了18个问题 |采纳率100%有的分子是对称结构,分子的正负电荷重心重合,就叫非极性分子,如CH4、CO2等;有的分子不是对称结构,分子的正负电荷重心不能重合,就叫极性分子,如HCl、CO等.1年前查看全部
- 咋区别极性键和非极性键,还有什么是极性分子,非极性分子,咋判断?
 yogo8881年前4
yogo8881年前4 -
 蓝雨纷飞 共回答了26个问题
蓝雨纷飞 共回答了26个问题 |采纳率88.5%成键两原子相同且环境也相同:非极性键,否则极性键.
如F3C-CH3中的C-C、C-H、C-F都为极性键,H3C-CH3中的C-C为非极性键.
正负电荷重心重合:非极性分子;
正负电荷重心不重合:极性分子.1年前查看全部
- 什么是正极性雷电?负极性雷电?
 眼下任务1年前1
眼下任务1年前1 -
 smw555 共回答了14个问题
smw555 共回答了14个问题 |采纳率85.7%即雷云是正极性的,产生的雷电是正极性雷电,负极性雷电同理.1年前查看全部
- 为什么PCl3是非极性分子?怎么看也不是对称的啊
 axelight1年前6
axelight1年前6 -
 吹水神童 共回答了16个问题
吹水神童 共回答了16个问题 |采纳率93.8%估计你是指PCl3易溶于非极性溶剂吧!
其实PCl3是极性分子,原因楼上几个都说的很清楚了.但为什么会易溶于非极性溶剂?主要是它的负电荷与正电荷虽然不重合,但很近,因此极性很弱,所以会易溶于非极性溶剂,而不是极性溶剂.其实极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂,这个原则不是万能的,最常见的例子就是CO,CO是极性分子(很明显),但它在水中的溶解度很小很小!1年前查看全部
大家在问
- 1阅读理解六、完型填空 (10’) My wife and I spent a few weeks in London l
- 2“等会儿3点半见 别忘了” 请翻译成英文
- 3生物是一门实验科学。下面是普通显微镜及相关实验技术应用,请回答:
- 4一位青年将月工资的一半存入银行,又将剩下的一半又10元用于生活费,还花了25元买了两本书,这时还剩下120元钱.问:这位
- 5关于透镜的应用,下列叙述正确的是( )
- 6如图,一直AC⊥BC,CD⊥AB,HF⊥AB,∠1与∠2互补,判断DE与AC是否垂直,并说明理由(等有钱在给 啊)
- 7晗的意思
- 8仿写句子 例句:天生才干犹如自然花草,如何修剪移接.天生才干犹如( ),读书然后( )
- 9高中数学提,求推导解决解不等式[(x+1)/(2x-1)] >1 麻烦大神写下啊
- 10(1)石油在炼油厂精馏塔中分馏可得到汽油、煤油、柴油等产品,其中汽油是汽车的主要燃料.请回答:
- 11五年级有24名学生被评为三好学生,占五年级学生人数的1/7,五年级人数占全校学生总数的8/61,全校有多少人
- 12我对极限计算的理解错在哪里?求下列极限:lim1/xsinx x→+∞ 我是这样解的:把原式化成lim1/x 乘以lim
- 13Eating healthy food is good for our health.的意思
- 14作文要求:那一刻,xx理解了xx.难道必须要写发生矛盾的吗?
- 15找困难并不可怕的作文要求:600字有点评最好请快速回答只要 ----并不可怕
