0.2克1片的高锰酸钾兑成0.5%,要加多少水,以矿泉水瓶为标准,请指教!
 5118812022-10-04 11:39:541条回答
5118812022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 千卜宝宝 共回答了17个问题
千卜宝宝 共回答了17个问题 |采纳率88.2%- 溶液的质量=0.2/0.5%=40克,加入水的质量=40-0.2=39.8克,加入水的体积为39.8毫升.
- 1年前
相关推荐
- 帮忙算下在不同速度下的动能Ek=(1/2)×m×v^2 那么M=0.2克;0.25克时 V=100米/秒;110米/秒;
帮忙算下在不同速度下的动能
Ek=(1/2)×m×v^2
那么M=0.2克;0.25克时 V=100米/秒;110米/秒;120 ;130;140;150的的动能分别是多少J
另外 V在 50米/秒 60/秒 70/80/90 的时候 EK是多少J呢 天堂_cool1年前2
天堂_cool1年前2 -
 bigRookie 共回答了21个问题
bigRookie 共回答了21个问题 |采纳率81%请问楼主,不知是哪里错了?
m=0.2g:
1J
1.21J
1.44J
1.69J
1.96J
2.25J
m=0.25g
1.25J
1.5125J
1.8J
2.1125J
2.45J
2.8125J1年前查看全部
- 向100毫升某缓冲溶液中加入0.2克氢氧化钠固体,所得缓冲溶液的PH为5.6.已知原缓冲溶液共轭酸HB的pKa=5.3,
向100毫升某缓冲溶液中加入0.2克氢氧化钠固体,所得缓冲溶液的PH为5.6.已知原缓冲溶液共轭酸HB的pKa=5.3,c(HB=0.25mol/L),求原缓冲溶液的PH
 娃哈哈gb5171年前1
娃哈哈gb5171年前1 -
 野僧1946 共回答了20个问题
野僧1946 共回答了20个问题 |采纳率90%PH=PKa+lg(A/HA),其中PKa=5.3,加入的0.2克氢氧化钠固体与酸发生反应,0.2/40=0.005mol,有lg(A+0.005)/(HA-0.005)=5.6-5.3=0.3,其中HA=0.25mol/L,求得A=0.438839mol/L,所以原缓冲溶液的PH=5.3+lg0.438839/0.25=5.544365.1年前查看全部
- 若6克不纯的锌粉(含杂质甲)和6克不纯的铁粉(含杂质乙),分别与足量的稀硫酸充分反应后,都得到0.2克氢气,则甲、乙可能
若6克不纯的锌粉(含杂质甲)和6克不纯的铁粉(含杂质乙),分别与足量的稀硫酸充分反应后,都得到0.2克氢气,则甲、乙可能是( )
A. 甲为Cu、乙为Zn
B. 甲为Fe、乙为Mg
C. 甲为Mg、乙为Cu
D. 甲为Ag、乙为Al 离堆1年前2
离堆1年前2 -
 ld620 共回答了29个问题
ld620 共回答了29个问题 |采纳率86.2%解题思路:根据金属活动顺序镁>铝>锌>铁>氢>铜>银,铜、银不能与酸反应放出氢气;若金属中混有铜、银,则产生氢气量会偏小;
金属与酸完全反应放出氢气的质量可利用经验推导公式“氢气质量=
×金属质量”求得;金属化合价 金属相对原子质量
使用以上方法,对金属中杂质甲、乙进行推断.根据金属完全反应放出氢气质量的计算公式:氢气质量=
金属化合价
金属相对原子质量×金属质量
6g锌完全反应放出氢气的质量=
2
65×6g≈0.18g<0.2g,则该锌粉中的甲应该是能与酸反应放出氢气的金属,且同等质量的金属甲完全反应产生氢气质量大于锌;而A、D选项中铜、银不能与酸反应产生氢气,故A、D不正确;而等质量的铁、镁与酸完全反应放出氢气的质量都比锌大,因此,B、C选项都有可能是正确的;
6g铁与酸完全反应放出氢气的质量=
2
56×6g≈0.21g>0.2g,则铁粉中金属乙不能与酸反应或虽是能与酸反应放出氢气但等质量的金属乙完全反应放出氢气的质量小于铁;而选项B中等质量的镁完全反应放出氢气的质量大于铁,故B选项不正确;选项C中的乙的铜不能与酸反应,铁粉中混有铜时放出氢气的质量偏小,故C选项正确;
故选C.点评:
本题考点: 含杂质物质的化学反应的有关计算.
考点点评: 等质量的金属镁、铝、锌、铁与足量酸完全反应产生氢气由多到少的顺序为铝>镁>铁>锌,根据这一模型可方便快速地进行判断.1年前查看全部
- 某合金6g与足量的稀硫酸充分反应后,如果生成0.2克氢气该合金中的元素可能是?
某合金6g与足量的稀硫酸充分反应后,如果生成0.2克氢气该合金中的元素可能是?
a.Fe Zn b Cu Au c Zn Cu d Mg Al
我知道B肯定不能选 答案是A为什么?我上网搜了 说什么摩尔什么的我们还没学 别用这个解释了! liveinsummer1年前1
liveinsummer1年前1 -
 szwalter 共回答了19个问题
szwalter 共回答了19个问题 |采纳率94.7%A、锌的相对原子质量是65,铁的中的原子质量是56,根据Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4═FeSO4+H2↑可知,如果生成0.2g氢气时,单独消耗锌的质量是6.5g,单独消耗铁的质量是5.6g,如果铁和锌按照一定的比例组合成6g时,生成的氢气可能是0.2g.故选项正确;
B、铜和金都不能与稀硫酸反应.故选项错误;
C、铜不能与稀硫酸反应,假设合金6g中全部是锌,生成的氢气质量也小于0.2g.故选项错误;
D、镁的相对原子质量是24,铝的相对原子质量是27,由Mg+H2SO4═MgSO4+H2↑,2Al+3H2SO4═Al2(SO4)3+3H2↑可知,如果生成0.2g氢气时,单独消耗镁的质量是2.4g,单独消耗铝的质量是1.8g,镁和铝不管以怎样的比例混合,生成氢气的质量都是大于0.2g的.故选项错误.
故选A1年前查看全部
- 有一含杂质的锌样品10克与足量的稀盐酸反应共产生0.2克氢气,计算样品中锌的纯度?
有一含杂质的锌样品10克与足量的稀盐酸反应共产生0.2克氢气,计算样品中锌的纯度?
(Zn+H2OSO4==ZnSO4+H2↑) lucky781年前5
lucky781年前5 -
 糖果弈 共回答了11个问题
糖果弈 共回答了11个问题 |采纳率90.9%设样品中含Zn的质量为X克.
与足量的稀硫酸的反应式应该是:
Zn+H2SO4==ZnSO4+H2↑
65 2
X 0.2
65/X=2/0.2
X=6.5
样品的纯度=6.5/10*100%=65%
答.1年前查看全部
- 100可稀盐酸与一定量的锌粉恰好反应,称量反应后的溶液比反应前少0.2克.求参加反应的锌的质量?
 言子20061年前1
言子20061年前1 -
 红叶秋雨1515 共回答了12个问题
红叶秋雨1515 共回答了12个问题 |采纳率91.7%减少的质量就是氢气的质量,设反应的Zn为xg
Zn+2HCl->ZnCl2+H2
65/x=2/0.2
x=6.5g1年前查看全部
- 取锌与另一种金属的合金为7克,与足量的稀硫酸充分反应后得到氢气0.2克,则该合金中的另一种金属是
取锌与另一种金属的合金为7克,与足量的稀硫酸充分反应后得到氢气0.2克,则该合金中的另一种金属是
A、铁 B、镁 C、铝 D、铜
假设只有一种7g的金属全部与盐酸反应,能生成多少氢气.
Zn H2
65 2
7 =0.22g
Fe H2
56 2
7 =0.25g
Mg H2
24 2
7 =0.58g
Al 3/2H2
27 3
7 =0.78g
CU不与稀盐酸反应,H2量为0.
由题意知,合金7g反应总共生成0.2gH2,那么由极限法的定义可知道,如果是
7gZn、Fe合金产生H2应该在0.22~0.25之间,
7gZn、Mg合金产生氢气应该在0.22~0.58之间,
7gZn、Al合金产生氢气应该在0.22~0.78之间,
7gZn、CU合金产生氢气应该在0~0.22之间.
综上所述,0.2落在7gZn、CU合金范围内,故应该是CU .
我想问,Al 3/2H2 这里为什么是3/2H2 颓废n1年前1
颓废n1年前1 -
 漠落 共回答了13个问题
漠落 共回答了13个问题 |采纳率92.3%2Al+3H2SO4=Al2(SO4)3+3H2
Al:H2=2:31年前查看全部
- 化学金属计算题1.某Cu-Zn合金共10克,放入足量的稀HCl充分反应后剩余质量减少0.2克则合金中Zn的质量分数.2.
化学金属计算题
1.某Cu-Zn合金共10克,放入足量的稀HCl充分反应后剩余质量减少0.2克则合金中Zn的质量分数.2.放10克Zn于足量CuSO4中,取出后质量变成9.9克,则生成Cu多少克?3.铁铅合金共9.8克与足量HCl充分反应生成0.8克H2,则合金中铁铅各多少克? 烟仔-1年前1
烟仔-1年前1 -
 all_by_myself 共回答了19个问题
all_by_myself 共回答了19个问题 |采纳率84.2%1.Cu-Zn合金中只有Zn能与稀盐酸反应,所以减少的0.2g质量即为合金中Zn的质量,所以质量分数为2%2.Zn+CuSO4=Cu+ZnSO4 1molZn(65g)充分反应置换出1molCu(64g)Δm=-1g,所以金属棒反应前后质量差为0.1g,即有0.1molZn反应置换0.1molCu,因此生成Cu 6.4g.3.Fe+2HCl=FeCl2+H2(气体),Pb+2HCl=PbCl2+H2(气体).0.8gH2为0.4mol,所以有0.4molFe和Pb发生反应,设n(Fe)=a mol,n(Pb)=b mol,因为盐酸足量,所以,合金当中Fe,Pb完全反应.所以n(Fe)+n(Pb)=a+b mol=0.4mol m(Fe)+m(Fe)=56a+207b=9.8g做到这里,我发觉无解.是不是题目错了?提供一个论证题目错误嘎方法,极值法,如果全为铁,则放0.35g H2,如果全为铅,则放出0.095g H2.所以不可能生成0.8g H2.1年前查看全部
- 求0.8克ca,03克mg,0.2克cu,0.01克fe的物质的量之比
 wanda5211年前2
wanda5211年前2 -
 骑猪逛西安 共回答了12个问题
骑猪逛西安 共回答了12个问题 |采纳率91.7%0.8克ca:0.8/40=0.02mol
03克mg:0.3/24=0.0125mol
0.2克cu:0.2/64=0.003125mol
0.01克fe:0.01/56=0.00018mol
自己比吧1年前查看全部
- 6克铁片放入足量盐酸中,共得氢气0.2克,该铁片中混有的杂质可能为?
6克铁片放入足量盐酸中,共得氢气0.2克,该铁片中混有的杂质可能为?
A.碳 B.锌 C.铝 D.镁 双剑下峨嵋1年前3
双剑下峨嵋1年前3 -
 芥末宝贝 共回答了16个问题
芥末宝贝 共回答了16个问题 |采纳率87.5%答案AB
Fe+2HCl=FeCl2+H2↑
因为6gFe反应可以得到比0.2g更加多的H2
所以杂质6g反应得到的H2比0.2g少
A 0g
B 0.018g
C 0.067g
D 0.05g1年前查看全部
- 有杂质的锌8克与足量的稀硫酸反应生成氢气0.2克,(杂质和硫酸不反应),则锌中杂质的百分含量为?
 冲淡1年前1
冲淡1年前1 -
 vv冰 共回答了26个问题
vv冰 共回答了26个问题 |采纳率92.3%Zn+H2SO4=ZnSO4+H2
65 2
X 0.2g
x=6.5g
(8g-6.5g)/8g*100%=18.75%1年前查看全部
- 将一黄铜样品(含锌,铜)7.0克,投入49.0克未知浓度的稀硫酸中,恰好完成反应,生成0.2克氢气.
将一黄铜样品(含锌,铜)7.0克,投入49.0克未知浓度的稀硫酸中,恰好完成反应,生成0.2克氢气.
求:黄铜中锌的质量分数.生成ZnSO4多少克?生成的ZnSO4溶液溶质的质量分数. wsboy1年前1
wsboy1年前1 -
 jc6ew5whe 共回答了22个问题
jc6ew5whe 共回答了22个问题 |采纳率95.5%Zn + H2SO4 = ZnSO4 + H2
65g 161g 2g
a b 0.2g
a= 6.5g
b= 16.1g
黄铜中锌的质量分数 = (6.5/7 )*100% = 92.86%
生成ZnSO4是16.1克
生成的ZnSO4溶液溶质的质量分数= 16.1/(7 + 49 - 0.2 - 0.5)*% = 29.1%1年前查看全部
- 0.2克等于多少毫克
 箥鈑餹oο1年前6
箥鈑餹oο1年前6 -
 受了点殇 共回答了22个问题
受了点殇 共回答了22个问题 |采纳率90.9%1克=1000毫克
0.2克=0.2×1000毫克=200毫克1年前查看全部
- 某六克合金,和足量的稀硫酸反应,生成0.2克氢气,该合金可能是?
某六克合金,和足量的稀硫酸反应,生成0.2克氢气,该合金可能是?
1.Zn和Fe
2.Fe和Mg
3.Mg和Al
4.Mg和Cu
5.Fe和Al
A.1和2
B.3和5
C.4和5
D.1和4 lilianjie_19761年前1
lilianjie_19761年前1 -
 老娘贵姓九三0 共回答了16个问题
老娘贵姓九三0 共回答了16个问题 |采纳率100%答案D,列出涉及的5种金属质量与产生氢气的质量比Zn(65-2)、Fe(56-2)、Mg(24-2)、Al(18-2)、Cu(64-0),而题目是6-0.2即60-2,要是刚好这样产生氢气,所以使得刚好一种金属小于60,一种大于60,符合题意的有1和4两个.1年前查看全部
- 科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.在四支试管中分别加入0.2克二氧化锰 (MnO2)粉
科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.在四支试管中分别加入0.2克二氧化锰 (MnO2)粉
科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.在四支试管中分别加入0.2克二氧化锰 (MnO2)粉末,然后加入等量的不同浓度的过氧化氢溶液,观察气泡产生的速度,记录如下:
实验次数 1 2 3 4
H2O2溶液的浓度 1% 5% 10% 15%
MnO2质量 0.2克 0.2克 0.2克 0.2克
气泡产生的速度 + ++ +++ ++++
(1)该实验研究的问题是:过氧化氢分解的速度与
的关系.
(2)为了检验产生的气体是否为氧气,请你写出检验的方法:
. 牧之银翼1年前1
牧之银翼1年前1 -
 窗外有风吹过 共回答了16个问题
窗外有风吹过 共回答了16个问题 |采纳率100%该实验研究的问题是:过氧化氢分解的速度与 过氧化氢浓度 的关系.
用带火星的木条伸到试管口,若复燃,则是氧气,否则不是1年前查看全部
- 将10克不纯的铁粉投入到100克稀硫酸中,恰好完全反应得到0.2克氧气 求反应后所得溶液质量
 coffee02171年前1
coffee02171年前1 -
 晚安儿 共回答了13个问题
晚安儿 共回答了13个问题 |采纳率100%设铁粉中铁的质量为x.
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.2g
56/x=2/0.2
x=5.6g
反应后所得溶液质量=5.6+100-0.2=105.4g
答:反应后所得溶液质量是105.4g.1年前查看全部
- 不纯的铁片6克与足量的稀硫酸反应,产生氢气0.2克,则铁片中可能含有的杂质是
不纯的铁片6克与足量的稀硫酸反应,产生氢气0.2克,则铁片中可能含有的杂质是
A、Mg
B、Al
C、Zn
D、不含杂质
为什么是 要么不与硫酸反应生成氢气,要么相同质量生成氢气比Fe少 beaora1年前2
beaora1年前2 -
 books_j 共回答了19个问题
books_j 共回答了19个问题 |采纳率89.5%选C
生成0.2g氢气需要Fe:0.2/2*56=5.6g
现在有六克物质,所以肯定有杂志,杂志要么不与硫酸反应生成氢气,要么相同质量生成氢气比Fe少,一一验证就可以知道只有Zn满足题意1年前查看全部
- 称取0.422克无水碳酸钠和碳酸氢钠的混合物,灼烧至恒重,把放出的气体通入足量的澄清石灰水中,生成0.2克沉淀.原混合物
称取0.422克无水碳酸钠和碳酸氢钠的混合物,灼烧至恒重,把放出的气体通入足量的澄清石灰水中,生成0.2克沉淀.原混合物中各物质的量分别为多少
 hhddaa1年前2
hhddaa1年前2 -
 共赏西窗雪 共回答了12个问题
共赏西窗雪 共回答了12个问题 |采纳率83.3%用关系式法:
2NaHCO3---CO2---CaCO3
168 100
m1 0.2g
m1=0.336g
n(NaHCO3)=0.336/84=0.004mol
所以碳酸钠质量为0.442g-0.336g=0.106g
n(Na2CO3)=0.106/106=0.001mol1年前查看全部
- 某不纯的铁粉与稀硫酸反应,5克铁与足量稀硫酸反应生成0.2克氢气问不纯铁粉中混入的杂质是 Amg BZn CCu DAg
 stargate_11年前2
stargate_11年前2 -
 rlxlr 共回答了15个问题
rlxlr 共回答了15个问题 |采纳率86.7%金属产生氢气的质量=金属的化合价/金属的相对原子质量再乘以金属的质量,铁的化合价为+2价,铁的相对原子质量为56,产生0.2克氢气需纯铁应是5.6克,现只有5克铁就产生了0.2克氢气,很容量看出混入的杂质的相对原子质量小于56,而Mg相对原子质量为24,Zn相对原子质量为65,Cu 和Ag不与稀硫酸反应,故混入的杂质是Mg1年前查看全部
- 用锌片与稀硫酸制取0.2克的氢气.含锌90%的锌片多少克?需加含硫酸19.6%的稀硫酸多少克
 这里不下雨1年前1
这里不下雨1年前1 -
 蒿峰 共回答了21个问题
蒿峰 共回答了21个问题 |采纳率90.5%Zn+H2SO4=ZnSO4+H2
65 98 2
x*90% y*19.6% 0.2g
x=7.2g
y=50g1年前查看全部
- 有一块质量为0.2克的镁铝合金,将它溶于500ml的4摩尔每升的盐酸中,若要使沉淀质量达到最大值,则需加入2摩尔每升的氢
有一块质量为0.2克的镁铝合金,将它溶于500ml的4摩尔每升的盐酸中,若要使沉淀质量达到最大值,则需加入2摩尔每升的氢氧化钠溶液体积为【 】
A500ml B100ml C1000ml D1500ml 我的rr被劫持了1年前3
我的rr被劫持了1年前3 -
 没办法 共回答了19个问题
没办法 共回答了19个问题 |采纳率78.9%2Al+6HCl=2AlCl3+3H2
Mg+2HCl=MgCl2+H2
盐酸=2mol
盐酸过量
将盐酸中和的氢氧化钠的量+与AlCl3,MgCl2反应的量=氯离子的量=2mol1年前查看全部
- 将足量的稀硫酸与5.6克某金属充分反映,生成2价金属化合物,并放出0.2克氢气则
将足量的稀硫酸与5.6克某金属充分反映,生成2价金属化合物,并放出0.2克氢气则
(1)该金属的相对原子质量(2)金属名称(3)在元素周期表什么位置
~急啊 dgtgryh1年前1
dgtgryh1年前1 -
 流水潺潺py 共回答了21个问题
流水潺潺py 共回答了21个问题 |采纳率95.2%1.R+H2SO4=RSO4+H2↑
R 2
5.6 0.2 所以R=56
2.Fe
3.在第四周期VIII1年前查看全部
- 如图所示,把质量为0.2克的带电小球A用丝线吊起,丝线与竖直夹角为45°,小球A带的电量qA=-2×10-6C,匀强电场
如图所示,把质量为0.2克的带电小球A用丝线吊起,丝线与竖直夹角为45°,小球A带的电量qA=-2×10-6C,匀强电场的电场强度大小为______N/c.
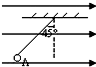
 咫尺天崖51年前2
咫尺天崖51年前2 -
 小圣 共回答了24个问题
小圣 共回答了24个问题 |采纳率83.3%解题思路:对小球受力分析,根据共点力平衡确定电场力的方向,根据电场力的大小求出电场强度的大小.通过受力分析,根据共点力平衡得,电场力F=qE=mgtanθ
解得E=
mgtan45°
q=
0.0002×10×1
2×10−6N/C=1000N/C.
故答案为:1000点评:
本题考点: 匀强电场中电势差和电场强度的关系.
考点点评: 决本题的关键知道正电荷所受的电场力方向与电场强度方向相同,负电荷所受的电场力方向与电场强度方向相反.1年前查看全部
- 2,4-二硝基酚如何溶解?土壤总磷检测中需要将0.2克2,4-二硝基酚溶于100mL水中,可是2,4-二硝基酚在常温中溶
2,4-二硝基酚如何溶解?
土壤总磷检测中需要将0.2克2,4-二硝基酚溶于100mL水中,可是2,4-二硝基酚在常温中溶解度很低,即使加热,在冷却到室温后又会有颗粒析出,应该如何溶解? 上帝的微笑1年前1
上帝的微笑1年前1 -
 晚秋-黄 共回答了20个问题
晚秋-黄 共回答了20个问题 |采纳率100%在水中加入少量丙酮!1年前查看全部
- 有杂质的锌8克与足量的稀硫酸反应生成氢气0.2克,(杂质和硫酸不反应),则锌中杂质的百分含量为?
 JJ真的AI你1年前1
JJ真的AI你1年前1 -
 jhnmbbg 共回答了22个问题
jhnmbbg 共回答了22个问题 |采纳率72.7%Zn+H2SO4=ZnSO4+H2
n(Zn)=0.1mol
杂质%=1-65*0.1/8=18.75%1年前查看全部
- 5.6克不纯的铁与足量的稀硫酸反应,生成氢气0.2克,则铁所含的杂质可能是
 小强01371年前1
小强01371年前1 -
 不nn不朽 共回答了22个问题
不nn不朽 共回答了22个问题 |采纳率90.9%Fe+H2SO4=FeSO4+H2↑
根据方程式5.6g铁与足量的稀硫酸反应,能生成氢气0.2克
现在已知铁不纯
所以所含杂质要能与稀硫酸反应生成氢气
如Mg Al等1年前查看全部
- 在某铁的样品中可能含有Zn,Mg,Al,Cu等杂质金属中的2种,取5.6克样品跟组量的稀硫酸反应,得0.2克氢气,则此铁
在某铁的样品中可能含有Zn,Mg,Al,Cu等杂质金属中的2种,取5.6克样品跟组量的稀硫酸反应,得0.2克氢气,则此铁的样品中不可能含有的杂质金属组是
A.Cu,Mg B.Zn,Al C.Mg,Al D.Zn,Cu
本人愚钝,最好有些过程和分析内容啊.谢谢``分虽然不多,但我很渴望你的帮助! rainbow200701年前3
rainbow200701年前3 -
 一生何求cj 共回答了16个问题
一生何求cj 共回答了16个问题 |采纳率81.3%用平均相对分子质量法,取5.6克样品跟组量的稀硫酸反应,得0.2克氢气,则平均相对分子质量是56,则杂质中一种比56大,另一种比56小
Zn,65
Mg,24
Al,27*2/3==18
Cu,64,不反应,可认为是无穷大的
C.Mg,Al D.Zn,Cu 不可能的1年前查看全部
- 一块表面已被氧化为过氧化钠的钠块10.8克,将其投进100克的水中,产生氢气0.2克,则被氧化的钠是多少克?
 sunlonggang19821年前2
sunlonggang19821年前2 -
 rrrrqqqq05 共回答了25个问题
rrrrqqqq05 共回答了25个问题 |采纳率92%0.2克氢气需要4.6克钠反应得到
10.8-4.6=6.2
有6.2克氧化钠,需要4.6克钠氧化得到1年前查看全部
- 一块表面已被氧化为Na2O的钠块10.8克,将其投入100克水中,产生氢气0.2克,则被氧化的钠的质量为?
 wxjzy1年前1
wxjzy1年前1 -
 鱼儿yan 共回答了5个问题
鱼儿yan 共回答了5个问题 |采纳率80%Na20:6.2克
被氧化的Na:4.6克1年前查看全部
- 有一表面被氧化的镁条3.2克跟54.6克稀H2SO4恰好完全反应生成H2 0.2克.计算:
有一表面被氧化的镁条3.2克跟54.6克稀H2SO4恰好完全反应生成H2 0.2克.计算:
①镁条中含单质镁多少克?
②表面被氧化的镁条中镁元素的质量分数是多少? 贝塞芬尼1年前1
贝塞芬尼1年前1 -
 cool狼 共回答了16个问题
cool狼 共回答了16个问题 |采纳率93.8%解题思路:(1)根据氢气的质量算出镁的质量,再进行计算;(2)根据3.2g被氧化的镁条的质量减去镁的质量就是氧化镁的质量,再根据镁元素的质量进行计算即可.设要生成H2 0.2克需要镁的质量为X则:Mg+H2SO4═MgSO4+H2↑
24 2
X O.2g
根据:[24/2=
X
0.2g]解得X=2.4g,
氧化镁的质量为:3.2g-2.4g=0.8g则:表面被氧化的镁条中镁元素的质量是:单质镁的质量+氧化镁中镁元素的质量,氧化镁中镁元素的质量:0.8×[24/40]=0.48g,则表面被氧化的镁条中镁元素的质量是0.48g+2.4g=2.88g.表面被氧化的镁条中镁元素的质量分数是[2.88g/3.2g]×100%=90%
故答案为:(1)2.4克(2)90%点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答本题的关键是要知道根据氢气的质量,算出镁的质量,再利用镁元素的质量分数的计算方法考虑.1年前查看全部
- 6克不纯的锌(含杂质金属M)跟足量的稀硫酸反应,最多可得到氢气0.2克,则金属M不可能是
6克不纯的锌(含杂质金属M)跟足量的稀硫酸反应,最多可得到氢气0.2克,则金属M不可能是
A.铝 B.镁 C.铁 D.铜 舞舞_cc1年前1
舞舞_cc1年前1 -
 398220242 共回答了16个问题
398220242 共回答了16个问题 |采纳率87.5%6克若为纯锌,也只能生成小于0.1mol(0.2g)的氢气.
所以金属M一定是一个摩尔质量较小的金属.
每1.8克Al,每2.4克Mg,每5.6克Fe,生成2克氢气
而Cu与稀硫酸反应不生成氢气.
所以选D1年前查看全部
- 这种铁合金5.6克与足量稀盐酸反应,生成氢气0.2克
这种铁合金5.6克与足量稀盐酸反应,生成氢气0.2克
有一种铁合金,取这种铁合金5.6克与足量的稀盐酸完全反应,生成氢气0.2克,下列有关铁合金的成分正确的是
A.铁和铜 B铁和镁 C铁 镁和锌 D 铁、镁和铜 天元nn1年前3
天元nn1年前3 -
 wwfcdn 共回答了23个问题
wwfcdn 共回答了23个问题 |采纳率73.9%选D
选A的话生成H2会少,选B或C则会多1年前查看全部
- 这种铁合金5.6克与足量稀盐酸反应,生成氢气0.2克
这种铁合金5.6克与足量稀盐酸反应,生成氢气0.2克
有一种铁合金,取这种铁合金5.6克与足量的稀盐酸完全反应,生成氢气0.2克,下列有关铁合金的成分正确的是
A.铁和铜 B铁和镁 C铁 镁和锌 D 铁、镁和铜
正确答案是C 这边走那边走1年前1
这边走那边走1年前1 -
 唐木 共回答了23个问题
唐木 共回答了23个问题 |采纳率87%要生成氢气0.2克
需FE的质量=0.2/2*56=5.6=5.6
m(Mg)=0.2/2*24=2.4g5.6
镁和锌 介于5.6中间
选C1年前查看全部
- 1.某金属5.6克,与足量的稀硫酸充分反应,可生成+2价的金属硫酸盐,同时有0.2克氢气一出,则这种金属的相对原子质量是
1.某金属5.6克,与足量的稀硫酸充分反应,可生成+2价的金属硫酸盐,同时有0.2克氢气一出,则这种金属的相对原子质量是?
2.取3.55克含有氯化钠杂质的硫酸钠样品于烧杯中,加水溶解后,滴入氯化钡溶液恰好完全反应,产生4.66克硫酸钡.试求:(1)样品中硫酸钠的百分含量.(2)如果再往烧杯中加入足量的硝酸银溶液,则还可生成沉淀多少克? ckandcc1年前3
ckandcc1年前3 -
 雅皮士24 共回答了31个问题
雅皮士24 共回答了31个问题 |采纳率83.9%1.Fe.56 设这种金属为M,相对原子质量是a.
M+H2SO4=MH2SO4+H2
a 2
5.6 0.2
a/5.6=2/0.2 a=56
2.样品中硫酸钠的百分含量为80%
设有Na2SO4有x克,硫酸钠的百分含量为a,生成氯化钠为b克
Na2SO4+BaCl2=BaSO4+2NaCl
142 233 117
x 4.66 b
142/x=233/4.66 x=2.84
a=2.84/3.55=80%1年前查看全部
- 一个大头针的质量大约是0.08克,某同学使用的天平游码是0.2克.你如何利用天平称出
 百福龙1年前1
百福龙1年前1 -
 不敢xx 共回答了16个问题
不敢xx 共回答了16个问题 |采纳率81.3%放3枚或以上个大头针,称出质量,再除以31年前查看全部
- 20℃时,15克某饱和溶液蒸干可得晶体0.2克,则该物质的溶解性为 - 15克是0.
20℃时,15克某饱和溶液蒸干可得晶体0.2克,则该物质的溶解性为 - 15克是0.
20℃时,15克某饱和溶液蒸干可得晶体0.2克,则该物质的溶解性为
-
15克是0.2
那100克是有多少溶质
- -
怎么做的解释下--THANKS badwiuqd1年前1
badwiuqd1年前1 -
 乳鸽A 共回答了25个问题
乳鸽A 共回答了25个问题 |采纳率92%设20℃时,该物质的溶解度为S
则有 0.2/15 = s/(100+s) S= 1.35克1年前查看全部
- 将6克铁片放入盐酸中,共得氢气0.2克,该铁片中含有的杂质可能是 ( )
将6克铁片放入盐酸中,共得氢气0.2克,该铁片中含有的杂质可能是 ( )
将6克铁片放入盐酸中,共得氢气0.2克,该铁片中含有的杂质可能是 ( )
A.锌 B.铝 C.镁 D.铝和镁 jacklin1年前1
jacklin1年前1 -
 myyantan 共回答了20个问题
myyantan 共回答了20个问题 |采纳率90%A.锌
生成0.2g氢气,需铁5.6g 锌 6.5g 镁 2.4g 铝 1.8g
5.6g1年前查看全部
- 为什么6.5g锌与稀硫酸反应生成0.2克氢气
 kerrywolf1年前3
kerrywolf1年前3 -
 客队 共回答了24个问题
客队 共回答了24个问题 |采纳率91.7%Zn为0.1摩尔,又锌与硫酸按照1比1反应,故生成0.1摩尔氢气,即为0.2克1年前查看全部
- 有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度
 benleden1年前2
benleden1年前2 -
 红色的太阳 共回答了10个问题
红色的太阳 共回答了10个问题 |采纳率100%Zn+H2SO4=ZnSO4+H2(向上的箭头)
65 2
X 0.2
X=6.5
Zn%=6.5/8*100%=81.25%
希望我的答案您能够满意!1年前查看全部
- 明矾中含K,AL,S.O.H如果某一天吃了0.2克,则摄入的铝的质量是多少
 kissyoung1年前1
kissyoung1年前1 -
 byjcww 共回答了12个问题
byjcww 共回答了12个问题 |采纳率83.3%明矾化学式KAl(SO4)2·12H2O,式量474.39.
含铝质量=0.2*27/474.39g=0.011383g.1年前查看全部
- 一定回答啊1.一个圆柱,底面周长2.5米.高5.2米,(1)他的侧面积是多少平方米?(2)如果每平方米用油漆0.2克,5
一定回答啊
1.一个圆柱,底面周长2.5米.高5.2米,
(1)他的侧面积是多少平方米?
(2)如果每平方米用油漆0.2克,5根这样的柱子需要多少千克油漆?
2.一个圆柱形的玻璃笔筒,侧面展开正好是一个边长为15.7cm的正方形,你知道这个笔筒的底面周长与高各是多少cm吗?做这个笔筒至少需要多少平方厘米的玻璃?(得数保留整平方厘米) 红二团1年前10
红二团1年前10 -
 203watin 共回答了17个问题
203watin 共回答了17个问题 |采纳率94.1%一个圆柱,底面周长2.5米.高5.2米,
(1)他的侧面积是多少平方米?
答:侧面积=2.5*5.2=13平方米.
(2)如果每平方米用油漆0.2"应该是千克"吧?,5根这样的柱子需要多少千克油漆?
答:一共要:13*0.2*5=13千克.
2.一个圆柱形的玻璃笔筒,侧面展开正好是一个边长为15.7cm的正方形,你知道这个笔筒的底面周长与高各是多少cm吗?做这个笔筒至少需要多少平方厘米的玻璃?(得数保留整平方厘米)
答:底周长=高=正方形的边长=15.7厘米.
底半径=15.7/(2*3.14)=2.5厘米
底面积=3.14*2.5*2.5=19.625平方厘米
侧面积=15.7*15.7=246.49平方厘米
所以,至少要:246.49+19.625=266.115平方厘米=约267平方厘米.1年前查看全部
- 某同学用称量为500克,最小刻度为0.2克.最小砝码为5克的托盘天平称量一铁块的质量,当调节横梁平衡后,他将铁块放在天平
某同学用称量为500克,最小刻度为0.2克.最小砝码为5克的托盘天平称量一铁块的质量,当调节横梁平衡后,他将铁块放在天平的右盘,砝码放在天平的左盘,同时移动游码,当天平平衡时,他读出铁快的质量是36.7克.测量结束后,他还未觉察出自己的失误,则铁快的实际质量应是( )
 楚门52521年前4
楚门52521年前4 -
 冬天不会冷 共回答了13个问题
冬天不会冷 共回答了13个问题 |采纳率84.6%35.3g1年前查看全部
- 10克黄铜加入装有100克稀硫酸的烧杯中,假定反应物完全,待不再产生气泡时杯中质量减少0.2克 计算(1)黄铜中铜的质量
10克黄铜加入装有100克稀硫酸的烧杯中,假定反应物完全,待不再产生气泡时杯中质量减少0.2克 计算(1)黄铜中铜的质量分数(2)100克稀硫酸中溶质硫酸质量为 溶剂水质量为 (3)反应后所得溶液中溶质质量为 溶剂质量为 溶液质量为
 susanhenry09141年前0
susanhenry09141年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- Fe,Cu混合物7克,加足量的盐酸反应后出0.2克氢气,求混合物中Fe质量和cu的质量 方程式Fe+2HCl=FeCl2
Fe,Cu混合物7克,加足量的盐酸反应后出0.2克氢气,求混合物中Fe质量和cu的质量 方程式Fe+2HCl=FeCl2+H2
 wq23511年前1
wq23511年前1 -
 dll911 共回答了13个问题
dll911 共回答了13个问题 |采纳率92.3%Cu活泼性在H后,不和盐酸反应生成H2,所以H2都是Fe反应生成的
Fe+2HCl==FeCl2+H2
56 2
x 0.2g
56/x==2/0.2
x==5.6g
所以Fe 5.6g
Cu就是7-5.6==1.4g了1年前查看全部
- 高锰酸钾片0.2克对了半盆洗脸盆水怎么还是紫色的啊?
 lfylin1年前1
lfylin1年前1 -
 步步为莹 共回答了19个问题
步步为莹 共回答了19个问题 |采纳率89.5%一种药物,加水1000ml.差不多就行了.普通盆地约半盆水,这两种药物.1年前查看全部
- 6克铁与某金属的混合物跟足量的稀硫酸反应,放出0.2克氢气,则铁中混有的金属是什么
6克铁与某金属的混合物跟足量的稀硫酸反应,放出0.2克氢气,则铁中混有的金属是什么
有4个选项
A Mg
B Zn
C Ca
D Na 冷锋991年前3
冷锋991年前3 -
 zhshkhyy 共回答了18个问题
zhshkhyy 共回答了18个问题 |采纳率83.3%Fe+H2SO4==FeSO4+H2
56g 2g
5.6g 0.2g
如果只有铁与稀硫酸反应,生成0.2克H2,则只需要铁56克
而混合物质量是6克,5.61年前查看全部
- 铜粉和铁粉的混合物20克,加如足量的20%的硫酸溶液,待完全反应后,得到氢气0.2克.
铜粉和铁粉的混合物20克,加如足量的20%的硫酸溶液,待完全反应后,得到氢气0.2克.
1,混合物中铁为多少克?
2,要使混合物中的铁完全反应,至少需20%的硫酸溶液多少克? youhuo231年前1
youhuo231年前1 -
 a26606 共回答了23个问题
a26606 共回答了23个问题 |采纳率91.3%(1)5.6g
(2)20%是质量分数还是体积分数?
质量:49g
体积:不知密度,没法做1年前查看全部
- 质量为0.2克Kg的棒球,原来以5m/s的速度水平飞行,被棒球迎击后以10m/s的速度反击水平飞回求大神帮助
质量为0.2克Kg的棒球,原来以5m/s的速度水平飞行,被棒球迎击后以10m/s的速度反击水平飞回求大神帮助
质量为 0.2kg 的棒球,原来以 5m/s 的速度水平飞行,被棒迎击后以 10m/s的 速度反向水平飞回,若棒与球作用的时间为 0.02s,求此过程中:( 1)球的动量变化大小; ( 2)棒对球的平均作用力 要对哦 wh2631年前1
wh2631年前1 -
 涂小丁 共回答了21个问题
涂小丁 共回答了21个问题 |采纳率90.5%1.P=mV=0.2*(5+10)=3kg m∕s 2.p=Ft得F=3∕0.02=150N1年前查看全部
- 0.2克等於多少公斤
 liudaben1年前1
liudaben1年前1 -
 小王07 共回答了10个问题
小王07 共回答了10个问题 |采纳率80%一公斤1000克
1000÷0.2=0.0002(公斤)1年前查看全部
大家在问
- 114.右图为汽车绕O点转弯时两个后轮运动情况的
- 2(2012•邵阳)小刚去邵阳某医院探视病人,途经医院的病友食堂,见食堂公布栏上写着今日食谱:
- 310乘以十二分之五七分之四乘以二十一十四分之五乘以十分之七五分之十六的倒数与二十四分之三十五的倒数的积是多少?十三分之四
- 4果汁翻译成英语是什么?
- 5参加青海玉树地震救援工作的队员发现,在当地烧水,水在80℃左右就沸腾了,这是因为当地的气压较___________(填“
- 6Hope you can help to solve the problem of shipment soon.
- 7汽车刹车问题上的加速度计算当一辆汽车刹车时,它的加速度是负数吗?例如:一辆车向东方向作直线运动,初速度为24m/s,突然
- 8你不用这么热情,我都受不了了.英文翻译谢谢.
- 9比尔喜欢草莓吗英文翻译
- 10在四边形ABCD中,角BAD=角BCD=90º,点M为BD的中点,点N为AC的中点,MN与AC的位置关系如何?
- 111 A=0.00.025(1998个0) B=0.000.016 (1998个0)
- 12两平行带电金属板1、2之间充以部分电介质,电介质的介电常数为.介质与两
- 13(2011•东营)如图所示,独轮车车身及车上物品总重力G为300N,作用线如图,O点为车轴.将车把抬起时,作用在车把竖直
- 14去年某省将地处A、B两地的两所大学合并成了一所综合大学.为了方便A、B两地师生的交往,学校准备在相距2km的A、B两地之
- 15Miss Liu will show you around _______Mount Yuntai, because s
