铁的吸氢 吸氧 电极方程式 怎么写啊 最好告诉我是怎么想的
 君随缘2022-10-04 11:39:541条回答
君随缘2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 WolfDuan 共回答了18个问题
WolfDuan 共回答了18个问题 |采纳率83.3%- 析氢:负极:Fe-2e-=Fe2+,正极:2H+ +2e- =H2↑
总反应:Fe+2H+ =Fe2+ +H2↑
吸氧:负极:2Fe-4e-=2Fe2+,正极:O2+2H2O+4e-=4OH-
总反应:2Fe+ O2+2H2O=2Fe(OH)2,Fe(OH)2继续与空气中的氧气作用,生成Fe(OH)3:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe(OH)3脱去一部分水生成Fe2O3.XH2O, - 1年前
相关推荐
- 为什么氢后面的金属不会发生吸氧腐蚀?
 bushifengshiwo1年前3
bushifengshiwo1年前3 -
 suryayangyang 共回答了21个问题
suryayangyang 共回答了21个问题 |采纳率76.2%氢离子的得电子能力比氢后面的金属离子得电子能力要强.轮不到他们得电子.所以一般条件下氢后面的金属不会失电子被氧化.1年前查看全部
- 大家都说金属阳离子的电子能力大于O2,但是电化学腐蚀的吸氧反应(腐蚀铁)中,为什么正极是O2得电子,而不是从阴极出来的F
大家都说金属阳离子的电子能力大于O2,但是电化学腐蚀的吸氧反应(腐蚀铁)中,为什么正极是O2得电子,而不是从阴极出来的Fe2+的电子呢?除此之外,谁可以举几个别的例子详细讲下这个问题.
 a01019821年前2
a01019821年前2 -
 c1ntmp 共回答了14个问题
c1ntmp 共回答了14个问题 |采纳率78.6%金属阳离子的电子能力大于O2不完全正确.
物质的得电子能力强弱与它本身的性质有关.从原子构型来讲,二价铁离子形成了相对稳定的半充满结构,难得到电子.而氧气中的氧原子形成共用电子对,得电子能力比二价铁离子要强.
例子,上高三老师就会讲.1年前查看全部
- 电解时会不会发生吸氧腐蚀像铝铁构成的原电池净化污水铝做阳极发生吸氧反应吗,为什么?
 xshmily1年前1
xshmily1年前1 -
 贝利比皮差一档 共回答了20个问题
贝利比皮差一档 共回答了20个问题 |采纳率95%由于水里氧气的浓度不高,自然条件下的吸氧腐蚀程度是很低的,电解则是外来能量强制发生反应,速度较快,这两者在程度上差异很大.
电解的时候阳极如果不是惰性电极,肯定在被氧化,但基本不会是吸氧腐蚀;阴极是被保护的,不会发生腐蚀.1年前查看全部
- 化学原电池中的吸氧腐蚀是怎么回事?两极的离子方程式是什么?
 eric008520001年前1
eric008520001年前1 -
 zxcvuasiofupasdu 共回答了29个问题
zxcvuasiofupasdu 共回答了29个问题 |采纳率93.1%吸氧腐蚀 金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀,叫吸氧腐蚀.
例如钢铁在接近中性的潮湿的空气中腐蚀属于吸氧腐蚀,其电极反应如下:
负极(Fe):2Fe - 4e = 2Fe2+
正极(C):2H2O + O2 + 4e = 4OH-
钢铁等金属的电化腐蚀主要是吸氧腐蚀.1年前查看全部
- 吸氧和析氢腐蚀各在什么条件下发生?
 无人知道1年前1
无人知道1年前1 -
 young_gun 共回答了16个问题
young_gun 共回答了16个问题 |采纳率100%电解质溶液酸性较强时发生析氢腐蚀,酸性较弱,或中性,或碱性,且金属和电解质溶液不能直接反应时发生吸氧腐蚀.1年前查看全部
- 析氢腐蚀与吸氧腐蚀能同时反应的原因
 基巴扎比利1年前1
基巴扎比利1年前1 -
 唬笑半步痴 共回答了18个问题
唬笑半步痴 共回答了18个问题 |采纳率88.9%当氧气少,腐蚀环境ph小时,主要发生析氢腐蚀.当氧气多,腐蚀环境ph大时,主要发生吸氧腐蚀.在ph小向ph大的过渡的过程中,析氢腐蚀和吸氧腐蚀同时发生.1年前查看全部
- 为什么钢铁发生吸氧腐蚀时的负极反应的电极反应式是2H2O + O2 + 4e = 4OH-
为什么钢铁发生吸氧腐蚀时的负极反应的电极反应式是2H2O + O2 + 4e = 4OH-
不应该是 2Fe-2e = Fe2+ 负极发生氧化反应啊 太阳的影子C1年前4
太阳的影子C1年前4 -
 焦作55 共回答了19个问题
焦作55 共回答了19个问题 |采纳率78.9%不管什么原因,发生吸氧腐蚀时负极反应都是2H2O + O2 + 4e = 4OH-,LZ你记住就好了1年前查看全部
- 钢铁腐蚀最普遍的是吸氧还是析氢一定要有 解释 为什么吸氧析氢 那要看铁表面水膜是否电离H+ 2H2O+O2+4e-=40
钢铁腐蚀最普遍的是吸氧还是析氢
一定要有 解释 为什么吸氧析氢 那要看铁表面水膜是否电离H+
2H2O+O2+4e-=40H-
2H+ +2e-=H2?
为什么析氢啊? 空气中C02比较多。。。。。。
来个权威的 b1cs81年前4
b1cs81年前4 -
 小安-呱呱 共回答了15个问题
小安-呱呱 共回答了15个问题 |采纳率100%吸氧.
当铁的表面有杂质或铁本身不够纯,含有其他成分的情况下,暴露在空气中的铁以空气为电解质,具备了原电池的条件:两个电极,电解质与自发的电子转移.
铁是相对活泼的金属,初中生也知道的,3FE+2O2=FE2O3是铁缓慢氧化的方程式,有水的话就是4FE+3O2+6H2O=4FE(OH)3产物是红色的铁锈.一般情况下铁表面的杂质是H2O,如果是铁内部成分不纯,那么是C.
以H2O为正极的例子:
O2-作为介质(一般地说,空气是中性的,反应在中性条件下进行,因此O2-作为电解质)
正极反应:3O2+12e-(电子)=6O2-
负极反应:4FE-12e-+6O2-+6H2O=4FE(OH)3
总反应:4FE+3O2+6H2O=4FE(OH)3
以C为正极的例子:
仍旧是O2-为电解质
正极反应:3O2+12e-=6O2-
负极反应:4FE-12e-+6O2-=2FE2O3
总反应:4FE+3O2=2FE2O3
Fe+3H2O===Fe(OH)3+3H+
2H2O+O2====4OH-
H++OH-===H2O
以上是吸氧腐蚀一般腐蚀都是吸氧腐蚀为主.
还有析氢腐蚀
Fe+2H+====Fe2++H21年前查看全部
- 常见化学原电池方程式吸氧腐蚀和析氢腐蚀的方程式 各列举出几例
 冬虫语冰1年前1
冬虫语冰1年前1 -
 関亠 共回答了10个问题
関亠 共回答了10个问题 |采纳率70%吸氧腐蚀
定义 金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀,叫吸氧腐蚀.
电极反应 负极(铁):2Fe-4e-=2Fe2+ 正极(碳或碳化铁):2H2O+O2+4e-=4OH-
析氢腐蚀
定义 金属在酸性较强的溶液里放出氢气的电化学的腐蚀叫做析氢腐蚀.
成因 在钢铁制品中一般都含有石墨(C)或碳化铁(Fe3C).在潮湿空气中,钢铁表面会吸附水汽而形成一层薄薄的水膜.水膜中溶有二氧化碳或二氧化硫后就变成一种电解质溶液,使水里的H+增多:
CO2+H2O←→H2CO3←→H++HCO3- SO2+H2O←→H2SO3←→H++HSO3-
于是就产生了无数个以铁为负极、碳或碳化铁为正极、酸性水膜为电解质溶液的微小原电池.1年前查看全部
- 钢铁发生吸氧腐蚀时,负极上发生的电极反应是:
 无雪的冬天啊1年前1
无雪的冬天啊1年前1 -
 fy775 共回答了16个问题
fy775 共回答了16个问题 |采纳率87.5%铁原子失去两个电子生成正二价的亚铁离子1年前查看全部
- 铁和锌构成原电池,氯化钠为溶液电极反应式中锌发生吸氧腐蚀,为什么不是铁发生,还有为什么一定要发生吸氧腐蚀,为什么不可以是
铁和锌构成原电池,氯化钠为溶液
电极反应式中锌发生吸氧腐蚀,为什么不是铁发生,还有为什么一定要发生吸氧腐蚀,为什么不可以是溶液氢离子放电
是不是铁就不发生吸氧腐蚀了,氧气在铁那一极被还原, 我忘了我1年前1
我忘了我1年前1 -
 只为你流泪 共回答了22个问题
只为你流泪 共回答了22个问题 |采纳率81.8%锌比铁活泼,所以锌腐蚀,析氢腐蚀只有在强酸性溶液中才会发生,而弱酸性及中性条件下发生的是吸氧腐蚀1年前查看全部
- 铁的吸氧腐蚀正极反应为什么不是氢离子得电子生成氢气?
 gaoyuan9871年前2
gaoyuan9871年前2 -
 无灰世界 共回答了16个问题
无灰世界 共回答了16个问题 |采纳率93.8%O2的氧化性比H+强.还有H+浓度太小,因为吸氧腐蚀要在中性(或很弱酸性).1年前查看全部
- 若析氢反应与吸氧反应在相同条件下分别进行,氧气和氢离子皆过量,哪一个反应速率快?
 芝ll子1年前1
芝ll子1年前1 -
 asavdhx 共回答了22个问题
asavdhx 共回答了22个问题 |采纳率90.9%析氢腐蚀一般在酸性条件下反应
吸氧腐蚀一般在中性碱性条件下反应
一般前者快1年前查看全部
- 将铁和碳用导线连接放入次氯酸钠电解液中,是不是发生了吸氧腐蚀
 ss里的妖怪1年前1
ss里的妖怪1年前1 -
 闲花落地 共回答了16个问题
闲花落地 共回答了16个问题 |采纳率100%若简单理解,似乎NaClO溶液是强碱弱酸的盐溶液,水解,显碱性,发生的是吸氧腐蚀
但此时溶液中的ClO^-具有更强的氧化性,比O2强,所以先得电子
你可以再比较一下析氢腐蚀与吸氧腐蚀的判断
当溶液中存在较多的H+,即酸性较强,则主要由H+得电子,即析氢腐蚀
当溶液中的H+很少,即酸性较小或者中性,则由溶液中溶解的O2得电子,即吸氧腐蚀
所以,是氧化性较强的,即得电子能力较强的先在正极得到电子,现在,存在氧化性更强的ClO-,所以是它先得电子了1年前查看全部
- 什么样的原电池会发生吸氧或析氢腐蚀?
 hiloyee1年前3
hiloyee1年前3 -
 锋魔小子 共回答了16个问题
锋魔小子 共回答了16个问题 |采纳率87.5%由铁和氯化钠溶液组成的原电池会发生吸氧,正极:2H2O +O2 +4e====4OH-
负极:Fe --- 2e ===Fe2+
由铜和硫酸溶液组成的原电池会发生析氢,正极:2H+ + 2e ==== H2
负极:Cu --- 2e === Cu2+
一般来说在酸性溶液组成的原电池中容易发生析氢腐蚀,在活泼金属组成的原电池中,也就是容易失去电子的金属组成的原电池中容易发生吸氧腐蚀.1年前查看全部
- 【原电池】什么条件发生①吸氧②析氢③金属阳粒子的电子?
 what09551年前1
what09551年前1 -
 bamgo 共回答了17个问题
bamgo 共回答了17个问题 |采纳率88.2%①吸氧 电极材料金属不能与溶液中的粒子发生自发的氧化还原反应 故而与空气中的氧气反应.
②析氢 负极材料能与溶液中的氢离子反应放出氢气
③金属阳粒子的电子?1年前查看全部
- 为什么会发生吸氧腐蚀析氢腐蚀?吸氧腐蚀和析氢腐蚀只会发生在原电池中吗?
 wghlym1年前1
wghlym1年前1 -
 小柠儿 共回答了15个问题
小柠儿 共回答了15个问题 |采纳率86.7%吸氧腐蚀可以发生在常温下1年前查看全部
- 电化学腐蚀什么时候吸氧?什么时候析氢?
 happyhaiyanhappy1年前1
happyhaiyanhappy1年前1 -
 pear407 共回答了20个问题
pear407 共回答了20个问题 |采纳率85%当溶液为中性或碱性时,发生吸氧腐蚀,反应为2M+n/2O2+nH2O=2M(OH)n,M表示金属,下同.当溶液为酸性时,发生析氢腐蚀,反应离子方程式为2M+2nH+=2Mn+nH2.1年前查看全部
- 发生吸氧腐蚀和析氢腐蚀的条件各是什么
 涩涩的向月葵1年前1
涩涩的向月葵1年前1 -
 左弦的耳 共回答了22个问题
左弦的耳 共回答了22个问题 |采纳率77.3%不纯的铁(含碳)在强酸性环境下和H+发生氧化还原反应,发生析氢腐蚀;在弱酸性或中性条件下和氧气反应,发生吸氧腐蚀.1年前查看全部
- 化学腐蚀和电化学腐蚀那个更普遍,吸氧腐蚀与析氢腐蚀那个更普遍
 巴哈鱼521年前4
巴哈鱼521年前4 -
 powow 共回答了13个问题
powow 共回答了13个问题 |采纳率84.6%电化学腐蚀那个更普遍,吸氧腐蚀更普遍1年前查看全部
- 关于铁铜氯化钠电解池铁作阳极时,阴极是吸氧还是水得电子析氢?
 潇洒男1年前3
潇洒男1年前3 -
 powerzz 共回答了26个问题
powerzz 共回答了26个问题 |采纳率92.3%氢离子得到电子变为氢气,或水得到电子变为氢气和氢氧根离子.阳极是铁失去电子变为亚铁离子.原电池的电极反应才有可能是吸氧.1年前查看全部
- 有关铁碳氯化钠电解池的问题在铁碳氯化钠电解池中,铁作为阳极,有人说铁吸氧腐蚀,吸氧腐蚀不是属于原电池中的吗,或者说阳极为
有关铁碳氯化钠电解池的问题
在铁碳氯化钠电解池中,铁作为阳极,有人说铁吸氧腐蚀,吸氧腐蚀不是属于原电池中的吗,或者说阳极为什么不是析氢呢,是因为氯化钠的关系吗?那不又成了原电池的问题,如果没有电源变成了铁碳氯化钠原电池,这个原电池正负极的电极反应又是怎么样的?
这个电解池实质是不是加强版的原电池,也就是说在原电池的基础上加快对铁的腐蚀 grjtgrjt1年前2
grjtgrjt1年前2 -
 slm850814 共回答了19个问题
slm850814 共回答了19个问题 |采纳率78.9%首先声明,电解池绝对可以进行原电池能发生的反应——即是自发的反应.
因此电解池中出现铁的吸氧腐蚀完全可以!
阳极优先让电极材料反应,因此不会有Cl-或者H+参加反应
另一侧阴极应该是析氢腐蚀,而不是O2(此时H+得电子要比O2的电子容易得多,因为量多)因此即使能发生,该网友也说错了——不过你先看清是不是电解池.
若变成原电池:
正极O2+2H2O+4e-=4OH-
负极Fe-2e-=Fe2+
你的最后一句话说的很多——以后会在速率判断题中遇到——非电化学反应<原电池<电解池
有疑问追问1年前查看全部
- 请把铁吸氧腐蚀和析氢腐蚀的总反应式
请把铁吸氧腐蚀和析氢腐蚀的总反应式
写给我 不需要电极反应式 Checking_in1年前1
Checking_in1年前1 -
 swj102 共回答了23个问题
swj102 共回答了23个问题 |采纳率91.3%吸氧腐蚀:4Fe+6H2O+3O2=4Fe(OH)3
析氢腐蚀:Fe+2H+=Fe2+ + H2↑
其实通过电极反应式的加和就可以弄出来1年前查看全部
- 铁在空气中发生吸氧腐蚀生成氢氧化铁的方程式
 苍蝇王子czy1年前3
苍蝇王子czy1年前3 -
 Google测试员4328 共回答了19个问题
Google测试员4328 共回答了19个问题 |采纳率89.5%4Fe + 3O2 + 6H2O ---> 4Fe(OH)31年前查看全部
- 活动性在氢后的金属做负极,电解液是硫酸,能发生吸氧腐蚀吗
 老牛731年前1
老牛731年前1 -
 我为煮酒狂13 共回答了23个问题
我为煮酒狂13 共回答了23个问题 |采纳率82.6%不晓得你的正极是什么
如果正极是氢之前的金属,则会在负极上析出氢气
负极不会被腐蚀1年前查看全部
- 临床上常给危重病人吸氧和点滴葡萄糖,请你用有关细胞的知识解释为什么要这样?
 vivien83041年前1
vivien83041年前1 -
 哈哈镜xy 共回答了26个问题
哈哈镜xy 共回答了26个问题 |采纳率96.2%解题思路:食物中含有六大类营养物质:蛋白质、糖类、脂肪、维生素、水和无机盐,每一类营养物质都是人体所必需的,但作用又各有所不同.糖类是人体最重要的供能物质,危重病人的消化及呼吸功能相对减弱.吸氧有助于病人的细胞获得氧气,静脉点滴葡萄糖可使病人的细胞及时获得葡萄糖,这样在细胞的线粒体中就可以将葡萄糖和氧转变成二氧化碳和水,同时释放能量,供给病人生命活动的需要.
故答案为:给危重病人吸氧和点滴葡萄糖,目的就是为人体提供能量.点评:
本题考点: 人体需要的主要营养物质.
考点点评: 此题考查了糖类对人体的作用,明确糖类是主要的供能物质,在氧气的作用下,分解葡萄糖,释放能量,供人体利用.1年前查看全部
- 析氢和吸氧的电极反应发生后,均能使该电极附近的电解质溶液的PH增大,因而工作后,X极附近PH增大了,说明X极为正极
析氢和吸氧的电极反应发生后,均能使该电极附近的电解质溶液的PH增大,因而工作后,X极附近PH增大了,说明X极为正极
这是为什么? 电视栏目rrrr1年前2
电视栏目rrrr1年前2 -
 dongfengpo 共回答了29个问题
dongfengpo 共回答了29个问题 |采纳率86.2%吸氧腐蚀:
O2+2H2O+4e-=4OH-
析氢腐蚀:
2H+ +2e-=H2
都是发生在正极的原电池反应,且PH都是增大的.
对应的负极的反应有:Fe-2e=Fe2+1年前查看全部
- 析氢反应和吸氧反应发生的电解质说明哪些电解质发生什么反映.
 8鼓点81年前1
8鼓点81年前1 -
 free12thme 共回答了16个问题
free12thme 共回答了16个问题 |采纳率81.3%很多盐都可以,比如 硫酸钠、硫酸钾、硝酸钙、硝酸钠1年前查看全部
- 什么时候发生析氢反应,什么时候发生吸氧反应
 supermamba1年前1
supermamba1年前1 -
 nn1234444 共回答了17个问题
nn1234444 共回答了17个问题 |采纳率88.2%在溶液中发生析氢腐蚀,不再溶液中发生吸氧腐蚀1年前查看全部
- 如何分析氢反应和吸氧反应
 xiaoxiaoygg1年前1
xiaoxiaoygg1年前1 -
 点击王乔任梁 共回答了15个问题
点击王乔任梁 共回答了15个问题 |采纳率100%是原电池的反应,有氢放出的腐蚀就是析氢反应!吸氧的腐蚀是吸氧!祝好1年前查看全部
- 请问什么是吸氧反应什么是析氢反应?
 豆豆三木1年前2
豆豆三木1年前2 -
 alan198679 共回答了17个问题
alan198679 共回答了17个问题 |采纳率82.4%吸氧反应是:2Fe+O2+2H2O=2Fe(OH)2;
析氢反应是:Fe+2H+=Fe2++H2.
碱性、中性和弱酸性环境下,发生的都是吸氧反应;析氢反应发生的条件是,环境中的酸酸性强于醋酸.
希望对你有帮助.1年前查看全部
- 水的电解 正极吸氧负极吸氢如果水中还有其他物质怎么办
 adm2251年前2
adm2251年前2 -
 zg_geng 共回答了22个问题
zg_geng 共回答了22个问题 |采纳率86.4%其它物质电离出的离子与H+、OH-离子比较,如果比H+、OH-容易得失电子,就电解其它物质,否则是电解水.
如电解硫酸、氢氧化钠溶液,就是电解水.电解氯化铜溶液,就是电解氯化铜.1年前查看全部
- 关于吸氧腐蚀与析氢腐蚀.介质是强酸性的时候 是吸氧中性和碱性是 析氢那电解质不是 要么碱性 要么酸性 要么中性么.那意思
关于吸氧腐蚀与析氢腐蚀.
介质是强酸性的时候 是吸氧
中性和碱性是 析氢
那电解质不是 要么碱性 要么酸性 要么中性么.
那意思不就是说 反应不是析氢 就是吸氧咯?
可是有些反应却不是这样呀.
为什么了.
怎么判断呢?
例如zn pt Na2SO4 是吸氧.
而Zn pt CuSO4 又是CU离子 得电子 xixi1101年前2
xixi1101年前2 -
 andrewgirl 共回答了20个问题
andrewgirl 共回答了20个问题 |采纳率85%你说反了.
介质是强酸性的时候 析氢
中性和碱性是 是吸氧
你想想强酸性的时候与H离子反应,就析氢,对吧..
某些东西不同时因为他们的金属活动性不同
··而Zn pt CuSO4 又是CU离子 得电子
对于这个是一个原电池.你明白吧?Cu离子的氧化性比H20大,所以Cu离子先得电子.你学到原电池,接触到离子放电顺序就知道了!
不懂再问,乐意为你解答1年前查看全部
- 氢氧化钠中铝的腐蚀,到底是析氢腐蚀还是吸氧腐蚀,如果是析氢腐蚀,为什么会产氢气
 daoba0081年前3
daoba0081年前3 -
 海棠春睡123 共回答了19个问题
海棠春睡123 共回答了19个问题 |采纳率84.2%别听楼上的= =.
是吸氧腐蚀.因为氢氧化钠是碱性环境.所以发生吸氧腐蚀.如果是析氢腐蚀的话要求是强酸环境下.吸氧腐蚀一般发生在中性和碱性环境中.
而且铝和氢氧化钠会反应.
2Al+2NAOH+2H2O==2NAAlO2+3H2↑1年前查看全部
- 有关原电池和电解池的问题~急原电池的方程式具体改怎么写?我知道一些基本的,负氧正还,还有析氢反应和吸氧反映,但想知道一些
有关原电池和电解池的问题~急
原电池的方程式具体改怎么写?我知道一些基本的,负氧正还,还有析氢反应和吸氧反映,但想知道一些特殊的反应,像Mg-Al-NaOH之类的
1.为什么cu-al-HNo3的cu会是负极
2.Fe失电子为什么只有fe2+
3.电解池的阴极是不是永远不反应?
4.电解池如果两级的材料都不是惰性电极的会是怎么反应(这个能具体点更好)
5.原电池正极如果没有电解液的阳离子活泼是不是就不会反应了?
过几天就要考试了 sctbcssr1年前1
sctbcssr1年前1 -
 湘里人家1 共回答了13个问题
湘里人家1 共回答了13个问题 |采纳率92.3%1.因为铝遇硝酸会钝化,表面会形成一层致密的氧化膜阻止反应进一步进行.而铜不会钝化,所以Cu-Al 硝酸电池中铜作负极;2.这是由铁的电极电势所决定的,高中不涉及这方面的知识,有兴趣可以找大学的教材看看了解了解.只要...1年前查看全部
- 吸氧腐蚀和析氢腐蚀的原理是什么我要知道详细的原理
 cls12331年前2
cls12331年前2 -
 zouzhhua 共回答了24个问题
zouzhhua 共回答了24个问题 |采纳率87.5%当氢离子浓度很低时,发生吸氧腐蚀,否侧发生析氢腐蚀.化学书的选修4反应原理的后面的电池那里有相关方程式1年前查看全部
- 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
A.负极电极反应式为:Fe-3e-=Fe3+
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu hurryguy1年前1
hurryguy1年前1 -
 emir37 共回答了13个问题
emir37 共回答了13个问题 |采纳率84.6%解题思路:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电时,电子从负极流向正极.根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀.
A、负极上Fe失去电子发生氧化反应,电极反应式为:Fe-3e-=Fe2+,故A错误;
B、负极上发生的电极反应式为:Fe-2e-=Fe2+,正极上的电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故B正确;
C、该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故C正确;
D、该原电池放电时,外电路上电子从负极铁流向正极铜,故D正确;
故选A.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题以原电池原理为载体考查了金属的腐蚀,难度不大,明确钢铁发生析氢腐蚀和吸氧腐蚀的条件是解本题的关键,注意钢铁的吸氧腐蚀中还含有氢氧化亚铁生成氢氧化铁的反应.1年前查看全部
- 饲养观赏鱼可以陶冶人的情操,增进人们对生活的热爱.空运观赏鱼必须密封.为了解决鱼的吸氧问题,可在水中加入过氧化钙(化学式
饲养观赏鱼可以陶冶人的情操,增进人们对生活的热爱.空运观赏鱼必须密封.为了解决鱼的吸氧问题,可在水中加入过氧化钙(化学式:CaO2).过氧化钙与水反应生成氢氧化钙和氧气.
(1)写出过氧化钙与水反应的化学方程式______
(2)已知钙元素只有一种化合价,请你分析过氧化钙中钙元素的化合价为______价.将来我们会学习“凡有元素化合价变化的化学反应就叫做氧化还原反应”,则根据这个概念判断过氧化钙与水反应是否为氧化还原反应______ (填写“是”或“否”). lv6661年前1
lv6661年前1 -
 不相信未来 共回答了24个问题
不相信未来 共回答了24个问题 |采纳率87.5%解题思路:(1)过氧化钙与水反应生成氢氧化钙和氧气,写出反应的化学方程式即可.
(2)根据常见元素的化合价进行分析解答;由题意:凡有元素化合价变化的化学反应就叫做氧化还原反应,据此进行分析解答.(1)过氧化钙与水反应生成氢氧化钙和氧气,反应的化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑.
(2)已知钙元素只有一种化合价,钙元素在化合物中显+2价,则过氧化钙中钙元素的化合价为+2价.
凡有元素化合价变化的化学反应就叫做氧化还原反应,在2CaO2+2H2O═2Ca(OH)2+O2↑中,钙元素显+2,设氧元素的化合价是x,可知CaO2中氧元素的化合价:(+2)+2x=0,则x=-1;单质中元素的化合价为0,O2属于单质,故氧元素的化合价为0;反应前后,氧元素的化合价发生了改变,则该反应属于氧化还原反应.
故答案为:(1)2CaO2+2H2O═2Ca(OH)2+O2↑;(2)+2;是.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关元素化合价的计算;氧化反应;还原反应.
考点点评: 本题难度不大,掌握化学方程式的书写方法、化合价的原则、氧化还原反应的概念是正确解答本题的关键.1年前查看全部
- 食品吸潮和吸氧后容易变质,为了延长食品保质期.通常在包装袋中加入1小包干燥剂.某化学兴趣小组经过查阅资料,发现常见的食品
食品吸潮和吸氧后容易变质,为了延长食品保质期.通常在包装袋中加入1小包干燥剂.某化学兴趣小组经过查阅资料,发现常见的食品干燥剂主要有’两种:一种是以生石灰为主要成份的千燥剂(简称A类,下同);另一种是以硅胶为主要成份的干燥剂(简称B类,下同).请问答下列问题:
(1)将装有A类干燥剂的小纸袋打开露置于潮湿的空气中,发现纸袋发热,与出其发生反应的化学方程式______.
(2)B类干燥剂中硅胶的主要成分为SiO2•nH2O.SiO2是______(填“酸”、“碱”、“盐”、“氧化物”),其中Si的化合价为______.
(3)小组在杳阅资料中,还发现了-种新型的食品干燥剂:泡沫铁粉(铁粉包裹在泡沫塑料中).当它露置于潮湿的空气中,很快变成铁锈(主要成分为Fe2O3•nH2O),并有发热现象,说明化学反应除了生成新物质外,还伴随着______变化.与A类干燥剂比较,泡沫铁粉除了做干燥剂外,还可做______剂. 水……seaman1年前1
水……seaman1年前1 -
 虫子-虫子 共回答了16个问题
虫子-虫子 共回答了16个问题 |采纳率93.8%解题思路:氧化钙能和水反应生成氢氧化钙,根据物质的元素组成可以判断物质的类别,根据化合物中元素化合价代数和为零的原则可以求出某种元素的化合价.(1)氧化钙和水反应能生成氢氧化钙,故填:CaO+H2O=Ca(OH)2.(2)二氧化硅是由硅元素和氧元素组成的化合物,属于氧化物.故填:氧化物.二氧化硅中氧元素的化合价是-2价,可以求出硅元素的化合价是+4价.故填:+...
点评:
本题考点: 水的性质和应用;从组成上识别氧化物;有关元素化合价的计算;物质发生化学变化时的能量变化.
考点点评: 本题主要考查了化学方程式的书写、化合价的求法及其干燥剂与水或与水和氧气反应等方面的内容,可以依据已有的知识进行.1年前查看全部
- 吸氧腐蚀和析氢腐蚀是不是都是铁被腐蚀
 夜听细雨1年前1
夜听细雨1年前1 -
 yangxk 共回答了23个问题
yangxk 共回答了23个问题 |采纳率82.6%不一定是Fe,但铁最常见
(1)析氢腐蚀(钢铁表面吸附水膜酸性较强时)电化学腐蚀 负极(Fe):Fe=Fe2++2e- Fe2++2H2O=Fe(OH)2+2H+ 正极(杂质):2H++2e-=H2 电池反应:Fe+2H2O=Fe(OH)2+H2↑ 由于有氢气放出,所以称之为析氢腐蚀.(2)吸氧腐蚀(钢铁表面吸附水膜酸性较弱时) 负极(Fe):Fe=Fe2++2e- 正极:O2+2H2O+4e-=4OH- 总反应:2Fe+O2+2H2O=2Fe(OH)2 由于吸收氧气,所以也叫吸氧腐蚀.析氢腐蚀与吸氧腐蚀生成的Fe(OH)2被氧所氧化,生成Fe(OH)3脱水生成Fe2O3 铁锈.4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 钢铁制品在大气中的腐蚀主要是吸氧腐蚀.Fe+2H2O=Fe(OH)2+H2↑ O2+2H2O+4e-→4OH- 2Fe+O2+2H2O=2Fe(OH)2 2H++2e-→H2 析氢腐蚀主要发生在强酸性环境中,而吸氧腐蚀发生在弱酸性或中性环境中.1年前查看全部
- 关于原电池正极得电子物质若电解质溶液为碱或中性,则发生吸氧腐蚀,为酸性,则发生析氢腐蚀,这种观点是不是有正极棒不活泼这一
关于原电池正极得电子物质
若电解质溶液为碱或中性,则发生吸氧腐蚀,为酸性,则发生析氢腐蚀,这种观点是不是有正极棒不活泼这一前提?为什么铜锌原电池是电解质溶液中的铜离子得电子呢? 酷酷小狗1年前2
酷酷小狗1年前2 -
 Richtting 共回答了18个问题
Richtting 共回答了18个问题 |采纳率88.9%金属离子的氧化性是金属活动顺序表倒置,但是Fe3+与此规律不相符,这个的氧化性排在Cu2+的前面,Fe2+的顺序与规律相符.所以由于Cu2+的氧化性大于Zn2+,所以Cu2+先得电子.由于Zn2+的氧化性在H+之后,所以理论上要把水反应完才能让Zn2+得电子.
吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀.这个是电化学腐蚀,如果是原电池的话不能这么叫的.而且要原电池要能自主反应,两个电极必须是不同材质.所以负极一定比正极活泼,也就是说两个材质连在一起,活泼的自然就成了负极.
你问这种观点是不是有正极棒不活泼这一前提是不存在这个问题的.组成原电池的两极,一定是负极活泼.1年前查看全部
- 1.铁的吸氧腐蚀是在中性或弱酸性环境下发生的么?那么如果是碱性呢?
1.铁的吸氧腐蚀是在中性或弱酸性环境下发生的么?那么如果是碱性呢?
2.对于I2+H2=2HI,在恒温的体积不变的容器中,最初放入1摩尔H2,2摩尔I2与最初放入2摩尔H2,4摩尔I2,以及最初放入2摩尔H2,1摩尔I2,最终到达平衡时HI的体积分数相同吗?如果不同,差别在哪里
但是左右两边气体的系数是一样的呀,压强变化应该不会导致平衡移动啊 小13最爱我281年前1
小13最爱我281年前1 -
 雨季飘泊 共回答了27个问题
雨季飘泊 共回答了27个问题 |采纳率88.9%我们知道金属腐蚀分为析氢腐蚀和吸氧腐蚀.在理论上,析氢腐蚀需要较大的酸度,而吸氧腐蚀一般在中性条件或者弱酸性条件下反应.
但实际上LZ你写出方程式就能感觉到,这两者属于替代反应,也就是说,如果反应1发生多了,反应2自然就发生的较少.
酸性减弱虽然使得吸氧腐蚀的反应平衡逆向进行,但是同时也抑制了析氢腐蚀的反应发生.故我刚才用电化学多重平衡计算了一下,发现实际上若考虑我说的替代反应的因素,在PH=9左右的溶液中也是可以相当量的发生的.
(具体电化学计算有点繁..不方便写上来).
这个就是我的结论
当然..若只是为了应付考试的话,就记住中性或者偏酸这个条件吧...我那计算只是为了寻求真相- -
至于2.首先操作1和操作2是相同的
因为你是等容条件.你可以这样想:你把2M的H2 和4M的I2放入2倍大的容器中,那么平衡时比例应该是相同的.然后再做一个压缩操作,把2倍大的体积压缩成原来的样子,那么进行了加压操作,但是两边气体分子量相同,加压不改变平衡,故相同.
操作2和操作3也应该是相同的..我的分析是用平衡常数大概写了下,如果都是气体的话,其实氢气和碘是等价的..所以我认为都相同...
看下答案,如果答案是不同,我在想想..毕竟很久没做这些题1年前查看全部
- 为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
 为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
A.正极的电极方程式为:O2+2H2O+4e-═4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 亦优FISH1年前1
亦优FISH1年前1 -
 muroi 共回答了12个问题
muroi 共回答了12个问题 |采纳率100%解题思路:钢铁的吸氧腐蚀装置属于原电池,较活泼的金属是负极,较不活泼的金属或导电的非金属是正极,负极上失去电子发生氧化反应,正极上氧气得电子发生还原反应,水中加入电解质溶液会增大溶液的导电能力,从而促进铁的腐蚀,亚铁离子易被氧气氧化生成而促进铁锈的生成.A、钢铁的吸氧腐蚀中,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-═4OH-,故A正确;
B、将石墨换成镁,镁和铁构成的原电池中,镁作负极,容易失去电子被氧气,所以铁被保护而不易生锈,故B正确;
C、向自来水中加入少量氯化钠固体,溶液中自由移动离子增加,铁失电子能力增加,所以可以较快看到铁锈,故C正确;
D、钢铁的吸氧腐蚀中,铁失去电子生成亚铁离子,正极上氧气得电子生成氢氧根离子,溶液中亚铁离子向正极移动,亚铁离子和氢氧根离子反应生成氢氧化亚铁,所以向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得慢,故D错误.
故选D.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题以原电池原理为载体考查了金属的腐蚀与防护,注意酸性条件下,钢铁发生析氢腐蚀,中性或弱酸性条件下,钢铁发生吸氧腐蚀.1年前查看全部
- (2008•珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
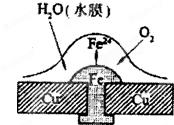 (2008•珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
(2008•珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
A.正极电极反应式为:2H++2e-→H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜不被腐蚀
D.此过程中电子从Fe移向Cu yungaoqian1年前1
yungaoqian1年前1 -
 dcdbgsy 共回答了20个问题
dcdbgsy 共回答了20个问题 |采纳率80%解题思路:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电时,电子从负极流向正极.根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀.
A、正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B、负极上发生的电极反应式为:Fe-2e-=Fe2+,正极上的电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故B正确;
C、该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故C正确;
D、该原电池放电时,外电路上电子从负极铁流向正极铜,故D正确;
故选A.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题以原电池原理为载体考查了金属的腐蚀,难度不大,明确钢铁发生析氢腐蚀和吸氧腐蚀的条件是解本题的关键,注意钢铁的吸氧腐蚀中还含有氢氧化亚铁生成氢氧化铁的反应.1年前查看全部
- 为什么二氧化碳比空气重,在着火的时候人们趴着却可以吸氧?
为什么二氧化碳比空气重,在着火的时候人们趴着却可以吸氧?
大家都知道在住宅等场所着火的时候人们都是爬着前进,这样不容易被呛到,而且还可以吸氧气.但是在化学角度来说二氧化碳的重量比氧气重,这样不是矛盾了吗? ppstar1年前6
ppstar1年前6 -
 秋枫820 共回答了20个问题
秋枫820 共回答了20个问题 |采纳率100%因为燃烧时生成的二氧化碳是热气体,热气体比冷空气的密度要略小,这样生成的二氧化碳浮在冷空气上,所以爬着能呼吸到氧气1年前查看全部
- 医院里的病人吸氧时,氧气从钢瓶出来,要经过一个如图所示的装置,想一想,为什么
 我不想说不1年前1
我不想说不1年前1 -
 ※快乐王子※ 共回答了21个问题
※快乐王子※ 共回答了21个问题 |采纳率85.7%那是水,作用是增加濕度,直接吸時間長了會很乾燥,就像冬天我们感覺空氣很乾燥一樣.1年前查看全部
- 我知道铜在空气中变成cu2(oh)2co3,那么铜棒和碳棒用导线连接放在氯化钠溶液中,就应该是吸氧腐蚀,要是把电解质溶液
我知道铜在空气中变成cu2(oh)2co3,那么铜棒和碳棒用导线连接放在氯化钠溶液中,就应该是吸氧腐蚀,要是把电解质溶液换成盐酸或氢氧化钠,那是什么腐蚀,两极电极反应式是啥,
我知道把电解质溶液换成盐酸或氢氧化钠,肯定还是吸氧腐蚀,因为要是析氢腐蚀,就是铜能和盐酸反应了。cu2(oh)2co3和盐酸反应是强酸制弱酸,但cu2(oh)2co3和氢氧化钠为什么不反应 coolma19841年前2
coolma19841年前2 -
 xqfed88gn18c6 共回答了20个问题
xqfed88gn18c6 共回答了20个问题 |采纳率90%答:是吸氧腐蚀.
正极反应:2(H2O)+O2+4e=4(OH-) (这好难表达化学式好,完全正确的写法写不出来)
负极反应:Cu+2(OH-)-2e=Cu(OH)2↓
假如Cu2(OH)2CO3能和NaOH反应,就会生成Cu(OH)2与Na2CO3
而Cu(OH)2在碱性环境下是沉淀的,它会在反应物表面形成一层阻碍反应进行的膜,只要反应还能进行,在能反应的地方膜就会加厚,直到膜把两反应物完全分开而停止反应.1年前查看全部
- 铁锈的生成过程主要是Fe—C原电池发生吸氧腐蚀的过程:
 失落上海1年前1
失落上海1年前1 -
 biaoge534 共回答了18个问题
biaoge534 共回答了18个问题 |采纳率77.8%钢材,生铁,熟铁都不是纯铁,是铁和碳的合金.在有水和空气的条件下,铁和碳形成原电池,铁充当负极,碳充当正极,吸收氧气,铁被氧化.原电池反应要比单纯的化学腐蚀快很多,所以铁锈的生成过程主要是Fe—C原电池发生吸氧腐蚀的过程.
负极 Fe-2e=Fe2+
正极 2H2O+O2+4e=4OH-1年前查看全部
- 钢铁的析氢腐蚀与吸氧腐蚀有哪些区别?3Q
 yaoyaoda1年前1
yaoyaoda1年前1 -
 黑马雷达 共回答了21个问题
黑马雷达 共回答了21个问题 |采纳率95.2%析氢腐蚀:要求水膜呈较强酸性,负极:Fe-2e-=Fe2+, 正极:2H++2e-=H2
吸氧腐蚀: 水膜呈极弱酸性、中性或碱性均可,负极:Fe-2e-=Fe2+, 正极:O2+2H2O+4e-=4OH-1年前查看全部
大家在问
- 1常微分方程题目:求下组初值问题的解
- 2Money must be spent where it can do the most good for the mo
- 3硝酸铁和过量典化氢反应方程式
- 4已知(A/X -5)+(B/X+2)=5X-4/X⒉-3X-10,试求A、B的值
- 5负数乘方乘以正数乘方怎么算呐?求众神了
- 6野鸡兔子共有36只 100只脚 设野鸡x只 兔子y只 克列方程作为()
- 7某企业已收购毛竹105吨,根据市场信息,将毛竹直接销售每吨可获利100元;如果对毛竹进行粗加工,每天可以加工8吨,每吨可
- 81:40000000的地图上,量得甲乙两地之间的距离是3厘米.那么在一张比例尺为1:50000000的地图上,甲乙两地
- 9我初中最后一次英语演讲,讲点什么好呢,比较有几年意义的,比如已经有人讲过的nickname,personality什么的
- 10一个数的80%是12,这个数是多少?
- 11unless引导的条件状语从句中出现了位移动词,主句或从句该用什么时态
- 12(急...)一组同学在校门口拍一张合影,已知冲一张底片需用0.64元,洗一张照片需用0.4元
- 13_____ you say is of no use now.
- 14在达成铁路复线工程中,某路段需要铺轨.先由甲工程队独做2天后,再由乙工程队独做3天刚好完成这项任务.已知乙工程队单独完成
- 15在达成铁路复线工程中,某路段需要铺轨.先由甲工程队独做2天后,再由乙工程队独做3天刚好完成这项任务.已知乙工程队单独完成
