制印刷电路时常用氯化铁溶液作为“腐蚀液”.向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
 lwewiwei73412022-10-04 11:39:544条回答
lwewiwei73412022-10-04 11:39:544条回答( )
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铜、铁都有 D、烧杯中铜、铁都无
选哪个,为什么?

已提交,审核后显示!提交回复
共4条回复
 jlyi 共回答了20个问题
jlyi 共回答了20个问题 |采纳率100%- 选B
由题可知,还原性:Fe>Cu>Fe2+
氧化性:Fe3+>Cu2+>Fe2+
所以向FeCl3溶液中加入Fe和Cu发生反应的顺序是
1)Fe3+和Fe反应生成Fe2+
2)若1)中Fe3+过量,则过量的Fe3+与Cu反应生成Fe2+和Cu2+
所以烧杯中有Fe则必有Cu,有Cu却不一定有Fe,但无Cu必无Fe
D是指FeCl3大大过量,将Fe和Cu都反应调的情况,自然都不会有剩余 - 1年前
 不常上线 共回答了144个问题
不常上线 共回答了144个问题 |采纳率- B
铁活泼,先起反应。
实际上全部反应是:
2FeCl3+Cu=2FeCl2+CuCl2
CuCl2+Fe=FeCl2+Cu
你就可以看出来了。 - 1年前
 大家顶才是真的顶 共回答了31个问题
大家顶才是真的顶 共回答了31个问题 |采纳率- 选B
铜和铁在溶液中能形成原电池,加速反应的进行(铁是负极)。先氧化铁,若三价铁离子有剩余再氧化铜。 - 1年前
 阿不Q 共回答了944个问题
阿不Q 共回答了944个问题 |采纳率- 结果不可能出现的是B、烧杯中有铁无铜
三者的电极电位从大到小排列顺序Fe3+>Cu>Fe所以三价铁首先氧化铁2Fe3++Fe=3Fe2+ 铁消耗完毕如果三价铁有剩余再与铜反应Fe3++Cu=Fe2++Cu+ 在这里只能生成一价铜,因为Cu2+的电极电位大于Fe3+,不可能有二价铜生成。... - 1年前
相关推荐
- “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl -
“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl - 、Fe 3+ 等杂质离子.在实验室中由“烂板液”制取ZnSO 4 •7H 2 O的过程如下: 
已知有关金属离子形成氢氧化物沉淀时的PH见下表:
(1)第①反应是使Zn 2+ 、Fe 3+ 沉淀,检验Fe 3+ 是否沉淀完全的操作是______.离子 开始沉淀时的PH 完全沉淀时的PH Fe 3+ 1.9 3.2 Zn 2+ 6.4 8.0
(2)第②步操作中需要的玻璃仪器有______.
(3)第④步中PH应保持在______.
(4)第⑥步调节溶液PH=2的目的是______.
(5)操作⑦包含3个基本实验操作,它们是______、______和过滤. 我是长颈鹿1年前1
我是长颈鹿1年前1 -
 夕阳晚风 共回答了12个问题
夕阳晚风 共回答了12个问题 |采纳率100%(1)用SCN - 检验Fe 3+ 是否有剩余,故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH) 3 沉淀完全;
(2)过滤需要用到玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(3)第④步目的是使Fe 3+ 完全沉淀,Zn 2+ 不沉淀故应调节PH为3.2~6.4,故答案为:3.2~6.4;
(4)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,故答案为:抑制Zn 2+ 水解;
(5)操作⑦包括蒸发浓缩,冷却结晶,过滤,故答案为:蒸发浓缩;冷却结晶(或降温结晶).1年前查看全部
- 制印刷电路时常用氯化铁溶液作为“腐蚀液”.铜被氯化铁溶液腐蚀的方程式为:2FeCl 3 +Cu=2FeCl 2 +CuC
制印刷电路时常用氯化铁溶液作为“腐蚀液”.铜被氯化铁溶液腐蚀的方程式为:2FeCl 3 +Cu=2FeCl 2 +CuCl 2 ;FeCl 3 溶液也能与铁反应2FeCl 3 +Fe=3FeCl 2 ;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是( ) A.有铜无铁 B.有铁无铜 C.有铁有铜 D.无铁无铜  蛇蝎妹1年前1
蛇蝎妹1年前1 -
 yangbimeng 共回答了18个问题
yangbimeng 共回答了18个问题 |采纳率94.4%由2FeCl 3 +Cu=2FeCl 2 +CuCl 2 可知还原剂为Cu,
2FeCl 3 +Fe=3FeCl 2 中还原剂为Fe,
根据金属活动顺序,铁的化学活动性大于铜.
金属活动顺序也就是还原性的顺序,铁的还原性大于铜.
则向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,
一定是铁优先与铁离子反应,
则①有铁必须有铜,②当铁完全反应后,铜开始反应,③氯化铁过量时,铁和铜都完全反应,
即不会出现有铁无铜的情况,
故选B.1年前查看全部
- “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl -
“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl - 、Fe 3+ 等杂质离子。在实验室中由“烂板液”制取ZnSO 4 ·7H 2 O的过程如下:

已知有关金属离子形成氢氧化物沉淀时的pH见下表:(1)沉淀B的主要成分是 。离子 开始沉淀时的pH 完全沉淀时的pH Fe 3+ 1.9 3.2 Zn 2+ 6.4 8.0
(2)第②步操作中需要的玻璃仪器有 。
(3)第④步中pH应保持在 范围内。
(4)第⑥步调节溶液pH=2的目的是 。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、 和过滤。 决波步景1年前1
决波步景1年前1 -
 lym830119 共回答了16个问题
lym830119 共回答了16个问题 |采纳率81.3%⑴Fe(OH) 3 ⑵漏斗、玻璃棒、烧杯⑶3.2~6.4⑷抑制Zn 2+ 水解⑸冷却结晶(或降温结晶) 略 ...1年前查看全部
- “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl -
“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的Cl - 、Fe 3+ 等杂质离子。在实验室中由“烂板液”制取ZnSO 4 ·7H 2 O的过程如下 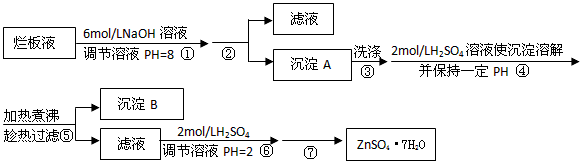
已知有关金属离子形成氢氧化物沉淀时的pH见下表 
⑴第①反应是使Zn 2+ 、Fe 3+ 沉淀,检验Fe 3+ 是否沉淀完全的操作是____________。
⑵第②步操作中需要的玻璃仪器有____________。
⑶第④步中PH应保持在____________范围内。
⑷第⑥步调节溶液PH=2的目的是____________。
⑸操作⑦包含3个基本实验操作,它们是蒸发浓缩、____________和过滤。 好想化为妖精1年前1
好想化为妖精1年前1 -
 草月花妤 共回答了18个问题
草月花妤 共回答了18个问题 |采纳率100%⑴取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe 3+ 沉淀完全
⑵漏斗、玻璃棒、烧杯
⑶3.2~6.4
⑷抑制Zn 2+ 水解
⑸冷却结晶1年前查看全部
- 制印刷电路时常用氯化铁溶液作为“腐蚀液”.铜被氯化铁溶液腐蚀的方程式为:2FeCl3+Cu=2FeCl2+CuCl2;F
制印刷电路时常用氯化铁溶液作为“腐蚀液”.铜被氯化铁溶液腐蚀的方程式为:2FeCl3+Cu=2FeCl2+CuCl2;FeCl3溶液也能与铁反应2FeCl3+Fe=3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是( )
A. 有铜无铁
B. 有铁无铜
C. 有铁有铜
D. 无铁无铜 tigerlove1年前4
tigerlove1年前4 -
 筱纨儿 共回答了24个问题
筱纨儿 共回答了24个问题 |采纳率87.5%解题思路:根据2FeCl3+Cu=2FeCl2+CuCl2、2FeCl3+Fe=3FeCl2,判断还原剂,得出铁的还原性大于铜,再利用多种还原剂和一种氧化剂反应的时候,还原性强的物质优先反应来分析解答.由2FeCl3 +Cu=2FeCl2+CuCl2可知还原剂为Cu,
2FeCl3 +Fe=3FeCl2中还原剂为Fe,
根据金属活动顺序,铁的化学活动性大于铜.
金属活动顺序也就是还原性的顺序,铁的还原性大于铜.
则向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,
一定是铁优先与铁离子反应,
则①有铁必须有铜,②当铁完全反应后,铜开始反应,③氯化铁过量时,铁和铜都完全反应,
即不会出现有铁无铜的情况,
故选B.点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较;铁盐和亚铁盐的相互转变.
考点点评: 本题考察氧化还原反应中的优先规律,明确当多种还原剂和一种氧化剂反应的时候,还原性强的物质优先反应是解答本题的关键.1年前查看全部
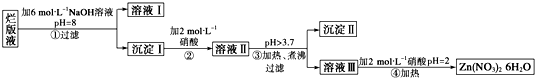
- “烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2•6H2O的过程如下:
已知:Zn(NO3)2•6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性.
(1)“烂版液”中溶质的主要成分是______(填化学式).
(2)若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______.
(3)在操作①中保持pH=8的目的是______.
(4)沉淀Ⅰ的主要成分是______.
(5)操作③中加热、煮沸的目的是______;此步骤操作的理论依据是______.
(6)操作④保持pH=2的目的是______;此步骤操作中所用的主要仪器是______. 迷失的lcy1年前1
迷失的lcy1年前1 -
 回风令 共回答了15个问题
回风令 共回答了15个问题 |采纳率86.7%解题思路:“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2•6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2;
(2)此时硝酸很稀,硝酸中的氮被还原+1价为N2O,Zn被氧化为Zn(NO3)2;
(3)使锌离子完全转化为氢氧化锌,pH不大,如果pH加大氢氧化锌两性又溶解;
(4)Zn2+、Fe3+完全沉淀生成相应的氢氧化物;
(5)热煮沸促使Fe3+完全水解;
(6)锌离子易水解生成氢氧化锌,操作④包括蒸发浓缩,冷却结晶,过滤.“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2•6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2,故答案为:Zn(NO3)2;
(2)此时硝酸很稀,硝酸中的氮被还原+1价,硝酸中的氮被还原+1价为N2O,Zn被氧化为Zn(NO3)2,发生的化学反应为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
故答案为:4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
(3)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解,故答案为:防止生成的Zn(OH)2溶解;
(4)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,故答案为:Fe(OH)3和Zn(OH)2;
(5)热煮沸促使Fe3+完全水解,原理是温度越高,水解程度越大,故答案为:促进Fe3+完全水解;水解反应吸热,温度高,水解程度大;
(6)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,则操作④保持pH=2的目的是抑制Zn2+水解为Zn(OH)2;操作④包括蒸发浓缩,冷却结晶,过滤,所用的主要仪器有蒸发皿、酒精灯、铁架台、玻璃棒,
故答案为:抑制Zn2+水解为Zn(OH)2;蒸发皿、酒精灯、铁架台、玻璃棒.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质的分离提纯实验操作,涉及氢氧化锌的两性、过滤的仪器、沉淀的生成、盐类的水解等,难度中等,注意锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解.1年前查看全部
- “烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl - 、Fe 3 + ),某化学兴趣小组拟用“
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl - 、Fe 3 + ),某化学兴趣小组拟用“烂版液”制取Zn(NO 3 ) 2 ·6H 2 O的过程如下:

已知:Zn(NO 3 ) 2 ·6H 2 O是一种无色晶体,水溶液呈酸性,Zn(NO 3 ) 2 能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N 2 O,写出稀硝酸腐蚀锌板反应的主要化学方程式_____________________________。
(2)在操作①中保持pH=8的目的是____________________________。
(3)沉淀Ⅰ的主要成分是_______________________________________。
(4)操作③中加热、煮沸的目的是________________________________;
此步骤操作的理论依据是____________________________________。
(5)操作④保持pH=2的目的是__________________________________;
此步骤操作中所用的主要仪器是________________________________。 小猪xx1年前1
小猪xx1年前1 -
 sailormo 共回答了16个问题
sailormo 共回答了16个问题 |采纳率87.5%(1)Zn(NO 3 ) 2
4Zn+10HNO 3 ===4Zn(NO 3 ) 2 +N 2 O↑+5H 2 O
(2)防止生成的Zn(OH) 2 沉淀被溶解
(3)Zn(OH) 2 和Fe(OH) 3
(4)促使Fe 3 + 完全水解 温度越高,水解程度越大
(5)抑制Zn 2 + 水解为Zn(OH) 2
蒸发皿、酒精灯、铁架台、玻璃棒
略1年前查看全部
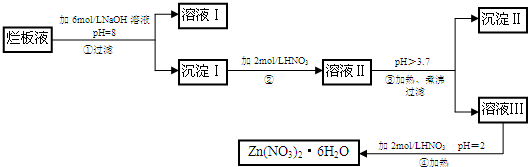
- (2009•宝安区模拟)“烂板液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含少量的Cl-、Fe3+),某化学兴
(2009•宝安区模拟)“烂板液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含少量的Cl-、Fe3+),某化学兴趣小组拟用“烂板液”制取Zn(NO3)2•6H2O的过程如图:
已知:Zn(NO3)2•6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2溶液能与碱反应,得到的产物有两性.回答下列问题:
(1)“烂板液”中溶质的主要成分是______(填化学式),若稀硝酸腐蚀锌板产物的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式:______
(2)在操作①中保持pH=8的目的是______.
(3)沉淀Ⅰ的主要成分是______.
(4)操作③中加热煮沸的目的是______;此步操作的理论依据是______.
(5)操作④保持pH=2的目的是______;此步操作中所用的主要仪器有:______. 9qq1221年前1
9qq1221年前1 -
 最快不过光光跑36 共回答了19个问题
最快不过光光跑36 共回答了19个问题 |采纳率84.2%解题思路:“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2•6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2,此时硝酸很稀,硝酸中的氮被还原+1价;
(2)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解;
(3)Zn2+、Fe3+完全沉淀生成相应的氢氧化物;
(4)热煮沸促使Fe3+完全水解;
(5)锌离子易水解生成氢氧化锌,操作④包括蒸发浓缩,冷却结晶,过滤.“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2•6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2,此时硝酸很稀,硝酸中的氮被还原+1价,发生的化学反应为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O,
故答案为:Zn(NO3)2、4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
(2)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解,故答案为:防止生成的Zn(OH)2溶解;
(3)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,故答案为:Fe(OH)3、Zn(OH)2;
(4)热煮沸促使Fe3+完全水解,原理是温度越高,水解程度越大,故答案为:促使Fe3+完全水解、温度越高,水解程度越大;
(5)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,操作④包括蒸发浓缩,冷却结晶,过滤,所用的主要仪器有蒸发皿、酒精灯、铁架台、玻璃棒,
故答案为:抑制Zn2+水解生成Zn(OH)2;蒸发皿、酒精灯、铁架台、玻璃棒.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查氢氧化锌的两性、过滤的仪器、沉淀的生成、盐类的水解等,难度不大,注意锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解.1年前查看全部
- 制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2Fecl3+Cu=2Fecl2+Cucl3.向盛有氯化铁的烧杯中
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2Fecl3+Cu=2Fecl2+Cucl3.向盛有氯化铁的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中有铜无铁
B.烧杯中有铁无铜
C.烧杯中铁,铜都有
D.烧杯中铁,铜都无 viviangod1年前3
viviangod1年前3 -
 stotom 共回答了17个问题
stotom 共回答了17个问题 |采纳率64.7%这个是氧化还原反应的典型代表.原理是铁离子将铜氧化为铜离子.但是铁离子也可氧化铁单质.生成亚铁离子.而在铁单质未反应完之前是不会将铜单质氧化的.因为即使铜被氧化,也会立刻被铁置换出来.所以过程就是先氧化铁粉,再氧化铜粉.所以不可能有铁而无铜
选B1年前查看全部
- 制印刷电路时,常用氯化铁溶液作为“腐蚀液”
制印刷电路时,常用氯化铁溶液作为“腐蚀液”
制印刷电路时常用氯化铁溶液作为“腐蚀液”.向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
( )
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铜、铁都有 D、烧杯中铜、铁都无 wanghang20021年前4
wanghang20021年前4 -
 meng蝶 共回答了22个问题
meng蝶 共回答了22个问题 |采纳率90.9%B
该反应的先后顺序是:还原性强的先反应
铁的还原性比铜强(金属活动表),所以铁先反应
只有铁反应完了铜才能反应(假设铜先反应,铁也会把铜置换出来)
所以只要有铁就一定有铜,选B1年前查看全部
- 制印刷电路时常用氯化铁溶液作为“腐蚀液”.铜被氯化铁溶液腐蚀,氯化铁也能与铁发生反应.当向盛有氯化铁溶液的烧杯中同时加入
制印刷电路时常用氯化铁溶液作为“腐蚀液”.铜被氯化铁溶液腐蚀,氯化铁也能与铁发生反应.当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是( )
A 有铜无铁 B 有铁无铜 C 有铁有铜 D 无铁无铜 出云之鹿83211年前2
出云之鹿83211年前2 -
 boysonny 共回答了15个问题
boysonny 共回答了15个问题 |采纳率86.7%我选B 因为这里面有两种情况:
1、当氯化铁溶液过剩时,铜被反应完全,然后铁也会反应完全,这里有三个反应,铜与氯化铁的反应,铁与前面反应生成的氯化亚铜反应,后生成的铜再与氯化铁反应.故排除D
2、当铁粉和铜粉过剩时,我们认为氯化铁已被完全反应了,故铁粉或铜粉有剩一种或两种.这里又分两种情况:一、铁粉过剩时,铜被反应完了,然后又被铁置换出来了,所以排除C,二、若铜粉过剩,肯定铁是不够用了,所以又排除A,
因上所述,应该选B.1年前查看全部
- “烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的
“烂板液”是制印刷锌板时,用稀HNO 3 腐蚀锌板后得到的废液,主要含Zn(NO 3 ) 2 和由自来水带进的
Cl - 、Fe 3+ 等杂质离子。在实验室中由“烂板液”制取ZnSO 4 ·7H 2 O的过程如下
已知有关金属离子形成氢氧化物沉淀时的PH见下表 
(1)第①反应是使Zn 2+ 、Fe 3+ 沉淀,检验Fe 3+ 是否沉淀完全的操作是____________________________。
(2)第②步操作中需要的玻璃仪器有_______________。
(3)第④步中PH应保持在_______________范围内。
(4)第⑥步调节溶液PH=2的目的是______________________________。
(5)操作⑦包含3个基本实验操作,它们是蒸发浓缩、_______________和过滤。 907891年前1
907891年前1 -
 网为媒 共回答了12个问题
网为媒 共回答了12个问题 |采纳率58.3%(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe 3+ 沉淀完全。
(2)漏斗、玻璃棒、烧杯
(3)3.2~6.4
(4)抑制Zn 2+ 水解
(5)冷却结晶1年前查看全部
大家在问
- 1赛车场上有三轮车和两轮摩托车共39辆,两种车共有96个轮,求三轮车和两轮摩托车各有多少辆
- 2求大家解决一道数学题!某机械制造厂,上半年完成全年计划的7分之4,下半年完成全年计划的5分之3,结果全年超额生产了120
- 3“表妹”用英语怎么说
- 4质量m=10kg的物体,在F=40N的水平向左的力的作用下,沿水平桌面从静止开始运动.物体受到滑动摩擦F'=30N.在开
- 5判断:当两个点电荷之间的距离为零时,它们间的库仑力为无穷大
- 6两点电荷距离无穷近时库仑力能趋向无穷大吗?
- 7两个带电物体无限靠近时库仑力是无限大吗?
- 8若一个边长为a的正方形的面积与一个一边长为5的长方形的面积相等,则这个长方形的周长为______.
- 9某超市销售一种饮料,平均每天了售出100箱,每箱利润120元.为了多销售,增加利润,超市准备适当降价.据测算,若每箱降价
- 10某超市销售一种饮料,平均每天可售出100箱,每箱利润120元.为了扩大销售,增加利润,超市准备适当降价.据测算,若每箱降
- 11物质所含的微粒数N、质量m 、气体体积V之间的关系
- 12把质量为10kg的物体放在光滑的水平面上,在与水平方向成53度的10N的力F作用下从静止开始运动,
- 13Creating world peace is a goal,__calls for efforts of many g
- 14英语翻译请一直守护在我身边 疼爱我一人 直到永远PS:在线翻译的不要 错误太多
- 15一种长方形的地砖,长24厘米,宽16厘米,用这种砖铺一个正方形,至少需多少块砖?
