离子交换法有哪些优点?
 静而后能安2022-10-04 11:39:541条回答
静而后能安2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 大头钢针 共回答了17个问题
大头钢针 共回答了17个问题 |采纳率88.2%- 离子交换法用于净化和富集金属组分具有选择性好、作业回收率高、作业成本低、可以得到质量较高的化学精矿等许多优点,还可以从浸出矿浆中直接提取目的组分,亦可将浸出作业和吸附作业合在一起进行.以提高浸出率和省去固液分离作业.
- 1年前
相关推荐
- 离子交换法中最常用的离子交换极是什么
 i飞1年前1
i飞1年前1 -
 泡沫是狗射出来的 共回答了18个问题
泡沫是狗射出来的 共回答了18个问题 |采纳率88.9%离子交换法常用的设备为“离子交换柱”,从来没听说过有什么“离子交换极”.
离子交换柱是用来进行离子交换反应的柱状压力容器.离子交换柱也称混床.所谓的离子交换柱,就是把一定比例的阳、阴离子交换树脂混合装填于同一交换装置中,对流体中的离子进行交换、脱除.
离子交换柱内填充离子交换树脂,工作中起离子交换作用的就是离子交换树脂.离子交换树脂品种繁多,大体可分两类:阴离子交换树脂和阳离子交换树脂.1年前查看全部
- 离子交换柱交换过程化学方程式离子交换法去离子法制造纯净水
 zdthankyou1年前2
zdthankyou1年前2 -
 万俟雨辰 共回答了20个问题
万俟雨辰 共回答了20个问题 |采纳率95%强酸型阳离子交换树脂:R-SO3H (有许多SO3H基团)
强碱型阴离子交换树脂:[R4N]OH (有许多OH基团)
R-SO3H + M(+) = RSO3M + H(+) 将所有阳离子吸附到树脂上,释放出H(+);
[R4N]OH + X(-) = [R4N]X + OH(-) 将所有阴离子吸附到树脂上,释放出OH(-);
H(+) + OH(-) = H2O 阳离子交换产生的H(+)与阴离子交换产生的OH(-)结合成水.1年前查看全部
- T 1.离子交换法中吸附离子的载体有什么.2.离子交换法的类型,阳离子交换柱对阴离子的选则的要求
T 1.离子交换法中吸附离子的载体有什么.2.离子交换法的类型,阳离子交换柱对阴离子的选则的要求
3.硫代硫酸根和氯离子作为交换离子的共同特点和硫代硫酸根的好处不同.我真的很着急啊.T.T
4.对于数=树脂要怎么处理.还有测配离子电荷时有什么技巧吗.在线等待您的回答. astro_sky1年前1
astro_sky1年前1 -
 7306037 共回答了19个问题
7306037 共回答了19个问题 |采纳率89.5%离子交换的实验我刚做过,掌握的也不是很好哈,载体一般就是离子交换树脂(制造原料主要有苯乙烯和丙烯酸(酯)之类的),机体是什么不重要因为它相当于一个催化剂全程“路过”,你一定用某个物质把它转型(酸性是阳型碱性阴型),然后才能用.硫代硫酸根比氯离子使用时更易被阴型阴离子交换柱吸收,所以要考虑使用时你准备用交换柱吸收什么离子再决定用什么阴离子转型树脂.它完全是个物理过程,不是化学反应,所以你要从离子大小,电荷数考虑,氧还性不必特别放在心上.具体你要看看书,网上也有很多课件说的很清楚我就不复制黏贴了,侧配离子电荷时溶液很容易弄得特别稀,上次我们测全班就一个人测出是4(正解),大多数是3和2.所以定容前和使用PH计时要谨慎别浪费太多1年前查看全部
- 离子交换法的发展历程近代的发展趋势及未来的发展方向
 fengzfzfzf1年前2
fengzfzfzf1年前2 -
 未满 共回答了16个问题
未满 共回答了16个问题 |采纳率93.8%因为超滤膜反渗透膜的飞速发展,离子交换法在很多领域正逐步退出市场.特别在处理水量较大的行业,如电厂、水厂等,因为膜法处理占地面积小(就目前见过的,同等产水占地至少小一半),维护简便,因此即使初期投资比离子交...1年前查看全部
- 离子交换法水处理技术,小(正)反洗的目的
离子交换法水处理技术,小(正)反洗的目的
1.离子交换法水处理技术,再生时进行小反洗的目的是( )多项选择
A.清除残余的再生剂和再生物
B.清除压脂层的杂质
C.翻腾树脂清晰各种杂质
D.再生树脂
2.离子交换法水处理技术,再生时经行正反洗的目的是( )多项选择
A.清除残余的再生剂和再生物
B.清除压脂层的杂质
C.翻腾树脂清晰各种杂质
D.再生树脂
2题都是B吗? anhaiayng19841年前5
anhaiayng19841年前5 -
 axingcyj 共回答了10个问题
axingcyj 共回答了10个问题 |采纳率100%第一题答案是 B
第二题:再生时经行正反洗的目的是( )意思如果是再生是进行正反洗的目的是()?那么正洗的目的是 A .反洗分大反洗和小反洗 如果是小反洗就是:清除压脂层的杂质.如果是大反洗就是:翻腾树脂清晰各种杂质.综上所述第二题的答案应该是:ABC.
或者可以说第二题的题目出的不严谨,因为无法判断他说的是反洗是大反洗还是小反洗.1年前查看全部
- 离子交换法处理的离子水 用兆欧表测电阻 多少合格
 森林之海1年前1
森林之海1年前1 -
 大海孤人 共回答了20个问题
大海孤人 共回答了20个问题 |采纳率100%最好的是超纯水或18兆欧水.就是接近18.18兆欧的.
一般离子纯净水的电导率为0.2-0.45us/cm,达到5~2.22兆欧就挺好了.
最低要求的大于0.05兆欧就行.1年前查看全部
- 海带中含有丰富的碘,一般以I-存在,可用离子交换法来提取海带中的碘,其步骤如下:
海带中含有丰富的碘,一般以I-存在,可用离子交换法来提取海带中的碘,其步骤如下:
(1)用水浸泡海带,浸出液中含I-和褐藻糖胶.
(2)用溶液调节浸出液的pH至12左右,使褐藻糖胶转化为褐藻糖酸钠而呈絮状沉淀析出,静置澄清,用倾析法倾出清液.
(3)用溶液调节清夜的pH至1.2,滴入NaClO,此时清夜变成棕褐色(此时应控制NaClO的用量,只使部分I-氧化为I2,故无沉淀生成).
①写出NaClO与I-反应离子方程式 答:2I-+ClO-+2H+==I2+Cl-+H2O 此时碘元素主要存在的形式为 答:I3-
②在实际操作中,为什么不能加入过量NaClO而I-使完全氧化(结合以下各步操作考虑这个问题)? 答:保留一部分使I2与形成I3-,这样既可通过离子交换树脂进行富集,又可增加离子交换树脂的交换容量压力(此时一个I3-所占的位置也只相当于一个I-的位置).如果I-全都氧化为I2,则无法在阴离子交换树脂上进行阴离子交换.
(4)将棕褐色的溶液通过氯型强碱性阴离子交换树脂(以R+—Cl-表示)柱.待溶液全部通过后,树脂呈黑红色,流出液无色,写出上述交换反应方程式:
答:R—Cl+I3-→R—I3+Cl- R—Cl+I-→R—I+Cl- (5)从柱的下端加入适当浓度的NaOH溶液,浸没树脂,静置一段时间以后,树脂恢复为原来的颜色,放出柱中无色液(称A液)于烧杯中,此时A液中所含的离子有
答:IO3-、I-(还有Na+、OH-)
树脂上的离子有 答:I-、OH-(还有IO3-) 所发生反应的离子方程式为:
答:3I2+6OH-==5I-+IO3-+3H2O
(6)将NaCl溶液加入柱中,浸没树脂,静置一段时间以后,慢慢放出无色溶液(称B液)于另一烧杯中,此时B溶液含有的离子有 答:I-、Na+、OH-(还有IO3-、Cl-) ;树脂上存在的离子有 答:Cl-
(7)往A液中滴加H2SO4溶液并不断搅拌,直到棕黑色沉淀不再继续形成为止,静置澄清,上述反应的离子方程式是
答:5I-+IO3-+6H+==3I2+3H2O
(8)B液用H2SO4酸化后,滴加NaNO2至棕黑色沉淀不再继续形成为止(反应产物中有N2),静置澄清.上述反应的离子方程式是:
答:6I-+2NO2-+8H+==3I2+N2+4H2O(2分)
(9)合并7、8两步所得到的沉淀及少量清夜,进行离心分离,得到粗碘,置于放有浓H2SO4的干燥器中进行干燥.粗碘不宜在烘箱中干燥,其原因是
答:碘易升华
我的答案已给出,就是那些离子都是怎么判断出来的,还有为什么会有那些离子,感激不尽. mochangyun1年前3
mochangyun1年前3 -
 xiangbing7 共回答了18个问题
xiangbing7 共回答了18个问题 |采纳率94.4%1,3是用次氯酸钠和酸反应形成的次氯酸氧化典离子因为用量不多生成碘单质和离子,由于碘3离子较稳定所以最终是他.过量的话就要有碘析出或生成碘酸更了.其实实验室碘水里也是这玩意儿,碘的水溶性不好(相似相溶)
4,5,先是氢氧根把碘3换出来,再是碘单质和氢氧根反应,歧化反应.有碘离子和碘酸根出来.钠离子,氢氧根原来就有
6,氯离子把树脂上的离子换出来,有氢氧根,碘离子本来就多,又不会和前面的碱液反应,钠离子和氯离子不解释,至于碘酸根,我怀疑是残留的关系.7,反歧化不解释
8,涉及到亚硝酸根的还原反应,既然说过有氮气,就是三价还原到0价了,典离子被氧化,
9,就是个物理操作,你问的应该不是这个
码字累呀,给分啊!1年前查看全部
- 处理含盐浓度较高的废水时,采用膜分离法好还是离子交换法好?
 lee198109021年前1
lee198109021年前1 -
 lxaizl0512 共回答了13个问题
lxaizl0512 共回答了13个问题 |采纳率92.3%粘度低的采用膜分离法好
极性强的是离子交换法好1年前查看全部
- 利用离子交换法制备饮水和去离子水
利用离子交换法制备饮水和去离子水
急用 caihao3111年前1
caihao3111年前1 -
 iiii卖 共回答了22个问题
iiii卖 共回答了22个问题 |采纳率90.9%那是交换钙、镁离子吧!
离子交换不是能脱盐、软化的吗?不过做饮水用反渗透就可以啊!
如果是用在污水回用上,前面要有预处理,不然膜容易阻塞缩短使用寿命,而且设备也不便宜1年前查看全部
- 离子交换法测定PbCl2的溶度积常数 实验中影响K测定结果准确度的因素有哪些
 钟麦1年前1
钟麦1年前1 -
 楚苏扬眉 共回答了21个问题
楚苏扬眉 共回答了21个问题 |采纳率90.5%在氯化铅饱和溶液中C(cl-)=2C(Pb2+)
Ksp=[cl-]*[cl-]*[Pb2+]
故而影响准确的因素主要是测定铅浓度时操作因素:离子交换柱中空气未排尽;转型时,钠型完全转变为氢型,蒸馏水冲洗交换柱至流出液呈中性;交换淋洗时液体的损失;滴定终点判定(指示剂选择);1年前查看全部
- 含盐浓度高的废水用模析法还是离子交换法好 为什么
 吕布喂1年前1
吕布喂1年前1 -
 koaring 共回答了14个问题
koaring 共回答了14个问题 |采纳率92.9%膜析的话一般不超过3%
看你的情况了
江苏德立环保工程有限公司1年前查看全部
- 简述采用离子交换法制备纯化水的过程
 mydaner1年前1
mydaner1年前1 -
 唯爱师尊 共回答了17个问题
唯爱师尊 共回答了17个问题 |采纳率100%离子交换法制备纯化水的过程分下列几种:
1、纯化水的制取的最早方法就是离子交换,他起源于60年代左右,一般采取阳离子交换树脂+阴离子交换树脂+混合离子交换树脂(阴树脂和阳树脂2:1),这种方法需要浪费大量的酸和碱再生树脂现在被淘汰了.
2、电渗析(ED)+阳离子交换树脂+阴离子交换树脂+混合离子交换树脂(阴树脂和阳树脂2:1),这是80年代制造纯化水的方法,原理就是通过电渗析预脱盐来减少树脂转型再生的酸碱使用量.
3、反渗透(RO)+混合离子交换树脂(阴树脂和阳树脂2:1),这是90年代流行的制造纯化水的方法,反渗透与电渗析相比脱盐率更高,操作更简便.
总结:离子交换法来制备纯化水应该是老工艺了,他的优点就是出水水质好,投资较少.缺点就是由污染,运行费用高.由于树脂本身就是有机物化学合成,他的破碎率较难控制或者一般厂家难以设计高标准的工艺,在新版GMP对TOC要求越来越严格的情况下,慢慢被双级反渗透工艺所淘汰.1年前查看全部
- 下列说法不正确的是( )A.工业上冶炼Fe用热还原方法B.海水淡化的方法主要有蒸馏法,电渗析法,离子交换法等C.工业上
下列说法不正确的是( )
A.工业上冶炼Fe用热还原方法
B.海水淡化的方法主要有蒸馏法,电渗析法,离子交换法等
C.工业上通过煤的干馏可获得芳香烃
D.单质硅是将太阳能转变为电能的材料,二氧化硅可以做半导体材料 masanspring1年前1
masanspring1年前1 -
 YanZi_Carrie 共回答了23个问题
YanZi_Carrie 共回答了23个问题 |采纳率95.7%解题思路:A、Fe通常采用一氧化碳还原氧化铁的还原法冶炼;
B、根据海水淡化的主要方法分析;
C、煤干馏是将煤加热到900~1100℃时,可以得到焦炭、煤焦油、煤气等物质;
D、单质硅可用于制作太阳能电池的原料,属于半导体材料.A、工业上用一氧化碳还原氧化铁冶炼Fe,属于热还原方法,故A正确;
B、海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故B正确;
C、煤的干馏是指煤在隔绝空气的条件下加热,生成煤焦油、焦炭、焦炉煤气等物质,可以得到甲烷、煤焦油中含有苯和氨等重要化工原料,故C正确;
D、单质硅可用于制作太阳能电池的原料,属于半导体材料,二氧化硅不可以做半导体材料,可以做光导纤维材料,故D错误.
故选D.点评:
本题考点: 金属冶炼的一般原理;海水资源及其综合利用;硅和二氧化硅;煤的干馏和综合利用.
考点点评: 本题考查学生物质的性质和应用等方面的知识,属于化学的实际应用题,难度不大,注意知识的归纳和整理是关键.1年前查看全部
- 怎样用沸石去除水中重金属最好是去除Cr(2+),Mn(2+),Fe(3+)不太明白,有写资料说的离子交换法,请问您明白吗
怎样用沸石去除水中重金属
最好是去除Cr(2+),Mn(2+),Fe(3+)
不太明白,有写资料说的离子交换法,请问您明白吗? syzhouzhou1年前1
syzhouzhou1年前1 -
 零下一度003 共回答了24个问题
零下一度003 共回答了24个问题 |采纳率91.7%沸石去除水中重金属以物理的吸附作用,可以先将Cr(2+),Mn(2+),Fe(3+)转化成沉淀,由沸石吸附经过滤除去.1年前查看全部
- 为回收利用废钒催化剂(含有V 2 O 5 、VOSO 4 及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺
为回收利用废钒催化剂(含有V 2 O 5 、VOSO 4 及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
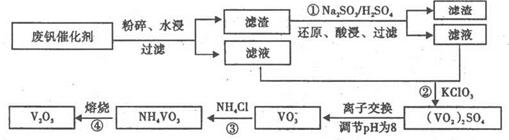
部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业上由V 2 O 5 冶炼金属钒常用铝热法,该反应的化学方程式为_______
(2)为了提高钒的浸出率,用酸浸使催化剂中的V 2 O 5 转变成可溶于水的VOSO 4 ,与水浸液合并,再用KClO 3 氧化,使+4价的V氧化成易溶于水的(VO 2 ) 2 SO 4 。反应①的离子方程式为_______;反应②的离子方程式为ClO 3 - +6VO 2 + +3H 2 O=6VO 2 + +6H + +Cl - 。
(3)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为_______。
(4) 实验室用的原料中V 2 O 5 占6%(原料中的所有钒已换算成V 2 O 5 )。取100g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL 0.1 mol·L -1 的KC1O 3 溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是_______ (已知V 2 O 5 的相对分子质量为182)。
(5)全钒液储能电池是利用不同价态的离子对之间的氧化还原反应来实现化学能和电能相互转化的装置,其原理如右下图所示。已知电池的总反应式为VO 2 + +V 2 + +2H + VO 2 + +V 3 + +H 2 O
VO 2 + +V 3 + +H 2 O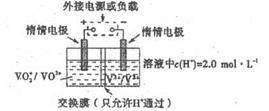
①放电时的正极反应式为______________。
②放电过程中氢离子的作用是______________,充电时若转移的电子为2mol,则左槽溶液中n(H + )的变化量为______________。 一个传说1年前1
一个传说1年前1 -
 芦花大公鸡 共回答了17个问题
芦花大公鸡 共回答了17个问题 |采纳率100%1年前查看全部
- 求设计一用离子交换法分离蛋白质的试验方案.
求设计一用离子交换法分离蛋白质的试验方案.
某蛋白酶粗品中含5中蛋白质,它们的等电点分别为4.5,5.0,6.5,7.1,7.9,试设计一用离子交换法分离它们的试验方案.
哪个人懂的 finr1年前1
finr1年前1 -
 林月儿 共回答了20个问题
林月儿 共回答了20个问题 |采纳率90%你的目标蛋白是什么?五中蛋白中应该只有一种才是目的蛋白,其余是杂质啊例如阴离子交换介质吸附的是阳离子,即蛋白质处于一个PH比其自身等电点低的环境中.装柱 氢氧化钠处理 磷酸盐缓冲液平衡 上样 吸附目...1年前查看全部
- 从水中去除某些离子,可用离子交换法和膜分离法.
从水中去除某些离子,可用离子交换法和膜分离法.
从水中去除某些离子(例如脱盐),可以用离子交换法和膜分离法.您认为,当含盐浓度较高时,应该用离子交换法还是膜分离法,为什么? hxly12131年前1
hxly12131年前1 -
 lizhu721347 共回答了26个问题
lizhu721347 共回答了26个问题 |采纳率92.3%膜分离法,简单而有效.
离子交换法是通过离子交换剂上的离子与水中离子交换以去除水中阴离子的方法.在城市污水深度处理中它是一种主要的处理技术.离子交换法脱盐处理主要是以含盐浓度为100-300mg/L的污水作为对象的.
膜分离法是利用特殊膜(离子交换膜、半透膜)的选择透过性,对溶剂(通常是水)中的溶质或微粒进行分离或浓缩的方法的统称.1年前查看全部
- 目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图.
目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图.
(1)下列说法不正确的是______
A.从E口逸出的气体是H 2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl 2 ,便产生2mol NaOH
D.粗盐水中含Ca 2+ 、Mg 2+ 、Fe 3+ 、SO 4 2- 等离子,精制时先加Na 2 CO 3 溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na 2 SO 4 溶液可制得氢氧化钠、硫酸等物质.A为______离子交换膜、B为______离子交换膜(填“阴”或“阳”),电极均为惰性电极.Na 2 SO 4 溶液应该在______区(填“I”、“II”、“III”)加入.通电电解时阴极的电极反应式为______,在III区得到______.当外电路总共通过30mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:______.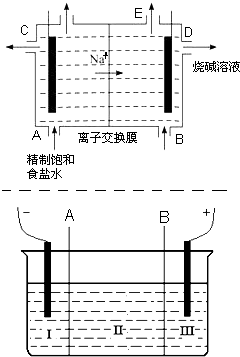
 maxreeves1年前1
maxreeves1年前1 -
 ytinter 共回答了19个问题
ytinter 共回答了19个问题 |采纳率84.2%(1)A、电解饱和食盐水时,大量的氢氧化钠在阴极附近析出,所以E极为阴极,放电的是氢离子,生成氢气,故AZ正确;
B、电解饱和食盐水时,大量的氢氧化钠在阴极附近析出,可以从B口加入含少量NaOH的水溶液以增强导电性,故B正确;
C、电解方程式为:2NaCl+2H 2 O
通电
.
2NaOH+H 2 ↑+Cl 2 ↑,标准状况下每生成22.4L 即1mol的Cl 2 ,便产生2molNaOH,故C正确;
D、粗盐提纯时,碳酸钠一定要加在氯化钡之后,可可以将多余的钡离子除掉,故D错误.
故选D.
(2)电解Na 2 SO 4 溶液时,和电源的正极相连的是阳极,该电极氢氧根离子放电生成的是氧气,和电源的负极相连的是阴极,该极上氢离子放电,生成的是氢气,所以A为阳离子交换膜,B为阴离子交换膜,Na 2 SO 4 溶液应该在Ⅱ区加入,阴极是溶液中水电离出的氢离子放电,电极反应式为:2H 2 O+2e - ═H 2 ↑+2OH - ,在III区是氢氧根放电,该极区生成硫酸和氧气,根据电极反应:2H 2 O+2e - ═H 2 ↑+2OH - ,当转移30mol电子时,生成氢氧化钠为30mol,即1200g,所以电解过程中能量的转化率=
960g
1200g ×100%=80%.
故答案为:阳;阴;Ⅱ;2H 2 O+2e - ═H 2 ↑+2OH - ;H 2 SO 4 溶液、氧气;80%.1年前查看全部
- 海水淡化方法较多,如反渗透法、蒸馏法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是( )
海水淡化方法较多,如反渗透法、蒸馏法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是( )
A.过滤法
B.萃取法
C.分液法
D.冰冻法 工9931年前1
工9931年前1 -
 sdpanhui 共回答了24个问题
sdpanhui 共回答了24个问题 |采纳率83.3%解题思路:淡化海水就是将海水中的可溶性杂质除去的过程,可根据淡化原理进行分析解答.淡化海水的方法有加热蒸发、结冰脱盐、淡化膜法、多级闪急蒸馏法,共同点都是使海水脱盐.
A.过滤法只能除去水中的不溶性杂质,而海水淡化的过程是除去海水中的可溶性杂质,通过过滤不能把水中的氯化钠等物质除去,不能使海水淡化,故A错误;
B.萃取法是利用溶解性差异分离混合物的方法,对于微溶于水的有机物,可用萃取法,则不能利用萃取法进行海水淡化,故B错误;
C.利用分液法不能实现把水中的氯化钠等物质除去,不能使海水淡化,故C错误;
D.使海水结冰脱盐,能将盐与水分开,能用来淡化海水,该方法能用来淡化海水,故D正确;
故选D.点评:
本题考点: 海水资源及其综合利用;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查海水资源的利用,为高频考点,侧重海水淡化的方法的考查,把握淡化海水的方法有蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,其中最常用的为蒸馏法和淡化膜法,题目难度不大.1年前查看全部
- 离子交换法制备纯水(1)离子交换法制纯水的基本原理是什么?(2)装柱时为何要赶净气泡?(3)钠型阳离子交换树脂和氯型阴离
离子交换法制备纯水
(1)离子交换法制纯水的基本原理是什么?
(2)装柱时为何要赶净气泡?
(3)钠型阳离子交换树脂和氯型阴离子交换树脂为什么在使用前要分别用酸、碱处理,并洗至中性? haungbi1年前1
haungbi1年前1 -
 阿洛哈aloha 共回答了17个问题
阿洛哈aloha 共回答了17个问题 |采纳率94.1%1.半透膜的选择透过性
2.防止气泡依附在交换树脂上影响离子的交换
3.清理交换树脂上有可能堵塞离子通过的杂质,洗至中性保证饮用的安全1年前查看全部
- 海水淡化方法中的:电渗析法及离子交换法的流程
海水淡化方法中的:电渗析法及离子交换法的流程
如题 柳紫颜1年前1
柳紫颜1年前1 -
 ghl453 共回答了19个问题
ghl453 共回答了19个问题 |采纳率94.7%电渗析法:水中的离子在直流电场的作用下,可通过半透膜.最初的惰性半透膜电渗析法,主要用于溶胶的提纯,电流效率很低.到了20世纪50年代初,由于选择性离子交换膜向世,才能够用电渗析法淡化海水或苦咸水.脱盐用的选择性...1年前查看全部
- 如何确定离子交换法分离蛋白质过程中的上样量和洗脱速度?
 破破熊1年前1
破破熊1年前1 -
 寒夜独狼 共回答了22个问题
寒夜独狼 共回答了22个问题 |采纳率100%看你scx柱子的结合能力吧,建议你在合适的范围内选用一组不同浓度的标准蛋白混合物来上样,通过比较起结果来确定上样量1年前查看全部
- 海水淡化中的电渗析法和离子交换法具体如何理解?
海水淡化中的电渗析法和离子交换法具体如何理解?
对电渗析法不理解之处(通入直流电那水中的氯离子和氢离子不是电解生成氯气和氢气了吗?如何得到淡水呢?再者离子能通过渗透膜?) TANQI761年前1
TANQI761年前1 -
 perfect123 共回答了30个问题
perfect123 共回答了30个问题 |采纳率70%离子交换法制淡水是将海水中所有离子全部吸附在离子交换树脂上,也就是说离子交换树脂将海水中的“离子”几乎全部“截流”了;而电渗析法是利用电场的作用,强行将离子向电极处吸引,致使电极中间部位的离子浓度大为下降,从而制得淡水的.
一般情况下水中离子都可以自由通过交换膜,除非人工合成的大分子离子.
电渗析与电解不同之处在于:电渗析的电压虽高,电流并不大,维持不了连续的氧化还原反应所需;电解却正好相反.1年前查看全部
- (8分)目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。
(8分)目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。

(1)下列说法不正确的是
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na 2 SO 4 溶液可制得氢氧化钠、硫酸等物质。A为 离子交换膜、B为 离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na 2 SO 4 溶液应该在 区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:A.从E口逸出的气体是H 2 B.从B口加入含少量NaOH的水溶液以增强导电性 C.标准状况下每生成22.4 L Cl 2 ,便产生2 mol NaOH D.粗盐水中含Ca 2+ 、Mg 2+ 、Fe 3+ 、SO 4 2- 等离子,精制时先加 Na 2 CO 3 溶液  tangdianwei1年前1
tangdianwei1年前1 -
 心口如一 共回答了17个问题
心口如一 共回答了17个问题 |采纳率82.4%(8分)(1)D(2分)
(2)阳(1分)阴(1分) II (1分) 2H 2 O + 2e - === H 2 ↑ + 2OH - (1分)
H 2 SO 4 溶液、氧气(1分) 80%
略1年前查看全部
大家在问
- 1不定积分,基本公式推导,
- 2王华从1楼爬到4楼用了3.6分钟.如果用同样的速度从5楼爬到10楼,需要多长时间?
- 3图中的重叠部分占大圆面积的8分之1,是小圆面积的5分之1
- 4形容冬天孩子开心玩的成语(10个)拜托了!
- 5下列离子方程式书写正确的是( ) A.FeCl 2 溶液中通入Cl 2 :Fe 2+ +Cl 2 ═Fe 3+ +2C
- 6照样子写词语;喜怒哀乐
- 71米4*25mm2的铝芯电缆重量是多少?
- 8做梦梦到外星人侵略地球意味着什么?
- 9英语句子亲爱的威廉宝宝:祝你生日快乐!姐姐代表全家人祝贺你1岁了!姐姐和全家人祝宝宝今后天天,一天比一天可爱,一天比一天
- 10问一道高中数学不等式的题若不等式x^2+ax+1≥0对一切x∈(0,½]成立,则a的最小值为?A.0 B.
- 113时15分=3[1/4]3[1/4]时 4.06公顷=____
- 12时尚家居 英文怎么说啊.
- 13用英语说骑自行车的三种方法及区别
- 14有24条棱的多面体是什么体 A.十二棱柱 b.十二棱锥 c.六棱柱 d.八棱柱或十二棱锥
- 15问一个英语的小问题?使役动词let有主动let sb do sth在英语有没有sb be let to do我们老师写的

