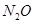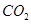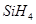硅的卤化物是固态 汽态还是液态
 zz排2022-10-04 11:39:541条回答
zz排2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 凉夏的朱砂 共回答了22个问题
凉夏的朱砂 共回答了22个问题 |采纳率95.5%- 四氟化硅 气态 熔点(℃):-90.2(175.6kPa) 沸点(℃):-65(24.1kPa)
四氯化硅 液态 熔点-70℃.沸点57.6℃
四溴化硅 液态 熔点 5.0℃ 沸点155.0 ℃
四碘化硅 固态熔点155.0 ℃ 沸点290.0 ℃ - 1年前
相关推荐
- 从单质氟到碘,下列情况中不能反映出它们的氧化性强弱不同的是( ) A.单质跟卤化物之间
从单质氟到碘,下列情况中不能反映出它们的氧化性强弱不同的是()
A.单质跟卤化物之间的置换情况 B.跟银结合而形成的卤化银的颜色变化情况 C.跟氢气反应的情况 D.跟水反应的情况  wg0311081年前1
wg0311081年前1 -
 朱古力212 共回答了33个问题
朱古力212 共回答了33个问题 |采纳率93.9%B
单质的氧化性强弱,即为单质的得电子能力;可以卤素之间的置换,跟氢气反应的难易,跟水反应的情况来判断,不能从物理性质如:颜色、状态、密度、溶解度等来判断,也不能从其化合物的颜色来判断。1年前查看全部
- 卤化物和卤酸盐在工业生产中有着重要的作用.某小组为探究其中一些盐的性质,查阅资料并进行实验.查阅资料如下:
卤化物和卤酸盐在工业生产中有着重要的作用.某小组为探究其中一些盐的性质,查阅资料并进行实验.查阅资料如下:
①BrO3-+6I-+6H+=3I2+Br-+3H2O ②2BrO3-+I2=2IO3-+Br2
③IO3-+5I-+6H+=3I2+3H2O ④2IO3-+10Br-+12H+=I2+5Br2+6H2O
实验如表:
请回答:步骤 现象 ⅰ.向盛有30mL 0.2mol•L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 ⅱ.继续向上述溶液中滴入KBrO3溶液 溶液的蓝色逐渐褪去
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移______mol e-,该反应中硫酸表现出的化学性质是______.
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应______(填“能”或“不能”)说明碘的非金属性强于溴,原因是______.
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是______;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是______.( ) yacity1年前1
yacity1年前1 -
 sdcworld 共回答了18个问题
sdcworld 共回答了18个问题 |采纳率77.8%解题思路:(1)根据n=cV计算溶液中n(I-),反应中I-是还原剂,被氧化为I2,化合价由-1价升高为0价,据此计算;反应中硫酸提供的氢离子参加反应,硫酸表现酸性;
(2)步骤ⅱ中溶液的蓝色逐渐褪去,说明I2被氧化,该反应只能说明I2的还原性比Br2强;
(3)根据氧化剂氧化性强于氧化产物的氧化性进行判断;KBrO3溶液与KBr溶液在酸性条件下,发生类似信息反应③的反应,BrO3-、Br-在酸性条件下生成溴单质与水;(1)溶液中n(I-)=0.03L×0.2mol•L-1=0.006mol,反应中I-是还原剂,被氧化为I2,化合价由-1价升高为0价,故转移电子物质的量为0.006mol×1=0.006mol;反应中硫酸提供的氢离子参加反应,硫酸表现酸性,
故答案为:0.006mol;酸性;
(2)步骤ⅱ中溶液的蓝色逐渐褪去,说明I2被氧化,发生反应②2BrO3-+I2=2IO3-+Br2,该反应只能说明I2的还原性比Br2强,不能说明碘的非金属性强于溴,
故答案为:②;不能;该反应只能说明I2的还原性比Br2强;
(3)由反应①可知,氧化性BrO3->I2,由反应②可知,氧化性BrO3->IO3-,由反应③可知,氧化性IO3->I2,由反应④可知,氧化性IO3->Br2,故氧化性BrO3->IO3->Br2>I2;BrO3-、Br-在酸性条件下生成溴单质与水,反应离子方程式为:BrO3-+5Br-+6H+=3Br2+3H2O,
故答案为:BrO3->IO3->Br2>I2;BrO3-+5Br-+6H+=3Br2+3H2O.点评:
本题考点: 氧化性、还原性强弱的比较;氧化还原反应的电子转移数目计算.
考点点评: 本题考查氧化还原反应及计算、对信息的利用,难度中等,是对学生综合能力的考查,注意氧化还原反应中氧化剂氧化性强于氧化产物的氧化性这一规律.1年前查看全部
- 溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O→HBr+HIO,下列有关IBr的叙述中,不正确的是( )
A. 在很多反应中IBr是强氧化剂
B. IBr与水反应时既做氧化剂,又做还原剂
C. IBr与AgNO3溶液反应会生成AgBr沉淀
D. IBr与NaOH溶液反应时,生成NaBr和NaIO 煤煤虫1年前1
煤煤虫1年前1 -
 生层云 共回答了14个问题
生层云 共回答了14个问题 |采纳率92.9%解题思路:根据IBr中I元素的化合价为+1价,Br为-1价,IBr化学性质与卤素单质具有相似性,及反应IBr+H2O═HBr+HIO中没有元素化合价的变化来分析解答.A.溴化碘的化学性质与卤素单质相似,则IBr中I元素的化合价为+1价,I元素的化合价在反应中能降低,则在很多化学反应中IBr是强氧化剂,故A正确;
B.因IBr中I元素的化合价为+1价,Br为-1价,HBr中Br为-1价,HIO中I为+1价,则IBr+H2O═HBr+HIO中没有元素化合价的变化,该反应属于非氧化还原反应,则IBr与水反应时既不做氧化剂,也不做还原剂,故B错误;
C.首先发生IBr+H2O═HBr+HIO,然后生成AgBr沉淀,故C正确;
D.由反应IBr+H2O═HBr+HIO可推知与NaOH反应的化学方程式为IBr+2NaOH=NaBr+NaIO+H2O,故D正确.
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意从氧化化合价的角度认识氧化还原反应的相关概念和相关物质的性质,答题时注意题给信息,为解答该题的关键.1年前查看全部
- 在金属卤化物中,能用于人工降雨的物质是_______.用于制作照相感光底片的物质是____________,
在金属卤化物中,能用于人工降雨的物质是_______.用于制作照相感光底片的物质是____________,
其原理用化学方程式表示为_______________ karlyinghuan91年前2
karlyinghuan91年前2 -
 jasonshyinj 共回答了13个问题
jasonshyinj 共回答了13个问题 |采纳率92.3%AgI AgBr
2AgBr=光照=2Ag+Br21年前查看全部
- 溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O═HBr+HIO.下
溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O═HBr+HIO.下列有关叙述中不正确的是( )
A.IBr不是单质分子
B.IBr与水反应时,它既是氧化剂,又是还原剂
C.在很多化学反应中IBr作氧化剂
D.跟NaOH溶液反应可生成NaI和NaBrO qutang2331年前1
qutang2331年前1 -
 alkaeda 共回答了25个问题
alkaeda 共回答了25个问题 |采纳率88%解题思路:IBr中I元素化合价为+1价,具有氧化性,与水发生反应元素的化合价没有发生变化,为水解反应.A.IBr为化合物,故A正确;
B.IBr与水发生反应元素的化合价没有发生变化,为水解反应,故B错误;
C.IBr中I元素化合价为+1价,具有氧化性,在很多化学反应中IBr作氧化剂,故C正确;
D.由与水的反应可知,跟NaOH溶液反应可生成NaBr和NaIO,故D错误.
故选BD.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意从氧化化合价的角度认识氧化还原反应的相关概念和相关物质的性质,答题时注意题给信息,为解答该题的关键.1年前查看全部
- 某些金属卤化物可跟其卤素反应,如KI+I2⇌KI3下列推断错误的是( )
某些金属卤化物可跟其卤素反应,如KI+I2⇌KI3下列推断错误的是( )
A.
溶液中存在如下平衡:I −3
⇌I2+I−I −3
B.在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀
C.KI3溶液可用于检验淀粉的存在
D.配制碘水时,加入KI可增大I2的溶解度 天下行书1年前1
天下行书1年前1 -
 呼拉啦 共回答了11个问题
呼拉啦 共回答了11个问题 |采纳率72.7%解题思路:根据KI+I2⇌KI3可知,在KI3溶液中存在I3-、I-、I2等粒子,结合对应的物质的性质以及平衡移动的影响因素解答该题.A.由反应KI+I2⇌KI3可知,溶液中存在平衡I3-⇌I-+I2,故A正确;
B.在KI3溶液中存在I-,加入AgNO3溶液,会析出AgI沉淀,故B错误;
C.在KI3溶液中存在I2,可用于检验淀粉的存在,故C正确;
D.从平衡移动的角度分析,对于平衡I3-⇌I-+I2,增加I-浓度,平衡向生成I3-的方向移动,可增大I2的溶解度,故D正确.
故选B.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查氯溴碘及其化合物的综合应用,题目难度中等,本题注意根据可逆反应的特点解答该题.1年前查看全部
- 氯化溴是由两种卤素互相结合而成的卤素互化物。其化学性质与Cl 2 相似,能与金属和非金属反应生成卤化物,能与水反应:Br
氯化溴是由两种卤素互相结合而成的卤素互化物。其化学性质与Cl 2 相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H 2 O
A.BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐 B.BrCl具有较强的氧化性 C.能使润湿的淀粉碘化钾试纸变蓝 D.BrCl与水反应中,BrCl既是氧化剂又是还原剂  尹默默1年前1
尹默默1年前1 -
 564077824 共回答了18个问题
564077824 共回答了18个问题 |采纳率94.4%D
根据BrCl+H 2 O HCl+HBrO则A正确,D错(元素的化合价没有变化);BrCl化学性质与Cl 2 相似,则BrCl具有较强的氧化性,B、C(可将碘离子氧化为碘单质)正确。1年前查看全部
- 互卤化物BrCl,ICl是什么卤化试剂
 dongfeng221年前1
dongfeng221年前1 -
 21164939 共回答了17个问题
21164939 共回答了17个问题 |采纳率100%要看什么情况,比如对于苯环的卤化而言,由于这是一个亲电取代反应,进攻物质是卤素正离子,所以此时互化物中电负性小的卤素原子带正电荷,发生的卤化反应就是这个电负性小的卤素原子的卤化.所以BrCl和苯环反应生成溴苯、ICl和苯环反应生成碘苯(产率较低)1年前查看全部
- 氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.
氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g),若反应中有4mol N-H键断裂,则形成的π键有______mol.
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为______.
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图1.写出该反应的化学方程式:8Fe+2NH3
2Fe4N+3H2640℃ .8Fe+2NH3.
2Fe4N+3H2640℃ .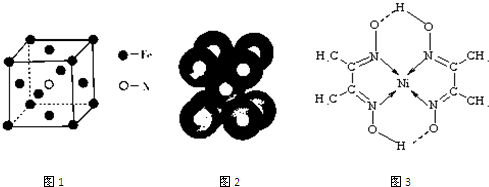
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)═2Na(l)+3N2(g),下列有关说法正确的是______(填序号).
a.常温下,N2很稳定,是因为N的电负性大
b.钠晶胞结构见图2,每个晶胞含有2个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
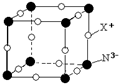
(5)配合物Y的结构见图3,Y中含有______(填序号);
a.极性共价键b.非极性共价键c.配位键d.氢键
Y中碳原子的杂化方式有______. tttt老兵1年前1
tttt老兵1年前1 -
 ying525ying 共回答了17个问题
ying525ying 共回答了17个问题 |采纳率82.4%解题思路:(1)反应中有4mol N-H键断裂,生成1.5molN2,根据结构式N≡N判断;
(2)根据分子中δ键和孤电子对数判断杂化类型和分子的空间构型;
(3)铁和氨气在640℃可发生置换反应生成氮气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式;
(4)a.根据氮气中的共价键分析;
b.利用均摊法确定其晶胞中的原子数;
c.非金属性越强,第一电离能越大,同周期从左到右第一电离能增大,第IIA与第IIIA,第VA族与第VIA反常;
d.离子半径越小,晶格能越大;
(5)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间有氢键;
(6)根据碳原子成键类型判断.(1)1mol氮气分子中含有2molπ键,若该反应中有4mol-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×2=3mol,故答案为:3;
(2)NF3中含有3个δ键,且孤电子对数为[5−3/2]=1,则应为sp3杂化,空间构型为三角锥形,故答案为:三角锥形;
(3)该晶胞中铁原子个数=8×[1/8],氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3
640℃
.
2Fe4N+3H2,
故答案为:8Fe+2NH3
640℃
.
2Fe4N+3H2;
(4)a.氮气中存在N≡N,N≡N的键能很大,不容易断裂,所以N2很稳定,故a错误;
b.钠晶胞中Na占据8个顶点和中心,根据均摊法确定其晶胞中的原子数为:8×[1/8]+1=2,故b正确;
c.非金属性越强,第一电离能越大,同周期从左到右第一电离能增大,第IIA与第IIIA,第VA族与第VIA反常,所以第一电离能:N>O>P>S,故c正确;
d.离子半径越小,晶格能越大,半径:Na+<K+,则晶格能:NaN3>KN3,故d错误;
故答案为:bc;
(5)根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,
故选:abcd;
(6)根据图可知,碳碳间形成单键,为sp3杂化,有的碳碳间形成双键,为sp2杂化,故答案为:sp3、sp2.点评:
本题考点: 判断简单分子或离子的构型;配合物的成键情况;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题综合性较大,涉及晶体、化学键、杂化轨道、晶胞计算等,题目难度中等,注意运用杂化理论推导分子构型,为易错点,侧重于考查学生对所学知识的综合应用能力.1年前查看全部
- 氟、氯、溴、碘的单质中,与氢气混合后在暗处就能发生剧烈反应的是【 】;与水剧烈反应并放出氧气的是【 】;不能将其他卤化物
氟、氯、溴、碘的单质中,与氢气混合后在暗处就能发生剧烈反应的是【 】;与水剧烈反应并放出氧气的是【 】;不能将其他卤化物种的卤素置换出来的是【 】.
 bailey6661年前3
bailey6661年前3 -
 五谷树 共回答了19个问题
五谷树 共回答了19个问题 |采纳率84.2%氟 F2 +H2= 2HF
氟 2F2+ 2H2O=4HF+O2
碘 因为碘的还原性最弱1年前查看全部
- 下列说法正确的是( )A. 冰融化时,分子中H-O键发生断裂B. 随着电子层数的增加,卤化物CX4分子间作用力逐渐增大
下列说法正确的是( )
A. 冰融化时,分子中H-O键发生断裂
B. 随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高
C. 由于H-O键比H-S键牢固,所以水的熔沸点比H2S高
D. 在由分子所构成的物质中,分子间作用力越大,该物质越稳定 zzuu1年前1
zzuu1年前1 -
 cat0829 共回答了23个问题
cat0829 共回答了23个问题 |采纳率82.6%解题思路:A.冰融化时只破坏范德华力;
B.结构相同的分子晶体中,物质的熔沸点与其相对分子质量成正比;
C.物质的熔沸点与化学键无关;
D.物质的稳定性与化学键有关.A.冰融化时发生物理变化,只破坏范德华力而不破坏化学键,故A错误;
B.结构相同的分子晶体中,物质的熔沸点与其相对分子质量成正比,所以随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高,故B正确;
C.物质的熔沸点与化学键无关,水的熔沸点比H2S高因为水中存在氢键,故C错误;
D.物质的稳定性与化学键有关,与范德华力无关,故D错误;
故选B.点评:
本题考点: 化学键;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题考查了物质的性质,知道物质的哪些性质取决于范德华力、哪些性质取决于化学键是解本题关键,知道氢键对物质性质的影响,注意氢键不属于化学键,为易错点.1年前查看全部
- 氮元素可形成卤化物、氮化物、叠氮化物及配位化合物等许多化合物.
氮元素可形成卤化物、氮化物、叠氮化物及配位化合物等许多化合物.
(1)化合物NF3为______分子(填“极性”或“非极性”),若其沸点为-129℃,则其晶体类型为______.
(2)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.
①与N3-互为等电子体的分子、离子有______(各举1例).
②叠氮化物、硫氰化物都能与Fe3+、Co3+等形成配位化合物,如:Fe(SCN)3、[Co(N3)(NH3)5]SO4等,[Co(N3)(NH3)5]SO4中Co3+的配位数为______;FeCl3与KSCN按物质的量之比1:5反应生成的配位化合物的化学式是______.
③NaN3与KN3的结构类似,则NaN3的晶格能______(填“>”或“<”)KN3的晶格能. KQL_681年前1
KQL_681年前1 -
 3225798 共回答了27个问题
3225798 共回答了27个问题 |采纳率85.2%解题思路:(1)NF3中N原子的价层电子对=3+1=4,且含有一个孤电子对,所以其空间构型为三角锥型,则分子中正负电荷中心不重合,为极性分子;
根据晶体的性质判断晶体类型;
(2)①原子个数相等且价电子数相等的微粒为等电子体;
②根据构造原理写出其基态核外电子排布式,根据价层电子对互斥理论确定其杂化类型,根据配体个数确定配位数;
③结构相似的离子晶体中,晶格能与离子半径呈反比.(1)NF3中N原子的价层电子对=3+1=4,且含有一个孤电子对,所以其空间构型为三角锥型,则分子中正负电荷中心不重合,为极性分子;
其沸点为-129℃,较低,根据分子晶体的性质,判断为分子晶体;
故答案为:极性;分子晶体;
(2)①N3-中原子个数是3,价电子数是16,则与N3-互为等电子体的分子、离子有:N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-,
故答案为:N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-;
②铁是26号元素,其核外有26个电子,根据构造原理知铁的基态原子核外电子排布式为[Ar]3d64s2,CN-中C原子的价层电子对=1+1=1,所以采取sp杂化,其配位数是6;
FeCl3与KSCN按物质的量之比1:5反应生成的配位化合物Fe元素和SCN-的数目比例为1:5,故配位化合物的化学式是K2[Fe(SCN)5];
故答案为:6;K2[Fe(SCN)5];
③NaN3与KN3的结构类似,钠离子半径小于钾离子半径,所以NaN3的晶格能>KN3的晶格能,故答案为:>.点评:
本题考点: 氮族元素简介;用晶格能的大小衡量离子晶体中离子键的强弱;配合物的成键情况;“等电子原理”的应用.
考点点评: 本题考查物质结构,涉及配位数的判断、等电子体等知识点,这些都是高考热点,要注重基础知识的积累.1年前查看全部
- 关于共价化合物为什么低价金属卤化物像FeCl2是离子型而高价金属卤化物像FeCl3就是共价型?
 谁说我没文化1年前1
谁说我没文化1年前1 -
 陈村车记 共回答了12个问题
陈村车记 共回答了12个问题 |采纳率83.3%其实共价键和离子键并没有严格的界限,很多化学键介于二者之间,一般只是说共价成分多或者是离子键成分多而已,而在初高中的化学学习体系中这种物质的连续性被割裂了,教育的弊端啊.这涉及到金属离子和卤素离子的极化问题,在此不必多说了.
就题论题,一般AlCl3才是典型的金属盐共价化合物,FeCl3倒不是太典型,并不是说高价金属卤化物就和共价化合物有必然联系,现阶段如果不学竞赛的话还是以背基础知识点为主吧.1年前查看全部
- Ⅰ、氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
Ⅰ、氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
(1)NF 3 ,NBr 3 、NCl 3 这三种分子的空间构型是 。
(2)叠氮酸(HN 3 )是一种弱酸,可部分电离出H + 和N 3 - 。请写出两种与N 3 - 电子数相等的分子 。
(3)NaN 3 与KN 3 离子键强弱相比,NaN 3 KN 3 (填“>”、“=”或“<” )。
(4)氮化碳结构如下图, 其硬度超过金刚石晶体,成为首屈一指的超硬新材料。
①写出氮化碳的化学式____ _ _____;
②指出氮化碳的晶体类型______ _____。
Ⅱ、分析表中四种物质的相关数 据,请回答:
据,请回答:
(1)CH 4 和SiH 4 比较,沸点高低的原因是____ _______;CH 4 SiH 4 NH 3 PH 3 沸点/K 101.7 161.2 239.7 185.4 分解温度/K 873 773 1073 713.2
(2)NH 3 和PH 3 比较,分 解温度高低的原因是_____ ______ ;
解温度高低的原因是_____ ______ ;
(3)结合上述数据和规律判 断,一定压强下HF和HCl的混合气体降温时___________先液化。
断,一定压强下HF和HCl的混合气体降温时___________先液化。 wangjuan0181年前1
wangjuan0181年前1 -
 流风go 共回答了25个问题
流风go 共回答了25个问题 |采纳率92%1年前查看全部
- 高中化学溴化碘化学性质问题溴化碘(IBr)的化学性质类似卤素单质,能跟大多数金属和非金属反应生成相应卤化物,能跟水反应:
高中化学溴化碘化学性质问题
溴化碘(IBr)的化学性质类似卤素单质,能跟大多数金属和非金属反应生成相应
卤化物,能跟水反应:IBr+H2O=HBr+HIO,下列有关IBr的叙述,不正确的是(C)
A,固体IBr是一种化合物
B,在很多反应中IBr是强氧化剂
C,IBr与水反应既是氧化剂又是还原剂
D,跟NaOH溶液反应生成NaBr和NaIO
最好解析一下
 sumans1年前1
sumans1年前1 -
 fudan55 共回答了17个问题
fudan55 共回答了17个问题 |采纳率94.1%溴化碘中溴负1价碘正1价
其中正1价碘有强氧化性水化物是次碘酸
A好理解不作解释
B参考上述解释
C与水反应化合价不变为非氧化还原反应
D容易理解不解释 不懂请追问1年前查看全部
- (2009•深圳一模)CsICl2是一种碱金属的多卤化物,它在化学反应中既可做现氧化剂也可做还原剂.下列说法中,正确的是
(2009•深圳一模)CsICl2是一种碱金属的多卤化物,它在化学反应中既可做现氧化剂也可做还原剂.下列说法中,正确的是( )
A.该化合物中含有离子键和共价键
B.CsICl2溶于水,电离生成:Cs+、I-、Cl-
C.向CsICl2溶液中通入Cl2,有I2生成
D.在CsICl2溶液中通入SO2,有SO42-生成 紫鸽儿1年前1
紫鸽儿1年前1 -
 k49n 共回答了13个问题
k49n 共回答了13个问题 |采纳率84.6%解题思路:CsICl2是一种碱金属的多卤化物,Cs为+1价,I为+1价,Cl为-1价,结合在化学反应中既可表现氧化性又可表现还原性来解答.A.金属离子与卤素离子形成离子键,卤素之间形成共价键,故A正确;
B.Cs为+1价,I为+1价,Cl为-1价,故B错误;
C.在CsICl2溶液中通入C12,二者不反应,故C错误;
D.CsICl2有氧化性,与具有还原性的SO2气体反应生成硫酸,故D正确;
故选AD.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;氧化还原反应.
考点点评: 本题考查氧化还原反应,明确物质中各元素的化合价是解答本题的关键,注意化合价降低表现氧化性,化合价升高表现还原性,难度不大1年前查看全部
- 下列金属卤化物中最稳定的是 A.Naf B.NaCl C.NaBr D.NaI
 冰淇淋的味道1年前2
冰淇淋的味道1年前2 -
 ravende 共回答了15个问题
ravende 共回答了15个问题 |采纳率93.3%选A
因为Na和F的电负性相差最大,结合力更大,离子键键能更强,所以最稳定.1年前查看全部
- (2013•江西二模)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(2013•江西二模)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)气态氟化氢中存在二聚分子(HF)2,这是由于______.
(2)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______,中心I原子的杂化轨道类型为______.
(3)基态溴原子的电子排布式为______,碘原子价电子的电子排布图为______.
(4)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近.Cl2、IBr、ICl沸点由高到低的顺序为______,I和Cl相比,电负性较大的是______,ICl中I元素的化合价为______.
(5)请推测 ①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为______(填序号).
(6)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物和卤素互化物,该反应的化学方程式为RbICl2
RbCl+ICl△ .RbICl2.RbICl2的晶体结构与CsCl相似,晶胞边长为685.5pm,RbICl2晶胞中含有______个氯原子,RbICl2晶体的密度是
RbCl+ICl△ .[283.5×4(685.5×10−10)3×NA  唐张1年前0
唐张1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- IBr(溴化碘)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟水反应的方程式为:IBr+H2O=HBr
IBr(溴化碘)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟水反应的方程式为:IBr+H2O=HBr+HIO等,下列有关IBr的叙述中错误的是:
A.跟溴,碘相似,固态溴化碘熔沸点也很低
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr,NaIO和H2O. yibai12201年前4
yibai12201年前4 -
 平平鱼ppy 共回答了14个问题
平平鱼ppy 共回答了14个问题 |采纳率100%A,既然是拟卤素,固然正确.
B,依然是卤素的性质,正确.
C,这里比较特殊的是IBr中I为+1价,Br为-1价,所以与水的反应不是氧化还原反应,这个选项错误.
D,根据I为+1价,Br为-1价,与NaOH溶液反应就是HBr与HIO分别与NaOH反应,所以得到NaBr,NaIO和H2O,正确.1年前查看全部
- 有些盐既不溶于水也难溶于酸,例如硫酸盐中的______和卤化物中的_____.
 ecoole1年前1
ecoole1年前1 -
 人在世上飘y 共回答了20个问题
人在世上飘y 共回答了20个问题 |采纳率80%有些盐既不溶于水也难溶于酸,例如硫酸盐中的硫酸钡和卤化物中的氯化银.1年前查看全部
- 为什么硼的最简单氢化物是B2H4,但硼的卤化物却能以BX3的形式存在?
 奋战上海滩1年前1
奋战上海滩1年前1 -
 crisco 共回答了18个问题
crisco 共回答了18个问题 |采纳率77.8%BH3系缺电子分子,不稳定,极易形成B2H6.BX3也属缺电子分子,但BX3中X原子有未成键的p孤电子对,它可以提供出来与B的空轨道形成大π键,补偿了缺电子的性质,因此BX3就很稳定,能单独存在.1年前查看全部
- 碱金属、碱土金属卤化物热稳定性有什么规律?试详细分析影响其热稳定性的各种因素.
碱金属、碱土金属卤化物热稳定性有什么规律?试详细分析影响其热稳定性的各种因素.
碱金属卤化物的规律? zepeng981年前1
zepeng981年前1 -
 lfp910 共回答了20个问题
lfp910 共回答了20个问题 |采纳率95%碱金属从上到下熔点逐渐降低,金属性逐渐增强
碱土金属卤化物熔点逐渐降低,离子键键长较长,键能小1年前查看全部
- (2013•南昌二模)将某种金属卤化物和浓硫酸在烧瓶里加热后,可得到无色卤化氢气体,则该金属卤化物是( )
(2013•南昌二模)将某种金属卤化物和浓硫酸在烧瓶里加热后,可得到无色卤化氢气体,则该金属卤化物是( )
A.氟化物
B.氯化物
C.溴化物
D.碘化物 洒水节1年前1
洒水节1年前1 -
 snowflake_365 共回答了14个问题
snowflake_365 共回答了14个问题 |采纳率100%解题思路:浓硫酸具有强氧化性,能氧化某些强还原性的氢化物,氢氟酸能和二氧化硅反应,据此分析解答.A.玻璃中含有二氧化硅,氢氟酸和二氧化硅反应生成四氟化硅,所以不能用普通圆底烧瓶制取氟化氢,故A不选;
B.利用高沸点的酸制取挥发性酸原理,盐酸是挥发性酸,浓硫酸是高沸点酸,且氯化氢和玻璃不反应,所以可以用浓硫酸和氯化钠制取氯化氢,故B选;
C.溴化氢能被浓硫酸氧化而得不到溴化氢,故C不选;
D.碘化氢易被浓硫酸氧化生成碘单质而得不到碘化氢,故D不选;
故选B.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查了氢化物的制取,为高频考点,侧重于学生的分析能力的考查,明确氢化物和浓硫酸的性质是解本题关键,注意难挥发性酸制取易挥发性酸的反应原理,题目难度不大.1年前查看全部
- 臭氧层 卤化能破坏大气臭氧层最主要的卤化物是什么
 莫说莫问1年前1
莫说莫问1年前1 -
 yuer2046 共回答了26个问题
yuer2046 共回答了26个问题 |采纳率100%国际组织《关于消耗臭氧层物质的蒙特利尔议定书》及其该《议定书修正》规定了15种氯氟烷烃(CFCs)、 3种哈龙、40种含氢氯氟烷烃(HCFCs)、34种含氢溴氟烷烃(HBFCs)、四氯化碳(CCl4)、甲基氯仿(CH3CCl3)和甲基溴(CH3Br)为控制使用的消耗臭氧层物质,也称受控物质.
氯氟烷烃(CFCs).此类化合物自1928年人类首次合成后被以多种方式使用,冰箱、空调制冷剂、气雾剂制品中的推进剂(CFC11、CFC12)、生产靠垫和垫子的软发泡剂、印刷线路板和其它设备的清洗剂等.
含氢氯氟烷烃(HCFC).此类物质是CFCs的一种过渡性替代品,HCFC因为含有H,使得它在底层大气易于分解,对O3层的破坏能力低于CFCs,但长期和大量使用对O3层危害也很大.
在工程和生产中作为溶剂的四氯化碳(CCl4)和甲基氯仿(CH3CCl3)同样具有很大的破坏O3层的潜值,所以也被列为受控物质.
溴氟烷烃主要是哈龙:哈龙1211(CF2BrCl)、哈龙1310(CF3Br)、哈龙2420(C2F4Br2),这些物质一般用作特殊场合的灭火剂.此类物质对臭氧层最具破坏性,比CFCs高3~10倍,1994年发达国家已经停止这3种哈龙的生产.
近年来,主要用于土壤熏蒸和检疫的另一种破坏臭氧层的含溴化合物即甲基溴(CH3Br)引起了人们的重视,它也被列为受控物质.
BR、CL、F几个元素1年前查看全部
- (2011•江苏二模)氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.
 (2011•江苏二模)氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.
(2011•江苏二模)氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.
(1)nf3的沸点为-129℃,其分子的空间构型为______.
(2)叠氮酸(hn3)是一种弱酸,可部分电离出h+和n3-.
①与n3-互为等电子体的分子、离子有______(各举1例).
②叠氮化物、***化物都能与fe2+、cu2+及co3+等形成配合物,如:[fe(cn)6]4-、[co(n3)(nh3)5]so4.铁的基态原子核外电子排布式为______;cn-中c原子的杂化类型是______;[co(n3)(nh3)5]so4中钴的配位数为______.
③nan3与kn3的结构类似,则nan3的晶格能______kn3的晶格能.(填“>”或“<”)
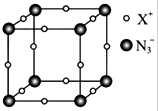
(3)元素x与n形成的氮化物中,x+中的所有电子正好充满k、l、m三个电子层,它与n3-形成晶体的结构如图所示.则x+符号是______,每个n3-与其距离最近的x+有______个. tete1211年前1
tete1211年前1 -
 娃娃屋子 共回答了20个问题
娃娃屋子 共回答了20个问题 |采纳率80%解题思路:(1)根据价层电子对互斥理论确定分子空间构型;
(2)①原子个数相等且价电子数相等的微粒为等电子体;
②根据构造原理写出其基态核外电子排布式,根据价层电子对互斥理论确定其杂化类型,根据配体个数确定配位数;
③结构相似的离子晶体中,晶格能与离子半径呈反比;
(3)元素X与N形成的氮化物中,X+中的所有电子正好充满K、L、M三个电子层,则X是Cu元素,采用沿X、Y、Z三轴切割的方法确定其配位数.(1)NF3中N原子的价层电子对=3+1=4,且含有一个孤电子对,所以其空间构型为:三角锥型,故答案为:三角锥形;
(2)①N3-中原子个数是3,价电子数是16,则与N3-互为等电子体的分子、离子有:N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-,故答案为:N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-;
②铁是26号元素,其核外有26个电子,根据构造原理知铁的基态原子核外电子排布式为[Ar]3d64s2,CN-中C原子的价层电子对=1+1=1,所以采取sp杂化,其配位数是6,故答案为:[Ar]3d64s2;sp杂化;6;
③NaN3与KN3的结构类似,钠离子半径小于钾离子半径,所以NaN3的晶格能>KN3的晶格能,故答案为:>;(3)元素X与N形成的氮化物中,X+中的所有电子正好充满K、L、M三个电子层,则X是Cu元素,则X+符号是Cu+,采用沿X、Y、Z三轴切割的方法知其配位数是6,故答案为:Cu+;6.点评:
本题考点: 晶胞的计算;判断简单分子或离子的构型;配合物的成键情况;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查物质结构,涉及核外电子排布式的书写、配位数的判断、等电子体等知识点,这些都是高考热点,要注重基础知识的积累.1年前查看全部
- CsICl 2 是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是(
CsICl 2 是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是( ) A.在CsICl 2 溶液中通入SO 2 气体,有硫酸生成 B.Cs显+1价,Cl显+l价,I显-l价 C.在CsICl 2 溶液中通入C1 2 ,有单质碘生成 D.Cs显+3价,I、Cl均显-l价  葵hua走失1年前1
葵hua走失1年前1 -
 roger1386 共回答了21个问题
roger1386 共回答了21个问题 |采纳率100%A.CsICl 2 有氧化性,与具有还原性的SO 2 气体反应生成硫酸,故A正确;
B.Cs为+1价,I为+1价,Cl为-1价,故B错误;
C.在CsICl 2 溶液中通入C1 2 ,二者不反应,故C错误;
D.Cs为+1价,I为+1价,Cl为-1价,故D错误;
故选A.1年前查看全部
- 4.10-1/将如下卤化物跟浓硫酸放在烧瓶中共热,可以得到纯净卤化氢气体的是()?
4.10-1/将如下卤化物跟浓硫酸放在烧瓶中共热,可以得到纯净卤化氢气体的是()?
(A)NaF (B)NaCl (C)NaBr (D)NaI
到底是哪个呢?说明理由. 落叶831年前1
落叶831年前1 -
 rocksuper 共回答了18个问题
rocksuper 共回答了18个问题 |采纳率94.4%B
A选项会生成HF,而HF会腐蚀玻璃,实验应在铅皿内进行.
C、D选项中的Br-、I-还原性较强,会被浓硫酸氧化为Br2、I2,浓硫酸被还原为SO2,混入制得的气体中.1年前查看全部
- 溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O═HBr+HIO.下
溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O═HBr+HIO.下列有关叙述中不正确的是( )
A.IBr是双原子分子
B.IBr与水反应时,它既是氧化剂,又是还原剂
C.在很多化学反应中IBr作氧化剂
D.跟NaOH溶液反应可生成NaBr和NaIO MJ物1年前1
MJ物1年前1 -
 j10kl 共回答了14个问题
j10kl 共回答了14个问题 |采纳率92.9%解题思路:根据IBr中I元素的化合价为+1价,Br为-1价,IBr化学性质与卤素单质具有相似性,及反应IBr+H2O═HBr+HIO中没有元素化合价的变化来分析解答.A.一个IBr分子含有1个碘原子1个溴原子,所以是双原子分子,故A正确;
B.因IBr中I元素的化合价为+1价,Br为-1价,HBr中Br为-1价,HIO中I为+1价,则IBr+H2O═HBr+HIO中没有元素化合价的变化,该反应属于非氧化还原反应,则IBr与水反应时既不做氧化剂,也不做还原剂,故B错误;
C.溴化碘的化学性质与卤素单质相似,则IBr中I元素的化合价为+1价,I元素的化合价在反应中能降低,则在很多化学反应中IBr是强氧化剂,故C正确;
D.由反应IBr+H2O═HBr+HIO可推知与NaOH反应的化学方程式为IBr+2NaOH=NaBr+NaIO+H2O,故D正确;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查卤素互化物的性质,题目难度不大,注意卤素互化物与卤素单质的性质相似,从卤素单质的性质角度分析即可.1年前查看全部
- 铁是目前应用最广泛的金属.铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.
铁是目前应用最广泛的金属.铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.
(1)铁在潮湿的空气中容易发生吸氧腐蚀而生锈,在该过程中,铁做______极,电极反应为______,
O2所在电极发生的反应为______
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法.实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-等物质的量发生交换.交换完成后,流出溶液的OH-用0.40mol•L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL.则0.54g该样品中n(Cl-)=______mol,x的值是______.
(3)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______.
(4)FeCl3与氢碘酸反应的离子方程式为:______. 雪儿之恋1年前1
雪儿之恋1年前1 -
 hongliang3721 共回答了14个问题
hongliang3721 共回答了14个问题 |采纳率92.9%解题思路:(1)依据原电池原理解答,Fe做负极发生氧化反应,氧气在正极发生还原反应;
(2)依据离子交换关系氢氧根离子物质的量等于氯离子物质的量等于氢离子物质的量,依据0.54g FeClx中氯离子物质的量计算x值;
(3)依据元素守恒计算氯化亚铁和氯化铁物质的量之比,进一步计算氯化铁质量分数;
(4)铁离子氧化碘离子成碘单质的反应.(1)依据原电池原理解答,Fe做负极发生氧化反应,氧气在正极发生还原反应,中性溶液中,氧气得电子生成氢氧根,铁失电子生成二价铁离子,注意正负极的电子守恒,电极反应式为:负极:2Fe-4e-=2Fe2+,正极:2H2O+O2+4e-=4OH-,
故答案为:负;2Fe-4e-=2Fe2+;2H2O+O2+4e-=4OH-;
(2)n(Cl)=n(H+)=n(OH-)=0.0250L×0.40 mol•L-1=0.010 mol,0.54g FeClx样品中含有氯离子物质的量为[0.54g/56+35.5x]=0.010 mol,解得x=3,
故答案为:0.010;3;
(3)FeCl2和FeCl3的混合物的样品中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=[1/9+1]×100%=10%;
故答案为:10%;
(4)FeCl3与氢碘酸反应就是铁离子氧化碘离子成碘单质的反应,离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2.点评:
本题考点: 金属的电化学腐蚀与防护;铁盐和亚铁盐的相互转变;有关混合物反应的计算;中和滴定.
考点点评: 本题考查学生阅读题目获取信息的能力、氧化还原反应,原电池的工作原理的应用,电极反应,电极产物的判断等,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力.注意基础知识的全面掌握.1年前查看全部
- (1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.
 (1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.
(1)氮元素是重要的非金属元素,可形成卤化物、氮化物、叠氮化物及配合物等多种化合物.
①nf3、nbr3、ncl3的沸点由高到低的顺序是nbr3>ncl3>nf3nbr3>ncl3>nf3.分子的空间构型是三角锥形三角锥形.
②fe2+、cu2+、co3+等过渡金属离子都能与叠氮化物、***化物形成配合物.配合物co[(n3)(nh3)5]so4中co的配位数为66.
③某元素x与n形成的氮化物中,x+中k、l、m三个电子层均充满了电子.它与n3-形成晶体的结构如图所示.x+的符号是cu+cu+,晶体中每个n3-与其距离最近的x+有66个.
(2)请阅读下表中的数据:
表中数据,得出判断离子晶体熔点高低的主要结论是离子所带电荷越多,离子半径越小,晶格能越大,晶体的熔沸点越高.离子所带电荷越多,离子半径越小,晶格能越大,晶体的熔沸点越高..晶格能/kj•mol-1 熔点/℃ cao 3401 2927 kcl 699 772 kbr 689 734 ki 632 680
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用.现有铬(+3价)与甲基丙烯酸根的配合物为: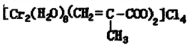
①该化合物中存在的化学键类型有离子键共价键配位键离子键共价键配位键.
②与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是k、cuk、cu(填元素符号)
③甲基丙烯酸分子中c原子的杂化方式有sp3、sp2sp3、sp2. 水木真一1年前1
水木真一1年前1 -
 察地理 共回答了19个问题
察地理 共回答了19个问题 |采纳率100%(1)由已知,2Sn=an2+an-2(n∈N*)①
得:a1=2,a2=3,a3=4,…(2分)
又2Sn+1=an+12+an+1-2②
由②-①得; (an+1-an-1)(an+1+an)=0,(an>0)
即an+1-an=1(n≥2,n∈N*),且a2-a1=1.
∴数列{an}是以a1=2为首项,公差为1的等差数列.
∴an=n+1. …(4分)
(2)由(Ⅰ)知bn=(n+1)•2n它的前n项和为Tn,
Tn=2•21+3•22+4•23+…+n•2n-1+(n+1)•2n ①
2Tn=2•22+3•23+4•24+…+n•2n+(n+1)•2n+1 ②
①-②:-Tn=2•21+22+23+24+…+2n-(n+1)•2n+1
=4+
22(1−2n−1)
1−2−(n+1)•2n+1
=-n•2n+1
∴Tn=n•2n+1…(8分)…(6分)
(3)∵an=n+1,∴cn=4n+(-1)n-1λ•2n+1,
要使cn+1>cn恒成立,
∴cn+1-cn=4n+1-4n+(-1)nλ•2n+2-(-1)n-1λ•2n+1>0恒成立
∴3•4n-3λ•(-1)n-12n+1>0恒成立,
∴(-1)n-1λ<2n-1恒成立. …(9分)
(ⅰ)当n为奇数时,即λ<2n-1恒成立
当且仅当n=1时,2n-1有最小值为1,
∴λ<1.…(11分)
(ⅱ)当n为偶数时,即λ>-2n-1恒成立
当且仅当n=2时,-2n-1有最大值-2,
∴λ>-2.…(13分)
即-2<λ<1,又λ为非零整数,则λ=-1.
综上所述,存在λ=-1,使得对任意n∈N*,
都有cn+1>cn.…(14分)1年前查看全部
- 钠的卤化物和硅的卤化物递变规律不同,而且钠的卤化物熔点高
 smcc2a251年前2
smcc2a251年前2 -
 sola1104 共回答了17个问题
sola1104 共回答了17个问题 |采纳率88.2%钠的卤化物属于离子晶体,阴阳离子重心艰巨增大离子键作用力减小
而硅的卤化物属于分子晶体 分子量愈大力愈大
力愈大 熔点愈大1年前查看全部
- 氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl 2 相似,能与金属和非金属反应生成卤化物,能与水反应:Br
氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl 2 相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H 2 O=HBrO+HCl,下列有关BrCl的性质的叙述中不正确的是 [ ]A.是较强的氧化剂
B.是一种化合物
C.能使湿润的淀粉碘化钾试纸变蓝
D.BrCl与水反应中,BrCl既是氧化剂又是还原剂 我的天堂rain1年前1
我的天堂rain1年前1 -
 夏希 共回答了11个问题
夏希 共回答了11个问题 |采纳率100%D1年前查看全部
- 现有5mL Ag+浓度为0.1mol•L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤
现有5mL Ag+浓度为0.1mol•L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤、干燥,称得质量为0.013g,则此沉淀是( )
A. LiF
B. LiCl
C. AgF
D. AgCl hsqujy1年前1
hsqujy1年前1 -
 小丫的杯子 共回答了15个问题
小丫的杯子 共回答了15个问题 |采纳率86.7%解题思路:根据银离子和卤素离子形成沉淀的情况,结合沉淀的物质的量和银离子物质的量之间的关系,可以获得沉淀的物质的量,再根据沉淀质量可以求得沉淀的摩尔质量,进而求得沉淀的成分.由于卤化物完全沉淀,则假设银完全沉淀,则沉淀物质的量为0.005L×0.1mol/L=0.0005mol,则沉淀的摩尔质量M=[m/n]=[0.013g/0.0005mol]=26g/mol.
故选A.点评:
本题考点: 卤化银.
考点点评: 本题考查学生银离子和卤素离子反应的实质,可以根据反应相关物质的量之间的关系来解答,难度不大,注意LiF、AgCl不溶于水.1年前查看全部
- XX'型卤化物中,X元素呈正化合价,X'元素呈负化合价 为什么?
XX'型卤化物中,X元素呈正化合价,X'元素呈负化合价 为什么?
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:
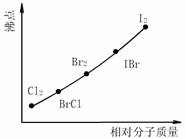
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式 .
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式
.
⑵上图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图.它们的沸点随着相对分子质量的增大而升高,其原因是
.
⑶试推测ICl的沸点所处的最小范围 .
这是全题,不需要做,XX'型卤化物中,X元素呈正化合价,X'元素呈负化合价 这句话是怎么得出的?关系到为什么第二小题答案是 +ICl →
+ICl →  -I+HCl 而不是生成碘化氢和氯苯?
-I+HCl 而不是生成碘化氢和氯苯?  rain_hellen1年前2
rain_hellen1年前2 -
 生ii不过一道疤 共回答了18个问题
生ii不过一道疤 共回答了18个问题 |采纳率100%XX'型卤化物中,注意看题
所有的 XX‘,都是第一个元素的原子序数大、第二个元素的原子序数小.
卤素,周期表中,越向上,非金属性越强,越容易得到电子.
因此 XX’ 中,X‘ 得电子能力强于 X ,所以 X' 是负价.
其实可以从化学式简单的判断,
除了个别氢化物(NH3),化学式书写原则,正价在前,负价在后.
所以 XX' 中X 是正价,X’ 是负价.
ICl 与 苯的反应,由于 Cl 是负价,所以与正价的 H结合为HCl,I只能与苯基结合为碘苯了.1年前查看全部
- 、以等物质的量混合的两种价态相同的无水金属卤化物(卤素相同)29.6g溶于水后可以结晶出这两种卤化物的六水合物共51.2
、以等物质的量混合的两种价态相同的无水金属卤化物(卤素相同)29.6g溶于水后可以结晶出这两种卤化物的六水合物共51.2g,将这两种水合物的混合物强热灼烧变为相同价态的(即金属价态不变)氧化物的混合物13.1g,若将原混合物溶液中加入过量NaOH溶液后,得到的沉淀滤出洗净,高温灼烧后称量为8.0g.请推出这两种金属卤化物各是什么物质?物质的量各位多少?
 雪舞祺洲1年前1
雪舞祺洲1年前1 -
 187293422 共回答了24个问题
187293422 共回答了24个问题 |采纳率79.2%两种卤化物的物质的量各是(51.2-29.6)/18/6/2=0.1mol
混合物的摩尔质量M(平均)=296/0.2=148g/mol
如果混合物的分子式为 MXn那么氧化物的分子式为MOn/2
MXn-----MOn/2
29.6 13.1
148 65.5
148-nX=65.5-8n
n=82.5/(X-8)分析:n只能是1-3的整数,所以X只能是Cl,n=3
MCl3=148 M(平均)=41.5 M(和)=83
假设灼烧后得到的氧化物是M2O3那么
0.05M2O3=8
M=56 可知两种金属为铁和铝,由于过量的氢氧化钠氯化铝反应后被滤出.
这两种金属卤化物各是FeCL3和AlCI3.1年前查看全部
- 下列性质与用途是某一种卤素或卤化物所特有的是:A、AgF可溶于水,且见光不分解无感光性
下列性质与用途是某一种卤素或卤化物所特有的是:A、AgF可溶于水,且见光不分解无感光性
B、AgI可用于人工降雨 C、HCl在潮湿空气中冒白烟,极易溶于水
D、HF酸腐蚀玻璃,只能贮存在塑料瓶中 guanjian1年前2
guanjian1年前2 -
 aa追逐南风 共回答了24个问题
aa追逐南风 共回答了24个问题 |采纳率100%A是AgF特有的,其他卤化银都难溶且见光分解.
人工降雨的话,AgBr也可以吧,就是效果没那么好.
C的话,HBr也有类似的性质.题目描述也不对,HCl是白雾,不是白烟.1年前查看全部
- 钠的卤化物与浓硫酸反应,何时生成硫酸氢钠,何时生成硫酸钠?
 来自温室的花1年前1
来自温室的花1年前1 -
 吴qq顺 共回答了15个问题
吴qq顺 共回答了15个问题 |采纳率86.7%微热时生成硫酸氢钠,加热到500度以上生成硫酸钠1年前查看全部
- 硅的卤化物的熔点及硅,锗,锡,铅的氯化物的熔点与什么有关,随着什么的增大,什么增强,故熔点依次增高
 美多尼1年前2
美多尼1年前2 -
 黑摩尔 共回答了24个问题
黑摩尔 共回答了24个问题 |采纳率87.5%物质NaFNaCl物质
NaF
NaCl
NaBr
NaI
NaCl
KCl
RbCl
CsCl
熔点/℃
995
801
755
651
801
776
715
646
物质
SiF4
SiCl4
SiBr4
SiI4
SiCl4
GeCl4
SnCl4
PbCl4
熔点/℃
-90.4
-70.4
5.2
120
-70.4
-49.5
-36.2
-15
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的___________有关,随着___________________的增大,熔点依次降低.
(2)硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与___________有关,随着___________增大,______________增大,故熔、沸点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与___________有关,因为一般______________比______________熔点高.
解析:比较表中物质的熔点,并从晶体的类型及决定熔点的微观作用力的角度深入分析熔点变化的原因,即可发现如下规律:(1)钠的卤化物的熔点从NaF到NaI依次降低,原因是它们所含阴离子的半径依次增大;碱金属的氯化物的熔点从NaCl到CsCl依次降低,原因是它们所含的阳离子的半径依次增大.(2)硅的卤化物的熔点从SiF4到SiI4依次升高,原因是它们的相对分子质量依次增大;硅、锗、锡、铅的氯化物的熔点从SiCl4到PbCl4依次增大,原因是它们的相对分子质量依次增大.(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,是由这两类物质的晶体类型不同引起的.
答案:(1)半径 半径
(2)相对分子质量 相对分子质量 分子间作用力
(3)晶体类型 离子晶体 分子晶体1年前查看全部
- 钠的卤化物的熔点比硅的卤化物的熔点高很多,为什么?
 biggoal1661年前1
biggoal1661年前1 -
 qinxx888 共回答了12个问题
qinxx888 共回答了12个问题 |采纳率91.7%硅的卤化物不属于原子晶体,是分子晶体.高中阶段的原子晶体只要记住金刚石,单晶硅,SiC,SiO2,钢玉就可以了.
另外原子晶体是原子间以共价键相联系,分子晶体是分子间以范德华力相联系,虽然部分原子晶体含有H键,但原子晶体的溶沸点一定比分子晶体高.1年前查看全部
- 卤化物见光都分解吗具体讲讲
 温暖四季1年前1
温暖四季1年前1 -
 zhijunfp 共回答了18个问题
zhijunfp 共回答了18个问题 |采纳率100%不是,一般难溶的分解.就像食盐见光就不分解.1年前查看全部
- 判断:可以用钠来把钛,铌,钽的金属从它们的卤化物中置换出来
 锥立1年前1
锥立1年前1 -
 ipcdw 共回答了27个问题
ipcdw 共回答了27个问题 |采纳率96.3%对,因为金属钠的活性更高,更有生成化合物的倾向!
但是因为钠的造价高,所以工业上是不会使用这种方法制取金属的!1年前查看全部
- F,Cl,Br,I被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大这句话对吗?为什么?
 清醒并痛着1年前1
清醒并痛着1年前1 -
 pigsu 共回答了20个问题
pigsu 共回答了20个问题 |采纳率80%对的,比如F,它的核电核数最小,被其他卤素单质置换出来的概率是0.
比如I,它的核电核数最大,被其他卤素单质置换出来的概率是100%.1年前查看全部
- 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大
被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大
下列关于氟氯溴碘 性质的比较
我想问这句话为什么对了 可可珂1年前2
可可珂1年前2 -
 嘟嘟的猪 共回答了23个问题
嘟嘟的猪 共回答了23个问题 |采纳率78.3%同族元素性质有一定的递变规律,从单质的氧化性和卤离子的还原性都一定的规律1年前查看全部
- 溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H 2 O═HBr+HIO
溴化碘(IBr)的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H 2 O═HBr+HIO.下列有关叙述中不正确的是( ) A.IBr是双原子分子 B.IBr与水反应时,它既是氧化剂,又是还原剂 C.在很多化学反应中IBr作氧化剂 D.跟NaOH溶液反应可生成NaBr和NaIO  205741561年前1
205741561年前1 -
 五十笑百步 共回答了17个问题
五十笑百步 共回答了17个问题 |采纳率76.5%A.一个IBr分子含有1个碘原子1个溴原子,所以是双原子分子,故A正确;
B.因IBr中I元素的化合价为+1价,Br为-1价,HBr中Br为-1价,HIO中I为+1价,则IBr+H 2 O═HBr+HIO中没有元素化合价的变化,该反应属于非氧化还原反应,则IBr与水反应时既不做氧化剂,也不做还原剂,故B错误;
C.溴化碘的化学性质与卤素单质相似,则IBr中I元素的化合价为+1价,I元素的化合价在反应中能降低,则在很多化学反应中IBr是强氧化剂,故C正确;
D.由反应IBr+H 2 O═HBr+HIO可推知与NaOH反应的化学方程式为IBr+2NaOH=NaBr+NaIO+H 2 O,故D正确;
故选B.1年前查看全部
- 溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O→HBr+HIO,下列有关IBr的叙述中,不正确的是( )
A. 在很多反应中IBr是强氧化剂
B. IBr与水反应时既做氧化剂,又做还原剂
C. IBr与AgNO3溶液反应会生成AgBr沉淀
D. IBr与NaOH溶液反应时,生成NaBr和NaIO 陈留儒生1年前2
陈留儒生1年前2 -
 aaID无 共回答了15个问题
aaID无 共回答了15个问题 |采纳率93.3%解题思路:根据IBr中I元素的化合价为+1价,Br为-1价,IBr化学性质与卤素单质具有相似性,及反应IBr+H2O═HBr+HIO中没有元素化合价的变化来分析解答.A.溴化碘的化学性质与卤素单质相似,则IBr中I元素的化合价为+1价,I元素的化合价在反应中能降低,则在很多化学反应中IBr是强氧化剂,故A正确;
B.因IBr中I元素的化合价为+1价,Br为-1价,HBr中Br为-1价,HIO中I为+1价,则IBr+H2O═HBr+HIO中没有元素化合价的变化,该反应属于非氧化还原反应,则IBr与水反应时既不做氧化剂,也不做还原剂,故B错误;
C.首先发生IBr+H2O═HBr+HIO,然后生成AgBr沉淀,故C正确;
D.由反应IBr+H2O═HBr+HIO可推知与NaOH反应的化学方程式为IBr+2NaOH=NaBr+NaIO+H2O,故D正确.
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意从氧化化合价的角度认识氧化还原反应的相关概念和相关物质的性质,答题时注意题给信息,为解答该题的关键.1年前查看全部
- 钠的卤化物熔点高低主要与___有关.随___,钠的卤化物熔点依次降低.
 junshaozou1年前1
junshaozou1年前1 -
 Jackaxo 共回答了20个问题
Jackaxo 共回答了20个问题 |采纳率90%卤素的相对原子质量
卤素的相对原子质量的增加1年前查看全部
- 现有5mL Ag+浓度为0.1mol•L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤
现有5mL Ag+浓度为0.1mol•L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤、干燥,称得质量为0.013g,则此沉淀是( )
A. LiF
B. LiCl
C. AgF
D. AgCl 我爱本田和丰田1年前1
我爱本田和丰田1年前1 -
 wyj9348 共回答了19个问题
wyj9348 共回答了19个问题 |采纳率89.5%解题思路:根据银离子和卤素离子形成沉淀的情况,结合沉淀的物质的量和银离子物质的量之间的关系,可以获得沉淀的物质的量,再根据沉淀质量可以求得沉淀的摩尔质量,进而求得沉淀的成分.由于卤化物完全沉淀,则假设银完全沉淀,则沉淀物质的量为0.005L×0.1mol/L=0.0005mol,则沉淀的摩尔质量M=[m/n]=[0.013g/0.0005mol]=26g/mol.
故选A.点评:
本题考点: 卤化银.
考点点评: 本题考查学生银离子和卤素离子反应的实质,可以根据反应相关物质的量之间的关系来解答,难度不大,注意LiF、AgCl不溶于水.1年前查看全部
- 在烧瓶中将一卤化物与浓H2SO4的混合物共热制卤化氢气体,该卤化物是( )
在烧瓶中将一卤化物与浓H2SO4的混合物共热制卤化氢气体,该卤化物是( )
A.CaF2 B.NaCl C.KBr D.KI scott831061年前4
scott831061年前4 -
 胡艾 共回答了17个问题
胡艾 共回答了17个问题 |采纳率88.2%B
A生成HF腐蚀玻璃,不能用烧瓶
CD的卤化氢都会被浓H2SO4氧化,不能用浓H2SO4,应用无氧化性的浓磷酸1年前查看全部
- 一卤化物有四种同分异构体的烃( )
一卤化物有四种同分异构体的烃( )
A. C3H8
B. C4H10
C.
D. CH2=CH2 droiyan1年前1
droiyan1年前1 -
 焦傲 共回答了27个问题
焦傲 共回答了27个问题 |采纳率92.6%解题思路:先写出各物质的结构简式,然后根据一卤化物的种类等于氢原子的种类;A.C3H8的结构简式为CH3CH2CH3,只有2种H原子,所以一卤化物有2种,故A不选;
B.丁烷有CH3CH2CH2CH3、(CH3)2CHCH3两种同分异构体,CH3CH2CH2CH3中有2种H原子,其一卤化物有2种,(CH3)2CHCH3中有2种H原子,其一卤化物有2种,所以一卤化物有四种,故B选;
C. 中有4种H原子,其一卤化物有4种,故C选;
中有4种H原子,其一卤化物有4种,故C选;
D.CH2=CH2中有1种H原子,其一卤化物有1种,故D不选;
故选BC.点评:
本题考点: 同分异构现象和同分异构体.
考点点评: 本题考查同分异构体的书写,难度不大,注意体会利用等效氢确定一元取代物.1年前查看全部
大家在问
- 1正在放风筝的英语怎么说
- 2鸡兔同笼,12只头30只脚,问:鸡,兔各几只?
- 3一个分数的分子缩小到原来的二分之一,分母扩大3倍,则这个数就( )
- 4师徒两人各加工同样多的零件,同时加工,当师傅完成任务时,徒弟还有30个没有完成,当徒弟完成任务时,师傅可以超额完成50个
- 57月五号星期一睛 英语翻译一下
- 6请问这个英语句子如何理解?These examples are simply to illustrate that th
- 7英语翻译"In this world there's two kinds of people,my friend.Tho
- 8十九分之十八,一百九九分之一百九八,一千九百九十这三个数中,最大的一个数是几?
- 9某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.
- 10在5,1,6,0中组成的数是2的倍数,最小是( ) 组成的数既是偶数,又是5的倍数,最大是( )
- 11某无色气体可能含有CO2、CO、H2和N2中的一种或几种,当混合气体依次通过紫色石蕊试液时,紫色石蕊试液没变色;通过灼热
- 1250财富值跪求:100-1000里不能被3,5,7任意一个数整除的所有偶数怎么用数学表达式表达出来?不要电脑程序
- 13对某植株作如下处理:(甲)持续光照10分钟;(乙)光照5秒后再黑暗处理5秒,连续交替进行20分钟.若它条件不变,则在甲、
- 143.3.1 两条直线的交点坐标公式是什么
- 15数学 空间曲线的斜率只能用其参数方程的导数求 这一种方法吗?