甲醚电解池方程式正极负极
 hzhuangcz2022-10-04 11:39:541条回答
hzhuangcz2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 jhf2316454 共回答了19个问题
jhf2316454 共回答了19个问题 |采纳率94.7%- 应该是甲醚燃料电池正负极的反应方程式吧.不知楼主的本意是不是这个
中性,负:CH3OCH3+3H2O﹣12e﹣==2CO2+12H﹢
正:3O2+12e﹣+6H2O==12OH﹣
酸性时把方程中的OH根消去就行了(两边同加H离子)
酸性,负:CH3OCH3+3H2O﹣12e﹣==2CO2+12H﹢
正:3O2+12e﹣+ 12H+ ==6H2O
碱性时将CO2改为碳酸根离子(CO2不能在碱性环境存在)再在两边加OH-离子配平.
碱性,负:CH3OCH3+16OH- ﹣12e﹣==2CO3 2-+ 11H2O
正:3O2+12e﹣+6H2O==12OH﹣
不管是什么电极反应,先写出中性的反应,配平后,再根据介质进行改写. - 1年前
相关推荐
- 甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使得其在制药、燃料、 农药等化学工业中有许多独特的用途。
甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使得其在制药、燃料、 农药等化学工业中有许多独特的用途。
(1)已知:2CH 3 OH(g) CH 3 OCH 3 (g)+H 2 O(g) △H=-25 kJ.mol -1 ,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH 3 OH,反应到某时刻测得各组分的物质的量浓度如下。
CH 3 OCH 3 (g)+H 2 O(g) △H=-25 kJ.mol -1 ,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH 3 OH,反应到某时刻测得各组分的物质的量浓度如下。 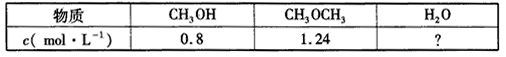
①平衡时,c(CH 3 OCH 3 )等于____mol.L -1 ,反应混合物的总能量减少____kJ。
②若在平衡后的容器中再加入与起始时等量的CH 3 OH,请在如图中画出CH 3 OH的浓度和转化率随时间变化的曲线。
(2)在直接以甲醚为燃料的电池中,电解质溶液为酸性,则负极反应式为____,正极反应式为___
(3)已知:
①2CH 4 (g)+O 2 (g)=2CO(g)+4H 2 (g) △H=-71 kJ. mol -1
②CO(g)+2H 2 (g)=CH 3 OH(l) △H=-90.5 kJ.mol -1
③CH 4 (g) +2O 2 (g)=CO 2 (g) +2H 2 O(l) △H=- 890 kJ. mol -1
则甲醇的燃烧热为___。若CO的燃烧热为282.5 kJ.mol -1 ,则H 2 的燃烧热为___。 学人oo1年前1
学人oo1年前1 -
 雪儿三 共回答了25个问题
雪儿三 共回答了25个问题 |采纳率92%1年前查看全部
- (2010•大连模拟)甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气
(2010•大连模拟)甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.工业上用合成气(CO、H2)直接或间接制取甲醚.
(1)写出甲醚燃烧的热化学方程式______.
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ•mol-1、393.5kJ•mol-1;计算反应4C(s)+6H2(g)+O2(g)═2CH2OCH3(g)的反应热为______.
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为______;从能量角度分析甲醚用作燃料电池与直接燃烧相比主要的优点是______.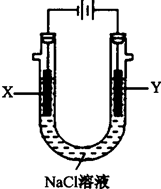
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象______.
②当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=______(假设溶液的体积不变,气体全部从溶液中逸出). wzcfjc1年前1
wzcfjc1年前1 -
 ziege_17 共回答了20个问题
ziege_17 共回答了20个问题 |采纳率95%解题思路:(1)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式;
(2)依据燃烧热写出热化学方程式,结合盖斯定律计算得到所需热化学方程式和对应焓变;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;
(4)①惰性电极电解饱和食盐水,Y电极是阳极,溶液中氯离子失电子生成氯气;
②依据原电池和电解池中存在的电子守恒结合电极反应计算溶液PH;(1)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
(2)H2(g)和C(s)的燃烧热分别是285.8kJ•mol-1、393.5kJ•mol-1;热化学方程式
①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8KJ/mol;
②C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol;
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
依据盖斯定律计算①×3+②×2-③得到反应热化学方程式为:2C(s)+3H2(g)+[1/2]O2(g)═CH2OCH3(g):△H=-169.4kJ/mol;
4C(s)+6H2(g)+O2(g)═2CH2OCH3(g):△H=-378.8kJ/mol;
故答案为:△H=-378.8kJ/mol;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O;从能量角度分析甲醚用作燃料电池与直接燃烧相比主要的优点是能量利用和转化率高;
故答案为:CH3OCH3+16OH-12e-=2CO2-3+11H2O,燃料电池的能量转换效率高;
(4)①电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色;
故答案为:Y电极附近溶液中有气体产生,上部分呈黄绿色;
②当燃料电池消耗2.8LO2(标准状况下)物质的量=[2.8L/22.4L/mol]=0.125mol,电极反应为O2+2H2O+4e-=4OH-,电子转移为0.5mol,电解池中 阳极电极反应为4OH--4e-=2H2O+O2↑,依据电子守恒溶液中减少氢氧根离子物质的量和增加的氢离子物质的量守恒,则溶液中氢离子浓度=[0.5mol/0.5L]=1mol/L,此时NaCl溶液的pH=14;
故答案为:14;点评:
本题考点: 热化学方程式;有关反应热的计算;化学电源新型电池;电解原理.
考点点评: 本题考查了热化学方程式的书写方法和燃烧热概念,盖斯定律的计算应用,原电池反应、电解池反应原理的应用判断,掌握实质是解题关键,题目难度中等.1年前查看全部
- (2004•福州)最近,科学家推出了一种廉价环保的新能源--甲醚,它完全燃烧时发生如下反应:X+3O2 点燃&
(2004•福州)最近,科学家推出了一种廉价环保的新能源--甲醚,它完全燃烧时发生如下反应:X+3O2
2CO2+3H2O,则X(甲醚)的化学式为( )点燃 .
A.C3H6O2
B.C2H6O
C.C2H4O
D.CH4O 猪也有美德1年前1
猪也有美德1年前1 -
 007lgsab 共回答了22个问题
007lgsab 共回答了22个问题 |采纳率95.5%解题思路:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质的过程.在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.据此答题.根据质量守恒定律和已知条件可得,X(甲醚)的化学式中C的个数应为2个,
H的个数应为3×2=6个,O的个数应为2×2+3-3×2=1个.
故X(甲醚)的化学式为C2H6O.
故选:B.点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查学生应用质量守恒定律进行计算,并能正确书写化学方程式的能力.1年前查看全部
- 写结构式:乙酸,3-甲基己烷,间甲基苯酚,乙酰氯,2-丙醇,丙炔,2-丁酮,甲醛,甲醚
 大姨丈的ww1年前0
大姨丈的ww1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚
 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
(1)写出甲烷与水蒸气在高温下反应制合成气的热化学方程式______.
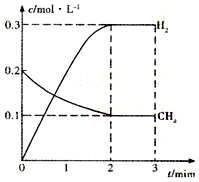
(2)在一定条件下,向体积固定为2L的密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化的曲线如图所示.
3min时改变条件,反应进行到4min时,体系中各物质的物质的量如下表所示:
则3~4min之间,平衡向______(填“正”或“逆”)反应方向移动,3min时改变的条件是______.t/min n(CH4)/mol n(H2O)/mol n(CO)/mol n(H2)/mol 4 0.18 0.38 0.22 0.66
(3)已知温度、压强和碳水比[
]对该反应的影响如图所示.n(CH4) n(H2O) 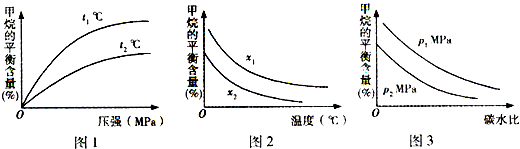
①图l中,两条曲线所示温度的关系:t1______t2(填“>”、“<”或“=”,下同).
②图2中,两条曲线所示碳水比的关系:x1______x2.
③图3中,两条曲线所示压强的关系:p1______p2.
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示.
①放电时,正极的电极反应式为______.
②假设装置中盛装100.0mL 3.0mol•L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960mL.放电完毕后,电解质溶液中各离子浓度的大小关系为______. xxxmly1年前1
xxxmly1年前1 -
 cc欲男 共回答了19个问题
cc欲男 共回答了19个问题 |采纳率100%解题思路:(1)根据燃烧热写出热化学方程式,利用盖斯定律计算;(2)根据图象可知3min时,平衡时各组分的平衡浓度,再根据4min时各组分浓度变化量判断改变的条件;(3)①根据反应的热效应判断温度对平衡移动的影响,结合图象分析解答;②碳水比[n(CH4)n(H2O)]值越大,平衡时甲烷的转化率越低,含量越高;③根据压强对平衡移动影响,结合图象分析解答;(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子;②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.(1)已知:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+[1/2]O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1 kJ•mol-1;
(2)根据图象可知3min时,平衡时甲烷的浓度为0.1mol/L,氢气的浓度为0.3mol/L,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
开始(mol/L):0.20.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时甲烷的浓度为0.09mol/L,浓度减小0.1-0.09=0.01
水的浓度为0.19mol,浓度减小0.2-0.19=0.01;
CO的浓度为0.11,浓度增大0.11-0.1=0.01
氢气的浓度为0.33,浓度增大0.33-0.3=0.03
浓度变化量之比为1:1:1:3,等于化学计量数之比,应是改变温度平衡向正反应方向移动,该反应正反应是吸热反应,故3min改变条件为升高温度;
故答案为:正;升高温度;
(3)①该反应正反应为吸热反应,升高温度平衡向正反应方向移动,甲烷的含量降低,故温度t1<t2,故答案为:<;
②碳水比[
n(CH4)
n(H2O)]值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
③该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量降低,故p1>p2,故答案为:>;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为[8.96L/22.4L/mol]=0.4mol,根据电子转移守恒可知,生成二氧化碳为[0.4mol×4/8]=0.2mol,n(NaOH)=0.1L×3.0mol•L-1=0.3mol,n(NaOH):n(CO2)=0.3mol:0.2mol=3:2,介于1:1与2:1之间,故生成碳酸钾、碳酸氢钾,令碳酸钾、碳酸氢钾的物质的量分别为xmol、ymol,则x+y=0.2,2x+y=0.3,解得x=0.1,y=0.1,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钾离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).点评:
本题考点: 物质的量或浓度随时间的变化曲线;热化学方程式;化学电源新型电池;体积百分含量随温度、压强变化曲线.
考点点评: 本题综合性较大,涉及热化学方程式书写、化学平衡图象、化学平衡的影响因素、化学平衡计算、原电池、化学计算、离子浓度比较等,难度中等,是对基础知识与学生能力的综合考查.1年前查看全部
- 2-甲氧基-4-戊苯的结构式与2-甲基苯甲基甲醚的结构式,急
2-甲氧基-4-戊苯的结构式与2-甲基苯甲基甲醚的结构式,急
如题, 想你妹妹依静1年前2
想你妹妹依静1年前2 -
 andyleeinfo 共回答了18个问题
andyleeinfo 共回答了18个问题 |采纳率88.9%1年前查看全部
- 请问为什么CH3OCH3(甲醚)分子间作用力是偶极力,算是氢键?
请问为什么CH3OCH3(甲醚)分子间作用力是偶极力,算是氢键?
RT
标题打错了,应该是如下:
请问为什么CH3OCH3(甲醚)分子间作用力是偶极力,而不是氢键? lqz1471年前1
lqz1471年前1 -
 andywanbt 共回答了17个问题
andywanbt 共回答了17个问题 |采纳率94.1%甲醚分子之间不可能形成氢键.形成氢键的条件应该分子中是有氧氢键(-OH),氢氟键(H-F),氮氢键(-N-H),所以甲醚分子之间没有氢键.根据来源不同范德华力又可分为:色散力(en:London dispersion force):瞬时偶极之间的电性引力,为非极性分子之间形成的作用力;取向力(dipole-dipole force):固有偶极之间的电性引力,为极性分子之间形成的作用力;诱导力:诱导偶极与固有偶极之间的电性引力,为极性分子与非极性分子之间形成的作用力.1年前查看全部
- 甲酸甲酯 甲酸乙酯组成的混合物中碳元素的质量分数是43.2%,混合物甲酸甲醚的质量分数是多少?
 chfgzp1年前1
chfgzp1年前1 -
 草之魂 共回答了22个问题
草之魂 共回答了22个问题 |采纳率95.5%设甲酸甲酯的质量分数为x,则可得:
x*24/60+(1-x)*36/74=43.2%
可求得:x=0.63
即甲酸甲酯的质量分数为63%,则甲酸乙酯的质量分数为37%
PS:题目是出错了吗?为什么是求甲酸甲醚?1年前查看全部
- 甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等.工业上利用煤在高温下气化得到的水煤气合成甲醇、甲醚.请回答下列问题:
甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等.工业上利用煤在高温下气化得到的水煤气合成甲醇、甲醚.请回答下列问题:
(1)写出煤的气化(生成水煤气)的主要化学反应方程式C+H2O
CO+H2高温 .C+H2O.
CO+H2高温 .
(2)一定温度下,若反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在一密闭容器中进行,能判定该反应达平衡状态的是______(填序号).
A.容器中气体的密度不变 B.v(CO)正=v(CO2)逆
C.混合气体中c(H2)=c(H2O) D.容器内的物质的量不变
(3)利用水煤气合成甲醚的三步反应为:
①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
则由H2和CO生成CH3OCH3和CO2的热化学方程式为:______.
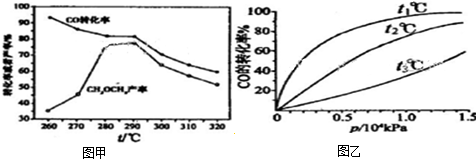
(4)CO和H2可用于合成甲醇(CH3OH),如图甲是CO在不同温度下的平衡转化率与压强的关系图,则温度t1、t2、t3三者的高低关系是______,实际生产控制在t1℃、1.3×104kPa左右,选择此压强的理由是______.
(5)某温度下.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)的平衡常数为400,此温度下,在2L密闭容器中加入3.28mol CH3OH,10分钟达平衡,则该时间内由甲醇生产甲醚的反应速率为v(CH3OCH3)=______.若此时再分别加入1mol CH3OH 和2mol的H2O(g),则此时”v正______v逆(填“>”“=”“<”).
(6)有研究者在催化剂、5.0MPa条件下,由CO和H2直接制备甲醚,结果如图乙所示,CO的转化率随温度升高而降低的原因是______. zszzzaa1年前1
zszzzaa1年前1 -
 azhuazhu26 共回答了19个问题
azhuazhu26 共回答了19个问题 |采纳率84.2%解题思路:(1)碳和水反应生成一氧化碳和氢气,根据质量守恒定律可以书写化学方程式;
(2)反应到达平衡状态时正逆反应速率相等,各物质的浓度保持不变,以及由此衍生的一些量保持不变,据此分析;
(3)根据已知方程式,利用盖斯定律计算;
(4)CO和 H2合成甲醇(CH3OH)的反应为放热反应,根据温度对CO转化率的影响分析;根据压强对转化率及生产成本的影响分析;
(5)列三段式,根据K求出CH3OCH3的浓度变化,再求出反应速率;根据
与平衡常数K的关系分析;c(CH3OCH3)•c(H2O) c2(CH3OH)
(6)依据温度对化学平衡移动的影响分析.(1)碳和水反应生成一氧化碳和氢气的化学方程式为:C+H2O
高温
.
CO+H2,故答案为:C+H2O
高温
.
CO+H2;
(2)A.容器的体积不变,气体的质量守恒,所以容器中气体的密度始终不变,因此不能根据密度不变来判断平衡状态,故A错误;
B.反应到达平衡状态时正逆反应速率相等,所以v(CO)正=v(CO2)逆,即是平衡状态,故B正确;
C.混合气体中c(H2)与c(H2O) 的关系,与初始量有关,所以不能说明达到平衡状态,故C错误;
D.该反应前后气体的总物质的量相等,所以容器内的物质的量不变,不能说明达到平衡状态,故D错误;
故答案为:B;
(3)已知:①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过①×2+②+③可得3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g),则△H=-90.8kJ/mol×2-23.5kJ/mol-41.3kJ/mol=-246.4kJ/mol,
故答案为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1;
(4)CO和 H2合成甲醇(CH3OH)的反应为放热反应,升高温度平衡逆移,则CO转化率减小,即温度越高CO的转化率越小,由图可知,温度的关系为:
t1<t2<t3;此压强下转化率已经很大,再增大压强转化率改变很小,而且增大压强会提高生产成本;
故答案为:t1<t2<t3;此压强下转化率已经很大,再增大压强转化率改变很小,而且增大压强会提高生产成本;
(5)在2L密闭容器中加入3.28mol CH3OH,则开始时甲醇的浓度为1.64mol/L,设转化的甲醇的浓度为xmol/L,
2CH3OH(g)≒CH3OCH3(g)+H2O(g)
起始浓度(mol•L-1):1.64 0 0
转化浓度(mol•L-1):x [1/2]x [1/2]x
平衡浓度(mol•L-1):1.64-x [1/2]x [1/2]x
已知此时平衡常数为400,则K=
1
2x×
1
2x
(1.64−x)2=400,解得x=1.6;则c(CH3OCH3)=0.8mol•L-1,所以v(CH3OCH3)=[0.8mol/L/10min]=0.08mol•L-1•min-1,
若此时再分别加入1mol CH3OH 和2mol的H2O(g),则c(CH3OH)=1.64mol•L-1-1.6mol•L-1+0.5mol•L-1=0.54mol•L-1,c(H2O)=0.8mol•L-1+1mol•L-1=1.8mol•L-1,c(CH3OCH3)=0.8mol•L-1,所以
c(CH3OCH3)•c(H2O)
c2(CH3OH)=
1.8×0.8
0.542=4.9<K=400,说明未达到平衡状态,所以反应正向进行,即v正>v逆
故答案为:0.08mol•L-1•min-1;>;
(6)因为该反应为放热反应,所以升高温度平衡逆向移动,则CO的转化率点评:
本题考点: 热化学方程式;化学平衡状态的判断;转化率随温度、压强的变化曲线.
考点点评: 本题考查了方程式的书写、化学平衡状态的判断、盖斯定律的应用、平衡移动原理的应用、反应速率及平衡常数的计算等,题目考查的知识点较多,题目综合性强,注意对相关原理的把握,题目难度中等.1年前查看全部
- 乙醇和甲醚的关系是什么
 Ilovesweetbox1年前3
Ilovesweetbox1年前3 -
 番外913 共回答了15个问题
番外913 共回答了15个问题 |采纳率86.7%同分异构体
分子式相同的不同物质1年前查看全部
- 甲醚乙醇燃烧产物有什么区别上课这一段没听..好像是氢气产量不同.为什么会不同?怎么不同法?.度娘的峰值什么的实在不懂.
 iilzt1年前1
iilzt1年前1 -
 shayuan 共回答了19个问题
shayuan 共回答了19个问题 |采纳率89.5%甲醚、乙醇完全燃烧的产物是二氧化碳和水,两者的产物没有差别啊,产物也与氢气无关.1年前查看全部
- 化42.乙醇与甲醚互为同分异构体,下列事实中能说明二者结构式不相同的是
化42.乙醇与甲醚互为同分异构体,下列事实中能说明二者结构式不相同的是

选的都不对。 陈霆夫1年前2
陈霆夫1年前2 -
 xydaet 共回答了25个问题
xydaet 共回答了25个问题 |采纳率88%选择C
因为乙醇与钠反应产生氢气,说明有羟基
而甲醚不能产生氢气,说明无羟基
所以显然结构不同1年前查看全部
- 甲醚用铜做催化剂加热 反应生成什么物质 写出化学反应方程式
 承受生命之轻1年前1
承受生命之轻1年前1 -
 geerhao 共回答了17个问题
geerhao 共回答了17个问题 |采纳率88.2%2KClO3=2KCl+3O2
2SO2+O2=2SO3
4NH3+5O2=4NO+6H2O
C6H6+Br2=C6H5Br+HB1年前查看全部
- 1.下列事实与氢键无关的是C乙醇比甲醚更易溶于水DNH3比PH3稳定为什么不是C?我觉得是因为甲醚是非极性分子 水是极性
1.下列事实与氢键无关的是
C乙醇比甲醚更易溶于水
DNH3比PH3稳定
为什么不是C?我觉得是因为甲醚是非极性分子 水是极性分子所以成立 D为什么对?
实际是1道囧 打错了 yidaoxiao1年前2
yidaoxiao1年前2 -
 未来的路在何方 共回答了22个问题
未来的路在何方 共回答了22个问题 |采纳率86.4%C是因为甲醚中无羟基,无法与水形成氢键,而乙醇中有羟基,与水形成氢键,易溶于水
DNH3比PH3更稳定是因为N吸引电子能力更强,所以会更稳定1年前查看全部
- 3、甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是 ( )
3、甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是 ( )
A.利用金属钠或者金属钾 B.利用质谱法
C.利用红外光谱法 D.利用核磁共振氢谱
 独自游荡的猫1年前10
独自游荡的猫1年前10 -
 ztnpsi 共回答了19个问题
ztnpsi 共回答了19个问题 |采纳率73.7%A1年前查看全部
- 请问甲醚能缔合吗 能与水分子形成氢键吗?为什么啊
请问甲醚能缔合吗 能与水分子形成氢键吗?为什么啊
你是指不能缔合?还是不能形成氢键? zzzgmail1年前1
zzzgmail1年前1 -
 BOBO事务所小Y 共回答了14个问题
BOBO事务所小Y 共回答了14个问题 |采纳率100%不能把,醚类不易容于水,我感觉不能1年前查看全部
- (2014•洪泽县二模)甲醚(用X表示)作为一种廉价的新能源,它燃烧时发生如下反应:X+3O2点燃2CO2+3H2O,则
(2014•洪泽县二模)甲醚(用X表示)作为一种廉价的新能源,它燃烧时发生如下反应:X+3O2
2CO2+3H2O,则甲醚(X)的化学式是( )点燃
A.CH4O
B.C2H4O
C.C2H6O
D.C3H6O2 msys3f1年前1
msys3f1年前1 -
 gg妖姬 共回答了19个问题
gg妖姬 共回答了19个问题 |采纳率89.5%该化学的反应后,存在2个碳原子,6个氢原子,7个氧原子.反应前,有6个氧原子.由于在化学反应前后,原子的种类、质量、个数不变.在X中一定存在1个氧原子,2个碳原子,6个氢原子.
故选C1年前查看全部
- 下列同组的两物质,不是同分异构体的是( ) A.乙醇和甲醚 B.苯甲醇和甲基苯酚 C
下列同组的两物质,不是同分异构体的是( )
A.乙醇和甲醚 B.苯甲醇和甲基苯酚 C.淀粉和纤维素 D.硝基乙烷和氨基乙酸  浅色幸福1年前0
浅色幸福1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 紫外吸收.邻溴苯甲基醚在液氨中与氨化钾反应是生成邻位还是间位氨基苯甲醚?紫外可见分光光度法中,以空白溶液做参比得透光率为
紫外吸收.
邻溴苯甲基醚在液氨中与氨化钾反应是生成邻位还是间位氨基苯甲醚?
紫外可见分光光度法中,以空白溶液做参比得透光率为百分之十,现以透光率为百分之二十的标准溶液为参比则透光率为多少?
发生霍夫曼消除反应的时候B碳上有氕氘氚,是什么消除顺序? chenyingze1年前3
chenyingze1年前3 -
 jiechupin 共回答了20个问题
jiechupin 共回答了20个问题 |采纳率100%A = -logT,
T标 = 0.20
A标 = 0.70
T样 = 0.10
A样 = 1.00
△A = A样-A标 = 1.00-0.70 = 0.30
T样1 = 0.50 = 50%1年前查看全部
- 下列叙述错误的是( )A.硝酸银溶液通常保存在棕色试剂瓶中,因为硝酸银见光易分解B.乙醇的沸点比甲醚(CH3-O-CH
下列叙述错误的是( )
A.硝酸银溶液通常保存在棕色试剂瓶中,因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3-O-CH3)高,主要原因是乙醇分子间作用力更大
C.反应AgCl+Br-→AgBr+Cl-能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应 打回原形1年前1
打回原形1年前1 -
 新的2006 共回答了16个问题
新的2006 共回答了16个问题 |采纳率87.5%解题思路:A.化学试剂存放要依据物质自身的物理性质和化学性质,见光易分解的试剂应存放在棕色试剂瓶中;
B.二甲醚(CH3OCH3)和乙醇(CH3CH2OH)分子式相同,但乙醇中由于O吸引电子的能力强,则有裸露的质子,分子间易形成氢键;
C.从难溶电解质的溶解平衡的角度分析,沉淀向着更难溶的方向转化;
D.常温下浓硫酸可贮存在铁制或铝制容器中,是金属被浓硫酸钝化,表面生成一层致密的氧化膜,这种氧化膜不溶于浓硫酸,利用的是浓硫酸的强氧化性;A.硝酸银是由银离子和硝酸根离子构成,因硝酸银见光易分解2AgNO3
光
.
2Ag+2NO2↑+O2↑,故应放在棕色瓶中保存,故A正确;
B.乙醇中由于O吸引电子的能力强,则有裸露的质子,分子间易形成氢键,乙醇分子间作用力更大,导致乙醇的沸点比二甲醚高,故B正确;
C.氯化银的溶解能力大于溴化银,根据现象结合沉淀会向着更难溶的方向转化,反应AgCl+Br-→AgBr+Cl-能在水溶液中进行,故C正确;
D.金属钝化的实质是金属被浓硫酸氧化,表面生成一层致密的氧化膜,这种氧化膜不溶于浓硫酸,是化学变化,故D错误;
故选D.点评:
本题考点: 化学试剂的存放;难溶电解质的溶解平衡及沉淀转化的本质;浓硫酸的性质.
考点点评: 本题考查了硝酸银的保存、有机物沸点的比较、难溶电解质的溶解平衡、钝化的原理等知识,明确见光易分解的试剂应存放在棕色试剂瓶中、分子中含有非金属性(电负性强)的元素易形成氢键,沉淀会向着更难溶的方向转化、钝化的实质是化学变化等内容是解答本题的关键,题目难度不大.1年前查看全部
- 最近日本找到了一种廉价环保的新能源--甲醚,它完全燃烧时发生如下反应:2X+3O2 点燃 .
最近日本找到了一种廉价环保的新能源--甲醚,它完全燃烧时发生如下反应:2X+3O2
2CO2+4H2O,则(甲醚)的化学式是( )点燃 .
A.C3H6O2
B.C2H6O
C.C2H4O
D.CH4O brisun1年前1
brisun1年前1 -
 superxuer 共回答了15个问题
superxuer 共回答了15个问题 |采纳率100%解题思路:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质的过程.在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.据此答题.甲醚完全燃烧时发生反应的方程式是X+3O2
点燃
.
2CO2+3H2O,根据质量守恒定律可得,X(甲醚)的化学式中C的个数应为2个,H的个数应为3×2=6个,O的个数应为2×2+3-3×2=1个,故X(甲醚)的化学式为C2H6O.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 据质量守恒定律的微观解释知,在化学反应前后,原子的种类、质量、个数不变.可以根据这个原理来进行化学方程式的配平和化学式的推断.1年前查看全部
- 甲醚(CH3OCH3)是一种新型的合成“柴油”,它可由天然气(体积分数:CO2为5%,CH4为95%)合成.
甲醚(CH3OCH3)是一种新型的合成“柴油”,它可由天然气(体积分数:CO2为5%,CH4为95%)合成.
过程如下(气体体积均在同温同压下测定;氧气由空气提供,其中N2和O2的体积比为4:1;不考虑CO与水的反应;各步反应转化率均为100%):
造气:CH4+H2O==3H2+CO
CH4+CO2==2H2+2CO
2CH4+O2==4H2+2CO
1)若造气得到的气体只含CO和H2,该混合气体中,碳元素的质量分数为a%,则氢元素的质量分数为 %(用含a的式子表示).
2)造气时每使用100m3天然气,应同时通入水蒸气________m3、空气_________m3,才能保证合成时CO与H2的体积比为1:2;合成甲醚后,有________m3的水蒸气可参加循环生产. AYYZG1231年前1
AYYZG1231年前1 -
 玩世不恭小无赖 共回答了13个问题
玩世不恭小无赖 共回答了13个问题 |采纳率100%忘记怎么写正规格式了 我写下算法格式你自己弄吧!
碳元素的质量分数为a% 得到气体只含CO和H2 所以每含有一个碳原子就含有一个氧原子C:O=12:16 算的氧元素的质量分数为4a/3% 氢元素的质量分数=1-a%-4a/3%=整理后的数字
保证CO和H2的体积比为1:2配成生成物中CO和H2比为1:2
2CH4+2H2O=6H2+2CO
CH4+CO2=2H2+2CO
16CH4+8O2=32H2+16CO 把三个方程式相加得
19CH4+2H2O+CO2+8O2=40H2+20CO
95 10 5 40 200 100
所以每使用100m3天然气应同时通入水蒸气10m3、200空气m3(氧气占空气20%)
每100m3天然气可制得100m3一氧化碳
2CO+4H2=C2H6O+H2O
100 200 50 50
所以有20m3的水蒸气可参加循环生产.
不知道对不对从高中毕业就没在碰过化学在加上上班这么多年都快还给老师了.1年前查看全部
- 分子式为C 2 H 6 O的有机物,有两种同分异构体,乙醇(CH 3 CH 2 OH)、甲醚(CH 3 OCH 3 ),
分子式为C 2 H 6 O的有机物,有两种同分异构体,乙醇(CH 3 CH 2 OH)、甲醚(CH 3 OCH 3 ),则通过下列方法,不可能将二者区别开来的是 ( )
A.红外光谱 B. 1 H核磁共振谱 C.质谱法 D.与钠反应  littlez19761年前1
littlez19761年前1 -
 dyceo 共回答了21个问题
dyceo 共回答了21个问题 |采纳率85.7%C
1年前查看全部
- 乙醇易溶于水,甲醚不溶于水?甲醚不溶于水?
 mdbfrgeh1年前1
mdbfrgeh1年前1 -
 lee杰 共回答了17个问题
lee杰 共回答了17个问题 |采纳率94.1%有机物除醇以外大多数都是不溶于水的!
溶解有个相似相容原理,水一般溶无机物.有机物一般不溶于水,可溶于有机溶剂!1年前查看全部
- 乙二醇二甲醚是氯甲醚吗
 树的绿色1年前1
树的绿色1年前1 -
 空中搭楼阁 共回答了21个问题
空中搭楼阁 共回答了21个问题 |采纳率95.2%不是,取代基不同.1年前查看全部
- 为什么乙醇比甲醚(ch2och3)更易溶于水
 绿椰A1年前4
绿椰A1年前4 -
 sky048 共回答了21个问题
sky048 共回答了21个问题 |采纳率85.7%羟基-OH比醚键-O-更与H-O-H的结构相近
不仅能提供孤对电子吸引水中的H原子形成氢键
更可以提供H原子让H2O的孤对电子形成氢键
乙醇在水中形成的氢键数目(2+1)比二甲醚(2)要多
而且乙醇的分子极性比二甲醚强很多
二甲醚的两个极性键O-C向两边使劲,矢量合成的偶极矩不是很大1年前查看全部
- 世博园内的公交车使用清洁能源,甲醚(用X表示)是一种廉价的清洁能源,它燃烧时发生如下反应:X+3O 2 2CO 2 +3
世博园内的公交车使用清洁能源,甲醚(用X表示)是一种廉价的清洁能源,它燃烧时发生如下反应:X+3O 2
 2CO 2 +3H 2 O,则甲醚(X)的化学式是:()
2CO 2 +3H 2 O,则甲醚(X)的化学式是:()A.CH 4 O B.C 2 H 4 O C.C 2 H 6 O D.C 3 H 6 O 2  fatbear991年前1
fatbear991年前1 -
 一夜轻 共回答了20个问题
一夜轻 共回答了20个问题 |采纳率90%C
1年前查看全部
- 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡
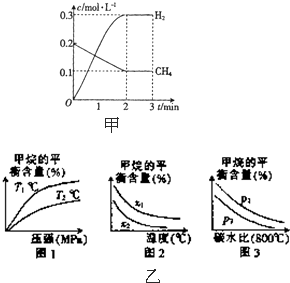 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
(1)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(g)△H=-1302.6kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
则天然气与水蒸气在高温下反应制备合成气的热化学方程式为______.
(2)在一定条件下,向2L的恒容密闭容器中充入0.40mol CH4(g)和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间的变化曲线如图甲所示.
①0~2min内,一氧化碳的平均反应速率
v(CO)=______mol•L-1•min-1.
②3min时改变条件.反应进行到4min时,体系中各物质的物质的量如下表所示:
则3~4min平衡向______方向移动,改变的条件可能是______t/min n(CH4)/mol n(H20)/mol n(CO)/mol n(H2)/mol 4 0.18 0.38 0.22 0.66
(3)已知温度、压强和碳水比[n(CH4):n(H2O)=x]对该反应的影响如图乙
①图乙1中,两条曲线所示温度的关系:T1______T2 (填“>”、“<”或“=”,下同)
②图乙2中,两条曲线所示碳水比(x)的关系:x1______x2
③图乙3中,两条曲线所示压强的关系:p1______2. 工9601年前1
工9601年前1 -
 板板559 共回答了14个问题
板板559 共回答了14个问题 |采纳率100%解题思路:(1)根据燃烧热写出热化学方程式,利用盖斯定律计算;
(2)①依据图象计算甲烷的反应速率,结合反应速率之比等于化学方程式计量数之比计算得到一氧化碳的反应速率;
②根据图象可知3min时,平衡时各组分的平衡浓度,再根据4min时各组分浓度变化量判断改变的条件;
(3)①根据反应的热效应判断温度对平衡移动的影响,结合图象分析解答;
②碳水比[
]值越大,平衡时甲烷的转化率越低,含量越高;n(CH4) n(H2O)
③根据压强对平衡移动影响,结合图象分析解答.(1)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(g)△H=-1302.6kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
依据盖斯定律计算(①-②×3)×[1/2]得到天然气与水蒸气在高温下反应制备合成气的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+74.1 kJ•mol-1;
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+74.1 kJ•mol-1;
(2)①0~2min内,V(CH4)=[0.2mol/L−0.1mol/L/2min]=0.05mol/L•min;
一氧化碳的平均反应速率v(CO)=V(CH4)=0.05mol/L•min,
故答案为:0.05;
②根据图象可知3min时,平衡时甲烷的浓度为0.1mol/L,氢气的浓度为0.3mol/L,则:
CH4(g)+H2O(g)=CO(g)+3H2(g)
开始(mol/L):0.20.3 0 0
变化(mol/L):0.1 0.1 0.1 0.3
平衡(mol/L):0.1 0.2 0.1 0.3
4min时甲烷的浓度为0.09mol/L,浓度减小0.1-0.09=0.01
水的浓度为0.19mol,浓度减小0.2-0.19=0.01;
CO的浓度为0.11,浓度增大0.11-0.1=0.01
氢气的浓度为0.33,浓度增大0.33-0.3=0.03
浓度变化量之比为1:1:1:3,等于化学计量数之比,应是改变温度平衡向正反应方向移动,该反应正反应是吸热反应,故3min改变条件为升高温度;
故答案为:正反应;升高温度;
(3)①该反应正反应为吸热反应,升高温度平衡向正反应方向移动,甲烷的含量降低,故温度T1<T2,故答案为:<;
②碳水比[
n(CH4)
n(H2O)]值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
③该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量降低,故p1>p2,故答案为:>.点评:
本题考点: 热化学方程式;反应速率的定量表示方法;化学平衡的影响因素;产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题综合性较大,涉及热化学方程式书写、化学平衡图象、化学平衡的影响因素、化学平衡计算、化学计算、离子浓度比较等,难度中等,是对基础知识与学生能力的综合考查.1年前查看全部
- 乙醇和甲醚属于什么异构
 tlgj1年前2
tlgj1年前2 -
 天蝎ww 共回答了13个问题
天蝎ww 共回答了13个问题 |采纳率92.3%同分异构体分为碳链异构、官能团异构和位置异构,乙醇与甲醚属于官能团异构,醇的官能团为羟基,醚的官能团为醚键.1年前查看全部
- 下列有关物质结构与性质的说法中正确的是( ) A.晶体中分子间作用力越大,分子越稳定 B.乙醇的沸点比甲醚(CH 3
下列有关物质结构与性质的说法中正确的是( ) A.晶体中分子间作用力越大,分子越稳定 B.乙醇的沸点比甲醚(CH 3 -O-CH 3 )高,主要原因是乙醇分子间能形成氢键 C.红宝石、蓝宝石和金刚石都是由碳元素组成的宝石 D.非金属的最高价含氧酸都具有强氧化性  wz801001年前1
wz801001年前1 -
 皮特鱼 共回答了18个问题
皮特鱼 共回答了18个问题 |采纳率77.8%A、分子间作用力影响分子的物理性质,不影响物质的化学性质,而分子的稳定性属于化学性质,晶体中分子间作用力和分子稳定性之间没有必然联系,故A错误;
B、乙醇分子间能形成氢键,甲醚(CH 3 -O-CH 3 )分子间不具备,氢键会导致物质沸点升高;所以乙醇的沸点比甲醚(CH 3 -O-CH 3 )高,故B正确;
C、红宝石、蓝宝石的主要成分是氧化铝(Al 2 O 3 ),不是碳单质,只有金刚石是碳元素组成的单质,故C错误;
D、碳酸、磷酸、稀硫酸等均不具有强的氧化性,硝酸、浓硫酸等有强氧化性,故D错误.
故选B.1年前查看全部
- 下列叙述中不正确的是( ) A.利用核磁共振分析可以辨别甲醚(CH 3 OCH 3 )和乙醇 B.利用丁达尔效应可以区
下列叙述中不正确的是( )
A.利用核磁共振分析可以辨别甲醚(CH 3 OCH 3 )和乙醇 B.利用丁达尔效应可以区分淀粉溶液与葡萄糖溶液 C.在一定温度下,对于任何两种难溶电解质,Ksp大的电解质的溶解度也一定大 D.ΔH>0、ΔS<0的反应在任何温度下都不能自发进行  四二三一1年前1
四二三一1年前1 -
 suiyuan1231 共回答了20个问题
suiyuan1231 共回答了20个问题 |采纳率95%C
因为甲醚(CH 3 OCH 3 )和乙醇中氢原子的种类是不同的,前者只有一类,后者有三类,所以利用核磁共振分析可以辨别甲醚(CH 3 OCH 3 )和乙醇。淀粉和葡萄糖所形成的分散系分别是胶体和溶液,故可以用丁达尔效应区分二者。在一定温度下,Ksp大的电解质的溶解度不一定大,C不正确。根据△G=△H-T·△S可知ΔH>0、ΔS<0的反应在任何温度下都不能自发进行,答案是C。1年前查看全部
- 甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,也可以使用仪器鉴定法,下列鉴别方法,不能对二者进行区别的是(
甲醚和乙醇互为同分异构体,其鉴别可采用化学方法或物理方法,也可以使用仪器鉴定法,下列鉴别方法,不能对二者进行区别的是( )
A.加入金属钠
B.利用质谱法
C.燃烧法
D.利用核磁共振氢谱仪 laozhangzaici1年前1
laozhangzaici1年前1 -
 龙洞弯人 共回答了24个问题
龙洞弯人 共回答了24个问题 |采纳率83.3%解题思路:A.乙醇中含-OH,与Na反应,而甲醚不与钠反应;
B.甲醚和乙醇互为同分异构体,相对分子质量相同;
C.组成元素相同,均燃烧生成二氧化碳和水;
D.甲醚中含1种H,而乙醇中含3种H.A.乙醇中含-OH,与Na反应,而甲醚不与钠反应,现象不同,可鉴别,故A不选;
B.甲醚和乙醇互为同分异构体,相对分子质量相同,则质谱法测定结果相同,不能鉴别,故B选;
C.组成元素相同,含C量相同,均燃烧生成二氧化碳和水,则不能利用燃烧法区分,故C选;
D.甲醚中含1种H,而乙醇中含3种H,则利用核磁共振氢谱仪可区别,故D不选;
故选BC.点评:
本题考点: 有机物的鉴别.
考点点评: 本题考查有机物的鉴别,为高频考点,把握常见有机物的性质及性质差异为解答的关键,侧重醇性质及有机物分子结构测定方法的考查,题目难度不大.1年前查看全部
- (2014•澄海区模拟)三甲醚(C2H6O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.下列有关三甲醚的说
(2014•澄海区模拟)三甲醚(C2H6O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.下列有关三甲醚的说法正确的是( )
A.由C、H、O三种元素组成
B.一个分子中含有3个氢分子
C.由碳原子、氢原子、氧原子构成
D.属于氧化物 futianxia1年前1
futianxia1年前1 -
 独孤不爱江南 共回答了14个问题
独孤不爱江南 共回答了14个问题 |采纳率100%解题思路:A、根据三甲醚化学式的含义进行分析判断.
B、根据分子是由原子构成的,进行分析判断.
C、根据三甲醚的微观构成进行分析判断.
D、氧化物是只含有两种元素且其中一种元素是氧元素的化合物.A、三甲醚是由碳、氢、氧三种元素组成的,故选项说法正确.
B、分子是由原子构成的,一个分子中含有6个碳原子,不含氢分子,故选项说法错误.
C、三甲醚是由三甲醚分子构成的,三甲醚分子是由碳原子、氢原子、氧原子构成的,故选项说法错误.
D、三甲醚是由碳、氢、氧三种元素组成的化合物,不属于氧化物,故选项说法错误.
故选:A.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义、氧化物的特征进行分析问题、解决问题的能力.1年前查看全部
- 乙二醇独甲醚化学及物理性质,以及制备
 我痛恨aa1年前1
我痛恨aa1年前1 -
 任性520 共回答了14个问题
任性520 共回答了14个问题 |采纳率78.6%【中文名称】乙二醇一甲醚;甲基溶纤剂;2-甲氧基乙醇
【英文名称】ethylene glycol monomethyl ether
【结构或分子式】 HOCH2CH2OCH3
【相对分子量或原子量】76.08
【密度】0.9647
【熔点(℃)】-85.1
【沸点(℃)】124.6
【闪点(℃)】46.1
【粘度 mPa·s(20℃)】0.85(15.6℃)
【折射率】1.4024
【毒性LD50(mg/kg)】
大鼠经口2460.
【性状】
由愉快气味的无色液体.
【溶解情况】
溶于水,乙醇、丙酮、乙二醇等.
【用途】
用作硝酸纤维素、树脂的溶剂.也用作农药分散剂、增塑剂等.
【制备或来源】
由环氧乙烷与甲醇作用而得.
【其他】
性质较稳定.1年前查看全部
- 三甲醚(C 2 H 6 O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景。下列有关三甲醚的说法正确的是
三甲醚(C 2 H 6 O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景。下列有关三甲醚的说法正确的是
A.由C、H、O三种元素组成 B.一个分子中含有3个氢分子
C.由碳原子、氢原子、氧原子构成 D.属于氧化物 冷月梦影1年前1
冷月梦影1年前1 -
 liujianli8882 共回答了15个问题
liujianli8882 共回答了15个问题 |采纳率86.7%A
1年前查看全部
- 将下列物质进行分类:① 1 1 H与 1 3 H;②O 2 与O 3 ;③乙醇与甲醚(CH 3 -O-CH 3 );④H
将下列物质进行分类:
① 1 1 H与 1 3 H;②O 2 与O 3 ;③乙醇与甲醚(CH 3 -O-CH 3 );④H 2 O与D 2 O;⑤CH 3 CH 2 CH 2 CH 3 与CH 3 -CH(CH 3 )-CH 3 ;⑥C 60 与C 70 ;⑦CH 4 与C 4 H 10
(1)互为同位素的是 (填编号,下同);互为同素异形体的是
互为同分异构体的是 互为同系物的是
(2)有下列反应:①由乙烯制乙醇;②甲烷在空气中燃烧;③由乙烯制氯乙烷;④丙烯使溴水褪色;⑤苯与浓硝酸、浓硫酸的混合酸反应;⑥用丙烯制聚丙烯;其中属于取代反应的是(填序号,下同) ,属于氧化反应的是 ,属于加成反应的是 ,属于加聚反应的是 。
(3)①正丁烷;②异丁烷;③正戊烷;④异戊烷;⑤新戊烷;⑥丙烷,物质的沸点由高到低的排列顺序是:
(4)某学生用0.100 mol·L -1 的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
E.调节液面至“0”或“0”以下刻度,记下读数;A.移取20 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞; B.用标准溶液润洗滴定管2~3次; C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液; D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 cm 处;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)__________________________________。 我的千里草1年前1
我的千里草1年前1 -
 499698839 共回答了19个问题
499698839 共回答了19个问题 |采纳率78.9%⑴① ②⑥ ③⑤ ⑦ (2)⑤ ② ①③④⑥ ⑥
(3)③>④>⑤>①>②>⑥ (4)BDCEAF 或 ABDCEF。
1年前查看全部
- 用实验分辨水、乙醇、苯酚、甲醚的氢原子活泼性
 gzc72621年前1
gzc72621年前1 -
 xzhebj 共回答了17个问题
xzhebj 共回答了17个问题 |采纳率88.2%此四类物质中氢原子的活泼性顺序可用与金属钠反应的情况来确定.常温下甲醚不与金属钠反应;金属钠与苯酚反应最剧烈,其次是水,再其次是乙醇.1年前查看全部
- 乙醇和甲醚沸点不同的原因
 秋水无痕331年前1
秋水无痕331年前1 -
 不日成名 共回答了17个问题
不日成名 共回答了17个问题 |采纳率100%乙醇分子间有氢键,醚类没有.1年前查看全部
- 乙醇和甲醚是同系物还是同分异构体?为什么?
 亦俗人1年前1
亦俗人1年前1 -
 不过是猪 共回答了22个问题
不过是猪 共回答了22个问题 |采纳率90.9%同系物是指两物质的结构相似,分子式相差n(n=1)个CH2.
同分异构体是指两物质的分子式相同,结构不同.
乙醇的分子式是C2H6O 甲醚的分子式也是C2H6O
但是乙醇的结构为CH3CH2OH,甲醚的结构为CH3OCH3.
两者分子式相同,结构不同.
所以是同分异构体.1年前查看全部
- 乙醇与甲醚互为同分异构体的下列事实中,
乙醇与甲醚互为同分异构体的下列事实中,
乙醇与甲醚互为同分异构体,下列事实中,能说明二者结构式不同的是.
A.乙醇易溶于水,甲醚不溶于水
B.在1份乙醇中加入6份浓硫酸,当加热到140℃时生成醚
C.乙醇跟金属钠反应放出氢气,甲醚则不能
D.甲醚比乙醇更易溶于油脂类物质中
为什么其他的不行, 哭了的梦1年前2
哭了的梦1年前2 -
 风倚流云 共回答了19个问题
风倚流云 共回答了19个问题 |采纳率94.7%能够与Na反应放出氢气,则说明有活泼的氢原子.1年前查看全部
- 乙醇和甲醚是同分异构体吗
 maoltuf1年前1
maoltuf1年前1 -
 过棵 共回答了18个问题
过棵 共回答了18个问题 |采纳率83.3%是的,官能团异构.分子式均为C2H6O1年前查看全部
- 三甲醚(C 2 H 6 O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.下列有关二甲醚的说法错误的是
三甲醚(C 2 H 6 O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.下列有关二甲醚的说法错误的是 [ ]A.由C、H、O三种元素组成
B.一个分子中含有3个氢分子
C.相对分子质量为46
D.属于有机化合物 kevin11221年前1
kevin11221年前1 -
 dan0819 共回答了22个问题
dan0819 共回答了22个问题 |采纳率95.5%B1年前查看全部
- 甲醚(用X表示)作为一种廉价的新能源,它燃烧时发生如下反应:
甲醚(用X表示)作为一种廉价的新能源,它燃烧时发生如下反应:
X+3O 2 2CO 2 +3H 2 O,则甲醚(X)的化学式是
2CO 2 +3H 2 O,则甲醚(X)的化学式是A.CH 4 O B.C 2 H 4 O C.C 2 H 6 O D.C 3 H 6 O 2  烤焦的熏鱼1年前1
烤焦的熏鱼1年前1 -
 新欢精选 共回答了16个问题
新欢精选 共回答了16个问题 |采纳率93.8%C
本题考查的是质量守恒定律及其应用,有关化学式的计算和推断。据质量守恒定律可知,在化学反应前后,原子的种类、质量、个数不变。该化学的反应后,存在2个碳原子,6个氢原子,7个氧原子,反应前,有6个氧原子。由于在化学反应前后,原子的种类、质量、个数不变。在X中一定存在1个氧原子,2个碳原子,6个氢原子。故选C1年前查看全部
- 上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行,以二甲醚(化学式为C2H6O,简称甲醚)为燃料的公共
上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行,以二甲醚(化学式为C2H6O,简称甲醚)为燃料的公共交通作为“绿色”花园中的一点鲜艳的绿色已正式启动,解决了汽车尾部冒黑烟的问题.下列叙述正确的是( )
A.甲醚与乙醇是同分异构体
B.甲醚可由甲醇在一定条件下发生消去反应而制得
C.甲醚作燃料不会产生氮的氧化物和碳氢化合物的污染
D.1mol甲醚完全燃烧消耗的氧气与1mol甲醇完全燃烧消耗的氧气相同 clotena1年前1
clotena1年前1 -
 其实我也是个yy 共回答了24个问题
其实我也是个yy 共回答了24个问题 |采纳率95.8%解题思路:A.同分异构体体是指分子式相同,结构不同的有机化合物的互称;
B.根据消去反应的条件判断;
C.甲醚含碳氢氧,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故B正确;
D.根据分子式计算耗氧量.A.乙醇分子式为C2H6O,结构为:CH3CH2OH,甲醚的分子式为C2H6O,结构为CH3OCH3,结构不同,互为同分异构体,故A正确;
B.醇发生消去反应的条件是和羟基相连的邻碳上有氢离子,甲醇没有邻碳,故甲醇不会发生消去反应,故B错误;
C.甲醚属于含氧衍生物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故C正确;
D.甲醚的分子式为C2H6O,1mol甲醚耗氧3mol,甲醇分子式为CH4O,1mol甲醇耗氧1.5mol,故D错误;
故选AC点评:
本题考点: 同分异构现象和同分异构体;消去反应与水解反应.
考点点评: 本题考查了同分异构体和甲醚和甲醇的性质,较基础,注意醇类发生消去反应的条件.1年前查看全部
- 金属钠区分甲醇和甲醚
 ChildrenLi1年前1
ChildrenLi1年前1 -
 就是要你的人 共回答了25个问题
就是要你的人 共回答了25个问题 |采纳率88%可以
金属钠和甲醇放出气体,而甲醚没有
2CH3OH+2Na===CH3ONa+H2气体1年前查看全部
大家在问
- 1如果是光明小学的运动场,跑道宽1.5米,李敏跑内道,张强跑外道.两人跑完了一圈各跑了多少米?
- 2硫酸氢氨与氢氧化钠反应 请详述
- 3请问3、3、3、9四个数字如何才能算出24点
- 4化学知识 求解!请问 碘化亚铁 与溴 单质 分别过量 应该如何反应 请写出方程式 谢谢
- 5客车货车同时从A地,B地相对开出,客车每小时行60千米,货车每小时行全程的1/10,当货车行到全程的13/24时,客车已
- 6把下面词语分三类眺望、花草、崇高、鲜艳、探视、祖国、崭新班级、打扰、冲刷、鞠躬、茂密、睡觉、土壤
- 7求证:2sina+2sin2a=2sina^3/(1-cosa)
- 8一个骰子扔三次 至少一次为1的概率是多少?
- 9从甲地到乙地,快车要4小时,慢车要用6小时,两车同时相向开出2小时,一共行了这段路的几分之几?
- 10遂博通众流百家之言的意思是什么
- 114b的平方分之b的平方-9a的平方÷2b的立方分之9ab-3b的平方=?
- 12a/a-2b*根号a的平方-4ab的平方+4b的立方/a(0
- 13翻译:一见辘能诵忆,遂博众流百家之言
- 14用英语介绍家人500单词以上,10分钟内再加50分!不要复制的!
- 15十分钟记50个单词的方法.



